このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
新生児大腸 菌 分離株の腸管トランスサイトーシスの評価
要約
大腸菌は、出生前後に細菌を摂取した新生児に敗血症を引き起こします。大腸菌が腸管から血流に移動する能力に関与するプロセスは、よく理解されていません。このin vitroモデルは、大腸菌株が腸上皮細胞を通過する能力を評価します。
要約
新生児は、出産前後に腸管にコロニーを形成する母体の大腸菌株を摂取します。腸内を移動する能力を持つ大腸菌株は、新生児の血流に侵入し、生命を脅かす菌血症を引き起こします。ここで紹介する方法論は、半透性インサート上で増殖させた分極腸上皮細胞を利用して、in vitroで新生児大腸菌血症分離株のトランスサイトーシスを評価します。この方法は、コンフルエントに成長し、タイトジャンクションとデスモソームを形成する能力を有する確立されたT84腸細胞株を使用します。コンフルエントに達した後、成熟したT84単層は経上皮抵抗(TEER)を発症し、電圧計を使用して定量化できます。TEER値は、腸単層を横切る細菌を含む細胞外成分の傍細胞透過性と逆相関しています。一方、細菌の経細胞通過(トランスサイトーシス)は、必ずしもTEER測定値を変化させるわけではありません。このモデルでは、腸単層を横切る細菌の通過が感染後最大6時間定量化され、傍細胞透過性を監視するためにTEERの繰り返し測定が行われます。さらに、この方法は、分極上皮を横切る細菌トランスサイトーシス中のタイトジャンクションおよび他の細胞間接着タンパク質の構造変化を研究するための免疫染色などの技術の使用を容易にします。このモデルの使用は、新生児大腸菌が腸上皮を横切って菌血症を引き起こすメカニズムの特性評価に貢献します。
概要
大腸菌は、新生児の早期発症型敗血症の最も一般的な原因です1、2、3。新生児大腸菌血症の死亡率は40%に達する可能性があり、髄膜炎は重度の神経発達障害に関連する可能性のある合併症です2。新生児による母体の大腸菌株の摂取は、新生児菌血症を引き起こす可能性があります。このプロセスは、動物モデル2、4で再現されています。摂取されると、病原菌は新生児の腸管腔から腸関門を越えて血流に入り、敗血症を引き起こします。菌血症を産生する新生児侵襲性大腸菌株は、腸上皮細胞に侵入する能力が異なる1,5。しかしながら、浸潤後に腸上皮をトランスサイトーゼするそれらの能力は完全には特徴付けられていない。
この腸管トランスサイトーシスモデルは、腸上皮を横切る細菌の通過をエミュレートするための有用なin vitro法である。この原稿で提示された方法の全体的な目標は、腸上皮をトランスサイトーゼする新生児大腸菌分離物の能力を比較することです。ここで説明するモデルは、不死化ヒト腸腺癌細胞であるT84細胞を利用する6,7。T84細胞は、2つの別々のコンパートメントを有する半透膜上でコンフルエントに増殖する。この技術を使用する理論的根拠は、in vivoで起こるように、これらの腸細胞が分極し、成熟したタイトジャンクションを発達させることです6,8。膜と接触する側が基底側となる。細胞の反対側は頂端側になり、摂取された病原体が付着して侵入する腸管腔に似ています。トランスウェル膜は細菌に対して透過性ですが、分極した腸細胞はタイトジャンクションを形成し、細菌の傍細胞運動を損ないます9。したがって、この方法は、経細胞経路を含む細菌性トランスサイトーシスの過程を研究するためにヒト細胞株を利用する制御されたインビトロ環境の利点を提供する。腸上皮を横切る細菌のトランスサイトーシスを調査するための他の方法が存在するが、ここで紹介するトランスウェル法は、より容易でアクセスしやすい方法を提供する。Ussingチャンバーシステムに設置されたex vivoサンプルを利用する技術などの代替技術が利用可能です。ただし、特に研究が人間の生理学を研究することを意図している場合は、簡単にアクセスできない可能性のある組織標本を利用します10。腸管オルガノイドは、宿主-細菌相互作用を研究するためのin vitro代替物の別の例を表しています11。オルガノイド単分子膜は、細菌のトランスサイトーシスを研究するためにトランスウェルシステムでも使用できますが、幹細胞の単離と増殖、および分化を誘導するための特定の成長因子の使用が必要です12。したがって、それらの使用は、この原稿に記載されているトランスウェル法と比較して、より時間がかかり、より大きなコストを伴う。
このin vitroトランスウェルシステムを用いた腸上皮を横切る細菌の通過の評価は、様々な病原体に対して成功裏に行われている。これらの研究は、分極した腸上皮を横切る細菌のトランスサイトーシスを特徴付けるためにT84細胞を使用するトランスウェルシステムの有用性を示しています13、14、15。しかしながら、菌血症産生新生児大腸菌株のトランスサイトーシス能を比較するためのこのトランスウェル法の適用は詳細に説明されていない。この原稿は、信頼性が高く使いやすく、高すぎるリソースを必要としない標準的なTranswellプロトコルを他の研究者に提供します。
腸上皮をトランスサイトーゼする新生児侵襲性 大腸菌 株の能力を比較するために、腸上皮単層の頂端側に、既知の数の細菌細胞を感染させることができる。インキュベーション後、上皮の基底側の培地を回収し、細菌を定量して、細菌トランスサイトーシスの量を経時的に決定することができます。この原稿では、提示された方法を利用して、菌血症で入院した新生児から回収された新生児 大腸菌 臨床株のトランスサイトーシス能力を研究しています。トランスサイトーシス研究のためのこれらの新生児臨床分離株の選択のための選択基準は、以前に公開されている1、2、16。この方法が異なる 大腸菌 株を用いて行われる場合、それらのトランスサイトーシス能力を比較することができる。このプロセスを通じて、腸管トランスサイトーシスモデルは、新生児菌血症の発症に至る多段階のプロセスに寄与する 大腸菌 の病原性因子を特徴付けるための貴重なデータを提供します。
プロトコル
注意: 汚染を避けるために、バイオセーフティレベル2(BSL-2)の安全キャビネットでT84細胞、細菌、プレート、および試薬のすべての操作を実行してください。滅菌T84細胞、感染したT84細胞、および大腸菌を含むすべての作業には、別々のエリアとインキュベーターを使用してください。ここに記載されている方法でテストされた臨床大腸菌分離株は、私たちの施設の治験審査委員会のガイドラインに従って取得されました1,16。
1. T84細胞を用いたトランスサイトーシスインサートの調製(実験の約1〜2週間前)
- ダルベッコ改変イーグル培地:ハムのF-12栄養混合物(1:1、最終濃度:各50%)、5%ウシ胎児血清、および1%(100 U / mL)ペニシリン/ストレプトマイシン二重抗生物質混合物からなる組織培養培地(TCM +抗生物質)でアメリカンタイプカルチャーコレクション(ATCC)T84細胞を増殖させます。細胞を5%CO2と共に37°Cでインキュベートする。
注:ペニシリン/ストレプトマイシンを含まないこの培地製剤のバリエーション(抗生物質なしのTCM)は、手順の後のステップ(セクション2以降)に使用されます。各ステップで正しい処方が使用されていることを確認してください。 - バイオセーフティキャビネット(BSC)内で作業し、T84細胞をポリエチレンテレフタレート膜細胞培養トランスウェルインサートに播種し、24ウェルプレート用に3 μmの細孔を作製します。目的の実験条件ごとにトランスウェルインサートの反復に加えて、感染していないコントロールを含めて、汚染の可能性を監視します。
- トランスウェルインサートを保持するように設計された24ウェルプレートに、必要な数の収集ウェルに1 mLのTCM +抗生物質を充填します。
- 各ウェルに、1つのトランスウェルインサートを配置します。
- これらのインサートに、500 μLのTCM +抗生物質に懸濁した1 x 105 T84細胞をシードします。トリパンブルー染色を有する血球計算盤または自動セルカウンター17を用いて細胞数を定量化する。
- シードインサートを含むトランスウェルプレートを、細胞が増殖したのと同じ条件でインキュベートします。
- インサートの播種後、播種後約48時間で単層がコンフルエントになり始めたことを光学顕微鏡で確認します。
- 播種後2日ごとに、上皮ボルト/オームメーター(EVOM)を使用して経上皮電気抵抗(TEER)を測定および記録し、単層の成熟度を評価します。インサートが少なくとも1,000 Ω・cm2のTEERに達すると、アッセイ18の準備ができていると見なされます。
注:インサートは通常、播種後このTEERに到達するまでに7〜10日かかります。T84細胞は、この抵抗に達すると、光学顕微鏡下で100%のコンフルエントを示します。- EVOMプローブは、使用しないときは電極を0.15 M KClに浸して保管してください。
- TEERを測定する前に、電極プローブを5mLのコニカルチューブに50mLの70%エタノールに10〜15分間沈めて除染します。プローブを取り外し、余分なエタノールを振り落とし、BSC内で10分間風乾させます。エタノールのチューブを保持します。
- 乾燥した除染プローブを1 mLのTCM +抗生物質を含む滅菌ウェルに入れ、内部に500 μLのTCM +抗生物質を含む滅菌インサートを入れて、EVOMとプローブをテストします。EVOMの読み取り値が<200 Ωであることを確認します。この空白値を記録して、手順1.3.6で説明する後の抵抗計算で使用します。
- TCM +抗生物質のチューブからプローブを取り外します。実験中ずっとプローブを保管するために、このチューブを保持してください。
- プローブを最初のインサートにゆっくりと下げ、長い電極を収集ウェルに、短い電極をインサート内に入れます。長い電極が収集ウェルの底に触れるのを待ちますが、上皮単層を破壊する可能性があるため、押し下げないでください。
- このプロセスを繰り返して、すべてのインサートの抵抗をオーム(Ω)で測定および記録します。終了したら、プローブをさらに10〜15分間沈めてエタノールに除染します。次に、除染されたプローブをKCl溶液に戻して保管します。T84セルを含む各インサートから得られた各値から、ステップ1.3.3で得られたブランク抵抗を差し引きます。各インサートで得られた抵抗(Ω)に各インサートの底部の面積(cm2)を掛けて、最終的なTEER測定値(Ω・cm2)を求めます。
- TEERが少なくとも1,000 Ω·cm2に達すると、上皮単層は成熟し、感染アッセイの準備が整います。
- TEERが成熟したら、1〜2日ごとに細胞に新しい培地を供給します。
- 新しい24ウェルプレートで、調製するシードインサートごとに1 mLのTCM +抗生物質を1ウェルに追加します。
- 滅菌鉗子を使用して、インサートを新しく補充したウェルに慎重に移します。
- メディアをドライブに挿入します。
- プレートを傾け、社内の真空アスピレーターを使用して、インサートの側面に沿ってピペットチップでメディアを静かに取り除き、インサートから古いメディアを取り除きます。吸引器は、細胞の破壊を防ぐために低レベルの吸引の調整を可能にします。ピペットチップがインサートの底部に触れないようにしてください, これは発達中の上皮単層を破壊するからです.
- 500 μLのTCM +抗生物質をインサートに加えます。単層を光学顕微鏡で視覚化し、無傷のままであることを確認します。
- 1〜2日ごとに、上記の手順1.3.2〜1.3.6で説明したように、各インサート全体のTEERを測定します。
2.抗生物質なしでTCMを使用した実験の1日前にT84細胞を準備する
- 実験の前日にTEERを測定して記録します。
- 以前のセルの準備とメンテナンス時と同じ方法でTCMを交換してください。ただし、感染の準備として抗生物質を含まないTCMが代わりに使用されます(プレートウェルに1 mL、インサートに500 μL)。
3. 大腸菌 培養(実験1日前に開始)
注意: 病原性臨床 大腸菌 株を扱うときは、バイオセーフティレベル2(BSL-2)の予防措置を使用してください。
- 5 mLの滅菌溶解ブロス(LB)を含む標識された15 mLコニカルチューブを取り、滅菌ループを使用して、1つの細菌株(大腸菌)からの1つのコロニーをブロスに接種します。このプロセスを繰り返し、試験する菌株ごとに1つの一晩培養チューブを作成します。
- チューブのキャップを緩めた状態で、インキュベーターシェーカー(250rpm、37°C)で一晩培養インキュベートします。
4. 大腸菌 の接種材料、上皮細胞、材料の準備(実験当日)
注:この時点から37°Cまで温めた抗生物質なしでTCMを使用してください。
- 各一晩LB培養から250 μLを、50 mLコニカルチューブ内の抗生物質なしのTCM25 mLに追加します(個々の株ごとに1つ)。チューブのキャップを緩めたままにします。これらの新しい培養チューブをシェーカーに同じ設定(250 rpm、37 °C)で正確に2時間置きます。待機中に残りのサブステップを実行します。
- 手順1.3.2〜1.3.6で説明されているように、各インサート全体のTEERを測定します。これらを時間(t)= 0時間のTEERとして記録します。
- インサートを新しいプレートのウェルに移動し、ステップ 1.4.3 で説明されている手法を使用してメディアを交換します。ただし、今回は、新しい収集ウェルに抗生物質なしのTCMを500 μL、インサートに抗生物質なしのTCMを400 μL充填します。感染時までインサートを組織培養インキュベーター内に保管してください。
- 室温(RT)まで温めるのに十分な数の正方形LB寒天プレートをセットして、後でメッキと細菌の定量を行います。
5.細胞の接種(実験開始)
- 正確に2時間後、朝の細菌培養物をシェーカーから取り出し、10分間遠心分離します(1,900 x g、4°C)。
注意: 以下のすべての手順では、成長を最小限に抑えるために、すべての細菌懸濁液を氷上に置いてください。 - 抗生物質なしでTCMに細菌ペレットを再懸濁します。分光光度計を使用して光学濃度(OD)を0.7〜0.9に調整し、抗生物質なしのTCMでさらに1 x 106 コロニー形成単位(CFU)/ mL(約1:100希釈)の濃度に希釈します。この細菌懸濁液を使用して、各インサートに100 μLの容量あたり1 x 105 CFUを感染させます。
- トランスウェルプレートにラベルを付け、各インサートに100 μLのOD調整接種材料を感染させます(インサートあたり合計1 x 105 CFU)。アッセイが開始されました。時刻をメモし、t = 0 hとして記録します。
- 接種菌懸濁液をプレートし、トラック希釈法を用いてCFU/mLを定量し、10 μLアリコートを正方形LB寒天プレート19にプレーティングする。
6. トランスサイトーシスの定量化
- 接種後30分ごとに、抗生物質を含まない500 μLのTCMを新しいウェルに充填します。異なる細菌株ごとに異なる滅菌鉗子のセットを使用して、これらの新しいウェルにインサートを移します。
- 各インサートの使用済み収集ウェルから培地を別々のラベル付きチューブに回収します。これらのチューブを氷の上に置きます。トランスウェルプレートを時間ポイントの間にインキュベーターに戻します。
- 各インサートについて、t = 0.5時間、t = 1時間、t = 1.5時間、およびt = 2時間から収集した培地を結合し、短時間渦流します。トラック希釈法を用いて採取した培地をLB寒天プレート上にプレートし、実験の最初の2時間にトランスサイトーゼーションされた細菌の量を定量化した。
注:30分ごとに細菌を回収し、氷上に保つことで、収集ウェルでの細菌の増殖を最小限に抑え、主にトランスサイトーゼーションされた細菌で測定を行うことができます。 - 標識トラック希釈LB寒天プレートをCO2補給なしで37°Cの細菌インキュベーターに入れ、T84トランスウェルプレートを組織培養インキュベーターに戻します。
- t = 4時間で、t = 2.5時間、t = 3時間、t = 3.5時間、およびt = 4時間から収集された培地を組み合わせて、ステップ6.3を繰り返します。
- t = 6時間で、t = 4.5時間、t = 5時間、t = 5.5時間、およびt = 6時間から収集された培地を組み合わせて、ステップ6.3を繰り返します。さらに、t = 6時間で、コントロールウェルから培地をプレートします。
7.実験の終了
- 実験終了時、t = 6時間にTEERを測定して記録する。手順 1.3.2-1.3.6 で説明されている手順を使用します。
- プローブを70%エタノールに10〜15分間沈めて除染します。必要に応じて、インサートを破棄するか、追加のアプリケーションのために保存/処理します。LB寒天プレートを一晩インキュベートし、他のすべての使用済み材料を消毒および/または安全に廃棄します。
- 一晩インキュベートした後、トラック希釈LBプレート上で細菌コロニーを手動でカウントし、接種量および 大腸菌 トランスサイトーシスの量を決定した。コントロールプレートに細菌の増殖が見られないことを確認してください。
結果
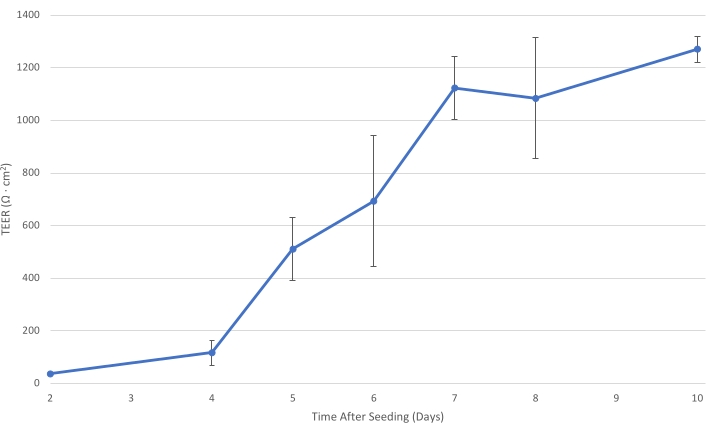
図1:T84は時間の経過とともに変化します。 T84セル層がインサート上で成熟するにつれて、単層の電気抵抗が増加します。少なくとも1,000 Ω・cm2のTEERでは、細胞層は、傍細胞細菌輸送を減少させ、主に経細胞細菌輸送の測定を可能にするのに十分に発達し?...
ディスカッション
この方法は、消化器病学および感染症20で使用される技術に由来します。腸管上皮バリアのin vitroモデルは、管腔内容物が自然免疫のこの関連成分と相互作用するメカニズムを解明するために使用されています6,8。侵襲性新生児大腸菌の宿主と病原体の相互作用も、遺伝子分析、抗菌薬耐性の研究、および免疫学的手?...
開示事項
何一つ。
謝辞
この研究は、ミズーリ大学カンザスシティ医学部がAIに発行したサラモリソン学生助成金によってサポートされました。
資料
| Name | Company | Catalog Number | Comments |
| 10,000 U/ mL Penicillin/Streptomycin Mixture | Fisher Scientific | 15-140-122 | |
| 15 mL sterile conical tubes | MidSci | C15B | |
| 2 mL microcentrifuge tubes | Avant | AVSS2000 | |
| 50 mL sterile polypropylene conical tubes | Falcon | 352070 | |
| Aspirator | Corning | 4930 | |
| Biosafety Cabinets | Labconco | 30441010028343 | Three of these are used in the method: one for sterile tissue work, one for infected tissue work, and one for bacterial work. |
| Centrifuge | Sorvall | Legend RT | |
| Disposable inoculation loops | Fisherbrand | 22363605 | |
| Dulbecco's Modified Eagle Medium (DMEM) | Gibco | 11965-084 | |
| Epithelial Volt/Ohm Meter | World Precision Instruments | EVOM2 | |
| Fetal Bovine Serum | Fisher Scientific | 10437028 | |
| Ham's F-12 Nutrient Mixture | Gibco | 11765-047 | |
| Hemacytometer | Sigma Aldrich, Bright Line | Z359629 | |
| Incubator shaker | New Brunswick | Innova 4080 | |
| Incubators | Thermo Scientific | 51030284 | Three of these are used in the method: one for sterile tissue culturing, one for infected tissue culturing, and one for bacterial incubation. |
| Lysogeny broth | Difco | 244610 | |
| Lysogeny broth agar | IBI Scientific | IB49101 | |
| Nikon Eclipse TS2R Microscope | Nikon | ||
| Spectrophotometer | Unico | 1100RS | |
| T84 Intestinal Cells | American Tissue Culture Collection | CCL248 | |
| Tissue culture inserts, with polyethylene trephthalate membrane, 3 µm pores, 24 well format | Falcon | 353096 | |
| Tissue culture plate, 24 wells | Falcon | 353504 | |
| Trypan blue stain | Fisher Scientific | T10282 |
参考文献
- Shakir, S. M., Goldbeck, J. M., Robison, D., Eckerd, A. M., Chavez-Bueno, S. Genotypic and phenotypic characterization of invasive neonatal Escherichia coli clinical isolates. American Journal of Perinatology. 31 (11), 975-982 (2014).
- Cole, B. K., et al. Route of infection alters virulence of neonatal septicemia Escherichia coli clinical isolates. PloS One. 12 (12), 0189032 (2017).
- Stoll, B. J., et al. Early-onset neonatal sepsis 2015 to 2017, the rise of Escherichia coli, and the need for novel prevention strategies. Journal of the American Medical Association Pediatrics. 174 (7), 200593 (2020).
- Dalgakiran, F., Witcomb, L. A., McCarthy, A. J., Birchenough, G. M., Taylor, P. W. Non-invasive model of neuropathogenic Escherichia coli infection in the neonatal rat. Journal of Visualized Experiments. (92), e52018 (2014).
- Williams, M., et al. Whole-genome sequencing-based phylogeny, antibiotic resistance, and invasive phenotype of Escherichia coli strains colonizing the cervix of women in preterm labor. BMC Microbiology. 21 (1), 330 (2021).
- Schoultz, I., Keita, &. #. 1. 9. 7. ;. The intestinal barrier and current techniques for the assessment of gut permeability. Cells. 9 (8), 1909 (2020).
- Devriese, S., et al. T84 monolayers are superior to Caco-2 as a model system of colonocytes. Histochemistry and Cell Biology. 148 (1), 85-93 (2017).
- Buckley, A., Turner, J. R. Cell biology of tight junction barrier regulation and mucosal disease. Cold Spring Harbor Perspectives in Biology. 10 (1), 029314 (2018).
- Awad, W. A., Hess, C., Hess, M. Enteric pathogens and their toxin-induced disruption of the intestinal barrier through alteration of tight junctions in chickens. Toxins. 9 (2), 60 (2017).
- Vancamelbeke, M., Vermeire, S. The intestinal barrier: A fundamental role in health and disease. Expert Review of Gastroenterology & Hepatology. 11 (9), 821-834 (2017).
- Aguilar, C., et al. Organoids as host models for infection biology - A review of methods. Experimental and Molecular Medicine. 53 (10), 1471-1482 (2021).
- Nickerson, K. P., et al. A versatile human intestinal organoid-derived epithelial monolayer model for the study of enteric pathogens. Microbiology Spectrum. 9 (1), 0000321 (2021).
- Gavin, H. E., Beubier, N. T., Satchell, K. J. The effector domain region of the Vibrio vulnificus MARTX toxin confers biphasic epithelial barrier disruption and is essential for systemic spread from the intestine. PLoS Pathogens. 13 (1), 1006119 (2017).
- Kobayashi, H., et al. Aeromonas sobria serine protease decreases epithelial barrier function in T84 cells and accelerates bacterial translocation across the T84 monolayer in vitro. PloS One. 14 (8), 0221344 (2019).
- Kalischuk, L. D., Inglis, G. D., Buret, A. G. Campylobacter jejuni induces transcellular translocation of commensal bacteria via lipid rafts. Gut Pathogens. 1 (1), 2 (2009).
- Cole, B. K., Ilikj, M., McCloskey, C. B., Chavez-Bueno, S. Antibiotic resistance and molecular characterization of bacteremia Escherichia coli isolates from newborns in the United States. PloS One. 14 (7), 0219352 (2019).
- Cadena-Herrera, D., et al. Validation of three viable-cell counting methods: Manual, semi-automated, and automated. Biotechnology Reports. 7, 9-16 (2015).
- den Hartog, G., et al. Apurinic/apyrimidinic endonuclease 1 restricts the internalization of bacteria into human intestinal epithelial cells through the inhibition of Rac1. Frontiers in Immunology. 11, 553994 (2020).
- Jett, B. D., Hatter, K. L., Huycke, M. M., Gilmore, M. S. Simplified agar plate method for quantifying viable bacteria. Biotechniques. 23 (4), 648-650 (1997).
- Lievin-Le Moal, V., Servin, A. L. Pathogenesis of human enterovirulent bacteria: Lessons from cultured, fully differentiated human colon cancer cell lines. Microbiology and Molecular Biology Reviews. 77 (3), 380-439 (2013).
- Kaczmarek, A., Budzynska, A., Gospodarek, E. Detection of K1 antigen of Escherichia coli rods isolated from pregnant women and neonates. Folia Microbiologica. 59 (5), 419-422 (2014).
- Kalita, A., Hu, J., Torres, A. G. Recent advances in adherence and invasion of pathogenic Escherichia coli. Current Opinion in Infectious Diseases. 27 (5), 459-464 (2014).
- McCool, D. J., Marcon, M. A., Forstner, J. F., Forstner, G. G. The T84 human colonic adenocarcinoma cell line produces mucin in culture and releases it in response to various secretagogues. Biochemical Journal. 267 (2), 491-500 (1990).
- Resta-Lenert, S., Barrett, K. E. Enteroinvasive bacteria alter barrier and transport properties of human intestinal epithelium: Role of iNOS and COX-2. Gastroenterology. 122 (4), 1070-1087 (2002).
- Elatrech, I., et al. Escherichia coli LF82 differentially regulates ROS production and mucin expression in intestinal epithelial T84 cells: Implication of NOX1. Inflammatory Bowel Diseases. 21 (5), 1018-1026 (2015).
- El-Aouar Filho, R. A., et al. Heterogeneous family of cyclomodulins: Smart weapons that allow bacteria to hijack the eukaryotic cell cycle and promote infections. Frontiers in Cellular and Infection Microbiology. 7, 208 (2017).
- Hopkins, A. M., Walsh, S. V., Verkade, P., Boquet, P., Nusrat, A. Constitutive activation of Rho proteins by CNF-1 influences tight junction structure and epithelial barrier function. Journal of Cell Science. 116, 725-742 (2003).
- Shiou, S. R., et al. Erythropoietin protects intestinal epithelial barrier function and lowers the incidence of experimental neonatal necrotizing enterocolitis. Journal of Biological Chemistry. 286 (14), 12123-12132 (2011).
- Newburg, D. S., Ko, J. S., Leone, S., Nanthakumar, N. N. Human milk oligosaccharides and synthetic galactosyloligosaccharides contain 3’-, 4-, and 6'-galactosyllactose and attenuate inflammation in human T84, NCM-460, and H4 cells and intestinal tissue ex vivo. Journal of Nutrition. 146 (2), 358-367 (2016).
- Burns, J. L., Griffith, A., Barry, J. J., Jonas, M., Chi, E. Y. Transcytosis of gastrointestinal epithelial cells by Escherichia coli K1. Pediatric Research. 49 (1), 30-37 (2001).
- Raut, B., Chen, L. J., Hori, T., Kaji, H. An open-source add-on EVOM((R)) device for real-time transepithelial/endothelial electrical resistance measurements in multiple transwell samples. Micromachines. 12 (3), 282 (2021).
- McCarthy, A. J., Stabler, R. A., Taylor, P. W. Genome-wide identification by transposon insertion sequencing of Escherichia coli K1 genes essential for in vitro growth, gastrointestinal colonizing capacity, and survival in serum. Journal of Bacteriology. 200 (7), 00698 (2018).
- Sayoc-Becerra, A., et al. The JAK-inhibitor tofacitinib rescues human intestinal epithelial cells and colonoids from cytokine-induced barrier dysfunction. Inflammatory Bowel Diseases. 26 (3), 407-422 (2020).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved