JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
신생아 대장균 균 혈증 분리물의 장 트랜스사이토시스 평가
요약
대장균은 출생 무렵에 박테리아를 섭취하는 신생아에게 패혈증을 일으킵니다. 대장균이 장내에서 혈류로 이동하는 능력과 관련된 과정은 잘 이해되지 않았습니다. 이 시험관 내 모델은 대장균 균주가 장 상피 세포를 통해 이동하는 능력을 평가합니다.
초록
신생아는 분만 시기에 장을 식민지화하는 모체 대장균 균주를 섭취합니다. 장을 가로질러 전위할 수 있는 능력을 가진 대장균 균주는 신생아의 혈류를 침범하여 생명을 위협하는 균혈증을 유발합니다. 여기에 제시된 방법론은 반투과성 삽입물에서 성장한 편광 장 상피 세포를 활용하여 시험관 내에서 분리된 신생아 대장균 균혈증의 트랜스사이토시스를 평가합니다. 이 방법은 합류하여 성장하여 단단한 접합부와 데스모좀을 형성하는 능력을 가진 확립된 T84 장 세포주를 사용합니다. 합류점에 도달한 후 성숙한 T84 단층은 전압계를 사용하여 정량화할 수 있는 경상피 저항(TEER)을 발생시킵니다. TEER 값은 장 단층에 걸쳐 박테리아를 포함한 세포 외 성분의 세포 외 투과성과 반비례 관계가 있습니다. 반면에 박테리아의 세포 횡단 통과 (transcytosis)는 반드시 TEER 측정을 변경하지는 않습니다. 이 모델에서는 감염 후 최대 6시간 동안 장 단층을 가로지르는 박테리아 통과를 정량화하고 TEER을 반복적으로 측정하여 세포 투과성을 모니터링합니다. 또한, 이 방법은 분극화된 상피를 가로지르는 박테리아 트랜스사이토시스 동안 단단한 접합부 및 기타 세포 간 접착 단백질의 구조적 변화를 연구하기 위해 면역염색과 같은 기술의 사용을 용이하게 합니다. 이 모델의 사용은 신생아 대장균이 장 상피를 가로 질러 트랜스 사이토 화하여 균혈증을 생성하는 메커니즘의 특성화에 기여합니다.
서문
대장균은 신생아에서 조기 발병 패혈증의 가장 흔한 원인입니다 1,2,3. 신생아 대장균 균혈증의 사망률은 40 %에 달할 수 있으며 수막염은 심각한 신경 발달 장애와 관련된 가능한 합병증입니다2. 신생아가 모체 대장균 균주를 섭취하면 신생아 균혈증이 발생할 수 있습니다. 이 과정은 동물 모델 2,4에서 복제되었습니다. 일단 섭취되면 병원성 박테리아는 신생아 장 내강에서 장 장벽을 넘어 혈류로 들어가 패혈증을 유발합니다. 균혈증을 생성하는 신생아 침습성 대장균 균주는 장 상피 세포를 침범하는 능력이 다양합니다 1,5. 그러나 침범 후 장 상피를 트랜스사이토이스하는 능력은 완전히 특성화되지 않았습니다.
이 장 트랜스사이토시스 모델은 장 상피를 가로지르는 박테리아 통로를 모방하기 위한 유용한 시험관내 방법이다. 이 원고에 제시된 방법의 전반적인 목표는 신생아 대장균 분리 물이 장 상피를 트랜스사이토 스하는 능력을 비교하는 것입니다. 여기에 설명된 모델은 불멸화된 인간 장 선암 세포(6,7)인 T84 세포를 이용한다. T84 세포는 두 개의 개별 구획이있는 반투막에서 합류하도록 성장합니다. 이 기술을 사용하는 이유는 생체 내에서 발생하는 것처럼 이러한 장 세포가 분극화되어 성숙한 단단한 접합부 6,8을 개발한다는 것입니다. 멤브레인과 접촉하는 쪽이 기저면이됩니다. 세포의 반대쪽은 섭취 한 병원체가 부착되어 침입하는 장 내강과 유사한 정점면이됩니다. 트랜스웰 막은 박테리아에 투과할 수 있지만 분극화된 장 세포는 단단한 접합부를 형성하여 박테리아 초세포 이동을 손상시킵니다9. 따라서, 이 방법은 세포횡단 경로를 포함하는 박테리아 트랜스사이토시스의 과정을 연구하기 위해 인간 세포주를 활용하는 제어된 시험관내 환경의 이점을 제공한다. 장 상피를 가로지르는 박테리아의 트랜스사이토시스를 조사하기 위한 다른 방법이 존재하지만, 여기에 제시된 트랜스웰 방법은 더 큰 용이성과 접근성을 제공합니다. Ussing 챔버 시스템에 설정된 생체 외 샘플을 활용하는 것과 같은 대체 기술을 사용할 수 있습니다. 그러나 그들은 특히 연구가 인간 생리학을 연구하려는 경우 쉽게 접근할 수 없는 조직 표본을 활용합니다10. 장내 오가노이드는 숙주-박테리아 상호작용을 연구하기 위한 시험관내 대안의 또 다른 예를 나타냅니다11. 오가노이드 단층은 박테리아 트랜스사이토시스를 연구하기 위해 트랜스웰 시스템에서도 사용할 수 있지만 줄기 세포의 분리 및 성장과 분화를 유도하기 위해 특정 성장 인자의 사용이 필요합니다12. 따라서, 이들의 사용은 더 많은 시간이 소요되고이 원고에 설명 된 transwell 방법에 비해 더 많은 비용과 관련이 있습니다.
이 시험관 내 트랜스웰 시스템을 사용하여 장 상피를 가로지르는 박테리아 통과 평가는 다양한 병원체에 대해 성공적으로 수행되었습니다. 이 연구는 편광된 장 상피13,14,15를 가로질러 박테리아의 트랜스사이토시스를 특성화하기 위해 T84 세포를 사용하는 트랜스웰 시스템의 유용성을 보여주었습니다. 그러나, 균혈증 생성 신생아 대장균 균주의 트랜스사이토시스 능력을 비교하기 위한 이러한 트랜스웰 방법의 적용은 구체적으로 설명되지 않았다. 이 원고는 다른 연구자들에게 신뢰할 수 있고 사용하기 쉽고 너무 비싼 리소스를 필요로하지 않는 표준 트랜스 웰 프로토콜을 제공합니다.
장 상피를 트랜스사이토이스하는 신생아 침습성 대장균 균주의 능력을 비교하기 위해, 장 상피 단층의 정점 쪽은 알려진 수의 박테리아 세포에 감염될 수 있다. 배양 후, 상피의 기저측에있는 배지를 수집하고 박테리아를 정량화하여 시간 경과에 따른 박테리아 트랜스 사이토 시스의 양을 결정할 수 있습니다. 이 원고에서 제시된 방법은 균혈증으로 입원 한 신생아에서 회수 된 신생아 대장균 임상 균주의 트랜스 사이토 시스 능력을 연구하는 데 사용됩니다. transcytosis 연구를위한 이러한 신생아 임상 분리 물의 선택에 대한 포함 기준은 이전에 발표되었습니다 1,2,16. 이 방법을 다른 대장균 균주를 사용하여 수행하면 트랜스 사이토 시스 능력을 비교할 수 있습니다. 이 과정을 통해 장 transcytosis 모델은 신생아 균혈증의 발달로 절정에 달하는 다단계 과정에 기여하는 대장균의 독성 인자를 특성화하는 귀중한 데이터를 제공합니다.
Access restricted. Please log in or start a trial to view this content.
프로토콜
알림: 오염을 방지하기 위해 생물안전 레벨 84(BSL-2) 안전 캐비닛에서 T2 세포, 박테리아, 플레이트 및 시약의 모든 조작을 수행하십시오. 멸균 T84 세포, 감염된 T84 세포 및 대장균과 관련된 모든 작업에 별도의 영역과 인큐베이터를 사용하십시오. 여기에 설명된 방법으로 테스트한 임상 대장균 분리는 우리 기관 1,16의 기관 검토 위원회의 지침에 따라 획득되었습니다.
1. T84 세포로 트랜스사이토시스 삽입물 준비(실험 약 1-2주 전)
- Dulbecco의 변형 독수리 배지 : Ham의 F-12 영양소 혼합물 (1 : 1, 최종 농도 : 각각 50 %), 5 % 태아 소 혈청 및 1 % (100 U / mL) 페니실린 / 스트렙토 마이신 이중 항생제 혼합물로 구성된 조직 배양 배지 (TCM + 항생제)에서 미국식 배양 컬렉션 (ATCC) T84 세포를 성장시킵니다. 세포를 37°C에서 5%CO2로 배양한다.
알림: 페니실린/스트렙토마이신(항생제가 없는 TCM)이 없는 이 배지 제형의 변형이 절차의 이후 단계(섹션 2 이후)에 사용됩니다. 각 단계에 올바른 공식이 사용되었는지 확인하십시오. - 생물안전 캐비닛(BSC) 내부에서 작업하면서 T84 세포를 24웰 플레이트용으로 제작된 3μm 공극이 있는 폴리에틸렌 테레프탈레이트 막 세포 배양 트랜스웰 삽입물에 시드합니다. 원하는 각 실험 조건에 대한 트랜스웰 삽입 반복과 감염되지 않은 대조군을 포함하여 오염 가능성을 모니터링합니다.
- 트랜스웰 삽입물을 고정하도록 설계된 24웰 플레이트에서 원하는 수의 수집 웰을 1mL의 TCM + 항생제로 채웁니다.
- 각 웰에 트랜스웰 인서트를 하나씩 배치합니다.
- 이 삽입물에 500μL의 TCM + 항생제에 현탁 된 1 x 105 T84 세포로 시드합니다. 트리판 블루 염색이 있는 혈구계 또는 자동 세포 계수기17을 사용하여 세포 수를 정량화합니다.
- 파종된 삽입물을 함유하는 트랜스웰 플레이트를 세포가 성장된 것과 동일한 조건에서 인큐베이션한다.
- 광학 현미경으로 단층이 인서트를 시딩한 후 약 48시간 후에 합류하기 시작했는지 확인합니다.
- 파종 후 2일마다 상피 전압/저항계(EVOM)를 사용하여 경상피 전기 저항(TEER)을 측정하고 기록하여 단층의 성숙도를 평가합니다. 일단 삽입물이 적어도 1,000 Ω·cm2의 TEER에 도달하면, 이들은 분석18을 위한 준비가 된 것으로 간주된다.
알림: 인서트는 일반적으로 파종 후 이 TEER에 도달하는 데 7-10일이 걸립니다. T84 세포는 이 저항에 도달하면 광학 현미경 검사에서 100% 합류를 보여줍니다.- EVOM 프로브를 사용하지 않을 때는 전극을 0.15M KCl에 담근 상태로 보관하십시오.
- TEER을 측정하기 전에 전극 프로브를 50mL 원뿔형 튜브에 70% 에탄올 5mL에 10-15분 동안 담가 오염을 제거합니다. 프로브를 제거하고 여분의 에탄올을 털어 내고 BSC 내부에서 10 분 동안 자연 건조시킵니다. 에탄올 튜브를 보관하십시오.
- 500μL의 TCM + 항생제가 들어있는 멸균 삽입물과 함께 1mL의 TCM + 항생제가 들어있는 멸균 웰에 건식 오염 제거 프로브를 배치하여 EVOM 및 프로브를 테스트합니다. EVOM 판독값이 <200 Ω인지 확인합니다. 이 공백 값을 기록하여 1.3.6단계에서 설명한 이후 저항 계산에 사용합니다.
- TCM + 항생제 튜브에서 프로브를 제거하십시오. 실험 전반에 걸쳐 프로브를 보관할 수 있도록이 튜브를 보관하십시오.
- 프로브를 수집 웰의 긴 전극과 인서트 내부의 짧은 전극으로 첫 번째 인서트로 부드럽게 내립니다. 긴 전극이 수집 우물의 바닥에 닿도록 허용하되 상피 단층을 방해할 수 있으므로 아래로 누르지 마십시오.
- 이 과정을 반복하여 모든 인서트에 대해 저항을 옴(Ω) 단위로 측정하고 기록합니다. 완료되면 프로브를 에탄올에 10-15 분 더 담가 오염시킵니다. 그런 다음 오염이 제거된 프로브를 보관을 위해 KCl 용액으로 다시 옮깁니다. T84 셀을 포함하는 각 삽입물로부터 얻은 각 값으로부터 단계 1.3.3에서 얻은 블랭크 저항을 뺀다. 각 인서트에 대한 결과 저항(Ω)에 각 인서트의 바닥 면적(cm2)을 곱하여 최종 TEER 측정값(Ω·cm2)을 얻습니다.
- TEER이 최소 1,000 Ω·cm2에 도달하면 상피 단층이 성숙되어 감염 분석을 위한 준비가 됩니다.
- TEER이 성숙함에 따라 1-2일마다 세포에 새로운 배지를 제공합니다.
- 새로운 24웰 플레이트에서 준비 중인 각 시드 삽입물에 대해 1mL의 TCM + 항생제를 한 웰에 추가합니다.
- 멸균 포셉을 사용하여 인서트를 새로 보충 된 우물로 조심스럽게 옮깁니다.
- 삽입물의 용지를 교체합니다.
- 플레이트를 기울이고 사내 진공 흡인기를 사용하여 인서트 측면을 따라 피펫 팁으로 미디어를 부드럽게 제거하여 인서트에서 기존 미디어를 제거합니다. 흡인기는 세포의 파괴를 방지하기 위해 낮은 수준의 흡입을 조절할 수있게합니다. 피펫 팁이 인서트 바닥에 닿지 않도록하면 상피 단층이 손상됩니다.
- 삽입물에 500μL의 TCM + 항생제를 추가합니다. 광학 현미경으로 단층을 시각화하여 손상되지 않았는지 확인합니다.
- 1-2일마다 1.3.2-1.3.6단계에서 설명한 대로 각 삽입물에 걸쳐 TEER을 측정합니다.
2. 실험 1일 전에 항생제 없이 TCM을 사용하여 T84 세포 준비
- 실험 전날 TEER을 측정하고 기록하였다.
- 이전 셀 준비 및 유지 관리 동안과 동일한 방식으로 TCM을 교체하십시오. 그러나 감염에 대비하여 항생제가없는 TCM이 대신 사용됩니다 (플레이트 웰에 1mL, 삽입물에 500μL).
3. 대장균 배양 (실험 1일 전에 시작)
주의 : 병원성 임상 대장균 균 주로 작업 할 때 생물 안전 레벨 2 (BSL-2) 예방 조치를 사용하십시오.
- 라벨이 붙은 15mL 원뿔형 튜브에 멸균 리소제닉 브로스(LB) 5mL를 넣고 멸균 루프를 사용하여 하나의 박테리아 균주(E. coli)에서 하나의 콜로니를 브로스에 접종합니다. 이 과정을 반복하여 테스트할 각 균주에 대해 하나의 야간 배양 튜브를 만듭니다.
- 튜브의 뚜껑을 느슨하게 한 상태에서 인큐베이터 쉐이커(250rpm, 37°C)에서 밤새 배양합니다.
4. 대장균 접종물, 상피세포 및 재료 준비(실험 당일 아침)
알림: 이 시점부터 37°C까지 예열된 항생제 없이 TCM을 사용하십시오.
- 각 야간 LB 배양에서 250μL를 50mL 원뿔형 튜브(개별 균주당 하나씩)에 항생제가 없는 TCM 25mL에 추가합니다. 튜브의 캡을 느슨하게 유지하십시오. 이 새로운 배양 튜브를 정확히 2시간 동안 동일한 설정(250rpm, 37°C)의 셰이커에 넣습니다. 기다리는 동안 나머지 하위 단계를 수행합니다.
- 1.3.2-1.3.6단계에 설명된 대로 각 삽입물에서 TEER을 측정합니다. 이를 시간 (t) = 0시간에 TEER로 기록합니다.
- 인서트를 새 플레이트의 웰로 이동하고 1.4.3 단계에서 설명한 기술을 사용하여 매체를 교체하십시오. 그러나 이번에는 새로운 수집 웰에 500μL의 TCM w/o 항생제를 채우고 삽입물을 400μL의 TCM w/o 항생제로 채웁니다. 감염 될 때까지 조직 배양 인큐베이터 내부에 삽입물을 보관하십시오.
- 나중에 도금 및 박테리아 정량화를 위해 실온(RT)으로 따뜻하게 하기에 충분한 수의 정사각형 LB 한천 플레이트를 설정합니다.
5. 세포 접종 (실험 시작)
- 정확히 2시간 후, 셰이커에서 아침 박테리아 배양물을 제거하고 10분 동안 원심분리합니다(1,900 x g, 4°C).
알림: 다음 모든 단계에서 성장을 최소화하기 위해 모든 박테리아 현탁액을 얼음 위에 보관하십시오. - 항생제 없이 TCM에 박테리아 펠릿을 재현탁합니다. 분광 광도계를 사용하여 광학 밀도 (OD)를 0.7-0.9로 조정하고 항생제가없는 TCM으로 1 x 106 콜 로니 형성 단위 (CFU) / mL (약 1:100 희석)의 농도로 추가로 희석합니다. 이 박테리아 현탁액을 사용하여 각 삽입물을 100 μL 부피당 1 x 105 CFU로 감염시킵니다.
- 트랜스웰 플레이트에 라벨을 붙이고 각 삽입물에 100μL의 OD 조정 접종물을 감염시킵니다(삽입물당 총 1 x 105CFU ). 이제 분석이 시작되었습니다. 시간을 기록하고 t = 0h로 기록하십시오.
- 접종 박테리아 현탁액을 플레이트하여 트랙 희석 방법을 사용하여 CFU/mL를 정량화하고 정사각형 LB 한천 플레이트19에 10μL 분취량을 플레이팅합니다.
6. 트랜스사이토시스 정량화
- 접종 후 30분마다 항생제 없이 500μL의 TCM으로 새 웰을 채웁니다. 각각의 다른 박테리아 균주에 대해 다른 멸균 겸자 세트를 사용하여 삽입물을 이 새로운 우물로 옮깁니다.
- 사용된 수집 웰에서 각 삽입물에 대해 별도의 라벨링된 튜브에 배지를 수집합니다. 이 튜브를 얼음 위에 놓습니다. 트랜스웰 플레이트를 시점 사이에 인큐베이터로 되돌립니다.
- 각 삽입물에 대해 t = 0.5h, t = 1h, t = 1.5h, t = 2h에서 수집된 매체를 결합하고 와류를 짧게 결합합니다. 수집된 배지를 트랙 희석 방법을 사용하여 LB 한천 플레이트에 플레이팅하여 실험의 처음 2시간 동안 트랜스사이토시션된 박테리아의 양을 정량화했습니다.
알림: 30분마다 박테리아를 회수하고 얼음 위에 보관하면 수집 우물의 박테리아 성장이 최소화되고 주로 형질전환된 박테리아에 대한 측정이 수행됩니다. - 표지된 트랙 희석 LB 한천 플레이트를 보충CO2 없이 37°C의 박테리아 인큐베이터에 놓고, T84 트랜스웰 플레이트를 조직 배양 인큐베이터로 되돌린다.
- t = 4h에서, t = 2.5h, t = 3h, t = 3.5h, 및 t = 4h에서 수집된 매체를 조합하여 단계 6.3을 반복한다.
- t=6h에서, t= 4.5h, t=5h, t=5.5h, 및 t=6h에서 수집된 매체를 조합하여 6.3단계를 반복한다. 추가적으로, t = 6 h에서, 대조 웰로부터 배지를 플레이트화한다.
7. 실험 종료
- 실험 종료시에 TEER을 측정하고 기록한다, t=6시간. 1.3.2-1.3.6단계에 설명된 절차를 사용합니다.
- 프로브를 70 % 에탄올에 10-15 분 동안 담가 오염을 제거하십시오. 인서트를 폐기하거나 원하는 경우 추가 적용을 위해 저장/처리합니다. LB 한천 플레이트를 밤새 배양하고 다른 모든 사용 된 재료를 소독 및 / 또는 안전하게 폐기하십시오.
- 하룻밤 배양 후, 트랙 희석 LB 플레이트에서 박테리아 콜로니를 수동으로 계수하여 접종량과 대장균 트랜스사이토시스의 양을 결정합니다. 컨트롤 플레이트에 박테리아 성장이 나타나지 않는지 확인하십시오.
Access restricted. Please log in or start a trial to view this content.
결과
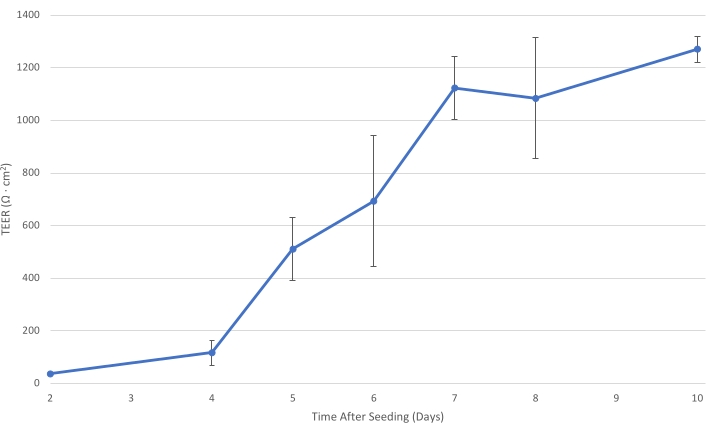
그림 1: 시간 경과에 따른 T84 TEER. T84 셀층이 인서트에서 성숙함에 따라 단층의 전기 저항이 증가합니다. 적어도 1,000 Ω·cm2의 TEER에서, 세포층은 세포내 박테리아 수송을 감소시키고 주로 세포경질 박테리아 수송의 측정을 허용하기에 충분히 발달된다. 오차 ?...
Access restricted. Please log in or start a trial to view this content.
토론
이 방법은 위장병 학 및 전염병20에서 사용되는 기술로부터 유도된다. 장 상피 장벽의 시험관 내 모델은 내강 내용물이 선천성 면역의 관련 구성 요소와 상호 작용하는 메커니즘을 밝히기 위해 사용되었습니다 6,8. 침습성 신생아 대장균의 숙주-병원체 상호 작용은 또한 유전자 분석, 항생제 내성 연구 및 면역학적 기술
Access restricted. Please log in or start a trial to view this content.
공개
없음.
감사의 말
이 작업은 미주리 대학교 캔자스 시티 의과 대학에서 AI에 발행 한 Sarah Morrison 학생 보조금의 지원을 받았습니다.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| 10,000 U/ mL Penicillin/Streptomycin Mixture | Fisher Scientific | 15-140-122 | |
| 15 mL sterile conical tubes | MidSci | C15B | |
| 2 mL microcentrifuge tubes | Avant | AVSS2000 | |
| 50 mL sterile polypropylene conical tubes | Falcon | 352070 | |
| Aspirator | Corning | 4930 | |
| Biosafety Cabinets | Labconco | 30441010028343 | Three of these are used in the method: one for sterile tissue work, one for infected tissue work, and one for bacterial work. |
| Centrifuge | Sorvall | Legend RT | |
| Disposable inoculation loops | Fisherbrand | 22363605 | |
| Dulbecco's Modified Eagle Medium (DMEM) | Gibco | 11965-084 | |
| Epithelial Volt/Ohm Meter | World Precision Instruments | EVOM2 | |
| Fetal Bovine Serum | Fisher Scientific | 10437028 | |
| Ham's F-12 Nutrient Mixture | Gibco | 11765-047 | |
| Hemacytometer | Sigma Aldrich, Bright Line | Z359629 | |
| Incubator shaker | New Brunswick | Innova 4080 | |
| Incubators | Thermo Scientific | 51030284 | Three of these are used in the method: one for sterile tissue culturing, one for infected tissue culturing, and one for bacterial incubation. |
| Lysogeny broth | Difco | 244610 | |
| Lysogeny broth agar | IBI Scientific | IB49101 | |
| Nikon Eclipse TS2R Microscope | Nikon | ||
| Spectrophotometer | Unico | 1100RS | |
| T84 Intestinal Cells | American Tissue Culture Collection | CCL248 | |
| Tissue culture inserts, with polyethylene trephthalate membrane, 3 µm pores, 24 well format | Falcon | 353096 | |
| Tissue culture plate, 24 wells | Falcon | 353504 | |
| Trypan blue stain | Fisher Scientific | T10282 |
참고문헌
- Shakir, S. M., Goldbeck, J. M., Robison, D., Eckerd, A. M., Chavez-Bueno, S. Genotypic and phenotypic characterization of invasive neonatal Escherichia coli clinical isolates. American Journal of Perinatology. 31 (11), 975-982 (2014).
- Cole, B. K., et al. Route of infection alters virulence of neonatal septicemia Escherichia coli clinical isolates. PloS One. 12 (12), 0189032(2017).
- Stoll, B. J., et al. Early-onset neonatal sepsis 2015 to 2017, the rise of Escherichia coli, and the need for novel prevention strategies. Journal of the American Medical Association Pediatrics. 174 (7), 200593(2020).
- Dalgakiran, F., Witcomb, L. A., McCarthy, A. J., Birchenough, G. M., Taylor, P. W. Non-invasive model of neuropathogenic Escherichia coli infection in the neonatal rat. Journal of Visualized Experiments. (92), e52018(2014).
- Williams, M., et al. Whole-genome sequencing-based phylogeny, antibiotic resistance, and invasive phenotype of Escherichia coli strains colonizing the cervix of women in preterm labor. BMC Microbiology. 21 (1), 330(2021).
- Schoultz, I., Keita, Å The intestinal barrier and current techniques for the assessment of gut permeability. Cells. 9 (8), 1909(2020).
- Devriese, S., et al. T84 monolayers are superior to Caco-2 as a model system of colonocytes. Histochemistry and Cell Biology. 148 (1), 85-93 (2017).
- Buckley, A., Turner, J. R. Cell biology of tight junction barrier regulation and mucosal disease. Cold Spring Harbor Perspectives in Biology. 10 (1), 029314(2018).
- Awad, W. A., Hess, C., Hess, M. Enteric pathogens and their toxin-induced disruption of the intestinal barrier through alteration of tight junctions in chickens. Toxins. 9 (2), 60(2017).
- Vancamelbeke, M., Vermeire, S. The intestinal barrier: A fundamental role in health and disease. Expert Review of Gastroenterology & Hepatology. 11 (9), 821-834 (2017).
- Aguilar, C., et al. Organoids as host models for infection biology - A review of methods. Experimental and Molecular Medicine. 53 (10), 1471-1482 (2021).
- Nickerson, K. P., et al. A versatile human intestinal organoid-derived epithelial monolayer model for the study of enteric pathogens. Microbiology Spectrum. 9 (1), 0000321(2021).
- Gavin, H. E., Beubier, N. T., Satchell, K. J. The effector domain region of the Vibrio vulnificus MARTX toxin confers biphasic epithelial barrier disruption and is essential for systemic spread from the intestine. PLoS Pathogens. 13 (1), 1006119(2017).
- Kobayashi, H., et al. Aeromonas sobria serine protease decreases epithelial barrier function in T84 cells and accelerates bacterial translocation across the T84 monolayer in vitro. PloS One. 14 (8), 0221344(2019).
- Kalischuk, L. D., Inglis, G. D., Buret, A. G. Campylobacter jejuni induces transcellular translocation of commensal bacteria via lipid rafts. Gut Pathogens. 1 (1), 2(2009).
- Cole, B. K., Ilikj, M., McCloskey, C. B., Chavez-Bueno, S. Antibiotic resistance and molecular characterization of bacteremia Escherichia coli isolates from newborns in the United States. PloS One. 14 (7), 0219352(2019).
- Cadena-Herrera, D., et al. Validation of three viable-cell counting methods: Manual, semi-automated, and automated. Biotechnology Reports. 7, 9-16 (2015).
- den Hartog, G., et al. Apurinic/apyrimidinic endonuclease 1 restricts the internalization of bacteria into human intestinal epithelial cells through the inhibition of Rac1. Frontiers in Immunology. 11, 553994(2020).
- Jett, B. D., Hatter, K. L., Huycke, M. M., Gilmore, M. S. Simplified agar plate method for quantifying viable bacteria. Biotechniques. 23 (4), 648-650 (1997).
- Lievin-Le Moal, V., Servin, A. L. Pathogenesis of human enterovirulent bacteria: Lessons from cultured, fully differentiated human colon cancer cell lines. Microbiology and Molecular Biology Reviews. 77 (3), 380-439 (2013).
- Kaczmarek, A., Budzynska, A., Gospodarek, E. Detection of K1 antigen of Escherichia coli rods isolated from pregnant women and neonates. Folia Microbiologica. 59 (5), 419-422 (2014).
- Kalita, A., Hu, J., Torres, A. G. Recent advances in adherence and invasion of pathogenic Escherichia coli. Current Opinion in Infectious Diseases. 27 (5), 459-464 (2014).
- McCool, D. J., Marcon, M. A., Forstner, J. F., Forstner, G. G. The T84 human colonic adenocarcinoma cell line produces mucin in culture and releases it in response to various secretagogues. Biochemical Journal. 267 (2), 491-500 (1990).
- Resta-Lenert, S., Barrett, K. E. Enteroinvasive bacteria alter barrier and transport properties of human intestinal epithelium: Role of iNOS and COX-2. Gastroenterology. 122 (4), 1070-1087 (2002).
- Elatrech, I., et al. Escherichia coli LF82 differentially regulates ROS production and mucin expression in intestinal epithelial T84 cells: Implication of NOX1. Inflammatory Bowel Diseases. 21 (5), 1018-1026 (2015).
- El-Aouar Filho, R. A., et al. Heterogeneous family of cyclomodulins: Smart weapons that allow bacteria to hijack the eukaryotic cell cycle and promote infections. Frontiers in Cellular and Infection Microbiology. 7, 208(2017).
- Hopkins, A. M., Walsh, S. V., Verkade, P., Boquet, P., Nusrat, A. Constitutive activation of Rho proteins by CNF-1 influences tight junction structure and epithelial barrier function. Journal of Cell Science. 116, 725-742 (2003).
- Shiou, S. R., et al. Erythropoietin protects intestinal epithelial barrier function and lowers the incidence of experimental neonatal necrotizing enterocolitis. Journal of Biological Chemistry. 286 (14), 12123-12132 (2011).
- Newburg, D. S., Ko, J. S., Leone, S., Nanthakumar, N. N. Human milk oligosaccharides and synthetic galactosyloligosaccharides contain 3’-, 4-, and 6'-galactosyllactose and attenuate inflammation in human T84, NCM-460, and H4 cells and intestinal tissue ex vivo. Journal of Nutrition. 146 (2), 358-367 (2016).
- Burns, J. L., Griffith, A., Barry, J. J., Jonas, M., Chi, E. Y. Transcytosis of gastrointestinal epithelial cells by Escherichia coli K1. Pediatric Research. 49 (1), 30-37 (2001).
- Raut, B., Chen, L. J., Hori, T., Kaji, H. An open-source add-on EVOM((R)) device for real-time transepithelial/endothelial electrical resistance measurements in multiple transwell samples. Micromachines. 12 (3), 282(2021).
- McCarthy, A. J., Stabler, R. A., Taylor, P. W. Genome-wide identification by transposon insertion sequencing of Escherichia coli K1 genes essential for in vitro growth, gastrointestinal colonizing capacity, and survival in serum. Journal of Bacteriology. 200 (7), 00698(2018).
- Sayoc-Becerra, A., et al. The JAK-inhibitor tofacitinib rescues human intestinal epithelial cells and colonoids from cytokine-induced barrier dysfunction. Inflammatory Bowel Diseases. 26 (3), 407-422 (2020).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유