Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Yenidoğan Escherichia coli Bakteriyemi İzolasyonlarının İntestinal Transsitozunun Değerlendirilmesi
Bu Makalede
Özet
Escherichia coli, doğum sırasında bakterileri yutan yenidoğanlarda sepsise neden olur. E. coli'nin enterik yoldan kan dolaşımına seyahat etme kabiliyetinde yer alan süreç tam olarak anlaşılamamıştır. Bu in vitro model, E. coli suşlarının bağırsak epitel hücrelerinden geçme yeteneğini değerlendirir.
Özet
Yenidoğanlar, doğum sırasında bağırsak yollarını kolonize eden maternal E. coli suşlarını yutarlar. Bağırsak boyunca yer değiştirme yeteneğine sahip E. coli suşları, yenidoğanın kan dolaşımını istila ederek hayatı tehdit eden bakteriyemiye neden olur. Burada sunulan metodoloji, neonatal E. coli bakteriyemi izolatlarının in vitro transsitozunu değerlendirmek için yarı geçirgen ekler üzerinde yetiştirilen polarize bağırsak epitel hücrelerini kullanır. Bu yöntem, birleşime doğru büyüme ve sıkı kavşaklar ve dezmozomlar oluşturma yeteneğine sahip yerleşik T84 bağırsak hücre hattını kullanır. Birleşime ulaştıktan sonra, olgun T84 monokatmanları, bir voltmetre kullanılarak ölçülebilen transepitelyal direnç (TEER) geliştirir. TEER değerleri, bakteriler de dahil olmak üzere hücre dışı bileşenlerin bağırsak tek katmanı boyunca parasellüler geçirgenliği ile ters orantılıdır. Öte yandan, bakterilerin hücre ötesi geçişi (transsitoz), TEER ölçümlerini mutlaka değiştirmez. Bu modelde, bağırsak tek katmanı boyunca bakteriyel geçiş, enfeksiyon sonrası 6 saate kadar ölçülür ve parasellüler geçirgenliği izlemek için tekrarlanan TEER ölçümleri yapılır. Ek olarak, bu yöntem, polarize epitel boyunca bakteriyel transsitoz sırasında sıkı kavşaklardaki yapısal değişiklikleri ve diğer hücreden hücreye yapışma proteinlerini incelemek için immün boyama gibi tekniklerin kullanılmasını kolaylaştırır. Bu modelin kullanımı, bağırsak epiteli boyunca yenidoğan E. coli transsitozunun bakteriyemi ürettiği mekanizmaların karakterizasyonuna katkıda bulunur.
Giriş
Escherichia coli yenidoğanlarda erken başlangıçlı sepsisin en sık nedenidir 1,2,3. Yenidoğan E. coli bakteriyemisinin mortalite oranı %40'a ulaşabilir ve menenjit ciddi nörogelişimsel sakatlıklarla ilişkili olası bir komplikasyondur2. Maternal E. coli suşlarının yenidoğan tarafından yutulması yenidoğan bakteriyemisi üretebilir; Bu süreç hayvan modellerindeçoğaltılmıştır 2,4. Bir kez yutulduğunda, patojenik bakteriler yenidoğan bağırsak lümeninden bağırsak bariyeri boyunca hareket eder ve kan dolaşımına girerek septisemiye neden olur. Bakteriyemi üreten yenidoğan invaziv E. coli suşları, bağırsak epitel hücrelerini istila etme yeteneklerine göre değişir 1,5. Bununla birlikte, invazyon sonrası bağırsak epitelini transsitoz etme yetenekleri tam olarak karakterize edilmemiştir.
Bu intestinal transsitoz modeli, intestinal epitel boyunca bakteriyel geçişi taklit etmek için yararlı bir in vitro yöntemdir. Bu makalede sunulan yöntemlerin genel amacı, yenidoğan E. coli izolatlarının intestinal epiteli transsitoz etme yeteneğini karşılaştırmaktır. Burada açıklanan model, ölümsüzleştirilmiş insan bağırsak adenokarsinomu hücreleri olan T84 hücrelerini kullanır 6,7. T84 hücreleri, iki ayrı bölmeye sahip yarı geçirgen bir zar üzerinde birleşecek şekilde yetiştirilir. Bu tekniği kullanmanın mantığı, in vivo olarak olduğu gibi, bu bağırsak hücrelerinin polarize olması ve olgun sıkı kavşaklar geliştirmesidir 6,8. Membranla temas eden taraf bazal taraf haline gelir. Hücrelerin karşı tarafı, yutulan patojenlerin yapıştığı ve istila ettiği bağırsak lümenine benzeyen apikal taraf haline gelir. Transwell membran bakterilere geçirgendir, ancak polarize bağırsak hücreleri, bakteriyel parasellüler hareketi bozan sıkı kavşaklar oluşturur9. Bu nedenle, bu yöntem, hücre içi yol da dahil olmak üzere bakteriyel transsitoz sürecini incelemek için bir insan hücre hattı kullanan kontrollü bir in vitro ortamın avantajını sağlar. Bağırsak epiteli boyunca bakterilerin transsitozunu araştırmak için başka yöntemler mevcut olsa da, burada sunulan transwell yöntemi daha fazla kolaylık ve erişilebilirlik sağlar. Ussing oda sistemlerinde kurulan ex vivo numuneleri kullananlar gibi alternatif teknikler mevcuttur. Bununla birlikte, özellikle araştırma insan fizyolojisini incelemeyi amaçlıyorsa, kolayca erişilemeyen doku örneklerini kullanırlar10. Bağırsak organoidleri, konakçı-bakteri etkileşimlerini incelemek için in vitro alternatifin başka bir örneğini temsil eder11. Organoid monokatmanlar transwell sisteminde bakteriyel transsitozu incelemek için de kullanılabilirken, kök hücrelerin izolasyonunu ve büyümesini ve farklılaşmayı indüklemek için spesifik büyüme faktörlerinin kullanılmasını gerektirirler12. Bu nedenle, kullanımları daha fazla zaman alıcıdır ve bu makalede açıklanan transwell yöntemine kıyasla daha yüksek maliyetlerle ilişkilidir.
Bu in vitro transwell sistemi kullanılarak bağırsak epiteli boyunca bakteriyel geçişin değerlendirilmesi, çeşitli patojenler için başarıyla gerçekleştirilmiştir. Bu çalışmalar, polarize bağırsak epiteli13,14,15 boyunca bakterilerin transsitozunu karakterize etmek için T84 hücrelerini kullanan transwell sisteminin yararlılığını göstermiştir. Bununla birlikte, bakteriyemi üreten yenidoğan E. coli suşlarının transsitoz yeteneğini karşılaştırmak için bu transwell yönteminin uygulanması ayrıntılı olarak tanımlanmamıştır. Bu makale, diğer araştırmacılara güvenilir ve kullanımı kolay olan ve çok pahalı kaynaklar gerektirmeyen standart bir transwell protokolü sunmaktadır.
Yenidoğan invaziv E. coli suşlarının bağırsak epitelini transsitoz etme yeteneğini karşılaştırmak için, bağırsak epitel tek katmanının apikal tarafı bilinen sayıda bakteri hücresi ile enfekte olabilir. Kuluçkadan sonra, epitelin bazal tarafındaki ortam toplanabilir ve zamanla bakteriyel transsitoz miktarını belirlemek için bakteriler nicelleştirilebilir. Bu yazıda, bakteriyemi ile hastaneye yatırılan yenidoğanlardan iyileşen yenidoğan E. coli klinik suşlarının transsitoz yeteneğini incelemek için sunulan yöntemler kullanılmıştır. Transsitoz çalışmaları için bu yenidoğan klinik izolatlarının seçiminde yer alan kriterler daha önceyayınlanmış 1,2,16. Bu yöntem farklı E. coli suşları kullanılarak gerçekleştirildiğinde, transsitoz yetenekleri karşılaştırılabilir. Bu süreçle, intestinal transsitoz modeli, yenidoğan bakteriyemi gelişimiyle sonuçlanan çok aşamalı sürece katkıda bulunan E. coli'nin virülans faktörlerini karakterize etmek için değerli veriler sağlar.
Protokol
NOT: Kontaminasyonu önlemek için T84 hücrelerinin, bakterilerinin, plakalarının ve reaktiflerinin tüm manipülasyonlarını bir Biyogüvenlik Seviye 2 (BSL-2) güvenlik kabininde gerçekleştirin. Steril T84 hücrelerini, enfekte T84 hücrelerini ve E. coli'yi içeren tüm çalışmalar için ayrı alanlar ve inkübatörler kullanın. Burada açıklanan yöntemlerle test edilen klinik E. coli izolatları, kurumumuzdaki Kurumsal Gözden Geçirme Kurulu'nun1,16 yönergelerine uygun olarak elde edilmiştir.
1. T84 hücreleri ile transsitoz eklerinin hazırlanması (deneyden yaklaşık 1-2 hafta önce)
- Dulbecco'nun Modifiye Kartal Ortamı: Ham'ın F-12 besin karışımından (1: 1, son konsantrasyon: her biri% 50), % 5 fetal sığır serumu ve% 1 (100 U / mL) penisilin / streptomisin ikili antibiyotik karışımından oluşan doku kültürü ortamında (TCM + antibiyotikler) Amerikan Tipi Kültür Koleksiyonu (ATCC) T84 hücrelerini büyütün. Hücreleri 37 ° C'de% 5 CO2 ile inkübe edin.
NOT: Bu ortam formülasyonunun penisilin/streptomisin (antibiyotikler olmadan TCM) içermeyen bir varyasyonu, işlemin sonraki adımları (bölüm 2 ve sonrası) için kullanılır. Her adım için doğru formülasyonun kullanıldığından emin olun. - Bir biyogüvenlik kabini (BSC) içinde çalışarak, T84 hücrelerini 24 delikli plakalar için yapılmış 3 μm gözenekli polietilen tereftalat membran hücre kültürü transwell eklerine tohumlayın. İstenilen her deneysel durum için transwell kesici uç replikalarını ve olası kontaminasyonu izlemek için enfekte olmamış kontrolleri dahil edin.
- Transwell uçlarını tutmak için tasarlanmış 24 delikli bir plakada, istenen sayıda toplama kuyusunu 1 mL TCM + antibiyotik ile doldurun.
- Her kuyucuğa, bir transwell eki yerleştirin.
- Bu ekleri,500 μL TCM + antibiyotik içinde askıya alınmış 1 x 10 5 T84 hücresi ile tohumlayın. Tripan mavisi boyalı bir hemositometre veya otomatik bir hücre sayacı17 kullanarak hücre sayısını ölçün.
- Tohumlanmış ekler içeren transwell plakalarını, hücrelerin yetiştirildiği aynı koşullarda inkübe edin.
- Işık mikroskobu ile tek katmanların, ekin tohumlanmasından sonra, tohumlamadan yaklaşık 48 saat sonra akmaya başladığını doğrulayın.
- Tohumlamadan sonra her 2 günde bir, tek katmanın olgunluğunu değerlendirmek için bir epitel volt / ohm metre (EVOM) kullanarak transepitelyal elektrik direncini (TEER) ölçün ve kaydedin. Kesici uçlar en az 1.000 Ω·cm2'lik bir TEER'e ulaştığında,18 numaralı tahlil için hazır kabul edilir.
NOT: Kesici uçların tohumlamadan sonra bu TEER'ye ulaşması genellikle 7-10 gün sürer. T84 hücreleri, bu dirence ulaşıldığında ışık mikroskobu altında% 100 birleşme gösterecektir.- EVOM probunu, kullanılmadığında 0,15 M KCl'ye batırılmış elektrotlarla saklayın.
- TEER'i ölçmeden önce, elektrot probunu 10-15 dakika boyunca 50 mL'lik bir konik tüp içinde 5 mL'lik %70 etanol içine batırarak dekontamine edin. Probu çıkarın, fazla etanolün çalkalanması ve BSC'nin içinde 10 dakika boyunca hava ile kurumasına izin verin. Etanol tüpünü tutun.
- Kuru dekontamine probu, içinde 500 μL TCM + antibiyotik içeren steril bir kesici uç bulunan 1 mL TCM + antibiyotik içeren steril bir kuyuya yerleştirerek EVOM ve probu test edin. EVOM okumasının <200 Ω olduğundan emin olun. Adım 1.3.6'da açıklanan daha sonraki direnç hesaplamalarında kullanmak için bu boş değeri kaydedin.
- Probu TCM + antibiyotik tüpünden çıkarın. Deney boyunca probun depolanması için bu tüpü saklayın.
- Probu, toplama kuyusundaki uzun elektrot ve kesici ucun içindeki kısa elektrot ile ilk kesici uca yavaşça indirin. Uzun elektrotun toplama kuyusunun dibine temas etmesine izin verin, ancak epitel tek katmanını bozabileceğinden aşağı itmeyin.
- Her kesici uç için Ohm (Ω) cinsinden direnci ölçmek ve kaydetmek için bu işlemi tekrarlayın. Tamamlandığında, probu etanol içinde 10-15 dakika daha batırarak dekontamine edin. Ardından, dekontamine probu depolama için KCl çözümüne geri taşıyın. Adım 1.3.3'te elde edilen boş direnci, T84 hücreleri içeren her bir uçtan elde edilen her değerden çıkarın. Son TEER ölçümünü (Ω·cm2) elde etmek için her kesici uç için ortaya çıkan direnci (Ω) her bir kesici ucun alt kısmındaki alanla (cm2) çarpın.
- TEER en az 1.000 Ω · cm2'ye ulaştığında, epitel tek katmanı olgunlaşır ve enfeksiyon tahlilleri için hazırdır.
- TEER olgunlaştıkça, hücrelere her 1-2 günde bir taze ortam sağlayın.
- Yeni bir 24 delikli plakada, hazırlanan her tohumlu kesici uç için bir oyuğa 1 mL TCM + antibiyotik ekleyin.
- Steril forseps kullanarak, ekleri dikkatlice yeni doldurulmuş kuyucuklara aktarın.
- Kesici uçlardaki ortamı değiştirin.
- Plakayı eğerek ve kesici ucun yan tarafındaki pipet ucuyla ortamı nazikçe çıkarmak için şirket içi bir vakum aspiratörü kullanarak eski ortamları kesici uçlardan çıkarın. Aspiratör, hücrelerin bozulmasını önlemek için düşük seviyeli emmenin düzenlenmesine izin verir. Pipet ucunun kesici ucun alt kısmına temas etmesine izin vermeyin, çünkü bu gelişmekte olan epitel tek katmanını bozacaktır.
- Eklere 500 μL TCM + antibiyotik ekleyin. Bozulmadan kaldığını doğrulamak için tek katmanı ışık mikroskobu ile görselleştirin.
- Her 1-2 günde bir, yukarıda 1.3.2-1.3.6 numaralı adımlarda açıklandığı gibi her bir kesici uç boyunca TEER'yi ölçün.
2. T84 hücrelerinin deneyden 1 gün önce TCM antibiyotiksiz olarak hazırlanması
- TEER'yi deneyden bir gün önce ölçün ve kaydedin.
- TCM'yi önceki hücre hazırlığı ve bakımı sırasında olduğu gibi değiştirin. Bununla birlikte, enfeksiyona hazırlık için antibiyotik içermeyen TCM kullanılır (plaka kuyusunda 1 mL ve ekte 500 μL).
3. E. coli kültürleri (deneyden 1 gün önce başladı)
DİKKAT: Patojenik klinik E. coli suşlarıyla çalışırken Biyogüvenlik Seviye 2 (BSL-2) önlemlerini kullanın.
- 5 mL steril lizojen et suyu (LB) ile etiketli 15 mL konik tüp alın ve suyu bir bakteri suşundan (E. coli) bir koloni ile aşılamak için steril bir döngü kullanın. Bu işlemi tekrarlayın, test edilecek her suş için bir gecelik kültür tüpü oluşturun.
- Gece kültürünü, tüplerin kapakları gevşetilerek, bir inkübatör çalkalayıcıda (250 rpm, 37 ° C) inkübe edin.
4. E. coli inokulumunun, epitel hücrelerinin ve materyallerinin hazırlanması (deney sabahı)
NOT: Bu noktadan itibaren 37 °C'ye kadar ısıtılmış antibiyotikler olmadan TCM kullanın.
- Her gece LB kültüründen 250 μL'yi, 50 mL'lik bir konik tüpte (bireysel suş başına bir tane) antibiyotikler olmadan 25 mL TCM'ye ekleyin. Tüplerin kapaklarını gevşetin. Bu yeni kültür tüplerini çalkalayıcıya tam olarak 2 saat boyunca aynı ayarlarda (250 rpm, 37 °C) yerleştirin. Beklerken kalan alt adımları gerçekleştirin.
- TEER'yi 1.3.2-1.3.6 numaralı adımlarda açıklandığı gibi her kesici uç boyunca ölçün. Bunları zamanında TEER'ler olarak kaydedin (t) = 0 h.
- Kesici uçları yeni bir plakadaki kuyucuklara taşıyın ve adım 1.4.3'te açıklanan tekniği kullanarak ortamı değiştirin. Bununla birlikte, bu kez, yeni toplama kuyularını antibiyotikler olmadan 500 μL TCM ile doldurun ve ekleri antibiyotik olmadan 400 μL TCM ile doldurun. Ekleri enfeksiyon zamanına kadar doku kültürü inkübatörünün içinde tutun.
- Daha sonra kaplama ve bakteri miktarı için oda sıcaklığına (RT) ısınmak için yeterli sayıda kare LB agar plakası ayarlayın.
5. Hücrelerin aşılanması (deneyin başlangıcı)
- Tam olarak 2 saat sonra, sabah bakteri kültürlerini çalkalayıcıdan çıkarın ve 10 dakika (1.900 x g, 4 ° C) boyunca santrifüj yapın.
NOT: Aşağıdaki tüm adımlarda, büyümeyi en aza indirmek için tüm bakteriyel süspansiyonları buz üzerinde tutun. - TCM'deki bakteri peletini antibiyotikler olmadan yeniden askıya alın. Optik yoğunluğu (OD) 0,7-0,9'a ayarlamak için bir spektrofotometre kullanın ve antibiyotikler olmadan TCM ile 1 x 106 koloni oluşturma birimi (CFU) / mL konsantrasyonuna (yaklaşık 1:100 seyreltme) kadar seyreltin. Her bir kesici ucu 100 μL hacim başına 1 x 105 CFU ile enfekte etmek için bu bakteriyel süspansiyonu kullanın.
- Transwell plakasını etiketleyin ve her bir kesici ucu 100 μL OD ayarlı inokulum ile enfekte edin (kesici uç başına toplam 1 x 105 CFU). Tahlil şimdi başladı. Saati not edin ve t = 0 h olarak kaydedin.
- Parça seyreltme yöntemini kullanarak CFU / mL'yi ölçmek için inokulum bakteriyel süspansiyonunu plakalayın, kare LB agar plakaları19 üzerine 10 μL alikotları kaplayın.
6. Transsitozun ölçülmesi
- Aşılamayı takip eden her 30 dakikada bir, yeni kuyuları antibiyotik olmadan 500 μL TCM ile doldurun. Her farklı bakteri suşu için farklı bir steril forseps seti kullanarak ekleri bu yeni kuyucuklara aktarın.
- Her bir uç için kullanılan toplama kuyusundan medyayı ayrı etiketli tüplere toplayın. Bu tüpleri buzun üzerine yerleştirin. Transwell plakalarını zaman noktaları arasında inkübatöre geri gönderin.
- Her kesici uç için, toplanan medyayı t = 0,5 saat, t = 1 saat, t = 1,5 saat ve t = 2 saat ve vorteksten kısaca birleştirin. Deneyin ilk 2 saatinde transsitozlanan bakteri miktarını ölçmek için iz seyreltme yöntemini kullanarak LB agar plakaları üzerinde toplanan medyayı plakalayın.
NOT: Bakterilerin her 30 dakikada bir alınması ve buz üzerinde tutulması, toplama kuyularındaki bakteri büyümesinin en aza indirilmesini ve ağırlıklı olarak transsitozlu bakteriler üzerinde ölçümlerin yapılmasını sağlar. - Etiketli iz seyreltme LB agar plakalarını, ek CO2 olmadan 37 ° C'de bakteriyel inkübatöre yerleştirin ve T84 transwell plakasını doku kültürü inkübatörüne geri verin.
- t = 4 h'de, toplanan medyayı t = 2,5 h, t = 3 h, t = 3,5 h ve t = 4 h'den birleştirerek adım 6.3'ü tekrarlayın.
- t = 6 h'de, toplanan medyayı t= 4.5 h, t = 5 h, t = 5.5 h ve t = 6 h'den birleştirerek adım 6.3'ü tekrarlayın. Ek olarak, t = 6 saatte, ortamı kontrol kuyularından plakalayın.
7. Deneyin sonu
- Deneyin sonunda TEER'yi ölçün ve kaydedin, t = 6 saat. Adım 1.3.2-1.3.6'da açıklanan yordamı kullanın.
- Probu 10-15 dakika boyunca% 70 etanol içine batırarak dekontamine edin. İsterseniz kesici uçları atın veya ek uygulamalar için kaydedin/işleyin. LB agar plakalarının gece boyunca inkübe olmasına izin verin ve kullanılan diğer tüm malzemeleri dezenfekte edin ve / veya güvenli bir şekilde atın.
- Gece boyunca inkübasyondan sonra, inokülum miktarını ve E. coli transsitoz miktarını belirlemek için bakteri kolonilerini iz seyreltme LB plakaları üzerinde manuel olarak sayın. Kontrol plakalarının herhangi bir bakteri büyümesi göstermediğinden emin olun.
Sonuçlar
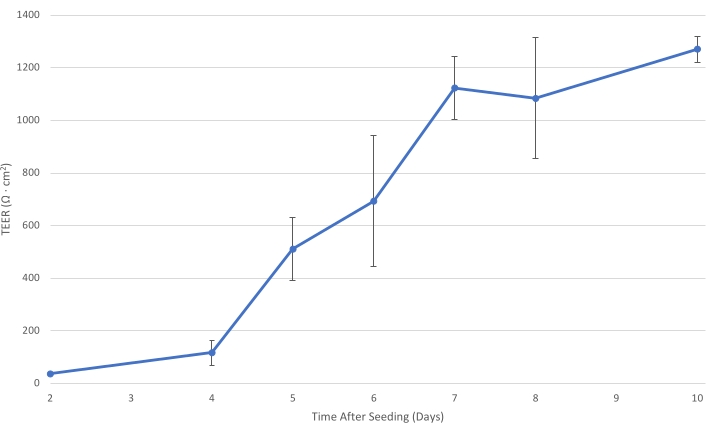
Resim 1: Zaman içinde T84 TEER. T84 hücre katmanı kesici uç üzerinde olgunlaştıkça, tek katmanın elektriksel direnci artar. En az 1.000 Ω · cm2'lik bir TEER'de, hücre tabakası parasellüler bakteri taşınımını azaltmak ve öncelikle hücre ötesi bakteri geçişinin ölçülmesine izin vermek için yeterince gelişmiştir...
Tartışmalar
Bu yöntem gastroenteroloji ve enfeksiyon hastalıklarında kullanılan tekniklerden türetilmiştir20. İntestinal epitel bariyerinin in vitro modelleri, luminal içeriğin doğuştan gelen bağışıklığın bu ilgili bileşeni ile etkileşime girdiği mekanizmaları aydınlatmak için kullanılmıştır 6,8. İnvaziv yenidoğan E. coli'nin konakçı-patojen etkileşimleri de genetik analiz, antimikrobiyal direnç çal...
Açıklamalar
Hiç kimse.
Teşekkürler
Bu çalışma, Missouri-Kansas City Üniversitesi Tıp Fakültesi tarafından AI'ya verilen Sarah Morrison öğrenci hibesi ile desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 10,000 U/ mL Penicillin/Streptomycin Mixture | Fisher Scientific | 15-140-122 | |
| 15 mL sterile conical tubes | MidSci | C15B | |
| 2 mL microcentrifuge tubes | Avant | AVSS2000 | |
| 50 mL sterile polypropylene conical tubes | Falcon | 352070 | |
| Aspirator | Corning | 4930 | |
| Biosafety Cabinets | Labconco | 30441010028343 | Three of these are used in the method: one for sterile tissue work, one for infected tissue work, and one for bacterial work. |
| Centrifuge | Sorvall | Legend RT | |
| Disposable inoculation loops | Fisherbrand | 22363605 | |
| Dulbecco's Modified Eagle Medium (DMEM) | Gibco | 11965-084 | |
| Epithelial Volt/Ohm Meter | World Precision Instruments | EVOM2 | |
| Fetal Bovine Serum | Fisher Scientific | 10437028 | |
| Ham's F-12 Nutrient Mixture | Gibco | 11765-047 | |
| Hemacytometer | Sigma Aldrich, Bright Line | Z359629 | |
| Incubator shaker | New Brunswick | Innova 4080 | |
| Incubators | Thermo Scientific | 51030284 | Three of these are used in the method: one for sterile tissue culturing, one for infected tissue culturing, and one for bacterial incubation. |
| Lysogeny broth | Difco | 244610 | |
| Lysogeny broth agar | IBI Scientific | IB49101 | |
| Nikon Eclipse TS2R Microscope | Nikon | ||
| Spectrophotometer | Unico | 1100RS | |
| T84 Intestinal Cells | American Tissue Culture Collection | CCL248 | |
| Tissue culture inserts, with polyethylene trephthalate membrane, 3 µm pores, 24 well format | Falcon | 353096 | |
| Tissue culture plate, 24 wells | Falcon | 353504 | |
| Trypan blue stain | Fisher Scientific | T10282 |
Referanslar
- Shakir, S. M., Goldbeck, J. M., Robison, D., Eckerd, A. M., Chavez-Bueno, S. Genotypic and phenotypic characterization of invasive neonatal Escherichia coli clinical isolates. American Journal of Perinatology. 31 (11), 975-982 (2014).
- Cole, B. K., et al. Route of infection alters virulence of neonatal septicemia Escherichia coli clinical isolates. PloS One. 12 (12), 0189032 (2017).
- Stoll, B. J., et al. Early-onset neonatal sepsis 2015 to 2017, the rise of Escherichia coli, and the need for novel prevention strategies. Journal of the American Medical Association Pediatrics. 174 (7), 200593 (2020).
- Dalgakiran, F., Witcomb, L. A., McCarthy, A. J., Birchenough, G. M., Taylor, P. W. Non-invasive model of neuropathogenic Escherichia coli infection in the neonatal rat. Journal of Visualized Experiments. (92), e52018 (2014).
- Williams, M., et al. Whole-genome sequencing-based phylogeny, antibiotic resistance, and invasive phenotype of Escherichia coli strains colonizing the cervix of women in preterm labor. BMC Microbiology. 21 (1), 330 (2021).
- Schoultz, I., Keita, &. #. 1. 9. 7. ;. The intestinal barrier and current techniques for the assessment of gut permeability. Cells. 9 (8), 1909 (2020).
- Devriese, S., et al. T84 monolayers are superior to Caco-2 as a model system of colonocytes. Histochemistry and Cell Biology. 148 (1), 85-93 (2017).
- Buckley, A., Turner, J. R. Cell biology of tight junction barrier regulation and mucosal disease. Cold Spring Harbor Perspectives in Biology. 10 (1), 029314 (2018).
- Awad, W. A., Hess, C., Hess, M. Enteric pathogens and their toxin-induced disruption of the intestinal barrier through alteration of tight junctions in chickens. Toxins. 9 (2), 60 (2017).
- Vancamelbeke, M., Vermeire, S. The intestinal barrier: A fundamental role in health and disease. Expert Review of Gastroenterology & Hepatology. 11 (9), 821-834 (2017).
- Aguilar, C., et al. Organoids as host models for infection biology - A review of methods. Experimental and Molecular Medicine. 53 (10), 1471-1482 (2021).
- Nickerson, K. P., et al. A versatile human intestinal organoid-derived epithelial monolayer model for the study of enteric pathogens. Microbiology Spectrum. 9 (1), 0000321 (2021).
- Gavin, H. E., Beubier, N. T., Satchell, K. J. The effector domain region of the Vibrio vulnificus MARTX toxin confers biphasic epithelial barrier disruption and is essential for systemic spread from the intestine. PLoS Pathogens. 13 (1), 1006119 (2017).
- Kobayashi, H., et al. Aeromonas sobria serine protease decreases epithelial barrier function in T84 cells and accelerates bacterial translocation across the T84 monolayer in vitro. PloS One. 14 (8), 0221344 (2019).
- Kalischuk, L. D., Inglis, G. D., Buret, A. G. Campylobacter jejuni induces transcellular translocation of commensal bacteria via lipid rafts. Gut Pathogens. 1 (1), 2 (2009).
- Cole, B. K., Ilikj, M., McCloskey, C. B., Chavez-Bueno, S. Antibiotic resistance and molecular characterization of bacteremia Escherichia coli isolates from newborns in the United States. PloS One. 14 (7), 0219352 (2019).
- Cadena-Herrera, D., et al. Validation of three viable-cell counting methods: Manual, semi-automated, and automated. Biotechnology Reports. 7, 9-16 (2015).
- den Hartog, G., et al. Apurinic/apyrimidinic endonuclease 1 restricts the internalization of bacteria into human intestinal epithelial cells through the inhibition of Rac1. Frontiers in Immunology. 11, 553994 (2020).
- Jett, B. D., Hatter, K. L., Huycke, M. M., Gilmore, M. S. Simplified agar plate method for quantifying viable bacteria. Biotechniques. 23 (4), 648-650 (1997).
- Lievin-Le Moal, V., Servin, A. L. Pathogenesis of human enterovirulent bacteria: Lessons from cultured, fully differentiated human colon cancer cell lines. Microbiology and Molecular Biology Reviews. 77 (3), 380-439 (2013).
- Kaczmarek, A., Budzynska, A., Gospodarek, E. Detection of K1 antigen of Escherichia coli rods isolated from pregnant women and neonates. Folia Microbiologica. 59 (5), 419-422 (2014).
- Kalita, A., Hu, J., Torres, A. G. Recent advances in adherence and invasion of pathogenic Escherichia coli. Current Opinion in Infectious Diseases. 27 (5), 459-464 (2014).
- McCool, D. J., Marcon, M. A., Forstner, J. F., Forstner, G. G. The T84 human colonic adenocarcinoma cell line produces mucin in culture and releases it in response to various secretagogues. Biochemical Journal. 267 (2), 491-500 (1990).
- Resta-Lenert, S., Barrett, K. E. Enteroinvasive bacteria alter barrier and transport properties of human intestinal epithelium: Role of iNOS and COX-2. Gastroenterology. 122 (4), 1070-1087 (2002).
- Elatrech, I., et al. Escherichia coli LF82 differentially regulates ROS production and mucin expression in intestinal epithelial T84 cells: Implication of NOX1. Inflammatory Bowel Diseases. 21 (5), 1018-1026 (2015).
- El-Aouar Filho, R. A., et al. Heterogeneous family of cyclomodulins: Smart weapons that allow bacteria to hijack the eukaryotic cell cycle and promote infections. Frontiers in Cellular and Infection Microbiology. 7, 208 (2017).
- Hopkins, A. M., Walsh, S. V., Verkade, P., Boquet, P., Nusrat, A. Constitutive activation of Rho proteins by CNF-1 influences tight junction structure and epithelial barrier function. Journal of Cell Science. 116, 725-742 (2003).
- Shiou, S. R., et al. Erythropoietin protects intestinal epithelial barrier function and lowers the incidence of experimental neonatal necrotizing enterocolitis. Journal of Biological Chemistry. 286 (14), 12123-12132 (2011).
- Newburg, D. S., Ko, J. S., Leone, S., Nanthakumar, N. N. Human milk oligosaccharides and synthetic galactosyloligosaccharides contain 3’-, 4-, and 6'-galactosyllactose and attenuate inflammation in human T84, NCM-460, and H4 cells and intestinal tissue ex vivo. Journal of Nutrition. 146 (2), 358-367 (2016).
- Burns, J. L., Griffith, A., Barry, J. J., Jonas, M., Chi, E. Y. Transcytosis of gastrointestinal epithelial cells by Escherichia coli K1. Pediatric Research. 49 (1), 30-37 (2001).
- Raut, B., Chen, L. J., Hori, T., Kaji, H. An open-source add-on EVOM((R)) device for real-time transepithelial/endothelial electrical resistance measurements in multiple transwell samples. Micromachines. 12 (3), 282 (2021).
- McCarthy, A. J., Stabler, R. A., Taylor, P. W. Genome-wide identification by transposon insertion sequencing of Escherichia coli K1 genes essential for in vitro growth, gastrointestinal colonizing capacity, and survival in serum. Journal of Bacteriology. 200 (7), 00698 (2018).
- Sayoc-Becerra, A., et al. The JAK-inhibitor tofacitinib rescues human intestinal epithelial cells and colonoids from cytokine-induced barrier dysfunction. Inflammatory Bowel Diseases. 26 (3), 407-422 (2020).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır