A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
المقايسة الحيوية الفتاكة باستخدام الأرتيميا سالينا L.
* These authors contributed equally
In This Article
Summary
يهدف هذا العمل إلى تقييم ومراجعة إجراء الفحص الحيوي للفتك بالأرتيميا ، والذي تم تحديده أيضا على أنه اختبار فتك الجمبري الملحي. توفر هذه الطريقة البسيطة والرخيصة معلومات حول السمية العامة (التي تعتبر تقييما أوليا للسمية) للعينات ، أي المنتجات الطبيعية.
Abstract
تم استخدام المنتجات الطبيعية منذ العصور القديمة لإنتاج الأدوية. في الوقت الحاضر ، هناك الكثير من أدوية العلاج الكيميائي التي يتم الحصول عليها من مصادر طبيعية وتستخدم ضد عدد كبير من الأمراض. لسوء الحظ ، غالبا ما تظهر معظم هذه المركبات سمية جهازية وتأثيرات ضارة. من أجل تقييم أفضل لتحمل عينات مختارة يحتمل أن تكون نشطة بيولوجيا ، يستخدم الجمبري الملحي (Artemia salina) بشكل عام كنموذج في دراسات الفتك. يعتمد اختبار A. salina على قدرة المركبات النشطة بيولوجيا المدروسة على قتل القشريات الدقيقة في مرحلة اليرقات (nauplii). تمثل هذه الطريقة نقطة انطلاق ملائمة لدراسات السمية الخلوية ، وكذلك لفحص السمية العامة للمنتجات الاصطناعية وشبه الاصطناعية والطبيعية. يمكن اعتباره مقايسة بسيطة وسريعة ومنخفضة التكلفة ، مقارنة بالعديد من المقايسات الأخرى (الخلايا المختبرية أو سلالات الخميرة ، الزرد ، القوارض) مناسبة بشكل عام للأغراض المذكورة أعلاه ؛ علاوة على ذلك ، يمكن إجراؤه بسهولة حتى بدون أي تدريب محدد. بشكل عام ، تمثل مقايسة A. salina أداة مفيدة لتقييم السمية الأولية للمركبات المختارة والتجزئة الموجهة بيولوجيا لمستخلصات المنتجات الطبيعية.
Introduction
كانت المنتجات الطبيعية من النباتات أو الحيوانات أو الكائنات الحية الدقيقة مجال اهتمام متزايد على مر السنين في تطوير جزيئات نشطة بيولوجيا جديدة بسبب مجموعتها المتنوعة من الأنشطة البيولوجية والدوائية1. ومع ذلك ، فإن الآثار الجانبية المرتبطة ، أو مقاومة الأدوية ، أو عدم كفاية خصوصية العوامل ، خاصة عند استخدامها كأدوية مضادة للسرطان ، تمثل العوامل الرئيسية التي يمكن أن تؤدي إلى علاج غير فعال 1,2.
على مدى العقود القليلة الماضية ، تم اكتشاف العديد من العوامل السامة للخلايا المشتقة من النباتات ، بعضها يستخدم كعوامل مضادة للسرطان1،2،3. في هذا السياق ، تم الإبلاغ عن باكليتاكسيل كواحد من أشهر أدوية العلاج الكيميائي وأكثرها نشاطا من أصل طبيعي 3,4. حاليا ، تشير التقديرات إلى أن أكثر من 35 ٪ من جميع الأدوية في السوق مشتقة من أو مستوحاة من المنتجات الطبيعية5. تتطلب السمية العالية المحتملة لهذه المركبات النظر فيها خلال جميع مراحل الدراسة ، لأن الأنواع المختلفة من الملوثات أو حتى المكونات الأيضية للنبات نفسه يمكن أن تسبب تأثيرات سامة. لهذا السبب ، ينبغي إجراء الملامح الدوائية والسمية في المرحلة الأولية ، لتقييم النشاط البيولوجي وسلامة العلاجات النباتية المحتملة الجديدة. لتقييم سمية العينات النشطة بيولوجيا الجديدة ، يمكن اعتبار الحيوانات اللافقارية أفضل النماذج للدراسة. إنهم يطالبون بحد أدنى من المتطلبات الأخلاقية ويسمحون بإجراء فحوصات أولية في المختبر ، لإعطاء الأولوية للمنتجات الواعدة للجولة التالية من الاختبار في الفقاريات 1,6.
يعرف A. salina باسم الجمبري الملحي ، وهو عبارة عن لافقاريات صغيرة محبة للملح تنتمي إلى جنس Artemia (عائلة Artemiidae ، رتبة Anostraca ، subphylum Crustacea. الشكل 1). وفي النظم الإيكولوجية البحرية والمائية المالحة، يلعب الجمبري المالح دورا غذائيا هاما لأنه يتغذى على الطحالب الدقيقة وهو أحد مكونات العوالق الحيوانية المستخدمة لتغذية الأسماك. علاوة على ذلك ، تستخدم يرقاتها (المعروفة باسم nauplii) على نطاق واسع في تقييم السمية العامة خلال الدراسات الأولية1،3،7.
الأرتيميا spp. تستخدم على نطاق واسع في دراسات الفتك وهي أيضا نقطة انطلاق ملائمة لتقييم السمية ، من خلال تتبع سمية المركبات النشطة بيولوجيا المحتملة بناء على قدرتها على قتل nauplii المزروعة في المختبر 1,8. لهذا السبب ، اكتسب استخدام A. salina جاذبية في دراسات السمية العامة ، لأنها طريقة فعالة للغاية وسهلة الاستخدام ، مقارنة بالاختبارات الأخرى على النماذج الحيوانية9.
نظرا لتشريحها البسيط وحجمها الصغير ودورة حياتها القصيرة ، يمكن دراسة عدد كبير من اللافقاريات في تجربة واحدة. على هذا النحو ، فإنها تجمع بين قابلية الملاءمة الوراثية والتوافق منخفض التكلفة مع الفحوصات واسعة النطاق1. في هذا السياق ، يظهر استخدام الجمبري الملحي في مقايسة السمية العامة العديد من المزايا ، مثل النمو السريع (هناك حاجة إلى 28-72 ساعة من الفقس إلى النتائج الأولى) ، والفعالية من حيث التكلفة ، والعمر الافتراضي الطويل للبيض التجاري ، والتي يمكن استخدامها على مدار السنة 3,10. من ناحية أخرى ، نظرا لأن اللافقاريات لديها نظام عضوي بدائي وتفتقر إلى نظام المناعة التكيفي ، فإنها لا تمثل نموذجا مثاليا وموثوقا للخلايا البشرية1.
ومع ذلك ، فإنه يوفر طريقة تقييم أولية للسمية العامة للعينات المختارة. نظرا لأنه يستخدم على نطاق واسع كاختبار مميت ، فإنه يمكن أن يوفر مؤشرات مؤقتة حول التأثيرات السامة للعوامل المضادة للسرطان المحتملة. وغالبا ما يستخدم أيضا للحصول على تغذية مرتدة حول السمية العامة للمركبات التي تتمتع بأي أنشطة بيولوجية أخرى من الضروري إظهار أدنى معدل نفوق ممكن بين جمبري الأرتيميا .
في دراسة مستمرة من مجموعتنا ، أظهرت مقتطفات مختلفة من أنواع Plectranthus أنشطة مضادة للأكسدة ومضادة للميكروبات (نتائج غير منشورة). في موازاة ذلك ، تم الحصول على المركبات المعزولة عن طريق تنقية المستخلصات ثم تم تعديلها كيميائيا. ثم تم اختبار المستخلصات والمركبات النقية والمشتقات شبه الاصطناعية من حيث السمية العامة. في هذا السياق ، يهدف هذا العمل إلى إعطاء لمحة عامة عن استخدام المقايسة الحيوية الفتاكة الأرتيميا لتقييم السمية العامة والنشاط السام للخلايا المحتمل للمستخلصات النشطة بيولوجيا والمركبات المعزولة من نباتات مختلفة من جنس Plectranthus11.

الشكل 1: الأرتيميا المالحة تحت المجهر. nauplii حديث الفقس من A. salina كما يظهر تحت المجهر (التكبير 12x). الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
Access restricted. Please log in or start a trial to view this content.
Protocol
1. إعداد المعدات
- الحصول على معدات الفقس المتاحة تجاريا. حدد مكانا مناسبا لإعداد معدات الفقس (الشكل 2 أ). ضع الحاوية على شكل قمع في الدعامة السوداء (المضمنة في المجموعة) وأدر القمع في اتجاه مناسب لرؤية علامة المستوى والصنبور.
- لصنع معدات ترحيل يدوية الصنع ، قم بقص الجزء العلوي من زجاجتين بلاستيكيتين سعة 0.5 لتر (قطرها 5.8 سم) للحصول على ارتفاع نهائي يبلغ 12 سم. قم بإنشاء ثقب بقطر 1.5 سم على جانب واحد عند 7 سم من الأسفل في كل زجاجة وأدخل أنبوبا مطاطيا 13 سم (1.3 سم خارجي وقطر داخلي 0.9 سم) بين الفتحتين. أغلق الفتحات بالغراء الساخن (الشكل 2 ب) واتركها لتجف لمدة 15 دقيقة ؛ ضع الزجاجات على سطح مستو واملأها بالماء للتحقق من عدم وجود تسرب.
2. تحضير محلول الملح الاصطناعي
- في دورق زجاجي ، حضري محلول ملح صناعي (ملح جمبري ملحي) بتركيز 35 جم / لتر. للقيام بذلك ، أضف 28 جم من الملح إلى 800 مل من ماء الصنبور ، وفقا لتعليمات الشركة الصانعة. امزجه بقضيب التحريك حتى يذوب الملح تماما.
ملاحظة: اضبط حجم المحلول الملحي المحضر وفقا لحجم الحاويات المتاحة.
3. إعداد العينة
- تحضير جميع العينات في أنبوب الطرد المركزي الدقيق عن طريق إذابة كمية مناسبة من المستخلصات (مقتطفات Plectranthus ، Pa- P. ambigerus; Pb- P. بارباتوس ؛ Pc- P. cylindraceus ؛ و Pe- P. ecklonii) أو المركبات 1-5 (مركبان طبيعيان [1 و 2] تم الحصول عليهما من Plectranthus spp. وثلاثة مشتقات شبه اصطناعية [3 ، 4 ، 5] ؛ الشكل 3) في ثنائي ميثيل سلفوكسيد (DMSO)12 ، وذلك للحصول على تركيز نهائي قدره 10 ملغ / مل (إذا كانت العينة قابلة للذوبان في الماء ، فإن استخدام DMSO ليس ضروريا).
- قم بتخفيف 10 ميكرولتر من كل عينة (و DMSO للتحكم السلبي) في أنبوب طرد مركزي دقيق جديد باستخدام 990 ميكرولتر من محلول ملحي اصطناعي محضر في الخطوة 2.1 ، للحصول على تركيز نهائي قدره 0.1 مجم / مل.
- تحت غطاء الدخان ، في دورق Erlenmeyer ، قم بإعداد محلول ثاني كرومات البوتاسيوم (K 2 Cr2O7) في الماء المقطر بتركيز 1 مجم / مل13،14،15.
4. المقايسة الحيوية الفتك الجمبري محلول ملحي
ملاحظة: تم تطوير هذا الفحص من أعمال العديد من المؤلفين مع التعديلات1،16،17،18،19.
- املأ وعاء الفقس بالوسط المحضر في الخطوة 2.1 حتى علامة المستوى (500 مل) (الشكل 2C).
- ضع ملعقة واحدة (حوالي 0.75 جم) من أكياس الروبيان الملحي في محلول الملح ، ثم أغلق الحاوية. ضع مصباحا (مصباح طاولة ، 40 واط ، 230 فولت ، 50 هرتز ، مع مصباح إضاءة LED بقوة 8 واط ، 4000 كلفن ، 830 لومن) يشير مباشرة نحو الجهاز (الشكل 2 أ) وقم بتشغيله.
- قم بتوصيل نظام مورد الهواء (خرج 3 واط ، 50 هرتز ، 230 فولت) بالموصل الموجود أعلى الجهاز وقم بتشغيل المضخة.
- حافظ على درجة حرارة الغرفة عند 25 ± 3 درجات مئوية. تفقس أكياس الجمبري الملحي في محلول الملح الاصطناعي ، تحت تهوية قوية ، وإضاءة مستمرة ، ودرجة حرارة ثابتة ، بعد 24 ساعة إلى 48 ساعة.
ملاحظة: بدلا من ذلك ، يمكن استخدام حاضنة عمودية. - بمجرد أن يفقس البيض ، قم بإيقاف تشغيل مضخة الهواء وانتظر حتى يتم فصل nauplii (التحرك نحو أسفل القمع) عن علب البيض الفارغة (تطفو في الأعلى).
- من أجل فصل البيض غير المفقس عن nauplii الحي ، افتح صنبور المخرج في الأسفل وقم بتفريغ محتوى القمع في إحدى حاويات حاوية معدات الهجرة المصنوعة يدويا (الموضحة في الخطوة 1.2). تأكد من أن المحلول الذي يحتوي على nauplii والبيض المتبقي غير المفقس أقل من مستوى الأنبوب. في الحاوية الثانية ، أضف محلول الملح المتبقي من الخطوة 2.1 فوق ارتفاع الأنبوب.
- قم بتغطية الحاوية ب nauplii والبيض المتبقي غير المفقس باستخدام رقائق الألومنيوم. ضع المصباح على الحاوية الثانية بمحلول الملح فقط. سوف ينجذب الجمبري الملحي بالضوء ويهاجر من حاوية إلى أخرى (حاوية الحصاد) ، مما يؤدي إلى فصل فعال بين البيض (المترسب ببطء إلى القاع) والأرتيميا الحية.
- بعد ذلك ، ضع الجهاز في الحاضنة في نفس الظروف المستخدمة في الخطوة 4.4 لمدة 4 ساعات (الشكل 2E). من حاوية الحصاد ، اجمع 900 ميكرولتر من المحلول الملحي الذي يحتوي على 10 إلى 15 nauplii. ضع المحلول الملحي مع nauplii في كل بئر من لوحة 24 بئر (الشكل 2F) ؛ يتم اختبار جميع العينات في أربعة أضعاف.
- أضف 100 ميكرولتر لكل من التحكم السلبي (DMSO) ، والتحكم الإيجابي (K 2Cr2O7 ، ثاني كرومات البوتاسيوم) ، ومحلول الملح الاصطناعي ، وكل عينة إلى البئر المعنية (الشكل 2F) 13,14.
ملاحظة: ستكون العينات في كل بئر بتركيز 0.01 مجم / مل. سيكون التركيز النهائي للتحكم الإيجابي في محلول الملح 0.1 مجم / مل ، للتأكد من أن جميع nauplii في البئر تتعرض للتأثير السام لثاني كرومات البوتاسيوم وتموت. سيكون محلول الملح الاصطناعي فارغا. - احتضان اللوحة عند 25 ± 3 درجات مئوية تحت الإضاءة لمدة 24 ساعة (الشكل 2G). بعد 24 ساعة ، قم بتسجيل عدد اليرقات الميتة (nauplii غير المتحركة لمدة 5 ثوان) في كل بئر تحت مجهر مجهر (12x)20 (الشكل 2H). بدلا من ذلك ، استخدم عدسة اليد.
- أضف 100 ميكرولتر من محلول ثاني كرومات البوتاسيوم ، للحث على موت اليرقات الحية المتبقية ، وانتظر لمدة 6 ساعات. عد إجمالي اليرقات الميتة في كل بئر تحت المجهر. أوجد معدل الوفيات وفقا للمعادلة الآتية.
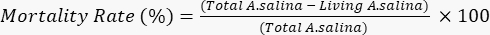
- أداء كل الفحص في ثلاث نسخ. احسب الانحرافات المعيارية (SD) ، وعبر عن النتائج كمتوسط لثلاث تجارب مستقلة ، لكل منها أربعة أضعاف داخلية (ن = 12) ، ± SD. كما ذكر ماير وآخرون ، اعتبر المستخلصات الخام والمركبات النقية التي تحتوي على LC50< 1000 ميكروغرام / مل سامة. أيضا ، يجب مراعاة أن معدل نفوق الجمبري الملحي يتناسب مع تركيز العينات المختبرة21.

الشكل 2: طريقة الفحص الحيوي للفتك بالأرتيميا سالينا. (أ) المعدات المتاحة تجاريا المستخدمة في تفريخ تكيسات الجمبري الملحي؛ (ب) معدات الهجرة المصنوعة يدويا؛ (ج) وعاء الفقس المملوء بمحلول ملحي؛ (د) جمع البيض غير المفقس و nauplii؛ (ه) معدات يدوية الصنع في الحاضنة أثناء خطوة الترحيل. يجب تغطية الحاوية البعيدة عن المصباح بورق الألمنيوم ؛ ومع ذلك ، للحصول على عرض أفضل للتثبيت المحدد هنا تمت إزالته ؛ (و) حصاد الأرتيميا في الآبار قبل إجراء الفحص. يجب وضع المركبات كما هو موضح: - يشير إلى التحكم السلبي (DMSO) ، + إلى التحكم الإيجابي (K 2 Cr2O7) ، الملح إلى محلول الملح الاصطناعي ، و 1 إلى 3 إلى العينات المراد اختبارها (في هذه الحالة المركبات 1-3) ؛ (ز) حضانة الصفيحة المكونة من 24 بئرا والتي تحتوي على الأرتيميا والعينات المختارة؛ (ح) عد الأرتيميا تحت المجهر ثنائي العين. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.

الشكل 3: تراكيب مركبات مختارة. هيكل المركبات 1-2 ، المستخرجة من أنواع Plectranthus ، والمركبات 3-5 ، التي تم الحصول عليها عن طريق شبه التوليف. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
Access restricted. Please log in or start a trial to view this content.
النتائج
تم تقييم السمية العامة لبعض المنتجات الطبيعية التي درستها مجموعتنا مؤخرا من خلال الفحص الحيوي لفتك الجمبري الملحي. أربعة مقتطفات (Pa- P. ambigerus; Pb- P. بارباتوس ؛ Pc- P. أسطواني. و Pe- P. ecklonii) من جنس Plectranthus ، المعروف بنشاطه المضاد للأكسدة (نتائج غير منشورة). بالإضافة إلى ذلك ، ت?...
Access restricted. Please log in or start a trial to view this content.
Discussion
خلال السنوات الأخيرة ، زاد المجتمع العلمي من اهتمامه بالنماذج البديلة لفحوصات السمية21. بجانب الفحص الحيوي لفتك A. salina ، عادة ما يتم إجراء منهجيات أخرى لتقييم تحمل العينات وتشمل المقايسات الحيوية للفقاريات (مثل القوارض) ، واللافقاريات (مثل الزرد) ، والطرق المختبرية ب?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
يعلن المؤلفون عدم وجود تضارب في المصالح ، مالي أو غير ذلك.
Acknowledgements
في ذكرى البروفيسور أميلكار روبرتو.
تم دعم هذا العمل ماليا من قبل Fundação para a Ciência e a Tecnologia (FCT ، البرتغال) في إطار المشروعين UIDB / 04567/2020 و UIDP / 04567/2020 المنسوبين إلى CBIOS ومنحة الدكتوراه SFRH / BD / 137671/2018 (Vera Isca).
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 24-well plates | Thermo Fisher Scientific, Denmark | 174899 | Thermo Scientific Nunc Up Cell 24 multidish |
| Aluminium foil | Albal | - | Can be purchased in supermarket |
| Artemio Set | JBL GmbH and Co. KG, D-67141, Neuhofen Germany | 61066000 | Can be purchased in pet shops |
| Binocular microscope | Ceti, Belgium | 1700.0000 | Flexum-24AED, 220-240 V, 50 Hz |
| Bottles | - | - | 0.5 L Diameter: 5.8 cm; Height: 12 cm |
| Brine shrimp cysts | JBL GmbH and Co. KG, D-67141, Neuhofen Germany | 3090700 | Can be purchased in pet shops |
| Brine shrimp salt | JBL GmbH and Co. KG, D-67141, Neuhofen Germany | 3090600 | Can be purchased in pet shops |
| Dimethyl sulfoxide (DMSO) | VWR chemicals | CAS: 67-68-5 | 99% purity |
| Discartable tips | Diamond | F171500 | Volume range: 100 - 1000 µL |
| Eppendorf microtubes | BRAND | 7,80,546 | Microtubes, PP, 2 mL, BIO-CERT PCR QUALITY |
| Erlenmeyer flask | VWR chemicals | 4,47,109 | volume: 100 mL |
| Glass beaker | Normax | 3.2111654N | Volume: 1000 mL |
| Gloves | Guantes Luna | GLSP3 | - |
| GraphPad Prism | GraphPad Software, San Diego, CA, USA | - | GraphPad Prism version 5.00 for Windows, www.graphpad.com, accessed on 5 February 2021; commercial statistical analysis software |
| Home-made A. salina Grower | - | - | Home made: two plastic bottles connected by a hose |
| Hot glue | Parkside | PHP500E3 | 230 V, 50 Hz, 25 W |
| Incubator | Heidolph Instruments, Denmark | - | One Heidolph Unimax 1010 equipment and one Heidolph Inkubator 1006 |
| Light | Roblan | SKYC3008FE14 | LED light bulb |
| Micropipettes | VWR chemicals | 613-5265 | Volume range: 100 - 1000 µL |
| Potassium dichromate (K2Cr2O7) | VWR chemicals | CAS: 7778-50-9 | 99% purity |
| Pump ProAir a50 | JBL GmbH and Co. KG, D-67141, Neuhofen Germany | - | Included in the Artemio Set+1 kit |
| Rubber tube | - | - | 1.3 cm outer and 0.9 cm inner diameter |
| Stirring rod | VWR chemicals | 441-0147 |  6 mm, 250 mm 6 mm, 250 mm |
| Termometer | VWR chemicals | 620-0821 | 0 - 100 °C |
References
- Ntungwe, N. E., et al. Artemia species: An important tool to screen general toxicity samples. Current Pharmaceutical Design. 26 (24), 2892-2908 (2020).
- Cragg, G. M., Newman, D. J. Natural products: A continuing source of novel drug leads. Biochimica et Biophysica Acta (BBA) - General Subjects. 1830 (6), 3670-3695 (2013).
- Ntungwe, E., et al. General toxicity screening of Royleanone derivatives using an artemia salina model. Journal Biomedical and Biopharmaceutical Research. 18 (1), 114(2021).
- Seca, A., Plant Pinto, D. secondary metabolites as anticancer agents: Successes in clinical trials and therapeutic application. International Journal of Molecular Sciences. 19 (1), 263(2018).
- Calixto, J. B. The role of natural products in modern drug discovery. Anais da Academia Brasileira de Ciências. 91 (3), 1-7 (2019).
- Mandrell, D., et al. Automated zebrafish chorion removal and single embryo placement: optimizing throughput of zebrafish developmental toxicity screens. Journal of Laboratory Automation. 17 (1), 66-74 (2012).
- Zhang, Y., Mu, J., Han, J., Gu, X. An improved brine shrimp larvae lethality microwell test method. Toxicology Mechanisms and Methods. 22 (1), 23-30 (2012).
- Domínguez-Villegas, V., et al. antioxidant and cytotoxicity activities of methanolic extract and prenylated flavanones isolated from leaves of eysehardtia platycarpa. Natural Product Communications. 8 (2), 177-180 (2013).
- Hamidi, M. R., Jovanova, B., Panovska, T. K. Toxicological evaluation of the plant products using Brine Shrimp (Artemia salina L.) model. Macedonian Pharmaceutical Bulletin. 60 (01), 9-18 (2014).
- Libralato, G., Prato, E., Migliore, L., Cicero, A. M., Manfra, L. A review of toxicity testing protocols and endpoints with Artemia spp. Ecological Indicators. 69, 35-49 (2016).
- Mendes Hacke, A. C., et al. Cytotoxicity of cymbopogon citratus (DC) Stapf fractions, essential oil, citral, and geraniol in human leukocytes and erythrocytes. Journal of Ethnopharmacology. 291, 115147(2022).
- Thangapandi, V., Pushpanathan, T. Comparison of the Artemia salina and Artemia fransiscana bioassays for toxicity of Indian medicinal plants. Journal of Coastal Life Medicine. 2 (6), 453-457 (2014).
- Syahmi, A. R. M., et al. Acute oral toxicity and brine shrimp lethality of Elaeis guineensis Jacq., (Oil Palm Leaf) methanol extract. Molecules. 15 (11), 8111-8121 (2010).
- Sasidharan, S., et al. Acute toxicity impacts of Euphorbia hirta L extract on behavior, organs body weight index and histopathology of organs of the mice and Artemia salina. Pharmacognosy Research. 4 (3), 170(2012).
- Libralato, G. The case of Artemia spp. in nanoecotoxicology. Marine Environmental Research. 101, 38-43 (2014).
- Okumu, M. O., et al. Artemia salina as an animal model for the preliminary evaluation of snake venom-induced toxicity. Toxicon: X. 12, 100082(2021).
- Rajabi, S., Ramazani, A., Hamidi, M., Naji, T. Artemia salina as a model organism in toxicity assessment of nanoparticles. DARU Journal of Pharmaceutical Sciences. 23 (1), 20(2015).
- Svensson, B. -M., Mathiasson, L., Mårtensson, L., Bergström, S. Artemia salina as test organism for assessment of acute toxicity of leachate water from landfills. Environmental Monitoring and Assessment. 102 (1), 309-321 (2005).
- Banti, C., Hadjikakou, S. Evaluation of toxicity with brine shrimp assay. Bio-Protocol. 11 (2), 3895(2021).
- Pecoraro, R., et al. Artemia salina: A microcrustacean to assess engineered nanoparticles toxicity. Microscopy Research and Technique. 84 (3), 531-536 (2021).
- Lillicrap, A., et al. Alternative approaches to vertebrate ecotoxicity tests in the 21st century: A review of developments over the last 2 decades and current status. Environmental Toxicology and Chemistry. 35 (11), 2637-2646 (2016).
- Ribeiro, I. C., et al. Yeasts as a model for assessing the toxicity of the fungicides Penconazol, Cymoxanil and Dichlofulanid. Chemosphere. (10), 1637-1642 (2000).
- Armour, C. D., Lum, P. Y. From drug to protein: using yeast genetics for high-throughput target discovery. Current Opinion in Chemical Biology. 9 (1), 20-24 (2005).
- Modarresi Chahardehi, A., Arsad, H., Lim, V. Zebrafish as a successful animal model for screening toxicity of medicinal plants. Plants. 9 (10), 1345(2020).
- Fischer, I., Milton, C., Wallace, H. Toxicity testing is evolving. Toxicology Research. 9 (2), 67-80 (2020).
- de Araújo, G. L., et al. Alternative methods in toxicity testing: the current approach. Brazilian Journal of Pharmaceutical Sciences. 50 (1), 55-62 (2014).
- Toussaint, M., et al. A high-throughput method to measure the sensitivity of yeast cells to genotoxic agents in liquid cultures. Mutation Research/Genetic Toxicology and Environmental Mutagenesis. 606 (1), 92-105 (2006).
- Horzmann, K. A., Freeman, J. L. Making waves: New developments in toxicology with the zebrafish. Toxicological Sciences. 163 (1), 5-12 (2018).
- Avdesh, A., et al. Regular care and maintenance of a zebrafish (Danio rerio) laboratory: An introduction. Journal of Visualized Experiments. (69), e4196(2012).
- Cunliffe, V. T. Zebrafish: A Practical Approach. Nüsslein-Volhard, C., Dahm, R. , Oxford University Press. (2002).
- Sitarek, P., et al. Insight the biological activities of selected Abietane Diterpenes isolated from Plectranthus spp. Biomolecules. 10 (2), 194(2020).
- Matias, D., et al. Cytotoxic activity of Royleanone Diterpenes from Plectranthus madagascariensis Benth. ACS Omega. 4 (5), 8094-8103 (2019).
- Garcia, C., et al. Royleanone derivatives from Plectranthus spp. as a novel class of P-glycoprotein inhibitors. Frontiers in Pharmacology. 11, (2020).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved