Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Bioensayo de letalidad utilizando Artemia salina L.
* Estos autores han contribuido por igual
En este artículo
Resumen
Este trabajo tiene como objetivo evaluar y revisar el procedimiento de bioensayo de letalidad de Artemia salina , también identificado como ensayo de letalidad de camarones en salmuera. Este método simple y barato proporciona información sobre la toxicidad general (considerada como una evaluación preliminar de la toxicidad) de las muestras, es decir, los productos naturales.
Resumen
Los productos naturales se han utilizado desde la antigüedad para producir medicamentos. Hoy en día, hay un montón de fármacos quimioterapéuticos obtenidos de fuentes naturales y utilizados contra una gran cantidad de enfermedades. Desafortunadamente, la mayoría de estos compuestos a menudo muestran toxicidad sistémica y efectos adversos. Con el fin de evaluar mejor la tolerabilidad de muestras potencialmente bioactivas seleccionadas, el camarón de salmuera (Artemia salina) se utiliza generalmente como modelo en estudios de letalidad. La prueba de A. salina se basa en la capacidad de los compuestos bioactivos estudiados para matar a los microcrustáceos en su etapa larvaria (nauplios). Este método representa un punto de partida conveniente para los estudios de citotoxicidad, así como para el cribado de toxicidad general de productos sintéticos, semisintéticos y naturales. Puede considerarse un ensayo simple, rápido y de bajo costo, en comparación con muchos otros ensayos (células in vitro o cepas de levadura, pez cebra, roedores) generalmente adecuados para los fines antes mencionados; Además, se puede realizar fácilmente incluso sin ningún entrenamiento específico. En general, el ensayo de A. salina representa una herramienta útil para la evaluación preliminar de la toxicidad de compuestos seleccionados y el fraccionamiento bioguiado de extractos de productos naturales.
Introducción
Los productos naturales de plantas, animales o microorganismos han sido un área de creciente interés a lo largo de los años en el desarrollo de nuevas moléculas bioactivas debido a su variada gama de actividades biológicas y farmacológicas1. Sin embargo, los efectos secundarios asociados, la resistencia a los medicamentos o la especificidad inadecuada de los agentes, especialmente cuando se usan como medicamentos contra el cáncer, representan los principales factores que pueden conducir a un tratamiento ineficaz 1,2.
En las últimas décadas, se han descubierto varios agentes citotóxicos derivados de plantas, algunos de ellos utilizados como agentes anticancerígenos 1,2,3. En este contexto, el paclitaxel es reportado como uno de los fármacos quimioterapéuticosde origen natural más conocidos y activos 3,4. Actualmente, se estima que más del 35% de todos los medicamentos en el mercado se derivan o están inspirados en productos naturales5. La alta toxicidad potencial de estos compuestos requiere consideración durante todas las fases de estudio, ya que diferentes tipos de contaminantes o incluso componentes metabólicos de la propia planta pueden causar efectos tóxicos. Por esta razón, los perfiles farmacológicos y toxicológicos deben realizarse en la fase preliminar, para evaluar la actividad biológica y la seguridad de nuevos tratamientos potenciales a base de plantas. Para evaluar la toxicidad de nuevas muestras bioactivas, los animales invertebrados pueden considerarse como los mejores modelos para estudiar. Exigen requisitos éticos mínimos y permiten ensayos preliminares in vitro, para priorizar los productos más prometedores para la próxima ronda de ensayos en vertebrados 1,6.
Comúnmente conocido como camarón de salmuera, A. salina es un pequeño invertebrado halófilo perteneciente al género Artemia (familia Artemiidae, orden Anostraca, subfilo Crustacea; Figura 1). En los ecosistemas salinos marinos y acuáticos, los camarones de salmuera desempeñan un papel nutricional importante, ya que se alimentan de microalgas y son constituyentes del zooplancton utilizado para alimentar a los peces. Además, sus larvas (conocidas como nauplios) son ampliamente utilizadas en la evaluación de la toxicidad general durante los estudios preliminares 1,3,7.
Artemia spp. son ampliamente utilizadas en estudios de letalidad y también son un punto de partida conveniente para las evaluaciones de toxicidad, al rastrear la toxicidad de compuestos potencialmente bioactivos en función de su capacidad para matar nauplios cultivados en el laboratorio 1,8. Por esta razón, el uso de A. salina ganó atracción en los estudios de toxicidad general, ya que es un método muy eficiente y fácil de usar, en comparación con otras pruebas en modelos animales9.
Debido a su anatomía simple, tamaño pequeño y ciclo de vida corto, se puede estudiar una gran cantidad de invertebrados en un solo experimento. Como tales, combinan la racionalidad genética y la compatibilidad de bajo costo con exámenes a gran escala1. En este contexto, el uso de camarones de salmuera en un ensayo de toxicidad general muestra varias ventajas, como el rápido crecimiento (se necesitan 28-72 h desde la eclosión hasta los primeros resultados), la rentabilidad y la larga vida útil de los huevos comerciales, que se pueden usar durante todo el año 3,10. Por otro lado, dado que los invertebrados tienen un sistema de órganos primitivo y carecen de un sistema inmune adaptativo, no representan un modelo perfecto y confiable para las células humanas1.
Sin embargo, proporciona un método de evaluación preliminar para la toxicidad general de las muestras seleccionadas. Dado que es ampliamente utilizado como un ensayo de letalidad, puede proporcionar indicaciones provisionales sobre los efectos tóxicos de los posibles agentes anticancerígenos. A menudo también se utiliza para obtener información sobre la toxicidad general de los compuestos dotados de cualquier otra actividad biológica para la cual es esencial mostrar la tasa de mortalidad más baja posible entre los camarones Artemia .
En un estudio en curso de nuestro grupo, diferentes extractos de especies de Plectranthus mostraron actividades antioxidantes y antimicrobianas (resultados no publicados). Paralelamente, se obtuvieron compuestos aislados mediante purificación de los extractos y luego se modificaron químicamente. Los extractos, compuestos puros y derivados semisintéticos se probaron en términos de toxicidad general. En este contexto, el presente trabajo tiene como objetivo dar una visión general del uso del bioensayo de letalidad de Artemia para la evaluación de la toxicidad general y la actividad citotóxica potencial de extractos bioactivos y compuestos aislados de diferentes plantas del género Plectranthus11.

Figura 1: Artemia salina bajo el microscopio. Nauplios recién nacidos de A. salina vistos bajo el microscopio (aumento 12x). Haga clic aquí para ver una versión más grande de esta figura.
Access restricted. Please log in or start a trial to view this content.
Protocolo
1. Preparación del equipo
- Adquirir equipos de incubación disponibles comercialmente. Seleccione un lugar adecuado para instalar el equipo de eclosión (Figura 2A). Coloque el recipiente en forma de embudo en el soporte negro (incluido en el conjunto) y gire el embudo en una dirección adecuada para ver la marca de nivel y el grifo.
- Para hacer equipos de migración hechos a mano, corte la parte superior de dos botellas de plástico de 0,5 L (5,8 cm de diámetro) para obtener una altura final de 12 cm. Cree un orificio de 1,5 cm de diámetro en un lado a 7 cm de la parte inferior de cada botella e inserte un tubo de goma de 13 cm (1,3 cm exterior y 0,9 cm de diámetro interior) entre las dos aberturas. Sellar las aberturas con pegamento caliente (Figura 2B) y dejar secar durante 15 min; Coloque las botellas sobre una superficie plana y llénelas con agua para verificar que no haya fugas.
2. Preparación de solución salina artificial
- En un vaso de precipitados de vidrio, prepare una solución de sal artificial (sal de camarones en salmuera) a una concentración de 35 g / L. Para hacer esto, agregue 28 g de sal a 800 ml de agua del grifo, de acuerdo con las instrucciones del fabricante. Mezclar con una varilla de agitación hasta que toda la sal se disuelva completamente.
NOTA: Ajuste el volumen de la solución salina preparada de acuerdo con el tamaño de los recipientes disponibles.
3. Preparación de la muestra
- Preparar todas las muestras en un tubo de microcentrífuga disolviendo una cantidad adecuada de extractos (extractos de Plectranthus , Pa- P. ambigerus; Pb- P. barbatus; Pc- P. cylindraceus ; y Pe- P. ecklonii) o compuestos 1-5 (dos compuestos naturales [1 y 2] obtenidos de Plectranthus spp. y tres derivados semisintéticos [3, 4, 5]; Figura 3) en dimetilsulfóxido (DMSO)12, para obtener una concentración final de 10 mg/ml (si la muestra es soluble en agua, no es necesario el uso de DMSO).
- Diluir 10 μL de cada muestra (y DMSO para el control negativo) en un nuevo tubo de microcentrífuga utilizando 990 μL de solución salina artificial preparada en la etapa 2.1, para obtener una concentración final de 0,1 mg/ml.
- Bajo una campana extractora, en un erlenmeyer, preparar una solución de dicromato potásico (K 2 Cr2O7)en agua destilada a una concentración de 1 mg/ml13,14,15.
4. Bioensayo de letalidad de camarones de salmuera
NOTA: Este ensayo se desarrolla a partir de los trabajos de varios autores con modificaciones 1,16,17,18,19.
- Llene el recipiente de incubación con el medio preparado en el paso 2.1 hasta la marca de nivel (500 ml) (figura 2C).
- Coloque una cucharada (aproximadamente 0,75 g) de quistes de camarones de salmuera en la solución salina y luego cierre el recipiente. Coloque una lámpara (lámpara de mesa, 40 W, 230 V, 50 Hz, con una bombilla LED de 8 W, 4.000 K, 830 lm) que apunte directamente hacia el equipo (Figura 2A) y enciéndalo.
- Conecte el sistema de suministro de aire (salida de 3 W, 50 Hz, 230 V) al conector colocado en la parte superior del equipo y encienda la bomba.
- Mantener la temperatura ambiente a 25 ± 3 °C. Los quistes de camarones de salmuera eclosionan en la solución salina artificial, bajo aireación vigorosa, iluminación continua y temperatura estable, después de 24 h a 48 h.
NOTA: Alternativamente, se puede utilizar una incubadora vertical. - Una vez que los huevos hayan eclosionado, apague la bomba de aire y espere hasta que los nauplios (que se mueven hacia la parte inferior del embudo) se separen de las cajas de huevos vacías (flotando en la parte superior).
- Para separar los huevos no eclosionados de los nauplios vivos, abra el grifo de salida en la parte inferior y descargue el contenido del embudo en uno de los contenedores del contenedor del equipo de migración hecho a mano (descrito en el paso 1.2). Asegúrese de que la solución que contiene los nauplios y los huevos residuales no eclosionados esté por debajo del nivel del tubo. En el segundo recipiente, añadir la solución salina residual del paso 2.1 por encima de la altura del tubo.
- Cubra el recipiente con los nauplios y los huevos residuales no eclosionados con papel de aluminio. Coloque la lámpara en el segundo recipiente con solo la solución salina. Los camarones de salmuera serán atraídos por la luz y migrarán de un contenedor a otro (contenedor de cosecha), lo que lleva a una separación eficiente entre los huevos (sedimentados lentamente hasta el fondo) y Artemia viva.
- A continuación, coloque el equipo en la incubadora en las mismas condiciones utilizadas en el paso 4.4 durante 4 h (Figura 2E). Del recipiente de recolección, recoger 900 μL de solución salina que contiene de 10 a 15 nauplios. Coloque la solución salina con nauplios en cada pocillo de una placa de 24 pocillos (Figura 2F); Todas las muestras se analizan en cuadruplicados.
- Añadir 100 μL cada uno del control negativo (DMSO), el control positivo (K 2Cr2O7, dicromato de potasio), la solución salina artificial y cada una de las muestras al pocillo respectivo (Figura 2F)13,14.
NOTA: Las muestras en cada pocillo estarán a una concentración de 0.01 mg/mL. La concentración final del control positivo en solución salina será de 0,1 mg/ml, para asegurarse de que todos los nauplios del pozo estén expuestos al efecto tóxico del dicromato de potasio y mueran. La solución salina artificial actuará como en blanco. - Incubar la placa a 25 ± 3 °C bajo iluminación durante 24 h (Figura 2G). Después de 24 h, registrar el número de larvas muertas (nauplios no móviles durante 5 s) en cada pocillo bajo un microscopio binocular (12x)20 (Figura 2H). Alternativamente, use una lente de mano.
- Agregue 100 μL de solución de dicromato de potasio, para inducir la muerte de las larvas vivas restantes, y espere 6 h. Cuente el total de larvas muertas en cada pocillo bajo un microscopio. Determine la tasa de mortalidad de acuerdo con la siguiente ecuación.
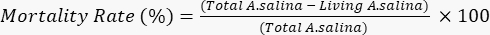
- Realizar todo el ensayo por triplicado. Calcule las desviaciones estándar (DE) y exprese los resultados como la media de tres experimentos independientes, cada uno con cuadruplicados internos (n = 12), ± DE. Como lo mencionaron Meyer et al., considere tóxicos los extractos crudos y compuestos puros con LC50< 1,000 μg / ml; Además, tenga en cuenta que la tasa de mortalidad del camarón en salmuera es proporcional a la concentración de las muestras analizadas21.

Figura 2: Método de bioensayo de letalidad de Artemia salina. (A) Equipo disponible comercialmente empleado para la incubación de quistes de camarón de salmuera; B) Equipo de migración hecho a mano; (C) Recipiente para incubar lleno de solución salina; D) Recolección de huevos y nauplios no eclosionados; (E) Equipo hecho a mano en la incubadora durante la etapa de migración. El recipiente lejos de la lámpara debe cubrirse con papel de aluminio; Sin embargo, para una mejor vista de la instalación del conjunto aquí se eliminó; (F) Recolección de Artemia en pozos antes de realizar el ensayo. Los compuestos deben colocarse como se muestra: - se refiere al control negativo (DMSO), + al control positivo (K 2 Cr2O7), sal a la solución salina artificial, y 1 a 3 a las muestras a probar (en este caso compuestos 1-3); G) Incubación de la placa de 24 pocillos que contiene Artemia y las muestras seleccionadas; (H) Recuento de artemia bajo el microscopio binocular. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Estructuras de compuestos seleccionados. Estructura de los compuestos 1-2, extraídos de especies de Plectranthus , y compuestos 3-5, obtenidos por semisíntesis. Haga clic aquí para ver una versión más grande de esta figura.
Access restricted. Please log in or start a trial to view this content.
Resultados
La toxicidad general de algunos productos naturales recientemente estudiados por nuestro grupo se evaluó a través del bioensayo de letalidad de camarones en salmuera. Cuatro extractos (Pa- P. ambigerus; Pb- P. barbatus; Pc- P. cylindraceus; y Pe- P. ecklonii) del género Plectranthus , conocidos por su actividad antioxidante (resultados no publicados), fueron probados. Adicionalmente, dos compuestos naturales (1 y 2) obtenidos de Plectranthus spp., y tres derivados ...
Access restricted. Please log in or start a trial to view this content.
Discusión
Durante los últimos años, la comunidad científica ha aumentado su atención hacia modelos alternativos para el cribado de toxicidad21. Además del bioensayo de letalidad de A. salina, generalmente se realizan otras metodologías para la evaluación de la tolerabilidad de la muestra e incluyen bioensayos de vertebrados (como roedores), invertebrados (como el pez cebra), métodos in vitro utilizando cepas o células de levadura, y métodos in silico 22...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
Los autores declaran no tener conflictos de intereses, financieros o de otro tipo.
Agradecimientos
En memoria del profesor Amílcar Roberto.
Este trabajo fue apoyado financieramente por la Fundação para a Ciência e a Tecnologia (FCT, Portugal) bajo los proyectos UIDB/04567/2020 y UIDP/04567/2020 atribuidos a CBIOS y beca de doctorado SFRH/BD/137671/2018 (Vera Isca).
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| 24-well plates | Thermo Fisher Scientific, Denmark | 174899 | Thermo Scientific Nunc Up Cell 24 multidish |
| Aluminium foil | Albal | - | Can be purchased in supermarket |
| Artemio Set | JBL GmbH and Co. KG, D-67141, Neuhofen Germany | 61066000 | Can be purchased in pet shops |
| Binocular microscope | Ceti, Belgium | 1700.0000 | Flexum-24AED, 220-240 V, 50 Hz |
| Bottles | - | - | 0.5 L Diameter: 5.8 cm; Height: 12 cm |
| Brine shrimp cysts | JBL GmbH and Co. KG, D-67141, Neuhofen Germany | 3090700 | Can be purchased in pet shops |
| Brine shrimp salt | JBL GmbH and Co. KG, D-67141, Neuhofen Germany | 3090600 | Can be purchased in pet shops |
| Dimethyl sulfoxide (DMSO) | VWR chemicals | CAS: 67-68-5 | 99% purity |
| Discartable tips | Diamond | F171500 | Volume range: 100 - 1000 µL |
| Eppendorf microtubes | BRAND | 7,80,546 | Microtubes, PP, 2 mL, BIO-CERT PCR QUALITY |
| Erlenmeyer flask | VWR chemicals | 4,47,109 | volume: 100 mL |
| Glass beaker | Normax | 3.2111654N | Volume: 1000 mL |
| Gloves | Guantes Luna | GLSP3 | - |
| GraphPad Prism | GraphPad Software, San Diego, CA, USA | - | GraphPad Prism version 5.00 for Windows, www.graphpad.com, accessed on 5 February 2021; commercial statistical analysis software |
| Home-made A. salina Grower | - | - | Home made: two plastic bottles connected by a hose |
| Hot glue | Parkside | PHP500E3 | 230 V, 50 Hz, 25 W |
| Incubator | Heidolph Instruments, Denmark | - | One Heidolph Unimax 1010 equipment and one Heidolph Inkubator 1006 |
| Light | Roblan | SKYC3008FE14 | LED light bulb |
| Micropipettes | VWR chemicals | 613-5265 | Volume range: 100 - 1000 µL |
| Potassium dichromate (K2Cr2O7) | VWR chemicals | CAS: 7778-50-9 | 99% purity |
| Pump ProAir a50 | JBL GmbH and Co. KG, D-67141, Neuhofen Germany | - | Included in the Artemio Set+1 kit |
| Rubber tube | - | - | 1.3 cm outer and 0.9 cm inner diameter |
| Stirring rod | VWR chemicals | 441-0147 |  6 mm, 250 mm 6 mm, 250 mm |
| Termometer | VWR chemicals | 620-0821 | 0 - 100 °C |
Referencias
- Ntungwe, N. E., et al. Artemia species: An important tool to screen general toxicity samples. Current Pharmaceutical Design. 26 (24), 2892-2908 (2020).
- Cragg, G. M., Newman, D. J. Natural products: A continuing source of novel drug leads. Biochimica et Biophysica Acta (BBA) - General Subjects. 1830 (6), 3670-3695 (2013).
- Ntungwe, E., et al. General toxicity screening of Royleanone derivatives using an artemia salina model. Journal Biomedical and Biopharmaceutical Research. 18 (1), 114(2021).
- Seca, A., Plant Pinto, D. secondary metabolites as anticancer agents: Successes in clinical trials and therapeutic application. International Journal of Molecular Sciences. 19 (1), 263(2018).
- Calixto, J. B. The role of natural products in modern drug discovery. Anais da Academia Brasileira de Ciências. 91 (3), 1-7 (2019).
- Mandrell, D., et al. Automated zebrafish chorion removal and single embryo placement: optimizing throughput of zebrafish developmental toxicity screens. Journal of Laboratory Automation. 17 (1), 66-74 (2012).
- Zhang, Y., Mu, J., Han, J., Gu, X. An improved brine shrimp larvae lethality microwell test method. Toxicology Mechanisms and Methods. 22 (1), 23-30 (2012).
- Domínguez-Villegas, V., et al. antioxidant and cytotoxicity activities of methanolic extract and prenylated flavanones isolated from leaves of eysehardtia platycarpa. Natural Product Communications. 8 (2), 177-180 (2013).
- Hamidi, M. R., Jovanova, B., Panovska, T. K. Toxicological evaluation of the plant products using Brine Shrimp (Artemia salina L.) model. Macedonian Pharmaceutical Bulletin. 60 (01), 9-18 (2014).
- Libralato, G., Prato, E., Migliore, L., Cicero, A. M., Manfra, L. A review of toxicity testing protocols and endpoints with Artemia spp. Ecological Indicators. 69, 35-49 (2016).
- Mendes Hacke, A. C., et al. Cytotoxicity of cymbopogon citratus (DC) Stapf fractions, essential oil, citral, and geraniol in human leukocytes and erythrocytes. Journal of Ethnopharmacology. 291, 115147(2022).
- Thangapandi, V., Pushpanathan, T. Comparison of the Artemia salina and Artemia fransiscana bioassays for toxicity of Indian medicinal plants. Journal of Coastal Life Medicine. 2 (6), 453-457 (2014).
- Syahmi, A. R. M., et al. Acute oral toxicity and brine shrimp lethality of Elaeis guineensis Jacq., (Oil Palm Leaf) methanol extract. Molecules. 15 (11), 8111-8121 (2010).
- Sasidharan, S., et al. Acute toxicity impacts of Euphorbia hirta L extract on behavior, organs body weight index and histopathology of organs of the mice and Artemia salina. Pharmacognosy Research. 4 (3), 170(2012).
- Libralato, G. The case of Artemia spp. in nanoecotoxicology. Marine Environmental Research. 101, 38-43 (2014).
- Okumu, M. O., et al. Artemia salina as an animal model for the preliminary evaluation of snake venom-induced toxicity. Toxicon: X. 12, 100082(2021).
- Rajabi, S., Ramazani, A., Hamidi, M., Naji, T. Artemia salina as a model organism in toxicity assessment of nanoparticles. DARU Journal of Pharmaceutical Sciences. 23 (1), 20(2015).
- Svensson, B. -M., Mathiasson, L., Mårtensson, L., Bergström, S. Artemia salina as test organism for assessment of acute toxicity of leachate water from landfills. Environmental Monitoring and Assessment. 102 (1), 309-321 (2005).
- Banti, C., Hadjikakou, S. Evaluation of toxicity with brine shrimp assay. Bio-Protocol. 11 (2), 3895(2021).
- Pecoraro, R., et al. Artemia salina: A microcrustacean to assess engineered nanoparticles toxicity. Microscopy Research and Technique. 84 (3), 531-536 (2021).
- Lillicrap, A., et al. Alternative approaches to vertebrate ecotoxicity tests in the 21st century: A review of developments over the last 2 decades and current status. Environmental Toxicology and Chemistry. 35 (11), 2637-2646 (2016).
- Ribeiro, I. C., et al. Yeasts as a model for assessing the toxicity of the fungicides Penconazol, Cymoxanil and Dichlofulanid. Chemosphere. (10), 1637-1642 (2000).
- Armour, C. D., Lum, P. Y. From drug to protein: using yeast genetics for high-throughput target discovery. Current Opinion in Chemical Biology. 9 (1), 20-24 (2005).
- Modarresi Chahardehi, A., Arsad, H., Lim, V. Zebrafish as a successful animal model for screening toxicity of medicinal plants. Plants. 9 (10), 1345(2020).
- Fischer, I., Milton, C., Wallace, H. Toxicity testing is evolving. Toxicology Research. 9 (2), 67-80 (2020).
- de Araújo, G. L., et al. Alternative methods in toxicity testing: the current approach. Brazilian Journal of Pharmaceutical Sciences. 50 (1), 55-62 (2014).
- Toussaint, M., et al. A high-throughput method to measure the sensitivity of yeast cells to genotoxic agents in liquid cultures. Mutation Research/Genetic Toxicology and Environmental Mutagenesis. 606 (1), 92-105 (2006).
- Horzmann, K. A., Freeman, J. L. Making waves: New developments in toxicology with the zebrafish. Toxicological Sciences. 163 (1), 5-12 (2018).
- Avdesh, A., et al. Regular care and maintenance of a zebrafish (Danio rerio) laboratory: An introduction. Journal of Visualized Experiments. (69), e4196(2012).
- Cunliffe, V. T. Zebrafish: A Practical Approach. Nüsslein-Volhard, C., Dahm, R. , Oxford University Press. (2002).
- Sitarek, P., et al. Insight the biological activities of selected Abietane Diterpenes isolated from Plectranthus spp. Biomolecules. 10 (2), 194(2020).
- Matias, D., et al. Cytotoxic activity of Royleanone Diterpenes from Plectranthus madagascariensis Benth. ACS Omega. 4 (5), 8094-8103 (2019).
- Garcia, C., et al. Royleanone derivatives from Plectranthus spp. as a novel class of P-glycoprotein inhibitors. Frontiers in Pharmacology. 11, (2020).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados