É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Bioensaio de Letalidade Utilizando Artemia salina L.
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Este trabalho tem como objetivo avaliar e revisar o procedimento de bioensaio de letalidade de Artemia salina , também identificado como ensaio de letalidade de camarão em salmoura. Este método simples e barato fornece informações sobre a toxicidade geral (considerada como uma avaliação preliminar de toxicidade) das amostras, ou seja, produtos naturais.
Resumo
Os produtos naturais têm sido usados desde os tempos antigos para produzir medicamentos. Hoje em dia, existem muitas drogas quimioterápicas obtidas de fontes naturais e usadas contra uma infinidade de doenças. Infelizmente, a maioria desses compostos geralmente exibe toxicidade sistêmica e efeitos adversos. A fim de melhor avaliar a tolerabilidade de amostras potencialmente bioativas selecionadas, o camarão de salmoura (Artemia salina) é geralmente utilizado como modelo em estudos de letalidade. O teste de A. salina baseia-se na capacidade dos compostos bioativos estudados de matar os microcrustáceos em seu estágio larval (náuplios). Este método representa um ponto de partida conveniente para estudos de citotoxicidade, bem como para a triagem de toxicidade geral de produtos sintéticos, semissintéticos e naturais. Pode ser considerado um ensaio simples, rápido e de baixo custo, em comparação com muitos outros ensaios (células in vitro ou cepas de levedura , peixe-zebra, roedores) geralmente adequados para os fins acima mencionados; além disso, pode ser facilmente realizado mesmo sem qualquer treinamento específico. No geral, o ensaio de A. salina representa uma ferramenta útil para a avaliação preliminar da toxicidade de compostos selecionados e o fracionamento bioguiado de extratos de produtos naturais.
Introdução
Os produtos naturais de plantas, animais ou microrganismos têm sido uma área de interesse crescente ao longo dos anos no desenvolvimento de novas moléculas bioativas devido à sua variada gama de atividades biológicas e farmacológicas1. No entanto, os efeitos colaterais associados, a resistência aos medicamentos ou a especificidade inadequada dos agentes, especialmente quando utilizados como drogas anticancerígenas, representam os principais fatores que podem levar a um tratamento ineficaz 1,2.
Nas últimas décadas, vários agentes citotóxicos derivados de plantas têm sido descobertos, alguns deles utilizados como agentes anticancerígenos 1,2,3. Nesse contexto, o paclitaxel é relatado como um dos quimioterápicos de origem natural mais conhecidos e ativos 3,4. Atualmente, estima-se que mais de 35% de todos os medicamentos no mercado são derivados ou são inspirados em produtos naturais5. A potencial alta toxicidade desses compostos requer consideração durante todas as fases do estudo, uma vez que diferentes tipos de contaminantes ou mesmo componentes metabólicos da própria planta podem causar efeitos tóxicos. Por esta razão, os perfis farmacológicos e toxicológicos devem ser realizados na fase preliminar, a fim de avaliar a atividade biológica e a segurança de novos potenciais tratamentos à base de plantas. Para avaliar a toxicidade de novas amostras bioativas, os animais invertebrados podem ser considerados como os melhores modelos a serem estudados. Exigem requisitos éticos mínimos e permitem ensaios preliminares in vitro, para priorizar os produtos mais promissores para a próxima rodada de testes em vertebrados 1,6.
A. salina é um pequeno invertebrado halofílico pertencente ao gênero Artemia (família Artemiidae, ordem Anostraca, subfilo Crustacea; Figura 1). Nos ecossistemas salinos marinhos e aquáticos, os camarões de salmoura desempenham um importante papel nutricional, pois se alimentam de microalgas e são constituintes do zooplâncton usado para alimentar peixes. Além disso, suas larvas (conhecidas como náuplios) são amplamente utilizadas na avaliação da toxicidade geral durante estudos preliminares 1,3,7.
Artemia spp. são amplamente utilizados em estudos de letalidade e também são um ponto de partida conveniente para avaliações de toxicidade, rastreando a toxicidade de compostos potencialmente bioativos com base em sua capacidade de matar náuplios cultivados em laboratório 1,8. Por esse motivo, o uso de A. salina ganhou atração em estudos gerais de toxicidade, por ser um método muito eficiente e de fácil utilização, em comparação com outros ensaios em modelos animais9.
Devido à sua anatomia simples, tamanho minúsculo e ciclo de vida curto, um grande número de invertebrados pode ser estudado em um único experimento. Como tal, combinam amenidade genética e compatibilidade de baixo custo com rastreios em larga escala1. Nesse contexto, o uso do camarão de salmoura em um ensaio geral de toxicidade apresenta diversas vantagens, como crescimento rápido (28-72 h é necessário desde a eclosão até os primeiros resultados), custo-efetividade e longa vida útil dos ovos comerciais, que podem ser utilizados durante todo o ano 3,10. Por outro lado, uma vez que os invertebrados possuem um sistema orgânico primitivo e carecem de um sistema imunológico adaptativo, eles não representam um modelo perfeito e confiável para as células humanas1.
No entanto, fornece um método de avaliação preliminar para a toxicidade geral de amostras selecionadas. Uma vez que é amplamente utilizado como um ensaio de letalidade, pode fornecer indicações provisórias sobre os efeitos tóxicos de potenciais agentes anticancerígenos. Muitas vezes também é usado para obter feedback sobre a toxicidade geral de compostos dotados de quaisquer outras atividades biológicas para as quais é essencial mostrar a menor taxa de mortalidade possível entre os camarões Artemia .
Em um estudo em andamento de nosso grupo, diferentes extratos de espécies de Plectranthus mostraram atividades antioxidantes e antimicrobianas (resultados não publicados). Paralelamente, compostos isolados foram obtidos por purificação dos extratos e então modificados quimicamente. Os extratos, compostos puros e derivados semissintéticos foram então testados em termos de toxicidade geral. Nesse contexto, o presente trabalho tem como objetivo dar uma visão geral do uso do bioensaio de letalidade Artemia para a avaliação da toxicidade geral e potencial atividade citotóxica de extratos bioativos e compostos isolados de diferentes plantas do gênero Plectranthus11.

Figura 1: Artemia salina ao microscópio. Náuplios recém-eclodidos de A. salina como visto ao microscópio (ampliação 12x). Por favor, clique aqui para ver uma versão maior desta figura.
Access restricted. Please log in or start a trial to view this content.
Protocolo
1. Preparação do equipamento
- Adquirir equipamentos de incubação comercialmente disponíveis. Selecione um local adequado para configurar o equipamento de eclosão (Figura 2A). Coloque o recipiente em forma de funil no suporte preto (incluído no conjunto) e gire o funil em uma direção adequada para ver a marca de nível e a torneira.
- Para fazer equipamentos de migração feitos à mão, corte a parte superior de duas garrafas plásticas de 0,5 L (5,8 cm de diâmetro) para obter uma altura final de 12 cm. Crie um orifício de 1,5 cm de diâmetro de um lado a 7 cm do fundo em cada garrafa e insira um tubo de borracha de 13 cm (1,3 cm de diâmetro externo e 0,9 cm de diâmetro interno) entre as duas aberturas. Selar as aberturas com cola quente (Figura 2B) e deixar secar por 15 min; Coloque as garrafas em uma superfície plana e encha-as com água para verificar se não há vazamento.
2. Preparação de solução salina artificial
- Num copo de vidro, preparar uma solução salina artificial (sal de camarão em salmoura) a uma concentração de 35 g/L. Para fazer isso, adicione 28 g de sal a 800mL de água da torneira, de acordo com as instruções do fabricante. Misture com uma haste de agitação até que todo o sal esteja completamente dissolvido.
NOTA: Ajustar o volume da solução salina preparada de acordo com o tamanho dos recipientes disponíveis.
3. Preparação da amostra
- Preparar todas as amostras em um tubo de microcentrífuga, dissolvendo uma quantidade adequada de extratos (extratos de Plectranthus , Pa- P. ambigerus; Pb- P. barbatus; Pc- P. cylindraceus ; e Pe- P. ecklonii) ou compostos 1-5 (dois compostos naturais [1 e 2] obtidos de Plectranthus spp. e três derivados semissintéticos [3, 4, 5]; Figura 3) em dimetilsulfóxido (DMSO)12, de modo a obter uma concentração final de 10 mg/mL (se a amostra for solúvel em água, não é necessário o uso de DMSO).
- Diluir 10 μL de cada amostra (e DMSO para o controlo negativo) num novo tubo de microcentrífuga utilizando 990 μL de solução salina artificial preparada no passo 2.1, para obter uma concentração final de 0,1 mg/ml.
- Sob um exaustor, num balão de Erlenmeyer, preparar uma solução de dicromato de potássio (K2 Cr2O7) em água destilada na concentração de 1 mg/ml13,14,15.
4. Bioensaio de letalidade de camarão em salmoura
NOTA: Este ensaio é desenvolvido a partir de trabalhos de diversos autores com modificações 1,16,17,18,19.
- Encher o recipiente de eclosão com o meio preparado na etapa 2.1 até a marca de nível (500 mL) (Figura 2C).
- Coloque uma colher (aproximadamente 0,75 g) de cistos de camarão de salmoura na solução salina e, em seguida, feche o recipiente. Coloque uma lâmpada (luminária de mesa, 40 W, 230 V, 50 Hz, com uma lâmpada LED de 8 W, 4.000 K, 830 lm) apontando diretamente para o equipamento (Figura 2A) e ligue-a.
- Conecte o sistema do fornecedor de ar (saída de 3 W, 50 Hz, 230 V) ao conector colocado na parte superior do equipamento e ligue a bomba.
- Manter a temperatura ambiente a 25 ± 3 °C. Os cistos de camarão de salmoura eclodem na solução salina artificial, sob aeração vigorosa, iluminação contínua e temperatura estável, após 24 h a 48 h.
NOTA: Alternativamente, uma incubadora vertical pode ser usada. - Uma vez que os ovos tenham eclodido, desligue a bomba de ar e espere até que os náuplios (movendo-se em direção ao fundo do funil) sejam separados das caixas de ovos vazias (flutuando no topo).
- Para separar os ovos não eclodidos dos náuplios vivos, abra a torneira de saída no fundo e descarregue o conteúdo do funil num dos recipientes do recipiente do equipamento de migração feito à mão (descrito na etapa 1.2). Certifique-se de que a solução que contém os náuplios e os ovos residuais não eclodidos está abaixo do nível do tubo. No segundo recipiente, adicionar a solução salina residual da etapa 2.1 acima da altura do tubo.
- Cubra o recipiente com os náuplios e os ovos residuais não eclodidos usando papel alumínio. Coloque a lâmpada no segundo recipiente apenas com a solução salina. O camarão de salmoura será atraído pela luz e migrará de um recipiente para o outro (recipiente de colheita), levando a uma separação eficiente entre ovos (sedimentados lentamente até o fundo) e Artemia viva.
- Em seguida, coloque o equipamento na incubadora nas mesmas condições utilizadas na etapa 4.4 por 4 h (Figura 2E). Do recipiente de colheita, coletar 900 μL de solução salina contendo 10 a 15 náuplios. Colocar a solução salina com náuplios em cada poço de uma placa de 24 poços (Figura 2F); todas as amostras são testadas em quadruplicados.
- Adicionar 100 μL cada um do controle negativo (DMSO), o controle positivo (K 2Cr2O7, dicromato de potássio), a solução salina artificial e cada uma das amostras ao respectivo poço (Figura 2F)13,14.
NOTA: As amostras em cada poço estarão na concentração de 0,01 mg/mL. A concentração final do controle positivo em solução salina será de 0,1 mg/mL, para garantir que todos os náuplios do poço sejam expostos ao efeito tóxico do dicromato de potássio e morram. A solução salina artificial atuará como em branco. - Incubar a placa a 25 ± 3 °C sob iluminação durante 24 h (figura 2G). Após 24 h, registrar o número de larvas mortas (náuplios não móveis por 5 s) em cada poço sob microscópio binocular (12x)20 (Figura 2H). Alternativamente, use uma lente de mão.
- Adicionar 100 μL de solução de dicromato de potássio, para induzir a morte das larvas vivas restantes, e aguardar 6 h. Conte o total de larvas mortas em cada poço sob um microscópio. Determine a taxa de mortalidade de acordo com a equação a seguir.
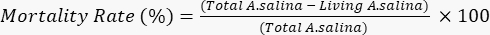
- Realize todo o ensaio em triplicado. Calcular desvios-padrão (DP) e expressar os resultados como a média de três experimentos independentes, cada um com quadruplicados internos (n = 12), ± DP. Como mencionado por Meyer et al., consideram extratos brutos e compostos puros com CL50< 1.000 μg/mL como tóxicos; além disso, levar em conta que a taxa de mortalidade do camarão de salmoura é proporcional à concentração das amostras testadas21.

Figura 2: Método de bioensaio de letalidade de Artemia salina. (A) Equipamento comercialmente disponível empregado para a eclosão de cistos de camarão de salmoura; (B) Equipamento de migração artesanal; (C) Recipiente para incubação cheio de solução salina; (D) Coleta de ovos não eclodidos e náuplios; (E) Equipamento artesanal na incubadora durante a etapa de migração. O recipiente longe da lâmpada deve ser coberto com papel alumínio; no entanto, para uma melhor visualização da instalação do conjunto aqui foi removido; (F) Colheita de artêmia em poços antes da realização do ensaio. Os compostos devem ser colocados como mostrado: - refere-se ao controle negativo (DMSO), + ao controle positivo (K2 Cr2O7), sal à solução salina artificial e 1 a 3 às amostras a serem testadas (neste caso, compostos 1-3); (G) Incubação da placa de 24 poços contendo Artemia e das amostras selecionadas; (H) Contagem de artemia ao microscópio binocular. Por favor, clique aqui para ver uma versão maior desta figura.

Figura 3: Estruturas de compostos selecionados. Estrutura dos compostos 1-2, extraídos de espécies de Plectranthus , e compostos 3-5, obtidos por semi-síntese. Por favor, clique aqui para ver uma versão maior desta figura.
Access restricted. Please log in or start a trial to view this content.
Resultados
A toxicidade geral de alguns produtos naturais recentemente estudados pelo nosso grupo foi avaliada através do bioensaio de letalidade de camarão em salmoura. Quatro extratos (Pa- P. ambigerus; Pb- P. barbatus; Pc- P. cylindraceus; e Pe- P. ecklonii) do gênero Plectranthus , conhecido por sua atividade antioxidante (resultados não publicados), foram testados. Além disso, dois compostos naturais (1 e 2) obtidos de Plectranthus spp., e três derivados semissintéti...
Access restricted. Please log in or start a trial to view this content.
Discussão
Nos últimos anos, a comunidade científica tem aumentado sua atenção para modelos alternativos para exames de toxicidade21. Além do bioensaio de letalidade de A. salina, outras metodologias são geralmente realizadas para a avaliação da tolerabilidade da amostra e incluem bioensaios de vertebrados (como roedores), invertebrados (como o peixe-zebra), métodos in vitro usando cepas ou células de levedura e métodos in silico 22,23,24,25<...
Access restricted. Please log in or start a trial to view this content.
Divulgações
Os autores declaram não haver conflitos de interesse, financeiros ou não.
Agradecimentos
Em memória do professor Amílcar Roberto.
Este trabalho foi apoiado financeiramente pela Fundação para a Ciência e a Tecnologia (FCT, Portugal) no âmbito dos projetos UIDB/04567/2020 e UIDP/04567/2020 atribuídos ao CBIOS e à bolsa de doutoramento SFRH/BD/137671/2018 (Vera Isca).
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| 24-well plates | Thermo Fisher Scientific, Denmark | 174899 | Thermo Scientific Nunc Up Cell 24 multidish |
| Aluminium foil | Albal | - | Can be purchased in supermarket |
| Artemio Set | JBL GmbH and Co. KG, D-67141, Neuhofen Germany | 61066000 | Can be purchased in pet shops |
| Binocular microscope | Ceti, Belgium | 1700.0000 | Flexum-24AED, 220-240 V, 50 Hz |
| Bottles | - | - | 0.5 L Diameter: 5.8 cm; Height: 12 cm |
| Brine shrimp cysts | JBL GmbH and Co. KG, D-67141, Neuhofen Germany | 3090700 | Can be purchased in pet shops |
| Brine shrimp salt | JBL GmbH and Co. KG, D-67141, Neuhofen Germany | 3090600 | Can be purchased in pet shops |
| Dimethyl sulfoxide (DMSO) | VWR chemicals | CAS: 67-68-5 | 99% purity |
| Discartable tips | Diamond | F171500 | Volume range: 100 - 1000 µL |
| Eppendorf microtubes | BRAND | 7,80,546 | Microtubes, PP, 2 mL, BIO-CERT PCR QUALITY |
| Erlenmeyer flask | VWR chemicals | 4,47,109 | volume: 100 mL |
| Glass beaker | Normax | 3.2111654N | Volume: 1000 mL |
| Gloves | Guantes Luna | GLSP3 | - |
| GraphPad Prism | GraphPad Software, San Diego, CA, USA | - | GraphPad Prism version 5.00 for Windows, www.graphpad.com, accessed on 5 February 2021; commercial statistical analysis software |
| Home-made A. salina Grower | - | - | Home made: two plastic bottles connected by a hose |
| Hot glue | Parkside | PHP500E3 | 230 V, 50 Hz, 25 W |
| Incubator | Heidolph Instruments, Denmark | - | One Heidolph Unimax 1010 equipment and one Heidolph Inkubator 1006 |
| Light | Roblan | SKYC3008FE14 | LED light bulb |
| Micropipettes | VWR chemicals | 613-5265 | Volume range: 100 - 1000 µL |
| Potassium dichromate (K2Cr2O7) | VWR chemicals | CAS: 7778-50-9 | 99% purity |
| Pump ProAir a50 | JBL GmbH and Co. KG, D-67141, Neuhofen Germany | - | Included in the Artemio Set+1 kit |
| Rubber tube | - | - | 1.3 cm outer and 0.9 cm inner diameter |
| Stirring rod | VWR chemicals | 441-0147 |  6 mm, 250 mm 6 mm, 250 mm |
| Termometer | VWR chemicals | 620-0821 | 0 - 100 °C |
Referências
- Ntungwe, N. E., et al. Artemia species: An important tool to screen general toxicity samples. Current Pharmaceutical Design. 26 (24), 2892-2908 (2020).
- Cragg, G. M., Newman, D. J. Natural products: A continuing source of novel drug leads. Biochimica et Biophysica Acta (BBA) - General Subjects. 1830 (6), 3670-3695 (2013).
- Ntungwe, E., et al. General toxicity screening of Royleanone derivatives using an artemia salina model. Journal Biomedical and Biopharmaceutical Research. 18 (1), 114(2021).
- Seca, A., Plant Pinto, D. secondary metabolites as anticancer agents: Successes in clinical trials and therapeutic application. International Journal of Molecular Sciences. 19 (1), 263(2018).
- Calixto, J. B. The role of natural products in modern drug discovery. Anais da Academia Brasileira de Ciências. 91 (3), 1-7 (2019).
- Mandrell, D., et al. Automated zebrafish chorion removal and single embryo placement: optimizing throughput of zebrafish developmental toxicity screens. Journal of Laboratory Automation. 17 (1), 66-74 (2012).
- Zhang, Y., Mu, J., Han, J., Gu, X. An improved brine shrimp larvae lethality microwell test method. Toxicology Mechanisms and Methods. 22 (1), 23-30 (2012).
- Domínguez-Villegas, V., et al. antioxidant and cytotoxicity activities of methanolic extract and prenylated flavanones isolated from leaves of eysehardtia platycarpa. Natural Product Communications. 8 (2), 177-180 (2013).
- Hamidi, M. R., Jovanova, B., Panovska, T. K. Toxicological evaluation of the plant products using Brine Shrimp (Artemia salina L.) model. Macedonian Pharmaceutical Bulletin. 60 (01), 9-18 (2014).
- Libralato, G., Prato, E., Migliore, L., Cicero, A. M., Manfra, L. A review of toxicity testing protocols and endpoints with Artemia spp. Ecological Indicators. 69, 35-49 (2016).
- Mendes Hacke, A. C., et al. Cytotoxicity of cymbopogon citratus (DC) Stapf fractions, essential oil, citral, and geraniol in human leukocytes and erythrocytes. Journal of Ethnopharmacology. 291, 115147(2022).
- Thangapandi, V., Pushpanathan, T. Comparison of the Artemia salina and Artemia fransiscana bioassays for toxicity of Indian medicinal plants. Journal of Coastal Life Medicine. 2 (6), 453-457 (2014).
- Syahmi, A. R. M., et al. Acute oral toxicity and brine shrimp lethality of Elaeis guineensis Jacq., (Oil Palm Leaf) methanol extract. Molecules. 15 (11), 8111-8121 (2010).
- Sasidharan, S., et al. Acute toxicity impacts of Euphorbia hirta L extract on behavior, organs body weight index and histopathology of organs of the mice and Artemia salina. Pharmacognosy Research. 4 (3), 170(2012).
- Libralato, G. The case of Artemia spp. in nanoecotoxicology. Marine Environmental Research. 101, 38-43 (2014).
- Okumu, M. O., et al. Artemia salina as an animal model for the preliminary evaluation of snake venom-induced toxicity. Toxicon: X. 12, 100082(2021).
- Rajabi, S., Ramazani, A., Hamidi, M., Naji, T. Artemia salina as a model organism in toxicity assessment of nanoparticles. DARU Journal of Pharmaceutical Sciences. 23 (1), 20(2015).
- Svensson, B. -M., Mathiasson, L., Mårtensson, L., Bergström, S. Artemia salina as test organism for assessment of acute toxicity of leachate water from landfills. Environmental Monitoring and Assessment. 102 (1), 309-321 (2005).
- Banti, C., Hadjikakou, S. Evaluation of toxicity with brine shrimp assay. Bio-Protocol. 11 (2), 3895(2021).
- Pecoraro, R., et al. Artemia salina: A microcrustacean to assess engineered nanoparticles toxicity. Microscopy Research and Technique. 84 (3), 531-536 (2021).
- Lillicrap, A., et al. Alternative approaches to vertebrate ecotoxicity tests in the 21st century: A review of developments over the last 2 decades and current status. Environmental Toxicology and Chemistry. 35 (11), 2637-2646 (2016).
- Ribeiro, I. C., et al. Yeasts as a model for assessing the toxicity of the fungicides Penconazol, Cymoxanil and Dichlofulanid. Chemosphere. (10), 1637-1642 (2000).
- Armour, C. D., Lum, P. Y. From drug to protein: using yeast genetics for high-throughput target discovery. Current Opinion in Chemical Biology. 9 (1), 20-24 (2005).
- Modarresi Chahardehi, A., Arsad, H., Lim, V. Zebrafish as a successful animal model for screening toxicity of medicinal plants. Plants. 9 (10), 1345(2020).
- Fischer, I., Milton, C., Wallace, H. Toxicity testing is evolving. Toxicology Research. 9 (2), 67-80 (2020).
- de Araújo, G. L., et al. Alternative methods in toxicity testing: the current approach. Brazilian Journal of Pharmaceutical Sciences. 50 (1), 55-62 (2014).
- Toussaint, M., et al. A high-throughput method to measure the sensitivity of yeast cells to genotoxic agents in liquid cultures. Mutation Research/Genetic Toxicology and Environmental Mutagenesis. 606 (1), 92-105 (2006).
- Horzmann, K. A., Freeman, J. L. Making waves: New developments in toxicology with the zebrafish. Toxicological Sciences. 163 (1), 5-12 (2018).
- Avdesh, A., et al. Regular care and maintenance of a zebrafish (Danio rerio) laboratory: An introduction. Journal of Visualized Experiments. (69), e4196(2012).
- Cunliffe, V. T. Zebrafish: A Practical Approach. Nüsslein-Volhard, C., Dahm, R. , Oxford University Press. (2002).
- Sitarek, P., et al. Insight the biological activities of selected Abietane Diterpenes isolated from Plectranthus spp. Biomolecules. 10 (2), 194(2020).
- Matias, D., et al. Cytotoxic activity of Royleanone Diterpenes from Plectranthus madagascariensis Benth. ACS Omega. 4 (5), 8094-8103 (2019).
- Garcia, C., et al. Royleanone derivatives from Plectranthus spp. as a novel class of P-glycoprotein inhibitors. Frontiers in Pharmacology. 11, (2020).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados