このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
アルテミアサリナLを用いた致死性バイオアッセイ。
* これらの著者は同等に貢献しました
要約
この作業は、評価とレビューを目的としています アルテミアサリナ 致死性バイオアッセイ手順、ブラインシュリンプ致死性アッセイとしても識別されます。このシンプルで安価な方法は、サンプル、すなわち天然物の一般的な毒性(予備毒性評価と見なされる)に関する情報を提供します。
要約
天然物は古くから医薬品の製造に使用されてきました。今日では、天然資源から入手し、多くの病気に対して使用される化学療法薬がたくさんあります。残念ながら、これらの化合物のほとんどは、全身毒性と副作用を示すことがよくあります。選択された潜在的に生理活性サンプルの忍容性をよりよく評価するために、ブラインシュリンプ(Artemia salina)は一般的に致死性研究のモデルとして使用されます。 A.サリナ テストは、研究された生理活性化合物が幼虫期(ノープリウス)で微小甲殻類を殺す能力に基づいています。この方法は、細胞毒性試験、ならびに合成、半合成、および天然物の一般的な毒性スクリーニングのための便利な出発点となります。これは、前述の目的に一般的に適した他の多くのアッセイ(in vitro 細胞または酵母株、ゼブラフィッシュ、げっ歯類)と比較して、単純、迅速、および低コストのアッセイと見なすことができます。さらに、特別なトレーニングがなくても簡単に実行できます。全体として、 A.サリナ アッセイは、選択された化合物の予備毒性評価および天然物抽出物のバイオガイド分画のための有用なツールである。
概要
植物、動物、または微生物からの天然物は、その多様な生物学的および薬理学的活性のために、新しい生理活性分子の開発において長年にわたって関心が高まっている分野です1。しかし、関連する副作用、薬剤耐性、または薬剤の不十分な特異性は、特に抗癌剤として使用される場合、無効な治療につながる可能性のある主要な要因を表しています1,2。
過去数十年にわたって、いくつかの植物由来の細胞傷害剤が発見されており、そのうちのいくつかは抗癌剤として使用されている1,2,3。これに関連して、パクリタキセルは、天然起源の最も有名で最も活性な化学療法薬の1つとして報告されています3,4。現在、市場に出回っているすべての医薬品の35%以上が天然物に由来するか、天然物に触発されていると推定されています5。これらの化合物の潜在的な高い毒性は、植物自体のさまざまな種類の汚染物質または代謝成分でさえ毒性作用を引き起こす可能性があるため、すべての研究段階で考慮する必要があります。このため、薬理学的および毒物学的プロファイルは、新しい潜在的な植物ベースの治療の生物学的活性と安全性を評価するために、予備段階で実施する必要があります。新しい生理活性サンプルの毒性を評価するために、無脊椎動物を研究するのに最適なモデルと見なすことができます。彼らは最小限の倫理的要件を要求し、脊椎動物1,6での次のテストラウンドで最も有望な製品を優先するために、予備的なin vitroアッセイを可能にします。
一般にブラインシュリンプとして知られているA.サリナは、アルテミア属に属する小さな好塩性無脊椎動物です(アルテミダエ科、アノストラカ目、甲殻類亜門;図1)。海洋および水生塩水の生態系では、ブラインシュリンプは微細藻類を食べ、魚の餌に使用される動物プランクトンの成分であるため、重要な栄養的役割を果たします。さらに、それらの幼虫(ノープリウスとして知られている)は、予備研究中の一般的な毒性の評価に広く使用されています1,3,7。
アルテミア属は致死性試験で広く使用されており、実験室で増殖したノープリウスを殺す能力に基づいて潜在的に生理活性化合物の毒性を追跡することにより、毒性評価の便利な出発点でもあります1,8。このため、A. salinaの使用は、動物モデル9の他の試験と比較して、非常に効率的で使いやすい方法であるため、一般的な毒性試験で注目を集めました。
解剖学的構造が単純で、サイズが小さく、ライフサイクルが短いため、1回の実験で膨大な数の無脊椎動物を研究することができます。そのため、遺伝的快適性と低コストの適合性を大規模スクリーニングと組み合わせています1。これに関連して、一般的な毒性アッセイにおけるブラインシュリンプの使用は、急速な成長(孵化から最初の結果まで28〜72時間が必要)、費用対効果、および一年中使用できる市販の卵の長い貯蔵寿命などのいくつかの利点を示しています3,10。一方、無脊椎動物は原始的な器官系を持ち、適応免疫系を持たないため、ヒト細胞の完全で信頼できるモデルではありません1。
ただし、選択したサンプルの一般的な毒性の予備評価方法を提供します。致死性アッセイとして広く使用されているため、潜在的な抗がん剤の毒性作用に関する暫定的な適応症を提供できます。また、 アルテミア エビの中で可能な限り低い死亡率を示すことが不可欠である他の生物学的活性に恵まれた化合物の一般的な毒性についてのフィードバックを得るためにもよく使用されます。
私たちのグループからの進行中の研究では、プレクトランサス種からのさまざまな抽出物が抗酸化作用と抗菌作用を示しました(未発表の結果)。並行して、単離された化合物を抽出物の精製によって得、次いで化学修飾した。次に、抽出物、純粋な化合物、および半合成誘導体を一般的な毒性の観点からテストしました。これに関連して、本研究は、生理活性抽出物およびPlectranthus属の異なる植物からの単離された化合物の一般的な毒性および潜在的な細胞毒性活性の評価のためのアルテミア致死性バイオアッセイの使用の概要を示すことを目的としています11。

図1:顕微鏡下の アルテミアサリナ 。 顕微鏡で見た A.サリナ の新しく孵化したノープリウス(倍率12倍)。 この図の拡大版を表示するには、ここをクリックしてください。
プロトコル
1.機器の準備
- 市販の孵化装置を入手してください。孵化装置を設置するのに適した場所を選択してください(図2A)。漏斗状の容器を黒いサポート(セットに含まれています)に入れ、漏斗を適切な方向に回してレベルマークとタップを確認します。
- 手作りの移行装置を作るには、0.5 L(直径5.8 cm)のペットボトル2本の上部をカットして、最終的な高さ12 cmにします。各ボトルの底から7cmの片側に直径1.5cmの穴を開け、2つの開口部の間に13cmのゴムチューブ(外側1.3cm、内径0.9cm)を挿入します。ホットグルーで開口部を密閉し(図2B)、15分間乾燥させます。ボトルを平らな面に置き、水で満たして、漏れがないことを確認します。
2.人工塩溶液の調製
- ガラスビーカーに、35g/Lの濃度の人工塩溶液(かん水エビ塩)を調製する。これを行うには、製造元の指示に従って、28 gの塩を800mLの水道水に加えます。すべての塩が完全に溶解するまで攪拌棒で混ぜます。
注意: 利用可能な容器のサイズに応じて、準備した生理食塩水の量を調整します。
3. サンプル調製
- 適量の抽出物(プレクトランサス 抽出物、Pa- P. ambigerus; Pb-P.バルバトゥス;Pc−P. シリンドラセウス ;およびPe− P.エクロニイ)または化合物1〜5( プレクトランサス 属から得られる2つの天然化合物[1および2]および3つの半合成誘導体[3、4、5]; 図3)ジメチルスルホキシド(DMSO)12で、最終濃度10 mg/mLになるようにします(サンプルが水溶性の場合、DMSOを使用する必要はありません)。
- ステップ2.1で調製した990 μLの人工生理食塩水を使用して、各サンプル(およびネガティブコントロールの場合はDMSO)を新しい微量遠心チューブで10 μL希釈し、最終濃度0.1 mg / mLを得ました。
- ヒュームフードの下で、三角フラスコで、1 mg / mLの濃度の蒸留水中の重クロム酸カリウム(K 2Cr2O7)の溶液を調製します13,14,15。
4.ブラインシュリンプ致死性バイオアッセイ
注:このアッセイは、修正1,16,17,18,19を有する数人の著者の研究から開発されている。
- ステップ2.1で調製した培地をレベルマーク(500 mL)まで孵化容器に充填します(図2C)。
- スプーン1杯(約0.75 g)の塩水エビ嚢胞を塩溶液に入れ、容器を閉じます。ランプ(テーブルランプ、40 W、230 V、50 Hz、8 W、4,000 K、830 lmのLED電球付き)を機器に直接向けて(図2A)オンにします。
- エアサプライヤーシステム(3 W出力、50 Hz、230 V)を機器の上部に配置されたコネクタに接続し、ポンプをオンにします。
- 室温を25±3°Cに保ちます。 ブラインシュリンプシストは、24時間から48時間後に、激しい曝気、連続照明、および安定した温度の下で、人工塩溶液中で孵化する。
注:あるいは、垂直インキュベーターを使用することもできます。 - 卵が孵化したら、エアポンプをオフにし、ノープリウス(漏斗の下部に向かって移動)が空の卵ケース(上部に浮かぶ)から分離されるまで待ちます。
- 孵化していない卵を生きているノープリウスから分離するには、底部の出口タップを開き、手作りの移動装置コンテナのコンテナの1つに漏斗の内容物を排出します(ステップ1.2で説明)。ノープリウスと残りの孵化していない卵を含む溶液がチューブのレベルより下にあることを確認してください。2番目の容器に、ステップ2.1の残留塩溶液をチューブの高さより上に追加します。
- アルミホイルを使用して、ノープリウスと残りの孵化していない卵で容器を覆います。塩溶液だけで2番目の容器にランプを置きます。ブラインシュリンプは光に引き付けられ、一方の容器からもう一方の容器(収穫容器)に移動し、卵(ゆっくりと底に沈降する)と生きている アルテミアを効率的に分離します。
- 次に、ステップ4.4で使用したのと同じ条件下で機器をインキュベーターに4時間配置します(図2E)。収穫容器から、10〜15個のノープリウスを含む生理食塩水900μLを収集します。ノープリウスを含む生理食塩水を24ウェルプレートの各ウェルに入れます(図2F)。すべてのサンプルは4倍でテストされます。
- 陰性対照(DMSO)、陽性対照(K2Cr2O7、重クロム酸カリウム)、人工塩溶液、および各サンプルをそれぞれウェルにそれぞれ100μL加える(図2F)13、14。
注:各ウェルのサンプルは0.01 mg / mLの濃度になります。塩溶液中のポジティブコントロールの最終濃度は0.1 mg / mLになり、ウェル内のすべてのノープリウスが重クロム酸カリウムの毒性作用にさらされて死ぬことを確認します。人工塩溶液はブランクとして機能します。 - プレートを25±3°Cの照明下で24時間インキュベートします(図2G)。24時間後、双眼顕微鏡(12x)20の下で各ウェルの死んだ幼虫(5秒間の非可動性ノープリウス)の数を登録します(図2H)。または、ハンドレンズを使用してください。
- 100μLの重クロム酸カリウム溶液を加え、残りの生きている幼虫の死を誘発し、6時間待つ。顕微鏡下で各ウェル内の死んだ幼虫の総数を数えます。次式に従って死亡率を求める。
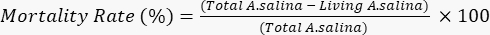
- すべてのアッセイを3回で実行します。標準偏差(SD)を計算し、結果を3つの独立した実験の平均として表し、それぞれに内部四重(n = 12)±SDがあります。Meyerらが述べたように、LC50< 1,000 μg / mLの粗抽出物および純粋な化合物を毒性と見なします。また、ブラインシュリンプの死亡率は試験試料21の濃度に比例することを考慮に入れる。

図2:アルテミアサリナ致死バイオアッセイ法。 (A)ブラインシュリンプシストの孵化に使用される市販の機器。(B)手作りの移行装置。(c)生理食塩水で満たされた孵化容器;(D)孵化していない卵とノープリウスの収集。(E)移行ステップ中のインキュベーター内の手作りの機器。ランプから離れた容器はアルミホイルで覆う必要があります。ただし、ここでのセットインストールをよりよく見るために、セットは削除されました。(f)アッセイを実施する前のウェルでのアルテミアの採取。化合物は次のように配置する必要があります:-ネガティブコントロール(DMSO)、+はポジティブコントロール(K 2 Cr2O7)、塩は人工塩溶液、およびテストするサンプル(この場合は化合物1〜3)を指します。(g)アルテミアおよび選択されたサンプルを含む24ウェルプレートのインキュベーション;(H)双眼顕微鏡下でのアルテミアカウント。この図の拡大版を表示するには、ここをクリックしてください。

図3:選択した化合物の構造。 化合物1〜2の構造は、 プレクトランサス 種から抽出され、化合物3〜5と、半合成により得られる。 この図の拡大版を表示するには、ここをクリックしてください。
結果
私たちのグループが最近研究したいくつかの天然物の一般的な毒性は、ブラインシュリンプ致死性バイオアッセイを通じて評価されました。4つの抽出物(Pa- P. ambigerus; Pb-P.バルバトゥス;Pc- P.シリンドラセウス;およびPe- P. ecklonii)は、それらの抗酸化活性(未発表の結果)で知られている プレクトランサス 属から、試験された。さらに、 プレクトランサス ...
ディスカッション
過去数年間、科学界は毒性スクリーニングの代替モデルへの関心を高めてきました21。A. salina致死バイオアッセイの他に、他の方法論が通常、サンプル忍容性の評価のために行われ、脊椎動物バイオアッセイ(げっ歯類など)、無脊椎動物(ゼブラフィッシュなど)、酵母株または細胞を使用するin vitro法、およびインシリコ法が含まれます22,23,24...
開示事項
著者は、金銭的またはその他の利益相反を宣言しません。
謝辞
アミルカル・ロベルト教授を偲んで。
この作業は、プロジェクトUIDB/04567/2020およびUIDP/04567/2020の下で、CFIOSおよび博士号助成金SFRH/BD/137671/2018(Vera Isca)に起因するFundaçãopara a Ciência e a Tecnologia(FCT、ポルトガル)によって財政的に支援されました。
資料
| Name | Company | Catalog Number | Comments |
| 24-well plates | Thermo Fisher Scientific, Denmark | 174899 | Thermo Scientific Nunc Up Cell 24 multidish |
| Aluminium foil | Albal | - | Can be purchased in supermarket |
| Artemio Set | JBL GmbH and Co. KG, D-67141, Neuhofen Germany | 61066000 | Can be purchased in pet shops |
| Binocular microscope | Ceti, Belgium | 1700.0000 | Flexum-24AED, 220-240 V, 50 Hz |
| Bottles | - | - | 0.5 L Diameter: 5.8 cm; Height: 12 cm |
| Brine shrimp cysts | JBL GmbH and Co. KG, D-67141, Neuhofen Germany | 3090700 | Can be purchased in pet shops |
| Brine shrimp salt | JBL GmbH and Co. KG, D-67141, Neuhofen Germany | 3090600 | Can be purchased in pet shops |
| Dimethyl sulfoxide (DMSO) | VWR chemicals | CAS: 67-68-5 | 99% purity |
| Discartable tips | Diamond | F171500 | Volume range: 100 - 1000 µL |
| Eppendorf microtubes | BRAND | 7,80,546 | Microtubes, PP, 2 mL, BIO-CERT PCR QUALITY |
| Erlenmeyer flask | VWR chemicals | 4,47,109 | volume: 100 mL |
| Glass beaker | Normax | 3.2111654N | Volume: 1000 mL |
| Gloves | Guantes Luna | GLSP3 | - |
| GraphPad Prism | GraphPad Software, San Diego, CA, USA | - | GraphPad Prism version 5.00 for Windows, www.graphpad.com, accessed on 5 February 2021; commercial statistical analysis software |
| Home-made A. salina Grower | - | - | Home made: two plastic bottles connected by a hose |
| Hot glue | Parkside | PHP500E3 | 230 V, 50 Hz, 25 W |
| Incubator | Heidolph Instruments, Denmark | - | One Heidolph Unimax 1010 equipment and one Heidolph Inkubator 1006 |
| Light | Roblan | SKYC3008FE14 | LED light bulb |
| Micropipettes | VWR chemicals | 613-5265 | Volume range: 100 - 1000 µL |
| Potassium dichromate (K2Cr2O7) | VWR chemicals | CAS: 7778-50-9 | 99% purity |
| Pump ProAir a50 | JBL GmbH and Co. KG, D-67141, Neuhofen Germany | - | Included in the Artemio Set+1 kit |
| Rubber tube | - | - | 1.3 cm outer and 0.9 cm inner diameter |
| Stirring rod | VWR chemicals | 441-0147 |  6 mm, 250 mm 6 mm, 250 mm |
| Termometer | VWR chemicals | 620-0821 | 0 - 100 °C |
参考文献
- Ntungwe, N. E., et al. Artemia species: An important tool to screen general toxicity samples. Current Pharmaceutical Design. 26 (24), 2892-2908 (2020).
- Cragg, G. M., Newman, D. J. Natural products: A continuing source of novel drug leads. Biochimica et Biophysica Acta (BBA) - General Subjects. 1830 (6), 3670-3695 (2013).
- Ntungwe, E., et al. General toxicity screening of Royleanone derivatives using an artemia salina model. Journal Biomedical and Biopharmaceutical Research. 18 (1), 114 (2021).
- Seca, A., Plant Pinto, D. secondary metabolites as anticancer agents: Successes in clinical trials and therapeutic application. International Journal of Molecular Sciences. 19 (1), 263 (2018).
- Calixto, J. B. The role of natural products in modern drug discovery. Anais da Academia Brasileira de Ciências. 91 (3), 1-7 (2019).
- Mandrell, D., et al. Automated zebrafish chorion removal and single embryo placement: optimizing throughput of zebrafish developmental toxicity screens. Journal of Laboratory Automation. 17 (1), 66-74 (2012).
- Zhang, Y., Mu, J., Han, J., Gu, X. An improved brine shrimp larvae lethality microwell test method. Toxicology Mechanisms and Methods. 22 (1), 23-30 (2012).
- Domínguez-Villegas, V., et al. antioxidant and cytotoxicity activities of methanolic extract and prenylated flavanones isolated from leaves of eysehardtia platycarpa. Natural Product Communications. 8 (2), 177-180 (2013).
- Hamidi, M. R., Jovanova, B., Panovska, T. K. Toxicological evaluation of the plant products using Brine Shrimp (Artemia salina L.) model. Macedonian Pharmaceutical Bulletin. 60 (01), 9-18 (2014).
- Libralato, G., Prato, E., Migliore, L., Cicero, A. M., Manfra, L. A review of toxicity testing protocols and endpoints with Artemia spp. Ecological Indicators. 69, 35-49 (2016).
- Mendes Hacke, A. C., et al. Cytotoxicity of cymbopogon citratus (DC) Stapf fractions, essential oil, citral, and geraniol in human leukocytes and erythrocytes. Journal of Ethnopharmacology. 291, 115147 (2022).
- Thangapandi, V., Pushpanathan, T. Comparison of the Artemia salina and Artemia fransiscana bioassays for toxicity of Indian medicinal plants. Journal of Coastal Life Medicine. 2 (6), 453-457 (2014).
- Syahmi, A. R. M., et al. Acute oral toxicity and brine shrimp lethality of Elaeis guineensis Jacq., (Oil Palm Leaf) methanol extract. Molecules. 15 (11), 8111-8121 (2010).
- Sasidharan, S., et al. Acute toxicity impacts of Euphorbia hirta L extract on behavior, organs body weight index and histopathology of organs of the mice and Artemia salina. Pharmacognosy Research. 4 (3), 170 (2012).
- Libralato, G. The case of Artemia spp. in nanoecotoxicology. Marine Environmental Research. 101, 38-43 (2014).
- Okumu, M. O., et al. Artemia salina as an animal model for the preliminary evaluation of snake venom-induced toxicity. Toxicon: X. 12, 100082 (2021).
- Rajabi, S., Ramazani, A., Hamidi, M., Naji, T. Artemia salina as a model organism in toxicity assessment of nanoparticles. DARU Journal of Pharmaceutical Sciences. 23 (1), 20 (2015).
- Svensson, B. -. M., Mathiasson, L., Mårtensson, L., Bergström, S. Artemia salina as test organism for assessment of acute toxicity of leachate water from landfills. Environmental Monitoring and Assessment. 102 (1), 309-321 (2005).
- Banti, C., Hadjikakou, S. Evaluation of toxicity with brine shrimp assay. Bio-Protocol. 11 (2), 3895 (2021).
- Pecoraro, R., et al. Artemia salina: A microcrustacean to assess engineered nanoparticles toxicity. Microscopy Research and Technique. 84 (3), 531-536 (2021).
- Lillicrap, A., et al. Alternative approaches to vertebrate ecotoxicity tests in the 21st century: A review of developments over the last 2 decades and current status. Environmental Toxicology and Chemistry. 35 (11), 2637-2646 (2016).
- Ribeiro, I. C., et al. Yeasts as a model for assessing the toxicity of the fungicides Penconazol, Cymoxanil and Dichlofulanid. Chemosphere. (10), 1637-1642 (2000).
- Armour, C. D., Lum, P. Y. From drug to protein: using yeast genetics for high-throughput target discovery. Current Opinion in Chemical Biology. 9 (1), 20-24 (2005).
- Modarresi Chahardehi, A., Arsad, H., Lim, V. Zebrafish as a successful animal model for screening toxicity of medicinal plants. Plants. 9 (10), 1345 (2020).
- Fischer, I., Milton, C., Wallace, H. Toxicity testing is evolving. Toxicology Research. 9 (2), 67-80 (2020).
- de Araújo, G. L., et al. Alternative methods in toxicity testing: the current approach. Brazilian Journal of Pharmaceutical Sciences. 50 (1), 55-62 (2014).
- Toussaint, M., et al. A high-throughput method to measure the sensitivity of yeast cells to genotoxic agents in liquid cultures. Mutation Research/Genetic Toxicology and Environmental Mutagenesis. 606 (1), 92-105 (2006).
- Horzmann, K. A., Freeman, J. L. Making waves: New developments in toxicology with the zebrafish. Toxicological Sciences. 163 (1), 5-12 (2018).
- Avdesh, A., et al. Regular care and maintenance of a zebrafish (Danio rerio) laboratory: An introduction. Journal of Visualized Experiments. (69), e4196 (2012).
- Cunliffe, V. T., Nüsslein-Volhard, C., Dahm, R. . Zebrafish: A Practical Approach. , (2002).
- Sitarek, P., et al. Insight the biological activities of selected Abietane Diterpenes isolated from Plectranthus spp. Biomolecules. 10 (2), 194 (2020).
- Matias, D., et al. Cytotoxic activity of Royleanone Diterpenes from Plectranthus madagascariensis Benth. ACS Omega. 4 (5), 8094-8103 (2019).
- Garcia, C., et al. Royleanone derivatives from Plectranthus spp. as a novel class of P-glycoprotein inhibitors. Frontiers in Pharmacology. 11, (2020).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved