È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Saggio biologico di letalità con Artemia salina L.
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Questo lavoro mira a valutare e rivedere la procedura di saggio biologico di letalità dell'Artemia salina , identificata anche come saggio di letalità dei gamberetti di salamoia. Questo metodo semplice ed economico fornisce informazioni sulla tossicità generale (considerata come una valutazione preliminare della tossicità) dei campioni, vale a dire i prodotti naturali.
Abstract
I prodotti naturali sono stati utilizzati fin dall'antichità per produrre medicinali. Al giorno d'oggi, ci sono molti farmaci chemioterapici ottenuti da fonti naturali e utilizzati contro una pletora di malattie. Sfortunatamente, la maggior parte di questi composti spesso mostrano tossicità sistemica ed effetti avversi. Al fine di valutare meglio la tollerabilità di campioni selezionati potenzialmente bioattivi, il gambero salamoia (Artemia salina) viene generalmente utilizzato come modello negli studi di letalità. Il test di A. salina si basa sulla capacità dei composti bioattivi studiati di uccidere i microcrostacei nel loro stadio larvale (naupli). Questo metodo rappresenta un comodo punto di partenza per gli studi di citotossicità, nonché per lo screening della tossicità generale di prodotti sintetici, semisintetici e naturali. Può essere considerato un test semplice, rapido e a basso costo, rispetto a molti altri saggi (cellule in vitro o ceppi di lievito, zebrafish, roditori) generalmente adatti agli scopi sopra indicati; Inoltre, può essere facilmente eseguito anche senza alcuna formazione specifica. Nel complesso, il saggio di A. salina rappresenta uno strumento utile per la valutazione preliminare della tossicità di composti selezionati e il frazionamento bioguidato di estratti di prodotti naturali.
Introduzione
I prodotti naturali di piante, animali o microrganismi sono stati una crescente area di interesse nel corso degli anni nello sviluppo di nuove molecole bioattive a causa della loro variegata gamma di attività biologiche e farmacologiche1. Tuttavia, gli effetti collaterali associati, la resistenza ai farmaci o l'inadeguata specificità degli agenti, specialmente se usati come farmaci antitumorali, rappresentano i principali fattori che possono portare a un trattamento inefficace 1,2.
Negli ultimi decenni sono stati scoperti diversi agenti citotossici di origine vegetale, alcuni dei quali utilizzati come agenti antitumorali 1,2,3. In questo contesto, il paclitaxel è segnalato come uno dei farmaci chemioterapici più noti e attivi di origine naturale 3,4. Attualmente, si stima che oltre il 35% di tutti i farmaci sul mercato derivino o siano ispirati a prodotti naturali5. La potenziale elevata tossicità di questi composti richiede considerazione durante tutte le fasi di studio, poiché diversi tipi di contaminanti o anche componenti metabolici della pianta stessa possono causare effetti tossici. Per questo motivo, i profili farmacologici e tossicologici dovrebbero essere intrapresi nella fase preliminare, per valutare l'attività biologica e la sicurezza di nuovi potenziali trattamenti a base vegetale. Per valutare la tossicità di nuovi campioni bioattivi, gli animali invertebrati possono essere considerati i migliori modelli da studiare. Richiedono requisiti etici minimi e consentono test preliminari in vitro, per dare priorità ai prodotti più promettenti per il prossimo ciclo di test sui vertebrati 1,6.
Comunemente noto come gambero salamoia, A. salina è un piccolo invertebrato alofilo appartenente al genere Artemia (famiglia Artemiidae, ordine Anostraca, subphylum Crustacea; Figura 1). Negli ecosistemi salini marini e acquatici, i gamberetti di salamoia svolgono un importante ruolo nutrizionale in quanto si nutrono di microalghe e sono costituenti dello zooplancton utilizzato per nutrire i pesci. Inoltre, le loro larve (note come naupli) sono ampiamente utilizzate nella valutazione della tossicità generale durante gli studi preliminari 1,3,7.
Le Artemia spp. sono ampiamente utilizzate negli studi di letalità e sono anche un comodo punto di partenza per le valutazioni di tossicità, monitorando la tossicità di composti potenzialmente bioattivi in base alla loro capacità di uccidere i naupli coltivati in laboratorio 1,8. Per questo motivo, l'uso di A. salina ha guadagnato attrazione negli studi di tossicità generale, perché è un metodo molto efficiente e facile da usare, rispetto ad altri test su modelli animali9.
Grazie alla loro anatomia semplice, alle piccole dimensioni e al breve ciclo di vita, un vasto numero di invertebrati può essere studiato in un singolo esperimento. In quanto tali, combinano l'amenabilità genetica e la compatibilità a basso costo con screening su larga scala1. In questo contesto, l'uso di gamberetti di salamoia in un saggio di tossicità generale mostra diversi vantaggi, come la crescita rapida (28-72 ore sono necessarie dalla schiusa ai primi risultati), l'economicità e la lunga durata di conservazione delle uova commerciali, che possono essere utilizzate tutto l'anno 3,10. D'altra parte, poiché gli invertebrati hanno un sistema di organi primitivo e mancano di un sistema immunitario adattativo, non rappresentano un modello perfetto e affidabile per le cellule umane1.
Tuttavia, fornisce un metodo di valutazione preliminare per la tossicità generale di campioni selezionati. Poiché è ampiamente usato come test di letalità, può fornire indicazioni provvisorie sugli effetti tossici di potenziali agenti antitumorali. Viene spesso utilizzato anche per ottenere feedback sulla tossicità generale di composti dotati di qualsiasi altra attività biologica per la quale è essenziale mostrare il più basso tasso di mortalità possibile tra i gamberetti di Artemia .
In uno studio in corso dal nostro gruppo, diversi estratti di specie Plectranthus hanno mostrato attività antiossidanti e antimicrobiche (risultati non pubblicati). Parallelamente, composti isolati sono stati ottenuti mediante purificazione degli estratti e sono stati poi modificati chimicamente. Gli estratti, i composti puri e i derivati semisintetici sono stati quindi testati in termini di tossicità generale. In questo contesto, il presente lavoro si propone di fornire una panoramica dell'uso del saggio biologico di letalità dell'Artemia per la valutazione della tossicità generale e della potenziale attività citotossica di estratti bioattivi e composti isolati da diverse piante del genere Plectranthus11.

Figura 1: Artemia salina al microscopio. Naupli appena schiusi di A. salina visti al microscopio (ingrandimento 12x). Fare clic qui per visualizzare una versione ingrandita di questa figura.
Access restricted. Please log in or start a trial to view this content.
Protocollo
1. Preparazione dell'attrezzatura
- Acquisire attrezzature di schiusa disponibili in commercio. Selezionare un luogo adatto per installare l'attrezzatura di schiusa (Figura 2A). Posizionare il contenitore a forma di imbuto nel supporto nero (incluso nel set) e ruotare l'imbuto in una direzione adatta per vedere il segno di livello e il rubinetto.
- Per realizzare attrezzature di migrazione fatte a mano, tagliare la parte superiore di due bottiglie di plastica da 0,5 L (5,8 cm di diametro) per ottenere un'altezza finale di 12 cm. Creare un foro di 1,5 cm di diametro su un lato a 7 cm dal fondo in ogni bottiglia e inserire un tubo di gomma di 13 cm (1,3 cm di diametro esterno e 0,9 cm interno) tra le due aperture. Sigillare le aperture con colla a caldo (Figura 2B) e lasciare asciugare per 15 minuti; Metti le bottiglie su una superficie piana e riempile d'acqua per verificare che non ci siano perdite.
2. Preparazione della soluzione salina artificiale
- In un becher di vetro, preparare una soluzione salina artificiale (sale di gamberetti di salamoia) ad una concentrazione di 35 g/L. Per fare questo, aggiungere 28 g di sale a 800 ml di acqua del rubinetto, secondo le istruzioni del produttore. Mescolare con una bacchetta di agitazione fino a quando tutto il sale è completamente sciolto.
NOTA: Regolare il volume della soluzione salina preparata in base alle dimensioni dei contenitori disponibili.
3. Preparazione del campione
- Preparare tutti i campioni in una provetta da microcentrifuga sciogliendo una quantità adeguata di estratti (estratti di Plectranthus , Pa- P. ambigerus; Pb- P. barbatus; Pc- P. cylindraceus ; e Pe- P. ecklonii) o composti 1-5 (due composti naturali [1 e 2] ottenuti da Plectranthus spp. e tre derivati semisintetici [3, 4, 5]; Figura 3) nel dimetilsolfossido (DMSO)12, in modo da ottenere una concentrazione finale di 10 mg/ml (se il campione è solubile in acqua, non è necessario l'uso di DMSO).
- Diluire 10 μL di ciascun campione (e DMSO per il controllo negativo) in una nuova provetta da microcentrifuga utilizzando 990 μL di soluzione salina artificiale preparata nella fase 2.1, per ottenere una concentrazione finale di 0,1 mg/ml.
- Sotto una cappa aspirante, in un matraccio di Erlenmeyer, preparare una soluzione di dicromato di potassio(K 2 Cr2O7) in acqua distillata ad una concentrazione di 1 mg/mL13,14,15.
4. Saggio biologico sulla letalità dei gamberetti di salamoia
NOTA: Questo saggio è sviluppato dalle opere di diversi autori con modifiche 1,16,17,18,19.
- Riempire il recipiente da cova con il mezzo preparato al punto 2.1 fino al livello (500 ml) (figura 2C).
- Mettere un cucchiaio (circa 0,75 g) di cisti di gamberetti di salamoia nella soluzione salina, quindi chiudere il contenitore. Posizionare una lampada (lampada da tavolo, 40 W, 230 V, 50 Hz, con una lampadina a LED da 8 W, 4.000 K, 830 lm) rivolta direttamente verso l'apparecchiatura (Figura 2A) e accenderla.
- Collegare il sistema di alimentazione dell'aria (uscita 3 W, 50 Hz, 230 V) al connettore posto sulla parte superiore dell'apparecchiatura e accendere la pompa.
- Mantenere la temperatura ambiente a 25 ± 3 °C. Le cisti di salamoia si schiudono nella soluzione salina artificiale, sotto aerazione vigorosa, illuminazione continua e temperatura stabile, dopo 24 ore a 48 ore.
NOTA: In alternativa, è possibile utilizzare un incubatore verticale. - Una volta che le uova si sono schiuse, spegnere la pompa dell'aria e attendere che i naupli (spostandosi verso il fondo dell'imbuto) siano separati dalle casse delle uova vuote (galleggianti nella parte superiore).
- Per separare le uova non schiuse dai naupli vivi, aprire il rubinetto di uscita in basso e scaricare il contenuto dell'imbuto in uno dei contenitori del contenitore dell'attrezzatura di migrazione fatto a mano (descritto al punto 1.2). Assicurarsi che la soluzione contenente i naupli e le uova residue non schiuse sia al di sotto del livello del tubo. Nel secondo contenitore, aggiungere la soluzione salina residua dal punto 2.1 sopra l'altezza del tubo.
- Coprire il contenitore con i naupli e le uova residue non schiuse usando un foglio di alluminio. Posizionare la lampada sul secondo contenitore con solo la soluzione salina. I gamberetti di salamoia saranno attratti dalla luce e migreranno da un contenitore all'altro (contenitore di raccolta), portando a un'efficiente separazione tra uova (lentamente sedimentate sul fondo) e Artemia viva.
- Quindi, posizionare l'apparecchiatura nell'incubatore nelle stesse condizioni utilizzate al punto 4.4 per 4 ore (Figura 2E). Dal contenitore di raccolta, raccogliere 900 μL di soluzione salina contenente da 10 a 15 naupli. Porre la soluzione salina con naupli in ciascun pozzetto di una piastra a 24 pozzetti (Figura 2F); Tutti i campioni sono testati in quadruplicati.
- Aggiungere 100 μL ciascuno del controllo negativo (DMSO), del controllo positivo (K 2 Cr2O7,dicromato di potassio), della soluzione salina artificiale e di ciascuno dei campioni al rispettivo pozzetto (Figura 2F)13,14.
NOTA: I campioni in ciascun pozzetto saranno ad una concentrazione di 0,01 mg/ml. La concentrazione finale del controllo positivo in soluzione salina sarà di 0,1 mg/ml, per essere sicuri che tutti i naupli nel pozzetto siano esposti all'effetto tossico del dicromato di potassio e muoiano. La soluzione salina artificiale agirà come bianco. - Incubare la piastra a 25 ± 3 °C sotto illuminazione per 24 ore (Figura 2G). Dopo 24 ore, registrare il numero di larve morte (naupli non mobili per 5 s) in ciascun pozzetto al microscopio binoculare (12x)20 (Figura 2H). In alternativa, utilizzare una lente a mano.
- Aggiungere 100 μL di soluzione di bicromato di potassio, per indurre la morte delle restanti larve viventi, e attendere 6 ore. Conta le larve morte totali in ciascun pozzetto al microscopio. Determinare il tasso di mortalità secondo la seguente equazione.
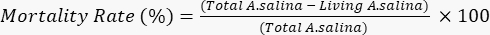
- Eseguire tutto il test in triplice copia. Calcolare le deviazioni standard (SD) ed esprimere i risultati come media di tre esperimenti indipendenti, ciascuno con quadruplicati interni (n = 12), ± SD. Come menzionato da Meyer et al., considerare gli estratti grezzi e i composti puri con LC50< 1.000 μg / mL come tossici; Inoltre, tenere conto del fatto che il tasso di mortalità dei gamberetti di salamoia è proporzionale alla concentrazione dei campioni testati21.

Figura 2: Metodo di saggio biologico di letalità di Artemia salina. A) attrezzature disponibili in commercio impiegate per la schiusa di cisti di gamberetti di salamoia; b) attrezzature per la migrazione fatte a mano; c) recipiente da cova riempito di soluzione salina; D) raccolta di uova e naupli non schiusi; (E) Attrezzature fabbricate a mano nell'incubatore durante la fase di migrazione. Il contenitore lontano dalla lampada deve essere coperto con un foglio di alluminio; Tuttavia, per una migliore visione dell'installazione del set qui è stato rimosso; (F) Raccolta di Artemia in pozzi prima di eseguire il test. I composti devono essere posizionati come indicato: - si riferisce al controllo negativo (DMSO), + al controllo positivo (K 2Cr2O7), sale alla soluzione salina artificiale e da 1 a 3 ai campioni da testare (in questo caso composti 1-3); (G) Incubazione della piastra a 24 pozzetti contenente Artemia e dei campioni selezionati; (H) Conta dell'artemia al microscopio binoculare. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 3: Strutture di composti selezionati. Struttura dei composti 1-2, estratti dalle specie di Plectranthus , e composti 3-5, ottenuti per semisintesi. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Access restricted. Please log in or start a trial to view this content.
Risultati
La tossicità generale di alcuni prodotti naturali recentemente studiati dal nostro gruppo è stata valutata attraverso il saggio biologico sulla letalità dei gamberetti in salamoia. Quattro estratti (Pa- P. ambigerus; Pb- P. barbatus; Pc- P. cylindraceus; e Pe- P. ecklonii) del genere Plectranthus , noti per la loro attività antiossidante (risultati non pubblicati), sono stati testati. Inoltre, due composti naturali (1 e 2) ottenuti da Plectranthus spp., e tre deri...
Access restricted. Please log in or start a trial to view this content.
Discussione
Negli ultimi anni, la comunità scientifica ha aumentato la sua attenzione verso modelli alternativi per gli screening di tossicità21. Oltre al saggio biologico sulla letalità di A. salina, vengono solitamente eseguite altre metodologie per la valutazione della tollerabilità del campione e includono saggi biologici di vertebrati (come roditori), invertebrati (come il pesce zebra), metodi in vitro che utilizzano ceppi o cellule di lievito e metodi in silico
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Gli autori non dichiarano conflitti di interesse, finanziari o di altro tipo.
Riconoscimenti
In memoria del professor Amilcar Roberto.
Questo lavoro è stato sostenuto finanziariamente dalla Fundação para a Ciência e a Tecnologia (FCT, Portogallo) nell'ambito dei progetti UIDB/04567/2020 e UIDP/04567/2020 attribuiti a CBIOS e PhD grant SFRH/BD/137671/2018 (Vera Isca).
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| 24-well plates | Thermo Fisher Scientific, Denmark | 174899 | Thermo Scientific Nunc Up Cell 24 multidish |
| Aluminium foil | Albal | - | Can be purchased in supermarket |
| Artemio Set | JBL GmbH and Co. KG, D-67141, Neuhofen Germany | 61066000 | Can be purchased in pet shops |
| Binocular microscope | Ceti, Belgium | 1700.0000 | Flexum-24AED, 220-240 V, 50 Hz |
| Bottles | - | - | 0.5 L Diameter: 5.8 cm; Height: 12 cm |
| Brine shrimp cysts | JBL GmbH and Co. KG, D-67141, Neuhofen Germany | 3090700 | Can be purchased in pet shops |
| Brine shrimp salt | JBL GmbH and Co. KG, D-67141, Neuhofen Germany | 3090600 | Can be purchased in pet shops |
| Dimethyl sulfoxide (DMSO) | VWR chemicals | CAS: 67-68-5 | 99% purity |
| Discartable tips | Diamond | F171500 | Volume range: 100 - 1000 µL |
| Eppendorf microtubes | BRAND | 7,80,546 | Microtubes, PP, 2 mL, BIO-CERT PCR QUALITY |
| Erlenmeyer flask | VWR chemicals | 4,47,109 | volume: 100 mL |
| Glass beaker | Normax | 3.2111654N | Volume: 1000 mL |
| Gloves | Guantes Luna | GLSP3 | - |
| GraphPad Prism | GraphPad Software, San Diego, CA, USA | - | GraphPad Prism version 5.00 for Windows, www.graphpad.com, accessed on 5 February 2021; commercial statistical analysis software |
| Home-made A. salina Grower | - | - | Home made: two plastic bottles connected by a hose |
| Hot glue | Parkside | PHP500E3 | 230 V, 50 Hz, 25 W |
| Incubator | Heidolph Instruments, Denmark | - | One Heidolph Unimax 1010 equipment and one Heidolph Inkubator 1006 |
| Light | Roblan | SKYC3008FE14 | LED light bulb |
| Micropipettes | VWR chemicals | 613-5265 | Volume range: 100 - 1000 µL |
| Potassium dichromate (K2Cr2O7) | VWR chemicals | CAS: 7778-50-9 | 99% purity |
| Pump ProAir a50 | JBL GmbH and Co. KG, D-67141, Neuhofen Germany | - | Included in the Artemio Set+1 kit |
| Rubber tube | - | - | 1.3 cm outer and 0.9 cm inner diameter |
| Stirring rod | VWR chemicals | 441-0147 |  6 mm, 250 mm 6 mm, 250 mm |
| Termometer | VWR chemicals | 620-0821 | 0 - 100 °C |
Riferimenti
- Ntungwe, N. E., et al. Artemia species: An important tool to screen general toxicity samples. Current Pharmaceutical Design. 26 (24), 2892-2908 (2020).
- Cragg, G. M., Newman, D. J. Natural products: A continuing source of novel drug leads. Biochimica et Biophysica Acta (BBA) - General Subjects. 1830 (6), 3670-3695 (2013).
- Ntungwe, E., et al. General toxicity screening of Royleanone derivatives using an artemia salina model. Journal Biomedical and Biopharmaceutical Research. 18 (1), 114(2021).
- Seca, A., Plant Pinto, D. secondary metabolites as anticancer agents: Successes in clinical trials and therapeutic application. International Journal of Molecular Sciences. 19 (1), 263(2018).
- Calixto, J. B. The role of natural products in modern drug discovery. Anais da Academia Brasileira de Ciências. 91 (3), 1-7 (2019).
- Mandrell, D., et al. Automated zebrafish chorion removal and single embryo placement: optimizing throughput of zebrafish developmental toxicity screens. Journal of Laboratory Automation. 17 (1), 66-74 (2012).
- Zhang, Y., Mu, J., Han, J., Gu, X. An improved brine shrimp larvae lethality microwell test method. Toxicology Mechanisms and Methods. 22 (1), 23-30 (2012).
- Domínguez-Villegas, V., et al. antioxidant and cytotoxicity activities of methanolic extract and prenylated flavanones isolated from leaves of eysehardtia platycarpa. Natural Product Communications. 8 (2), 177-180 (2013).
- Hamidi, M. R., Jovanova, B., Panovska, T. K. Toxicological evaluation of the plant products using Brine Shrimp (Artemia salina L.) model. Macedonian Pharmaceutical Bulletin. 60 (01), 9-18 (2014).
- Libralato, G., Prato, E., Migliore, L., Cicero, A. M., Manfra, L. A review of toxicity testing protocols and endpoints with Artemia spp. Ecological Indicators. 69, 35-49 (2016).
- Mendes Hacke, A. C., et al. Cytotoxicity of cymbopogon citratus (DC) Stapf fractions, essential oil, citral, and geraniol in human leukocytes and erythrocytes. Journal of Ethnopharmacology. 291, 115147(2022).
- Thangapandi, V., Pushpanathan, T. Comparison of the Artemia salina and Artemia fransiscana bioassays for toxicity of Indian medicinal plants. Journal of Coastal Life Medicine. 2 (6), 453-457 (2014).
- Syahmi, A. R. M., et al. Acute oral toxicity and brine shrimp lethality of Elaeis guineensis Jacq., (Oil Palm Leaf) methanol extract. Molecules. 15 (11), 8111-8121 (2010).
- Sasidharan, S., et al. Acute toxicity impacts of Euphorbia hirta L extract on behavior, organs body weight index and histopathology of organs of the mice and Artemia salina. Pharmacognosy Research. 4 (3), 170(2012).
- Libralato, G. The case of Artemia spp. in nanoecotoxicology. Marine Environmental Research. 101, 38-43 (2014).
- Okumu, M. O., et al. Artemia salina as an animal model for the preliminary evaluation of snake venom-induced toxicity. Toxicon: X. 12, 100082(2021).
- Rajabi, S., Ramazani, A., Hamidi, M., Naji, T. Artemia salina as a model organism in toxicity assessment of nanoparticles. DARU Journal of Pharmaceutical Sciences. 23 (1), 20(2015).
- Svensson, B. -M., Mathiasson, L., Mårtensson, L., Bergström, S. Artemia salina as test organism for assessment of acute toxicity of leachate water from landfills. Environmental Monitoring and Assessment. 102 (1), 309-321 (2005).
- Banti, C., Hadjikakou, S. Evaluation of toxicity with brine shrimp assay. Bio-Protocol. 11 (2), 3895(2021).
- Pecoraro, R., et al. Artemia salina: A microcrustacean to assess engineered nanoparticles toxicity. Microscopy Research and Technique. 84 (3), 531-536 (2021).
- Lillicrap, A., et al. Alternative approaches to vertebrate ecotoxicity tests in the 21st century: A review of developments over the last 2 decades and current status. Environmental Toxicology and Chemistry. 35 (11), 2637-2646 (2016).
- Ribeiro, I. C., et al. Yeasts as a model for assessing the toxicity of the fungicides Penconazol, Cymoxanil and Dichlofulanid. Chemosphere. (10), 1637-1642 (2000).
- Armour, C. D., Lum, P. Y. From drug to protein: using yeast genetics for high-throughput target discovery. Current Opinion in Chemical Biology. 9 (1), 20-24 (2005).
- Modarresi Chahardehi, A., Arsad, H., Lim, V. Zebrafish as a successful animal model for screening toxicity of medicinal plants. Plants. 9 (10), 1345(2020).
- Fischer, I., Milton, C., Wallace, H. Toxicity testing is evolving. Toxicology Research. 9 (2), 67-80 (2020).
- de Araújo, G. L., et al. Alternative methods in toxicity testing: the current approach. Brazilian Journal of Pharmaceutical Sciences. 50 (1), 55-62 (2014).
- Toussaint, M., et al. A high-throughput method to measure the sensitivity of yeast cells to genotoxic agents in liquid cultures. Mutation Research/Genetic Toxicology and Environmental Mutagenesis. 606 (1), 92-105 (2006).
- Horzmann, K. A., Freeman, J. L. Making waves: New developments in toxicology with the zebrafish. Toxicological Sciences. 163 (1), 5-12 (2018).
- Avdesh, A., et al. Regular care and maintenance of a zebrafish (Danio rerio) laboratory: An introduction. Journal of Visualized Experiments. (69), e4196(2012).
- Cunliffe, V. T. Zebrafish: A Practical Approach. Nüsslein-Volhard, C., Dahm, R. , Oxford University Press. (2002).
- Sitarek, P., et al. Insight the biological activities of selected Abietane Diterpenes isolated from Plectranthus spp. Biomolecules. 10 (2), 194(2020).
- Matias, D., et al. Cytotoxic activity of Royleanone Diterpenes from Plectranthus madagascariensis Benth. ACS Omega. 4 (5), 8094-8103 (2019).
- Garcia, C., et al. Royleanone derivatives from Plectranthus spp. as a novel class of P-glycoprotein inhibitors. Frontiers in Pharmacology. 11, (2020).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon