Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Биоанализ летальности с использованием Artemia salina L.
* Эти авторы внесли равный вклад
В этой статье
Резюме
Эта работа направлена на оценку и обзор процедуры биоанализа летальности Artemia salina , также идентифицированной как анализ летальности креветок в рассоле. Этот простой и дешевый метод дает информацию об общей токсичности (рассматриваемой как предварительная оценка токсичности) образцов, а именно натуральных продуктов.
Аннотация
Натуральные продукты использовались с древних времен для производства лекарств. В настоящее время существует множество химиотерапевтических препаратов, полученных из природных источников и используемых против множества заболеваний. К сожалению, большинство из этих соединений часто проявляют системную токсичность и побочные эффекты. Чтобы лучше оценить переносимость отобранных потенциально биологически активных образцов, рассольная креветка (Artemia salina) обычно используется в качестве модели в исследованиях летальности. Тест A. salina основан на способности исследуемых биологически активных соединений убивать микрокрустацев в их личиночной стадии (nauplii). Этот метод представляет собой удобную отправную точку для исследований цитотоксичности, а также для скрининга общей токсичности синтетических, полусинтетических и натуральных продуктов. Его можно считать простым, быстрым и недорогим анализом по сравнению со многими другими анализами (клетки in vitro или штаммы дрожжей, рыбки данио, грызуны), обычно подходящие для вышеупомянутых целей; более того, его можно легко выполнить даже без какой-либо специальной подготовки. В целом, анализ A. salina представляет собой полезный инструмент для предварительной оценки токсичности выбранных соединений и био-управляемого фракционирования экстрактов натуральных продуктов.
Введение
Натуральные продукты из растений, животных или микроорганизмов на протяжении многих лет были растущей областью интереса в разработке новых биологически активных молекул из-за их разнообразного диапазона биологической и фармакологической активности1. Однако связанные с этим побочные эффекты, лекарственная устойчивость или недостаточная специфичность агентов, особенно при использовании в качестве противоопухолевых препаратов, представляют собой основные факторы, которые могут привести к неэффективномулечению 1,2.
За последние несколько десятилетий было обнаружено несколько цитотоксических агентов растительного происхождения, некоторые из которых используются в качестве противоопухолевых средств 1,2,3. В этом контексте паклитаксел сообщается как один из самых известных и наиболее активных химиотерапевтических препаратов природного происхождения 3,4. В настоящее время, по оценкам, более 35% всех лекарственных средств на рынке получены из натуральных продуктов5 или вдохновлены ими. Потенциальная высокая токсичность этих соединений требует рассмотрения на всех этапах исследования, поскольку различные типы загрязняющих веществ или даже метаболических компонентов самого растения могут вызывать токсические эффекты. По этой причине фармакологические и токсикологические профили должны проводиться на предварительном этапе для оценки биологической активности и безопасности новых потенциальных методов лечения на растительной основе. Чтобы оценить токсичность новых биологически активных образцов, беспозвоночные животные могут рассматриваться как лучшие модели для изучения. Они требуют минимальных этических требований и позволяют проводить предварительные анализы in vitro, чтобы определить приоритетность наиболее перспективных продуктов для следующего раунда тестирования на позвоночных 1,6.
A. salina, широко известная как рассольная креветка, является небольшим галофильным беспозвоночным, принадлежащим к роду Artemia (семейство Artemiidae, отряд Anostraca, подтип ракообразных; Рисунок 1). В морских и водных соленых экосистемах соленые креветки играют важную питательную роль, поскольку они питаются микроводорослями и являются компонентами зоопланктона, используемого для кормления рыб. Более того, их личинки (известные как науплии) широко используются в оценке общей токсичности при предварительных исследованиях 1,3,7.
Artemia spp. широко используются в исследованиях летальности, а также являются удобной отправной точкой для оценки токсичности, отслеживая токсичность потенциально биологически активных соединений на основе их способности убивать науплии, выращенные в лаборатории 1,8. По этой причине применение A. salina приобрело привлекательность в общих исследованиях токсичности, поскольку это очень эффективный и простой в использовании метод, по сравнению с другими испытаниями на животных моделях9.
Благодаря их простой анатомии, крошечным размерам и короткому жизненному циклу, огромное количество беспозвоночных может быть изучено в одном эксперименте. Таким образом, они сочетают генетическую податливость и недорогую совместимость с крупномасштабными скринингами1. В этом контексте использование рассола креветок в общем анализе токсичности показывает несколько преимуществ, таких как быстрый рост (от вылупления до первых результатов требуется 28-72 ч), экономическая эффективность и длительный срок хранения коммерческих яиц, которые можно использовать круглый год 3,10. С другой стороны, поскольку беспозвоночные имеют примитивную систему органов и не имеют адаптивной иммунной системы, они не представляют собой идеальную и надежную модель для клеток человека1.
Однако он обеспечивает предварительный метод оценки общей токсичности отобранных образцов. Поскольку он широко используется в качестве анализа летальности, он может предоставить предварительные показания о токсических эффектах потенциальных противоопухолевых агентов. Он также часто используется для получения обратной связи об общей токсичности соединений, наделенных любой другой биологической активностью, для которой важно показать самый низкий уровень смертности среди креветок артемии .
В продолжающемся исследовании нашей группы различные экстракты из видов Plectranthus показали антиоксидантную и антимикробную активность (неопубликованные результаты). Параллельно выделенные соединения получали путем очистки экстрактов и затем химически модифицировали. Затем экстракты, чистые соединения и полусинтетические производные были протестированы с точки зрения общей токсичности. В этом контексте настоящая работа направлена на то, чтобы дать обзор использования биоанализа на летальность артемии для оценки общей токсичности и потенциальной цитотоксической активности биоактивных экстрактов и изолированных соединений из различных растений рода Plectranthus11.

Рисунок 1: Артемия салина под микроскопом. Недавно вылупившиеся науплии A. salina , как видно под микроскопом (увеличение 12x). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Access restricted. Please log in or start a trial to view this content.
протокол
1. Подготовка оборудования
- Приобретение коммерчески доступного хэтчингового оборудования. Выберите подходящее место для установки штриховочного оборудования (рисунок 2А). Поместите воронкообразный контейнер в черную опору (входит в комплект) и поверните воронку в подходящем направлении, чтобы увидеть отметку уровня и кран.
- Чтобы изготовить миграционное оборудование ручной работы, вырежьте верхнюю часть двух пластиковых бутылок диаметром 0,5 л (5,8 см), чтобы получить окончательную высоту 12 см. Создайте отверстие диаметром 1,5 см с одной стороны при 7 см от дна в каждой бутылке и вставьте резиновую трубку 13 см (1,3 см снаружи и 0,9 см внутренний диаметр) между двумя отверстиями. Заклейте отверстия горячим клеем (рисунок 2B) и оставьте сохнуть на 15 мин; положите бутылки на ровную поверхность и наполните их водой, чтобы убедиться, что нет утечки.
2. Приготовление раствора искусственной соли
- В стеклянном стакане приготовьте искусственный солевой раствор (соль креветок) в концентрации 35 г/л. Для этого добавьте 28 г соли в 800 мл водопроводной воды, согласно инструкции производителя. Смешайте его с помешивающим стержнем до тех пор, пока вся соль не растворится.
ПРИМЕЧАНИЕ: Отрегулируйте объем приготовленного солевого раствора в соответствии с размером имеющихся контейнеров.
3. Пробоподготовка
- Подготовьте все образцы в микроцентрифужной трубке, растворив подходящее количество экстрактов (экстракты Plectranthus , Pa- P. ambigerus; Pb- P. barbatus; Pc- P. cylindraceus; и Pe- P. ecklonii) или соединения 1-5 (два природных соединения [1 и 2], полученные из Plectranthus spp. и три полусинтетических производных [3, 4, 5]; Рисунок 3) в диметилсульфоксиде (ДМСО)12, с тем чтобы получить конечную концентрацию 10 мг/мл (если проба водорастворима, использование ДМСО не требуется).
- Разбавляют 10 мкл каждого образца (и ДМСО для отрицательного контроля) в новой микроцентрифужной трубке, используя 990 мкл искусственного физиологического раствора, приготовленного на стадии 2.1, для получения конечной концентрации 0,1 мг/мл.
- Под вытяжной вытяжкой, в колбе Эрленмейера, готовят раствор дихромата калия (K2Cr2O7) в дистиллированной воде в концентрации 1 мг/мл 13,14,15.
4. Биоанализ летальности креветок рассола
ПРИМЕЧАНИЕ: Данный анализ разработан из работ нескольких авторов с модификациями 1,16,17,18,19.
- Наполните инкубационный сосуд средой, подготовленной на этапе 2.1, до отметки уровня (500 мл) (рис. 2С).
- Поместите одну ложку (примерно 0,75 г) рассола креветочных цист в солевой раствор, а затем закройте емкость. Поместите лампу (настольную лампу, 40 Вт, 230 В, 50 Гц, со светодиодной лампочкой 8 Вт, 4000 К, 830 лм), направленную непосредственно на оборудование (рисунок 2А), и включите его.
- Подключите систему подачи воздуха (выход 3 Вт, 50 Гц, 230 В) к разъему, расположенному в верхней части оборудования, и включите насос.
- Держите комнатную температуру на уровне 25 ± 3 °C. Цисты креветок вылупляются в искусственном солевом растворе, при энергичной аэрации, непрерывном освещении и стабильной температуре, через 24 ч до 48 ч.
ПРИМЕЧАНИЕ: В качестве альтернативы можно использовать вертикальный инкубатор. - Как только яйца вылупятся, выключите воздушный насос и подождите, пока науплии (движущиеся к нижней части воронки) не отделятся от пустых ящиков для яиц (плавающих наверху).
- Для того чтобы отделить невылупившиеся яйца от живых науплии, откройте выходной кран на дне и выгрузите содержимое воронки в один из контейнеров контейнера для миграционного оборудования ручной работы (описано на этапе 1.2). Убедитесь, что раствор, содержащий науплии и остаточные невылупившиеся яйца, находится ниже уровня трубки. Во второй контейнер добавляют остаточный раствор соли со стадии 2.1 над высотой трубки.
- Накройте контейнер науплиями и остаточными невылупленными яйцами с использованием алюминиевой фольги. Поместите лампу на вторую емкость только с солевым раствором. Рассольные креветки будут притягиваться светом и мигрировать из одного контейнера в другой (контейнер для сбора урожая), что приведет к эффективному разделению между яйцами (медленно осажденными на дно) и живой артемией.
- Затем поместите оборудование в инкубатор в тех же условиях, которые использовались на этапе 4.4 в течение 4 ч (рисунок 2E). Из контейнера для сбора урожая собирают 900 мкл солевого раствора, содержащего от 10 до 15 науплий. Поместите солевой раствор с науплиями в каждую лунку 24-луночной пластины (рисунок 2F); все образцы тестируются в четырех экземплярах.
- Добавьте по 100 мкл к отрицательному контрольному (DMSO), положительному контролю (K2Cr2O7, дихромат калия), искусственному раствору соли и каждому из образцов к соответствующей скважине (рисунок 2F)13,14.
ПРИМЕЧАНИЕ: Пробы в каждой скважине будут находиться в концентрации 0,01 мг/мл. Конечная концентрация положительного контроля в солевом растворе составит 0,1 мг/мл, чтобы быть уверенным, что все науплии в лунке подвергаются токсическому действию дихромата калия и погибают. Раствор искусственной соли будет действовать как пустой. - Инкубируют пластину при 25 ± 3 °C при освещении в течение 24 ч (рисунок 2G). Через 24 ч регистрируют количество погибших личинок (неподвижных науплии за 5 с) в каждой лунке под бинокулярным микроскопом (12х)20 (рисунок 2Н). В качестве альтернативы используйте ручной объектив.
- Добавьте 100 мкл раствора дихромата калия, чтобы вызвать гибель оставшихся живых личинок, и подождите 6 ч. Подсчитайте общее количество мертвых личинок в каждой лунке под микроскопом. Определите коэффициент смертности по следующему уравнению.
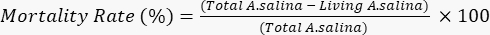
- Выполните все анализы в трех экземплярах. Рассчитайте стандартные отклонения (SD) и выразите результаты как среднее значение трех независимых экспериментов, каждый с внутренними квадрупликатами (n = 12), ± SD. Как упоминалось Мейером и др., считать токсичными сырые экстракты и чистые соединения с ЛК50< 1000 мкг/мл; также учтите, что смертность соленых креветок пропорциональна концентрации испытуемых образцов21.

Рисунок 2: Метод биоанализа летальности Artemia salina. (A) Коммерчески доступное оборудование, используемое для вылупления цист рассола креветок; B) миграционное оборудование ручной работы; с) инкубационный сосуд, заполненный солевым раствором; D) сбор невылупившихся яиц и науплий; E) оборудование ручной работы в инкубаторе на этапе миграции. Контейнер, удаленный от лампы, должен быть покрыт алюминиевой фольгой; однако для лучшего представления о наборе установки здесь он был удален; (F) Сбор артемии в скважинах до проведения анализа. Соединения следует размещать так, как показано: - относится к отрицательному контролю (ДМСО), + к положительному контролю (K2Cr2O7), соль - к искусственному раствору соли и от 1 до 3 к образцам для тестирования (в данном случае соединения 1-3); G) инкубация 24-луночной плиты, содержащей артемию, и отобранных образцов; (H) Количество артемии под бинокулярным микроскопом. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 3: Структуры выбранных соединений. Структура соединений 1-2, экстрагированных из видов Plectranthus , и соединений 3-5, полученных полусинтезом. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Access restricted. Please log in or start a trial to view this content.
Результаты
Общая токсичность некоторых натуральных продуктов, недавно изученных нашей группой, была оценена с помощью биоанализа летальности креветок в рассоле. Четыре экстракта (Pa- P. ambigerus; Pb- P. barbatus; Pc- P. cylindraceus; и Pe- P. ecklonii) из рода Plectranthus, известные своей антиоксидантной ак...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
В последние годы научное сообщество усилило свое внимание к альтернативным моделям скрининга токсичности21. Помимо биоанализа на летальность A. salina, другие методологии обычно выполняются для оценки переносимости образцов и включают биоанализы позвоночных (таких как ?...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Авторы заявляют об отсутствии конфликта интересов, финансовых или иных.
Благодарности
Памяти профессора Амилькара Роберто.
Эта работа была финансово поддержана Фондом социальной и технологической науки (FCT, Португалия) в рамках проектов UIDB/04567/2020 и UIDP/04567/2020, приписываемых CBIOS и гранту PhD SFRH/BD/137671/2018 (Vera Isca).
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| 24-well plates | Thermo Fisher Scientific, Denmark | 174899 | Thermo Scientific Nunc Up Cell 24 multidish |
| Aluminium foil | Albal | - | Can be purchased in supermarket |
| Artemio Set | JBL GmbH and Co. KG, D-67141, Neuhofen Germany | 61066000 | Can be purchased in pet shops |
| Binocular microscope | Ceti, Belgium | 1700.0000 | Flexum-24AED, 220-240 V, 50 Hz |
| Bottles | - | - | 0.5 L Diameter: 5.8 cm; Height: 12 cm |
| Brine shrimp cysts | JBL GmbH and Co. KG, D-67141, Neuhofen Germany | 3090700 | Can be purchased in pet shops |
| Brine shrimp salt | JBL GmbH and Co. KG, D-67141, Neuhofen Germany | 3090600 | Can be purchased in pet shops |
| Dimethyl sulfoxide (DMSO) | VWR chemicals | CAS: 67-68-5 | 99% purity |
| Discartable tips | Diamond | F171500 | Volume range: 100 - 1000 µL |
| Eppendorf microtubes | BRAND | 7,80,546 | Microtubes, PP, 2 mL, BIO-CERT PCR QUALITY |
| Erlenmeyer flask | VWR chemicals | 4,47,109 | volume: 100 mL |
| Glass beaker | Normax | 3.2111654N | Volume: 1000 mL |
| Gloves | Guantes Luna | GLSP3 | - |
| GraphPad Prism | GraphPad Software, San Diego, CA, USA | - | GraphPad Prism version 5.00 for Windows, www.graphpad.com, accessed on 5 February 2021; commercial statistical analysis software |
| Home-made A. salina Grower | - | - | Home made: two plastic bottles connected by a hose |
| Hot glue | Parkside | PHP500E3 | 230 V, 50 Hz, 25 W |
| Incubator | Heidolph Instruments, Denmark | - | One Heidolph Unimax 1010 equipment and one Heidolph Inkubator 1006 |
| Light | Roblan | SKYC3008FE14 | LED light bulb |
| Micropipettes | VWR chemicals | 613-5265 | Volume range: 100 - 1000 µL |
| Potassium dichromate (K2Cr2O7) | VWR chemicals | CAS: 7778-50-9 | 99% purity |
| Pump ProAir a50 | JBL GmbH and Co. KG, D-67141, Neuhofen Germany | - | Included in the Artemio Set+1 kit |
| Rubber tube | - | - | 1.3 cm outer and 0.9 cm inner diameter |
| Stirring rod | VWR chemicals | 441-0147 |  6 mm, 250 mm 6 mm, 250 mm |
| Termometer | VWR chemicals | 620-0821 | 0 - 100 °C |
Ссылки
- Ntungwe, N. E., et al. Artemia species: An important tool to screen general toxicity samples. Current Pharmaceutical Design. 26 (24), 2892-2908 (2020).
- Cragg, G. M., Newman, D. J. Natural products: A continuing source of novel drug leads. Biochimica et Biophysica Acta (BBA) - General Subjects. 1830 (6), 3670-3695 (2013).
- Ntungwe, E., et al. General toxicity screening of Royleanone derivatives using an artemia salina model. Journal Biomedical and Biopharmaceutical Research. 18 (1), 114(2021).
- Seca, A., Plant Pinto, D. secondary metabolites as anticancer agents: Successes in clinical trials and therapeutic application. International Journal of Molecular Sciences. 19 (1), 263(2018).
- Calixto, J. B. The role of natural products in modern drug discovery. Anais da Academia Brasileira de Ciências. 91 (3), 1-7 (2019).
- Mandrell, D., et al. Automated zebrafish chorion removal and single embryo placement: optimizing throughput of zebrafish developmental toxicity screens. Journal of Laboratory Automation. 17 (1), 66-74 (2012).
- Zhang, Y., Mu, J., Han, J., Gu, X. An improved brine shrimp larvae lethality microwell test method. Toxicology Mechanisms and Methods. 22 (1), 23-30 (2012).
- Domínguez-Villegas, V., et al. antioxidant and cytotoxicity activities of methanolic extract and prenylated flavanones isolated from leaves of eysehardtia platycarpa. Natural Product Communications. 8 (2), 177-180 (2013).
- Hamidi, M. R., Jovanova, B., Panovska, T. K. Toxicological evaluation of the plant products using Brine Shrimp (Artemia salina L.) model. Macedonian Pharmaceutical Bulletin. 60 (01), 9-18 (2014).
- Libralato, G., Prato, E., Migliore, L., Cicero, A. M., Manfra, L. A review of toxicity testing protocols and endpoints with Artemia spp. Ecological Indicators. 69, 35-49 (2016).
- Mendes Hacke, A. C., et al. Cytotoxicity of cymbopogon citratus (DC) Stapf fractions, essential oil, citral, and geraniol in human leukocytes and erythrocytes. Journal of Ethnopharmacology. 291, 115147(2022).
- Thangapandi, V., Pushpanathan, T. Comparison of the Artemia salina and Artemia fransiscana bioassays for toxicity of Indian medicinal plants. Journal of Coastal Life Medicine. 2 (6), 453-457 (2014).
- Syahmi, A. R. M., et al. Acute oral toxicity and brine shrimp lethality of Elaeis guineensis Jacq., (Oil Palm Leaf) methanol extract. Molecules. 15 (11), 8111-8121 (2010).
- Sasidharan, S., et al. Acute toxicity impacts of Euphorbia hirta L extract on behavior, organs body weight index and histopathology of organs of the mice and Artemia salina. Pharmacognosy Research. 4 (3), 170(2012).
- Libralato, G. The case of Artemia spp. in nanoecotoxicology. Marine Environmental Research. 101, 38-43 (2014).
- Okumu, M. O., et al. Artemia salina as an animal model for the preliminary evaluation of snake venom-induced toxicity. Toxicon: X. 12, 100082(2021).
- Rajabi, S., Ramazani, A., Hamidi, M., Naji, T. Artemia salina as a model organism in toxicity assessment of nanoparticles. DARU Journal of Pharmaceutical Sciences. 23 (1), 20(2015).
- Svensson, B. -M., Mathiasson, L., Mårtensson, L., Bergström, S. Artemia salina as test organism for assessment of acute toxicity of leachate water from landfills. Environmental Monitoring and Assessment. 102 (1), 309-321 (2005).
- Banti, C., Hadjikakou, S. Evaluation of toxicity with brine shrimp assay. Bio-Protocol. 11 (2), 3895(2021).
- Pecoraro, R., et al. Artemia salina: A microcrustacean to assess engineered nanoparticles toxicity. Microscopy Research and Technique. 84 (3), 531-536 (2021).
- Lillicrap, A., et al. Alternative approaches to vertebrate ecotoxicity tests in the 21st century: A review of developments over the last 2 decades and current status. Environmental Toxicology and Chemistry. 35 (11), 2637-2646 (2016).
- Ribeiro, I. C., et al. Yeasts as a model for assessing the toxicity of the fungicides Penconazol, Cymoxanil and Dichlofulanid. Chemosphere. (10), 1637-1642 (2000).
- Armour, C. D., Lum, P. Y. From drug to protein: using yeast genetics for high-throughput target discovery. Current Opinion in Chemical Biology. 9 (1), 20-24 (2005).
- Modarresi Chahardehi, A., Arsad, H., Lim, V. Zebrafish as a successful animal model for screening toxicity of medicinal plants. Plants. 9 (10), 1345(2020).
- Fischer, I., Milton, C., Wallace, H. Toxicity testing is evolving. Toxicology Research. 9 (2), 67-80 (2020).
- de Araújo, G. L., et al. Alternative methods in toxicity testing: the current approach. Brazilian Journal of Pharmaceutical Sciences. 50 (1), 55-62 (2014).
- Toussaint, M., et al. A high-throughput method to measure the sensitivity of yeast cells to genotoxic agents in liquid cultures. Mutation Research/Genetic Toxicology and Environmental Mutagenesis. 606 (1), 92-105 (2006).
- Horzmann, K. A., Freeman, J. L. Making waves: New developments in toxicology with the zebrafish. Toxicological Sciences. 163 (1), 5-12 (2018).
- Avdesh, A., et al. Regular care and maintenance of a zebrafish (Danio rerio) laboratory: An introduction. Journal of Visualized Experiments. (69), e4196(2012).
- Cunliffe, V. T. Zebrafish: A Practical Approach. Nüsslein-Volhard, C., Dahm, R. , Oxford University Press. (2002).
- Sitarek, P., et al. Insight the biological activities of selected Abietane Diterpenes isolated from Plectranthus spp. Biomolecules. 10 (2), 194(2020).
- Matias, D., et al. Cytotoxic activity of Royleanone Diterpenes from Plectranthus madagascariensis Benth. ACS Omega. 4 (5), 8094-8103 (2019).
- Garcia, C., et al. Royleanone derivatives from Plectranthus spp. as a novel class of P-glycoprotein inhibitors. Frontiers in Pharmacology. 11, (2020).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены