JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
아르테미아 살리나 L을 사용한 치사율 생물학적 분석법
* 이 저자들은 동등하게 기여했습니다
요약
이 작업은 소금물 새우 치사 분석으로도 확인된 Artemia salina 치사율 생물학적 분석 절차를 평가하고 검토하는 것을 목표로 합니다. 이 간단하고 저렴한 방법은 샘플, 즉 천연물의 일반적인 독성 (예비 독성 평가로 간주 됨)에 대한 정보를 제공합니다.
초록
천연물은 고대부터 의약품을 생산하는 데 사용되어 왔습니다. 요즘에는 천연 자원에서 얻은 화학 요법 약물이 많이 있으며 과다한 질병에 사용됩니다. 불행히도, 이러한 화합물의 대부분은 종종 전신 독성 및 부작용을 나타냅니다. 선택된 잠재적 생리활성 샘플의 내약성을 더 잘 평가하기 위해, 염수 새우(Artemia salina)는 일반적으로 치사율 연구의 모델로서 사용된다. A. salina 테스트는 연구 된 생리 활성 화합물이 애벌레 단계 (nauplii)에서 미세 갑각류를 죽이는 능력을 기반으로합니다. 이 방법은 세포 독성 연구뿐만 아니라 합성, 반합성 및 천연 제품의 일반적인 독성 스크리닝을위한 편리한 출발점을 나타냅니다. 일반적으로 전술한 목적에 적합한 다른 많은 분석(시험관 내 세포 또는 효모 균주, 제브라피쉬, 설치류)과 비교하여 간단하고 빠르며 저렴한 분석으로 간주될 수 있습니다. 또한 특별한 교육 없이도 쉽게 수행 할 수 있습니다. 전반적으로, A. salina 분석은 선택된 화합물의 예비 독성 평가 및 천연 제품 추출물의 바이오 유도 분획화에 유용한 도구를 나타낸다.
서문
식물, 동물 또는 미생물의 천연물은 다양한 생물학적 및 약리학적 활성으로 인해 새로운생리 활성 분자의 개발에서 수년 동안 관심이 증가하고 있습니다1. 그러나 관련 부작용, 약물 내성 또는 약제의 부적절한 특이성은 특히 항암제로 사용될 때 비효율적인 치료 1,2로 이어질 수 있는 주요 요인을 나타냅니다.
지난 수십 년 동안 여러 식물 유래 세포 독성 제제가 발견되었으며 그 중 일부는 항암제 1,2,3으로 사용되었습니다. 이러한 맥락에서 파클리탁셀은 천연 기원의 가장 잘 알려져 있고 가장 활동적인 화학 요법 약물 중 하나로보고됩니다 3,4. 현재 시장에 나와있는 모든 의약품의 35 % 이상이 천연 제품에서 파생되거나 천연 제품에서 영감을 얻은 것으로 추정됩니다5. 이러한 화합물의 잠재적 인 높은 독성은 다양한 유형의 오염 물질 또는 식물 자체의 대사 성분이 독성 영향을 일으킬 수 있기 때문에 모든 연구 단계에서 고려해야합니다. 이러한 이유로 새로운 잠재적 식물 기반 치료의 생물학적 활성과 안전성을 평가하기 위해 예비 단계에서 약리학 적 및 독성 학적 프로파일을 수행해야합니다. 새로운 생리 활성 샘플의 독성을 평가하기 위해 무척추 동물을 연구하기에 가장 좋은 모델로 간주 할 수 있습니다. 그들은 최소한의 윤리적 요구 사항을 요구하고 예비 체외 분석을 허용하여 척추 동물 1,6의 다음 테스트 라운드에서 가장 유망한 제품의 우선 순위를 지정합니다.
일반적으로 소금물 새우로 알려진 A. salina는 Artemia 속에 속하는 작은 호 염성 무척추 동물입니다 (가족 Artemiidae, 주문 Anostraca, 아문 갑각류; 그림 1). 해양 및 수생 식염수 생태계에서 소금물 새우는 미세 조류를 먹고 물고기에게 먹이를주는 데 사용되는 동물성 플랑크톤의 구성 요소이기 때문에 중요한 영양 역할을합니다. 또한, 그들의 유충 (nauplii로 알려짐)은 예비 연구 1,3,7 동안 일반적인 독성 평가에 널리 사용됩니다.
Artemia spp.는 치사율 연구에 널리 사용되며 실험실 1,8에서 자란 nauplii를 죽이는 능력을 기반으로 잠재적으로 생리 활성 화합물의 독성을 추적하여 독성 평가를위한 편리한 출발점이기도합니다. 이러한 이유로 A. salina의 사용은 동물 모델9에 대한 다른 테스트에 비해 매우 효율적이고 사용하기 쉬운 방법이기 때문에 일반적인 독성 연구에서 매력을 얻었습니다.
간단한 해부학, 작은 크기 및 짧은 수명주기로 인해 한 번의 실험으로 수많은 무척추 동물을 연구 할 수 있습니다. 따라서 유전적 순응성과 저비용 호환성을 대규모 스크리닝과결합합니다1. 이러한 맥락에서 일반적인 독성 분석에서 염수 새우를 사용하면 빠른 성장 (부화에서 첫 번째 결과까지 28-72 시간 필요), 비용 효율성 및 상업용 계란의 긴 유통 기한과 같은 몇 가지 이점이 있습니다., 일년 내내 사용할 수있는 3,10. 반면에 무척추 동물은 원시 장기 시스템을 가지고 있고 적응 면역 체계가 없기 때문에 인간 세포에 대한 완벽하고 신뢰할 수있는 모델을 나타내지 않습니다1.
그러나, 선택된 샘플의 일반적인 독성에 대한 예비 평가 방법을 제공한다. 치사율 분석으로 널리 사용되기 때문에 잠재적인 항암제의 독성 효과에 대한 잠정적 징후를 제공할 수 있습니다. 또한 Artemia 새우 중에서 가능한 가장 낮은 사망률을 나타내는 것이 필수적인 다른 생물학적 활동이 부여 된 화합물의 일반적인 독성에 대한 피드백을 얻는 데에도 종종 사용됩니다.
우리 그룹의 진행중인 연구에서 Plectranthus 종의 다른 추출물은 항산화 및 항균 활성을 보여주었습니다 (미공개 결과). 병행하여, 분리 된 화합물을 추출물의 정제에 의해 수득 한 다음, 화학적으로 변형 하였다. 추출물, 순수 화합물 및 반합성 유도체를 일반적인 독성 측면에서 테스트했습니다. 이러한 맥락에서, 본 연구는 Plectranthus11 속의 다른 식물에서 생리 활성 추출물 및 분리 된 화합물의 일반적인 독성 및 잠재적 세포 독성 활성의 평가를위한 Artemia 치사 생물학적 분석법의 사용에 대한 개요를 제공하는 것을 목표로합니다.

그림 1: 현미경으로 본 아르테미아 살리나 . 현미경으로 본 A. salina 의 새로 부화 된 nauplii (배율 12x). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
Access restricted. Please log in or start a trial to view this content.
프로토콜
1. 장비 준비
- 상업적으로 이용 가능한 해칭 장비를 구입하십시오. 해칭 장비를 설치할 적절한 장소를 선택하십시오(그림 2A). 깔때기 모양의 용기를 검은색 지지대(세트에 포함)에 놓고 깔때기를 적절한 방향으로 돌려 레벨 표시와 탭을 확인합니다.
- 손으로 만든 마이그레이션 장비를 만들려면 두 개의 0.5L (직경 5.8cm) 플라스틱 병의 상단을 잘라 최종 높이 12cm를 얻으십시오. 각 병의 바닥에서 7cm에서 한쪽에 직경 1.5cm의 구멍을 만들고 두 구멍 사이에 13cm 고무 튜브 (외부 1.3cm, 내경 0.9cm)를 삽입합니다. 뜨거운 접착제 (그림 2B)로 개구부를 밀봉하고 15 분 동안 건조시킵니다. 병을 평평한 표면에 놓고 물로 채워 누출이 없는지 확인하십시오.
2. 인공 염 용액의 제조
- 유리 비커에서 35g/L 농도의 인공 소금 용액(소금물 새우 소금)을 준비합니다. 이렇게하려면 제조업체의 지침에 따라 수돗물 800mL에 소금 28g을 넣으십시오. 모든 소금이 완전히 녹을 때까지 교반 막대와 섞는다.
알림: 사용 가능한 용기의 크기에 따라 준비된 식염수의 부피를 조정하십시오.
3. 샘플 준비
- 모든 시료를 미세원심분리 튜브에 적절한 양의 추출물(플렉트란서 스 추출물, Pa-P. ambigerus; Pb- P. 바바투스; Pc-P. cylindraceus ; 및 Pe-P. ecklonii) 또는 화합물 1-5 ( Plectranthus spp.로부터 수득되는 2개의 천연 화합물 [1 및 2] 및 3개의 반합성 유도체 [3, 4, 5]; 그림 3) 디메틸 설폭 사이드 (DMSO)12에서 최종 농도 10mg / mL를 얻습니다 (샘플이 수용성 인 경우 DMSO를 사용할 필요가 없음).
- 단계 2.1에서 제조된 990μL의 인공 식염수를 사용하여 새로운 미세 원심분리 튜브에서 각 시료(음성 대조군의 경우 DMSO) 10μL를 희석하여 최종 농도 0.1mg/mL를 얻습니다.
- 흄 후드 아래에서, 삼각 플라스크에서, 1 mg/mL13,14,15 농도의 증류수에 중크롬산칼륨(K2Cr2O7) 용액을 준비한다.
4. 소금물 새우 치사율 생물학적 분석
참고 :이 분석은 수정된 여러 저자의 작업에서 개발되었습니다 1,16,17,18,19.
- 2.1단계에서 준비한 배지를 레벨 표시(500mL)까지 부화 용기에 채웁니다(그림 2C).
- 소금물 새우 낭종 한 스푼 (약 0.75g)을 소금 용액에 넣은 다음 용기를 닫습니다. 램프(테이블 램프, 40W, 230V, 50Hz, LED 전구 8W, 4,000K, 830lm)를 장비(그림 2A)를 직접 가리키도록 놓고 켭니다.
- 공기 공급 시스템(3W 출력, 50Hz, 230V)을 장비 상단에 있는 커넥터에 연결하고 펌프를 켭니다.
- 실내 온도를 25 ± 3 °C로 유지하십시오. 소금물 새우 낭종은 인공 소금 용액에서 격렬한 통기, 지속적인 조명 및 안정적인 온도 하에서 24 시간에서 48 시간 후에 부화합니다.
알림: 또는 수직 인큐베이터를 사용할 수 있습니다. - 알이 부화하면 공기 펌프를 끄고 노플리(깔때기 아래쪽으로 이동)가 빈 알 케이스(상단에 떠 있음)에서 분리될 때까지 기다립니다.
- 부화되지 않은 알을 살아있는 nauplii에서 분리하려면 바닥의 배출구 탭을 열고 깔때기의 내용물을 수제 마이그레이션 장비 컨테이너의 컨테이너 중 하나에 배출하십시오 (1.2 단계에서 설명). nauplii와 잔여 부화되지 않은 계란이 들어있는 용액이 튜브 높이보다 낮은지 확인하십시오. 두 번째 용기에 2.1 단계의 잔류 염 용액을 튜브 높이 위에 놓습니다.
- 알루미늄 호일을 사용하여 nauplii와 나머지 부화되지 않은 계란으로 용기를 덮으십시오. 소금 용액만으로 두 번째 용기에 램프를 놓습니다. 소금물 새우는 빛에 끌려 한 용기에서 다른 용기 (수확 용기)로 이동하여 계란 (천천히 바닥으로 침전됨)과 살아있는 Artemia 사이의 효율적인 분리로 이어집니다.
- 그런 다음 4.4 단계에서 사용 된 것과 동일한 조건에서 장비를 4 시간 동안 인큐베이터에 놓습니다 (그림 2E). 수확 용기로부터 10 내지 15 노플리를 함유하는 900 μL의 식염수를 수집한다. 생리식염수와 함께 노플리를 24-웰 플레이트의 각 웰에 놓는다(도 2F); 모든 샘플은 사중 증식으로 테스트됩니다.
- 음성 대조군(DMSO), 양성 대조군(K2Cr2O7, 중크롬산칼륨),인공 염 용액 및각각의 샘플을 각각 웰에 각각 100 μL씩 추가합니다(그림 2F)13,14.
알림: 각 웰의 샘플은 0.01 mg / mL의 농도입니다. 소금 용액에서 양성 대조군의 최종 농도는 0.1mg/mL로, 우물의 모든 노플리가 중크롬산칼륨의 독성 효과에 노출되어 죽는지 확인합니다. 인공 염 용액은 공백으로 작용합니다. - 플레이트를 조명 하에서 25 ± 3°C에서 24시간 동안 배양합니다(그림 2G). 24 시간 후, 쌍안 현미경 (12x) 20 (그림 2H)으로 각 웰에서 죽은 유충 수 (5 초 동안 비 이동성 nauplii)를 등록합니다. 또는 핸드 렌즈를 사용하십시오.
- 중크롬산 칼륨 용액 100μL를 첨가하여 나머지 살아있는 유충의 죽음을 유도하고 6 시간 동안 기다립니다. 현미경으로 각 우물의 총 죽은 유충을 세십시오. 다음 방정식에 따라 사망률을 결정하십시오.
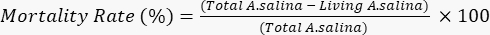
- 모든 분석을 삼중으로 수행하십시오. 표준 편차(SD)를 계산하고 결과를 각각 내부 사중(n = 12)이 있는 3개의 독립적인 실험의 평균± SD로 표현합니다. Meyer et al.이 언급했듯이 LC50< 1,000 μg / mL의 원유 추출물과 순수 화합물을 독성으로 간주하십시오. 또한, 염수 새우의 폐사율은 시험 된 샘플(21)의 농도에 비례한다는 것을 고려한다.

그림 2: 아르테미아 살리나 치사 생물학적 분석 방법. (A) 염수 새우 낭종의 부화에 사용되는 상업적으로 이용 가능한 장비; (B) 손으로 만든 마이그레이션 장비; (c) 식염수로 채워진 부화 용기; (D) 부화되지 않은 알과 노플리의 수집; (E) 마이그레이션 단계 동안 인큐베이터의 수제 장비. 램프에서 멀리 떨어진 용기는 알루미늄 호일로 덮어야합니다. 그러나 세트 설치를 더 잘 볼 수 있도록 여기에서 제거되었습니다. (F) 분석을 수행하기 전에 우물에서 아르테미아 수확. 화합물은 다음과 같이 배치되어야 한다: - 음성 대조군 (DMSO)을 지칭하고, 양성 대조군 (K2Cr2O7)에+, 인공 염 용액에 염, 및 시험할 샘플에 1 내지 3 (이 경우 화합물 1 내지 3); (g) 선택된 샘플을 포함하는 24-웰 플레이트의 인큐베이션; (H) 쌍안 현미경으로 아르테미아 수. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 선택된 화합물의 구조. Plectranthus 종에서 추출한 화합물 1-2 및 반 합성으로 얻은 화합물 3-5의 구조. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
Access restricted. Please log in or start a trial to view this content.
결과
우리 그룹이 최근에 연구 한 일부 천연물의 일반적인 독성은 소금물 새우 치사율 생물학적 분석을 통해 평가되었습니다. 4개의 추출물( Pa-P. ambigerus; Pb- P. 바바투스; Pc- P. 원통형; 및 Pe- P. ecklonii)의 항산화 활성으로 알려진 Plectranthus 속의 (미공개 결과)를 테스트했습니다. 추가적으로, Plectranthus spp.로부터 얻은 2 개의 천연 화합물 (1 및 2) 및 3 개의 반합성 유?...
Access restricted. Please log in or start a trial to view this content.
토론
지난 몇 년 동안 과학계는 독성 스크리닝을위한 대체 모델에 대한 관심을 증가 시켰습니다21. A. salina 치사성 생물학적 분석 외에도 샘플 내약성 평가를 위해 다른 방법론이 일반적으로 수행되며 척추 동물 생물 분석 (예 : 설치류), 무척추 동물 (예 : 제브라 피쉬), 효모 균주 또는 세포를 사용하는 시험관 내 방법 및 인실리코 방법22,23,24,25...
Access restricted. Please log in or start a trial to view this content.
공개
저자는 재정적 또는 기타 이해 상충을 선언하지 않습니다.
감사의 말
아밀카르 로베르토 교수를 추모합니다.
이 작업은 CBIOS 및 박사 보조금 SFRH/BD/137671/2018(Vera Isca)에 기인하는 UIDB/04567/2020 및 UIDP/04567/2020 프로젝트에 따라 Fundação para a Ciência e a Tecnologia (FCT, 포르투갈)에 의해 재정적으로 지원되었습니다.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| 24-well plates | Thermo Fisher Scientific, Denmark | 174899 | Thermo Scientific Nunc Up Cell 24 multidish |
| Aluminium foil | Albal | - | Can be purchased in supermarket |
| Artemio Set | JBL GmbH and Co. KG, D-67141, Neuhofen Germany | 61066000 | Can be purchased in pet shops |
| Binocular microscope | Ceti, Belgium | 1700.0000 | Flexum-24AED, 220-240 V, 50 Hz |
| Bottles | - | - | 0.5 L Diameter: 5.8 cm; Height: 12 cm |
| Brine shrimp cysts | JBL GmbH and Co. KG, D-67141, Neuhofen Germany | 3090700 | Can be purchased in pet shops |
| Brine shrimp salt | JBL GmbH and Co. KG, D-67141, Neuhofen Germany | 3090600 | Can be purchased in pet shops |
| Dimethyl sulfoxide (DMSO) | VWR chemicals | CAS: 67-68-5 | 99% purity |
| Discartable tips | Diamond | F171500 | Volume range: 100 - 1000 µL |
| Eppendorf microtubes | BRAND | 7,80,546 | Microtubes, PP, 2 mL, BIO-CERT PCR QUALITY |
| Erlenmeyer flask | VWR chemicals | 4,47,109 | volume: 100 mL |
| Glass beaker | Normax | 3.2111654N | Volume: 1000 mL |
| Gloves | Guantes Luna | GLSP3 | - |
| GraphPad Prism | GraphPad Software, San Diego, CA, USA | - | GraphPad Prism version 5.00 for Windows, www.graphpad.com, accessed on 5 February 2021; commercial statistical analysis software |
| Home-made A. salina Grower | - | - | Home made: two plastic bottles connected by a hose |
| Hot glue | Parkside | PHP500E3 | 230 V, 50 Hz, 25 W |
| Incubator | Heidolph Instruments, Denmark | - | One Heidolph Unimax 1010 equipment and one Heidolph Inkubator 1006 |
| Light | Roblan | SKYC3008FE14 | LED light bulb |
| Micropipettes | VWR chemicals | 613-5265 | Volume range: 100 - 1000 µL |
| Potassium dichromate (K2Cr2O7) | VWR chemicals | CAS: 7778-50-9 | 99% purity |
| Pump ProAir a50 | JBL GmbH and Co. KG, D-67141, Neuhofen Germany | - | Included in the Artemio Set+1 kit |
| Rubber tube | - | - | 1.3 cm outer and 0.9 cm inner diameter |
| Stirring rod | VWR chemicals | 441-0147 |  6 mm, 250 mm 6 mm, 250 mm |
| Termometer | VWR chemicals | 620-0821 | 0 - 100 °C |
참고문헌
- Ntungwe, N. E., et al. Artemia species: An important tool to screen general toxicity samples. Current Pharmaceutical Design. 26 (24), 2892-2908 (2020).
- Cragg, G. M., Newman, D. J. Natural products: A continuing source of novel drug leads. Biochimica et Biophysica Acta (BBA) - General Subjects. 1830 (6), 3670-3695 (2013).
- Ntungwe, E., et al. General toxicity screening of Royleanone derivatives using an artemia salina model. Journal Biomedical and Biopharmaceutical Research. 18 (1), 114(2021).
- Seca, A., Plant Pinto, D. secondary metabolites as anticancer agents: Successes in clinical trials and therapeutic application. International Journal of Molecular Sciences. 19 (1), 263(2018).
- Calixto, J. B. The role of natural products in modern drug discovery. Anais da Academia Brasileira de Ciências. 91 (3), 1-7 (2019).
- Mandrell, D., et al. Automated zebrafish chorion removal and single embryo placement: optimizing throughput of zebrafish developmental toxicity screens. Journal of Laboratory Automation. 17 (1), 66-74 (2012).
- Zhang, Y., Mu, J., Han, J., Gu, X. An improved brine shrimp larvae lethality microwell test method. Toxicology Mechanisms and Methods. 22 (1), 23-30 (2012).
- Domínguez-Villegas, V., et al. antioxidant and cytotoxicity activities of methanolic extract and prenylated flavanones isolated from leaves of eysehardtia platycarpa. Natural Product Communications. 8 (2), 177-180 (2013).
- Hamidi, M. R., Jovanova, B., Panovska, T. K. Toxicological evaluation of the plant products using Brine Shrimp (Artemia salina L.) model. Macedonian Pharmaceutical Bulletin. 60 (01), 9-18 (2014).
- Libralato, G., Prato, E., Migliore, L., Cicero, A. M., Manfra, L. A review of toxicity testing protocols and endpoints with Artemia spp. Ecological Indicators. 69, 35-49 (2016).
- Mendes Hacke, A. C., et al. Cytotoxicity of cymbopogon citratus (DC) Stapf fractions, essential oil, citral, and geraniol in human leukocytes and erythrocytes. Journal of Ethnopharmacology. 291, 115147(2022).
- Thangapandi, V., Pushpanathan, T. Comparison of the Artemia salina and Artemia fransiscana bioassays for toxicity of Indian medicinal plants. Journal of Coastal Life Medicine. 2 (6), 453-457 (2014).
- Syahmi, A. R. M., et al. Acute oral toxicity and brine shrimp lethality of Elaeis guineensis Jacq., (Oil Palm Leaf) methanol extract. Molecules. 15 (11), 8111-8121 (2010).
- Sasidharan, S., et al. Acute toxicity impacts of Euphorbia hirta L extract on behavior, organs body weight index and histopathology of organs of the mice and Artemia salina. Pharmacognosy Research. 4 (3), 170(2012).
- Libralato, G. The case of Artemia spp. in nanoecotoxicology. Marine Environmental Research. 101, 38-43 (2014).
- Okumu, M. O., et al. Artemia salina as an animal model for the preliminary evaluation of snake venom-induced toxicity. Toxicon: X. 12, 100082(2021).
- Rajabi, S., Ramazani, A., Hamidi, M., Naji, T. Artemia salina as a model organism in toxicity assessment of nanoparticles. DARU Journal of Pharmaceutical Sciences. 23 (1), 20(2015).
- Svensson, B. -M., Mathiasson, L., Mårtensson, L., Bergström, S. Artemia salina as test organism for assessment of acute toxicity of leachate water from landfills. Environmental Monitoring and Assessment. 102 (1), 309-321 (2005).
- Banti, C., Hadjikakou, S. Evaluation of toxicity with brine shrimp assay. Bio-Protocol. 11 (2), 3895(2021).
- Pecoraro, R., et al. Artemia salina: A microcrustacean to assess engineered nanoparticles toxicity. Microscopy Research and Technique. 84 (3), 531-536 (2021).
- Lillicrap, A., et al. Alternative approaches to vertebrate ecotoxicity tests in the 21st century: A review of developments over the last 2 decades and current status. Environmental Toxicology and Chemistry. 35 (11), 2637-2646 (2016).
- Ribeiro, I. C., et al. Yeasts as a model for assessing the toxicity of the fungicides Penconazol, Cymoxanil and Dichlofulanid. Chemosphere. (10), 1637-1642 (2000).
- Armour, C. D., Lum, P. Y. From drug to protein: using yeast genetics for high-throughput target discovery. Current Opinion in Chemical Biology. 9 (1), 20-24 (2005).
- Modarresi Chahardehi, A., Arsad, H., Lim, V. Zebrafish as a successful animal model for screening toxicity of medicinal plants. Plants. 9 (10), 1345(2020).
- Fischer, I., Milton, C., Wallace, H. Toxicity testing is evolving. Toxicology Research. 9 (2), 67-80 (2020).
- de Araújo, G. L., et al. Alternative methods in toxicity testing: the current approach. Brazilian Journal of Pharmaceutical Sciences. 50 (1), 55-62 (2014).
- Toussaint, M., et al. A high-throughput method to measure the sensitivity of yeast cells to genotoxic agents in liquid cultures. Mutation Research/Genetic Toxicology and Environmental Mutagenesis. 606 (1), 92-105 (2006).
- Horzmann, K. A., Freeman, J. L. Making waves: New developments in toxicology with the zebrafish. Toxicological Sciences. 163 (1), 5-12 (2018).
- Avdesh, A., et al. Regular care and maintenance of a zebrafish (Danio rerio) laboratory: An introduction. Journal of Visualized Experiments. (69), e4196(2012).
- Cunliffe, V. T. Zebrafish: A Practical Approach. Nüsslein-Volhard, C., Dahm, R. , Oxford University Press. (2002).
- Sitarek, P., et al. Insight the biological activities of selected Abietane Diterpenes isolated from Plectranthus spp. Biomolecules. 10 (2), 194(2020).
- Matias, D., et al. Cytotoxic activity of Royleanone Diterpenes from Plectranthus madagascariensis Benth. ACS Omega. 4 (5), 8094-8103 (2019).
- Garcia, C., et al. Royleanone derivatives from Plectranthus spp. as a novel class of P-glycoprotein inhibitors. Frontiers in Pharmacology. 11, (2020).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유