A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
קטלניות ביואסאי באמצעות ארטמיה סלינה L.
* These authors contributed equally
In This Article
Summary
עבודה זו נועדה להעריך ולסקור את הליך הבדיקה הביולוגית של Artemia salina קטלניות, המזוהה גם כבדיקת קטלניות של שרימפס מלח. שיטה פשוטה וזולה זו נותנת מידע על הרעילות הכללית (הנחשבת להערכת רעילות ראשונית) של דגימות, כלומר, מוצרים טבעיים.
Abstract
מוצרים טבעיים שימשו מאז ימי קדם לייצור תרופות. כיום, יש שפע של תרופות כימותרפיות המתקבלות ממקורות טבעיים ומשמשות נגד שפע של מחלות. למרבה הצער, רוב התרכובות הללו מציגות לעתים קרובות רעילות מערכתית ותופעות לוואי. על מנת להעריך טוב יותר את הסבילות של דגימות נבחרות שעשויות להיות פעילות ביולוגית, שרימפס תמלחת (Artemia salina) משמש בדרך כלל כמודל במחקרי קטלניות. מבחן A. salina מבוסס על היכולת של התרכובות הביו-אקטיביות שנחקרו להרוג את המיקרו-סרטנים בשלב הזחל שלהם (nauplii). שיטה זו מהווה נקודת התחלה נוחה למחקרי ציטוטוקסיות, כמו גם לבדיקת רעילות כללית של מוצרים סינתטיים, סמי-סינתטיים וטבעיים. זה יכול להיחשב בדיקה פשוטה, מהירה, ובעלות נמוכה, בהשוואה למבחנים רבים אחרים (תאי מבחנה או זני שמרים, דגי זברה, מכרסמים) המתאימים בדרך כלל למטרות הנ"ל; יתר על כן, זה יכול להתבצע בקלות גם ללא כל הכשרה ספציפית. באופן כללי, בדיקת A. salina מייצגת כלי שימושי להערכת רעילות ראשונית של תרכובות נבחרות ולפיצול מונחה ביולוגית של תמציות מוצרים טבעיים.
Introduction
מוצרים טבעיים מצמחים, בעלי חיים או מיקרואורגניזמים היו תחום עניין הולך וגדל לאורך השנים בפיתוח מולקולות ביו-אקטיביות חדשות בגלל מגוון הפעילויות הביולוגיות והפרמקולוגיות שלהם1. עם זאת, תופעות הלוואי הקשורות, עמידות לתרופות או ספציפיות לא מספקת של הסוכנים, במיוחד כאשר הם משמשים כתרופות נגד סרטן, מייצגים את הגורמים העיקריים שיכולים להוביל לטיפול לא יעיל 1,2.
במהלך העשורים האחרונים התגלו מספר חומרים ציטוטוקסיים ממקור צמחי, חלקם משמשים כחומרים אנטי-סרטניים 1,2,3. בהקשר זה, פקליטקסל מדווחת כאחת התרופות הכימותרפיות הידועות והפעילות ביותר ממוצא טבעי 3,4. נכון לעכשיו, ההערכה היא כי יותר מ -35% מכלל התרופות בשוק נגזרות או שואבות השראה ממוצרים טבעיים5. הרעילות הגבוהה הפוטנציאלית של תרכובות אלה דורשת התחשבות במהלך כל שלבי המחקר, שכן סוגים שונים של מזהמים או אפילו רכיבים מטבוליים של הצמח עצמו יכולים לגרום להשפעות רעילות. מסיבה זו, פרופילים פרמקולוגיים וטוקסיקולוגיים צריכים להתבצע בשלב הראשוני, כדי להעריך את הפעילות הביולוגית והבטיחות של טיפולים פוטנציאליים חדשים מבוססי צמחים. כדי להעריך את הרעילות של דגימות ביו-אקטיביות חדשות, בעלי חיים חסרי חוליות יכולים להיחשב כמודלים הטובים ביותר לחקור. הם דורשים דרישות אתיות מינימליות ומאפשרים בדיקות מבחנה ראשוניות, כדי לתעדף את המוצרים המבטיחים ביותר לסבב הבדיקות הבא בבעלי חוליות 1,6.
A. salina, הידוע בכינויו שרימפס מלח, הוא חסר חוליות הלופילי קטן השייך לסוג ארטמיה (משפחה Artemiidae, סדר אנוסטרקה, תת-גוף סרטנאים; איור 1). במערכות אקולוגיות של מלחים ימיים ומימיים, חסילוני מלח ממלאים תפקיד תזונתי חשוב מכיוון שהם ניזונים ממיקרו-אצות והם מרכיבים של הזואופלנקטון המשמש להזנת דגים. יתר על כן, הזחלים שלהם (הידועים בשם nauplii) נמצאים בשימוש נרחב בהערכת רעילות כללית במהלך מחקרים ראשוניים 1,3,7.
Artemia spp. נמצאים בשימוש נרחב במחקרי קטלניות והם גם נקודת מוצא נוחה להערכות רעילות, על ידי מעקב אחר הרעילות של תרכובות בעלות פוטנציאל ביו-אקטיבי בהתבסס על יכולתן להרוג נאופליי שגדלו במעבדה 1,8. מסיבה זו, השימוש ב- A. salina צבר משיכה במחקרי רעילות כלליים, מכיוון שמדובר בשיטה יעילה מאוד וקלה לשימוש, בהשוואה לניסויים אחרים במודלים של בעלי חיים9.
הודות לאנטומיה הפשוטה שלהם, גודלם הזעיר ומחזור החיים הקצר שלהם, ניתן לחקור מספר עצום של חסרי חוליות בניסוי אחד. ככאלה, הם משלבים נוחות גנטית ותאימות בעלות נמוכה עם הקרנות בקנה מידה גדול1. בהקשר זה, השימוש בשרימפס תמלחת בבדיקת רעילות כללית מראה מספר יתרונות, כגון צמיחה מהירה (28-72 שעות נדרשות מהבקיעה ועד התוצאות הראשונות), עלות-תועלת וחיי מדף ארוכים של ביצים מסחריות, שניתן להשתמש בהן כל השנה 3,10. מאידך גיסא, מכיוון שלחסרי חוליות יש מערכת איברים פרימיטיבית ואין להם מערכת חיסון נרכשת, הם אינם מייצגים מודל מושלם ואמין לתאים אנושיים1.
עם זאת, הוא מספק שיטת הערכה ראשונית לרעילות הכללית של דגימות נבחרות. מאז זה נמצא בשימוש נרחב כמבחן קטלני, זה יכול לספק אינדיקציות זמניות על ההשפעות הרעילות של סוכנים אנטי סרטניים פוטנציאליים. זה משמש לעתים קרובות גם כדי לקבל משוב על הרעילות הכללית של תרכובות ניחן בכל פעילויות ביולוגיות אחרות שעבורן חיוני כדי להראות את שיעור התמותה הנמוך ביותר האפשרי בקרב שרימפס ארטמיה .
במחקר מתמשך מהקבוצה שלנו, תמציות שונות מזני Plectranthus הראו פעילות נוגדת חמצון ואנטי-בקטריאלית (תוצאות שלא פורסמו). במקביל, תרכובות מבודדות התקבלו על ידי טיהור של תמציות ולאחר מכן שונה כימית. התמציות, התרכובות הטהורות והנגזרות הסמי-סינתטיות נבדקו לאחר מכן במונחים של רעילות כללית. בהקשר זה, העבודה הנוכחית שואפת לתת סקירה כללית של השימוש ב- Artemia lethality bioassay להערכת רעילות כללית ופעילות ציטוטוקסית פוטנציאלית של תמציות ביו-אקטיביות ותרכובות מבודדות מצמחים שונים של הסוג Plectranthus11.

איור 1: ארטמיה סלינה מתחת למיקרוסקופ. נאופליי שזה עתה בקע של A. salina כפי שנראה מתחת למיקרוסקופ (הגדלה 12x). אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
Access restricted. Please log in or start a trial to view this content.
Protocol
1. הכנת ציוד
- רכשו ציוד בקיעה זמין מסחרית. בחר מקום מתאים להגדרת ציוד הבקיעה (איור 2A). הנח את המיכל בצורת משפך בתמיכה השחורה (הכלולה בסט) וסובב את המשפך בכיוון מתאים כדי לראות את סימן הרמה ואת הברז.
- כדי ליצור ציוד הגירה בעבודת יד, חתכו את החלק העליון של שני בקבוקי פלסטיק בקוטר 0.5 ליטר (5.8 ס"מ) כדי לקבל גובה סופי של 12 ס"מ. צרו חור בקוטר 1.5 ס"מ בצד אחד בגודל 7 ס"מ מתחתית כל בקבוק והכניסו צינור גומי בקוטר 13 ס"מ (1.3 ס"מ חיצוני ו-0.9 ס"מ קוטר פנימי) בין שני הפתחים. אוטמים את הפתחים בדבק חם (איור 2B) ומשאירים לייבוש למשך 15 דקות; שים את הבקבוקים על משטח שטוח ומלא אותם במים כדי לוודא שאין נזילה.
2. הכנת תמיסת מלח מלאכותית
- בכוס זכוכית מכינים תמיסת מלח מלאכותית (מלח שרימפס תמלחת) בריכוז של 35 גרם/ליטר. לשם כך, הוסף 28 גרם של מלח ל 800mL של מי ברז, על פי הוראות היצרן. מערבבים אותו עם מוט ערבוב עד שכל המלח מומס היטב.
הערה: התאם את עוצמת הקול של תמיסת המלח המוכנה בהתאם לגודל המיכלים הזמינים.
3. הכנת מדגם
- הכן את כל הדגימות בצינור מיקרוצנטריפוגה על ידי המסת כמות מתאימה של תמציות (תמציות פלקטרנתוס , Pa- P. ambigerus; Pb- P. barbatus; Pc- P. cylindraceus ; ו- Pe- P. ecklonii) או תרכובות 1-5 (שתי תרכובות טבעיות [1 ו-2] המתקבלות מפלקטרנתוס spp. ושלוש נגזרות סינתטיות למחצה [3, 4, 5]; איור 3) בדימתיל סולפוקסיד (DMSO)12, כדי להשיג ריכוז סופי של 10 מ"ג/מ"ל (אם הדגימה מסיסה במים, אין צורך להשתמש ב-DMSO).
- יש לדלל 10 μL מכל דגימה (ו-DMSO לבקרה שלילית) בצינור מיקרוצנטריפוגה חדש באמצעות 990 μL של תמיסת מלח מלאכותית שהוכנה בשלב 2.1, כדי להשיג ריכוז סופי של 0.1 מ"ג/מ"ל.
- מתחת למכסה אדים, בבקבוק ארלנמאייר, הכינו תמיסה של אשלגן דיכרומט (K 2 Cr2O7) במיםמזוקקים בריכוז של 1 מ"ג/מ"ל13,14,15.
4. ביו-אסאי קטלני של שרימפס מלח
הערה: בדיקה זו פותחה מעבודותיהם של מספר מחברים עם שינויים 1,16,17,18,19.
- מלאו את כלי הבקיעה במדיום שהוכן בשלב 2.1 עד לגובה (500 מ"ל) (איור 2C).
- מניחים כף אחת (כ 0.75 גרם) של ציסטות שרימפס מלח בתמיסת המלח, ולאחר מכן לסגור את המיכל. הניחו מנורה (מנורת שולחן, 40 ואט, 230 וולט, 50 הרץ, עם נורת לד של 8 ואט, 4,000 K, 830 לומן) שמצביעה ישירות לכיוון הציוד (איור 2A) והפעילו אותה.
- חבר את מערכת ספק האוויר (פלט 3 W, 50 Hz, 230 V) למחבר הממוקם בחלק העליון של הציוד והפעל את המשאבה.
- שמור על טמפרטורת החדר על 25 ± 3 מעלות צלזיוס. ציסטות שרימפס תמלחת בוקעות בתמיסת המלח המלאכותית, תחת אוורור נמרץ, תאורה רציפה וטמפרטורה יציבה, לאחר 24 שעות עד 48 שעות.
הערה: לחלופין, ניתן להשתמש בחממה אנכית. - לאחר שהביצים בקעו, כבו את משאבת האוויר והמתינו עד שהנאופליי (הנע לכיוון תחתית המשפך) יופרד ממארזי הביצים הריקים (צפים בחלק העליון).
- על מנת להפריד בין הביצים שלא נקטפו לבין הנאופליי החי, פתחו את ברז היציאה בתחתית ופרקו את תוכן המשפך באחד המכלים של מיכל ציוד הנדידה בעבודת יד (המתואר בשלב 1.2). ודא כי התמיסה המכילה את nauplii ואת שאריות הביצים unhatched הוא מתחת לגובה של הצינור. במיכל השני, מוסיפים את תמיסת המלח השיורית משלב 2.1 מעל גובה הצינור.
- מכסים את המיכל עם nauplii ואת שאריות ביצים unhatched באמצעות רדיד אלומיניום. מניחים את המנורה על המיכל השני רק עם תמיסת המלח. חסילוני המלח יימשכו על ידי האור ויעברו ממיכל אחד למשנהו (מיכל קציר), מה שיוביל להפרדה יעילה בין ביצים (משקעים לאט לתחתית) לבין ארטמיה חיה.
- לאחר מכן, מקם את הציוד באינקובטור באותם תנאים המשמשים בשלב 4.4 במשך 4 שעות (איור 2E). ממיכל הקציר, לאסוף 900 μL של תמיסת מלח המכילה 10 עד 15 nauplii. הניחו את תמיסת המלח עם נאופליי בכל באר של צלחת בת 24 בארות (איור 2F); כל הדגימות נבדקות ברביעיות.
- הוסף 100 μL כל אחד מהבקרה השלילית (DMSO), הבקרה החיובית (K 2 Cr2O7, אשלגן דיכרומט), תמיסת המלח המלאכותית, וכל אחת מהדגימות לבאר המתאימה (איור 2F)13,14.
הערה: הדגימות בכל באר יהיו בריכוז של 0.01 מ"ג/מ"ל. הריכוז הסופי של הבקרה החיובית בתמיסת המלח יהיה 0.1 מ"ג/מ"ל, כדי להיות בטוחים שכל הנאופליי בבאר נחשפים להשפעה הרעילה של אשלגן דיכרומט ומתים. תמיסת המלח המלאכותית תפעל כריק. - דגרו את הצלחת בטמפרטורה של 25 ± 3 מעלות צלזיוס תחת תאורה למשך 24 שעות (איור 2G). לאחר 24 שעות, רשמו את מספר הזחלים המתים (nauplii לא ניידים במשך 5 שניות) בכל באר תחת מיקרוסקופ דו-עיני (12x)20 (איור 2H). לחלופין, השתמש בעדשת יד.
- הוסף 100 μL של תמיסת אשלגן דיכרומט, כדי לגרום למוות של הזחלים החיים הנותרים, ולחכות 6 שעות. ספרו את סך הזחלים המתים בכל באר תחת מיקרוסקופ. קבע את שיעור התמותה על פי המשוואה הבאה.
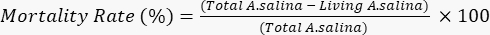
- בצע את כל הבדיקה במשולש. חשב סטיות תקן (SD), ובטא את התוצאות כממוצע של שלושה ניסויים בלתי תלויים, שלכל אחד מהם מרובעים פנימיים (n = 12), ± SD. כפי שצוין על ידי Meyer et al., לשקול תמציות גולמיות ותרכובות טהורות עם LC50< 1,000 מיקרוגרם / מ"ל כרעילים; כמו כן, יש לקחת בחשבון כי שיעור התמותה של שרימפס מלח הוא פרופורציונלי לריכוז של דגימות נבדק21.

איור 2: שיטת הבדיקה הביולוגית של ארטמיה סלינה קטלנית. (א) ציוד זמין מסחרית המשמש לבקיעה של ציסטות שרימפס תמלחת; (ב) ציוד הגירה בעבודת יד; (ג) כלי בקיעה מלא בתמיסת מלח; (ד) אוסף של ביצים ונאופליי שלא נקטעו; (E) ציוד בעבודת יד באינקובטור במהלך שלב הנדידה. המיכל רחוק מן המנורה צריך להיות מכוסה רדיד אלומיניום; עם זאת, לתצוגה טובה יותר של התקנת הסט כאן הוא הוסר; (ו) קצירת ארטמיה בבארות לפני ביצוע הבדיקה. יש למקם את התרכובות כפי שמוצג: - מתייחס לבקרה השלילית (DMSO), + לבקרה החיובית (K 2Cr2O7), מלח לתמיסת המלח המלאכותית, ו -1 עד 3 לדגימות לבדיקה (במקרה זה תרכובות 1-3); (ז) דגירה של לוחית 24 בארות המכילה ארטמיה והדגימות שנבחרו; (H) ספירת ארטמיה תחת מיקרוסקופ המשקפת. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 3: מבנים של תרכובות נבחרות. מבנה של תרכובות 1-2, מופק מינים Plectranthus ותרכובות 3-5, המתקבל על ידי חצי סינתזה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
Access restricted. Please log in or start a trial to view this content.
תוצאות
הרעילות הכללית של כמה מוצרים טבעיים שנחקרו לאחרונה על ידי הקבוצה שלנו הוערכה באמצעות bioassay קטלניות שרימפס תמלחת. ארבע תמציות (Pa- P. ambigerus; Pb- P. barbatus; PC- P. cylindraceus; ו- Pe- P. ecklonii) מהסוג פלקטרנתוס , הידוע בפעילותו נוגדת החמצון (תוצאות שלא פורסמו), נבדקו. בנוסף, שתי תרכובות טבעיו...
Access restricted. Please log in or start a trial to view this content.
Discussion
במהלך השנים האחרונות, הקהילה המדעית הגבירה את תשומת הלב שלה למודלים חלופיים לבדיקות רעילות21. לצד A. salina lethality bioassay, מתודולוגיות אחרות מבוצעות בדרך כלל להערכת סבילות הדגימה וכוללות בדיקות ביולוגיות של בעלי חוליות (כגון מכרסמים), חסרי חוליות (כגון דגי זברה), שיטות במבחנה
Access restricted. Please log in or start a trial to view this content.
Disclosures
המחברים מצהירים על היעדר ניגוד עניינים, כספי או אחר.
Acknowledgements
לזכרו של פרופסור אמילקר רוברטו.
עבודה זו נתמכה כספית על ידי Fundação para a Ciência e a Tecnologia (FCT, פורטוגל) תחת פרויקטים UIDB/04567/2020 ו- UIDP/04567/2020 המיוחסים ל- CBIOS ומענק דוקטורט SFRH / BD / 137671 / 2018 (ורה איסקה).
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 24-well plates | Thermo Fisher Scientific, Denmark | 174899 | Thermo Scientific Nunc Up Cell 24 multidish |
| Aluminium foil | Albal | - | Can be purchased in supermarket |
| Artemio Set | JBL GmbH and Co. KG, D-67141, Neuhofen Germany | 61066000 | Can be purchased in pet shops |
| Binocular microscope | Ceti, Belgium | 1700.0000 | Flexum-24AED, 220-240 V, 50 Hz |
| Bottles | - | - | 0.5 L Diameter: 5.8 cm; Height: 12 cm |
| Brine shrimp cysts | JBL GmbH and Co. KG, D-67141, Neuhofen Germany | 3090700 | Can be purchased in pet shops |
| Brine shrimp salt | JBL GmbH and Co. KG, D-67141, Neuhofen Germany | 3090600 | Can be purchased in pet shops |
| Dimethyl sulfoxide (DMSO) | VWR chemicals | CAS: 67-68-5 | 99% purity |
| Discartable tips | Diamond | F171500 | Volume range: 100 - 1000 µL |
| Eppendorf microtubes | BRAND | 7,80,546 | Microtubes, PP, 2 mL, BIO-CERT PCR QUALITY |
| Erlenmeyer flask | VWR chemicals | 4,47,109 | volume: 100 mL |
| Glass beaker | Normax | 3.2111654N | Volume: 1000 mL |
| Gloves | Guantes Luna | GLSP3 | - |
| GraphPad Prism | GraphPad Software, San Diego, CA, USA | - | GraphPad Prism version 5.00 for Windows, www.graphpad.com, accessed on 5 February 2021; commercial statistical analysis software |
| Home-made A. salina Grower | - | - | Home made: two plastic bottles connected by a hose |
| Hot glue | Parkside | PHP500E3 | 230 V, 50 Hz, 25 W |
| Incubator | Heidolph Instruments, Denmark | - | One Heidolph Unimax 1010 equipment and one Heidolph Inkubator 1006 |
| Light | Roblan | SKYC3008FE14 | LED light bulb |
| Micropipettes | VWR chemicals | 613-5265 | Volume range: 100 - 1000 µL |
| Potassium dichromate (K2Cr2O7) | VWR chemicals | CAS: 7778-50-9 | 99% purity |
| Pump ProAir a50 | JBL GmbH and Co. KG, D-67141, Neuhofen Germany | - | Included in the Artemio Set+1 kit |
| Rubber tube | - | - | 1.3 cm outer and 0.9 cm inner diameter |
| Stirring rod | VWR chemicals | 441-0147 |  6 mm, 250 mm 6 mm, 250 mm |
| Termometer | VWR chemicals | 620-0821 | 0 - 100 °C |
References
- Ntungwe, N. E., et al. Artemia species: An important tool to screen general toxicity samples. Current Pharmaceutical Design. 26 (24), 2892-2908 (2020).
- Cragg, G. M., Newman, D. J. Natural products: A continuing source of novel drug leads. Biochimica et Biophysica Acta (BBA) - General Subjects. 1830 (6), 3670-3695 (2013).
- Ntungwe, E., et al. General toxicity screening of Royleanone derivatives using an artemia salina model. Journal Biomedical and Biopharmaceutical Research. 18 (1), 114(2021).
- Seca, A., Plant Pinto, D. secondary metabolites as anticancer agents: Successes in clinical trials and therapeutic application. International Journal of Molecular Sciences. 19 (1), 263(2018).
- Calixto, J. B. The role of natural products in modern drug discovery. Anais da Academia Brasileira de Ciências. 91 (3), 1-7 (2019).
- Mandrell, D., et al. Automated zebrafish chorion removal and single embryo placement: optimizing throughput of zebrafish developmental toxicity screens. Journal of Laboratory Automation. 17 (1), 66-74 (2012).
- Zhang, Y., Mu, J., Han, J., Gu, X. An improved brine shrimp larvae lethality microwell test method. Toxicology Mechanisms and Methods. 22 (1), 23-30 (2012).
- Domínguez-Villegas, V., et al. antioxidant and cytotoxicity activities of methanolic extract and prenylated flavanones isolated from leaves of eysehardtia platycarpa. Natural Product Communications. 8 (2), 177-180 (2013).
- Hamidi, M. R., Jovanova, B., Panovska, T. K. Toxicological evaluation of the plant products using Brine Shrimp (Artemia salina L.) model. Macedonian Pharmaceutical Bulletin. 60 (01), 9-18 (2014).
- Libralato, G., Prato, E., Migliore, L., Cicero, A. M., Manfra, L. A review of toxicity testing protocols and endpoints with Artemia spp. Ecological Indicators. 69, 35-49 (2016).
- Mendes Hacke, A. C., et al. Cytotoxicity of cymbopogon citratus (DC) Stapf fractions, essential oil, citral, and geraniol in human leukocytes and erythrocytes. Journal of Ethnopharmacology. 291, 115147(2022).
- Thangapandi, V., Pushpanathan, T. Comparison of the Artemia salina and Artemia fransiscana bioassays for toxicity of Indian medicinal plants. Journal of Coastal Life Medicine. 2 (6), 453-457 (2014).
- Syahmi, A. R. M., et al. Acute oral toxicity and brine shrimp lethality of Elaeis guineensis Jacq., (Oil Palm Leaf) methanol extract. Molecules. 15 (11), 8111-8121 (2010).
- Sasidharan, S., et al. Acute toxicity impacts of Euphorbia hirta L extract on behavior, organs body weight index and histopathology of organs of the mice and Artemia salina. Pharmacognosy Research. 4 (3), 170(2012).
- Libralato, G. The case of Artemia spp. in nanoecotoxicology. Marine Environmental Research. 101, 38-43 (2014).
- Okumu, M. O., et al. Artemia salina as an animal model for the preliminary evaluation of snake venom-induced toxicity. Toxicon: X. 12, 100082(2021).
- Rajabi, S., Ramazani, A., Hamidi, M., Naji, T. Artemia salina as a model organism in toxicity assessment of nanoparticles. DARU Journal of Pharmaceutical Sciences. 23 (1), 20(2015).
- Svensson, B. -M., Mathiasson, L., Mårtensson, L., Bergström, S. Artemia salina as test organism for assessment of acute toxicity of leachate water from landfills. Environmental Monitoring and Assessment. 102 (1), 309-321 (2005).
- Banti, C., Hadjikakou, S. Evaluation of toxicity with brine shrimp assay. Bio-Protocol. 11 (2), 3895(2021).
- Pecoraro, R., et al. Artemia salina: A microcrustacean to assess engineered nanoparticles toxicity. Microscopy Research and Technique. 84 (3), 531-536 (2021).
- Lillicrap, A., et al. Alternative approaches to vertebrate ecotoxicity tests in the 21st century: A review of developments over the last 2 decades and current status. Environmental Toxicology and Chemistry. 35 (11), 2637-2646 (2016).
- Ribeiro, I. C., et al. Yeasts as a model for assessing the toxicity of the fungicides Penconazol, Cymoxanil and Dichlofulanid. Chemosphere. (10), 1637-1642 (2000).
- Armour, C. D., Lum, P. Y. From drug to protein: using yeast genetics for high-throughput target discovery. Current Opinion in Chemical Biology. 9 (1), 20-24 (2005).
- Modarresi Chahardehi, A., Arsad, H., Lim, V. Zebrafish as a successful animal model for screening toxicity of medicinal plants. Plants. 9 (10), 1345(2020).
- Fischer, I., Milton, C., Wallace, H. Toxicity testing is evolving. Toxicology Research. 9 (2), 67-80 (2020).
- de Araújo, G. L., et al. Alternative methods in toxicity testing: the current approach. Brazilian Journal of Pharmaceutical Sciences. 50 (1), 55-62 (2014).
- Toussaint, M., et al. A high-throughput method to measure the sensitivity of yeast cells to genotoxic agents in liquid cultures. Mutation Research/Genetic Toxicology and Environmental Mutagenesis. 606 (1), 92-105 (2006).
- Horzmann, K. A., Freeman, J. L. Making waves: New developments in toxicology with the zebrafish. Toxicological Sciences. 163 (1), 5-12 (2018).
- Avdesh, A., et al. Regular care and maintenance of a zebrafish (Danio rerio) laboratory: An introduction. Journal of Visualized Experiments. (69), e4196(2012).
- Cunliffe, V. T. Zebrafish: A Practical Approach. Nüsslein-Volhard, C., Dahm, R. , Oxford University Press. (2002).
- Sitarek, P., et al. Insight the biological activities of selected Abietane Diterpenes isolated from Plectranthus spp. Biomolecules. 10 (2), 194(2020).
- Matias, D., et al. Cytotoxic activity of Royleanone Diterpenes from Plectranthus madagascariensis Benth. ACS Omega. 4 (5), 8094-8103 (2019).
- Garcia, C., et al. Royleanone derivatives from Plectranthus spp. as a novel class of P-glycoprotein inhibitors. Frontiers in Pharmacology. 11, (2020).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved