Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Letalität Bioassay mit Artemia salina L.
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Diese Arbeit zielt darauf ab, das Artemia salina lethality Bioassay-Verfahren, das auch als Solegarnelen-Letalitätstest bezeichnet wird, zu bewerten und zu überprüfen. Diese einfache und kostengünstige Methode gibt Aufschluss über die allgemeine Toxizität (die als vorläufige Toxizitätsbewertung betrachtet wird) von Proben, nämlich Naturstoffen.
Zusammenfassung
Naturprodukte werden seit der Antike zur Herstellung von Medikamenten verwendet. Heutzutage gibt es viele Chemotherapeutika, die aus natürlichen Quellen gewonnen und gegen eine Vielzahl von Krankheiten eingesetzt werden. Leider zeigen die meisten dieser Verbindungen oft systemische Toxizität und Nebenwirkungen. Um die Verträglichkeit ausgewählter potentiell bioaktiver Proben besser beurteilen zu können, werden in der Regel Salzgarnelen (Artemia salina) als Modell in Letalitätsstudien verwendet. Der A. salina-Test basiert auf der Fähigkeit der untersuchten bioaktiven Verbindungen, die Mikrokrebstiere in ihrem Larvenstadium (Nauplien) abzutöten. Diese Methode stellt einen geeigneten Ausgangspunkt für Zytotoxizitätsstudien sowie für das allgemeine Toxizitätsscreening von synthetischen, halbsynthetischen und natürlichen Produkten dar. Es kann als einfacher, schneller und kostengünstiger Assay angesehen werden, verglichen mit vielen anderen Assays (In-vitro-Zellen oder Hefestämme, Zebrafische, Nagetiere), die im Allgemeinen für die oben genannten Zwecke geeignet sind. Darüber hinaus kann es auch ohne spezielle Schulung problemlos durchgeführt werden. Insgesamt stellt der A. salina-Assay ein nützliches Werkzeug für die vorläufige Toxizitätsbewertung ausgewählter Verbindungen und die biogesteuerte Fraktionierung von Naturstoffextrakten dar.
Einleitung
Naturstoffe aus Pflanzen, Tieren oder Mikroorganismen sind im Laufe der Jahre aufgrund ihres vielfältigen biologischen und pharmakologischen Wirkungsspektrums ein wachsendes Interesse an der Entwicklung neuer bioaktiver Moleküle 1. Die damit verbundenen Nebenwirkungen, die Arzneimittelresistenz oder die unzureichende Spezifität der Wirkstoffe, insbesondere wenn sie als Krebsmedikamente eingesetzt werden, stellen jedoch die Hauptfaktoren dar, die zu einer unwirksamen Behandlung führen können 1,2.
In den letzten Jahrzehnten wurden mehrere pflanzliche Zytostatika entdeckt, von denen einige als Krebsmittel eingesetzt werden 1,2,3. In diesem Zusammenhang wird Paclitaxel als eines der bekanntesten und wirksamsten Chemotherapeutika natürlichen Ursprungs bezeichnet 3,4. Derzeit wird geschätzt, dass mehr als 35 % aller Arzneimittel auf dem Markt aus Naturprodukten stammen oder von diesen inspiriert sind5. Die potentiell hohe Toxizität dieser Verbindungen muss in allen Untersuchungsphasen berücksichtigt werden, da verschiedene Arten von Schadstoffen oder sogar Stoffwechselbestandteile der Pflanze selbst toxische Wirkungen hervorrufen können. Aus diesem Grund sollten in der Vorphase pharmakologische und toxikologische Profile erstellt werden, um die biologische Aktivität und Sicherheit neuer potenzieller pflanzlicher Behandlungen zu bewerten. Um die Toxizität neuer bioaktiver Proben zu bewerten, können wirbellose Tiere als die besten Modelle für die Untersuchung angesehen werden. Sie fordern ethische Mindestanforderungen und erlauben vorläufige In-vitro-Assays, um die vielversprechendsten Produkte für die nächste Testrunde an Wirbeltieren zu priorisieren 1,6.
A. salina ist ein kleines halophiles wirbelloses Tier aus der Gattung Artemia (Familie Artemiidae, Ordnung Anostraca, Unterstamm Crustacea; Abbildung 1). In marinen und aquatischen Salzökosystemen spielen Salzgarnelen eine wichtige ernährungsphysiologische Rolle, da sie sich von Mikroalgen ernähren und Bestandteile des Zooplanktons sind, das zur Fütterung von Fischen verwendet wird. Darüber hinaus werden ihre Larven (bekannt als Nauplien) häufig bei der Beurteilung der allgemeinen Toxizität in Vorstudienverwendet 1,3,7.
Artemia spp. werden häufig in Letalitätsstudien verwendet und sind auch ein geeigneter Ausgangspunkt für Toxizitätsbewertungen, indem sie die Toxizität potenziell bioaktiver Verbindungen basierend auf ihrer Fähigkeit, im Labor gezüchtete Nauplien abzutöten, verfolgen 1,8. Aus diesem Grund hat die Verwendung von A. salina in allgemeinen Toxizitätsstudien an Attraktivität gewonnen, da es sich im Vergleich zu anderen Tests an Tiermodellen um eine sehr effiziente und einfach anzuwendende Methode handelt9.
Aufgrund ihrer einfachen Anatomie, ihrer winzigen Größe und ihres kurzen Lebenszyklus kann eine große Anzahl von wirbellosen Tieren in einem einzigen Experiment untersucht werden. Als solche kombinieren sie genetische Zugänglichkeit und kostengünstige Kompatibilität mit groß angelegten Screenings1. In diesem Zusammenhang zeigt die Verwendung von Salzgarnelen in einem allgemeinen Toxizitätstest mehrere Vorteile, wie z.B. schnelles Wachstum (28-72 h ist vom Schlüpfen bis zu den ersten Ergebnissen erforderlich), Kosteneffizienz und lange Haltbarkeit von kommerziellen Eiern, die das ganze Jahr über verwendet werden können 3,10. Auf der anderen Seite, da wirbellose Tiere ein primitives Organsystem haben und kein adaptives Immunsystem haben, stellen sie kein perfektes und zuverlässiges Modell für menschliche Zellendar 1.
Es bietet jedoch eine vorläufige Bewertungsmethode für die allgemeine Toxizität ausgewählter Proben. Da es häufig als Letalitätstest verwendet wird, kann es vorläufige Hinweise auf die toxischen Wirkungen potenzieller Krebsmittel geben. Es wird oft auch verwendet, um Rückmeldungen über die allgemeine Toxizität von Verbindungen zu erhalten, die mit anderen biologischen Aktivitäten ausgestattet sind, für die es unerlässlich ist, eine möglichst niedrige Sterblichkeitsrate bei den Artemia-Garnelen zu zeigen.
In einer laufenden Studie unserer Gruppe zeigten verschiedene Extrakte aus Plectranthus-Arten antioxidative und antimikrobielle Aktivitäten (unveröffentlichte Ergebnisse). Parallel dazu wurden durch Aufreinigung der Extrakte isolierte Verbindungen erhalten und anschließend chemisch modifiziert. Die Extrakte, reinen Verbindungen und halbsynthetischen Derivate wurden dann auf ihre allgemeine Toxizität getestet. In diesem Zusammenhang zielt die vorliegende Arbeit darauf ab, einen Überblick über die Verwendung des Artemia lethality Bioassays zur Bewertung der allgemeinen Toxizität und potenziellen zytotoxischen Aktivität von bioaktiven Extrakten und isolierten Verbindungen aus verschiedenen Pflanzen der Gattung Plectranthus11 zu geben.

Abbildung 1: Artemia salina unter dem Mikroskop. Frisch geschlüpfte Nauplien von A. salina unter dem Mikroskop (12-fache Vergrößerung). Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Protokoll
1. Vorbereitung der Ausrüstung
- Erwerben Sie handelsübliche Schlupfausrüstung. Wählen Sie einen geeigneten Ort für die Aufstellung der Schraffurausrüstung aus (Abbildung 2A). Legen Sie den trichterförmigen Behälter in die schwarze Halterung (im Set enthalten) und drehen Sie den Trichter in eine geeignete Richtung, um die Füllstandsmarkierung und den Wasserhahn zu sehen.
- Um handgefertigte Migrationsausrüstung herzustellen, schneiden Sie den Deckel von zwei 0,5-Liter-Plastikflaschen (5,8 cm Durchmesser) ab, um eine Endhöhe von 12 cm zu erhalten. Schaffen Sie ein Loch von 1,5 cm Durchmesser auf einer Seite in 7 cm Entfernung vom Boden in jeder Flasche und führen Sie einen 13 cm langen Gummischlauch (1,3 cm Außen- und 0,9 cm Innendurchmesser) zwischen die beiden Öffnungen ein. Die Öffnungen werden mit Heißkleber verschlossen (Abbildung 2B) und 15 min trocknen gelassen. Stellen Sie die Flaschen auf eine ebene Fläche und füllen Sie sie mit Wasser, um sicherzustellen, dass sie nicht auslaufen.
2. Herstellung von künstlicher Salzlösung
- In einem Becherglas wird eine künstliche Salzlösung (Salzlake Garnelensalz) in einer Konzentration von 35 g/l hergestellt. Fügen Sie dazu 28 g Salz zu 800 ml Leitungswasser gemäß den Anweisungen des Herstellers hinzu. Mischen Sie es mit einem Rührstab, bis sich das gesamte Salz vollständig aufgelöst hat.
HINWEIS: Passen Sie das Volumen der vorbereiteten Kochsalzlösung entsprechend der Größe der verfügbaren Behälter an.
3. Probenvorbereitung
- Alle Proben werden in einem Mikrozentrifugenröhrchen vorbereitet, indem eine geeignete Menge an Extrakten (Plectranthus-Extrakte , Pa- P. ambigerus; Pb- P. barbatus; Pc- P. cylindraceus ; und Pe- P. ecklonii) oder Verbindungen 1-5 (zwei natürliche Verbindungen [1 und 2] erhalten aus Plectranthus spp. und drei halbsynthetischen Derivaten [3, 4, 5]; Abbildung 3) in Dimethylsulfoxid (DMSO)12, um eine Endkonzentration von 10 mg/ml zu erhalten (wenn die Probe wasserlöslich ist, ist die Verwendung von DMSO nicht erforderlich).
- Verdünnen Sie 10 μl jeder Probe (und DMSO für die Negativkontrolle) in einem neuen Mikrozentrifugenröhrchen mit 990 μl künstlicher Kochsalzlösung, die in Schritt 2.1 hergestellt wurde, um eine Endkonzentration von 0,1 mg/ml zu erhalten.
- Unter einem Abzug wird in einem Erlenmeyerkolben eine Lösung von Kaliumdichromat (K2Cr2O7)in destilliertem Wasser in einer Konzentration von 1 mg/ml13,14,15 hergestellt.
4. Bioassay zur Letalität von Salzgarnelen
ANMERKUNG: Dieser Assay wurde aus den Arbeiten mehrerer Autoren mit den Modifikationen 1,16,17,18,19 entwickelt.
- Das Schlupfgefäß wird mit dem in Schritt 2.1 vorbereiteten Medium bis zur Füllstandsmarkierung (500 ml) gefüllt (Abbildung 2C).
- Legen Sie einen Löffel (ca. 0,75 g) Salzgarnelenzysten in die Salzlösung und schließen Sie dann den Behälter. Stellen Sie eine Lampe (Tischlampe, 40 W, 230 V, 50 Hz, mit einer LED-Glühbirne von 8 W, 4.000 K, 830 lm) direkt auf das Gerät (Abbildung 2A) auf und schalten Sie sie ein.
- Schließen Sie das Luftversorgungssystem (3 W Leistung, 50 Hz, 230 V) an den Anschluss an, der sich auf der Oberseite des Geräts befindet, und schalten Sie die Pumpe ein.
- Halten Sie die Raumtemperatur bei 25 ± 3 °C. Solegarnelenzysten schlüpfen in der künstlichen Salzlösung unter kräftiger Belüftung, kontinuierlicher Beleuchtung und stabiler Temperatur nach 24 h bis 48 h.
HINWEIS: Alternativ kann ein vertikaler Inkubator verwendet werden. - Sobald die Eier geschlüpft sind, schalten Sie die Luftpumpe aus und warten Sie, bis die Nauplien (die sich zum Boden des Trichters bewegen) von den leeren Eiergehäusen getrennt sind (oben schwimmend).
- Um die ungeschlüpften Eier von den lebenden Nauplien zu trennen, öffnen Sie den Auslasshahn am Boden und entleeren Sie den Inhalt des Trichters in einen der Behälter des handgefertigten Behälters für Migrationsausrüstung (beschrieben in Schritt 1.2). Stellen Sie sicher, dass die Lösung, die die Nauplien und die restlichen nicht geschlüpften Eier enthält, unter dem Niveau des Röhrchens liegt. Im zweiten Behälter die Restsalzlösung aus Schritt 2.1 über der Höhe des Röhrchens hinzufügen.
- Decken Sie den Behälter mit den Nauplien und den restlichen ungeschlüpften Eiern mit Alufolie ab. Stellen Sie die Lampe nur mit der Salzlösung auf den zweiten Behälter. Die Salzgarnelen werden vom Licht angezogen und wandern von einem Behälter zum anderen (Erntebehälter), was zu einer effizienten Trennung zwischen Eiern (langsam auf den Boden sedimentiert) und lebender Artemia führt.
- Stellen Sie dann das Gerät unter den gleichen Bedingungen wie in Schritt 4.4 für 4 h in den Inkubator (Abbildung 2E). Sammeln Sie aus dem Erntebehälter 900 μL Kochsalzlösung mit 10 bis 15 Nauplien. Legen Sie die Kochsalzlösung mit Nauplien in jede Vertiefung einer 24-Well-Platte (Abbildung 2F); Alle Proben werden in vierfacher Ausführung getestet.
- Jeweils 100 μL der Negativkontrolle (DMSO), der Positivkontrolle (K2Cr2O7, Kaliumdichromat), der künstlichen Salzlösung und jeder der Proben in die jeweilige Vertiefung geben (Abbildung 2F)13,14.
HINWEIS: Die Proben in jedem Bohrloch weisen eine Konzentration von 0,01 mg/ml auf. Die Endkonzentration der Positivkontrolle in Salzlösung beträgt 0,1 mg / ml, um sicherzustellen, dass alle Nauplien in der Vertiefung der toxischen Wirkung von Kaliumdichromat ausgesetzt sind und absterben. Die künstliche Salzlösung wirkt als Blindling. - Inkubieren Sie die Platte bei 25 ± 3 °C unter Beleuchtung für 24 h (Abbildung 2G). Nach 24 h registrieren Sie die Anzahl der toten Larven (nicht mobile Nauplien für 5 s) in jeder Vertiefung unter einem binokularen Mikroskop (12x)20 (Abbildung 2H). Alternativ können Sie eine Handlinse verwenden.
- Fügen Sie 100 μL Kaliumdichromatlösung hinzu, um den Tod der verbleibenden lebenden Larven zu induzieren, und warten Sie 6 h. Zählen Sie die Gesamtzahl der toten Larven in jeder Vertiefung unter einem Mikroskop. Bestimmen Sie die Sterblichkeitsrate gemäß der folgenden Gleichung.
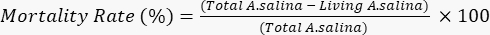
- Führen Sie alle Tests in dreifacher Ausfertigung durch. Berechnen Sie Standardabweichungen (SD) und drücken Sie die Ergebnisse als Mittelwert von drei unabhängigen Experimenten aus, jedes mit internen Vierfachen (n = 12), ± SD. Wie von Meyer et al. erwähnt, betrachten rohe Extrakte und reine Verbindungen mit LC50< 1.000 μg / ml als toxisch; Es ist auch zu berücksichtigen, dass die Sterblichkeitsrate von Salzgarnelen proportional zur Konzentration der untersuchten Probenist 21.

Abbildung 2: Artemia salina letale Bioassay-Methode. a) handelsübliche Ausrüstung, die zum Schlüpfen von Salzgarnelenzysten verwendet wird; b) handgefertigte Migrationsausrüstung; c) Schlupfgefäß, das mit Kochsalzlösung gefüllt ist; d) Entnahme von ungeschlüpften Eiern und Nauplien; (E) Handgefertigte Geräte im Inkubator während des Migrationsschritts. Der Behälter weit von der Lampe entfernt sollte mit Aluminiumfolie abgedeckt werden; Für eine bessere Ansicht der Set-Installation hier wurde es jedoch entfernt; (F) Ernte von Artemia in Bohrlöchern vor der Durchführung des Assays. Die Verbindungen sollten wie folgt platziert werden: - bezieht sich auf die Negativkontrolle (DMSO), + auf die Positivkontrolle (K2Cr2O7), Salz auf die künstliche Salzlösung und 1 bis 3 auf die zu testenden Proben (in diesem Fall Verbindungen 1-3); g) Inkubation der 24-Well-Platte, die Artemia enthält, und der ausgewählten Proben; (H) Artemia-Zählung unter dem binokularen Mikroskop. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 3: Strukturen ausgewählter Verbindungen. Struktur der Verbindungen 1-2, extrahiert aus Plectranthus-Spezies , und Verbindungen 3-5, erhalten durch Halbsynthese. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Ergebnisse
Die allgemeine Toxizität einiger Naturstoffe, die kürzlich von unserer Gruppe untersucht wurden, wurde durch den Sole-Garnelen-Letalitäts-Bioassay bewertet. Vier Auszüge (Pa- P. ambigerus; Pb- P. barbatus; Pc- P. cylindraceus; und Pe- P. ecklonii) aus der Gattung Plectranthus , die für ihre antioxidative Wirkung bekannt sind (unveröffentlichte Ergebnisse), wurden getestet. Zusätzlich werden zwei natürliche Verbindungen (1 und 2), die aus Plectranthus spp. gewo...
Diskussion
In den letzten Jahren hat die wissenschaftliche Gemeinschaft ihre Aufmerksamkeit auf alternative Modelle für Toxizitätsscreenings gelenkt21. Neben dem Bioassay A. salina lethality werden in der Regel andere Methoden zur Bewertung der Probenverträglichkeit durchgeführt und umfassen Wirbeltier-Bioassays (z. B. Nagetiere), Wirbellose (wie Zebrafische), In-vitro-Methoden mit Hefestämmen oder -zellen und In-silico-Methoden 22,23,24,25
Offenlegungen
Die Autoren erklären keine Interessenkonflikte, weder finanziell noch anderweitig.
Danksagungen
In Erinnerung an Professor Amilcar Roberto.
Diese Arbeit wurde von der Fundação para a Ciência e a Tecnologia (FCT, Portugal) im Rahmen der Projekte UIDB/04567/2020 und UIDP/04567/2020 finanziell unterstützt, die CBIOS und dem Promotionsstipendium SFRH/BD/137671/2018 (Vera Isca) zugeschrieben wurden.
Materialien
| Name | Company | Catalog Number | Comments |
| 24-well plates | Thermo Fisher Scientific, Denmark | 174899 | Thermo Scientific Nunc Up Cell 24 multidish |
| Aluminium foil | Albal | - | Can be purchased in supermarket |
| Artemio Set | JBL GmbH and Co. KG, D-67141, Neuhofen Germany | 61066000 | Can be purchased in pet shops |
| Binocular microscope | Ceti, Belgium | 1700.0000 | Flexum-24AED, 220-240 V, 50 Hz |
| Bottles | - | - | 0.5 L Diameter: 5.8 cm; Height: 12 cm |
| Brine shrimp cysts | JBL GmbH and Co. KG, D-67141, Neuhofen Germany | 3090700 | Can be purchased in pet shops |
| Brine shrimp salt | JBL GmbH and Co. KG, D-67141, Neuhofen Germany | 3090600 | Can be purchased in pet shops |
| Dimethyl sulfoxide (DMSO) | VWR chemicals | CAS: 67-68-5 | 99% purity |
| Discartable tips | Diamond | F171500 | Volume range: 100 - 1000 µL |
| Eppendorf microtubes | BRAND | 7,80,546 | Microtubes, PP, 2 mL, BIO-CERT PCR QUALITY |
| Erlenmeyer flask | VWR chemicals | 4,47,109 | volume: 100 mL |
| Glass beaker | Normax | 3.2111654N | Volume: 1000 mL |
| Gloves | Guantes Luna | GLSP3 | - |
| GraphPad Prism | GraphPad Software, San Diego, CA, USA | - | GraphPad Prism version 5.00 for Windows, www.graphpad.com, accessed on 5 February 2021; commercial statistical analysis software |
| Home-made A. salina Grower | - | - | Home made: two plastic bottles connected by a hose |
| Hot glue | Parkside | PHP500E3 | 230 V, 50 Hz, 25 W |
| Incubator | Heidolph Instruments, Denmark | - | One Heidolph Unimax 1010 equipment and one Heidolph Inkubator 1006 |
| Light | Roblan | SKYC3008FE14 | LED light bulb |
| Micropipettes | VWR chemicals | 613-5265 | Volume range: 100 - 1000 µL |
| Potassium dichromate (K2Cr2O7) | VWR chemicals | CAS: 7778-50-9 | 99% purity |
| Pump ProAir a50 | JBL GmbH and Co. KG, D-67141, Neuhofen Germany | - | Included in the Artemio Set+1 kit |
| Rubber tube | - | - | 1.3 cm outer and 0.9 cm inner diameter |
| Stirring rod | VWR chemicals | 441-0147 |  6 mm, 250 mm 6 mm, 250 mm |
| Termometer | VWR chemicals | 620-0821 | 0 - 100 °C |
Referenzen
- Ntungwe, N. E., et al. Artemia species: An important tool to screen general toxicity samples. Current Pharmaceutical Design. 26 (24), 2892-2908 (2020).
- Cragg, G. M., Newman, D. J. Natural products: A continuing source of novel drug leads. Biochimica et Biophysica Acta (BBA) - General Subjects. 1830 (6), 3670-3695 (2013).
- Ntungwe, E., et al. General toxicity screening of Royleanone derivatives using an artemia salina model. Journal Biomedical and Biopharmaceutical Research. 18 (1), 114 (2021).
- Seca, A., Plant Pinto, D. secondary metabolites as anticancer agents: Successes in clinical trials and therapeutic application. International Journal of Molecular Sciences. 19 (1), 263 (2018).
- Calixto, J. B. The role of natural products in modern drug discovery. Anais da Academia Brasileira de Ciências. 91 (3), 1-7 (2019).
- Mandrell, D., et al. Automated zebrafish chorion removal and single embryo placement: optimizing throughput of zebrafish developmental toxicity screens. Journal of Laboratory Automation. 17 (1), 66-74 (2012).
- Zhang, Y., Mu, J., Han, J., Gu, X. An improved brine shrimp larvae lethality microwell test method. Toxicology Mechanisms and Methods. 22 (1), 23-30 (2012).
- Domínguez-Villegas, V., et al. antioxidant and cytotoxicity activities of methanolic extract and prenylated flavanones isolated from leaves of eysehardtia platycarpa. Natural Product Communications. 8 (2), 177-180 (2013).
- Hamidi, M. R., Jovanova, B., Panovska, T. K. Toxicological evaluation of the plant products using Brine Shrimp (Artemia salina L.) model. Macedonian Pharmaceutical Bulletin. 60 (01), 9-18 (2014).
- Libralato, G., Prato, E., Migliore, L., Cicero, A. M., Manfra, L. A review of toxicity testing protocols and endpoints with Artemia spp. Ecological Indicators. 69, 35-49 (2016).
- Mendes Hacke, A. C., et al. Cytotoxicity of cymbopogon citratus (DC) Stapf fractions, essential oil, citral, and geraniol in human leukocytes and erythrocytes. Journal of Ethnopharmacology. 291, 115147 (2022).
- Thangapandi, V., Pushpanathan, T. Comparison of the Artemia salina and Artemia fransiscana bioassays for toxicity of Indian medicinal plants. Journal of Coastal Life Medicine. 2 (6), 453-457 (2014).
- Syahmi, A. R. M., et al. Acute oral toxicity and brine shrimp lethality of Elaeis guineensis Jacq., (Oil Palm Leaf) methanol extract. Molecules. 15 (11), 8111-8121 (2010).
- Sasidharan, S., et al. Acute toxicity impacts of Euphorbia hirta L extract on behavior, organs body weight index and histopathology of organs of the mice and Artemia salina. Pharmacognosy Research. 4 (3), 170 (2012).
- Libralato, G. The case of Artemia spp. in nanoecotoxicology. Marine Environmental Research. 101, 38-43 (2014).
- Okumu, M. O., et al. Artemia salina as an animal model for the preliminary evaluation of snake venom-induced toxicity. Toxicon: X. 12, 100082 (2021).
- Rajabi, S., Ramazani, A., Hamidi, M., Naji, T. Artemia salina as a model organism in toxicity assessment of nanoparticles. DARU Journal of Pharmaceutical Sciences. 23 (1), 20 (2015).
- Svensson, B. -. M., Mathiasson, L., Mårtensson, L., Bergström, S. Artemia salina as test organism for assessment of acute toxicity of leachate water from landfills. Environmental Monitoring and Assessment. 102 (1), 309-321 (2005).
- Banti, C., Hadjikakou, S. Evaluation of toxicity with brine shrimp assay. Bio-Protocol. 11 (2), 3895 (2021).
- Pecoraro, R., et al. Artemia salina: A microcrustacean to assess engineered nanoparticles toxicity. Microscopy Research and Technique. 84 (3), 531-536 (2021).
- Lillicrap, A., et al. Alternative approaches to vertebrate ecotoxicity tests in the 21st century: A review of developments over the last 2 decades and current status. Environmental Toxicology and Chemistry. 35 (11), 2637-2646 (2016).
- Ribeiro, I. C., et al. Yeasts as a model for assessing the toxicity of the fungicides Penconazol, Cymoxanil and Dichlofulanid. Chemosphere. (10), 1637-1642 (2000).
- Armour, C. D., Lum, P. Y. From drug to protein: using yeast genetics for high-throughput target discovery. Current Opinion in Chemical Biology. 9 (1), 20-24 (2005).
- Modarresi Chahardehi, A., Arsad, H., Lim, V. Zebrafish as a successful animal model for screening toxicity of medicinal plants. Plants. 9 (10), 1345 (2020).
- Fischer, I., Milton, C., Wallace, H. Toxicity testing is evolving. Toxicology Research. 9 (2), 67-80 (2020).
- de Araújo, G. L., et al. Alternative methods in toxicity testing: the current approach. Brazilian Journal of Pharmaceutical Sciences. 50 (1), 55-62 (2014).
- Toussaint, M., et al. A high-throughput method to measure the sensitivity of yeast cells to genotoxic agents in liquid cultures. Mutation Research/Genetic Toxicology and Environmental Mutagenesis. 606 (1), 92-105 (2006).
- Horzmann, K. A., Freeman, J. L. Making waves: New developments in toxicology with the zebrafish. Toxicological Sciences. 163 (1), 5-12 (2018).
- Avdesh, A., et al. Regular care and maintenance of a zebrafish (Danio rerio) laboratory: An introduction. Journal of Visualized Experiments. (69), e4196 (2012).
- Cunliffe, V. T., Nüsslein-Volhard, C., Dahm, R. . Zebrafish: A Practical Approach. , (2002).
- Sitarek, P., et al. Insight the biological activities of selected Abietane Diterpenes isolated from Plectranthus spp. Biomolecules. 10 (2), 194 (2020).
- Matias, D., et al. Cytotoxic activity of Royleanone Diterpenes from Plectranthus madagascariensis Benth. ACS Omega. 4 (5), 8094-8103 (2019).
- Garcia, C., et al. Royleanone derivatives from Plectranthus spp. as a novel class of P-glycoprotein inhibitors. Frontiers in Pharmacology. 11, (2020).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten