A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
اختبار العلاجات المناعية للسرطان في نموذج فأر متوافق مع البشر يحمل أوراما بشرية
* These authors contributed equally
In This Article
Erratum Notice
Summary
يحدد هذا البروتوكول جيل فئران الجهاز المناعي البشري (HIS) لدراسات الأورام المناعية. يتم تقديم التعليمات والاعتبارات في استخدام هذا النموذج لاختبار العلاجات المناعية البشرية على الأورام البشرية المزروعة في هذا النموذج مع التركيز على توصيف استجابة جهاز المناعة البشري للورم.
Abstract
يعد عكس الطبيعة المثبطة للمناعة للبيئة المكروية للورم أمرا بالغ الأهمية لنجاح علاج السرطانات بأدوية العلاج المناعي. نماذج سرطان الفئران محدودة للغاية في تنوعها وتعاني من ضعف الترجمة إلى العيادة. ليكون بمثابة نموذج ما قبل سريري أكثر فسيولوجية لدراسات العلاج المناعي ، تم تطوير هذا البروتوكول لتقييم علاج الأورام البشرية في الفأر المعاد تشكيله مع جهاز المناعة البشري. يوضح هذا البروتوكول الفريد تطور فئران الجهاز المناعي البشري (HIS ، "الإنسانية") ، يليها زرع ورم بشري ، إما طعم أجنبي مشتق من خط الخلية (CDX) أو طعم أجنبي مشتق من المريض (PDX). يتم إنشاء الفئران HIS عن طريق حقن الخلايا الجذعية المكونة للدم CD34 + البشرية المعزولة من دم الحبل السري في BRGS حديثي الولادة (BALB / c Rag2-/- IL2RγC-/- NODSIRPα) الفئران عالية نقص المناعة القادرة أيضا على قبول ورم غريب المنشأ. يتم التأكيد على أهمية حركية وخصائص تطور جهاز المناعة البشري وزرع الورم. أخيرا ، يتم وصف تقييم متعمق للبيئة المكروية للورم باستخدام قياس التدفق الخلوي. في العديد من الدراسات باستخدام هذا البروتوكول ، وجد أن البيئة المكروية للورم للأورام الفردية يتم تلخيصها في الفئران HIS-PDX. تظهر الأورام "الساخنة" تسلل مناعي كبير بينما لا تظهر الأورام "الباردة". يعمل هذا النموذج كأرض اختبار للعلاجات المناعية المركبة لمجموعة واسعة من الأورام البشرية ويمثل أداة مهمة في البحث عن الطب الشخصي.
Introduction
تعد نماذج سرطان الفئران مهمة لإنشاء آليات أساسية لنمو الورم والهروب المناعي. ومع ذلك ، فقد أسفرت دراسات علاج السرطان في نماذج الفئران عن ترجمة محدودة للعيادة بسبب النماذج الجينية المحدودة والاختلافات الخاصة بالأنواع 1,2. أكد ظهور العلاجات المناعية كنهج مهيمن للسيطرة على الأورام الحاجة إلى نموذج في الجسم الحي مع جهاز مناعة بشري وظيفي. جعلت التطورات في فئران الجهاز المناعي البشري (HIS MICE) على مدى العقد الماضي من الممكن دراسة علم الأورام المناعي في الجسم الحي في مجموعة واسعة من أنواع السرطان وعوامل العلاج المناعي3،4،5،6. تنمو نماذج الأورام البشرية ، بما في ذلك الطعوم الخارجية المشتقة من خط الخلية والمشتقة من المريض (CDX و PDX ، على التوالي) ، بشكل جيد في فئران HIS وفي معظم الحالات تكون متطابقة تقريبا مع نموها في المضيف الذي يعاني من نقص المناعة والذي يفتقر إلى تطعيم المكونة للدمالبشري 7,8. بناء على هذه النتيجة الرئيسية ، يستخدم الباحثون نموذج الماوس HIS لدراسة العلاجات المناعية البشرية ، بما في ذلك العلاجات المركبة المصممة لتغيير البيئة المكروية للورم (TME) لتقليل كبت المناعة وبالتالي تعزيز قتل الورم الموجه للمناعة. تساعد هذه النماذج قبل السريرية في معالجة قضايا عدم تجانس السرطانات البشرية ، ويمكنها أيضا التنبؤ بنجاح العلاج وكذلك مراقبة سمية الأدوية المرتبطة بالمناعة 9,10.
يتطلب إنتاج نموذج فأر مع جهاز المناعة البشري من خلال إدخال الخلايا الجذعية المكونة للدم البشرية فأرا يعاني من نقص المناعة المتلقي الذي لن يرفض الطعم الخارجي. تستمد نماذج الفئران الحالية HIS من سلالات الفئران التي تعاني من نقص المناعة والتي تم الإبلاغ عنها منذ أكثر من 30 عاما. كانت أول سلالة فأر تعاني من نقص المناعة تم وصفها هي فئران SCID التي تفتقر إلى الخلايا التائية والبائية11 ، تليها NOD-SCID الهجين مع تعدد أشكال SIRPα المسؤول عن تحمل بلاعم الفئران للخلايا البشرية ، بسبب زيادة ارتباط أليل NOD SIRPα بجزيء CD47 البشري12,13. في أوائل عام 2000 ، كان حذف سلسلة جاما الشائعة لمستقبلات IL-2 (IL-2Rγc) على كل من سلالات نقص المناعة BALB / c و NOD بمثابة تغيير لقواعد اللعبة لتعزيز النقش البشري ، بسبب الحذف الجيني الذي يمنع تطوير الخلايا القاتلة الطبيعية المضيفة14،15،16،17. النماذج البديلة ، مثل الفئران BRG و NRG ، تحقق نقص الخلايا التائية والبائية من خلال حذف جين Rag1 أو Rag2 ، المطلوب لإعادة ترتيب جين مستقبلات الخلايا التائية والبائية وبالتالي نضوج وبقاء الخلايا الليمفاوية18,19. يجمع فأر BRGS (BALB / c -Rag2nullIl2RγCnullSirpα NOD) المستخدم هنا بين نقص سلسلة IL-2Rγ وأليلNOD SIRPα على خلفية Rag2 / - ، مما يؤدي إلى فأر يعاني من نقص المناعة بدرجة عالية بدون خلايا T أو B أو NK ، ولكن بقوة وصحة كافية للسماح بالتطعيم على المدى الطويل لأكثر من 30 أسبوعا13.
يمكن إنشاء فئران HIS بطرق متعددة ، مع كون حقن PBMC البشري هو الطريقة الأكثر مباشرة15،18،20. ومع ذلك ، فإن هذه الفئران لديها توسع واضح في الخلايا التائية البشرية المنشطة التي تؤدي إلى مرض الكسب غير المشروع مقابل المضيف (GVHD) بحلول 12 أسبوعا من العمر ، مما يمنع الدراسات طويلة الأجل. بدلا من ذلك ، يمكن أيضا استخدام الخلايا الجذعية المكونة للدم البشرية من دم الحبل السري (CB) ونخاع العظام وكبد الجنين لتطعيم وإنتاج جهاز المناعة البشري من جديد. في هذا النظام ، تنتج الخلايا الجذعية المكونة للدم جهازا مناعيا بشريا متعدد السلالات مع توليد الخلايا المناعية T و B والخلايا المناعية الفطرية التي تتحمل مضيف الفأر بشكل مهم ، مقارنة بالفئران PBMC التي تطور في الغالب الخلايا التائية. لذلك ، فإن GVHD غائب أو متأخر بشكل كبير ، ويمكن تمديد الدراسات لتشمل الفئران حتى عمر 10 أشهر. يوفر CB مصدرا سهلا ويمكن الوصول إليه وغير جراحي للخلايا الجذعية المكونة للدم البشرية CD34 + التي تسهل تطعيم العديد من فئران HIS بأجهزة مناعية متطابقة وراثيا17،18،20،21. على مدى السنوات القليلة الماضية ، تم استخدام نماذج الفئران HIS على نطاق واسع لدراسة العلاج المناعي و TME3،4،5،6. على الرغم من تطور أجهزة المناعة المشتقة من الإنسان في هذه الفئران ، تنمو أورام الطعم الأجنبي البشري بمعدلات مماثلة مقارنة بالفئران التي تعاني من نقص المناعة وتسمح بالتفاعل المعقد بين الخلايا السرطانية والخلايا المناعية ، وهو أمر مهم للحفاظ على البيئة المكروية ل PDX3،7،8 . تم استخدام هذا البروتوكول لإجراء أكثر من 50 دراسة لاختبار العلاجات في الفئران HIS-BRGS مع PDXs و CDXs. الاستنتاج المهم هو أن الأورام البشرية في فئران HIS تحافظ على TME الفريد الخاص بها كما هو محدد من خلال التقييم الجزيئي للورم بالنسبة لعينة المريض الأولية وخصائص التسلل المناعي3،22،23. تركز مجموعتنا على التقييم المتعمق ل HIS في كل من الأعضاء المناعية والورم باستخدام قياس التدفق الخلوي متعدد المعلمات. هنا ، نصف بروتوكولا لإضفاء الطابع الإنساني على الفئران BRGS ، وتقييم الخيمرية ، وزرع الأورام البشرية ، وقياسات نمو الورم ، وإدارة علاج السرطان ، وتحليل خلايا HIS عن طريق قياس التدفق الخلوي.
Protocol
تم تنفيذ جميع الأعمال الحيوانية بموجب بروتوكولات الحيوانات المعتمدة من قبل لجنة رعاية واستخدام الحيوانات المؤسسية بجامعة كولورادو دنفر (بروتوكولات IACUC # 00593 و # 00021). تم تنفيذ جميع الأعمال الحيوانية وفقا لمكتب موارد المختبر (OLAR) ، وهو مرفق معتمد من قبل الجمعية الأمريكية لرعاية المختبر ، في حرم جامعة كولورادو دنفر أنشوتز الطبي. تم الحصول على جميع عينات دم الحبل السري البشري كتبرعات من متبرعين مجهولي الهوية وبالتالي فهي لا تخضع لموافقة لجنة أخلاقيات البحوث البشرية.
ملاحظة: يتم تضمين تركيبات جميع الوسائط والحلول المذكورة في البروتوكول في الملف التكميلي 1. يوضح الشكل 1 البروتوكول العام لتوليد وتحليل الاستجابات المناعية للأورام في فئران HIS-BRGS.
1. جيل من الفئران HIS
- تربية الفئران من الفئران BALB / c -Rag2 null Il2RγCnull SirpαNOD (BRGS)
ملاحظة: هذه السلالة تعاني من نقص شديد في المناعة ، مع عدم وجود خلايا T أو B أو NK. لذلك ، يجب استخدام تدابير صارمة لمنع العدوى الانتهازية. الحفاظ على مستعمرة على نظام غذائي يحتوي على تريميثوبريم وسلفاديازين على جدول 2 أسبوع بالتناوب مع اتباع نظام غذائي عادي. حافظ على أعلى مستوى ممكن من غرفة السكن الوقائي (على سبيل المثال ، مرفق دش حاجز مع وصول محدود).- الحفاظ على مستعمرات BALB / c -Rag2 null Il2RγC null Sirpα NOD (BRGS) و BALB / c Rag2 null Il2RγC null Sirpa Balb / c (BRG) الفئران متماثلة الزيجوت كمربية.
- قم بتربية BRGS N / N × BRG B / B لتوليد جراء BRGSB/ N ، لاستخدامها كمتلقين للخلايا الجذعية البشرية. في هذه المستعمرة ، تكون BRGSB / N أكثر صحة من BRGS N/ N ، ونقش عند مستويات مكافئة (أكثر من BRG).
- CD34 + عزل الخلايا الجذعية البشرية من CB السري
ملاحظة: لا يتم استخدام المضادات الحيوية لهذا الإجراء. لذلك ، تقنية معقمة جيدة أمر حتمي.- ضع رف أنبوب مخروطي سعة 50 مل ، بالإضافة إلى أنابيب مخروطية 3 × 15 مل و ~ 10 × 50 مل في خزانة معقمة للسلامة الحيوية (BSC). رش كيس جمع الدم بنسبة 70٪ من الإيثانول واتركه يجف في BSC.
- احسب عدد الأنابيب المخروطية سعة 50 مل المطلوبة لعزل تدرج كثافة CB = حجم CB / 15 ، مقربا لأعلى وإلى رقم أنبوب زوجي. احسب حجم الدم لكل أنبوب = حجم CB / عدد الأنابيب. صب الدم بعناية من كيس CB في كل أنبوب مخروطي ؛ هذا هو الحد الأقصى 15 مل لكل أنبوب. استخدم ماصة أوتوماتيكية وماصة مصلية سعة 25 مل لخلط الدم 1: 1 مع برنامج تلفزيوني معقم عن طريق السحب لأعلى ولأسفل.
- استخدم ماصة أوتوماتيكية على سرعة منخفضة وماصة مصلية سعة 10 مل لبطانة الدم ببطء مع محلول تدرج الكثافة بدرجة حرارة الغرفة (RT) 1.077 جم / مل (انظر جدول المواد) دون الإخلال بالواجهة. حافظ على طرف الماصة من لمس قاع الأنبوب. كرر لجميع الأنابيب. ثم أجهزة الطرد المركزي لمدة 30 دقيقة عند 850 × جم ، بدون فرامل ، في RT لضمان الحفاظ على تدرج الكثافة.
- تصور طبقة الانتفاخ الخلوية أعلى تدرج الكثافة 1.077 جم / مل كطبقة بيضاء غائمة. قم بإزالة طبقة البلازما والتخلص منها إلى حوالي 10 مل فوق طبقة بافي باستخدام ماصة مصلية سعة 25 مل وماصة أوتوماتيكية.
- جمع معطف بافي مع نقل معقمة أو ماصة المصلية. استخدم الماصة مثل الملعقة لكشط الخلايا من جانب الأنبوب المخروطي أثناء تحرير المصباح (أو السحب ببطء) لسحب الخلايا لأعلى. اجمع بين الأغطية المنتفخة من أنبوبين مخروطيين سعة 50 مل في أنبوب مخروطي جديد سعة 50 مل.
- اغسل الخلايا عن طريق صب 45 مل من HBSS المعقم الذي يحتوي على 2٪ FBS في كل أنبوب مخروطي. أجهزة الطرد المركزي لمدة 11 دقيقة عند 360 × ز في RT.
- قم بشفط وسائط الغسيل وصولا إلى الحبيبات في جميع الأنابيب. استخدم ماصة مصلية سعة 10 مل وماصة أوتوماتيكية لإعادة تعليق الحبيبات الأولى في 10 مل من HBSS تحتوي على 2٪ FBS. أعد تعليق كل حبيبة في نفس 10 مل من HBSS ، واشطف كل أنبوب ب 10 مل إضافية من HBSS لجمع كل الخلايا في أنبوب واحد.
- صب 45 مل من HBSS المعقم الذي يحتوي على 2٪ FBS في الأنبوب المخروطي. جهاز طرد مركزي لمدة 10 دقائق عند 360 × جم ، عند 4 درجات مئوية.
- قم بنضح المخزن المؤقت للغسيل وصولا إلى حبيبات الخلية وأعد تعليق الحبيبات في 20 مل من المخزن المؤقت لفاصل الخلايا المغناطيسية (انظر جدول المواد). قم بإزالة الحصة الصغيرة لحساب الخلايا باستخدام مقياس الدم عند تخفيف 1:20 باللون الأزرق الميثيلين. اجمع عدد الخلايا الزرقاء والبيضاء. جهاز طرد مركزي عند 360 × جم ، لمدة 10 دقائق عند 4 درجات مئوية.
ملاحظة: يستخدم هذا البروتوكول تقنية الخرزة المغناطيسية (انظر جدول المواد). يمكن تعديل البروتوكول للاستخدام مع أي تقنية لفصل الخلايا ، مع نقاء وإنتاجية كافية للخلايا الجذعية CD34 +. - نضح المادة الطافية وإعادة تعليق حبيبات الخلايا CD34 + المعزولة من دم الحبل السري في 300 ميكرولتر من المخزن المؤقت لفاصل الخلايا المغناطيسية لكل 1 × 108 خلايا. أضف 100 ميكرولتر من كاشف حجب FcR أولا ، ثم 100 ميكرولتر من الخرز المغناطيسي CD34 + لكل 1 × 108 خلايا. احتضان في 4 درجة مئوية لمدة 30 دقيقة (بدون ثلج).
- أضف 5 مل من المخزن المؤقت لفاصل الخلايا المغناطيسية لكل 1 × 108 خلايا وقم بتدويرها عند 360 × جم لمدة 10 دقائق عند 4 درجات مئوية. كرر خطوة الغسيل وأعد تعليق الحبيبات في 500 ميكرولتر من المخزن المؤقت لفاصل الخلايا المغناطيسية لكل 1 × 108 خلايا في أنبوب مخروطي سعة 15 مل مكتوب عليه "غير مجزأ".
- قم بتسمية أنبوبين مخروطيين آخرين سعة 15 مل "CD34-" و "CD34 +". ضع الأنابيب المخروطية الثلاثة سعة 15 مل (غير مجزأة ، CD34- و CD34 +) في الفتحات A1 و B1 و C1 ، على التوالي ، على رف تبريد (انظر جدول المواد). افصل الخلايا باستخدام برنامج الاختيار الإيجابي المكون من عمودين على فاصل الخلايا المغناطيسية التلقائي (انظر جدول المواد) في BSC ، وفقا لتعليمات أداة الشركة المصنعة.
- توسيع وتجميد الخلايا الجذعية البشرية CD34 +
- Aliquot 10 μL من تعليق خلية CD34 + المستردة (2 مل) على شريحة مقياس الدم وحساب الخلايا تحت تكبير 10x. احسب العدد الإجمالي لخلايا CD34 + بضرب عدد الخلايا في 2 × 104. اقسم إجمالي عدد خلايا CD34 + على 250,000 لحساب عدد القوارير المراد تجميدها (50,000 خلية لكل جرو فأر قبل التوسع في المختبر ).
- قم بإعداد CB medium Iscove's 10٪ FCS (بالإضافة إلى 1 مل إضافي لفقدان الترشيح) ، مع استكماله بعامل الخلايا الجذعية 40 نانوغرام / مل ، و 20 نانوغرام / مل Flt3L ، و 10 نانوغرام / مل IL-6 ، ويمر عبر مرشح 0.22 ميكرومتر. أعد تعليق خلايا CD34 + عند 100000 لكل مل من وسط CB ، واحتضانها عند 37 درجة مئوية. في اليوم 3 ، أضف حجما مكافئا من وسط CB بدون السيتوكينات إلى القارورة التي تحتوي على الخلايا ووسط CB مع السيتوكينات.
ملاحظة: إضافة هذه السيتوكينات إلى وسط CB يعزز بقاء وتوسع خلايا CD34 + مع منع التمايز. - احصد خلايا CD34 + الموسعة في اليوم 5. ماصة تعليق الخلية لأعلى ولأسفل وجمعها في أنبوب مخروطي 50 مل. أضف ما يكفي من وسط CB لتغطية الجزء السفلي من القارورة. باستخدام مكشطة الخلية ، كشط الجزء السفلي بأكمله من القارورة. اجمع كل الوسائط في نفس الأنبوب سعة 50 مل ، وأجهزة الطرد المركزي عند 360 × جم لمدة 11 دقيقة.
- أعد تعليق الخلايا في 2 مل من وسط CB. احفظ القطرة النهائية من الماصة في لوحة 96 بئرا للعد. تمييع الخلايا 1: 1 باللون الأزرق trypan وإضافة 10 μL إلى مقياس الدم ، ثم عد ومتوسط الخلايا من أربعة أرباع. احسب العدد الإجمالي لخلايا CD34 + بضرب عدد الخلايا في 4 × 104 ، وسجل الصلاحية.
- اصنع n + 1 مل من وسط التجميد ، حيث n هو عدد قوارير التجميد المحسوبة في الخطوة 1.3.1. قم بإعداد وسط التجميد عن طريق إضافة 10٪ (v / v) DMSO إلى FBS واحتفظ به على الجليد. قم بتسمية cryovials ب CB # و CD34 + d5 والتاريخ.
- قم بتدوير خلايا CD34 + عند 360 × جم لمدة 10 دقائق عند 4 درجات مئوية. نضح الوسط لأسفل إلى الحبيبات وأعد تعليق حبيبات الخلية في وسط التجميد. قسمة 1 مل من تعليق الخلية لكل قارورة وقسم أي ما تبقى بالتساوي بين القوارير. أضف القوارير إلى مجمد خلية الأيزوبروبانول المبرد إلى 4 درجات مئوية ، وضعها في -80 درجة مئوية ، وانقلها إلى النيتروجين السائل لتخزينها لمدة >90 يوما.
- تشعيع الجراء الماوس
- اجمع جراء BRGSB / N ، بعد 1-3 أيام من الولادة ، في صندوق بلاستيكي معقم مع الحشو. أضف كمية صغيرة من الفراش مع الجراء. قم بتسمية الصندوق برقم القفص وعدد الجراء.
- قم بإعداد جهاز التشعيع (انظر جدول المواد) بجرعة 300 راد. ضع صندوق الجراء في جهاز التشعيع وعرضهم ل 300 راد. خذ الجراء إلى قفصهم ، ضعهم في كومة ، وقم بتغطيتها بالفراش.
- حقن الجرو وإعداد خلايا CD34 +
- ابدأ إعداد خلية CD34 + ~ 3 ساعات بعد التشعيع. قم بتسخين 10 مل من وسائط CB في أنبوب مخروطي سعة 50 مل. نفذ جميع الخطوات في BSC معقمة.
- استرجع قارورة واحدة من خلايا CD34 + الموسعة والمجمدة في المختبر لكل أربعة إلى ستة جراء للحقن. قم بإذابة الجليد بسرعة عند 55 درجة مئوية ، حتى تظهر كمية صغيرة من الثلج ، وأضف الخلايا إلى وسط CB الدافئ (يجب أن تظل القارورة باردة عند لمسها). استخدم 1 مل من الوسط لشطف كل قارورة وتدوير الخلايا عند 360 × جم لمدة 12 دقيقة عند 4 درجات مئوية.
ملاحظة: وجد أن الذوبان السريع عند 55 درجة مئوية ينتج عنه قابلية أفضل للخلية (90٪ -95٪) من الذوبان عند 37 درجة مئوية. - نضح الوسط بعناية. أعد تعليق الحبيبات (الصغيرة) في 2 مل من وسائط CB ، واخلطها برفق ، وأضف ~ 30 ميكرولتر من تعليق الخلية إلى بئر واحد في لوحة العد. تمييع 1: 1 في تريبان الأزرق ، ثم إضافة 10 ميكرولتر إلى مقياس الدم وعد ومتوسط الخلايا من أربعة أرباع.
- احسب العدد الإجمالي لخلايا CD34 + بضرب عدد الخلايا في 4 × 104 ثم سجل الصلاحية. تدور عند 360 × جم لمدة 12 دقيقة عند 4 درجات مئوية.
- قم بشفط الوسط بعناية وأعد تعليق حبيبات الخلية في 100 ميكرولتر من PBS المعقمة لكل n + 1 جراء للحقن ، مما ينتج عنه 250,000-450,000 خلية CD34 + لكل فأر. ضع الأنبوب المخروطي على الثلج في حاوية نقل وسافر إلى حظيرة الحيوان لحقن الجرو.
- أحضر مصباحا حراريا وحفاضات ومحقنة سعة 1 مل وإبرة 18 جم وإبرة 30 جم وإعداد خلية CD34 + في حاويات معقمة إلى حظيرة الحيوان BSC. ضع حفاضات معقمة ~ 2 قدم تحت مصباح الحرارة. استرجع القفص مع القمامة المراد حقنها ووضعها في BSC.
- قم بتجميع المحقنة بإبرة مشطوفة 18 جم. مطابقة زاوية الأنبوب المخروطي مع شطبة الإبرة ، قم بخلط وسحب تعليق الخلية برفق. ضع الجراء على الحفاض للتدفئة (راقب ارتفاع درجة الحرارة). أخرج الهواء من المحقنة واستبدل إبرة 18 جم بإبرة 30 جم ، ثم ادفع المحقنة بحذر حتى يصبح تعليق الخلية عند طرف الإبرة.
ملاحظة: بدلا من ذلك ، يمكن استخدام حقنة الأنسولين. - خذ جروا واحدا في كل مرة إلى حافة الحفاض بعيدا عن مصباح الحرارة. شل حركة الجرو على جانبه تحت الإبهام والسبابة ، مما يسمح برؤية واضحة للوجه. لاحظ الوريد عبر الخد تحت مكان الأذن. أدخل الإبرة بسطحية في الوريد (IV) الأقرب إلى العين ، وقم بحقن 50 ميكرولتر من الخلايا ببطء.
- تحقق مما إذا كانت الفقاعة تتشكل من الحقن تحت الجلد. إذا كان الأمر كذلك ، أدخل الإبرة أعمق واستمر في حقن الخلايا. ستكون قطرة صغيرة من الدم / ورم دموي مرئية عند نجاحها.
ملاحظة: راجع الإجراء الذي أجراه Gombash Lampe et al.24 فيما يتعلق بحقن الجرو. - مع استمرار تجميد الجرو ، قم بإجراء حقن داخل الكبد (IH) مع 50 ميكرولتر أخرى من الخلايا (إجمالي 100 ميكرولتر لكل جرو من IV + IH). يمكن تصور الكبد كبقعة داكنة بين شريط الحليب الأبيض والقفص الصدري. ضع الجرو المحقون على حفاضات بعيدة عن الجراء غير المحقونة وقم بالتسخين.
ملاحظة: ينتج عن الحقن الوريدي كيمرية أفضل على المدى الطويل من حقن IH وحده25 ، لكن الحقن الوريدي لا ينجح دائما. لذلك ، فإن تقسيم الحقن بين IV و IH يضمن النقش إلى نسبة أكبر من الفئران. - كرر كل من حقن الوريد الوجهي و IH لجميع الجراء. تنظيف أي دم ، وإعادة الجراء إلى العش في قفصهم ، وتغطي مع الفراش.
2. اختبار الخيمرية البشرية في الدم
- اختبار الخيمرية في دم الفئران HIS في كل من 10 و 14 أسبوعا من العمر. اجمع 50 ميكرولتر من الدم عبر الوريد الحجاجي الخلفي أو باستخدام طريقة بديلة معتمدة من IACUC.
- بالنسبة للنزيف المداري الخلفي ، قم بتخدير الفئران باستخدام مبخر isoflurane مضبوط على 5 لمدة 1-2 دقيقة ثم قم بتحويل إعداد المرذاذ إلى 4. قم بإيقاف تشغيل المرذاذ حسب الحاجة للسماح للفئران بالبقاء مؤكسجة بدرجة كافية أثناء التخدير. لا تبقي الفئران تحت الأيزوفلوران لأكثر من 5 دقائق.
- ضع أنف الفأر المخدر في مرفق مخروط الأنف بمبخر الأيزوفلوران وضع قطرة من المسكن (0.5٪ محلول بروباراكايين هيدروكلورايد للعيون USP) على العين.
- بعد 1 دقيقة ، قم بإزالة البروباراكايين باستخدام شاش معقم ، وقم بمسح العين ، وأدخل أنبوب هيماتوكريت هيبارين 75 مم بأثر رجعي لجمع 50 ميكرولتر من الدم. أخرج الدم في أنبوب ميكروفوج سعة 1.5 مل يحتوي على 50 ميكرولتر من الهيبارين واخلطه برفق.
- قرصة العين مغلقة مع الشاش المعقم لوقف النزيف وتطبيق قطرة من proparacaine. إزالة الماوس من isoflurane واستعادة في قفص نظيف.
- عزل PBMC من دم الفأر
- امزج الدم / الهيبارين عن طريق السحب برفق لأعلى ولأسفل والتراكب ببطء فوق 500 ميكرولتر من تدرج الكثافة 1.077 جم / مل ، مع الحرص على عدم إزعاج الواجهة. أجهزة الطرد المركزي الأنابيب عند 1220 × جم لمدة 20 دقيقة في RT بدون فرامل.
- تصور طبقة بافي الخلوية كطبقة غائمة فوق تدرج الكثافة 1.077 جم / مل ، أسفل البلازما. قم بإزالة أكبر عدد ممكن من الخلايا من طبقة بافي باستخدام ماصة 200 ميكرولتر وأضفها إلى أنابيب جديدة سعة 1.5 مل تحتوي على 750 ميكرولتر من وسط الحصاد. أجهزة الطرد المركزي في 360 × ز لمدة 11 دقيقة في RT.
- نضح الوسط إلى 50 ميكرولتر وأعد تعليق الحبيبات في 750 ميكرولتر من وسط الحصاد. أجهزة الطرد المركزي عند 360 × جم لمدة 10 دقائق عند 4 درجات مئوية ، ونضح مرة أخرى إلى 50 ميكرولتر. الخلايا جاهزة لإعادة تعليقها في بقعة السطح.
- تلطيخ السطح وتحليل التدفق الخلوي
- املأ ورقة عمل لوحة التلوين (الجدول 1 ؛ ورقة عمل "لوحة نزيف التدفق الطيفي") مع أرقام الماوس وإعداد كوكتيل تلطيخ الأجسام المضادة عن طريق إضافة جميع الأجسام المضادة الفلورية إلى المخزن المؤقت للتلطيخ (الملف التكميلي 1). قم بعمل تخطيط لوحة لإضافة العينات إلى لوحة قاع U ذات 96 بئرا. ضع علامة على قيعان الآبار باستخدام علامة دائمة. معايرة الأجسام المضادة باستخدام إجراء قياسي قبل تلطيخ لتحديد التركيز المناسب26.
- أضف 62 ميكرولتر من كوكتيل البقع السطحية إلى كل بئر من اللوحة السفلية على شكل حرف U المكونة من 96 بئرا. أعد تعليق الخلايا في 50 ميكرولتر المتبقية في الأنبوب وأضف كل عينة إلى البئر المقابلة. قم بتضمين بئر للتحكم الإيجابي في التلوين (PBMCs البشرية + خلايا طحال الفئران ، 1 × 106 خلايا لكل منهما) للبقع جنبا إلى جنب مع العينات. يخلط المزيج عن طريق السحب ويحتضنه لمدة 15 دقيقة على حرارة 4 درجات مئوية.
- أجهزة الطرد المركزي عند 680 × جم لمدة 3 دقائق عند 4 درجات مئوية. نفض الغبار عن اللوحة في الحوض لإزالة المادة الطافية ، واغسل الخلايا عن طريق تعليق 150 ميكرولتر من المخزن المؤقت للتلطيخ عن طريق سحب الإصبع برفق ~ 10x. قم بتدوير وإعادة تعليق كل بئر في 150 ميكرولتر من المخزن المؤقت للتلطيخ.
- احصل على بيانات 100 ميكرولتر من كل عينة على مقياس التدفق الخلوي (انظر جدول المواد) وقم بتصدير ملفات .fcs. قم باستيراد ملفات .fcs إلى برنامج تحرير بيانات التدفق (انظر جدول المواد). قم بتطبيق بوابة مضلعة على مخطط FSC-A x SSC-A المحيط بالخلايا ، باستثناء أي حطام. حدد الخلايا داخل البوابة (انظر الجدول 1; ورقة عمل "بوابة نزيف التدفق الطيفي").
- قم بتغيير المحاور إلى (FSC-A x FSC-H) وقم ببوابة الخلايا الموجودة على القطر الخطي باستثناء الثنائيات التي تبرز من الخط. حدد هذه الخلايا وقم بتغيير المحاور إلى (hCD45 x mCD45).
- قم بتطبيق بوابة مضلعة على مجتمع hCD45 + وقم بتطبيق اسم "الإنسان". قم بتطبيق بوابة مضلعة على محتوى mCD45 + وقم بتطبيق الاسم "الماوس". قم بإنشاء إحصائية عد لكل من البشر والفئران.
- حدد السكان وقم بتغيير المحاور إلى (CD19 x CD3). قم بتطبيق بوابة مضلعة على خلايا CD19 + وقم بتسميتها "الخلايا البائية". قم بتطبيق بوابة مضلعة على محتوى CD3 + وقم بتسميتها "الخلايا التائية". قم بتطبيق بوابة مضلعة على المجتمع السلبي المزدوج وقم بتسميته "NonTB".
- حدد محتوى الخلايا التائية وقم بتغيير المحاور إلى (CD8 x CD4). ضع بوابة مضلعة على المجموعات السكانية الإيجابية CD4 و CD8 وقم بتسميتها "CD4 +" و "CD8 +" ، على التوالي.
- حدد السكان غير المصابين بالسل وقم بتغيير المحاور إلى (CD56 x myeloid). ضع بوابة مضلعة على إجمالي السكان الموجبة CD56 بما في ذلك الأحداث الإيجابية المزدوجة وقم بتسميتها "الخلايا القاتلة الطبيعية". ضع بوابة مضلعة على السكان السالبين والنخاعيين الموجب CD56 وأطلق عليه اسم "النخاعي".
- قم بإنشاء جدول للنسبة المئوية وعدد إحصائيات جميع السكان وقم بالتصدير إلى برنامج جدول بيانات (انظر جدول المواد). احسب ٪hCD45 الخيمرية = ٪hCD45/(٪hCD45 + mCD45).
- استبعاد الفئران HIS التي هي <20٪ hCD45 + (من mCD45 + hCD45) لمزيد من التجارب.
ملاحظة: في هذه الدراسة ، تم تحضير PBMCs باستخدام فصل تدرج كثافة 1.077 جم / مل لاستنفاد كرات الدم الحمراء الأنظف. استبعد هذا الإجراء الخلايا المحببة البشرية والفأر من طبقة PBMC. بدلا من ذلك ، يمكن استخدام تحلل كرات الدم الحمراء.
3. حقن الأورام في الفئران
- قبل حقن الورم ، تأكد من أرقام الخلايا التائية من بيانات النزيف لمدة 14 أسبوعا. يتم حقن الأورام لتكون جاهزة للحصاد بين 20-26 أسبوعا إذا كانت الخلايا التائية >20٪ ، وبين 24-28 أسبوعا إذا كانت الخلايا التائية <20٪ من إجمالي عدد الخلايا المناعية. يضمن توقيت الحقن هذا أن عمر الفئران يتراوح بين 20 و 28 أسبوعا ولديها أعداد كافية من الخلايا التائية في نهاية الدراسة.
- حقن الطعوم الخارجية المشتقة من خط الخلية (CDX)
ملاحظة: يتم وصف الإجراء باستخدام خلايا سرطان الثدي الغدي MDA-MB-231 (انظر جدول المواد) كمثال.- قم بإذابة حصة من الخلايا المجمدة ، واغسل 1x عن طريق تعليق 10 مل من DMEM المكمل ب 10٪ FBS و 1٪ PenStrep و 1٪ من الأحماض الأمينية غير الأساسية وأجهزة الطرد المركزي عند 360 × جم لمدة 10 دقائق عند 4 درجات مئوية. نضح الوسط وأعد تعليقه في 10 مل من DMEM المكمل ب 10٪ FBS و 1٪ PenStrep و 1٪ من الأحماض الأمينية غير الأساسية في دورق T25 واحتضانه عند 37 درجة مئوية مع 5٪ CO2.
ملاحظة: تتم مصادقة خطوط الخلايا بواسطة تفاعل البوليميراز المتسلسل لضمان نوع الخلية الصحيح. يتم اختبار طافات الخلايا بحثا عن الميكوبلازما عن طريق مقايسة كيميائية حيوية قبل الحقن. - مرور وتوسيع الخلايا خلال مرحلة النمو الأسي عند التقاء حوالي 80٪.
- نضح الوسط ، وشطف الخلايا مع 5-10 مل من PBS المعقمة (درجة الحموضة 7.2) ، واحتضان مع 1 مل من 0.25 ٪ التربسين-EDTA لمدة 1-5 دقائق حتى تنفصل الخلايا عن القارورة.
- أضف 5 مل من نفس DMEM واخلطها عن طريق السحب لأعلى ولأسفل. قم بتمرير 6 مل كاملة من معلق الخلايا إلى دورق T75 معالج بزراعة الأنسجة الجديدة (تخفيف 1: 3) وإضافة 10 مل إضافية من DMEM.
- مرور الخلايا كل 2-3 أيام عند التقاء 80٪ عند طلاء مخفف 1: 3 في DMEM لتوسيع الخلايا.
- حصاد الخلايا مع 0.25 ٪ التربسين-EDTA خلال مرحلة النمو الأسي في غضون ستة ممرات وتغسل مع برنامج تلفزيوني. امزج PBS ومستخلص الغشاء القاعدي (انظر جدول المواد) بنسبة 1: 1 وأضفه إلى الخلايا بتركيز نهائي قدره 5 × 107 خلايا / مل.
- تخدير الفئران بالإيزوفلوران كما هو موضح في الخطوة 2.1.1. حقن تحت الجلد 100 ميكرولتر (5 × 106 خلايا) من تعليق الخلايا السرطانية في كل جناح باستخدام إبرة 23 جرام.
- قم بإذابة حصة من الخلايا المجمدة ، واغسل 1x عن طريق تعليق 10 مل من DMEM المكمل ب 10٪ FBS و 1٪ PenStrep و 1٪ من الأحماض الأمينية غير الأساسية وأجهزة الطرد المركزي عند 360 × جم لمدة 10 دقائق عند 4 درجات مئوية. نضح الوسط وأعد تعليقه في 10 مل من DMEM المكمل ب 10٪ FBS و 1٪ PenStrep و 1٪ من الأحماض الأمينية غير الأساسية في دورق T25 واحتضانه عند 37 درجة مئوية مع 5٪ CO2.
- إجراء حقن الطعوم الخارجية المشتقة من المريض (PDX) باستخدام المبازل. يتوفر إجراء الحقن وتعليمات التطوير والصيانة الأخرى لنموذج PDX في الأدبيات27.
4. قياس نمو الورم
- تحقق من تقدم الورم مرة واحدة في الأسبوع بعد الزرع عن طريق الشعور على طول الجناح لنمو الورم. بمجرد أن تصبح الأورام واضحة ، قم بتخدير الفئران باستخدام الأيزوفلوران (كما هو موضح في الخطوة 2.1.1) واحلق على كل جناح باستخدام أداة تشذيب كهربائية ، مع الحرص على الورم لمنع التقرحات مع نمو الورم.
ملاحظة: يمكن حلق الفئران قبل حقن الورم لمنع إصابات الجلد حول الأورام. ومع ذلك ، فإن معدل إعادة نمو الشعر يمكن أن يعيق قياسات الورم. - قياس طول وعرض الأورام مرتين في الأسبوع باستخدام الفرجار وتسجيل القياسات بالملليمتر. الإبلاغ عن قياسات الورم كحجم الورم (مم3) باستخدام الصيغة
 . احرص على عدم السماح لعبء الورم بتجاوز 2000 مم 3 لكل ورم واحد أو حجم مجمع يبلغ 3000 مم3.
. احرص على عدم السماح لعبء الورم بتجاوز 2000 مم 3 لكل ورم واحد أو حجم مجمع يبلغ 3000 مم3.
ملاحظة: تختلف الإرشادات الخاصة باستخدام الفئران في أبحاث السرطان حسب الموقع. يرجى الرجوع إلى سياسات رعاية واستخدام الحيوان في مؤسسة الباحث.
5. العلاجات الدوائية
- قم بتخصيص فئران HIS في مجموعات علاجية مكافئة بناء على الخيمرية hCD45 وخيمرية hCD3 وخيمرية hCD8. بمجرد أن تصل الأورام إلى 100 مم3 في المتوسط ، ابدأ العلاج بالعقاقير.
ملاحظة: يعتمد عدد الفئران لكل مجموعة على عدد فئران HIS الناتجة عن CB. يوصى بما لا يقل عن أربعة فئران لكل مجموعة. تعد المطابقة متعددة المجموعات غير الثنائية (على سبيل المثال ، في برنامج R-vivo Manila ) مفيدة لهذه المجموعة28. - طريق المخدرات وتواترها
- يتم حقن مثبطات مضادات PD-1 (نيفولوماب ، بيمبروليزوماب) داخل الصفاق (i.p.) بمعدل 30 مجم / كجم 1x في الأسبوع أو 20 مجم / كجم 2x في الأسبوع للعلاجات الفردية ، أو 10-15 مجم / كجم 2x في الأسبوع للعلاجات المركبة.
- جرعة العلاجات المركبة ، مثل العلاجات المستهدفة ، والعلاجات الكيميائية ، والإشعاع ، وفقا للتصميم التجريبي. يمكن إعطاء العلاجات المستهدفة والعلاجات الكيميائية من خلال التزويج الفموي أو الحقن أو الطعام.
ملاحظة: يمكن تغيير الجرعات وتحسينها وفقا للبيانات المنشورة ونموذج الورم. غالبا ما يتم اختبار دراسات الجرعة في المتلقين الذين يعانون من نقص المناعة قبل دراسات الفئران HIS.
- راقب الفئران 3 مرات على الأقل أسبوعيا بحثا عن تغييرات صحية مثل فقدان الوزن والبراز الرخو والموقف المنحني وانخفاض الحركة وفقدان الفراء. قد تكون بعض الأعراض علامات على سمية الدواء أو GVHD ، وقد تحتاج جرعات الدواء إلى التقليل أو التوقف. القتل الرحيم للفئران حسب الحاجة وفقا لسياسات رعاية الحيوان واستخدامه.
6. حصاد أنسجة وأورام الفئران في نهاية الدراسة
- القتل الرحيم للفئران منفردة وفقا للإرشادات المؤسسية والبيطرية باستخدام غاز CO 2 المضغوط بمعدل تدفق 2.75 لتر / دقيقة. مراقبة الفئران المحتجزة في CO2 لمدة 1 دقيقة بعد الموت ثم إجراء خلع عنق الرحم كشكل ثانوي من القتل الرحيم.
- جمع الدم
- جمع الدم عن طريق ثقب داخل القلب. أمسك الماوس في وضع رأسي وأدخل حقنة سعة 1 مل بإبرة 25 جم مباشرة في القلب من خط يسار خط الوسط مباشرة وأسفل الضلوع. اجمع الدم في حقنة بشكل مثالي من خلال سحب طويل واحد وانقله إلى أنبوب 1.5 مل مكتوب عليه.
ملاحظة: يمكن إجراء إدخالات إبرة إضافية لجمع دم إضافي من زوايا تجويف الرئة بعناية. - اترك الدم عند 4 درجات مئوية لمدة 1 ساعة ، ثم قم بطرد الدم في جهاز طرد مركزي دقيق لمدة 6 دقائق عند 7800 × جم. اجمع السائل الصافي (الأمصال) فوق واجهة الدم في أنبوب ثان نظيف ومكتوب عليه 1.5 مل. قم بتخزين المصل في درجة حرارة -20 درجة مئوية للتحليل النهائي ، مثل السيتوكين الالتهابي البشري والفأر أو عيار الغلوبولين المناعي.
- جمع الدم عن طريق ثقب داخل القلب. أمسك الماوس في وضع رأسي وأدخل حقنة سعة 1 مل بإبرة 25 جم مباشرة في القلب من خط يسار خط الوسط مباشرة وأسفل الضلوع. اجمع الدم في حقنة بشكل مثالي من خلال سحب طويل واحد وانقله إلى أنبوب 1.5 مل مكتوب عليه.
- تشريح الأنسجة
- بعد حقن ونمو الخلايا السرطانية في الفئران وإدارة العلاجات الدوائية ، حصاد الأنسجة. ضع الفئران على لوح تشريح رغوي ، مع دبابيس لتثبيتها في مكانها ، وتمتد الذراعين والساقين بزاوية 45 درجة. قم بعمل شق في منتصف الجذع ، بدءا من الحوض ويمتد إلى الذقن ، في محاولة لتجنب قطع الصفاق (على الرغم من أن هذا ليس ضروريا). اسحب الجلد إلى الحافة وثبته في مكانه باستخدام المسامير.
- استخراج الغدد الليمفاوية (LNs) باستخدام ملقط دقيق بالترتيب التالي: الأربية ، الإبطية ، عنق الرحم ، المساريقي ، الحجاب الحاجز.
ملاحظة: في فئران HIS ، غالبا ما تكون LNs صغيرة جدا ، أو تشبه anlage ، أو "ملتهبة" بمظهر مميز على عكس مظهر الفأر البري. لذلك ، يتم أخذ الأنسجة التي تشبه LNs من كل موقع. غالبا ما تظهر LNs الطرفية على شكل "كرات" مملوءة بالسوائل ، في حين أن LNs المساريقية أكثر كثافة. LNs المساريقية هي الأكثر وضوحا واتساقا ويتم ملاحظتها كعقدة أو عقدتين أكثر كثافة متميزة ، على عكس السلسلة. - ضع LNs على جانب واحد من الشرائح الزجاجية المصنفرة في 8 مل من وسط الحصاد في طبق بتري. أمسك الشرائح بزوايا متعامدة مع الحواف المتجمدة إلى الداخل ، واضغط برفق على الأنسجة حتى يتم تحرير المحتويات الخلوية.
- شطف الشرائح عدة مرات عن طريق سحبها بعيدا ومعا لتحرير أكبر قدر ممكن من الخلايا. اجمع الخلايا التي تحتوي على ماصة زجاجية مقاس 5 بوصات وقم بترشيحها من خلال ماصة موصولة بالقطن مقاس 9 بوصات في أنبوب مخروطي سعة 15 مل مكتوب عليه.
- استخراج الطحال من الجانب الأيسر العلوي من البطن باستخدام إما زوجين من الملقط أو ملقط ومقص. لاحظ حجم الطحال كتقدير لحجم وسائط إعادة التعليق. جمع وتصفية الطحال عن طريق الهضم الميكانيكي باستخدام الشرائح الزجاجية بلوري ، كما هو الحال مع LNs.
ملاحظة: يمكن استخدام أي تقنية لإعداد الأنسجة لمعلقات الخلية الواحدة. - إجراء عد وإعادة تعليق الخلايا من عينات الأنسجة كما هو موضح أدناه.
- الطرد المركزي للخلايا الليمفاوية عند 360 × جم لمدة 10 دقائق عند 4 درجات مئوية. نضح السائل وإعادة تعليق بيليه الخلية في 1 مل من وسط الحصاد مع DNase.
- إزالة كريات الدم الحمراء من خلايا الطحال عن طريق الحضانة مع 3 مل من المخزن المؤقت لتحلل ACK في RT لمدة 3 دقائق ، تليها إضافة 10 مل من وسط الحصاد / DNase. قم بطرد خلايا الطحال مرة أخرى ، واستنشاق المادة الطافية ، وإعادة تعليق الخلايا في 1-10 مل من وسائط الحصاد / DNase ، بناء على حجم الطحال (على سبيل المثال ، 1 مل للطحال الصغير جدا وما يصل إلى 10 مل لأكبر الطحال).
- أضف حصة 10 ميكرولتر من معلق الخلية إلى 90 ميكرولتر من الوسائط واعتمد على مقياس الدم. أجهزة الطرد المركزي LNs وخلايا الطحال ، ونضح المواد الطافية ، وإعادة تعليق الخلايا في وسط الحصاد بتركيز 1 × 108 خلايا / مل ، أو بحد أدنى 80 ميكرولتر.
- استخراج الأورام.
- قم بإزالة الورم من الخاصرة المفتوحة عن طريق إمساك الورم بالملقط أثناء القص ببطء عند حواف الورم بمقص التشريح.
- بمجرد إزالة الورم ، قم بوزنه وإزالة 1/4 لمعالجة الحمض النووي الريبي والكيمياء المناعية (IHC). قسم الورم إلى نصفين ؛ ضع نصفا (1/8 من الورم بأكمله) في تجميد فلاش مبرد في السائل N2 ، واحفظه عند -80 درجة مئوية للدراسات الجينومية النهائية.
- ضع 1/8 الأخرى من الورم في أنبوب عينة مسمى يحتوي على 10٪ فورمالين. في اليوم التالي ، شطف وإعادة تعليق الأنسجة في 70 ٪ من الإيثانول حتى الاستخدام في المستقبل. ضع 3/4 المتبقية من الورم في طبق 6 سم وفرم في قطع ~ 1 مم باستخدام شفرة مشرط.
- انقل قطع الورم إلى أنبوب تفكك (انظر جدول المواد) ، واشطف الطبق ب 5 مل من وسط الكريات البيض المتسللة إلى الورم غير المكتمل (TIL) ، وأضفه إلى أنبوب التفكك.
ملاحظة: بالنسبة للأورام التي تزن >0.4 جم ، اشطف الطبق ب 10 مل من وسائط TIL غير المكتملة وأضفه إلى أنبوب التفكك. - أضف مستحضر كولاجيناز (انظر جدول المواد) بتركيز نهائي قدره 50 مجم / مل إلى الأنسجة في أنبوب التفكك. فصل الأنسجة باستخدام التفكك الميكانيكي عند 37 درجة مئوية لمدة 30 دقيقة إلى 1 ساعة ، اعتمادا على صلابة الورم.
- بعد التفكك ، مرر التعليق فوق مرشح 100 ميكرومتر في أنبوب مخروطي سعة 50 مل وشطف المرشح ب 10 مل من وسائط TIL الكاملة. سيوقف المصل الموجود في هذه الوسائط تفاعل الكولاجيناز ويحمي الخلايا من المزيد من التدهور.
- جهاز طرد مركزي تعليق خلية واحدة عند 360 × جم لمدة 10 دقائق عند 4 درجات مئوية. أعد تعليق الحبيبات في وسط حصاد كاف باستخدام DNase بحيث يمكن لتعليق الخلية المرور بسهولة عبر طرف ماصة P1000 وتسجيل الحجم لتحليل المصب.
ملاحظة: يزيد الحجم الأصغر من تجمع الخلايا المناعية للورم ولكنه أكثر عرضة لانسداد مقياس التدفق الخلوي.
7. تلطيخ الخلايا وتحليلات التدفق الخلوي
- تحضير البقع وطلاء الخلايا
- تحضير كوكتيلات تلطيخ: في يوم الحصاد ، أضف عدد العينات إلى ورقة عمل التلوين (الجدول 2 ؛ أوراق عمل "لوحة التدفق A التقليدية" و "لوحة التدفق الطيفي B" و "لوحة التدفق C التقليدية") لجميع البقع والطباعة. قم بإعداد كوكتيلات البقع السطحية للبقع A و B في محلول التلوين (SB) عن طريق إضافة كل جسم مضاد على حدة بطرف جديد ، ووضع علامة على كل كاشف أثناء التنقل ، وتخزينه عند 4 درجات مئوية لحين الحاجة. قم بإعداد أصباغ الصلاحية المناسبة في برنامج تلفزيوني خال من الأزيد وقم بتخزينها على حرارة 4 درجات مئوية لحين الحاجة (دافئة إلى RT قبل الاستخدام). قم بإعداد كوكتيل البقع السطحية C في اليوم 2 في SB جنبا إلى جنب مع البقع داخل الخلايا B و C في مخازن النفاذية الخاصة بكل منها.
- قم بإنشاء تخطيط لوحة لجميع العينات في ورقة عمل التلوين وقسمة 100 ميكرولتر من PBS الخالي من الأزيد إلى الآبار. قم بتضمين عناصر تحكم غير ملوثة لكل نسيج وبقعة (لقياس الخلايا الطيفي).
- أضف الخلايا إلى 96 لوحة بئر تحتوي على 50 ميكرولتر من PBS. بالنسبة للبقعة أ ، أعد تعليق كل مجموعة أنسجة في الحجم المناسب ، كما هو مذكور في ورقة عمل التلوين ، وقم بتخزينها عند 4 درجات مئوية حتى الحصول على مقياس التدفق الخلوي في نفس اليوم. بالنسبة للبقع B و C ، أضف 25 ميكرولتر من الليمفاوية و 60 ميكرولتر من معلقات خلايا الأنسجة غير الليمفاوية إلى الآبار باستخدام PBS.
- أداء التحفيز في المختبر من السيتوكينات للكشف عن طريق تلطيخ داخل الخلايا باستخدام وصمة عار C.
- قم بطرد مركزي للوحة البئر C 96 من الخطوة 7.1.3 عند 680 × جم لمدة 3 دقائق عند 4 درجات مئوية. أضف 200 ميكرولتر من وسائط TIL الكاملة (RPMI 1640 ، 10 mM HEPES [pH 7] ، 10٪ FBS) إلى كل بئر. قم بتخزين اللوحة مع تعليق الخلية عند 4 درجات مئوية طوال الليل.
- في وقت مبكر من صباح اليوم التالي ، قم بتخفيف كوكتيل تحفيز الخلية (انظر جدول المواد) 1: 500 في وسائط TIL الكاملة. أجهزة الطرد المركزي اللوحة التي تحتوي على تعليق الخلية عند 680 × جم لتكوير الخلايا ونفض الغبار لإزالة الوسائط. أعد تعليق الخلايا في 200 ميكرولتر من كوكتيل تحفيز الخلايا المحضر واحتضانها عند 37 درجة مئوية لمدة 1 ساعة.
- أضف 25 ميكرولتر من محلول مثبط نقل البروتين الذي يحتوي على مونينسين بتخفيف 1: 1000 في وسائط TIL كاملة ، وامزج الخلايا ، واحتضنها عند 37 درجة مئوية لمدة 4 ساعات إضافية للسماح بتراكم السيتوكينات داخل الخلايا.
- أداء تلطيخ الخلايا.
- بالنسبة للبقع A و B (اليوم 1) ، وللبقع C (اليوم 2) ، أجهزة الطرد المركزي عند 680 × g لمدة 3 دقائق عند 4 درجات مئوية. نفض الغبار عن الألواح وأضف أصباغ الصلاحية المناسبة إلى الآبار. تخلط جيدا عن طريق سحب الإصبع برفق لأعلى ولأسفل باستخدام ماصة متعددة القنوات واحتضانها لمدة 15 دقيقة في RT.
- قم بطرد الألواح (كما في الخطوة 7.1.5.1) ، ثم أضف البقع السطحية المناسبة إلى الألواح واخلطها برفق عن طريق السحب باستخدام ماصة متعددة القنوات. احتضان لمدة 15 دقيقة عند 4 درجات مئوية وأجهزة الطرد المركزي مرة أخرى. نفض الغبار عن الألواح ، وغسل الخلايا عن طريق ماصة بلطف صعودا وهبوطا مع 150 ميكرولتر من SB ، وأجهزة الطرد المركزي.
- حرك الألواح ، وكرر الغسيل عن طريق السحب برفق لأعلى ولأسفل باستخدام 150 ميكرولتر من SB ، وأجهزة الطرد المركزي عند 680 × جم لمدة 3 دقائق عند 4 درجات مئوية. بالنسبة للبقعة أ ، أعد تعليق كل مجموعة أنسجة في الحجم المناسب ، كما هو مذكور في ورقة عمل التلوين ، واحفظها عند 4 درجات مئوية. بالنسبة للبقعة B ، قم بالإصلاح باستخدام مثبت مجموعة عامل النسخ FoxP3 (انظر جدول المواد) لمدة 30 دقيقة في RT. بالنسبة للبقعة C ، ثبت في 1٪ (v / v) بارافورمالدهيد في SB لمدة 30 دقيقة في RT.
- أجهزة الطرد المركزي الألواح الثابتة عند 480 × جم لمدة 3 دقائق عند 4 درجات مئوية. اغسل 1x في SB. بالنسبة للبقعة ب ، يمكن ترك الخلايا طوال الليل.
- تخلل الخلايا: أعد تعليق الآبار في 150 ميكرولتر من مخزن نفاذية مجموعة عامل النسخ FoxP3 للبقعة B وفي 0.5٪ (وزن / حجم) سابونين في SB ل Stain C. احتضان لمدة 15 دقيقة في RT. أجهزة الطرد المركزي الألواح الثابتة عند 480 × جم لمدة 3 دقائق عند 4 درجات مئوية.
- نفض الغبار عن الأطباق وأضف كوكتيلات التلوين داخل الخلايا المعنية للبقعة B والبقع C. احتضان لمدة 30 دقيقة في RT.
- أجهزة الطرد المركزي الألواح الثابتة عند 480 × جم لمدة 3 دقائق عند 4 درجات مئوية ونفض الغبار عن الألواح. اغسل الخلايا ب 150 ميكرولتر من المخازن المؤقتة للنفاذية المقابلة (بقعة B ، مجموعة عامل النسخ FoxP3 عازلة نفاذية ؛ بقعة C ، سابونين).
- نفض الغبار عن الألواح واغسلها عن طريق سحب السحب لأعلى ولأسفل في 150 ميكرولتر من SB. جهاز طرد مركزي عند 480 × جم لمدة 3 دقائق عند 4 درجات مئوية. حرك الألواح وأعد تعليق الخلايا في SB حسب مجموعة الأنسجة في الأحجام المناسبة المذكورة في ورقة عمل التلطيخ.
ملاحظة: العينات جاهزة الآن للاقتناء عن طريق قياس التدفق الخلوي الطيفي. - قم بإعداد مقياس التدفق الخلوي (انظر جدول المواد) باستخدام عناصر تحكم مفردة مناسبة لكل بقعة وعينات غير ملوثة لكل مجموعة أنسجة لحساب الاختلافات في التألق الذاتي أثناء فك الخلط. احصل على وحدات التخزين المناسبة لكل مجموعة أنسجة كما هو محدد في ورقة عمل التلوين (الجدول 2) وقم بتصدير ملفات .fcs.
- تحليل بيانات قياس التدفق الخلوي
- باستخدام برنامج تحليل التدفق الخلوي (انظر جدول المواد) ، قم بإنشاء مساحة عمل جديدة. قم بإنشاء مجموعات جديدة لكل عضو (LN والطحال و TIL). استيراد ملفات .fcs لكل عضو إلى المجموعة.
- قم بإنشاء مخطط نقطي ثنائي المتغير، واضبط المحاور على (FSC-A x SSC-A)، وقم بتطبيق بوابة مضلعة على الأحداث الخلوية، وتجنب الأحداث على الحواف (بوابة جميع الخلايا). حدد الأحداث الخلوية ، وقم بتغيير المحاور إلى (FSC-A x FSC-H) ، وقم بتطبيق بوابة مضلعة على الأحداث على القطر الخطي ، باستثناء الأحداث التي تنحرف عن القطر لإنشاء بوابة "singlets". حدد بوابة "الفردي" وقم بتغيير المحاور إلى (hCD45 x mCD45). قم بتطبيق بوابات المضلع على الأحداث الإيجابية hCD45 و mCD45 ، وقم بتسميتها "الإنسان" و "الماوس" ، على التوالي.
- حدد عدد السكان وقم بتغيير المحور Y إلى أكوا حي / ميت. قم بتطبيق بوابة مضلعة على السكان الأحياء / الأموات السالبين ، hCD45 الإيجابي وأطلق عليه اسم "الإنسان الحي". حدد مجموعة الماوس وقم بتغيير المحور X إلى Live/Dead Aqua. قم بتطبيق بوابة مضلعة على السكان الأحياء / الميتين السالبين ، mCD45 الإيجابي وأطلق عليه اسم "الماوس الحي".
- بطريقة مماثلة ، حدد البوابة الرئيسية والمحورين X و Y كما هو موضح في أوراق عمل "بوابات التدفق A التقليدية" و "بوابات التدفق الطيفي B" و "بوابات التدفق C التقليدية" (الجدول 2) لعزل المجموعات المشار إليها (على سبيل المثال ، الخلايا البائية البشرية ، الخلايا التائية المنشطة).
ملاحظة: يتم تضمين بوابة تمثيلية لكل بقعة (نزيف ، A ، B ، C) في الملف التكميلي 2. - قم بإنشاء جداول تصدير العد والتردد في برنامج تحليل التدفق الخلوي لجميع السكان وتصديرها إلى برنامج جدول بيانات. يشار إلى السكان الأصليين للترددات في الجدول 2.
- استخدم البيانات لإنشاء رسوم بيانية بناء على مجموعات العلاج التجريبية.
ملاحظة: يمكن أيضا تحليل البيانات باستخدام حزم R في برنامج التحليل. يمكن إنشاء ملف .fcs واحد من جميع العينات المراد تحليلها باستخدام ميزة التسلسل. يمكن تقليل هذه البيانات بالأبعاد باستخدام خوارزمية T-SNE أثناء إضافة معلمات الكلمات الرئيسية لنوع الأنسجة ومجموعة العلاج. يمكن بعد ذلك استخدام خوارزمية FlowSOM لتجميع السكان ويمكن استخدام أداة ClusterExplorer لتحديد السكان. يمكن تحديد مجموعات الخلايا الجديدة بهذه الطريقة ، ومقارنتها بصريا ، وقياسها كميا بين مجموعات العلاج أو داخل الأنسجة المختلفة. - ربط المعلمات المناعية للأورام داخل نفس مجموعة العلاج ، مع نمو هذا الورم لتحديد الأنماط المناعية التي ترتبط بتثبيط نمو الورم. حدد نمو الورم من خلال معدل النمو المحدد (SGR) لهذا الورم ، وهو قياس يأخذ في الاعتبار الاختلاف في أحجام الورم خلال فترة زمنية محددة. يعمل هذا القياس على تطبيع الأورام التي يتم حصادها في أيام مختلفة بسبب صحة الفئران وتواريخ بدء العلاج.
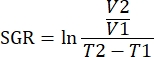
النتائج
باتباع بروتوكول ورم الجناح والجدول الزمني التجريبي (الشكل 1) ، تمت دراسة نمو الورم والاستجابة المناعية للعلاج المستهدف بمثبطات التيروزين كيناز (TKI) والعلاج المركب نيفولوماب في اثنين من PDXs لسرطان القولون والمستقيم البشري (CRC). تمت دراسة أدوية TKI في المضيفين الذين يعانون من نق...
Discussion
على مدى السنوات ال 6 الماضية ، باستخدام خبرتنا في كل من علم المناعة والفئران الإنسانية ، طور فريق البحث لدينا نموذجا قبل سريريا تشتد الحاجة إليه لاختبار العلاجات المناعية على مجموعة متنوعة من الأورام البشرية3،7،30،31. يؤ?...
Disclosures
اي.
Acknowledgements
نود أن نشكر كلا من مرفق أبحاث الحيوان (OLAR) على رعايتهم للفئران لدينا ، ومورد قياس التدفق الخلوي المشترك المدعوم من منحة دعم مركز السرطان (P30CA046934) في معهدنا لمساعدتهم الهائلة في جميع أعمالنا. كما نعرب عن تقديرنا لكل من غيل إيكهاردت وآنا كاباسو لتعاوننا الافتتاحي في دراسة العلاجات المناعية ل PDXs البشرية في نموذج HIS-BRGS الخاص بنا. تم دعم هذه الدراسة جزئيا من قبل المعاهد الوطنية للصحة P30CA06934 منحة دعم مركز السرطان باستخدام الموارد المشتركة PHISM (نماذج فأر جهاز المناعة البشري قبل السريرية) ، RRID: SCR_021990 ومورد قياس التدفق الخلوي المشترك ، RRID: SCR_022035. تم دعم هذا البحث جزئيا من قبل NIAID التابع للمعاهد الوطنية للصحة بموجب العقد رقم 75N93020C00058.
Materials
| Name | Company | Catalog Number | Comments |
| 1 mL syringe w/needles | McKesson | 1031815 | |
| 15 mL tubes | Grenier Bio-One | 188271 | |
| 2-mercaptoethanol | Sigma | M6250 | |
| 50 mL tubes | Grenier Bio-One | 227261 | |
| AutoMACS Pro Separator | Miltenyi | 130-092-545 | |
| BD Golgi Stop Protein Transport Inhibitor with monensin | BD Bioscience | BDB563792 | |
| BSA | Fisher Scientific | BP1600100 | |
| Cell Stim Cocktail | Life Technologies | 509305 | |
| Chill 15 Rack | Miltenyi | 130-092-952 | |
| Cotton-plugged glass pipettes | Fisher Scientific | 13-678-8B | |
| Cultrex Basement membrane extract | R&D Systems | 363200502 | |
| Cytek Aurora | Cytek | ||
| DNase | Sigma | 9003-98-9 | |
| eBioscience FoxP3/Transcription Factor Staining Buffer Set | Invitrogen | 00-5523-00 | |
| Embryonic Stemcell FCS | Gibco | 10439001 | |
| Eppendorf Tubes; 1.5 mL volume | Grenier Bio-One | 616201 | |
| Excel | Microsoft | ||
| FBS | Benchmark | 100-106 500mL | |
| Ficoll Hypaque | GE Healthcare | 45001752 | |
| FlowJo Software | BD Biosciences | ||
| Forceps - fine | Roboz Surgical | RS5045 | |
| Forceps normal | Dumont | RS4919 | |
| Formaldehyde | Fisher | F75P1GAL | |
| Frosted Glass Slides | Corning | 1255310 | |
| Gentlemacs C-Tubes | Miltenyi | 130-096-334 | |
| GentleMACS Dissociator | Miltenyi | 130-093-235 | |
| glass pipettes | DWK Life Sciences | 63A53 | |
| Glutamax | Gibco | 11140050 | |
| HBSS w/ Ca & Mg | Sigma | 55037C | |
| HEPES | Corning | MT25060CI | |
| IgG standard | Sigma | I2511 | |
| IgM standard | Sigma | 401108 | |
| IMDM | Gibco | 12440053 | |
| Liberase DL | Roche | 5466202001 | |
| LIVE/DEAD Fixable Blue | Thermo | L23105 | |
| MDA-MB-231 | ATCC | HTB-26 | |
| MEM | Gibco | 1140050 | |
| mouse anti-human IgG-AP | Southern Biotech | JDC-10 | |
| mouse anti-human IgG-unabeled | Southern Biotech | H2 | |
| mouse anti-human IgM-AP | Southern Biotech | UHB | |
| mouse anti-human IgM-unlabeled | Southern Biotech | SA-DA4 | |
| MultiRad 350 | Precision X-Ray | ||
| PBS | Corning | 45000-446 | |
| Pen Strep | Gibco | 15140122 | |
| Petri Dishes | Fisher Scientific | FB0875713A | |
| p-nitrophenyl substrate | Thermo | 34045 | |
| PRISM | Graphpad | ||
| Rec Hu FLT3L | R&D systems | 308-FK-005/CF | |
| Rec Hu IL6 | R&D systems | 206-IL-010/CF | |
| Rec Hu SCF | R&D systems | 255SC010 | |
| RPMI 1640 | Corning | 45000-39 | |
| Saponin | Sigma | 8047-15-2 | |
| Scissors | McKesson | 862945 | |
| Serological pipettes 25 mL | Fisher Scientific | 1367811 | |
| Sterile filter | Nalgene | 567-0020 | |
| Sterile molecular water | Sigma | 7732-18-5 | |
| Yeti Cell Analyzer | Bio-Rad | 12004279 | |
| Zombie Green | biolegend | 423112 |
References
- Chulpanova, D. S., Kitaeva, K. V., Rutland, C. S., Rizvanov, A. A., Solovyeva, V. V. Mouse tumor models for advanced cancer immunotherapy. International Journal of Molecular Sciences. 21 (11), 4118 (2020).
- Olson, B., Li, Y., Lin, Y., Liu, E. T., Patnaik, A. Mouse models for cancer immunotherapy research. Cancer Discovery. 8 (11), 1358-1365 (2018).
- Marin-Jimenez, J. A., et al. Testing cancer immunotherapy in a human immune system mouse model: correlating treatment responses to human chimerism, therapeutic variables and immune cell phenotypes. Frontiers in Immunology. 12, 607282 (2021).
- Yin, L., Wang, X. J., Chen, D. X., Liu, X. N., Wang, X. J. Humanized mouse model: a review on preclinical applications for cancer immunotherapy. American Journal of Cancer Research. 10 (12), 4568-4584 (2020).
- Cogels, M. M., et al. Humanized mice as a valuable pre-clinical model for cancer immunotherapy research. Frontiers in Oncology. 11, 784947 (2021).
- Jin, K. T., et al. Development of humanized mouse with patient-derived xenografts for cancer immunotherapy studies: A comprehensive review. Cancer Science. 112 (7), 2592-2606 (2021).
- Capasso, A., et al. Characterization of immune responses to anti-PD-1 mono and combination immunotherapy in hematopoietic humanized mice implanted with tumor xenografts. Journal for Immunotherapy of Cancer. 7 (1), 37 (2019).
- Wang, M., et al. Humanized mice in studying efficacy and mechanisms of PD-1-targeted cancer immunotherapy. The FASEB Journal. 32 (3), 1537-1549 (2018).
- Yong, K. S. M., et al. Humanized mouse as a tool to predict immunotoxicity of human biologics. Frontiers in Immunology. 11, 553362 (2020).
- Shen, H. W., Jiang, X. L., Gonzalez, F. J., Yu, A. M. Humanized transgenic mouse models for drug metabolism and pharmacokinetic research. Current Drug Metabolism. 12 (10), 997-1006 (2011).
- Bosma, G. C., Custer, R. P., Bosma, M. J. A severe combined immunodeficiency mutation in the mouse. Nature. 301 (5900), 527-530 (1983).
- Shultz, L. D., et al. Multiple defects in innate and adaptive immunologic function in NOD/LtSz-scid mice. The Journal of Immunology. 154 (1), 180-191 (1995).
- Legrand, N., et al. Functional CD47/signal regulatory protein alpha (SIRP(alpha)) interaction is required for optimal human T- and natural killer- (NK) cell homeostasis in vivo. Proceedings of the National Academy of Sciences. 108 (32), 13224-13229 (2011).
- Ishikawa, F., et al. Development of functional human blood and immune systems in NOD/SCID/IL2 receptor {gamma} chain(null) mice. Blood. 106 (5), 1565-1573 (2005).
- Ito, M., et al. NOD/SCID/gamma(c)(null) mouse: an excellent recipient mouse model for engraftment of human cells. Blood. 100 (9), 3175-3182 (2002).
- Shultz, L. D., et al. Human lymphoid and myeloid cell development in NOD/LtSz-scid IL2R gamma null mice engrafted with mobilized human hemopoietic stem cells. The Journal of Immunology. 174 (10), 6477-6489 (2005).
- Traggiai, E., et al. Development of a human adaptive immune system in cord blood cell-transplanted mice. Science. 304 (5667), 104-107 (2004).
- Theocharides, A. P., Rongvaux, A., Fritsch, K., Flavell, R. A., Manz, M. G. Humanized hemato-lymphoid system mice. Haematologica. 101 (1), 5-19 (2016).
- Goldman, J. P., et al. Enhanced human cell engraftment in mice deficient in RAG2 and the common cytokine receptor gamma chain. British Journal of Haematology. 103 (2), 335-342 (1998).
- Stripecke, R., et al. Innovations, challenges, and minimal information for standardization of humanized mice. EMBO Molecular Medicine. 12 (7), (2020).
- Allen, T. M., et al. Humanized immune system mouse models: progress, challenges and opportunities. Nature Immunology. 20 (7), 770-774 (2019).
- Gammelgaard, O. L., Terp, M. G., Preiss, B., Ditzel, H. J. Human cancer evolution in the context of a human immune system in mice. Molecular Oncology. 12 (10), 1797-1810 (2018).
- Rios-Doria, J., Stevens, C., Maddage, C., Lasky, K., Koblish, H. K. Characterization of human cancer xenografts in humanized mice. Journal for Immunotherapy of Cancer. 8 (1), 000416 (2020).
- Gombash Lampe, S. E., Kaspar, B. K., Foust, K. D. Intravenous injections in neonatal mice. Journal of Visualized Experiments. (93), e52037 (2014).
- Lang, J., Weiss, N., Freed, B. M., Torres, R. M., Pelanda, R. Generation of hematopoietic humanized mice in the newborn BALB/c-Rag2null Il2rγnull mouse model: a multivariable optimization approach. Clinical Immunology. 140 (1), 102-116 (2011).
- Laskowski, T. J., Hazen, A. L., Collazo, R. S., Haviland, D. Rigor and reproducibility of cytometry practices for immuno-oncology: a multifaceted challenge. Cytometry Part A. 97 (2), 116-125 (2020).
- Bagby, S., et al. Development and maintenance of a preclinical patient derived tumor xenograft model for the investigation of novel anti-cancer therapies. Journal of Visualized Experiments. (115), e54393 (2016).
- Laajala, T. D., et al. Optimized design and analysis of preclinical intervention studies in vivo. Scientific Reports. 6, 30723 (2016).
- Na, Y. S., et al. Establishment of patient-derived xenografts from patients with gastrointestinal stromal tumors: analysis of clinicopathological characteristics related to engraftment success. Scientific Reports. 10 (1), 7996 (2020).
- Tentler, J. J., et al. RX-5902, a novel beta-catenin modulator, potentiates the efficacy of immune checkpoint inhibitors in preclinical models of triple-negative breast cancer. BMC Cancer. 20 (1), 1063 (2020).
- Lang, J., et al. Development of an adrenocortical cancer humanized mouse model to characterize anti-PD1 effects on tumor microenvironment. The Journal of Clinical Endocrinology & Metabolism. 105 (1), 26-42 (2020).
- Lang, J., et al. Studies of lymphocyte reconstitution in a humanized mouse model reveal a requirement of T cells for human B cell maturation. The Journal of Immunology. 190 (5), 2090-2101 (2013).
- Katano, I., et al. NOD-Rag2null IL-2Rγnull mice: an alternative to NOG mice for generation of humanized mice. Experimental Animalas. 63 (3), 321-330 (2014).
- Brehm, M. A., et al. Parameters for establishing humanized mouse models to study human immunity: analysis of human hematopoietic stem cell engraftment in three immunodeficient strains of mice bearing the IL2rγ(null) mutation. Clinical Immunology. 135 (1), 84-98 (2010).
- Hasgur, S., Aryee, K. E., Shultz, L. D., Greiner, D. L., Brehm, M. A. Generation of immunodeficient mice bearing human immune systems by the engraftment of hematopoietic stem cells. Methods in Molecular Biology. 1438, 67-78 (2016).
- Andre, M. C., et al. Long-term human CD34+ stem cell-engrafted nonobese diabetic/SCID/IL-2Rγnull mice show impaired CD8+ T cell maintenance and a functional arrest of immature NK cells. The Journal of Immunology. 185 (5), 2710-2720 (2010).
- Wunderlich, M., et al. Improved multilineage human hematopoietic reconstitution and function in NSGS mice. PLoS One. 13 (12), 0209034 (2018).
- Lee, J., Brehm, M. A., Greiner, D., Shultz, L. D., Kornfeld, H. Engrafted human cells generate adaptive immune responses to Mycobacterium bovis BCG infection in humanized mice. BMC Immunology. 14, 53 (2013).
- Masse-Ranson, G., et al. Accelerated thymopoiesis and improved T-cell responses in HLA-A2/-DR2 transgenic BRGS-based human immune system mice. European Journal of Immunology. 49 (6), 954-965 (2019).
- Oswald, E., et al. Immune cell infiltration pattern in non-small cell lung cancer PDX models is a model immanent feature and correlates with a distinct molecular and phenotypic make-up. Journal for Immunotherapy of Cancer. 10 (4), 004412 (2022).
Erratum
Formal Correction: Erratum: Testing Cancer Immunotherapeutics in a Humanized Mouse Model Bearing Human Tumors
Posted by JoVE Editors on 5/25/2023. Citeable Link.
An erratum was issued for: Testing Cancer Immunotherapeutics in a Humanized Mouse Model Bearing Human Tumors. The Authors section was updated from:
Jordi M. Lanis1
Matthew S. Lewis1
Hannah Strassburger1
Stacey M. Bagby2
Adrian T. A. Dominguez2
Juan A. Marín-Jiménez3
Roberta Pelanda1
Todd M. Pitts2
Julie Lang1
1Department of Immunology and Microbiology, School of Medicine, University of Colorado Denver Anschutz Medical Campus
2Division of Oncology, School of Medicine, University of Colorado Denver Anschutz Medical Campus
3Department of Medical Oncology, Catalan Institute of Oncology (ICO-L’Hospitalet)
to:
Jordi M. Lanis1
Matthew S. Lewis1
Hannah Strassburger1
Kristina Larsen1
Stacey M. Bagby2
Adrian T. A. Dominguez2
Juan A. Marín-Jiménez3
Roberta Pelanda1
Todd M. Pitts2
Julie Lang1
1Department of Immunology and Microbiology, School of Medicine, University of Colorado Denver Anschutz Medical Campus
2Division of Oncology, School of Medicine, University of Colorado Denver Anschutz Medical Campus
3Department of Medical Oncology, Catalan Institute of Oncology (ICO-L’Hospitalet)
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved