Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
İnsan Tümörleri Taşıyan İnsanlaştırılmış Bir Fare Modelinde Kanser İmmünoterapötiklerinin Test Edilmesi
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Erratum Notice
Özet
Bu protokol, immüno-onkoloji çalışmaları için insan bağışıklık sistemi (HIS) farelerinin neslini özetlemektedir. Bu modelde implante edilen insan tümörleri üzerinde insan immünoterapötiklerini test etmek için bu modelin kullanımındaki talimatlar ve hususlar, insan bağışıklık sisteminin tümöre tepkisini karakterize etmeye vurgu yapılarak sunulmuştur.
Özet
Tümör mikroçevresinin immünsüpresif doğasının tersine çevrilmesi, immünoterapi ilaçları ile kanserlerin başarılı tedavisi için kritik öneme sahiptir. Murin kanseri modelleri çeşitliliklerinde son derece sınırlıdır ve kliniğe kötü çeviriden muzdariptir. İmmünoterapi çalışmaları için daha fizyolojik bir preklinik model olarak hizmet etmek için, bu protokol, bir insan bağışıklık sistemi ile yeniden oluşturulmuş bir farede insan tümörlerinin tedavisini değerlendirmek için geliştirilmiştir. Bu eşsiz protokol, insan bağışıklık sistemi (HIS, "insancıllaştırılmış") farelerin gelişimini, ardından hücre hattından türetilmiş bir ksenograft (CDX) veya hasta kaynaklı bir ksenogreft (PDX) olmak üzere bir insan tümörünün implantasyonunu göstermektedir. HIS fareleri, göbek kordon kanından izole edilen CD34 + insan hematopoetik kök hücrelerinin, ksenojenik bir tümörü de kabul edebilen yüksek immün yetmezlikli farelere yenidoğan BRGS'ye (BALB / c Rag2-/- IL2RγC-/- NODSIRPα) enjekte edilmesiyle üretilir. İnsan bağışıklık sistemi gelişiminin ve tümör implantasyonunun kinetiğinin ve özelliklerinin önemi vurgulanmaktadır. Son olarak, akış sitometrisi kullanılarak tümör mikroçevresinin derinlemesine bir değerlendirmesi açıklanmaktadır. Bu protokolü kullanan çok sayıda çalışmada, bireysel tümörlerin tümör mikroçevresinin HIS-PDX farelerde özetlendiği bulunmuştur; "Sıcak" tümörler büyük bağışıklık infiltrasyonu sergilerken, "soğuk" tümörler bunu yapmaz. Bu model, çok çeşitli insan tümörleri için kombinasyon immünoterapileri için bir test alanı görevi görür ve kişiselleştirilmiş tıp arayışında önemli bir aracı temsil eder.
Giriş
Fare kanseri modelleri, tümör büyümesinin ve immün kaçışın temel mekanizmalarını oluşturmak için önemlidir. Bununla birlikte, fare modellerinde yapılan kanser tedavisi çalışmaları, sınırlı sinjenik modeller ve türe özgü farklılıklar nedeniyle kliniğe sonlu çeviri sağlamıştır 1,2. İmmün tedavilerin tümörleri kontrol etmek için baskın bir yaklaşım olarak ortaya çıkması, fonksiyonel bir insan bağışıklık sistemine sahip in vivo bir modele olan ihtiyacı yinelemiştir. Son on yılda insan bağışıklık sistemi farelerinde (HIS fareleri) meydana gelen ilerlemeler, immüno-onkolojiyi in vivo olarak çok çeşitli kanser türlerinde ve immünoterapötik ajanlarda incelemeyi mümkün kılmıştır 3,4,5,6. Hücre hattı kaynaklı ve hasta kaynaklı ksenogreftler (sırasıyla CDX ve PDX) dahil olmak üzere insan tümör modelleri, HIS farelerinde iyi büyür ve çoğu durumda, insan hematopoetik engraftmanı olmayan immün yetmezlikli konakçıdaki büyümeleriyle neredeyse aynıdır 7,8. Bu önemli bulguya dayanarak, araştırmacılar, immünsüpresyonu azaltmak ve böylece bağışıklık yönelimli tümör öldürmeyi arttırmak için tümör mikroçevresini (TME) değiştirmek için tasarlanmış kombinasyon terapileri de dahil olmak üzere insan immünoterapilerini incelemek için HIS fare modelini kullanıyorlar. Bu preklinik modeller, insan kanserlerinin heterojenliği konularının ele alınmasına yardımcı olur ve ayrıca tedavi başarısını tahmin edebilir ve bağışıklıkla ilişkili ilaç toksisitelerini izleyebilir 9,10.
İnsan hematopoetik kök hücrelerinin tanıtılması yoluyla insan bağışıklık sistemine sahip bir fare modelinin üretilmesi, ksenograftı reddetmeyecek bir alıcı immün yetmezlikli fare gerektirir. Mevcut HIS fare modelleri, 30 yıl önce bildirilen immün yetmezlikli fare suşlarından türetilmiştir. Tanımlanan ilk immün yetmezlikli fare suşu, T ve B hücreleri11'den yoksun SCID fareleriydi, bunu insan CD47 molekülü12,13'e NOD SIRPa alelinin bağlanmasının artması nedeniyle, insan hücrelerine fare makrofaj toleransından sorumlu bir SIRPa polimorfizmine sahip hibrit bir NOD-SCID izledi. 2000'li yılların başında, IL-2 reseptörünün (IL-2Rγc) ortak gama zincirinin hem BALB / c hem de NOD immün yetmezlikli suşlarda silinmesi, konakçı NK hücre gelişimini yasaklayan genetik delesyonlar nedeniyle gelişmiş insan engraftmanı için bir oyun değiştiriciydi14,15,16,17. BRG ve NRG fareleri gibi alternatif modeller, T ve B hücre reseptör geninin yeniden düzenlenmesi için gerekli olan Rag1 veya Rag2 geninin silinmesi ve böylece lenfositlerin olgunlaşması ve hayatta kalması yoluyla T ve B hücre eksikliğine ulaşır18,19. Burada kullanılan BRGS (BALB/c -Rag2 nullIl2R γCnullSirpαNOD) faresi, IL-2Rγ zincir eksikliğini ve Rag2-/- arka planındakiNOD SIRPα alelini birleştirerek, T, B veya NK hücreleri olmayan, ancak 30 haftadan fazla uzun süreli aşılamaya izin verecek kadar güçlü ve sağlıklı bir fareyle sonuçlanan yüksek immün yetmezlikli bir fare ile sonuçlanır13.
HIS fareleri çeşitli şekillerde üretilebilir, insan PBMC enjeksiyonu en doğrudan yöntem15,18,20'dir. Bununla birlikte, bu fareler, 12 haftalıkken greft versus host hastalığı (GVHD) ile sonuçlanan ve uzun süreli çalışmaları önleyen aktif insan T hücrelerinin belirgin bir genişlemesine sahiptir. Alternatif olarak, göbek kordon kanı (CB), kemik iliği ve fetal karaciğerden elde edilen insan hematopoetik kök hücreleri, insan bağışıklık sistemi de novo'nun engraftasyonu ve üretimi için de kullanılabilir. Bu sistemde, hematopoetik kök hücreler, çoğunlukla T hücreleri geliştiren PBMC farelerine kıyasla, fare konakçısına önemli ölçüde toleranslı olan T, B ve doğuştan gelen bağışıklık hücrelerinin üretilmesiyle çok soylu bir insan bağışıklık sistemi üretir. Bu nedenle, GVHD yoktur veya büyük ölçüde gecikmiştir ve çalışmalar 10 aya kadar olan farelere genişletilebilir. CB, genetik olarak aynı bağışıklık sistemlerine sahip birden fazla HIS faresinin aşılanmasını kolaylaştıran kolay, erişilebilir ve invaziv olmayan bir CD34 + insan hematopoetik kök hücre kaynağı sağlar 17,18,20,21. Son birkaç yılda, HIS fare modelleri immünoterapiyi ve TME 3,4,5,6'yı incelemek için yaygın olarak kullanılmıştır. Bu farelerde insan kaynaklı bağışıklık sistemlerinin gelişmesine rağmen, insan ksenogreft tümörleri, kontrol immün yetmezlikli farelere kıyasla benzer oranlarda büyür ve aşılanmış PDX'in mikro ortamını korumak için önemli olan kanser hücreleri ile bağışıklık hücreleri arasındaki karmaşık etkileşime izin verir 3,7,8 . Bu protokol, PDX'ler ve CDX'ler ile HIS-BRGS farelerde tedavileri test eden 50'den fazla çalışma gerçekleştirmek için kullanılmıştır. Önemli bir sonuç, HBYS farelerindeki insan tümörlerinin, tümörün ilk hasta örneğine göre moleküler değerlendirmesi ve immün infiltrasyon özellikleri 3,22,23 ile tanımlandığı gibi benzersiz TME'lerini koruduğudur. Grubumuz, çok parametreli akım sitometrisi kullanılarak hem immün organlarda hem de tümörde HBYS'nin derinlemesine değerlendirilmesine odaklanmaktadır. Burada, BRGS farelerinin insancıllaştırılması, kimerizmin değerlendirilmesi, insan tümörlerinin implantasyonu, tümör büyüme ölçümleri, kanser tedavisi uygulaması ve HIS hücrelerinin akış sitometrisi ile analizi için bir protokol açıklanmaktadır.
Protokol
Tüm hayvan çalışmaları, Colorado Denver Üniversitesi Kurumsal Hayvan Bakımı ve Kullanımı Komitesi (IACUC Protokolleri #00593 ve #00021) tarafından onaylanan hayvan protokolleri kapsamında gerçekleştirilmiştir. Tüm hayvan çalışmaları, Colorado Denver Üniversitesi Anschutz Tıp Kampüsü'ndeki Amerikan Laboratuvar Hayvanları Bakımı Derneği tarafından akredite edilmiş bir tesis olan Laboratuvar Hayvanları Kaynakları Ofisi'ne (OLAR) uygun olarak gerçekleştirildi. Tüm insan kordon kanı örnekleri, kimliği belirsiz bağışçılardan bağış olarak alınmıştır ve bu nedenle insan araştırma etik komitesinin onayına tabi değildir.
NOT: Protokolde belirtilen tüm medya ve çözümlerin bileşimleri Ek Dosya 1'de yer almaktadır. Şekil 1 , HIS-BRGS farelerinde tümörlere karşı immün yanıtların oluşturulması ve analizi için genel protokolü göstermektedir.
1. HIS farelerinin nesli
- BALB/c -Rag2 null Il2RγCnull SirpαNOD (BRGS) farelerin fare yetiştiriciliği
NOT: Bu suş, T, B veya NK hücreleri olmadan son derece immün yetmezdir. Bu nedenle, fırsatçı enfeksiyonları önlemek için sıkı önlemler alınmalıdır. Koloniyi, normal bir diyetle alternatif 2 haftalık bir programda trimetoprim ve sülfadiazin içeren bir diyette tutun. Mümkün olan en yüksek önlem barınma odasında (örneğin, sınırlı erişime sahip bir bariyer duş tesisi) muhafaza edin.- BALB/c -Rag2 null Il2RγC null Sirpα NOD (BRGS) ve BALB/c Rag2 null Il2RγC null SirpaBalb/c (BRG) homozigot farelerin kolonilerini damızlık olarak koruyun.
- İnsan kök hücrelerinin alıcıları olarak kullanılmak üzere BRGS B /N yavruları üretmek için BRGS N/ N × BRGB / Bdoğurun. Bu kolonide, BRGS B / N, BRGSN / N'den daha sağlıklıdır ve eşdeğer seviyelerde (BRG'den daha fazla) engrafttır.
- CD34 + göbek CB'den insan kök hücre izolasyonu
NOT: Bu prosedür için antibiyotik kullanılmaz. Bu nedenle, iyi steril teknik şarttır.- Sterilize edilmiş bir biyogüvenlik kabinine (BSC) 50 mL'lik bir konik tüp rafının yanı sıra 3x 15 mL ve ~ 10x 50 mL konik tüpler yerleştirin. % 70 etanol içeren bir kan toplama torbası püskürtün ve BSC'de kurumasını bekleyin.
- CB yoğunluğu gradyan izolasyonu için gereken 50 mL konik tüp sayısını = CB hacmi/15, yukarı yuvarlanmış ve çift tüp numarasına hesaplayın. Tüp başına kan hacmini hesaplayın = CB hacmi / tüp sayısı. CB torbasından her konik tüpe dikkatlice kan dökün; bu, tüp başına maksimum 15 mL'dir. Otomatik pipetleyici ve 25 mL serolojik pipet kullanarak kanı 1:1 oranında steril PBS ile yukarı ve aşağı pipetleyerek karıştırın.
- Düşük hızda otomatik bir pipetör ve 10 mL serolojik pipet kullanarak arayüzü bozmadan kanın altına oda sıcaklığı (RT) 1,077 g/mL yoğunluk gradyan çözeltisi (bkz. Pipet ucunun tüp tabanına temas etmesini önleyin. Tüm tüpler için tekrarlayın. Daha sonra yoğunluk gradyanının korunmasını sağlamak için RT'de frenleme olmadan 850 x g'de 30 dakika boyunca santrifüj.
- 1,077 g/mL yoğunluk gradyanının üstündeki hücresel buffy kaplamayı bulutlu beyaz bir tabaka olarak görselleştirin. 25 mL serolojik pipet ve otomatik pipetleyici kullanarak plazma tabakasını kabarık katın yaklaşık 10 mL yukarısına kadar çıkarın ve atın.
- Buffy ceketini steril bir transfer veya serolojik pipet ile toplayın. Hücreleri yukarı çekmek için ampulü serbest bırakırken (veya yavaşça pipetleme) hücreleri serbest bırakırken, hücreleri yukarı çekmek için hücreleri konik tüpün yanından kazımak için pipeti bir spatula gibi kullanın. İki adet 50 mL'lik konik tüpteki buffy kaplamaları yeni bir 50 mL konik tüpte birleştirin.
- Her konik tüpe %2 FBS içeren 45 mL steril HBSS dökerek hücreleri yıkayın. RT'de 360 x g'de 11 dakika boyunca santrifüj.
- Yıkama ortamını tüm tüplerdeki peletlere kadar aspire edin. İlk peleti %2 FBS içeren 10 mL HBSS'de yeniden askıya almak için 10 mL serolojik pipet ve otomatik pipetleyici kullanın. Her bir peleti aynı 10 mL HBSS'de tekrar askıya alın ve tüm hücreleri tek bir tüpte toplamak için her tüpü ek 10 mL HBSS ile durulayın.
- Konik tüpe %2 FBS içeren 45 mL steril HBSS dökün. 360 x g'de, 4 °C'de 10 dakika boyunca santrifüj.
- Yıkama tamponunu hücre peletine kadar aspire edin ve peleti 20 mL manyetik hücre ayırıcı tamponunda yeniden askıya alın ( bkz. Metilen mavisinde 1:20 seyreltmede hemasitometre ile hücreleri saymak için küçük bir aliquot çıkarın. Mavi ve beyaz hücrelerin sayısını ekleyin. 360 x g'de santrifüj, 4 °C'de 10 dakika.
NOT: Bu protokol manyetik boncuk teknolojisini kullanır (bkz. Protokol, CD34+ kök hücrelerin yeterli saflığı ve verimi ile herhangi bir hücre ayırma teknolojisi ile kullanılmak üzere değiştirilebilir. - Süpernatantı aspire edin ve kordon kanından izole edilen CD34+ hücre peletini 1 x 108 hücre başına 300 μL manyetik hücre ayırıcı tamponunda yeniden askıya alın. Önce 100 μL FcR bloke edici reaktif, ardından 1 x 108 hücre başına 100 μL CD34+ manyetik boncuk ekleyin. 4 ° C'de 30 dakika boyunca inkübe edin (buz yok).
- 1 x 108 hücre başına 5 mL manyetik hücre ayırıcı tampon ekleyin ve 4 ° C'de 10 dakika boyunca 360 x g'de döndürün. Yıkama adımını tekrarlayın ve peleti "fraksiyone edilmemiş" etiketli 15 mL'lik bir konik tüpte 1 x 108 hücre başına 500 μL manyetik hücre ayırıcı tamponunda yeniden askıya alın.
- İki adet daha 15 mL konik tüp "CD34-" ve "CD34+" etiketleyin. Üç adet 15 mL konik tüpü (fraksiyone edilmemiş, CD34- ve CD34+) sırasıyla A1, B1 ve C1 yuvalarına bir soğutma rafına yerleştirin (bkz. Üreticinin cihaz talimatlarına göre, bir BSC'deki otomatik manyetik hücre ayırıcıdaki iki sütunlu pozitif seçim programını kullanarak hücreleri ayırın (bkz.
- CD34+ insan kök hücrelerinin genişletilmesi ve dondurulması
- Geri kazanılan CD34+ hücre süspansiyonunun (2 mL) 10 μL'sini bir hemositometre slaytı üzerinde aliquot edin ve hücreleri 10x büyütme altında sayın. Hücre sayısını 2 x 104 ile çarparak CD34+ hücrelerinin toplam sayısını hesaplayın. Dondurulacak şişe sayısını hesaplamak için toplam CD34+ hücre sayısını 250.000'e bölün ( in vitro genişlemeden önce fare yavrusu başına 50.000 hücre).
- CB ortamı Iscove'un 40 ng / mL kök hücre faktörü, 20 ng / mL Flt3L ve 10 ng / mL IL-6 ile desteklenmiş% 10 FCS'sini (artı filtreleme kaybı için 1 mL ekstra) hazırlayın ve 0.22 μm filtreden geçirin. CD34 + hücrelerini mL CB ortamı başına 100.000'de yeniden askıya alın ve 37 ° C'de inkübe edin. 3. günde, hücreleri içeren şişeye sitokinsiz eşdeğer miktarda CB ortamı ve sitokinli CB ortamı ekleyin.
NOT: Bu sitokinlerin CB ortamına eklenmesi, farklılaşmayı önlerken CD34 + hücrelerinin hayatta kalmasını ve genişlemesini teşvik eder. - Genişletilmiş CD34 + hücrelerini 5. günde toplayın. Hücre süspansiyonunu yukarı ve aşağı pipet edin ve 50 mL'lik bir konik tüpte toplayın. Şişenin tabanını örtmek için yeterli CB ortamı ekleyin. Bir hücre kazıyıcı kullanarak, şişenin tüm tabanını kazıyın. Tüm medyayı aynı 50 mL'lik tüpte toplayın ve 11 dakika boyunca 360 x g'de santrifüj yapın.
- Hücreleri 2 mL CB ortamında yeniden askıya alın. Pipetteki son damlayı sayım için 96 delikli bir plakaya kaydedin. Hücreleri tripan mavisinde 1: 1 oranında seyreltin ve hemasitometreye 10 μL ekleyin, ardından dört kadrandan hücreleri sayın ve ortalamasını alın. Hücre sayısını 4 x 104 ile çarparak CD34+ hücrelerinin toplam sayısını hesaplayın ve canlılığı kaydedin.
- n + 1 mL dondurma ortamı yapın, burada n, adım 1.3.1'de hesaplanan dondurma şişelerinin sayısıdır. FBS'ye %10 (v/v) DMSO ekleyerek donma ortamını hazırlayın ve buzda tutun. Kriyovyalleri CB#, CD34+ d5 ve tarih ile etiketleyin.
- CD34+ hücrelerini 360 x g'de 4 °C'de 10 dakika boyunca döndürün. Ortamı peletin içine doğru aspire edin ve hücre peletini dondurucu ortamda yeniden askıya alın. Her bir şişeye 1 mL hücre süspansiyonu alın ve kalan kısmı şişeler arasında eşit olarak bölün. Şişeleri 4 ° C'ye soğutulmuş bir izopropanol hücreli dondurucuya ekleyin, -80 ° C'ye yerleştirin ve >90 gün boyunca saklamak için sıvı azota aktarın.
- Fare yavrularının ışınlanması
- BRGSB / N yavrularını, doğumdan 1-3 gün sonra, dolgulu otoklavlanmış plastik bir kutuya toplayın. Yavrularla az miktarda yatak takımı ekleyin. Kutuyu kafes numarası ve yavru sayısı ile etiketleyin.
- Işınlayıcıyı (bkz. Malzeme Tablosu) 300 rad'lık bir doz için ayarlayın. Yavru kutusunu ışınlayıcıya yerleştirin ve 300 rad'a maruz bırakın. Yavruları kafeslerine geri götürün, bir yığına yerleştirin ve yatak takımlarıyla örtün.
- Yavru enjeksiyonları ve CD34+ hücre hazırlığı
- CD34 + hücre preparasyonuna ışınlamadan ~ 3 saat sonra başlayın. 10 mL'lik CB ortamını 50 mL'lik bir konik tüpte ısıtın. Steril bir BSC'de tüm adımları gerçekleştirin.
- Her dört ila altı yavru için bir şişe in vitro genişletilmiş ve dondurulmuş CD34 + hücresi alın. Sadece az miktarda buz görünene kadar 55 ° C'de hızla çözülür ve hücreleri ısıtılmış CB ortamına ekleyin (şişe hala dokunuşa soğuk olmalıdır.) Her bir şişeyi durulamak için 1 mL ortam kullanın ve hücreleri 4 ° C'de 12 dakika boyunca 360 x g'de döndürün.
NOT: 55 ° C'de hızlı çözülmenin, 37 ° C'de çözülmeden daha iyi hücre canlılığı (% 90 -% 95) sağladığı bulunmuştur. - Ortamı dikkatlice aspire edin. (Küçük) peleti 2 mL CB ortamında yeniden askıya alın, yavaşça karıştırın ve hücre süspansiyonunun ~ 30 μL'sini bir sayım plakasındaki tek bir kuyucuğa ekleyin. 1: 1'i tripan mavisinde seyreltin, ardından bir hemositometreye 10 μL ekleyin ve dört kadrandan hücreleri sayın ve ortalamasını alın.
- Hücre sayısını 4 x 104 ile çarparak CD34+ hücrelerinin toplam sayısını hesaplayın ve ardından canlılığı kaydedin. 4 °C'de 12 dakika boyunca 360 x g'de döndürün.
- Ortamı dikkatli bir şekilde aspire edin ve hücre peletini enjekte etmek için n + 1 yavru başına 100 μL steril PBS içinde yeniden askıya alın, bu da fare başına 250.000-450.000 CD34 + hücresi ile sonuçlanır. Konik tüpü bir taşıma kabına buz üzerine yerleştirin ve yavru enjeksiyonu için vivaryuma gidin.
- Vivaryum BSC'ye bir ısı lambası, çocuk bezi, 1 mL şırınga, 18 G iğne, 30 G iğne ve steril kaplarda CD34 + hücre preparatı getirin. Isı lambasının altına ~ 2 ft steril bir bebek bezi yerleştirin. Enjekte edilecek çöple kafesi alın ve BSC'ye yerleştirin.
- Şırıngayı 18 G eğimli bir iğne ile birleştirin. Konik tüpün açısını iğnenin eğimi ile eşleştirerek, hücre süspansiyonunu yavaşça karıştırın ve çizin. Yavruları ısınmak için bebek bezine yerleştirin (aşırı ısınmaya dikkat edin). Şırıngadaki havayı çıkarın ve 18 G iğneyi 30 G iğne ile değiştirin ve ardından hücre süspansiyonu iğne ucunda olana kadar şırıngayı dikkatlice itin.
NOT: Alternatif olarak, bir insülin şırıngası kullanılabilir. - Her seferinde bir yavruyu bebek bezinin kenarına ısı lambasından uzağa götürün. Yavruyu baş parmağının ve işaret parmağının altındaki yan tarafında hareketsiz hale getirin ve yüzün net bir şekilde görülmesini sağlayın. Kulağın olacağı yerin altındaki yanaktaki damara dikkat edin. İğneyi göze en yakın damara (IV) sığ bir şekilde yerleştirin ve yavaşça 50 μL hücre enjekte edin.
- Subkutan enjeksiyondan bir kabarcık oluşup oluşmadığını kontrol edin. Eğer öyleyse, iğneyi daha derine yerleştirin ve hücreleri enjekte etmeye devam edin. Başarılı olduğunda küçük bir damla kan / hematom görülecektir.
NOT: Gombash Lampe ve ark.24'ün yavru enjeksiyonu ile ilgili prosedürüne bakınız. - Yavru hala hareketsizken, başka bir 50 μL hücre (IV + IH yavrusu başına toplam 100 μL) ile bir intrahepatik enjeksiyon (IH) gerçekleştirin. Karaciğer, beyaz süt bandı ile göğüs kafesi arasında karanlık bir nokta olarak görselleştirilebilir. Enjekte edilen yavruyu, enjekte edilmemiş yavrulardan ve ısıdan daha uzakta bir bebek bezine yerleştirin.
NOT: IV enjeksiyonu, tek başına IH enjeksiyonundan daha iyi uzun süreli kimerizm ile sonuçlanır25, ancak IV enjeksiyonları her zaman başarılı değildir. Bu nedenle, enjeksiyonun IV ve IH arasında bölünmesi, farelerin daha büyük bir yüzdesine engraftasyon sağlar. - Tüm yavrular için hem yüz-damar hem de IH enjeksiyonlarını tekrarlayın. Kanı temizleyin, yavruları kafeslerindeki yuvaya geri getirin ve yataklarla örtün.
2. İnsan kimerizmini kanda test etmek
- Hem 10 hem de 14 haftalıkken HIS farelerinin kanındaki kimerizmi test edin. Retro-orbital ven yoluyla veya alternatif bir IACUC onaylı yöntem kullanarak 50 μL kan toplayın.
- Retro-orbital kanamalar için, fareleri 1-2 dakika boyunca 5'e ayarlanmış bir izofluran buharlaştırıcı ile uyuşturun ve ardından buharlaştırıcı ayarını 4'e düşürün. Farelerin anestezi altındayken yeterince oksijenli kalmasına izin vermek için buharlaştırıcıyı gerektiği gibi azaltın. Fareleri izofluran altında 5 dakikadan fazla tutmayın.
- Anestezi uygulanan farenin burnunu izofluran buharlaştırıcı burun konisi ekine yerleştirin ve gözün üzerine bir damla analjezik (% 0.5 proparakain HCl oftalmik solüsyon USP) yerleştirin.
- 1 dakika sonra, steril bir gazlı bez kullanarak proparakaini çıkarın, gözü proptoz edin ve 50 μL kan toplamak için retro-orbital olarak 75 mm'lik heparinize hematokrit tüpü yerleştirin. Kanı 50 μL heparin içeren 1,5 mL'lik bir mikrofüj tüpüne atın ve yavaşça karıştırın.
- Kanamayı durdurmak ve bir damla proparakain uygulamak için gözü steril gazlı bezle kapatın. Fareyi izofluran'dan çıkarın ve temiz bir kafeste kurtarın.
- Fare kanından PBMC izolasyonu
- Kan/heparini hafifçe yukarı ve aşağı pipetleyerek karıştırın ve arayüzü rahatsız etmemeye dikkat ederek 500 μL 1.077 g/mL yoğunluk gradyanının üzerine yavaşça yerleştirin. RT'de fren yapmadan tüpleri 20 dakika boyunca 1.220 x g'de santrifüjleyin.
- Hücresel buffy ceketi, plazmanın altındaki 1,077 g/mL yoğunluk gradyanının üstünde bulutlu bir tabaka olarak görselleştirin. 200 μL pipetle kabarık kaplamadan mümkün olduğunca çok sayıda hücreyi çıkarın ve 750 μL hasat ortamı içeren yeni 1,5 mL tüplere ekleyin. RT'de 11 dakika boyunca 360 x g'de santrifüj.
- Ortamı 50 μL'ye kadar aspire edin ve peleti 750 μL hasat ortamında yeniden askıya alın. 360 x g'de 4 °C'de 10 dakika boyunca santrifüj yapın ve tekrar 50 μL'ye kadar aspire edin. Hücreler yüzey lekesinde yeniden askıya alınmaya hazırdır.
- Yüzey boyama ve akış sitometrik analizi
- Boyama paneli çalışma sayfasını doldurun (Tablo 1; "spektral akış kanama paneli" çalışma sayfası) fare numaraları ile ve tüm floresan antikorları boyama tamponuna ekleyerek antikor boyama kokteylini hazırlayın (Ek Dosya 1). Numuneleri 96 delikli bir U-taban plakasına eklemek için bir plaka düzeni oluşturun. Kalıcı bir işaretleyici kullanarak kuyucukların diplerini işaretleyin. Uygun konsantrasyonu belirlemek için boyamadan önce standart bir prosedür kullanarak antikorları titre edin26.
- 96 delikli U-taban plakasının her bir kuyucuğuna 62 μL yüzey lekesi kokteyli ekleyin. Tüpte kalan 50 μL'deki hücreleri tekrar askıya alın ve her numuneyi karşılık gelen kuyucuğuna ekleyin. Numunelerin yanında boyamak için pozitif bir boyama kontrolü (insan PBMC'leri + fare splenositleri, her biri 1 x 106 hücre) için bir kuyu ekleyin. Pipetleme ile karıştırın ve karışımı 4 °C'de 15 dakika inkübe edin.
- 680 x g'de 4 °C'de 3 dakika boyunca santrifüj. Süpernatanı çıkarmak için plakayı lavaboya doğru kaydırın ve ~ 10x hafifçe pipetleyerek 150 μL boyama tamponunda yeniden askıya alarak hücreleri yıkayın. Her bir kuyucuğu 150 μL boyama tamponunda döndürün ve yeniden askıya alın.
- Bir akış sitometresindeki her numunenin 100 μL'si için verileri alın (bkz. Malzeme Tablosu) ve .fcs dosyalarını dışa aktarın. .fcs dosyalarını akış verileri düzenleme yazılımına aktarın (bkz. Herhangi bir enkaz hariç, hücreleri çevreleyen FSC-A x SSC-A grafiğine çokgen kapısı uygulayın. Kapı içindeki hücreleri seçin (bkz. Tablo 1; "spektral akış kanaması gating" çalışma sayfası).
- Eksenleri (FSC-A x FSC-H) olarak değiştirin ve çizgiden çıkıntı yapan çiftleri hariç tutarak doğrusal köşegende bulunan hücreleri geçitleyin. Bu hücreleri seçin ve eksenleri (hCD45 x mCD45) olarak değiştirin.
- hCD45+ popülasyonuna bir çokgen kapısı uygulayın ve "insan" adını uygulayın. mCD45+ popülasyonuna bir çokgen kapısı uygulayın ve "fare" adını uygulayın. Hem insan hem de fare popülasyonları için bir sayım istatistiği oluşturun.
- İnsan popülasyonunu seçin ve eksenleri (CD19 x CD3) olarak değiştirin. CD19+ hücrelerine çokgen kapısı uygulayın ve "B hücreleri" olarak adlandırın. CD3+ popülasyonuna bir çokgen kapısı uygulayın ve "T hücreleri" olarak adlandırın. Çift negatif popülasyona bir çokgen kapısı uygulayın ve "TB olmayan" olarak adlandırın.
- T hücresi popülasyonunu seçin ve eksenleri (CD8 x CD4) olarak değiştirin. CD4 ve CD8 pozitif popülasyonlara bir çokgen kapısı uygulayın ve bunları sırasıyla "CD4+" ve "CD8+" olarak adlandırın.
- TB olmayan popülasyonu seçin ve eksenleri (CD56 x miyeloid) olarak değiştirin. Çift pozitif olaylar da dahil olmak üzere toplam CD56 pozitif popülasyonuna bir çokgen kapısı uygulayın ve "NK hücreleri" olarak adlandırın. CD56 negatif ve miyeloid pozitif popülasyona bir çokgen kapısı uygulayın ve "miyeloid" olarak adlandırın.
- Tüm popülasyonların yüzde ve sayım istatistikleri için bir tablo oluşturun ve bir elektronik tablo yazılımına aktarın (bkz. %hCD45 kimerizmini = %hCD45/(%hCD45 + mCD45) hesaplayın.
- Daha fazla deney için% <20 hCD45 + (mCD45 + hCD45) olan HIS farelerini hariç tutun.
NOT: Bu çalışmada, PBMC'ler daha temiz bir RBC tükenmesi için 1.077 g / mL yoğunluk gradyanı ayrımı kullanılarak hazırlanmıştır. Bu yordam, insan ve fare granülositlerini PBMC katmanından dışladı. Alternatif olarak, RBC lizisi kullanılabilir.
3. Tümörlerin farelere enjeksiyonu
- Tümör enjeksiyonundan önce, 14 haftalık kanama verilerinden T hücresi sayılarını doğrulayın. Tümörler, T hücrelerinin% >20'si ise 20-26 hafta arasında ve T hücreleri toplam bağışıklık hücresi popülasyonunun% <20'si ise 24-28 hafta arasında hasada hazır olacak şekilde enjekte edilir. Bu enjeksiyon zamanlaması, farelerin 20-28 haftalık olmasını ve çalışmanın sonunda yeterli sayıda T hücresine sahip olmasını sağlar.
- Hücre hattından türetilmiş ksenogreftlerin (CDX) enjeksiyonu
NOT: Prosedür, örnek olarak MDA-MB-231 meme adenokarsinom hücreleri (bakınız Malzeme Tablosu) kullanılarak açıklanmıştır.- Dondurulmuş hücrelerin bir alikotunu çözün, % 10 FBS,% 1 PenStrep ve% 1 esansiyel olmayan amino asitlerle desteklenmiş 10 mL DMEM'de askıya alarak 1x'i yıkayın ve 4 ° C'de 10 dakika boyunca 360 x g'de santrifüj yapın. Ortamı aspire edin ve bir T25 şişesinde% 10 FBS,% 1 PenStret ve% 1 esansiyel olmayan amino asitlerle desteklenmiş 10 mL DMEM'de yeniden askıya alın ve% 5 CO2 ile 37 ° C'de inkübe edin.
NOT: Doğru hücre tipini sağlamak için hücre satırlarının kimliği PCR tarafından doğrulanır. Hücre süpernatantları, enjeksiyondan önce biyokimyasal bir tahlil yoluyla mikoplazma için test edilir. - Üstel büyüme fazı sırasında hücreleri yaklaşık% 80 akıcılıkta geçirin ve genişletin.
- Ortamı aspire edin, hücreleri 5-10 mL steril PBS (pH 7.2) ile durulayın ve hücreler şişeden ayrılana kadar 1-5 dakika boyunca 1 mL% 0.25 tripsin-EDTA ile inkübe edin.
- Aynı DMEM'den 5 mL ekleyin ve yukarı ve aşağı pipetleme yaparak karıştırın. 6 mL'lik hücre süspansiyonunun tamamını yeni bir doku kültürü ile muamele edilmiş T75 şişesine (1:3 seyreltme) geçirin ve ilave 10 mL DMEM ekleyin.
- Hücreleri genişletmek için hücreleri DDEM'de 1: 3 seyreltme kaplamasında% 80 akıcılıkta% 80 akıcılıkta her 2-3 günde bir geçirin.
- Altı pasajda üstel büyüme fazı sırasında% 0.25 tripsin-EDTA ile hücreleri toplayın ve PBS ile yıkayın. PBS ve bazal membran ekstraktını (bakınız Malzeme Tablosu) 1:1 oranında karıştırın ve hücrelere 5 x 107 hücre/mL'lik son konsantrasyonda ekleyin.
- Fareleri adım 2.1.1'de açıklandığı gibi izofluran ile uyuşturun. Subkutan olarak 23 G'lik bir iğne kullanarak her bir tarafa 100 μL (5 x 106 hücre) tümör hücresi süspansiyonu enjekte edin.
- Dondurulmuş hücrelerin bir alikotunu çözün, % 10 FBS,% 1 PenStrep ve% 1 esansiyel olmayan amino asitlerle desteklenmiş 10 mL DMEM'de askıya alarak 1x'i yıkayın ve 4 ° C'de 10 dakika boyunca 360 x g'de santrifüj yapın. Ortamı aspire edin ve bir T25 şişesinde% 10 FBS,% 1 PenStret ve% 1 esansiyel olmayan amino asitlerle desteklenmiş 10 mL DMEM'de yeniden askıya alın ve% 5 CO2 ile 37 ° C'de inkübe edin.
- Trokarlar kullanarak hasta kaynaklı ksenogreftlerin (PDX) enjeksiyonunu gerçekleştirin. PDX modeli için enjeksiyon prosedürü ve diğer geliştirme ve bakım talimatları literatür27'de mevcuttur.
4. Tümör büyüme ölçümü
- İmplantasyondan sonra haftada bir kez, tümör büyümesi için yan tarafta hissederek tümör ilerlemesini kontrol edin. Tümörler palpe edilebilir hale geldikten sonra, fareleri izofluran ile uyuşturun (adım 2.1.1'de açıklandığı gibi) ve her bir kanatta elektrikli bir düzeltici ile tıraş edin, tümör büyüdükçe ülserasyonları önlemek için tümörün etrafına dikkat edin.
NOT: Tümörlerin etrafındaki cildin yaralanmasını önlemek için tümör enjeksiyonundan önce fareler tıraş edilebilir; Bununla birlikte, saç büyüme oranı tümör ölçümlerini engelleyebilir. - Kaliperler kullanarak tümörlerin uzunluğunu ve genişliğini haftada iki kez ölçün ve ölçümleri mm cinsinden kaydedin. Tümör ölçümlerini tümör
 hacmi (mm3) olarak formülünü kullanarak raporlayın. Tümör yükünün tek bir tümör başına 2.000mm3'ü veya kombine 3.000mm3'lük bir hacmi aşmasına izin vermemeye dikkat edin.
hacmi (mm3) olarak formülünü kullanarak raporlayın. Tümör yükünün tek bir tümör başına 2.000mm3'ü veya kombine 3.000mm3'lük bir hacmi aşmasına izin vermemeye dikkat edin.
NOT: Kanser araştırmalarında farelerin kullanımına ilişkin kılavuzlar konuma göre değişir. Lütfen araştırmacının kurumundaki Hayvan Bakımı ve Kullanımı politikalarına bakın.
5. İlaç tedavileri
- HIS farelerini hCD45 kimerizmi, hCD3 kimerizmi ve hCD8 kimerizmine dayanan eşdeğer tedavi gruplarına ayırın. Tümörler ortalama 100mm3'e ulaştığında, ilaç tedavilerine başlayın.
NOT: Grup başına düşen fare sayısı, CB'den üretilen HIS farelerinin sayısına dayanmaktadır. Grup başına en az dört fare önerilir. İki taraflı olmayan çok gruplu eşleştirme (örneğin, R-vivo Manila yazılımında) bu gruplama28 için yararlıdır. - İlaç yolu ve sıklığı
- Anti-PD-1 inhibitörlerini (nivolumab, pembrolizumab) intraperitoniyal olarak (i.p.) haftada 30 mg / kg 1x veya tek tedaviler için haftada 20 mg / kg 2x veya kombinasyon tedavileri için haftada 10-15 mg / kg 2x enjekte edin.
- Hedefe yönelik tedaviler, kemoterapiler ve ışınlama gibi kombinasyon terapilerini deneysel tasarıma uygun olarak dozlayın. Hedefe yönelik tedaviler ve kemoterapiler oral gavaj, i.p. enjeksiyon veya gıda yoluyla verilebilir.
NOT: Dozlar, yayınlanan verilere ve tümör modeline göre değiştirilebilir ve optimize edilebilir. Doz çalışmaları genellikle HIS fare çalışmalarından önce immün yetmezlikli alıcılarda test edilir.
- Kilo kaybı, gevşek dışkı, kambur duruş, hareketliliğin azalması ve kürk kaybı gibi sağlık değişiklikleri için fareleri haftada en az 3 kez izleyin. Bazı semptomlar ilaç toksisitesi veya GVHD belirtileri olabilir ve ilaç dozunun azaltılması veya durdurulması gerekebilir. Hayvan Bakımı ve Kullanımı politikalarına göre fareleri gerektiği gibi ötenazi yapın.
6. Çalışma sonunda fare dokularının ve tümörlerinin toplanması
- Fareleri, 2.75 L / dak akış hızına sahip sıkıştırılmış CO2 gazı kullanarak kurumsal ve veterinerlik kılavuzlarına göre tek başına ötenazi yapın. CO2'de tutulan fareleri ölümden 1 dakika sonra izleyin ve daha sonra ikincil bir ötenazi şekli olarak servikal çıkık gerçekleştirin.
- Kan alımı
- İntrakardiyak ponksiyon yoluyla kan toplayın. Fareyi dik konumda tutun ve orta çizginin hemen solundaki ve kaburgaların altındaki bir çizgiden doğrudan kalbe 25 G iğneli 1 mL'lik bir şırınga yerleştirin. Kanı ideal olarak uzun bir çekme yoluyla bir şırıngaya toplayın ve etiketli 1.5 mL'lik bir tüpe aktarın.
NOT: Akciğer boşluğunun köşelerinden dikkatli bir şekilde ek kan toplamak için ek iğne yerleştirmeleri yapılabilir. - Kanı 1 saat boyunca 4 ° C'de bırakın, ardından kanı 7.800 x g'de 6 dakika boyunca bir mikrosantrifüjde santrifüj edin. Kan arayüzünün üzerindeki berrak sıvıyı (serum) ikinci bir temiz ve etiketli 1,5 mL tüpte toplayın. İnsan ve fare enflamatuar sitokini veya immünoglobulin titreleri gibi aşağı akış analizi için serumu -20 ° C'de saklayın.
- İntrakardiyak ponksiyon yoluyla kan toplayın. Fareyi dik konumda tutun ve orta çizginin hemen solundaki ve kaburgaların altındaki bir çizgiden doğrudan kalbe 25 G iğneli 1 mL'lik bir şırınga yerleştirin. Kanı ideal olarak uzun bir çekme yoluyla bir şırıngaya toplayın ve etiketli 1.5 mL'lik bir tüpe aktarın.
- Doku diseksiyonu
- Farelerde tümör hücrelerinin enjeksiyonu ve büyümesinden ve ilaç tedavilerinin uygulanmasından sonra, dokuları toplayın. Fareleri bir köpük diseksiyon tahtasına yerleştirin, onları yerinde tutmak için pimlerle ve kollar ve bacaklar 45 ° açılarla uzatılmıştır. Gövdenin ortasından yukarıya, pelvisin yakınından başlayıp çeneye uzanan, peritonun kesilmesini önlemeye çalışan bir kesi yapın (bu gerekli olmasa da). Cildi kenara doğru çekin ve pimlerle yerinde tutun.
- Lenf düğümlerini (LN'ler) aşağıdaki sırayla ince forseps kullanarak çıkarın: inguinal, aksiller, servikal, mezenterik, hiatal.
NOT: HIS farelerinde, LN'ler genellikle çok küçüktür, anlage'ye benzer veya vahşi tip bir fareden farklı olarak farklı bir görünüme sahip "iltihaplı"dır. Bu nedenle her bölgeden LN'lere benzeyen dokular alınır. Periferik LN'ler genellikle sıvı dolu "toplar" olarak görünürken, mezenterik LN'ler daha yoğundur. Mezenterik LN'ler en belirgin ve tutarlı olanlardır ve bir dizenin aksine bir veya iki ayrı daha yoğun düğüm olarak gözlenir. - LN'leri buzlu cam slaytların bir tarafına bir Petri kabında 8 mL hasat ortamına yerleştirin. Slaytları buzlu kenarları içe doğru olacak şekilde dik açılarda tutarak, hücresel içerikler serbest bırakılana kadar dokuları hafifçe bastırın.
- Maksimum hücre miktarını serbest bırakmak için slaytları birbirinden ayırarak ve birlikte çekerek birkaç kez durulayın. Hücreleri 5 inç cam pipetle toplayın ve 9 inç pamukla takılı pipetten etiketli 15 mL'lik bir konik tüpe filtreleyin.
- Dalağı, iki çift forseps veya forseps ve makas kullanarak karnın sol üst tarafından çıkarın. Dalağın boyutunu, resüspansiyon ortamının hacminin bir tahmini olarak not edin. LN'lerde olduğu gibi buzlu cam slaytlar kullanarak dalağı mekanik sindirim ile toplayın ve filtreleyin.
NOT: Tek hücreli süspansiyonlar için dokuların hazırlanması için herhangi bir teknik kullanılabilir. - Aşağıda açıklandığı gibi doku örneklerinden hücrelerin sayımını ve yeniden süspansiyonunu gerçekleştirin.
- Lenf hücrelerini 360 x g'de 4 ° C'de 10 dakika boyunca santrifüj edin. Sıvıyı aspire edin ve hücre peletini DNaz ile 1 mL hasat ortamında yeniden askıya alın.
- RT'de 3 dakika boyunca 3 mL ACK lizis tamponu ile inkübe ederek eritrositleri dalak hücrelerinden çıkarın, ardından 10 mL hasat ortamı / DNaz ilavesi yapın. Dalak hücrelerini tekrar santrifüj edin, süpernatanı aspire edin ve dalak boyutuna bağlı olarak hücreleri 1-10 mL hasat ortamı / DNaz'da yeniden askıya alın (örneğin, çok küçük dalaklar için 1 mL ve en büyük dalaklar için 10 mL'ye kadar).
- 90 μL ortama 10 μL'lik bir hücre süspansiyonu aliquot ekleyin ve bir hemositometreye güvenin. LN'leri ve dalak hücrelerini santrifüj edin, süpernatantları aspire edin ve hasat ortamındaki hücreleri 1 x 108 hücre / mL veya en az 80 μL konsantrasyonda yeniden askıya alın.
- Tümörleri çıkarın.
- Diseksiyon makası ile tümör kenarlarından yavaşça keserken tümörü forseps ile tutarak tümörü açık kanattan çıkarın.
- Tümör çıkarıldıktan sonra, tartın ve RNA ve immünohistokimya (IHC) işleme için 1/4 çıkarın. 1/4 tümörü ikiye bölün; Bir yarısını (tüm tümörün 1 / 8'i) bir kriyovyal içine yerleştirin, sıvı N2'de flaş dondurun ve aşağı akış genomik çalışmaları için -80 ° C'de saklayın.
- Tümörün diğer 1 / 8'ini% 10 formalin içeren etiketli bir örnek tüpüne yerleştirin. Ertesi gün, dokuyu gelecekteki kullanıma kadar% 70 etanol içinde durulayın ve yeniden askıya alın. Tümörün kalan 3/4'ünü 6 cm'lik bir kaba yerleştirin ve bir neşter bıçağı kullanarak ~ 1 mm'lik parçalara ayırın.
- Tümör parçalarını bir ayrışma tüpüne taşıyın (bakınız Malzeme Tablosu), kabı 5 mL tamamlanmamış tümör infiltrasyon lökosit (TIL) ortamı ile durulayın ve ayrışma tüpüne ekleyin.
NOT: >0.4 g ağırlığındaki tümörler için, kabı 10 mL TIL tamamlanmamış ortam ile durulayın ve ayrışma tüpüne ekleyin. - Ayrışma tüpündeki dokuya 50 mg / mL'lik son bir konsantrasyonda kollajenaz preparatı (bakınız Malzeme Tablosu) ekleyin. Tümörün sıkılığına bağlı olarak, 30 dakika ila 1 saat boyunca 37 ° C'de mekanik ayrışma kullanarak dokuyu ayırın.
- Ayrışmadan sonra, süspansiyonu 100 μm'lik bir filtre üzerinden 50 mL'lik bir konik tüpe geçirin ve filtreyi 10 mL TIL komple ortam ile durulayın. Bu ortamdaki serum, kollajenaz reaksiyonunu durduracak ve hücreleri daha fazla bozulmaya karşı koruyacaktır.
- Tek hücreli süspansiyonu 360 x g'de 4 °C'de 10 dakika boyunca santrifüjleyin. Peletin DNase ile yeterli hasat ortamında yeniden askıya alın, böylece hücre süspansiyonu bir P1000 pipet ucundan kolayca geçebilir ve aşağı akış analizi için hacmi kaydedebilir.
NOT: Daha küçük bir hacim, tümör bağışıklık hücrelerinin toplanmasını arttırır, ancak akış sitometre tıkanmalarına karşı daha hassastır.
7. Hücre boyama ve akım sitometrik analizleri
- Leke hazırlama ve hücre kaplama
- Boyama kokteylleri hazırlayın: Hasat günü, numune sayısını boyama çalışma sayfasına ekleyin (Tablo 2; "Konvansiyonel Akış A paneli", "Spektral Akış B paneli" ve "Geleneksel Akış C paneli" çalışma sayfaları) tüm lekeler ve baskılar için. Her bir antikoru ayrı ayrı yeni bir uçla ekleyerek, hareket halindeyken her bir reaktifi işaretleyerek boyama tamponunda (SB) A ve B lekeleri için yüzey lekesi kokteylleri hazırlayın ve ihtiyaç duyulana kadar 4 ° C'de saklayın. Uygun canlılık boyalarını azid içermeyen PBS'de hazırlayın ve ihtiyaç duyulana kadar 4 ° C'de saklayın (kullanımdan önce RT'ye sıcak). SB'de 2. günde yüzey boyası C kokteylini, hücre içi B ve C boyaları ile birlikte kendi geçirgenlik tamponlarında hazırlayın.
- Boyama çalışma sayfasındaki tüm numuneler için bir plaka düzeni oluşturun ve kuyucuklara 100 μL azid içermeyen PBS aliquot yapın. Her doku ve leke için lekesiz kontrolleri dahil edin (spektral sitometri için).
- Hücreleri 50 μL PBS içeren 96 delikli plakalara ekleyin. A boyası için, boyama çalışma sayfasında belirtildiği gibi her doku grubunu uygun hacimde yeniden askıya alın ve aynı gün akış sitometresinde elde edilene kadar 4 ° C'de saklayın. B ve C lekeleri için, PBS ile kuyucuklara 25 μL lenf ve 60 μL lenf dışı doku hücresi süspansiyonları ekleyin.
- C boyası kullanılarak hücre içi boyama ile tespit için sitokinlerin in vitro stimülasyonunu gerçekleştirin.
- C 96 delikli plaka lekesini 7.1.3 adımından 680 x g'de 4 °C'de 3 dakika boyunca santrifüj edin. Her bir kuyucuğa 200 μL TIL komple ortam (RPMI 1640, 10 mM HEPES [pH 7], %10 FBS) ekleyin. Plakayı hücre süspansiyonu ile gece boyunca 4 ° C'de saklayın.
- Ertesi sabahın erken saatlerinde, hücre stimülasyon kokteylini (bakınız Malzeme Tablosu) 1:500 oranında tam TIL ortamında seyreltin. Hücreleri pelet haline getirmek için hücre süspansiyonunu içeren plakayı 680 x g'de santrifüj edin ve ortamı çıkarmak için hafifçe kaydırın. Hücreleri hazırlanan hücre stimülasyon kokteylinin 200 μL'sinde tekrar askıya alın ve 1 saat boyunca 37 ° C'de inkübe edin.
- Tam TIL ortamında 1: 1.000 seyreltmede monensin içeren 25 μL protein taşıma inhibitörü çözeltisi ekleyin, hücreleri karıştırın ve hücre içi sitokin birikimine izin vermek için 37 ° C'de ek bir 4 saat boyunca inkübe edin.
- Hücre boyama işlemini gerçekleştirin.
- A ve B lekeleri (1. Gün) ve C lekesi (2. Gün) için, 4 ° C'de 3 dakika boyunca 680 x g'de santrifüj. Plakaları hafifçe vurun ve kuyucuklara uygun canlılık boyalarını ekleyin. Çok kanallı bir pipetle hafifçe yukarı ve aşağı pipetleyerek iyice karıştırın ve RT'de 15 dakika boyunca inkübe edin.
- Plakaları santrifüj edin (adım 7.1.5.1'de olduğu gibi), ardından plakalara uygun yüzey lekeleri ekleyin ve çok kanallı pipetle pipetleyerek nazikçe karıştırın. 4 °C'de 15 dakika inkübe edin ve tekrar santrifüj yapın. Plakaları hafifçe kaydırın, 150 μL SB ile hafifçe yukarı ve aşağı pipetleyerek hücreleri yıkayın ve santrifüj.
- Plakaları hafifçe kaydırın, 150 μL SB ile hafifçe yukarı ve aşağı pipetleyerek yıkamayı tekrarlayın ve 4 °C'de 3 dakika boyunca 680 x g'de santrifüj yapın. A boyası için, boyama çalışma sayfasında belirtildiği gibi her doku grubunu uygun hacimde tekrar askıya alın ve 4 ° C'de saklayın. B lekesi için, RT'de 30 dakika boyunca FoxP3 transkripsiyon faktörü kiti fiksatif (bkz. Malzeme Tablosu) ile sabitleyin. C lekesi için, RT'de 30 dakika boyunca SB'de% 1 (v / v) paraformaldehit ile sabitleyin.
- Sabit plakaları 480 x g'de 4 °C'de 3 dakika boyunca santrifüjleyin. SB'de 1x yıkayın. Leke B için, hücreler gece boyunca bırakılabilir.
- Hücreleri geçirgenleştirin: B lekesi için 150 μL FoxP3 transkripsiyon faktörü kiti geçirgenlik tamponunda ve SB'de Leke C için% 0,5 (w / v) saponin içinde kuyucukları yeniden askıya alın. RT'de 15 dakika boyunca inkübe edin.
- Tabakları hafifçe vurun ve B lekesi ve C lekesi için ilgili hücre içi boyama kokteyllerini ekleyin. RT'de 30 dakika boyunca inkübe edin.
- Sabit plakaları 480 x g'de 4 °C'de 3 dakika boyunca santrifüj edin ve plakaları hafifçe kaydırın. Hücreleri karşılık gelen geçirgenlik tamponlarının 150 μL'si ile yıkayın (leke B, FoxP3 transkripsiyon faktörü kiti geçirgenlik tamponu; leke C, saponin).
- Plakaları hafifçe vurun ve 150 μL SB'de yukarı ve aşağı pipetleyerek yıkayın. 480 x g'de 4 °C'de 3 dakika boyunca santrifüj. Plakaları hafifçe kaydırın ve SB'deki hücreleri doku grubuna göre boyama çalışma sayfasında belirtilen uygun hacimlerde yeniden askıya alın.
NOT: Numuneler artık spektral akış sitometrisi ile elde edilmeye hazırdır. - Akış sitometresini ( bakınız Malzeme Tablosu) her leke için uygun tek boyalı kontrollerle ve karıştırma sırasında otofloresanstaki farklılıkları hesaba katmak için her doku grubu için lekesiz numunelerle ayarlayın. Boyama çalışma sayfasında (Tablo 2) tanımlandığı gibi doku grubu başına uygun birimleri edinin ve .fcs dosyalarını dışa aktarın.
- Akış sitometrisi veri analizi
- Akış sitometrisi analiz yazılımını kullanarak (bkz. Malzeme Tablosu), yeni bir çalışma alanı oluşturun. Her organ için yeni gruplar oluşturun (LN, dalak ve TIL). Her organ için .fcs dosyalarını gruba alın.
- İki değişkenli bir nokta grafiği oluşturun, eksenleri (FSC-A x SSC-A) olarak ayarlayın ve kenarlardaki olaylardan kaçınarak hücresel olaylara çokgen kapısı uygulayın (tüm hücreler kapısı). Hücresel olayları seçin, eksenleri (FSC-A x FSC-H) olarak değiştirin ve "singlets" kapısını oluşturmak için köşegenden sapan olayları hariç tutarak, doğrusal diyagonaldeki olaylara çokgen kapısı uygulayın. "Singlets" kapısını seçin ve eksenleri (hCD45 x mCD45) olarak değiştirin. hCD45 ve mCD45 pozitif olaylarına çokgen kapıları uygulayın ve bunları sırasıyla "insan" ve "fare" olarak adlandırın.
- İnsan popülasyonunu seçin ve Y eksenini Canlı/Ölü Su olarak değiştirin. Canlı/Ölü negatif, hCD45 pozitif popülasyona bir çokgen kapısı uygulayın ve buna "canlı insan" adını verin. Fare popülasyonunu seçin ve X eksenini Live/Dead Aqua olarak değiştirin. Canlı/Ölü negatif, mCD45 pozitif popülasyona bir çokgen kapısı uygulayın ve buna "canlı fare" adını verin.
- Benzer şekilde, belirtilen popülasyonları (örneğin, insan B hücreleri, aktif T hücreleri) izole etmek için "Geleneksel Akış A Geçidi", "Spektral Akış B Geçidi" ve "Geleneksel Akış C Geçidi" çalışma sayfalarında (Tablo 2) belirtildiği gibi ana kapıyı ve X ve Y eksenlerini seçin.
NOT: Her leke için temsili geçit (Taşma, A, B, C) Ek Dosya 2'de yer almaktadır. - Tüm popülasyonlar için akış sitometri analiz yazılımında sayım ve frekans dışa aktarma tabloları oluşturun ve bir elektronik tablo yazılımına aktarın. Frekanslar için ana popülasyon Tablo 2'de belirtilmiştir.
- Deneysel tedavi gruplarına dayalı grafikler oluşturmak için verileri kullanın.
NOT: Veriler, analiz yazılımında R paketleri kullanılarak da analiz edilebilir. Analiz edilecek tüm örneklerden tek bir .fcs dosyası, birleştirme özelliği kullanılarak oluşturulabilir. Bu veriler T-SNE algoritması ile boyutsal olarak azaltılabilirken, doku tipi ve tedavi grubu için anahtar kelime parametreleri eklenebilir. FlowSOM algoritması daha sonra popülasyonları kümelemek için kullanılabilir ve ClusterExplorer aracı popülasyonları tanımlamak için kullanılabilir. Yeni hücre popülasyonları bu şekilde tanımlanabilir, görsel olarak karşılaştırılabilir ve tedavi grupları arasında veya çeşitli dokularda ölçülebilir. - Aynı tedavi grubundaki tümörler için immün parametreleri, tümör büyüme inhibisyonu ile ilişkili immünotipleri tanımlamak için bu tümörün büyümesi ile ilişkilendirin. Tümör büyümesini, belirli bir süre boyunca tümör hacimlerindeki farkı dikkate alan bir ölçüm olan o tümör için spesifik büyüme hızına (SGR) göre ölçün. Bu ölçüm, fare sağlığı ve tedavi başlangıç tarihleri nedeniyle farklı günlerde toplanan tümörleri normalleştirir.
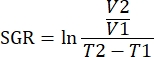
Sonuçlar
Yan tümör protokolünü ve deneysel zaman çizelgesini takiben (Şekil 1), tümör büyümesi ve hedeflenen tirozin kinaz inhibitörü (TKI) tedavisine ve nivolumab kombinasyon tedavisine karşı immün yanıt iki ayrı insan kolorektal kanseri (CRC) PDX'inde incelenmiştir. TKİ ilaçları immün yetmezlikli konakçılarda tümör büyümesini değerlendirmek için sadece29 kez incelenmiştir. Bu model, TKİ'nin bağışıklık tepkisindeki değişikliklerin tek ba...
Tartışmalar
Son 6 yılda, hem immünoloji hem de insanlaştırılmış farelerdeki uzmanlığımızı kullanarak, araştırma ekibimiz çeşitli insan tümörleri üzerinde immünoterapileri test etmek için çok ihtiyaç duyulan bir klinik öncesi model geliştirdi 3,7,30,31. Bu protokol, immünoterapi merkezli insan T hücresi popülasyonlarına özel dikkat göstererek, modelin değişkenliğinin dikkat...
Açıklamalar
Hiç kimse.
Teşekkürler
Hem Hayvan Araştırma Tesisi'ne (OLAR) farelerimize gösterdikleri özen için hem de enstitümüzdeki Kanser Merkezi Destek Hibesi (P30CA046934) tarafından desteklenen Akış Sitometrisi Ortak Kaynağı'na tüm çalışmalarımızda muazzam yardımları için teşekkür ederiz. Ayrıca, HIS-BRGS modelimizde insan PDX'lerine immünoterapileri inceleyen açılış işbirliklerimiz için hem Gail Eckhardt'a hem de Anna Capasso'ya teşekkür ediyoruz. Bu çalışma kısmen Ulusal Sağlık Enstitüleri P30CA06934 Kanser Merkezi Destek Hibesi tarafından PHISM (Pre-clinical Human Immune System Mouse Models) Paylaşılan Kaynak, RRID: SCR_021990 ve Akış Sitometrisi Paylaşılan Kaynağı, RRID: SCR_022035 kullanılarak desteklenmiştir. Bu araştırma kısmen Ulusal Sağlık Enstitüleri NIAID tarafından 75N93020C00058 Sözleşme Numarası altında desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1 mL syringe w/needles | McKesson | 1031815 | |
| 15 mL tubes | Grenier Bio-One | 188271 | |
| 2-mercaptoethanol | Sigma | M6250 | |
| 50 mL tubes | Grenier Bio-One | 227261 | |
| AutoMACS Pro Separator | Miltenyi | 130-092-545 | |
| BD Golgi Stop Protein Transport Inhibitor with monensin | BD Bioscience | BDB563792 | |
| BSA | Fisher Scientific | BP1600100 | |
| Cell Stim Cocktail | Life Technologies | 509305 | |
| Chill 15 Rack | Miltenyi | 130-092-952 | |
| Cotton-plugged glass pipettes | Fisher Scientific | 13-678-8B | |
| Cultrex Basement membrane extract | R&D Systems | 363200502 | |
| Cytek Aurora | Cytek | ||
| DNase | Sigma | 9003-98-9 | |
| eBioscience FoxP3/Transcription Factor Staining Buffer Set | Invitrogen | 00-5523-00 | |
| Embryonic Stemcell FCS | Gibco | 10439001 | |
| Eppendorf Tubes; 1.5 mL volume | Grenier Bio-One | 616201 | |
| Excel | Microsoft | ||
| FBS | Benchmark | 100-106 500mL | |
| Ficoll Hypaque | GE Healthcare | 45001752 | |
| FlowJo Software | BD Biosciences | ||
| Forceps - fine | Roboz Surgical | RS5045 | |
| Forceps normal | Dumont | RS4919 | |
| Formaldehyde | Fisher | F75P1GAL | |
| Frosted Glass Slides | Corning | 1255310 | |
| Gentlemacs C-Tubes | Miltenyi | 130-096-334 | |
| GentleMACS Dissociator | Miltenyi | 130-093-235 | |
| glass pipettes | DWK Life Sciences | 63A53 | |
| Glutamax | Gibco | 11140050 | |
| HBSS w/ Ca & Mg | Sigma | 55037C | |
| HEPES | Corning | MT25060CI | |
| IgG standard | Sigma | I2511 | |
| IgM standard | Sigma | 401108 | |
| IMDM | Gibco | 12440053 | |
| Liberase DL | Roche | 5466202001 | |
| LIVE/DEAD Fixable Blue | Thermo | L23105 | |
| MDA-MB-231 | ATCC | HTB-26 | |
| MEM | Gibco | 1140050 | |
| mouse anti-human IgG-AP | Southern Biotech | JDC-10 | |
| mouse anti-human IgG-unabeled | Southern Biotech | H2 | |
| mouse anti-human IgM-AP | Southern Biotech | UHB | |
| mouse anti-human IgM-unlabeled | Southern Biotech | SA-DA4 | |
| MultiRad 350 | Precision X-Ray | ||
| PBS | Corning | 45000-446 | |
| Pen Strep | Gibco | 15140122 | |
| Petri Dishes | Fisher Scientific | FB0875713A | |
| p-nitrophenyl substrate | Thermo | 34045 | |
| PRISM | Graphpad | ||
| Rec Hu FLT3L | R&D systems | 308-FK-005/CF | |
| Rec Hu IL6 | R&D systems | 206-IL-010/CF | |
| Rec Hu SCF | R&D systems | 255SC010 | |
| RPMI 1640 | Corning | 45000-39 | |
| Saponin | Sigma | 8047-15-2 | |
| Scissors | McKesson | 862945 | |
| Serological pipettes 25 mL | Fisher Scientific | 1367811 | |
| Sterile filter | Nalgene | 567-0020 | |
| Sterile molecular water | Sigma | 7732-18-5 | |
| Yeti Cell Analyzer | Bio-Rad | 12004279 | |
| Zombie Green | biolegend | 423112 |
Referanslar
- Chulpanova, D. S., Kitaeva, K. V., Rutland, C. S., Rizvanov, A. A., Solovyeva, V. V. Mouse tumor models for advanced cancer immunotherapy. International Journal of Molecular Sciences. 21 (11), 4118 (2020).
- Olson, B., Li, Y., Lin, Y., Liu, E. T., Patnaik, A. Mouse models for cancer immunotherapy research. Cancer Discovery. 8 (11), 1358-1365 (2018).
- Marin-Jimenez, J. A., et al. Testing cancer immunotherapy in a human immune system mouse model: correlating treatment responses to human chimerism, therapeutic variables and immune cell phenotypes. Frontiers in Immunology. 12, 607282 (2021).
- Yin, L., Wang, X. J., Chen, D. X., Liu, X. N., Wang, X. J. Humanized mouse model: a review on preclinical applications for cancer immunotherapy. American Journal of Cancer Research. 10 (12), 4568-4584 (2020).
- Cogels, M. M., et al. Humanized mice as a valuable pre-clinical model for cancer immunotherapy research. Frontiers in Oncology. 11, 784947 (2021).
- Jin, K. T., et al. Development of humanized mouse with patient-derived xenografts for cancer immunotherapy studies: A comprehensive review. Cancer Science. 112 (7), 2592-2606 (2021).
- Capasso, A., et al. Characterization of immune responses to anti-PD-1 mono and combination immunotherapy in hematopoietic humanized mice implanted with tumor xenografts. Journal for Immunotherapy of Cancer. 7 (1), 37 (2019).
- Wang, M., et al. Humanized mice in studying efficacy and mechanisms of PD-1-targeted cancer immunotherapy. The FASEB Journal. 32 (3), 1537-1549 (2018).
- Yong, K. S. M., et al. Humanized mouse as a tool to predict immunotoxicity of human biologics. Frontiers in Immunology. 11, 553362 (2020).
- Shen, H. W., Jiang, X. L., Gonzalez, F. J., Yu, A. M. Humanized transgenic mouse models for drug metabolism and pharmacokinetic research. Current Drug Metabolism. 12 (10), 997-1006 (2011).
- Bosma, G. C., Custer, R. P., Bosma, M. J. A severe combined immunodeficiency mutation in the mouse. Nature. 301 (5900), 527-530 (1983).
- Shultz, L. D., et al. Multiple defects in innate and adaptive immunologic function in NOD/LtSz-scid mice. The Journal of Immunology. 154 (1), 180-191 (1995).
- Legrand, N., et al. Functional CD47/signal regulatory protein alpha (SIRP(alpha)) interaction is required for optimal human T- and natural killer- (NK) cell homeostasis in vivo. Proceedings of the National Academy of Sciences. 108 (32), 13224-13229 (2011).
- Ishikawa, F., et al. Development of functional human blood and immune systems in NOD/SCID/IL2 receptor {gamma} chain(null) mice. Blood. 106 (5), 1565-1573 (2005).
- Ito, M., et al. NOD/SCID/gamma(c)(null) mouse: an excellent recipient mouse model for engraftment of human cells. Blood. 100 (9), 3175-3182 (2002).
- Shultz, L. D., et al. Human lymphoid and myeloid cell development in NOD/LtSz-scid IL2R gamma null mice engrafted with mobilized human hemopoietic stem cells. The Journal of Immunology. 174 (10), 6477-6489 (2005).
- Traggiai, E., et al. Development of a human adaptive immune system in cord blood cell-transplanted mice. Science. 304 (5667), 104-107 (2004).
- Theocharides, A. P., Rongvaux, A., Fritsch, K., Flavell, R. A., Manz, M. G. Humanized hemato-lymphoid system mice. Haematologica. 101 (1), 5-19 (2016).
- Goldman, J. P., et al. Enhanced human cell engraftment in mice deficient in RAG2 and the common cytokine receptor gamma chain. British Journal of Haematology. 103 (2), 335-342 (1998).
- Stripecke, R., et al. Innovations, challenges, and minimal information for standardization of humanized mice. EMBO Molecular Medicine. 12 (7), (2020).
- Allen, T. M., et al. Humanized immune system mouse models: progress, challenges and opportunities. Nature Immunology. 20 (7), 770-774 (2019).
- Gammelgaard, O. L., Terp, M. G., Preiss, B., Ditzel, H. J. Human cancer evolution in the context of a human immune system in mice. Molecular Oncology. 12 (10), 1797-1810 (2018).
- Rios-Doria, J., Stevens, C., Maddage, C., Lasky, K., Koblish, H. K. Characterization of human cancer xenografts in humanized mice. Journal for Immunotherapy of Cancer. 8 (1), 000416 (2020).
- Gombash Lampe, S. E., Kaspar, B. K., Foust, K. D. Intravenous injections in neonatal mice. Journal of Visualized Experiments. (93), e52037 (2014).
- Lang, J., Weiss, N., Freed, B. M., Torres, R. M., Pelanda, R. Generation of hematopoietic humanized mice in the newborn BALB/c-Rag2null Il2rγnull mouse model: a multivariable optimization approach. Clinical Immunology. 140 (1), 102-116 (2011).
- Laskowski, T. J., Hazen, A. L., Collazo, R. S., Haviland, D. Rigor and reproducibility of cytometry practices for immuno-oncology: a multifaceted challenge. Cytometry Part A. 97 (2), 116-125 (2020).
- Bagby, S., et al. Development and maintenance of a preclinical patient derived tumor xenograft model for the investigation of novel anti-cancer therapies. Journal of Visualized Experiments. (115), e54393 (2016).
- Laajala, T. D., et al. Optimized design and analysis of preclinical intervention studies in vivo. Scientific Reports. 6, 30723 (2016).
- Na, Y. S., et al. Establishment of patient-derived xenografts from patients with gastrointestinal stromal tumors: analysis of clinicopathological characteristics related to engraftment success. Scientific Reports. 10 (1), 7996 (2020).
- Tentler, J. J., et al. RX-5902, a novel beta-catenin modulator, potentiates the efficacy of immune checkpoint inhibitors in preclinical models of triple-negative breast cancer. BMC Cancer. 20 (1), 1063 (2020).
- Lang, J., et al. Development of an adrenocortical cancer humanized mouse model to characterize anti-PD1 effects on tumor microenvironment. The Journal of Clinical Endocrinology & Metabolism. 105 (1), 26-42 (2020).
- Lang, J., et al. Studies of lymphocyte reconstitution in a humanized mouse model reveal a requirement of T cells for human B cell maturation. The Journal of Immunology. 190 (5), 2090-2101 (2013).
- Katano, I., et al. NOD-Rag2null IL-2Rγnull mice: an alternative to NOG mice for generation of humanized mice. Experimental Animalas. 63 (3), 321-330 (2014).
- Brehm, M. A., et al. Parameters for establishing humanized mouse models to study human immunity: analysis of human hematopoietic stem cell engraftment in three immunodeficient strains of mice bearing the IL2rγ(null) mutation. Clinical Immunology. 135 (1), 84-98 (2010).
- Hasgur, S., Aryee, K. E., Shultz, L. D., Greiner, D. L., Brehm, M. A. Generation of immunodeficient mice bearing human immune systems by the engraftment of hematopoietic stem cells. Methods in Molecular Biology. 1438, 67-78 (2016).
- Andre, M. C., et al. Long-term human CD34+ stem cell-engrafted nonobese diabetic/SCID/IL-2Rγnull mice show impaired CD8+ T cell maintenance and a functional arrest of immature NK cells. The Journal of Immunology. 185 (5), 2710-2720 (2010).
- Wunderlich, M., et al. Improved multilineage human hematopoietic reconstitution and function in NSGS mice. PLoS One. 13 (12), 0209034 (2018).
- Lee, J., Brehm, M. A., Greiner, D., Shultz, L. D., Kornfeld, H. Engrafted human cells generate adaptive immune responses to Mycobacterium bovis BCG infection in humanized mice. BMC Immunology. 14, 53 (2013).
- Masse-Ranson, G., et al. Accelerated thymopoiesis and improved T-cell responses in HLA-A2/-DR2 transgenic BRGS-based human immune system mice. European Journal of Immunology. 49 (6), 954-965 (2019).
- Oswald, E., et al. Immune cell infiltration pattern in non-small cell lung cancer PDX models is a model immanent feature and correlates with a distinct molecular and phenotypic make-up. Journal for Immunotherapy of Cancer. 10 (4), 004412 (2022).
Erratum
Formal Correction: Erratum: Testing Cancer Immunotherapeutics in a Humanized Mouse Model Bearing Human Tumors
Posted by JoVE Editors on 5/25/2023. Citeable Link.
An erratum was issued for: Testing Cancer Immunotherapeutics in a Humanized Mouse Model Bearing Human Tumors. The Authors section was updated from:
Jordi M. Lanis1
Matthew S. Lewis1
Hannah Strassburger1
Stacey M. Bagby2
Adrian T. A. Dominguez2
Juan A. Marín-Jiménez3
Roberta Pelanda1
Todd M. Pitts2
Julie Lang1
1Department of Immunology and Microbiology, School of Medicine, University of Colorado Denver Anschutz Medical Campus
2Division of Oncology, School of Medicine, University of Colorado Denver Anschutz Medical Campus
3Department of Medical Oncology, Catalan Institute of Oncology (ICO-L’Hospitalet)
to:
Jordi M. Lanis1
Matthew S. Lewis1
Hannah Strassburger1
Kristina Larsen1
Stacey M. Bagby2
Adrian T. A. Dominguez2
Juan A. Marín-Jiménez3
Roberta Pelanda1
Todd M. Pitts2
Julie Lang1
1Department of Immunology and Microbiology, School of Medicine, University of Colorado Denver Anschutz Medical Campus
2Division of Oncology, School of Medicine, University of Colorado Denver Anschutz Medical Campus
3Department of Medical Oncology, Catalan Institute of Oncology (ICO-L’Hospitalet)
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır