このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
ヒト腫瘍を有するヒト化マウスモデルにおける癌免疫療法の試験
* これらの著者は同等に貢献しました
要約
このプロトコルは、免疫腫瘍学研究のためのヒト免疫系(HIS)マウスの生成について概説しています。このモデルに移植されたヒト腫瘍に対するヒト免疫療法を試験するためのこのモデルの使用における指示および考慮事項は、腫瘍に対するヒト免疫系の応答を特徴付けることに重点を置いたものとして提示されている。
要約
腫瘍微小環境の免疫抑制性を逆転させることは、免疫療法薬による癌の治療を成功させるために重要です。マウスがんモデルは、その多様性が非常に限られており、臨床への翻訳が不十分です。免疫療法研究のためのより生理学的な前臨床モデルとして役立つために、このプロトコルは、ヒト免疫系で再構成されたマウスにおけるヒト腫瘍の治療を評価するために開発されました。このユニークなプロトコルは、ヒト免疫系(HIS、「ヒト化」)マウスの開発と、それに続く細胞株由来異種移植片(CDX)または患者由来異種移植片(PDX)のいずれかのヒト腫瘍の移植を示しています。HISマウスは、臍帯血から分離したCD34+ヒト造血幹細胞を、異種腫瘍も受け入れることができる新生児BRGS(BALB/c Rag2-/-IL2RγC-/- NODSIRPα)の高免疫不全マウスに注入することによって生成されます。ヒト免疫系の発達と腫瘍移植の動態と特性の重要性が強調されています。最後に、フローサイトメトリーを用いた腫瘍微小環境の詳細な評価について説明します。このプロトコルを使用した多数の研究では、個々の腫瘍の腫瘍微小環境がHIS-PDXマウスで再現されることがわかりました。「熱い」腫瘍は大きな免疫浸潤を示しますが、「冷たい」腫瘍はそうではありません。このモデルは、幅広いヒト腫瘍に対する併用免疫療法の試験場として機能し、個別化医療の探求における重要なツールを表しています。
概要
マウスがんモデルは、腫瘍の成長と免疫逃避の基本的なメカニズムを確立するために重要です。しかし、マウスモデルでのがん治療研究では、同系モデルが限られており、種固有の違いがあるため、臨床への翻訳は有限です1,2。腫瘍を制御するための支配的なアプローチとしての免疫療法の出現は、機能的なヒト免疫システムを備えたin vivoモデルの必要性を繰り返し示しています。過去10年間のヒト免疫系マウス(HISマウス)の進歩により、さまざまな種類の癌および免疫療法剤におけるin vivoでの免疫腫瘍学の研究が可能になりました3、4、5、6。細胞株由来および患者由来異種移植片(それぞれCDXおよびPDX)を含むヒト腫瘍モデルは、HISマウスでよく増殖し、ほとんどの場合、ヒト造血生着を欠く免疫不全宿主における増殖とほぼ同じである7,8。この重要な発見に基づいて、研究者はHISマウスモデルを使用して、腫瘍微小環境(TME)を変化させて免疫抑制を低下させ、免疫指向性腫瘍殺傷を強化するように設計された併用療法を含むヒト免疫療法を研究しています。これらの前臨床モデルは、ヒト癌の不均一性の問題に対処するのに役立ち、治療の成功を予測し、免疫関連の薬物毒性を監視することもできます9,10。
ヒト造血幹細胞の導入によるヒト免疫系を有するマウスモデルの作製には、異種移植片を拒絶しないレシピエント免疫不全マウスが必要である。現在のHISマウスモデルは、30年以上前に報告された免疫不全マウス系統に由来します。記載された最初の免疫不全マウス系統は、T細胞およびB細胞を欠失したSCIDマウスであり11、続いて、ヒトCD47分子12,13へのNOD SIRPα対立遺伝子の結合の増加により、ヒト細胞に対するマウスマクロファージ耐性に関与するSIRPα多型を有するハイブリッドNOD-SCIDが続いた。2000年代初頭、BALB/cとNODの両方の免疫不全株におけるIL-2受容体(IL-2Rγc)の共通ガンマ鎖の欠失は、宿主NK細胞の発生を禁止する遺伝子欠失により、ヒト生着増強のゲームチェンジャーでした14,15,16,17。BRGおよびNRGマウスなどの代替モデルは、TおよびB細胞受容体遺伝子の再配列、したがってリンパ球の成熟および生存に必要なRag1またはRag2遺伝子の欠失を通じてTおよびB細胞欠損を達成する18,19。本明細書で用いられるBRGS(BALB/c -Rag2ヌルIl2RγCヌルSirpα NOD)マウスは、IL-2Rγ鎖欠損症とRag2-/-バックグラウンド上のNOD SIRPα対立遺伝子を結合し、T、B、またはNK細胞を持たないが、30週以上の長期生着を可能にするのに十分な活力と健康を備えた高度に免疫不全マウスをもたらす13。
HISマウスは複数の方法で生成することができ、ヒトPBMC注射が最も直接的な方法である15、18、20。しかし、これらのマウスは、活性化ヒトT細胞の顕著な増殖を有し、12週齢までに移植片対宿主病(GVHD)をもたらし、長期研究を妨げる。あるいは、臍帯血(CB)、骨髄、および胎児肝臓からのヒト造血幹細胞も、ヒト免疫系の生着および産生に使用することができる。このシステムでは、造血幹細胞は、主にT細胞を発達させるPBMCマウスと比較して、マウス宿主に有意に耐性のあるT、B、および自然免疫細胞の生成を伴う多系統のヒト免疫系を産生する。したがって、GVHDは存在しないか、大幅に遅延し、研究は10ヶ月齢までのマウスに拡張することができる。CBは、遺伝的に同一の免疫系を持つ複数のHISマウスの生着を促進する、CD34+ヒト造血幹細胞の簡単でアクセスしやすい非侵襲的な供給源を提供します17、18、20、21。過去数年間、HISマウスモデルは免疫療法およびTME 3,4,5,6の研究に広く使用されてきました。これらのマウスではヒト由来の免疫系が発達しているにもかかわらず、ヒト異種移植片腫瘍は対照免疫不全マウスと比較して同様の速度で成長し、生着したPDXの微小環境を維持するために重要な癌細胞と免疫細胞の間の複雑な相互作用を可能にします3,7,8.このプロトコルは、PDXおよびCDXを使用したHIS-BRGSマウスで治療をテストする50を超える研究を実施するために使用されています。重要な結論は、HISマウスのヒト腫瘍は、最初の患者サンプルおよび免疫浸潤特性に対する腫瘍の分子評価によって定義される独自のTMEを維持することである3、22、23。私たちのグループは、マルチパラメータフローサイトメトリーを使用して、免疫器官と腫瘍の両方におけるHISの詳細な評価に焦点を当てています。本明細書では、BRGSマウスのヒト化、キメラの評価、ヒト腫瘍の移植、腫瘍増殖測定、癌治療投与、およびフローサイトメトリーによるHIS細胞の解析のためのプロトコールを記載する。
プロトコル
すべての動物作業は、コロラド大学デンバー校の施設動物管理および使用委員会(IACUCプロトコル#00593および#00021)によって承認された動物プロトコルの下で実施されました。すべての動物作業は、コロラド大学デンバーアンシュッツメディカルキャンパスにある米国実験動物管理協会の認定施設である実験動物資源局(OLAR)に従って実施されました。すべてのヒト臍帯血サンプルは、匿名化されたドナーからの寄付として取得されたため、人間の研究倫理委員会による承認の対象にはなりません。
メモ: プロトコルに記載されているすべてのメディアとソリューションの構成は、 補足ファイル1に含まれています。 図1 は、HIS-BRGSマウスにおける腫瘍に対する免疫応答の生成および解析のための全体的なプロトコルを示す。
1. HISマウスの作製
- BALB/c -Rag2ヌルIl2RγCヌルSirpαNOD(BRGS)マウスのマウス飼育
注:この株は非常に免疫不全であり、T、B、またはNK細胞はありません。したがって、日和見感染を防ぐために厳格な対策を講じる必要があります。トリメトプリムとスルファジアジンを含む食事でコロニーを通常の食事と交互に2週間のスケジュールで維持します。.可能な限り最高レベルの予防用住宅室(たとえば、アクセスが制限されたバリアシャワーイン施設)で維持します。- BALB/c -Rag2ヌルIl2RγCヌルシルプαNOD(BRGS)およびBALB/c Rag2ヌルIl2RγCヌルシルパバルブ/c(BRG)ホモ接合マウスのコロニーをブリーダーとして維持する。
- BRGS N / N×BRG B / Bを繁殖させて、BRGSB / N子犬を生成し、ヒト幹細胞のレシピエントとして使用します。このコロニーでは、BRGSB / NはBRGS N/ Nよりも健康であり、同等のレベル(BRG以上)で生着します。
- 臍帯CBからのCD34+ヒト幹細胞単離
注:この手順には抗生物質は使用されていません。したがって、優れた滅菌技術が不可欠です。- 50 mLのコニカルチューブラック、および3x 15 mLおよび~10x 50 mLのコニカルチューブを滅菌済みバイオセーフティキャビネット(BSC)に入れます。採血バッグに70%エタノールをスプレーし、BSCで乾燥させます。
- CB密度勾配分離に必要な50 mLコニカルチューブの数= CB容量/15を計算し、切り上げて偶数のチューブ数にします。チューブあたりの血液量= CB量/チューブ数を計算します。CBバッグから各円錐管に注意深く血液を注ぎます。これはチューブあたり最大15mLです。自動ピペッターと25 mLの血清学的ピペットを使用して、上下にピペッティングすることにより、血液を滅菌PBSと1:1で混合します。
- 低速の自動ピペッターと10 mLの血清学的ピペットを使用して、界面を乱すことなく、室温(RT)1.077 g/mL密度勾配溶液( 材料表を参照)で血液をゆっくりと下敷きにします。ピペットチップがチューブの底に触れないようにしてください。すべてのチューブについて繰り返します。次に、RTでブレーキをかけずに850 x gで30分間遠心分離し、密度勾配を確実に維持します。
- 1.077 g/mLの密度勾配の上にあるセルラーバフィーコートを、曇った白い層として視覚化します。25 mLの血清学的ピペットと自動ピペッターを使用して、バフィーコートの約10 mL上の血漿層を取り除き、廃棄します。
- 滅菌トランスファーまたは血清学的ピペットでバフィーコートを収集します。へらのようにピペットを使用して、球を放して(またはゆっくりとピペッティングして)細胞を引き上げながら、円錐形のチューブの側面から細胞をこすり落とします。2本の50 mLコニカルチューブのバフィーコートを1本の新しい50 mLコニカルチューブに組み合わせます。
- 2%FBSを含む45 mLの滅菌HBSSを各コニカルチューブに注ぎ、細胞を洗浄します。RTで360 x g で11分間遠心分離します。
- 洗浄媒体をすべてのチューブのペレットまで吸引します。10 mLの血清学的ピペットと自動ピペッターを使用して、2%FBSを含む10 mLのHBSSに最初のペレットを再懸濁します。各ペレットを同じ10 mLのHBSSに再懸濁し、各チューブを追加の10 mLのHBSSですすぎ、すべての細胞を1つのチューブに集めます。
- 2%FBSを含む滅菌HBSS45mLを円錐管に注ぎます。360 x g、4°Cで10分間遠心分離します。
- 洗浄バッファーをセルペレットまで吸引し、ペレットを20 mLの磁気セルセパレーターバッファーに再懸濁します( 材料の表を参照)。少量のアリコートを除去し、メチレンブルーの1:20希釈で血球計で細胞をカウントします。青と白のセルの数を追加します。360 x gで遠心分離し、4°Cで10分間加熱します。
メモ: このプロトコルは磁気ビーズ技術を使用しています( 材料の表を参照)。このプロトコルは、CD34+幹細胞の十分な純度と収量で、あらゆる細胞分離技術で使用するために変更することができます。 - 上清を吸引し、臍帯血から単離したCD34+細胞ペレットを、1 x 108 細胞あたり300 μLの磁気細胞分離バッファーに再懸濁します。最初に100 μLのFcRブロッキング試薬を添加し、次に1 x 108 細胞あたり100 μLのCD34+磁気ビーズを追加します。4°Cで30分間インキュベートします(氷なし)。
- 1 x 108 セルあたり5 mLの磁気セルセパレーターバッファーを加え、360 x g で4°Cで10分間スピンします。 洗浄ステップを繰り返し、「未分画」とラベル付けされた15 mLコニカルチューブ内の1 x 108 セルあたり500 μLの磁気セルセパレーターバッファーにペレットを再懸濁します。
- さらに2本の15 mLコニカルチューブに「CD34-」と「CD34+」というラベルを付けます。3本の15 mLコニカルチューブ(未分画、CD34-、およびCD34+)を冷却ラックのスロットA1、B1、およびC1にそれぞれ配置します( 材料の表を参照)。製造元の指示に従って、BSCの自動磁気セルセパレーター( 材料表を参照)の2列のポジティブ選択プログラムを使用してセルを分離します。
- CD34+ヒト幹細胞の増殖と凍結
- 回収したCD34+細胞懸濁液(2 mL)10 μLを血球計算盤スライドに分注し、10倍の倍率で細胞をカウントします。細胞数に2 x 104を掛けて、CD34+細胞の総数を計算します。総CD34 +細胞数を250,000で割って、凍結するバイアルの数を計算します( in vitro 増殖前のマウスの子犬あたり50,000細胞)。
- CB培地Iscoveの10%FCS(および1 mLのろ過損失のために1 mLの追加)を準備し、40 ng / mLの幹細胞因子、20 ng / mLのFlt3L、および10 ng / mLのIL-6を添加し、0.22 μmのフィルターを通過させます。CD34+細胞をCB培地1mLあたり100,000で再懸濁し、37°Cでインキュベートします。 3日目に、サイトカインを含まない等量のCB培地を、細胞を含むフラスコとサイトカインを含むCB培地に加えます。
注:これらのサイトカインをCB培地に添加すると、分化を防ぎながらCD34+細胞の生存と増殖が促進されます。 - 5日目に増殖したCD34+細胞を回収します。細胞懸濁液を上下にピペットで動かし、50 mLのコニカルチューブに回収します。フラスコの底を覆うのに十分なCB培地を追加します。セルスクレーパーを使用して、フラスコの底全体をこすります。すべての培地を同じ50 mLチューブに回収し、360 x g で11分間遠心分離します。
- 細胞を2 mLのCB培地に再懸濁します。ピペットからの最後の滴を計数用の96ウェルプレートに保存します。細胞をトリパンブルーで1:1に希釈し、血球計算盤に10 μLを加えてから、4つの象限から細胞を数えて平均化します。細胞数に4 x 104を掛けてCD34+細胞の総数を計算し、生存率を記録します。
- n+1 mLの凍結培地を作ります(nはステップ1.3.1で計算された凍結バイアルの数です)。FBSに10%(v / v)DMSOを加えて凍結培地を準備し、氷上に保ちます。クライオバイアルにCB#、CD34+ d5、および日付をラベル付けします。
- CD34+細胞を360 x g で4°Cで10分間スピンダウンします。 培地をペレットまで吸引し、細胞ペレットを凍結培地に再懸濁します。1 mLの細胞懸濁液を各バイアルに分注し、残りをバイアル間で均等に分割します。バイアルを4°Cに冷却したイソプロパノールセルフリーザーに加え、-80°Cに置き、液体窒素に移して>90日間保存します。
- マウスの子犬の照射
- 生後1〜3日でBRGSB / N の子犬を、パッド付きのオートクレーブ滅菌されたプラスチックの箱に集めます。子犬と一緒に少量の寝具を追加します。ケージ番号と子犬の数でボックスにラベルを付けます。
- 照射器( 材料の表を参照)を300radの線量でセットアップします。子犬の箱を照射器にセットし、300radにさらします。子犬をケージに戻し、山に入れ、寝具で覆います。
- 子犬注射とCD34+細胞製剤
- CD34+細胞の調製を照射後~3時間で開始します。10 mLのCB培地を50 mLのコニカルチューブで温めます。滅菌BSCですべてのステップを実行します。
- 注入する4〜6匹の子犬ごとに、 in vitro で拡張および凍結されたCD34 +細胞のバイアルを1つ取り出します。55°Cで、少量の氷が見えるまで急速に解凍し、温めたCB培地に細胞を加えます(バイアルは触ると冷たくなっているはずです)。1 mLの培地を使用して各バイアルをすすぎ、細胞を360 x g で4°Cで12分間回転させます。
注:55°Cでの急速融解は、37°Cでの融解よりも優れた細胞生存率(90%-95%)をもたらすことがわかりました。 - 培地を慎重に吸引します。(小さな)ペレットを2 mLのCB培地に再懸濁し、穏やかに混合し、~30 μLの細胞懸濁液をカウントプレートの単一ウェルに加えます。トリパンブルーで1:1に希釈し、血球計算盤に10 μLを加え、4つの象限から細胞をカウントして平均化します。
- 細胞数に4 x 104 を掛けてCD34+細胞の総数を計算し、生存率を記録します。360 x g で4°Cで12分間スピンします。
- 培地を注意深く吸引し、細胞ペレットをn + 1匹あたり100 μLの滅菌PBSに再懸濁して注入すると、マウスあたり250,000〜450,000個のCD34 +細胞が得られます。円錐形のチューブを輸送容器の氷の上に置き、子犬の注射のためにビバリウムに移動します。
- ヒートランプ、おむつ、1 mLシリンジ、18 G針、30 G針、および滅菌容器に入ったCD34 +細胞製剤をビバリウムBSCに持ち込みます。滅菌おむつをヒートランプの下に~2フィート置きます。注入するごみの入ったケージを回収し、BSCに入れます。
- 18 Gの斜角針でシリンジを組み立てます。円錐管の角度を針の斜角と一致させ、細胞懸濁液を穏やかに混合して引き上げます。子犬をおむつの上に置いて温めます(過熱に注意してください)。シリンジから空気を取り除き、18 G針を30 G針に交換し、細胞懸濁液が針の先端にちょうど来るまでシリンジを慎重に押します。
注:あるいは、インスリン注射器を使用することもできます。 - 一度に1匹ずつおむつの端までヒートランプから離します。子犬を親指と人差し指の下で横にして固定し、顔がはっきりと見えるようにします。耳がある場所の下の頬を横切る静脈に注目してください。眼に最も近い静脈(IV)に針を浅く挿入し、50μLの細胞をゆっくりと注入します。
- 皮下注射から泡が形成されていないか確認してください。その場合は、針を深く挿入し、細胞の注入に進みます。成功すると、少量の血液/血腫が見えます。
注:子犬の注射に関するゴンバッシュランペらの手順を参照してください24 。 - 子犬がまだ固定された状態で、さらに50 μLの細胞(IV + IHの子犬あたり合計100 μL)を使用して肝内注射(IH)を実行します。肝臓は、ホワイトミルクバンドと胸郭の間の暗いスポットとして視覚化できます。注射された子犬を、注射されていない子犬と熱からさらに離れたおむつに置きます。
注:IV注射は、IH注射単独よりも優れた長期キメラをもたらします25が、IV注射は常に成功するとは限りません。したがって、注射をIVとIHの間で分割すると、より大きな割合のマウスへの生着が保証されます。 - すべての子犬に対して顔面静脈注射とIH注射の両方を繰り返します。血をきれいにし、子犬をケージの巣に戻し、寝具で覆います。
2.血液中のヒトキメラのテスト
- 10週齢と14週齢の両方でHISマウスの血中キメラをテストします。眼窩後静脈 を介して 、またはIACUCが承認した別の方法を使用して、50μLの血液を採取します。
- 眼窩後出血の場合は、イソフルラン気化器を5に設定したマウスを1〜2分間麻酔してから、気化器の設定を4に下げます。必要に応じて気化器を下げて、麻酔下にある間、マウスが十分に酸素化された状態を維持できるようにします。マウスをイソフルラン下に5分以上置かないでください。
- 麻酔をかけたマウスの鼻をイソフルラン気化器ノーズコーンアタッチメントに入れ、鎮痛剤(0.5%プロパラカインHCl点眼液USP)を眼に一滴置きます。
- 1分後、滅菌ガーゼを使用してプロパラカインを取り除き、眼球をプロトースし、75 mmのヘパリン化ヘマトクリットチューブを眼窩後に挿入して50 μLの血液を採取します。50 μLのヘパリンを含む1.5 mLの微量遠心チューブに血液を排出し、穏やかに混合します。
- 出血を止めるために滅菌ガーゼで目をつまんで、プロパラカインを一滴塗ります。マウスをイソフルランから取り出し、清潔なケージで回復させる。
- マウス血液からのPBMC単離
- 血液/ヘパリンを穏やかに上下にピペッティングして混合し、界面を乱さないように注意しながら、1.077 g/mLの密度勾配500 μLの上にゆっくりと重ねます。チューブを1,220 x g で、ブレーキなしでRTで20分間遠心分離します。
- 細胞バフィーコートを、血漿の下の1.077 g / mL密度勾配の上にある曇った層として視覚化します。200 μLのピペットでバフィーコートからできるだけ多くの細胞を取り除き、750 μLの回収培地を含む新しい1.5 mLチューブに追加します。360 x g でRTで11分間遠心分離します。
- 培地を50 μLまで吸引し、ペレットを750 μLの回収培地に再懸濁します。360 x g で4°Cで10分間遠心分離し、再び50 μLまで吸引します。細胞は表面染色剤に再懸濁する準備ができています。
- 表面染色およびフローサイトメトリー解析
- 染色パネルワークシートに記入します(表1;「スペクトルフローブリードパネル」ワークシート)をマウス番号で使用し、全ての蛍光抗体を染色バッファーに添加して抗体染色カクテルを調製した(補足ファイル1)。サンプルを96ウェルU底プレートに追加するプレートレイアウトを作成します。永久マーカーを使用してウェルの底に印を付けます。染色前の標準手順を用いて抗体を滴定し、適切な濃度を決定した26。
- 62 μLの表面ステインカクテルを96ウェルUボトムプレートの各ウェルに追加します。チューブ内に残っている50 μLの細胞を再懸濁し、各サンプルを対応するウェルに追加します。ポジティブ染色コントロール用のウェル(ヒトPBMC +マウス脾細胞、各1 x 106 細胞)をサンプルと一緒に染色します。ピペッティングで混合し、4°Cで15分間インキュベートします。
- 680 x g で4°Cで3分間遠心分離します。 プレートを流しにフリックして上清を除去し、穏やかにピペッティングして150 μLの染色バッファーに再懸濁~10倍にして細胞を洗浄します。各ウェルをスピンし、150 μLの染色バッファーに再懸濁します。
- フローサイトメーター( 材料表を参照)で各サンプルの100 μLのデータを取得し、.fcsファイルをエクスポートします。.fcs ファイルをフロー データ編集ソフトウェアにインポートします(「 材料表」を参照)。セルを囲むFSC-A x SSC-Aプロットにポリゴンゲートを適用し、破片を除外します。ゲート内のセルを選択します( 表1を参照)。「スペクトルフローブリードゲーティング」ワークシート)。
- 軸を(FSC-A x FSC-H)に変更し、線から突き出ているダブレットを除く線形対角線上に含まれるセルをゲートします。これらのセルを選択し、軸を (hCD45 x mCD45) に変更します。
- hCD45+集団にポリゴンゲートを適用し、「ヒト」という名前を適用します。mCD45+集団にポリゴンゲートを適用し、「マウス」という名前を適用します。ヒト集団とマウス集団の両方のカウント統計を作成します。
- 人口を選択し、軸を (CD19 x CD3) に変更します。CD19+セルにポリゴンゲートを適用し、「Bセル」という名前を付けます。CD3+集団にポリゴンゲートを適用し、「T細胞」という名前を付けます。二重負の母集団にポリゴン ゲートを適用し、"NonTB" という名前を付けます。
- T 細胞集団を選択し、軸を (CD8 x CD4) に変更します。CD4 陽性集団と CD8 陽性集団にポリゴン ゲートを適用し、それぞれ "CD4+" と "CD8+" という名前を付けます。
- 非結核集団を選択し、軸を(CD56 x骨髄)に変更します。ダブルポジティブイベントを含むCD56陽性集団全体にポリゴンゲートを適用し、「NK細胞」という名前を付けます。CD56陰性および骨髄系陽性集団に多角形ゲートを適用し、「骨髄」という名前を付けます。
- すべての母集団のパーセンテージとカウント統計のテーブルを作成し、スプレッドシートソフトウェアにエクスポートします( 材料表を参照)。%hCD45キメラ = %hCD45/(%hCD45 + mCD45)を計算します。
- さらなる実験のために、<20%hCD45+(mCD45 + hCD45の)であるHISマウスを除外します。
注:この研究では、よりクリーンな赤血球の枯渇のために、1.077 g / mLの密度勾配分離を使用してPBMCを調製しました。この手順では、PBMC層からヒトおよびマウス顆粒球を除外した。あるいは、赤血球溶解を使用することができる。
3.マウスへの腫瘍の注射
- 腫瘍注入の前に、14週間の出血データからT細胞数を確認する。腫瘍は、T細胞が>20%の場合は20〜26週間、T細胞が全免疫細胞集団の<20%の場合は24〜28週間の間に収穫の準備ができているように注射されます。この注射タイミングは、マウスが20〜28週齢であり、研究の終わりに十分な数のT細胞を有することを保証する。
- 細胞株由来異種移植片(CDX)の注入
注:手順は、例としてMDA-MB-231乳房腺癌細胞( 材料の表を参照)を使用して説明されています。- 凍結細胞のアリコートを解凍し、10%FBS、1%PenStrep、および1%非必須アミノ酸を添加した10 mLのDMEMに再懸濁して1回洗浄し、360 x g で4°Cで10分間遠心分離します。 培地を吸引し、10%FBS、1%PenStrep、および1%非必須アミノ酸を添加した10 mLのDMEMにT25フラスコに再懸濁し、5%CO2で37°Cでインキュベートします。
注:細胞株は、正しい細胞型を確認するためにPCRによって認証されます。細胞上清は、注射前に生化学的アッセイ を介して マイコプラズマについてテストされます。 - 指数関数的増殖期の間に細胞を約80%のコンフルエントで通過および拡張する。
- 培地を吸引し、5〜10 mLの滅菌PBS(pH 7.2)で細胞をすすぎ、細胞がフラスコから剥離するまで1 mLの0.25%トリプシン-EDTAで1〜5分間インキュベートします。
- 同じDMEMを5 mL加え、上下にピペッティングして混合します。6 mLの細胞懸濁液全体を新しい組織培養処理T75フラスコ(1:3希釈)に継代し、さらに10 mLのDMEMを追加します。
- DMEM中の1:3希釈プレーティングで80%コンフルエントで2〜3日ごとに細胞を継代し、細胞を増殖させた。
- 指数関数的増殖期に0.25%トリプシン-EDTAで細胞を6継代以内に回収し、PBSで洗浄します。PBSと基底膜抽出物( 材料の表を参照)を1:1の比率で混合し、最終濃度5 x 107 細胞/ mLで細胞に加えます。
- ステップ2.1.1に記載されるようにイソフルランでマウスを麻酔する。23 Gの針を使用して、100 μL(5 x 106 細胞)の腫瘍細胞懸濁液を各脇腹に皮下注射します。
- 凍結細胞のアリコートを解凍し、10%FBS、1%PenStrep、および1%非必須アミノ酸を添加した10 mLのDMEMに再懸濁して1回洗浄し、360 x g で4°Cで10分間遠心分離します。 培地を吸引し、10%FBS、1%PenStrep、および1%非必須アミノ酸を添加した10 mLのDMEMにT25フラスコに再懸濁し、5%CO2で37°Cでインキュベートします。
- トロカールを使用して患者由来の異種移植片(PDX)の注射を行います。PDXモデルの注入手順およびその他の開発および保守手順は、資料27で入手できます。
4. 腫瘍増殖測定
- 移植後週に一度、脇腹に沿って腫瘍の成長を感じて腫瘍の進行を確認します。腫瘍が触知可能になったら、マウスをイソフルランで麻酔し(ステップ2.1.1に記載)、電気トリマーで各脇腹を剃り、腫瘍が成長するにつれて潰瘍形成を防ぐために腫瘍の周囲に注意を払います。
注:腫瘍の周りの皮膚の損傷を防ぐために、腫瘍注射の前にマウスを剃ることができます。ただし、毛髪の再生速度は腫瘍の測定を妨げる可能性があります。 - ノギスを使用して週に2回腫瘍の長さと幅を測定し、測定値をmm単位で記録します。式
 を使用して腫瘍測定値を腫瘍体積(mm3)として報告します。腫瘍量が単一の腫瘍あたり2,000 mm 3を超えるか、合計体積が3,000 mm3を超えないように注意してください。
を使用して腫瘍測定値を腫瘍体積(mm3)として報告します。腫瘍量が単一の腫瘍あたり2,000 mm 3を超えるか、合計体積が3,000 mm3を超えないように注意してください。
注:がん研究におけるマウスの使用に関するガイドラインは、場所によって異なります。研究者の機関での動物の世話と使用の方針を参照してください。
5.薬物治療
- HISマウスを、hCD45キメリズム、hCD3キメリズム、およびhCD8キメラに基づいて同等の治療群に割り付ける。腫瘍が平均100 mm3 に達したら、薬物治療を開始します。
注:グループあたりのマウス数は、CBから生成されたHISマウスの数に基づいています。グループごとに最低4匹のマウスが推奨されます。非二者マルチグループマッチング(例えば、R−vivoマニラソフトウェア内)は、このグルーピング28に有用である。 - 薬物経路と頻度
- 抗PD-1阻害剤(ニボルマブ、ペムブロリズマブ)を腹腔内(i.p.)に30 mg / kg 1週1回、単回治療の場合は週20 mg / kg 2回、併用治療の場合は週10〜15 mg / kg 2回注射します。.
- 実験デザインに従って、標的療法、化学療法、照射などの併用療法を投与します。標的療法と化学療法は、経口強制経口投与、i.p.注射、または食物を通して与えることができます。
注:線量は、公開されたデータと腫瘍モデルに応じて変化させ、最適化することができます。用量試験は、HISマウス試験の前に免疫不全レシピエントでテストされることがよくあります。
- 体重減少、ゆるい糞便、猫背姿勢、可動性の低下、毛皮の喪失などの健康上の変化について、マウスを少なくとも週に3回監視します。一部の症状は薬物毒性またはGVHDの兆候である可能性があり、薬物投与を減らすか停止する必要がある場合があります。動物の世話と使用の方針に従って、必要に応じてマウスを安楽死させます。
6.研究終了時のマウス組織と腫瘍の採取
- 施設および獣医のガイドラインに従って、流量2.75 L/minの圧縮CO2 ガスを使用してマウスを単独で安楽死させます。死亡後1分間CO2 に保持されたマウスを監視し、その後、安楽死の二次形態として頸部脱臼を行う。
- 採血
- 心臓内穿刺 によって 採血します。マウスを直立させ、正中線のすぐ左と肋骨の下の線から、25 Gの針が付いた1 mLシリンジを心臓に直接挿入します。理想的には1回の長いドローで血液をシリンジに集め、ラベルの付いた1.5mLチューブに移します。
注意: 追加の針挿入を実行して、肺腔の角から追加の血液を注意して収集できます。 - 血液を4°Cで1時間放置した後、微量遠心機で7,800 x gで6分間遠心分離します。血液界面の上の透明な液体(血清)を2番目の清潔でラベル付けされた1.5mLチューブに集めます。血清を-20°Cで保存して、ヒトおよびマウスの炎症性サイトカインや免疫グロブリン力価などの下流分析を行います。
- 心臓内穿刺 によって 採血します。マウスを直立させ、正中線のすぐ左と肋骨の下の線から、25 Gの針が付いた1 mLシリンジを心臓に直接挿入します。理想的には1回の長いドローで血液をシリンジに集め、ラベルの付いた1.5mLチューブに移します。
- 組織解剖
- マウスの腫瘍細胞の注射と成長、および薬物治療の投与の後、組織を採取します。マウスをフォーム解剖ボードの上に置き、ピンで固定し、腕と脚を45°の角度で伸ばします。腹膜の切断を避けながら、骨盤の近くからあごまで伸びて、胴体の中央を切開します(ただし、これは必須ではありません)。皮膚を端まで引っ張り、ピンで所定の位置に保持します。
- 細かい鉗子を使用してリンパ節(LN)を鼠径部、腋窩、頸部、腸間膜、裂孔の順に抽出します。
注:HISマウスでは、LNはしばしば非常に小さく、anlageに似ているか、野生型のマウスとは異なる明確な外観で「炎症を起こしている」。したがって、LNに似た組織が各部位から採取されます。末梢LNはしばしば液体で満たされた「ボール」として現れますが、腸間膜LNはより密度が高いです。腸間膜LNは最も明白で一貫性があり、文字列とは対照的に、1つまたは2つの異なる密度の高いノードとして観察されます。 - LNをすりガラススライドの片側に置き、ペトリ皿の8mLの収穫培地に入れます。つや消しの端を内側にしてスライドを垂直な角度で保持し、細胞内容物が放出されるまで組織を静かに押します。
- スライドを引き離して一緒に数回すすぎ、最大量の細胞を解放します。5インチのガラスピペットで細胞を回収し、9インチのコットンプラグピペットでラベルの付いた15 mLコニカルチューブにろ過します。
- 2対の鉗子または鉗子とはさみのいずれかを使用して、腹部の左上から脾臓を抽出します。再懸濁培地の体積の推定値として脾臓のサイズに注意してください。LNと同様に、すりガラススライドを使用した機械的消化によって脾臓を収集し、ろ過します。
注:単一細胞懸濁液用の組織を調製するための任意の技術を使用できます。 - 以下に述べるように組織サンプルからの細胞の計数および再懸濁を行う。
- リンパ細胞を360 x g で4°Cで10分間遠心分離します。 液体を吸引し、DNaseを含む1 mLの回収培地に細胞ペレットを再懸濁します。
- 3 mLのACK溶解バッファーをRTで3分間インキュベートした後、10 mLのハーベスト培地/DNaseを加えて、脾臓細胞から赤血球を除去します。脾臓細胞を再度遠心分離し、上清を吸引し、脾臓のサイズに基づいて1〜10 mLの回収培地/ DNaseに細胞を再懸濁します(例:.、非常に小さな脾液の場合は1 mL、最大の脾臓の場合は最大10 mL)。
- 10 μLの細胞懸濁液を90 μLの培地に加え、血球計算盤でカウントします。LNと脾臓細胞を遠心分離し、上清を吸引し、細胞を1 x 108 細胞/mL、または最低80 μLの濃度で回収培地に再懸濁します。
- 腫瘍を抽出します。
- 解剖ハサミで腫瘍の縁をゆっくりと切り取りながら、鉗子で腫瘍を保持して、開いた脇腹から腫瘍を取り除きます。
- 腫瘍が除去されたら、それを計量し、RNAおよび免疫組織化学(IHC)処理のために1/4を除去します。1/4腫瘍を半分に分割します。半分(腫瘍全体の1/8)をクライオバイアルに入れ、液体N2で瞬間凍結し、下流のゲノム研究のために-80°Cで保存します。
- 腫瘍の残りの1/8を10%ホルマリンを含む標識標本チューブに入れます。翌日、組織をすすぎ、将来の使用まで70%エタノールに再懸濁します。腫瘍の残りの3/4を6 cmの皿に入れ、メスの刃を使って~1 mmの小片に細切りにします。
- 腫瘍片を解離チューブ( 材料の表を参照)に輸送し、5 mLの不完全な腫瘍浸潤白血球(TIL)培地で皿をすすぎ、解離チューブに追加します。
注:重量>0.4 gの腫瘍の場合は、10 mLのTIL不完全培地で皿をすすぎ、解離チューブに追加します。 - 解離チューブ内の組織に最終濃度50 mg / mLのコラゲナーゼ調製物( 材料の表を参照)を追加します。腫瘍の硬さに応じて、37°Cで30分から1時間の機械的解離を使用して組織を解離します。
- 解離後、懸濁液を100 μmのフィルターで50 mLのコニカルチューブに通し、10 mLのTIL完全培地でフィルターをすすぎます。この培地中の血清は、コラゲナーゼ反応を停止し、細胞をさらなる分解から保護します。
- 単一細胞懸濁液を360 x g で4°Cで10分間遠心分離します。 DNaseを含むちょうど十分な量の回収培地にペレットを再懸濁して、細胞懸濁液がP1000ピペットチップを簡単に通過し、下流分析のために容量を記録できるようにします。
注:容量が小さいほど、腫瘍免疫細胞の収集量は増加しますが、フローサイトメーターの詰まりの影響を受けやすくなります。
7. 細胞染色およびフローサイトメトリー解析
- 染色剤とセルプレーティング
- 染色カクテルを準備する:収穫日に、サンプル数を染色ワークシートに追加します(表2;「従来型フローAパネル」、「スペクトルフローBパネル」、および「従来型フローCパネル」ワークシート)をすべての汚れと印刷用。染色バッファー(SB)で染色AおよびBの表面染色カクテルを準備し、各抗体を新しいチップで個別に添加し、外出先で各試薬に印を付け、必要になるまで4°Cで保存します。アジドフリーPBSで適切な生存率色素を調製し、必要になるまで4°Cで保存します(使用前にRTに温めてください)。SBで2日目に表面染色剤Cカクテルを調製し、細胞内染色剤BおよびCをそれぞれの透過処理バッファーで調製します。
- 染色ワークシートのすべてのサンプルのプレートレイアウトを作成し、100 μLのアジドフリーPBSをウェルに分注します。各組織および染色(スペクトルサイトメトリー用)の染色されていないコントロールを含めます。
- 50 μLのPBSを含む96ウェルプレートに細胞を追加します。染色Aについては、染色ワークシートに記載されているように、各組織群を適切な容量で再懸濁し、同日にフローサイトメーターで取得するまで4°Cで保存します。染色BおよびCの場合、25 μLのリンパ液および60 μLの非リンパ組織細胞懸濁液をPBSでウェルに追加します。
- 染色剤Cを用いた細胞内染色による検出のためのサイトカインの in vitro 刺激を行う。
- ステップ 7.1.3 のステイン C 96 ウェルプレートを 680 x g で 4 °C で 3 分間遠心分離します。 200 μLのTILコンプリート培地(RPMI 1640、10 mM HEPES [pH 7]、10%FBS)を各ウェルに加えます。細胞懸濁液と共にプレートを4°Cで一晩保存する。
- 翌朝早く、細胞刺激カクテル( 材料表を参照)を完全なTIL培地で1:500に希釈します。細胞懸濁液を含むプレートを680 x g で遠心分離して細胞をペレット化し、フリックして培地を除去します。調製した細胞刺激カクテル200 μLに細胞を再懸濁し、37°Cで1時間インキュベートします。
- モネンシンを含むタンパク質輸送阻害剤溶液25 μLを完全TIL培地に1:1,000希釈で加え、細胞を混合し、37°Cでさらに4時間インキュベートして、サイトカインの細胞内蓄積を可能にします。
- 細胞染色を行います。
- 染色剤AおよびB(1日目)、および染色剤C(2日目)の場合は、680 x g で4°Cで3分間遠心分離します。 プレートをフリックし、適切な生存率染料をウェルに追加します。マルチチャンネルピペットで上下に穏やかにピペッティングしてよく混合し、RTで15分間インキュベートします。
- プレートを遠心分離し(ステップ7.1.5.1のように)、プレートに適切な表面汚れを加え、マルチチャンネルピペットでピペッティングして穏やかに混合します。4°Cで15分間インキュベートし、再度遠心分離します。プレートをフリックし、150 μLのSBで穏やかに上下にピペッティングして細胞を洗浄し、遠心分離します。
- プレートをフリックし、150 μLのSBで上下に穏やかにピペッティングして洗浄を繰り返し、680 x gで4°Cで3分間遠心分離します。 染色Aについては、染色ワークシートに記載されているように、各組織群を適切な容量で再懸濁し、4°Cで保存します。 染色剤Bの場合は、FoxP3転写因子キット固定液( 材料の表を参照)でRTで30分間固定します。染色剤Cの場合は、SB中の1%(v / v)パラホルムアルデヒドをRTで30分間固定します。
- 固定プレートを480 x g で4°Cで3分間遠心分離します。 SBで1回洗浄します。染色Bの場合、細胞を一晩放置することができます。
- 細胞の透過処理:染色剤Bの場合は150 μLのFoxP3転写因子キット透過処理バッファーにウェルを再懸濁し、染色Cの場合はSB中の0.5%(w/v)サポニンにウェルを再懸濁します。 RTで15分間インキュベートします。 固定プレートを480 x g で4°Cで3分間遠心分離します。
- プレートをフリックし、染色Bと染色Cのそれぞれの細胞内染色カクテルを加え、RTで30分間インキュベートします。
- 固定プレートを480 x g で4°Cで3分間遠心分離し、プレートをフリックします。150 μLの対応する透過処理バッファー(染色B、FoxP3転写因子キット透過処理バッファー、染色C、サポニン)で細胞を洗浄します。
- プレートをフリックし、150 μLのSB中で上下にピペッティングして洗浄します。 480 x g で4°Cで3分間遠心分離します。 プレートをフリックし、染色ワークシートに記載されている適切な量で組織群ごとにSB中の細胞を再懸濁します。
注:これで、サンプルをスペクトルフローサイトメトリーで取得する準備が整いました。 - フローサイトメーター( 材料の表を参照)をセットアップし、各染色に適切な単一染色コントロールを使用し、各組織群に未染色サンプルを配置して、混合解除中の自家蛍光の違いを説明します。染色ワークシート(表2)で定義されているように、組織グループごとに適切な容量を取得し、.fcsファイルをエクスポートします。
- フローサイトメトリーデータ解析
- フローサイトメトリー解析ソフトウェア( 材料表を参照)を使用して、新しいワークスペースを作成します。臓器(LN、脾臓、およびTIL)ごとに新しいグループを作成します。各臓器の .fcs ファイルをグループにインポートします。
- 二変量ドットプロットを作成し、軸を(FSC-A x SSC-A)に設定し、セルラーイベントにポリゴンゲートを適用して、エッジ(すべてのセルゲート)のイベントを回避します。セルラーイベントを選択し、軸を(FSC-A x FSC-H)に変更し、線形対角線上のイベントにポリゴンゲートを適用し、対角線から逸脱して「シングレット」ゲートを生成するイベントを除外します。「シングレット」ゲートを選択し、軸を(hCD45 x mCD45)に変更します。hCD45 および mCD45 陽性イベントにポリゴン ゲートを適用し、それぞれ "ヒト" および "マウス" という名前を付けます。
- 人口を選択し、Y 軸を [ライブ/デッド アクア] に変更します。ポリゴンゲートをライブ/デッドネガティブ、hCD45陽性の集団に適用し、「ライブヒューマン」という名前を付けます。マウスの個体群を選択し、X 軸を [ライブ/デッド アクア] に変更します。ポリゴン ゲートをライブ/デッド陰性、mCD45 陽性の集団に適用し、「ライブ マウス」という名前を付けます。
- 同様の方法で、「従来型フローAゲーティング」、「スペクトルフローBゲーティング」、および「従来型フローCゲーティング」ワークシート(表2)に概説されているように、親ゲートとX軸およびY軸を選択して、示された集団(ヒトB細胞、活性化T細胞など)を分離します。
注意: 各汚れ(ブリード、A、B、C)の代表的なゲーティングは、 補足ファイル2に含まれています。 - フローサイトメトリー解析ソフトウェアで、すべての集団のカウントと頻度のエクスポートテーブルを作成し、スプレッドシートソフトウェアにエクスポートします。頻度の親母集団を 表2に示します。
- データを使用して、実験的な治療グループに基づいてグラフを生成します。
注: データは、分析ソフトウェアの R パッケージを使用して分析することもできます。連結機能を使用して、分析するすべてのサンプルから単一の.fcsファイルを作成できます。このデータは、T-SNEアルゴリズムを使用して次元的に縮小し、組織タイプと治療グループのキーワードパラメータを追加することができます。その後、FlowSOM アルゴリズムを使用して母集団をクラスター化し、クラスターエクスプローラー ツールを使用して母集団を識別できます。新規細胞集団は、この方法で同定し、視覚的に比較し、治療群間または様々な組織内で定量化することができる。 - 同じ治療グループ内の腫瘍の免疫パラメータを、その腫瘍の成長と相関させて、腫瘍の成長阻害と相関する免疫型を定義します。腫瘍増殖を、その腫瘍に対する比増殖速度(SGR)によって定量化し、指定された時間にわたる腫瘍体積の差を考慮に入れた測定値である。この測定は、マウスの健康状態と治療開始日のために異なる日に採取された腫瘍を正常化します。
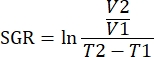
結果
脇腹腫瘍プロトコルと実験タイムライン(図1)に従って、標的チロシンキナーゼ阻害剤(TKI)療法とニボルマブ併用療法に対する腫瘍増殖と免疫応答を、2つの異なるヒト結腸直腸癌(CRC)PDXで研究しました。TKI薬は、腫瘍増殖を評価するために免疫不全宿主で研究されているのは29だけです。このモデルは、TKI単独、そしてさらに重要なことに、抗PD-1との併?...
ディスカッション
過去6年間、免疫学とヒト化マウスの両方の専門知識を使用して、私たちの研究チームは、さまざまなヒト腫瘍の免疫療法をテストするために非常に必要な前臨床モデルを開発しました3、7、30、31。このプロトコルは、免疫療法中心のヒトT細胞集団に特に注意を払いながら、モデルの変動性を考?...
開示事項
何一つ。
謝辞
マウスの世話をしてくれた動物研究施設(OLAR)と、がんセンター支援助成金(P30CA046934)が支援するフローサイトメトリー共有リソースの両方に、私たちのすべての仕事に多大な支援をしてくださったことに感謝します。また、ゲイル・エックハルトとアンナ・カパソの両氏が、HIS-BRGSモデルでヒトPDXに対する免疫療法を研究する最初の共同研究を行ったことに感謝しています。この研究は、米国国立衛生研究所のP30CA06934がんセンター支援助成金によって、PHISM(前臨床ヒト免疫系マウスモデル)共有リソースRRID:SCR_021990およびフローサイトメトリー共有リソース(RRID:SCR_022035)を使用して部分的にサポートされました。この研究の一部は、契約番号75N93020C00058の下で国立衛生研究所のNIAIDによってサポートされました。
資料
| Name | Company | Catalog Number | Comments |
| 1 mL syringe w/needles | McKesson | 1031815 | |
| 15 mL tubes | Grenier Bio-One | 188271 | |
| 2-mercaptoethanol | Sigma | M6250 | |
| 50 mL tubes | Grenier Bio-One | 227261 | |
| AutoMACS Pro Separator | Miltenyi | 130-092-545 | |
| BD Golgi Stop Protein Transport Inhibitor with monensin | BD Bioscience | BDB563792 | |
| BSA | Fisher Scientific | BP1600100 | |
| Cell Stim Cocktail | Life Technologies | 509305 | |
| Chill 15 Rack | Miltenyi | 130-092-952 | |
| Cotton-plugged glass pipettes | Fisher Scientific | 13-678-8B | |
| Cultrex Basement membrane extract | R&D Systems | 363200502 | |
| Cytek Aurora | Cytek | ||
| DNase | Sigma | 9003-98-9 | |
| eBioscience FoxP3/Transcription Factor Staining Buffer Set | Invitrogen | 00-5523-00 | |
| Embryonic Stemcell FCS | Gibco | 10439001 | |
| Eppendorf Tubes; 1.5 mL volume | Grenier Bio-One | 616201 | |
| Excel | Microsoft | ||
| FBS | Benchmark | 100-106 500mL | |
| Ficoll Hypaque | GE Healthcare | 45001752 | |
| FlowJo Software | BD Biosciences | ||
| Forceps - fine | Roboz Surgical | RS5045 | |
| Forceps normal | Dumont | RS4919 | |
| Formaldehyde | Fisher | F75P1GAL | |
| Frosted Glass Slides | Corning | 1255310 | |
| Gentlemacs C-Tubes | Miltenyi | 130-096-334 | |
| GentleMACS Dissociator | Miltenyi | 130-093-235 | |
| glass pipettes | DWK Life Sciences | 63A53 | |
| Glutamax | Gibco | 11140050 | |
| HBSS w/ Ca & Mg | Sigma | 55037C | |
| HEPES | Corning | MT25060CI | |
| IgG standard | Sigma | I2511 | |
| IgM standard | Sigma | 401108 | |
| IMDM | Gibco | 12440053 | |
| Liberase DL | Roche | 5466202001 | |
| LIVE/DEAD Fixable Blue | Thermo | L23105 | |
| MDA-MB-231 | ATCC | HTB-26 | |
| MEM | Gibco | 1140050 | |
| mouse anti-human IgG-AP | Southern Biotech | JDC-10 | |
| mouse anti-human IgG-unabeled | Southern Biotech | H2 | |
| mouse anti-human IgM-AP | Southern Biotech | UHB | |
| mouse anti-human IgM-unlabeled | Southern Biotech | SA-DA4 | |
| MultiRad 350 | Precision X-Ray | ||
| PBS | Corning | 45000-446 | |
| Pen Strep | Gibco | 15140122 | |
| Petri Dishes | Fisher Scientific | FB0875713A | |
| p-nitrophenyl substrate | Thermo | 34045 | |
| PRISM | Graphpad | ||
| Rec Hu FLT3L | R&D systems | 308-FK-005/CF | |
| Rec Hu IL6 | R&D systems | 206-IL-010/CF | |
| Rec Hu SCF | R&D systems | 255SC010 | |
| RPMI 1640 | Corning | 45000-39 | |
| Saponin | Sigma | 8047-15-2 | |
| Scissors | McKesson | 862945 | |
| Serological pipettes 25 mL | Fisher Scientific | 1367811 | |
| Sterile filter | Nalgene | 567-0020 | |
| Sterile molecular water | Sigma | 7732-18-5 | |
| Yeti Cell Analyzer | Bio-Rad | 12004279 | |
| Zombie Green | biolegend | 423112 |
参考文献
- Chulpanova, D. S., Kitaeva, K. V., Rutland, C. S., Rizvanov, A. A., Solovyeva, V. V. Mouse tumor models for advanced cancer immunotherapy. International Journal of Molecular Sciences. 21 (11), 4118 (2020).
- Olson, B., Li, Y., Lin, Y., Liu, E. T., Patnaik, A. Mouse models for cancer immunotherapy research. Cancer Discovery. 8 (11), 1358-1365 (2018).
- Marin-Jimenez, J. A., et al. Testing cancer immunotherapy in a human immune system mouse model: correlating treatment responses to human chimerism, therapeutic variables and immune cell phenotypes. Frontiers in Immunology. 12, 607282 (2021).
- Yin, L., Wang, X. J., Chen, D. X., Liu, X. N., Wang, X. J. Humanized mouse model: a review on preclinical applications for cancer immunotherapy. American Journal of Cancer Research. 10 (12), 4568-4584 (2020).
- Cogels, M. M., et al. Humanized mice as a valuable pre-clinical model for cancer immunotherapy research. Frontiers in Oncology. 11, 784947 (2021).
- Jin, K. T., et al. Development of humanized mouse with patient-derived xenografts for cancer immunotherapy studies: A comprehensive review. Cancer Science. 112 (7), 2592-2606 (2021).
- Capasso, A., et al. Characterization of immune responses to anti-PD-1 mono and combination immunotherapy in hematopoietic humanized mice implanted with tumor xenografts. Journal for Immunotherapy of Cancer. 7 (1), 37 (2019).
- Wang, M., et al. Humanized mice in studying efficacy and mechanisms of PD-1-targeted cancer immunotherapy. The FASEB Journal. 32 (3), 1537-1549 (2018).
- Yong, K. S. M., et al. Humanized mouse as a tool to predict immunotoxicity of human biologics. Frontiers in Immunology. 11, 553362 (2020).
- Shen, H. W., Jiang, X. L., Gonzalez, F. J., Yu, A. M. Humanized transgenic mouse models for drug metabolism and pharmacokinetic research. Current Drug Metabolism. 12 (10), 997-1006 (2011).
- Bosma, G. C., Custer, R. P., Bosma, M. J. A severe combined immunodeficiency mutation in the mouse. Nature. 301 (5900), 527-530 (1983).
- Shultz, L. D., et al. Multiple defects in innate and adaptive immunologic function in NOD/LtSz-scid mice. The Journal of Immunology. 154 (1), 180-191 (1995).
- Legrand, N., et al. Functional CD47/signal regulatory protein alpha (SIRP(alpha)) interaction is required for optimal human T- and natural killer- (NK) cell homeostasis in vivo. Proceedings of the National Academy of Sciences. 108 (32), 13224-13229 (2011).
- Ishikawa, F., et al. Development of functional human blood and immune systems in NOD/SCID/IL2 receptor {gamma} chain(null) mice. Blood. 106 (5), 1565-1573 (2005).
- Ito, M., et al. NOD/SCID/gamma(c)(null) mouse: an excellent recipient mouse model for engraftment of human cells. Blood. 100 (9), 3175-3182 (2002).
- Shultz, L. D., et al. Human lymphoid and myeloid cell development in NOD/LtSz-scid IL2R gamma null mice engrafted with mobilized human hemopoietic stem cells. The Journal of Immunology. 174 (10), 6477-6489 (2005).
- Traggiai, E., et al. Development of a human adaptive immune system in cord blood cell-transplanted mice. Science. 304 (5667), 104-107 (2004).
- Theocharides, A. P., Rongvaux, A., Fritsch, K., Flavell, R. A., Manz, M. G. Humanized hemato-lymphoid system mice. Haematologica. 101 (1), 5-19 (2016).
- Goldman, J. P., et al. Enhanced human cell engraftment in mice deficient in RAG2 and the common cytokine receptor gamma chain. British Journal of Haematology. 103 (2), 335-342 (1998).
- Stripecke, R., et al. Innovations, challenges, and minimal information for standardization of humanized mice. EMBO Molecular Medicine. 12 (7), (2020).
- Allen, T. M., et al. Humanized immune system mouse models: progress, challenges and opportunities. Nature Immunology. 20 (7), 770-774 (2019).
- Gammelgaard, O. L., Terp, M. G., Preiss, B., Ditzel, H. J. Human cancer evolution in the context of a human immune system in mice. Molecular Oncology. 12 (10), 1797-1810 (2018).
- Rios-Doria, J., Stevens, C., Maddage, C., Lasky, K., Koblish, H. K. Characterization of human cancer xenografts in humanized mice. Journal for Immunotherapy of Cancer. 8 (1), 000416 (2020).
- Gombash Lampe, S. E., Kaspar, B. K., Foust, K. D. Intravenous injections in neonatal mice. Journal of Visualized Experiments. (93), e52037 (2014).
- Lang, J., Weiss, N., Freed, B. M., Torres, R. M., Pelanda, R. Generation of hematopoietic humanized mice in the newborn BALB/c-Rag2null Il2rγnull mouse model: a multivariable optimization approach. Clinical Immunology. 140 (1), 102-116 (2011).
- Laskowski, T. J., Hazen, A. L., Collazo, R. S., Haviland, D. Rigor and reproducibility of cytometry practices for immuno-oncology: a multifaceted challenge. Cytometry Part A. 97 (2), 116-125 (2020).
- Bagby, S., et al. Development and maintenance of a preclinical patient derived tumor xenograft model for the investigation of novel anti-cancer therapies. Journal of Visualized Experiments. (115), e54393 (2016).
- Laajala, T. D., et al. Optimized design and analysis of preclinical intervention studies in vivo. Scientific Reports. 6, 30723 (2016).
- Na, Y. S., et al. Establishment of patient-derived xenografts from patients with gastrointestinal stromal tumors: analysis of clinicopathological characteristics related to engraftment success. Scientific Reports. 10 (1), 7996 (2020).
- Tentler, J. J., et al. RX-5902, a novel beta-catenin modulator, potentiates the efficacy of immune checkpoint inhibitors in preclinical models of triple-negative breast cancer. BMC Cancer. 20 (1), 1063 (2020).
- Lang, J., et al. Development of an adrenocortical cancer humanized mouse model to characterize anti-PD1 effects on tumor microenvironment. The Journal of Clinical Endocrinology & Metabolism. 105 (1), 26-42 (2020).
- Lang, J., et al. Studies of lymphocyte reconstitution in a humanized mouse model reveal a requirement of T cells for human B cell maturation. The Journal of Immunology. 190 (5), 2090-2101 (2013).
- Katano, I., et al. NOD-Rag2null IL-2Rγnull mice: an alternative to NOG mice for generation of humanized mice. Experimental Animalas. 63 (3), 321-330 (2014).
- Brehm, M. A., et al. Parameters for establishing humanized mouse models to study human immunity: analysis of human hematopoietic stem cell engraftment in three immunodeficient strains of mice bearing the IL2rγ(null) mutation. Clinical Immunology. 135 (1), 84-98 (2010).
- Hasgur, S., Aryee, K. E., Shultz, L. D., Greiner, D. L., Brehm, M. A. Generation of immunodeficient mice bearing human immune systems by the engraftment of hematopoietic stem cells. Methods in Molecular Biology. 1438, 67-78 (2016).
- Andre, M. C., et al. Long-term human CD34+ stem cell-engrafted nonobese diabetic/SCID/IL-2Rγnull mice show impaired CD8+ T cell maintenance and a functional arrest of immature NK cells. The Journal of Immunology. 185 (5), 2710-2720 (2010).
- Wunderlich, M., et al. Improved multilineage human hematopoietic reconstitution and function in NSGS mice. PLoS One. 13 (12), 0209034 (2018).
- Lee, J., Brehm, M. A., Greiner, D., Shultz, L. D., Kornfeld, H. Engrafted human cells generate adaptive immune responses to Mycobacterium bovis BCG infection in humanized mice. BMC Immunology. 14, 53 (2013).
- Masse-Ranson, G., et al. Accelerated thymopoiesis and improved T-cell responses in HLA-A2/-DR2 transgenic BRGS-based human immune system mice. European Journal of Immunology. 49 (6), 954-965 (2019).
- Oswald, E., et al. Immune cell infiltration pattern in non-small cell lung cancer PDX models is a model immanent feature and correlates with a distinct molecular and phenotypic make-up. Journal for Immunotherapy of Cancer. 10 (4), 004412 (2022).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved