É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Testando imunoterápicos contra o câncer em um modelo humanizado de camundongo com tumores humanos
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Este protocolo descreve a geração de camundongos do sistema imunológico humano (HIS) para estudos de imuno-oncologia. Instruções e considerações sobre o uso deste modelo para testes de imunoterápicos humanos em tumores humanos implantados neste modelo são apresentadas com ênfase na caracterização da resposta do sistema imune humano ao tumor.
Resumo
A reversão da natureza imunossupressora do microambiente tumoral é crítica para o sucesso do tratamento de cânceres com drogas imunoterápicas. Os modelos de câncer murino são extremamente limitados em sua diversidade e sofrem de má tradução para a clínica. Para servir como um modelo pré-clínico mais fisiológico para estudos de imunoterapia, este protocolo foi desenvolvido para avaliar o tratamento de tumores humanos em um camundongo reconstituído com um sistema imunológico humano. Este protocolo único demonstra o desenvolvimento de camundongos do sistema imunológico humano (HIS, "humanizados"), seguido pela implantação de um tumor humano, seja um xenoenxerto derivado de linhagem celular (CDX) ou um xenoenxerto derivado de paciente (PDX). Os camundongos HIS são gerados pela injeção de células-tronco hematopoéticas humanas CD34+ isoladas do sangue do cordão umbilical em camundongos neonatais BRGS (BALB/c Rag2-/- IL2RγC-/- NODSIRPα) altamente imunodeficientes que também são capazes de aceitar um tumor xenogênico. Enfatiza-se a importância da cinética e das características do desenvolvimento do sistema imune humano e da implantação tumoral. Finalmente, uma avaliação aprofundada do microambiente tumoral usando citometria de fluxo é descrita. Em numerosos estudos utilizando este protocolo, verificou-se que o microambiente tumoral de tumores individuais é recapitulado em camundongos HIS-PDX; Tumores "quentes" exibem grande infiltração imunológica, enquanto tumores "frios" não. Este modelo serve como um campo de testes para imunoterapias combinadas para uma ampla gama de tumores humanos e representa uma ferramenta importante na busca por medicina personalizada.
Introdução
Modelos de câncer em camundongos são importantes para estabelecer mecanismos básicos de crescimento tumoral e escape imunológico. No entanto, estudos de tratamento de câncer em modelos murinos têm produzido tradução finita para a clínica devido a modelos singênicos limitados e diferenças espécie-específicas 1,2. O surgimento das imunoterapias como abordagem dominante para o controle de tumores tem reiterado a necessidade de um modelo in vivo com sistema imune humano funcional. Os avanços em camundongos do sistema imunológico humano (camundongos HIS) na última década tornaram possível o estudo da imuno-oncologia in vivo em uma ampla variedade de tipos de câncer e agentes imunoterápicos3,4,5,6. Modelos tumorais humanos, incluindo xenoenxertos derivados de linhagem celular e derivados de pacientes (CDX e PDX, respectivamente), crescem bem em camundongos HIS e, na maioria dos casos, são quase idênticos ao seu crescimento no hospedeiro imunodeficiente sem enxerto hematopoiético humano 7,8. Com base nesta descoberta chave, os pesquisadores têm usado o modelo do rato HIS para estudar imunoterapias humanas, incluindo terapias combinadas projetadas para alterar o microambiente tumoral (TME) para diminuir a imunossupressão e, assim, aumentar a morte do tumor imune-dirigido. Esses modelos pré-clínicos ajudam a abordar as questões de heterogeneidade dos cânceres humanos e também podem prever o sucesso do tratamento, bem como monitorar as toxicidades de drogas relacionadas à imunidade 9,10.
A produção de um modelo de camundongo com sistema imune humano através da introdução de células-tronco hematopoéticas humanas requer um camundongo receptor imunodeficiente que não rejeite o xenoenxerto. Os modelos atuais de camundongos HIS são derivados de cepas de camundongos imunodeficientes que foram relatadas há mais de 30 anos. A primeira linhagem imunodeficiente de camundongo descrita foi a de camundongos SCID que não possuíam células T e B11, seguida por um híbrido NOD-SCID com polimorfismo SIRPα responsável pela tolerância de macrófagos de camundongos a células humanas, devido à maior ligação do alelo NOD SIRPα à molécula CD47 humana12,13. No início dos anos 2000, a deleção da cadeia gama comum do receptor de IL-2 (IL-2Rγc) em cepas imunodeficientes de BALB/c e NOD foi um divisor de águas para o aumento do enxerto humano, devido às deleções genéticas que proibiam o desenvolvimento de células NK hospedeiras14,15,16,17. Modelos alternativos, como camundongos BRG e NRG, alcançam a deficiência de células T e B por meio da deleção do gene Rag1 ou Rag2, necessários para rearranjos gênicos de receptores de células T e B e, consequentemente, maturação e sobrevivência dos linfócitos18,19. O camundongo BRGS (BALB/c -Rag2 nullIl2RγCnullSirpα NOD) aqui utilizado combina a deficiência da cadeia IL-2Rγ e o aleloNOD SIRPα no fundo Rag2-/-, resultando em um camundongo altamente imunodeficiente sem células T, B ou NK, mas com vigor e saúde suficientes para permitir enxertia de longo prazo de mais de 30 semanas13.
Camundongos HIS podem ser gerados de múltiplas maneiras, sendo a injeção humana de CMSP o método mais direto15,18,20. No entanto, esses camundongos têm uma expansão pronunciada de células T humanas ativadas que resulta em doença do enxerto contra o hospedeiro (DECH) até 12 semanas de idade, impedindo estudos de longo prazo. Alternativamente, células-tronco hematopoéticas humanas do sangue do cordão umbilical (CB), medula óssea e fígado fetal também podem ser usadas para enxerto e produção do sistema imunológico humano de novo. Nesse sistema, as células-tronco hematopoéticas produzem um sistema imunológico humano de várias linhagens com a geração de células T, B e imunes inatas que são significativamente tolerantes ao hospedeiro de camundongos, em comparação com os camundongos PBMC que desenvolvem principalmente células T. Portanto, a DECH está ausente ou muito atrasada, e os estudos podem ser estendidos a camundongos até 10 meses de idade. A CB fornece uma fonte fácil, acessível e não invasiva de células-tronco hematopoéticas humanas CD34+ que facilita o enxerto de múltiplos camundongos HIS com sistemas imunológicos geneticamente idênticos 17,18,20,21. Nos últimos anos, modelos de camundongos HIS têm sido amplamente utilizados para estudar a imunoterapia e a ETM3,4,5,6. Apesar do desenvolvimento de sistemas imunes derivados de humanos nesses camundongos, os tumores de xenoenxertos humanos crescem em taxas semelhantes aos camundongos imunodeficientes controle e permitem a complexa interação entre as células cancerosas e as células imunes, o que é importante para a manutenção do microambiente da PDX enxertada3,7,8 . Este protocolo foi utilizado para realizar mais de 50 estudos testando tratamentos em camundongos HIS-BRGS com PDXs e CDXs. Uma conclusão importante é que os tumores humanos em camundongos HIS mantêm sua ETM única, definida pela avaliação molecular do tumor em relação à amostra inicial do paciente e características do infiltrado imune3,22,23. Nosso grupo se concentra na avaliação aprofundada do SIH em ambos os órgãos imunes e no tumor usando citometria de fluxo multiparâmetro. Neste trabalho, descrevemos um protocolo para humanização de camundongos BRGS, avaliação de quimerismo, implantação de tumores humanos, medidas de crescimento tumoral, administração de tratamento de câncer e análise de células HIS por citometria de fluxo.
Protocolo
Todo o trabalho com animais foi realizado sob protocolos animais aprovados pelo Comitê Institucional de Cuidados e Uso de Animais da Universidade do Colorado Denver (Protocolos IACUC #00593 e #00021). Todo o trabalho com animais foi realizado de acordo com o Office of Laboratory Animal Resources (OLAR), uma instalação credenciada pela American Association for Laboratory Animal Care, na University of Colorado Denver Anschutz Medical Campus. Todas as amostras de sangue do cordão umbilical humano foram obtidas como doações de doadores não identificados e, portanto, não estão sujeitas à aprovação do comitê de ética em pesquisa com seres humanos.
NOTA: Composições de todas as mídias e soluções mencionadas no protocolo estão incluídas no Arquivo Suplementar 1. A Figura 1 ilustra o protocolo geral para geração e análise de respostas imunes a tumores em camundongos HIS-BRGS.
1. Geração de ratos HIS
- Criação de camundongos BALB/c -Rag2 null Il2RγCnull SirpαNOD (BRGS)
NOTA: Esta estirpe é extremamente imunodeficiente, sem células T, B ou NK. Portanto, medidas rigorosas devem ser utilizadas para prevenir infecções oportunistas. Manter a colônia em uma dieta contendo trimetoprim e sulfadiazina em um esquema alternado de 2 semanas com uma dieta normal. Mantenha o mais alto nível de precaução possível (por exemplo, uma instalação de chuveiro com barreira com acesso limitado).- Manter colônias de BALB/c -Rag2 null Il2RγC null Sirpα NOD (BRGS) e BALB/c Rag2 null Il2RγC null SirpaBalb/c (BRG) homozygots camundongos como reprodutores.
- Raça BRGS N/N×BRG B/B para gerar filhotes de BRGSB/N, para serem utilizados como receptores de células-tronco humanas. Nesta colônia, os BRGSB/N são mais saudáveis que os BRGS N/N, e enxertam em níveis equivalentes (mais que BRG).
- Isolamento de células-tronco humanas CD34+ de CB umbilical
NOTA: Nenhum antibiótico é usado para este procedimento. Portanto, uma boa técnica estéril é imprescindível.- Coloque um rack de tubo cônico de 50 mL, bem como tubos cônicos de 3x 15 mL e ~10 x 50 mL em um gabinete de biossegurança esterilizado (BSC). Borrifar uma bolsa coletora de sangue com etanol 70% e deixar secar no BSC.
- Calcular o número de tubos cônicos de 50 mL necessários para o isolamento do gradiente de densidade CB = volume CB/15, arredondado para cima e para um número par de tubos. Calcular volume sanguíneo por tubo = volume CB/número de tubos. Despeje o sangue cuidadosamente da bolsa CB em cada tubo cônico; isto é um máximo de 15 mL por tubo. Use um pipetador automático e uma pipeta sorológica de 25 mL para misturar o sangue 1:1 com PBS estéril pipetando para cima e para baixo.
- Use um pipetador automático em baixa velocidade e uma pipeta sorológica de 10 mL para cobrir lentamente o sangue com solução de gradiente de densidade à temperatura ambiente (RT) 1,077 g/mL (ver Tabela de Materiais) sem perturbar a interface. Evite que a ponta da pipeta toque no fundo do tubo. Repita para todos os tubos. Em seguida, centrifugar por 30 min a 850 x g, sem frenagem, em RT para garantir a manutenção do gradiente de densidade.
- Visualize o buffy coat celular no topo do gradiente de densidade de 1,077 g/mL como uma camada branca turva. Remover e descartar a camada de plasma até cerca de 10 mL acima do buffy coat usando uma pipeta sorológica de 25 mL e um pipetador automático.
- Recolher o buffy coat com uma transferência estéril ou pipeta sorológica. Use a pipeta como uma espátula para raspar as células do lado do tubo cônico enquanto libera o bulbo (ou pipetando lentamente) para puxar as células para cima. Combinar os casacos buffy de dois tubos cônicos de 50 mL em um novo tubo cônico de 50 mL.
- Lave as células despejando 45 mL de HBSS estéril contendo 2% de SFB em cada tubo cônico. Centrifugar por 11 min a 360 x g em RT.
- Aspirar o meio de lavagem até o pellet em todos os tubos. Utilizar pipeta sorológica de 10 mL e pipetador automático para ressuspender o primeiro pellet em 10 mL de HBSS contendo SFB a 2%. Ressuspender cada pastilha nos mesmos 10 mL de HBSS e enxaguar cada tubo com mais 10 mL de HBSS para coletar todas as células em um único tubo.
- Despeje 45 mL de HBSS estéril contendo SFB a 2% no tubo cônico. Centrifugar durante 10 min a 360 x g, a 4 °C.
- Aspirar o tampão de lavagem até ao pellet de células e voltar a suspendê-lo em 20 ml de tampão separador de células magnéticas (ver Tabela de Materiais). Remova uma pequena alíquota para contar as células com um hemacitômetro na diluição de 1:20 em azul de metileno. Adicione o número de células azuis e brancas. Centrifugar a 360 x g, durante 10 min a 4 °C.
NOTA: Este protocolo utiliza a tecnologia de esferas magnéticas (consulte a Tabela de Materiais). O protocolo pode ser modificado para uso com qualquer tecnologia de separação celular, com pureza e rendimento suficientes das células-tronco CD34+. - Aspirar o sobrenadante e ressuspender a pastilha de células CD34+ isoladas do sangue do cordão umbilical em 300 μL de tampão separador magnético de células por 1 x 108 células. Adicionar primeiro 100 μL de reagente bloqueador de FcR e, em seguida, 100 μL de esferas magnéticas CD34+ por 1 x 108 células. Incubar a 4 °C durante 30 min (sem gelo).
- Adicionar 5 ml de tampão separador de células magnéticas por 1 x 108 células e girar a 360 x g durante 10 minutos a 4 °C. Repetir a etapa de lavagem e ressuspender o pellet em 500 μL de tampão separador magnético de células por 1 x 108 células em um tubo cônico de 15 mL rotulado como "não fracionado".
- Rotular mais dois tubos cônicos de 15 mL "CD34-" e "CD34+". Coloque os três tubos cônicos de 15 mL (não fracionados, CD34 e CD34+) nos slots A1, B1 e C1, respectivamente, em um rack de resfriamento (consulte a Tabela de Materiais). Separe as células usando o programa de seleção positiva de duas colunas em um separador automático de células magnéticas (ver Tabela de Materiais) em um BSC, de acordo com as instruções do instrumento do fabricante.
- Expansão e congelamento de células-tronco humanas CD34+
- Alíquota 10 μL da suspensão de células CD34+ recuperadas (2 mL) em lâmina de hemocitômetro e contagem das células em aumento de 10x. Calcule o número total de células CD34+ multiplicando a contagem de células por 2 x 104. Divida o número total de células CD34+ por 250.000 para calcular o número de frascos para congelar (50.000 células por filhote de camundongo antes da expansão in vitro ).
- Preparar o FCS de 10% do meio CB Iscove (mais 1 mL extra para perda de filtragem), suplementado com 40 ng/mL de fator de células-tronco, 20 ng/mL de Flt3L e 10 ng/mL de IL-6, e passar por um filtro de 0,22 μm. Ressuspender as células CD34+ a 100.000 por mL de meio CB e incubar a 37 °C. No dia 3, adicionar um volume equivalente de meio CB sem citocinas ao frasco contendo as células e ao meio CB com citocinas.
NOTA: A adição dessas citocinas ao meio CB promove a sobrevivência e a expansão das células CD34+, impedindo a diferenciação. - Colher as células CD34+ expandidas no dia 5. Pipetar a suspensão celular para cima e para baixo e coletar em um tubo cônico de 50 mL. Adicionar um meio CB suficiente para cobrir o fundo do balão. Usando um raspador de células, raspe todo o fundo do frasco. Recolher todos os meios no mesmo tubo de 50 ml e centrifugar a 360 x g durante 11 minutos.
- Ressuspender as células em 2 mL de meio CB. Guarde a gota final da pipeta em uma placa de 96 poços para contagem. Diluir as células 1:1 em azul de tripano e adicionar 10 μL ao hemacômetro, em seguida, contar e fazer a média das células de quatro quadrantes. Calcule o número total de células CD34+ multiplicando a contagem de células por 4 x 104 e registre a viabilidade.
- Completar n+1 ml de meio de congelação, em que n é o número de frascos para injetáveis de congelação calculado no passo 1.3.1. Prepare o meio de congelamento adicionando 10% (v/v) de DMSO ao FBS e mantenha no gelo. Rotule os criósculos com CB#, CD34+ d5 e data.
- Gire as células CD34+ a 360 x g durante 10 minutos a 4 °C. Aspirar o meio até o pellet e ressuspender o pellet celular em meio de congelamento. Alíquota 1 ml de suspensão celular para cada frasco para injetáveis e divida o restante uniformemente entre os frascos para injetáveis. Adicione os frascos para injetáveis a um congelador de células de isopropanol refrigerado a 4 °C, coloque a -80 °C e transfira para azoto líquido para armazenar durante >90 dias.
- Irradiação de filhotes de camundongos
- Coletar os filhotes BRGSB/N , 1-3 dias após o nascimento, em uma caixa plástica autoclavada com estofamento. Adicione uma pequena quantidade de roupa de cama com os filhotes. Rotule a caixa com o número da gaiola e o número de filhotes.
- Instalar o irradiador (ver Tabela de Materiais) para uma dose de 300 rad. Coloque a caixa de filhotes no irradiador e exponha a 300 rad. Leve os filhotes de volta para a gaiola, coloque-os em uma pilha e cubra com roupa de cama.
- Injeções de filhotes e preparação de células CD34+
- Comece a preparação de células CD34+ ~3 h após a irradiação. Aquecer 10 mL de CB em um tubo cônico de 50 mL. Execute todas as etapas em um BSC estéril.
- Recupere um frasco de células CD34+ expandidas e congeladas in vitro para cada quatro a seis filhotes a injetar. Descongelar rapidamente a 55 °C, até que apenas uma pequena quantidade de gelo seja visível, e adicionar as células ao meio CB aquecido (o frasco para injetáveis ainda deve estar fresco ao toque). Utilizar 1 ml de meio para enxaguar cada frasco para injetáveis e girar as células a 360 x g durante 12 minutos a 4 °C.
NOTA: O descongelamento rápido a 55 °C produziu melhor viabilidade celular (90%-95%) do que o descongelamento a 37 °C. - Aspirar o meio cuidadosamente. Ressuspenda o pellet (pequeno) em 2 mL de meio CB, misture suavemente e adicione ~30 μL da suspensão celular a um único poço em uma placa de contagem. Diluir 1:1 em azul de tripano, adicionar 10 μL a um hemocitômetro e contar e fazer a média das células de quatro quadrantes.
- Calcule o número total de células CD34+ multiplicando a contagem de células por 4 x 104 e, em seguida, registre a viabilidade. Gire a 360 x g por 12 min a 4 °C.
- Aspirar o meio cuidadosamente e ressuspender o pellet celular em 100 μL de PBS estéril por n+1 filhotes a injetar, resultando em 250.000-450.000 células CD34+ por camundongo. Coloque o tubo cônico sobre gelo em um recipiente de transporte e viaje até o biotério para injeção do filhote.
- Levar uma lâmpada de calor, fraldas, seringa de 1 mL, agulha 18 G, agulha 30 G e a preparação de células CD34+ em recipientes estéreis para o biotério BSC. Coloque uma fralda estéril ~2 pés embaixo da lâmpada de calor. Retirar a gaiola com a cama a ser injetada e colocar no BSC.
- Monte a seringa com uma agulha chanfrada de 18 G. Combinando o ângulo do tubo cônico com o bisel da agulha, misture suavemente e desenhe a suspensão celular. Coloque os filhotes na fralda para aquecer (cuidado com o superaquecimento). Retire o ar da seringa e substitua a agulha de 18 G pela agulha de 30 G e, em seguida, empurre cuidadosamente a seringa até que a suspensão celular esteja apenas na ponta da agulha.
NOTA: Alternativamente, uma seringa de insulina pode ser usada. - Leve um filhote de cada vez para a borda da fralda longe da lâmpada de calor. Imobilize o filhote de lado sob o polegar e indicador, permitindo uma visão clara do rosto. Observe a veia em toda a bochecha sob onde a orelha estará. Insira a agulha superficialmente na veia (IV) mais próxima do olho e injete lentamente 50 μL de células.
- Verifique se uma bolha está se formando a partir de uma injeção subcutânea. Em caso afirmativo, insira a agulha mais profundamente e proceda à injeção de células. Uma pequena gota de sangue/hematoma será visível quando bem sucedida.
OBS: Consulte o procedimento de Gombash Lampe et al.24 referente à injeção em filhotes. - Com o filhote ainda imobilizado, realizar uma injeção intra-hepática (IH) com mais 50 μL de células (100 μL total por filhote de IV+IH). O fígado pode ser visualizado como uma mancha escura entre a faixa branca de leite e a caixa torácica. Coloque o filhote injetado em uma fralda mais afastada dos filhotes não injetados e aqueça.
NOTA: A injeção IV resulta em melhor quimerismo a longo prazo do que a injeção de IH isoladamente25, mas as injeções IV nem sempre são bem-sucedidas. Portanto, dividir a injeção entre IV e IH garante o enxerto em uma porcentagem maior de camundongos. - Repita as injeções de veia facial e IH para todos os filhotes. Limpe qualquer sangue, devolva os filhotes ao ninho em sua gaiola e cubra com roupa de cama.
2. Testando o quimerismo humano no sangue
- Teste o quimerismo no sangue de camundongos HIS com 10 e 14 semanas de idade. Coletar 50 μL de sangue através da veia retro-orbital ou usando um método alternativo aprovado pela IACUC.
- Para sangramentos retro-orbitais, anestesiar camundongos com um vaporizador de isoflurano ajustado para 5 por 1-2 min e, em seguida, gire o vaporizador para 4. Desligue o vaporizador conforme necessário para permitir que os ratos permaneçam suficientemente oxigenados enquanto estão sob anestesia. Não mantenha os ratinhos sob isoflurano durante mais de 5 minutos.
- Coloque o nariz do camundongo anestesiado na fixação do cone do nariz do vaporizador de isoflurano e coloque uma gota do analgésico (solução oftálmica de HCl 0,5% proparacaína USP) no olho.
- Após 1 min, retirar a proparacaína com gaze estéril, proptose o olho e insira um tubo de hematócrito heparinizado de 75 mm retro-orbitalmente para coletar 50 μL de sangue. Ejetar o sangue em um tubo de microfuga de 1,5 mL contendo 50 μL de heparina e misturar suavemente.
- Aperte o olho fechado com gaze estéril para parar o sangramento e aplique uma gota de proparacaína. Retire o rato do isoflurano e recupere numa gaiola limpa.
- Isolamento de CMSP a partir de sangue de camundongos
- Misturar o sangue/heparina pipetando suavemente para cima e para baixo e sobrepor lentamente sobre 500 μL de gradiente de densidade de 1,077 g/mL, tomando cuidado para não perturbar a interface. Centrifugar os tubos a 1.220 x g por 20 min no RT sem freios.
- Visualize o buffy coat celular como uma camada turva sobre o gradiente de densidade de 1,077 g/mL, abaixo do plasma. Remova o maior número possível de células do buffy coat com uma pipeta de 200 μL e adicione a novos tubos de 1,5 mL contendo 750 μL de meio de colheita. Centrifugar a 360 x g por 11 min em RT.
- Aspirar o meio até 50 μL e ressuspender o pellet em 750 μL de meio de colheita. Centrifugar a 360 x g durante 10 min a 4 °C e aspirar novamente até 50 μL. As células estão prontas para serem ressuspensas na coloração superficial.
- Coloração de superfície e análise por citometria de fluxo
- Preencher a planilha do painel de coloração (Tabela 1; planilha "spectral flow bleed panel") com números de camundongos e preparar o coquetel de coloração de anticorpos adicionando todos os anticorpos fluorescentes ao tampão de coloração (Arquivo Suplementar 1). Faça um layout de placa para adicionar as amostras a uma placa de fundo em U de 96 poços. Marque os fundos dos poços usando um marcador permanente. Titular os anticorpos utilizando um procedimento padrão antes da coloração para determinar a concentração apropriada26.
- Adicione 62 μL do coquetel de manchas de superfície a cada poço da placa de fundo em U de 96 poços. Ressuspender as células nos 50 μL restantes no tubo e adicionar cada amostra ao seu poço correspondente. Incluir um poço para um controle de coloração positivo (PBMCs humanos + esplenócitos de camundongo, 1 x 106 células cada) para manchar ao lado das amostras. Misturar por pipetagem e incubar a mistura durante 15 min a 4 °C.
- Centrifugar a 680 x g durante 3 min a 4 °C. Deslize a placa para a pia para remover o sobrenadante e lave as células ressuspendendo em 150 μL de tampão de coloração pipetando suavemente ~10x. Girar e ressuspender cada poço em 150 μL de tampão corante.
- Adquira os dados de 100 μL de cada amostra em um citômetro de fluxo (consulte Tabela de Materiais) e exporte os arquivos .fcs. Importe os arquivos .fcs para o software de edição de dados de fluxo (consulte Tabela de materiais). Aplique uma porta de polígono a um gráfico FSC-A x SSC-A ao redor das células, excluindo quaisquer detritos. Selecione as células dentro do portão (consulte a Tabela 1; planilha "espectral flow bleed gating").
- Altere os eixos para (FSC-A x FSC-H) e gate as células contidas na diagonal linear excluindo os duplos que se projetam da linha. Selecione essas células e altere os eixos para (hCD45 x mCD45).
- Aplique uma porta de polígono à população hCD45+ e aplique o nome "humano". Aplique uma porta de polígono à população mCD45+ e aplique o nome "mouse". Crie uma estatística de contagem para as populações humana e de camundongos.
- Selecione a população humana e altere os eixos para (CD19 x CD3). Aplique uma porta de polígono às células CD19+ e nomeie-a como "células B". Aplique uma porta de polígono à população CD3+ e nomeie-a como "células T". Aplique uma porta de polígono à população dupla negativa e nomeie-a como "NonTB".
- Selecione a população de células T e altere os eixos para (CD8 x CD4). Aplicar uma porta poligonal às populações CD4 e CD8 positivas e nomeá-las como "CD4+" e "CD8+", respectivamente.
- Selecione a população sem TB e altere os eixos para (CD56 x mieloide). Aplique uma porta poligonal à população total CD56 positiva, incluindo os eventos duplos positivos e nomeie-a como "células NK". Aplique uma porta poligonal à população CD56 negativa e mieloide positiva e nomeie-a "mieloide".
- Crie uma tabela para as estatísticas de porcentagem e contagem de todas as populações e exporte para um software de planilha (consulte Tabela de Materiais). Calcule %hCD45 quimerismo = %hCD45/(%hCD45 + mCD45).
- Excluir camundongos HIS que tenham <20% hCD45+ (de mCD45 + hCD45) para experimentos posteriores.
NOTA: Neste estudo, PBMCs foram preparados usando uma separação de gradiente de densidade de 1,077 g/mL para uma depleção de hemácias mais limpa. Este procedimento excluiu granulócitos humanos e de camundongos da camada de CMSP. Alternativamente, a lise eritrocitária pode ser usada.
3. Injeção de tumores em camundongos
- Antes da injeção do tumor, confirme os números de células T a partir dos dados de sangramento de 14 semanas. Os tumores são injetados para estarem prontos para a colheita entre 20-26 semanas se as células T estiverem >20%, e entre 24-28 semanas se as células T estiverem <20% da população total de células imunes. Este tempo de injeção garante que os ratos têm 20-28 semanas de idade e têm um número suficiente de células T no final do estudo.
- Injeção de xenoenxertos derivados de linhagem celular (CDX)
NOTA: O procedimento é descrito usando células de adenocarcinoma de mama MDA-MB-231 (consulte a Tabela de Materiais) como exemplo.- Descongelar uma alíquota de células congeladas, lavar 1x ressuspendendo em 10 mL de DMEM suplementado com 10% FBS, 1% PenStrep e 1% aminoácidos não essenciais, e centrifugar a 360 x g por 10 min a 4 °C. Aspirar o meio e ressuspender em 10 mL de DMEM suplementado com FBS a 10%, PenStrep 1% e aminoácidos não essenciais a 1% em frasco T25 e incubar a 37 °C com CO2 a 5%.
NOTA: As linhas celulares são autenticadas por PCR para garantir o tipo de célula correto. Os sobrenadantes celulares são testados para micoplasma através de um ensaio bioquímico antes da injeção. - Passar e expandir as células durante a fase de crescimento exponencial com cerca de 80% de confluência.
- Aspirar o meio, enxaguar as células com 5-10 mL de PBS estéril (pH 7,2) e incubar com 1 mL de tripsina-EDTA a 0,25% por 1-5 min até que as células se desprendam do frasco.
- Adicionar 5 mL do mesmo DMEM e misturar pipetando para cima e para baixo. Passar todos os 6 mL de suspensão celular para um novo frasco T75 tratado com cultura de tecidos (diluição 1:3) e adicionar mais 10 mL de DMEM.
- Passar as células a cada 2-3 dias a 80% de confluência em plaqueamento dilucional 1:3 em DMEM para expandir as células.
- Colher as células com 0,25% de tripsina-EDTA durante a fase de crescimento exponencial dentro de seis passagens e lavar com PBS. Misturar PBS e extrato de membrana basal (ver Tabela de Materiais) em uma proporção de 1:1 e adicionar às células em uma concentração final de 5 x 107 células/mL.
- Anestesiar os camundongos com isoflurano conforme descrito na etapa 2.1.1. Injetar por via subcutânea 100 μL (5 x 106 células) de suspensão de células tumorais em cada flanco com uma agulha de 23 G.
- Descongelar uma alíquota de células congeladas, lavar 1x ressuspendendo em 10 mL de DMEM suplementado com 10% FBS, 1% PenStrep e 1% aminoácidos não essenciais, e centrifugar a 360 x g por 10 min a 4 °C. Aspirar o meio e ressuspender em 10 mL de DMEM suplementado com FBS a 10%, PenStrep 1% e aminoácidos não essenciais a 1% em frasco T25 e incubar a 37 °C com CO2 a 5%.
- Realizar injeção de xenoenxertos derivados do paciente (PDX) usando trocárteres. O procedimento de injeção e outras instruções de desenvolvimento e manutenção do modelo PDX estão disponíveis na literatura27.
4. Medida do crescimento tumoral
- Verifique o progresso do tumor uma vez por semana após o implante, sentindo ao longo do flanco para o crescimento do tumor. Uma vez que os tumores são palpáveis, anestesiar os camundongos com isoflurano (conforme descrito no passo 2.1.1) e raspar em cada flanco com um aparador elétrico, tomando cuidado ao redor do tumor para evitar ulcerações à medida que o tumor cresce.
NOTA: Os ratos podem ser raspados antes da injeção do tumor para evitar lesões na pele ao redor dos tumores; no entanto, a taxa de crescimento do cabelo pode obstruir as medidas do tumor. - Medir o comprimento e a largura dos tumores duas vezes por semana com paquímetro e registrar as medidas em mm. Relate as medidas do tumor como volume tumoral (mm3) usando a fórmula
 . Tome cuidado para não permitir que a carga tumoral exceda 2.000 mm 3 por tumor único ou um volume combinado de 3.000 mm3.
. Tome cuidado para não permitir que a carga tumoral exceda 2.000 mm 3 por tumor único ou um volume combinado de 3.000 mm3.
NOTA: As diretrizes para o uso de camundongos na pesquisa do câncer variam de acordo com o local. Consulte as políticas de Cuidados e Uso de Animais na instituição do pesquisador.
5. Tratamentos medicamentosos
- Alocar os camundongos HIS em grupos de tratamento equivalentes com base no quimerismo hCD45, quimerismo hCD3 e quimerismo hCD8. Quando os tumores atingirem 100 mm3 em média, inicie os tratamentos medicamentosos.
NOTA: O número de camundongos por grupo é baseado no número de camundongos HIS gerados a partir do CB. Recomenda-se um mínimo de quatro camundongos por grupo. A correspondência multigrupo não bipartida (por exemplo, no software R-vivo Manila) é útil para esse agrupamento28. - Via e frequência do medicamento
- Injetar inibidores anti-PD-1 (nivolumab, pembrolizumab) por via intraperitonial (i.p.) a 30 mg/kg 1x por semana ou 20 mg/kg 2x por semana para tratamentos únicos, ou 10-15 mg/kg 2x por semana para tratamentos combinados.
- Dosar as terapias combinadas, como terapias-alvo, quimioterapias e irradiação, de acordo com o desenho experimental. Terapias-alvo e quimioterapias podem ser administradas por gavagem oral, injeção i.p. ou alimentos.
NOTA: As doses podem ser variadas e otimizadas de acordo com os dados publicados e o modelo tumoral. Os estudos de dose são frequentemente testados em receptores imunodeficientes antes dos estudos com HIS em camundongos.
- Monitore os ratos pelo menos 3x por semana para alterações de saúde, como perda de peso, fezes soltas, postura curvada, mobilidade reduzida e perda de pelos. Alguns sintomas podem ser sinais de toxicidade de drogas ou DECH, e a dosagem de drogas pode precisar ser reduzida ou interrompida. Eutanasiar camundongos conforme necessário de acordo com as políticas de Cuidados e Uso de Animais.
6. Colheita de tecidos e tumores de camundongos ao final do estudo
- Eutanasiar os camundongos isoladamente de acordo com as diretrizes institucionais e veterinárias usando gás CO 2 comprimido com vazão de 2,75 L/min. Monitorar os camundongos mantidos em CO2 por 1 min após a morte e, em seguida, realizar o deslocamento cervical como uma forma secundária de eutanásia.
- Coleta de sangue
- Coletar sangue por punção intracardíaca. Segure o rato na posição vertical e introduza uma seringa de 1 ml com uma agulha de 25 G directamente no coração a partir de uma linha à esquerda da linha média e abaixo das costelas. Recolher o sangue numa seringa, idealmente através de uma recolha longa, e transferir para um tubo de 1,5 ml marcado.
NOTA: Inserções adicionais de agulhas podem ser realizadas para coletar sangue adicional dos cantos da cavidade pulmonar com cuidado. - Deixar o sangue a 4 °C durante 1 h e, em seguida, centrifugar o sangue numa microcentrífuga durante 6 minutos a 7.800 x g. Coletar o líquido claro (soros) acima da interface sanguínea em um segundo tubo limpo e marcado de 1,5 mL. Armazenar o soro a -20 °C para análise a jusante, como citocinas inflamatórias humanas e de camundongos ou títulos de imunoglobulinas.
- Coletar sangue por punção intracardíaca. Segure o rato na posição vertical e introduza uma seringa de 1 ml com uma agulha de 25 G directamente no coração a partir de uma linha à esquerda da linha média e abaixo das costelas. Recolher o sangue numa seringa, idealmente através de uma recolha longa, e transferir para um tubo de 1,5 ml marcado.
- Dissecção tecidual
- Após a injeção e crescimento de células tumorais nos ratos e a administração de tratamentos medicamentosos, colher os tecidos. Coloque os ratos em uma placa de dissecção de espuma, com pinos para mantê-los no lugar, e os braços e pernas estendidos em ângulos de 45°. Faça uma incisão até o meio do tronco, começando perto da pelve e estendendo-se até o queixo, tentando evitar o corte do peritônio (embora isso não seja essencial). Puxe a pele para a borda e segure no lugar com alfinetes.
- Extrair os linfonodos (LNs) usando pinças finas na seguinte ordem: inguinal, axilar, cervical, mesentérica, hiatal.
NOTA: Em camundongos HIS, os LNs são frequentemente muito pequenos, assemelhando-se a anlage, ou "inflamados" com uma aparência distinta ao contrário de um camundongo selvagem. Portanto, tecidos semelhantes a LNs são retirados de cada local. Os LNs periféricos frequentemente aparecem como "bolas" cheias de líquido, enquanto os LNs mesentéricos são mais densos. Os LNs mesentéricos são os mais óbvios e consistentes e são observados como um ou dois nós distintos mais densos, em oposição a uma corda. - Colocar os LNs em um dos lados das lâminas de vidro fosco em 8 mL de meio de colheita em uma placa de Petri. Segurando as lâminas em ângulos perpendiculares com as bordas foscas para dentro, pressione suavemente os tecidos até que o conteúdo celular seja liberado.
- Enxágue as lâminas várias vezes, separando-as e juntas para liberar a quantidade máxima de células. Recolher as células com uma pipeta de vidro de 5 polegadas e filtrá-las através de uma pipeta de 9 polegadas de algodão em um tubo cônico de 15 mL marcado.
- Extraia o baço do lado superior esquerdo do abdômen usando dois pares de pinças ou pinças e tesouras. Observe o tamanho do baço como uma estimativa do volume do meio de ressuspensão. Coletar e filtrar o baço por digestão mecânica usando lâminas de vidro fosco, como acontece com os LNs.
NOTA: Qualquer técnica para a preparação de tecidos para suspensões de célula única pode ser usada. - Realizar a contagem e ressuspensão das células das amostras de tecido conforme descrito abaixo.
- Centrifugar as células linfáticas a 360 x g durante 10 minutos a 4 °C. Aspirar o líquido e ressuspender o pellet celular em 1 mL de meio de colheita com DNase.
- Remover os eritrócitos das células do baço incubando com 3 mL de tampão de lise ACK em TR por 3 min, seguido da adição de 10 mL de meio de colheita/DNase. Centrifugar novamente as células do baço, aspirar o sobrenadante e ressuspender as células em 1-10 mL de meio de colheita/DNase, com base no tamanho do baço (por exemplo, 1 mL para baços muito pequenos e até 10 mL para baços maiores).
- Adicione uma alíquota de 10 μL de suspensão celular a 90 μL de meio e conte com um hemocitômetro. Centrifugar os LNs e as células do baço, aspirar os sobrenadantes e ressuspender as células em meio de colheita na concentração de 1 x 108 células/mL, ou no mínimo 80 μL.
- Extrair os tumores.
- Remova o tumor do flanco aberto segurando o tumor com pinças enquanto corta lentamente as margens do tumor com tesoura de dissecção.
- Uma vez removido o tumor, pesá-lo e remover 1/4 para processamento de RNA e imunohistoquímica (IHQ). Divida o tumor 1/4 ao meio; colocar metade (1/8 de todo o tumor) num criovial, congelar rapidamente em N líquido2 e armazenar a -80 °C para estudos genómicos a jusante.
- Coloque o outro 1/8 do tumor em um tubo de espécime marcado contendo formalina a 10%. No dia seguinte, enxaguar e ressuspender o tecido em etanol 70% até uso futuro. Coloque os 3/4 restantes do tumor em um prato de 6 cm e pique em pedaços de ~1 mm usando uma lâmina de bisturi.
- Transportar as peças tumorais para um tubo de dissociação (ver Tabela de Materiais), enxaguar a placa com 5 mL de meio leucocitário infiltrante tumoral incompleto (TIL) e adicionar ao tubo de dissociação.
NOTA: Para tumores com peso >0,4 g, enxaguar a placa com 10 mL de meio TIL incompleto e adicionar ao tubo de dissociação. - Adicionar a preparação de colagenase (ver Tabela de Materiais) a uma concentração final de 50 mg/ml ao tecido no tubo de dissociação. Dissociar o tecido usando dissociação mecânica a 37 °C por 30 min a 1 h, dependendo da firmeza do tumor.
- Após a dissociação, passar a suspensão sobre um filtro de 100 μm para um tubo cônico de 50 mL e enxaguar o filtro com 10 mL de meio TIL completo. O soro neste meio irá parar a reação de colagenase e proteger as células de uma maior degradação.
- Centrifugar a suspensão de célula única a 360 x g durante 10 minutos a 4 °C. Ressuspenda o pellet em meio de colheita suficiente com DNase para que a suspensão da célula possa passar facilmente por uma ponta de pipeta P1000 e registrar o volume para análise a jusante.
NOTA: Um volume menor aumenta a coleção de células imunes tumorais, mas é mais suscetível a entupimentos de citômetro de fluxo.
7. Coloração celular e análise por citometria de fluxo
- Preparação de corantes e plaqueamento celular
- Preparar coquetéis de coloração: No dia da colheita, adicionar o número de amostras à planilha de coloração (Tabela 2; "Painel de fluxo A convencional", "Painel de fluxo espectral B" e "Painel de fluxo C convencional") para todas as manchas e impressão. Prepare coquetéis de coloração de superfície para as manchas A e B em tampão de coloração (SB) adicionando cada anticorpo individualmente com uma nova ponta, marcando cada reagente em movimento, e armazene a 4 °C até que seja necessário. Preparar os corantes de viabilidade adequados em PBS isento de azida e conservar a 4 °C até ser necessário (aquecer a RT antes da utilização). Preparar coquetel de coloração C de superfície no dia 2 em SB juntamente com as colorações intracelulares B e C em seus respectivos tampões de permeabilização.
- Crie um layout de placa para todas as amostras na planilha de coloração e alíquota 100 μL de PBS livre de azida para os poços. Incluir controles não corados para cada tecido e coloração (para citometria espectral).
- Adicionar as células a placas de 96 poços contendo 50 μL de PBS. Para a coloração A, ressuspender cada grupo de tecido no volume apropriado, conforme observado na planilha de coloração, e armazenar a 4 °C até a aquisição no citômetro de fluxo no mesmo dia. Para as colorações B e C, adicionar 25 μL de linfa e 60 μL de suspensões de células de tecido não linfático aos poços com PBS.
- Realizar estimulação in vitro de citocinas para detecção por coloração intracelular utilizando corante C.
- Centrifugar a placa de 96 poços da mancha C do passo 7.1.3 a 680 x g durante 3 minutos a 4 °C. Adicionar 200 μL de meio completo TIL (RPMI 1640, 10 mM HEPES [pH 7], 10% FBS) a cada poço. Conservar a placa com a suspensão celular a 4 °C durante a noite.
- No início da manhã seguinte, diluir o coquetel de estimulação celular (ver Tabela de Materiais) 1:500 em mídia TIL completa. Centrifugar a placa que contém a suspensão celular a 680 x g para pellet as células e mexer para remover o meio. Ressuspender as células em 200 μL do coquetel de estimulação celular preparado e incubar a 37 °C por 1 h.
- Adicionar 25 μL de solução inibidora do transporte de proteínas contendo monensina numa diluição de 1:1.000 em meio TIL completo, misturar as células e incubar a 37 °C durante mais 4 h para permitir a acumulação intracelular de citocinas.
- Realizar coloração celular.
- Para as colorações A e B (Dia 1) e para a coloração C (Dia 2), centrifugar a 680 x g por 3 min a 4 °C. Agite as placas e adicione os corantes de viabilidade apropriados aos poços. Misture bem pipetando suavemente para cima e para baixo com uma pipeta multicanal e incube por 15 min no RT.
- Centrifugar as placas (como no passo 7.1.5.1), em seguida, adicionar manchas superficiais adequadas às placas e misturar suavemente pipetando com uma pipeta multicanal. Incubar durante 15 min a 4 °C e centrifugar novamente. Agite as placas, lave as células pipetando suavemente para cima e para baixo com 150 μL de SB e centrifuja.
- Agite as placas, repita a lavagem pipetando suavemente para cima e para baixo com 150 μL de SB e centrifugando a 680 x g por 3 min a 4 °C. Para a coloração A, ressuspender cada grupo de tecidos no volume apropriado, conforme indicado na planilha de coloração, e armazenar a 4 °C. Para a coloração B, corrigir com o fixador do kit de fator de transcrição FoxP3 (consulte Tabela de Materiais) por 30 min no RT. Para a coloração C, fixar paraformaldeído a 1% (v/v) em SB por 30 min no TR.
- Centrifugar as placas fixas a 480 x g durante 3 min a 4 °C. Lave 1x em SB. Para a mancha B, as células podem ser deixadas durante a noite.
- Permeabilizar as células: ressuspender os poços em 150 μL de tampão de permeabilização do kit de fator de transcrição FoxP3 para coloração B e em saponina a 0,5% (p/v) em SB para coloração C. Incubar por 15 min em RT. Centrifugar as placas fixas a 480 x g por 3 min a 4 °C.
- Agite as placas e adicione os respectivos coquetéis de coloração intracelular para manchar B e manchar C. Incubar por 30 min no RT.
- Centrifugar as placas fixas a 480 x g durante 3 min a 4 °C e agitar as placas. Lavar as células com 150 μL dos tampões de permeabilização correspondentes (corante B, tampão de permeabilização do kit de fator de transcrição FoxP3; coloração C, saponina).
- Agite as placas e lave pipetando para cima e para baixo em 150 μL de SB. Centrifugar a 480 x g por 3 min a 4 °C. Agitar as placas e ressuspender as células em SB por grupo de tecido nos volumes apropriados anotados na planilha de coloração.
NOTA: As amostras já estão prontas para aquisição por citometria de fluxo espectral. - Configure o citômetro de fluxo (ver Tabela de Materiais) com controles de coloração única apropriados para cada coloração e amostras não coradas para cada grupo de tecidos para levar em conta as diferenças na autofluorescência durante a desmistura. Adquira os volumes apropriados por grupo de tecidos, conforme definido na planilha de coloração (Tabela 2) e exporte os arquivos .fcs.
- Análise dos dados de citometria de fluxo
- Usando o software de análise de citometria de fluxo (consulte Tabela de Materiais), crie um novo espaço de trabalho. Crie novos grupos para cada órgão (LN, baço e TIL). Importe os arquivos .fcs de cada órgão para o grupo.
- Crie um gráfico de pontos bivariado, defina os eixos como (FSC-A x SSC-A) e aplique uma porta de polígono a eventos celulares, evitando eventos nas bordas (porta de todas as células). Selecione os eventos celulares, altere os eixos para (FSC-A x FSC-H) e aplique uma porta poligonal aos eventos na diagonal linear, excluindo eventos que se desviam da diagonal para gerar a porta "singlets". Selecione o portão "singlets" e altere os eixos para (hCD45 x mCD45). Aplique portas de polígono aos eventos positivos hCD45 e mCD45 e nomeie-os como "humanos" e "camundongos", respectivamente.
- Selecione a população humana e altere o eixo Y para Água Viva/Morta. Aplique uma porta de polígono à população positiva para hCD45 negativo/vivo e nomeie-a como "humana viva". Selecione a população do mouse e altere o eixo X para Aqua Vivo/Morto. Aplique uma porta de polígono à população positiva mCD45 negativa e nomeada como "rato vivo".
- De maneira semelhante, selecione a porta mãe e os eixos X e Y, conforme descrito nas planilhas "Convencional Flow A Gating", "Spectral Flow B Gating" e "Conventional Flow C Gating" (Tabela 2) para isolar as populações indicadas (por exemplo, células B humanas, células T ativadas).
NOTA: O limite representativo para cada mancha (Sangria, A, B, C) está incluído no Arquivo Suplementar 2. - Crie tabelas de contagem e exportação de frequência no software de análise de citometria de fluxo para todas as populações e exporte para um software de planilha. A população de pais para frequências está indicada na Tabela 2.
- Use os dados para gerar gráficos com base em grupos de tratamento experimentais.
NOTA: Os dados também podem ser analisados usando pacotes R no software de análise. Um único arquivo .fcs de todas as amostras a serem analisadas pode ser criado usando o recurso concatenar. Esses dados podem ser dimensionalmente reduzidos com o algoritmo T-SNE enquanto adicionamos parâmetros de palavras-chave para o tipo de tecido e o grupo de tratamento. O algoritmo FlowSOM pode então ser usado para agrupar populações e a ferramenta ClusterExplorer pode ser usada para identificar as populações. Novas populações celulares podem ser identificadas dessa maneira, comparadas visualmente e quantificadas entre grupos de tratamento ou dentro de vários tecidos. - Correlacionar parâmetros imunológicos para tumores dentro do mesmo grupo de tratamento, com o crescimento desse tumor para definir imunotipos que se correlacionam com a inibição do crescimento tumoral. Quantificar o crescimento tumoral pela taxa de crescimento específica (TCE) para aquele tumor, uma medida que leva em conta a diferença nos volumes tumorais ao longo de um tempo especificado. Esta medida normaliza tumores colhidos em dias diferentes devido à saúde do rato e datas de início do tratamento.
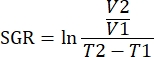
Resultados
Seguindo o protocolo tumoral do flanco e a linha do tempo experimental (Figura 1), o crescimento tumoral e a resposta imune a uma terapia direcionada com inibidor de tirosina quinase (TKI) e tratamento combinado com nivolumab foram estudados em duas PDXs distintas de câncer colorretal humano (CCR). As drogas TKI têm sido estudadas em hospedeiros imunodeficientes para avaliar o crescimento tumoral apenas29. Esse modelo possibilitou o estudo de alterações na respost...
Discussão
Nos últimos 6 anos, usando nossa experiência em imunologia e camundongos humanizados, nossa equipe de pesquisa desenvolveu um modelo pré-clínico muito necessário para testar imunoterapias em uma variedade de tumores humanos 3,7,30,31. Este protocolo enfatiza a consideração da variabilidade do modelo, com especial atenção às populações de células T humanas centradas na imunoterapia....
Divulgações
Nenhum.
Agradecimentos
Gostaríamos de agradecer tanto ao Animal Research Facility (OLAR) por seu cuidado com nossos camundongos, quanto ao Flow Cytometry Shared Resource apoiado pelo Cancer Center Support Grant (P30CA046934) em nosso instituto por sua imensa ajuda em todo o nosso trabalho. Também agradecemos a Gail Eckhardt e Anna Capasso por nossas colaborações inaugurais estudando imunoterapias para PDXs humanos em nosso modelo HIS-BRGS. Este estudo foi apoiado em parte pelo National Institutes of Health P30CA06934 Cancer Center Support Grant com o uso do PHISM (Pre-clinical Human Immune System Mouse Models) Shared Resource, RRID: SCR_021990 and Flow Cytometry Shared Resource, RRID: SCR_022035. Esta pesquisa foi apoiada em parte pelo NIAID dos Institutos Nacionais de Saúde sob o número de contrato 75N93020C00058.
Materiais
| Name | Company | Catalog Number | Comments |
| 1 mL syringe w/needles | McKesson | 1031815 | |
| 15 mL tubes | Grenier Bio-One | 188271 | |
| 2-mercaptoethanol | Sigma | M6250 | |
| 50 mL tubes | Grenier Bio-One | 227261 | |
| AutoMACS Pro Separator | Miltenyi | 130-092-545 | |
| BD Golgi Stop Protein Transport Inhibitor with monensin | BD Bioscience | BDB563792 | |
| BSA | Fisher Scientific | BP1600100 | |
| Cell Stim Cocktail | Life Technologies | 509305 | |
| Chill 15 Rack | Miltenyi | 130-092-952 | |
| Cotton-plugged glass pipettes | Fisher Scientific | 13-678-8B | |
| Cultrex Basement membrane extract | R&D Systems | 363200502 | |
| Cytek Aurora | Cytek | ||
| DNase | Sigma | 9003-98-9 | |
| eBioscience FoxP3/Transcription Factor Staining Buffer Set | Invitrogen | 00-5523-00 | |
| Embryonic Stemcell FCS | Gibco | 10439001 | |
| Eppendorf Tubes; 1.5 mL volume | Grenier Bio-One | 616201 | |
| Excel | Microsoft | ||
| FBS | Benchmark | 100-106 500mL | |
| Ficoll Hypaque | GE Healthcare | 45001752 | |
| FlowJo Software | BD Biosciences | ||
| Forceps - fine | Roboz Surgical | RS5045 | |
| Forceps normal | Dumont | RS4919 | |
| Formaldehyde | Fisher | F75P1GAL | |
| Frosted Glass Slides | Corning | 1255310 | |
| Gentlemacs C-Tubes | Miltenyi | 130-096-334 | |
| GentleMACS Dissociator | Miltenyi | 130-093-235 | |
| glass pipettes | DWK Life Sciences | 63A53 | |
| Glutamax | Gibco | 11140050 | |
| HBSS w/ Ca & Mg | Sigma | 55037C | |
| HEPES | Corning | MT25060CI | |
| IgG standard | Sigma | I2511 | |
| IgM standard | Sigma | 401108 | |
| IMDM | Gibco | 12440053 | |
| Liberase DL | Roche | 5466202001 | |
| LIVE/DEAD Fixable Blue | Thermo | L23105 | |
| MDA-MB-231 | ATCC | HTB-26 | |
| MEM | Gibco | 1140050 | |
| mouse anti-human IgG-AP | Southern Biotech | JDC-10 | |
| mouse anti-human IgG-unabeled | Southern Biotech | H2 | |
| mouse anti-human IgM-AP | Southern Biotech | UHB | |
| mouse anti-human IgM-unlabeled | Southern Biotech | SA-DA4 | |
| MultiRad 350 | Precision X-Ray | ||
| PBS | Corning | 45000-446 | |
| Pen Strep | Gibco | 15140122 | |
| Petri Dishes | Fisher Scientific | FB0875713A | |
| p-nitrophenyl substrate | Thermo | 34045 | |
| PRISM | Graphpad | ||
| Rec Hu FLT3L | R&D systems | 308-FK-005/CF | |
| Rec Hu IL6 | R&D systems | 206-IL-010/CF | |
| Rec Hu SCF | R&D systems | 255SC010 | |
| RPMI 1640 | Corning | 45000-39 | |
| Saponin | Sigma | 8047-15-2 | |
| Scissors | McKesson | 862945 | |
| Serological pipettes 25 mL | Fisher Scientific | 1367811 | |
| Sterile filter | Nalgene | 567-0020 | |
| Sterile molecular water | Sigma | 7732-18-5 | |
| Yeti Cell Analyzer | Bio-Rad | 12004279 | |
| Zombie Green | biolegend | 423112 |
Referências
- Chulpanova, D. S., Kitaeva, K. V., Rutland, C. S., Rizvanov, A. A., Solovyeva, V. V. Mouse tumor models for advanced cancer immunotherapy. International Journal of Molecular Sciences. 21 (11), 4118 (2020).
- Olson, B., Li, Y., Lin, Y., Liu, E. T., Patnaik, A. Mouse models for cancer immunotherapy research. Cancer Discovery. 8 (11), 1358-1365 (2018).
- Marin-Jimenez, J. A., et al. Testing cancer immunotherapy in a human immune system mouse model: correlating treatment responses to human chimerism, therapeutic variables and immune cell phenotypes. Frontiers in Immunology. 12, 607282 (2021).
- Yin, L., Wang, X. J., Chen, D. X., Liu, X. N., Wang, X. J. Humanized mouse model: a review on preclinical applications for cancer immunotherapy. American Journal of Cancer Research. 10 (12), 4568-4584 (2020).
- Cogels, M. M., et al. Humanized mice as a valuable pre-clinical model for cancer immunotherapy research. Frontiers in Oncology. 11, 784947 (2021).
- Jin, K. T., et al. Development of humanized mouse with patient-derived xenografts for cancer immunotherapy studies: A comprehensive review. Cancer Science. 112 (7), 2592-2606 (2021).
- Capasso, A., et al. Characterization of immune responses to anti-PD-1 mono and combination immunotherapy in hematopoietic humanized mice implanted with tumor xenografts. Journal for Immunotherapy of Cancer. 7 (1), 37 (2019).
- Wang, M., et al. Humanized mice in studying efficacy and mechanisms of PD-1-targeted cancer immunotherapy. The FASEB Journal. 32 (3), 1537-1549 (2018).
- Yong, K. S. M., et al. Humanized mouse as a tool to predict immunotoxicity of human biologics. Frontiers in Immunology. 11, 553362 (2020).
- Shen, H. W., Jiang, X. L., Gonzalez, F. J., Yu, A. M. Humanized transgenic mouse models for drug metabolism and pharmacokinetic research. Current Drug Metabolism. 12 (10), 997-1006 (2011).
- Bosma, G. C., Custer, R. P., Bosma, M. J. A severe combined immunodeficiency mutation in the mouse. Nature. 301 (5900), 527-530 (1983).
- Shultz, L. D., et al. Multiple defects in innate and adaptive immunologic function in NOD/LtSz-scid mice. The Journal of Immunology. 154 (1), 180-191 (1995).
- Legrand, N., et al. Functional CD47/signal regulatory protein alpha (SIRP(alpha)) interaction is required for optimal human T- and natural killer- (NK) cell homeostasis in vivo. Proceedings of the National Academy of Sciences. 108 (32), 13224-13229 (2011).
- Ishikawa, F., et al. Development of functional human blood and immune systems in NOD/SCID/IL2 receptor {gamma} chain(null) mice. Blood. 106 (5), 1565-1573 (2005).
- Ito, M., et al. NOD/SCID/gamma(c)(null) mouse: an excellent recipient mouse model for engraftment of human cells. Blood. 100 (9), 3175-3182 (2002).
- Shultz, L. D., et al. Human lymphoid and myeloid cell development in NOD/LtSz-scid IL2R gamma null mice engrafted with mobilized human hemopoietic stem cells. The Journal of Immunology. 174 (10), 6477-6489 (2005).
- Traggiai, E., et al. Development of a human adaptive immune system in cord blood cell-transplanted mice. Science. 304 (5667), 104-107 (2004).
- Theocharides, A. P., Rongvaux, A., Fritsch, K., Flavell, R. A., Manz, M. G. Humanized hemato-lymphoid system mice. Haematologica. 101 (1), 5-19 (2016).
- Goldman, J. P., et al. Enhanced human cell engraftment in mice deficient in RAG2 and the common cytokine receptor gamma chain. British Journal of Haematology. 103 (2), 335-342 (1998).
- Stripecke, R., et al. Innovations, challenges, and minimal information for standardization of humanized mice. EMBO Molecular Medicine. 12 (7), (2020).
- Allen, T. M., et al. Humanized immune system mouse models: progress, challenges and opportunities. Nature Immunology. 20 (7), 770-774 (2019).
- Gammelgaard, O. L., Terp, M. G., Preiss, B., Ditzel, H. J. Human cancer evolution in the context of a human immune system in mice. Molecular Oncology. 12 (10), 1797-1810 (2018).
- Rios-Doria, J., Stevens, C., Maddage, C., Lasky, K., Koblish, H. K. Characterization of human cancer xenografts in humanized mice. Journal for Immunotherapy of Cancer. 8 (1), 000416 (2020).
- Gombash Lampe, S. E., Kaspar, B. K., Foust, K. D. Intravenous injections in neonatal mice. Journal of Visualized Experiments. (93), e52037 (2014).
- Lang, J., Weiss, N., Freed, B. M., Torres, R. M., Pelanda, R. Generation of hematopoietic humanized mice in the newborn BALB/c-Rag2null Il2rγnull mouse model: a multivariable optimization approach. Clinical Immunology. 140 (1), 102-116 (2011).
- Laskowski, T. J., Hazen, A. L., Collazo, R. S., Haviland, D. Rigor and reproducibility of cytometry practices for immuno-oncology: a multifaceted challenge. Cytometry Part A. 97 (2), 116-125 (2020).
- Bagby, S., et al. Development and maintenance of a preclinical patient derived tumor xenograft model for the investigation of novel anti-cancer therapies. Journal of Visualized Experiments. (115), e54393 (2016).
- Laajala, T. D., et al. Optimized design and analysis of preclinical intervention studies in vivo. Scientific Reports. 6, 30723 (2016).
- Na, Y. S., et al. Establishment of patient-derived xenografts from patients with gastrointestinal stromal tumors: analysis of clinicopathological characteristics related to engraftment success. Scientific Reports. 10 (1), 7996 (2020).
- Tentler, J. J., et al. RX-5902, a novel beta-catenin modulator, potentiates the efficacy of immune checkpoint inhibitors in preclinical models of triple-negative breast cancer. BMC Cancer. 20 (1), 1063 (2020).
- Lang, J., et al. Development of an adrenocortical cancer humanized mouse model to characterize anti-PD1 effects on tumor microenvironment. The Journal of Clinical Endocrinology & Metabolism. 105 (1), 26-42 (2020).
- Lang, J., et al. Studies of lymphocyte reconstitution in a humanized mouse model reveal a requirement of T cells for human B cell maturation. The Journal of Immunology. 190 (5), 2090-2101 (2013).
- Katano, I., et al. NOD-Rag2null IL-2Rγnull mice: an alternative to NOG mice for generation of humanized mice. Experimental Animalas. 63 (3), 321-330 (2014).
- Brehm, M. A., et al. Parameters for establishing humanized mouse models to study human immunity: analysis of human hematopoietic stem cell engraftment in three immunodeficient strains of mice bearing the IL2rγ(null) mutation. Clinical Immunology. 135 (1), 84-98 (2010).
- Hasgur, S., Aryee, K. E., Shultz, L. D., Greiner, D. L., Brehm, M. A. Generation of immunodeficient mice bearing human immune systems by the engraftment of hematopoietic stem cells. Methods in Molecular Biology. 1438, 67-78 (2016).
- Andre, M. C., et al. Long-term human CD34+ stem cell-engrafted nonobese diabetic/SCID/IL-2Rγnull mice show impaired CD8+ T cell maintenance and a functional arrest of immature NK cells. The Journal of Immunology. 185 (5), 2710-2720 (2010).
- Wunderlich, M., et al. Improved multilineage human hematopoietic reconstitution and function in NSGS mice. PLoS One. 13 (12), 0209034 (2018).
- Lee, J., Brehm, M. A., Greiner, D., Shultz, L. D., Kornfeld, H. Engrafted human cells generate adaptive immune responses to Mycobacterium bovis BCG infection in humanized mice. BMC Immunology. 14, 53 (2013).
- Masse-Ranson, G., et al. Accelerated thymopoiesis and improved T-cell responses in HLA-A2/-DR2 transgenic BRGS-based human immune system mice. European Journal of Immunology. 49 (6), 954-965 (2019).
- Oswald, E., et al. Immune cell infiltration pattern in non-small cell lung cancer PDX models is a model immanent feature and correlates with a distinct molecular and phenotypic make-up. Journal for Immunotherapy of Cancer. 10 (4), 004412 (2022).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados