需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
在携带人类肿瘤的人源化小鼠模型中测试癌症免疫疗法
* 这些作者具有相同的贡献
Erratum Notice
摘要
该协议概述了用于免疫肿瘤学研究的人免疫系统(HIS)小鼠的产生。介绍了使用该模型在植入该模型中的人类肿瘤上测试人类免疫疗法的说明和注意事项,重点是表征人类免疫系统对肿瘤的反应。
摘要
逆转肿瘤微环境的免疫抑制性质对于用免疫治疗药物成功治疗癌症至关重要。鼠癌模型的多样性极其有限,并且无法转化为临床。为了作为免疫治疗研究的更生理学的临床前模型,已经开发了该协议来评估用人类免疫系统重组的小鼠中人类肿瘤的治疗。这种独特的方案展示了人类免疫系统(HIS,"人源化")小鼠的发展,然后植入人类肿瘤,细胞系衍生异种移植(CDX)或患者来源的异种移植(PDX)。HIS小鼠是通过将从脐带血中分离的CD34 +人造血干细胞注射到新生儿BRGS(BALB / c Rag2-/- IL2RγC-/- NODSIRPα)高度免疫缺陷的小鼠中产生的,这些小鼠也能够接受异种肿瘤。强调了人体免疫系统发育和肿瘤植入的动力学和特征的重要性。最后,描述了使用流式细胞术对肿瘤微环境的深入评估。在使用该方案的众多研究中,发现单个肿瘤的肿瘤微环境在HIS-PDX小鼠中被概括;"热"肿瘤表现出大的免疫浸润,而"冷"肿瘤则没有。该模型是针对各种人类肿瘤的联合免疫疗法的试验场,也是寻求个性化医疗的重要工具。
引言
小鼠癌症模型对于建立肿瘤生长和免疫逃逸的基本机制很重要。然而,由于有限的同系模型和物种特异性差异,小鼠模型中的癌症治疗研究已经产生了有限的临床翻译1,2。免疫疗法作为控制肿瘤的主要方法的出现重申了对具有功能性人类免疫系统的体内模型的需求。在过去的十年中,人类免疫系统小鼠(HIS小鼠)的进步使得在各种癌症类型和免疫治疗剂中研究体内免疫肿瘤学成为可能3,4,5,6。人类肿瘤模型,包括细胞系衍生和患者来源的异种移植物(分别为CDX和PDX),在HIS小鼠中生长良好,并且在大多数情况下与它们在缺乏人类造血植入的免疫缺陷宿主中的生长几乎相同7,8。基于这一关键发现,研究人员一直在使用HIS小鼠模型来研究人类免疫疗法,包括旨在改变肿瘤微环境(TME)以减少免疫抑制从而增强免疫定向肿瘤杀伤的联合疗法。这些临床前模型有助于解决人类癌症的异质性问题,还可以预测治疗成功以及监测免疫相关药物毒性9,10。
通过引入人造血干细胞来生产具有人类免疫系统的小鼠模型需要不会排斥异种移植物的受体免疫缺陷小鼠。目前的HIS小鼠模型来源于30多年前报道的免疫缺陷小鼠品系。描述的第一个免疫缺陷小鼠品系是缺乏T细胞和B细胞的SCID小鼠11,其次是具有SIRPα多态性的杂交NOD-SCID,负责小鼠巨噬细胞对人类细胞的耐受性,这是由于NOD SIRPα等位基因与人CD47分子12,13的结合增加。在 2000 年代初期,由于基因缺失禁止宿主 NK 细胞发育,ALLB/c 和 NOD 免疫缺陷菌株上 IL-2 受体 (IL-2Rγc) 的共同 γ 链缺失改变了增强人类植入的游戏规则14,15,16,17。替代模型,例如BRG和NRG小鼠,通过删除Rag1或Rag2基因来实现T细胞和B细胞细胞缺乏,这是T细胞受体基因重排所必需的,因此淋巴细胞的成熟和存活18,19。本文使用的BRGS(BALB / c -Rag2 nullIl2RγCnullSirpα NOD)小鼠结合了IL-2Rγ链缺陷和Rag2-/-背景上的NOD SIRPα等位基因,导致没有T,B或NK细胞的高度免疫缺陷小鼠,但具有足够的活力和健康以允许长期植入超过30周13。
HIS小鼠可以通过多种方式产生,人PBMC注射是最直接的方法15,18,20。然而,这些小鼠具有活化的人T细胞的显着扩增,导致移植物抗宿主病(GVHD)在12周龄时,阻止了长期研究。或者,来自脐带血(CB)、骨髓和胎儿肝脏的人造血干细胞也可用于从头植入和生产人体免疫系统。在该系统中,造血干细胞产生多谱系人类免疫系统,与主要发育T细胞的PBMC小鼠相比,T,B和先天免疫细胞的产生对小鼠宿主具有重要的耐受性。因此,GVHD 不存在或大大延迟,研究可以扩展到 10 个月大的小鼠。CB提供了一种简单,可及且无创的CD34 +人造血干细胞来源,有助于植入具有遗传相同免疫系统的多只HIS小鼠17,18,20,21。在过去的几年中,HIS小鼠模型已被广泛用于研究免疫疗法和TME3,4,5,6。尽管这些小鼠发育了人类来源的免疫系统,但与对照免疫缺陷小鼠相比,人类异种移植肿瘤的生长速度相似,并且允许癌细胞和免疫细胞之间的复杂相互作用,这对于维持移植PDX的微环境很重要3,7,8.该协议已被用于进行50多项研究,测试具有PDX和CDX的HIS-BRGS小鼠的治疗。一个重要的结论是,HIS小鼠中的人类肿瘤保持其独特的TME,这是通过相对于初始患者样本和免疫浸润特征的肿瘤的分子评估所定义的3,22,23。我们小组专注于使用多参数流式细胞术深入评估免疫器官和肿瘤中的HIS。在此,我们描述了用于BRGS小鼠人源化,嵌合体评估,人类肿瘤植入,肿瘤生长测量,癌症治疗给药以及通过流式细胞术分析HIS细胞的方案。
研究方案
所有动物工作均根据科罗拉多大学丹佛分校机构动物护理和使用委员会批准的动物协议(IACUC 协议 #00593 和 #00021)进行。所有动物工作均按照科罗拉多大学丹佛安舒茨医学院的美国实验动物护理协会认可的设施实验动物资源办公室 (OLAR) 进行。所有人类脐带血样本都是从去识别化的捐赠者那里获得的,因此无需人类研究伦理委员会的批准。
注意:协议中提到的所有介质和溶液的组成都包含在 补充文件1中。 图1 说明了在HIS-BRGS小鼠中产生和分析对肿瘤的免疫应答的总体方案。
1. HIS小鼠的产生
- BALB/c -Rag2 null Il2RγCnull SirpαNOD (BRGS) 小鼠的小鼠饲养
注意:该菌株免疫缺陷极强,没有T,B或NK细胞。因此,必须采取严格的措施来预防机会性感染。在含有甲氧苄啶和磺胺嘧啶的饮食中维持菌落,与正常饮食交替进行2周。尽可能保持最高水平的预防性住房房间(例如,通道受限的屏障淋浴设施)。- 维持BALB / c -Rag2 null Il2RγC null Sirpα NOD (BRGS)和BALB / c Rag2null Il2RγC null SirpaBalb / c(BRG)纯合小鼠的菌落作为育种者。
- 繁殖BRGS N / N×BRG B /B以产生BRGSB / N幼崽,用作人类干细胞的受体。在这个菌落中,BRGSB / N比BRGS N /N更健康,并且移植物处于同等水平(超过BRG)。
- 从脐带CB中分离出CD34+人干细胞
注意:此过程不使用抗生素。因此,良好的无菌技术势在必行。- 将 50 mL 锥形管架以及 3x 15 mL 和 ~10x 50 mL 锥形管放入无菌生物安全柜 (BSC) 中。用70%乙醇喷洒采血袋,让它在BSC中干燥。
- 计算CB密度梯度分离所需的50 mL锥形管数量= CB体积/15,四舍五入并得到偶数管数。计算每管血容量 = CB 体积/管数。将血液小心地从CB袋中倒入每个锥形管中;每管最多 15 mL。使用自动移液器和 25 mL 血清移液器,通过上下移液将血液与无菌 PBS 以 1:1 的比例混合。
- 使用低速自动移液器和 10 mL 血清移液器,用室温 (RT) 1.077 g/mL 密度梯度溶液(参见 材料表)缓慢覆盖血液,而不会干扰界面。防止移液器吸头接触管底。对所有管子重复此操作。然后在室温下以850× g离心30分钟,不制动,以确保保持密度梯度。
- 将 1.077 g/mL 密度梯度顶部的细胞血沉棕黄层可视化为浑浊的白色层。使用 25 mL 血清移液器和自动移液器取出血浆层,将其丢弃至血沉棕黄层上方约 10 mL。
- 用无菌转移或血清移液管收集血沉棕黄层。像刮刀一样使用移液器从锥形管的侧面刮下细胞,同时释放灯泡(或缓慢移液)以将细胞吸起。将来自两个 50 mL 锥形管的血沉棕黄层合并到一个新的 50 mL 锥形管中。
- 通过将 45 mL 含有 2% FBS 的无菌 HBSS 倒入每个锥形管中来洗涤细胞。在室温下以360× g 离心11分钟。
- 将洗涤介质吸入所有管中的沉淀中。使用 10 mL 血清移液器和自动移液器将第一个沉淀重悬于含有 2% FBS 的 10 mL HBSS 中。将每个沉淀重悬于相同的 10 mL HBSS 中,并用额外的 10 mL HBSS 冲洗每个试管,将所有细胞收集到单个管中。
- 将 45 mL 含有 2% FBS 的无菌 HBSS 倒入锥形管中。在4°C下以360× g离心10分钟。
- 将洗涤缓冲液吸出到细胞沉淀中,并将沉淀重悬于20 mL磁性细胞分离器缓冲液中(参见 材料表)。取出一小块等分试样,用血细胞计数器以1:20稀释的亚甲蓝计数细胞。添加蓝色和白色单元格的数量。在360× g下离心,在4°C下离心10分钟。
注意:此协议使用磁珠技术(见 材料表)。该方案可以修改为与任何细胞分离技术一起使用,具有足够的CD34 +干细胞纯度和产量。 - 吸出上清液,并将从脐带血中分离的CD34+细胞沉淀重悬于每1 x 108 个细胞的300μL磁性细胞分离器缓冲液中。首先加入 100 μL FcR 封闭试剂,然后每 1 x 108 个细胞加入 100 μL CD34+ 磁珠。在4°C孵育30分钟(无冰)。
- 每 1 x 108 个细胞加入 5 mL 磁性细胞分离器缓冲液,并在 4 °C 下以 360 x g 旋转 10 分钟。 重复洗涤步骤,并将沉淀重悬于标记为"未分级"的 15 mL 锥形管中每 1 x 108 个细胞的 500 μL 磁性细胞分离器缓冲液中。
- 再标记两个 15 mL 锥形管"CD34-"和"CD34+"。将三个 15 mL 锥形管(普通、CD34-和CD34+)分别放入冷却架上的插槽A1、B1和C1(参见 材料表)。根据制造商的仪器说明,使用平衡计分卡中自动磁性细胞分离器(参见 材料表)上的两柱正向选择程序分离细胞。
- 扩增和冷冻CD34+人类干细胞
- 将 10 μL 回收的 CD34+ 细胞悬液 (2 mL) 等分到血细胞计数器载玻片上,并在 10 倍放大倍数下对细胞进行计数。通过将细胞计数乘以 2 x 104 来计算 CD34+ 细胞的总数。将总CD34 +细胞数除以250,000以计算要冷冻的小瓶数量( 体外 扩增前每只小鼠幼崽50,000个细胞)。
- 制备 CB 培养基 Iscove 的 10% FCS(加上 1 mL 额外过滤损失),补充 40 ng/mL 干细胞因子、20 ng/mL Flt3L 和 10 ng/mL IL-6,并通过 0.22 μm 过滤器。将CD34 +细胞重悬于每mL CB培养基100,000,并在37°C下孵育。 在第3天,将等体积的不含细胞因子的CB培养基加入含有细胞的烧瓶和含有细胞因子的CB培养基中。
注意:将这些细胞因子添加到CB培养基中可促进CD34 +细胞的存活和扩增,同时防止分化。 - 在第5天收获扩增的CD34 +细胞。上下移液细胞悬液,并收集在 50 mL 锥形管中。加入足够的CB培养基以覆盖烧瓶底部。使用细胞刮刀刮擦烧瓶的整个底部。将所有培养基收集到同一个 50 mL 管中,并以 360 x g 离心 11 分钟。
- 将细胞重悬于 2 mL CB 培养基中。将移液器的最后一滴液保存到 96 孔板中进行计数。将细胞用台盼蓝 1:1 稀释,向血细胞计数器中加入 10 μL,然后对四个象限的细胞进行计数和平均。通过将细胞计数乘以4 x 104来计算CD34 +细胞的总数,并记录活力。
- 制作n + 1 mL冷冻培养基,其中n是在步骤1.3.1中计算的冷冻瓶数。通过在FBS中加入10%(v / v)DMSO来制备冷冻培养基并保持在冰上。用CB#,CD34 + d5和日期标记冷冻管。
- 在4°C下以360× g 旋转CD34 +细胞10分钟。 将培养基向下吸出到沉淀中,并将细胞沉淀重悬于冷冻培养基中。将 1 mL 细胞悬液等分到每个小瓶中,并在小瓶之间均匀分配任何剩余部分。将小瓶加入冷却至4°C的异丙醇细胞冰箱中,置于-80°C,并转移到液氮中储存>90天。
- 对小鼠幼崽的照射
- 出生后 1-3 天将 BRGSB/N 幼崽收集到带衬垫的高压灭菌塑料盒中。与幼崽一起添加少量床上用品。在盒子上贴上笼子编号和幼崽数量。
- 将辐照器(见 材料表)设置为300 rad的剂量。将一盒幼崽放入辐照器中,并将它们暴露在 300 rad 下。将幼崽带回笼子里,将它们堆成一堆,并盖上被褥。
- 幼崽注射和CD34+细胞制备
- 照射后~3小时开始CD34 +细胞制备。在 50 mL 锥形管中加热 10 mL CB 培养基。在无菌平衡计分卡中执行所有步骤。
- 每四到六只幼崽注射一瓶体 外 扩增和冷冻的CD34 +细胞。在55°C下快速解冻,直到只有少量的冰可见,然后将细胞加入加热的CB培养基中(小瓶摸起来应该仍然凉爽。使用1mL培养基冲洗每个小瓶,并在4°C下以360× g 旋转细胞12分钟。
注意:发现在55°C下快速解冻比在37°C下解冻产生更好的细胞活力(90%-95%)。 - 小心吸出培养基。将(小)沉淀重悬于 2 mL CB 培养基中,轻轻混合,并将 ~30 μL 细胞悬液加入计数板中的单个孔中。在台盼蓝中 1:1 稀释,然后将 10 μL 加入血细胞计数器中,对四个象限的细胞进行计数和平均。
- 通过将细胞计数乘以4 x 104 来计算CD34 +细胞的总数,然后记录活力。在4°C下以360× g 旋转12分钟。
- 小心吸出培养基并将细胞沉淀重悬于每 n+1 只要注射的幼崽 100 μL 无菌 PBS 中,导致每只小鼠 250,000-450,000 个 CD34+ 细胞。将锥形管放在运输容器中的冰上,然后前往动物饲养室进行幼犬注射。
- 将加热灯,尿布,1 mL注射器,18 G针头,30 G针头和无菌容器中的CD34 +细胞制剂带到动物饲养室BSC。将无菌尿布放在加热灯下方~2英尺处。取回装有要注射的垫料的笼子并放入平衡计分卡中。
- 用18 G斜面针组装注射器。将锥形管的角度与针的斜面相匹配,轻轻混合并拉起细胞悬液。将幼崽放在尿布上加热(注意过热)。从注射器中取出空气,用30G针头替换18 G针头,然后小心地推动注射器,直到细胞悬液刚好在针尖。
注意:或者,可以使用胰岛素注射器。 - 一次带一只小狗到尿布边缘远离加热灯。将幼犬侧卧在拇指和食指下方,以便清楚地看到脸部。注意耳朵下方脸颊上的静脉。将针头浅浅插入离眼睛最近的静脉(IV),然后缓慢注射50μL细胞。
- 检查皮下注射是否形成气泡。如果是这样,请将针头插入更深并继续注射细胞。成功后可以看到一小滴血/血肿。
注意:请参阅Gombash Lampe等人关于幼犬注射的程序24 。 - 在幼崽仍然固定的情况下,用另外 50 μL 细胞(每只 IV+IH 幼崽总共 100 μL)进行肝内注射 (IH)。肝脏可以可视化为白色乳带和胸廓之间的黑点。将注射的幼犬放在尿布上,远离未注射的幼犬并加热。
注意:IV注射比单独IH注射产生更好的长期嵌合25,但IV注射并不总是成功的。因此,在IV和IH之间拆分注射可确保植入更大比例的小鼠中。 - 对所有幼崽重复面部静脉和IH注射。清除任何血液,将幼崽放回笼子里的巢穴,并盖上被褥。
2. 在血液中测试人类嵌合体
- 在10周和14周龄时测试HIS小鼠血液中的嵌合体。 通过 眶后静脉或使用 IACUC 批准的替代方法收集 50 μL 血液。
- 对于眶后出血,用异氟烷蒸发器设置为5麻醉小鼠1-2分钟,然后将蒸发器设置降低到4。根据需要调低蒸发器,以使小鼠在麻醉下保持足够的氧合。不要将小鼠保持在异氟醚下超过5分钟。
- 将麻醉小鼠的鼻子放入异氟醚蒸发器鼻锥附件中,并将一滴镇痛药(0.5%盐酸丙帕卡因眼用溶液USP)放在眼睛上。
- 1 分钟后,使用无菌纱布去除丙帕卡因,突出眼睛,并在眶后插入 75 mm 肝素化血细胞比容管以收集 50 μL 血液。将血液喷射到含有 50 μL 肝素的 1.5 mL 微量离心管中并轻轻混合。
- 用无菌纱布捏住闭合的眼睛以止血并涂抹一滴丙帕卡因。从异氟醚中取出小鼠并在干净的笼子中恢复。
- 从小鼠血液中分离PBMC
- 通过轻轻上下移液混合血液/肝素,然后慢慢覆盖在 500 μL 1.077 g/mL 密度梯度的顶部,注意不要干扰界面。在没有制动器的情况下,在室温下以1,220 x g 离心管20分钟。
- 将细胞血沉棕黄层可视化为等离子体下方 1.077 g/mL 密度梯度顶部的浑浊层。用 200 μL 移液器从血沉棕黄层中取出尽可能多的细胞,并添加到含有 750 μL 收获培养基的新 1.5 mL 管中。在室温下以360× g 离心11分钟。
- 将培养基吸出至 50 μL,并将沉淀重悬于 750 μL 收获培养基中。在4°C下以360× g 离心10分钟,然后再次吸出至50μL。细胞准备重悬于表面染色剂中。
- 表面染色和流式细胞术分析
- 填写染色面板工作表(表1;"光谱流出血面板"工作表)与小鼠编号,并通过将所有荧光抗体添加到染色缓冲液中来制备抗体染色混合物(补充文件1)。制作板布局以将样品添加到 96 孔 U 形底板中。使用永久性标记标记孔的底部。在染色前使用标准程序滴定抗体,以确定适当的浓度26。
- 向 96 孔 U 底板的每个孔中加入 62 μL 表面染色混合物。将细胞重悬于管中剩余的 50 μL 中,并将每个样品添加到其相应的孔中。包括一个用于阳性染色对照(人PBMC+小鼠脾细胞,每个1 x 106 个细胞)的孔,以与样品一起染色。通过移液混合并将混合物在4°C孵育15分钟。
- 在4°C下以680× g 离心3分钟。 将板弹出到水槽中以除去上清液,并通过轻轻移液~10x重悬于150μL染色缓冲液中来洗涤细胞。将每个孔旋转并重悬于 150 μL 染色缓冲液中。
- 在流式细胞仪上获取每个样品 100 μL 的数据(参见 材料表)并导出 .fcs 文件。将 .fcs 文件导入流数据编辑软件(请参见 材料表)。将多边形门应用于单元格周围的 FSC-A x SSC-A 图,不包括任何碎片。选择门内的细胞(见 表1;"光谱流出血门控"工作表)。
- 将轴更改为 (FSC-A x FSC-H) 并控制线性对角线上包含的单元格,不包括从直线突出的双峰。选择这些单元格并将轴更改为 (hCD45 x mCD45)。
- 将多边形门应用于 hCD45+ 种群并应用名称"人类"。将多边形门应用于 mCD45+ 群体并应用名称"鼠标"。为人类和小鼠群体创建计数统计量。
- 选择人口并将轴更改为 (CD19 x CD3)。将多边形门应用于CD19 +细胞并将其命名为"B细胞"。将多边形门应用于CD3 +群体并将其命名为"T细胞"。将多边形门应用于双重阴性总体,并将其命名为"非结核病"。
- 选择 T 细胞群并将轴更改为 (CD8 x CD4)。将多边形门应用于CD4和CD8阳性群体,并分别将它们命名为"CD4+"和"CD8+"。
- 选择非结核病群体并将轴更改为(CD56 x髓系)。将多边形门应用于包括双阳性事件在内的总CD56阳性群体,并将其命名为"NK细胞"。将多边形门应用于CD56阴性和骨髓阳性群体,并将其命名为"骨髓"。
- 为所有总体的百分比和计数统计数据创建一个表格,并导出到电子表格软件(请参阅 材料表)。计算 %hCD45 嵌合体 = %hCD45/(%hCD45 + mCD45)。
- 排除<20%hCD45 +(mCD45 + hCD45)的HIS小鼠进行进一步实验。
注意:在本研究中,使用1.077 g/mL密度梯度分离制备PBMC,以获得更清洁的红细胞去除。该程序从PBMC层中排除了人和小鼠粒细胞。或者,可以使用红细胞裂解术。
3.将肿瘤注射到小鼠体内
- 在肿瘤注射之前,从14周出血数据中确认T细胞数量。如果T细胞为>20%,则在20-26周之间注射肿瘤以准备收获,如果T细胞占总免疫细胞群的<20%,则在24-28周之间注射肿瘤。这种注射时间确保小鼠在20-28周龄,并且在研究结束时具有足够数量的T细胞。
- 细胞系衍生异种移植物(CDX)的注射
注意:该过程以MDA-MB-231乳腺腺癌细胞(见 材料表)为例进行描述。- 解冻等分试样的冷冻细胞,通过在补充有10%FBS,1%PenStrep和1%非必需氨基酸的10mLDMEM重悬1x洗涤1x,并在4°C下以360× g 离心10分钟。 吸出培养基并在 T25 烧瓶中重悬于 10 mL 补充有 10% FBS、1% PenStrep 和 1% 非必需氨基酸的 DMEM 中,并在 37 °C 下用 5% CO2 孵育。
注意:细胞系通过PCR认证,以确保正确的细胞类型。注射前通过生化测定 法检测 细胞上清液的支原体。 - 在指数生长期以约80%汇合度传代和扩增细胞。
- 吸出培养基,用5-10mL无菌PBS(pH 7.2)冲洗细胞,并与1mL的0.25%胰蛋白酶-EDTA孵育1-5分钟,直到细胞从烧瓶中分离。
- 加入 5 mL 相同的 DMEM,上下移液混合。将整个 6 mL 细胞悬液传代到新的组织培养处理的 T75 烧瓶中(1:3 稀释),并额外加入 10 mL DMEM。
- 每2-3天以80%汇合度在DMEM中以1:3稀释板传代细胞以扩增细胞。
- 在六代内的指数生长期用0.25%胰蛋白酶-EDTA收获细胞,并用PBS洗涤。以1:1的比例混合PBS和基底膜提取物(参见 材料表),并以5 x 107 个细胞/ mL的终浓度添加到细胞中。
- 如步骤2.1.1所述用异氟醚麻醉小鼠。使用 23 G 针头将 100 μL(5 x 106 个细胞)的肿瘤细胞悬液皮下注射到每侧。
- 解冻等分试样的冷冻细胞,通过在补充有10%FBS,1%PenStrep和1%非必需氨基酸的10mLDMEM重悬1x洗涤1x,并在4°C下以360× g 离心10分钟。 吸出培养基并在 T25 烧瓶中重悬于 10 mL 补充有 10% FBS、1% PenStrep 和 1% 非必需氨基酸的 DMEM 中,并在 37 °C 下用 5% CO2 孵育。
- 使用穿刺器注射患者来源的异种移植物(PDX)。PDX 模型的注射程序和其他开发和维护说明可在文献27 中找到。
4. 肿瘤生长测量
- 植入后每周检查一次肿瘤进展,感觉肿瘤生长的侧翼。一旦肿瘤可触及,用异氟醚麻醉小鼠(如步骤2.1.1中所述),并用电动修剪器在每个侧翼剃须,注意肿瘤周围以防止肿瘤生长时溃疡。
注意:小鼠可以在肿瘤注射前剃光,以防止肿瘤周围的皮肤受伤;然而,头发再生的速度可能会阻碍肿瘤的测量。 - 使用卡尺每周测量肿瘤的长度和宽度两次,并以毫米为单位记录测量值。使用公式
 将肿瘤测量值报告为肿瘤体积(mm3)。注意不要让每个肿瘤的肿瘤负荷超过2,000 mm 3或总体积为3,000 mm3。
将肿瘤测量值报告为肿瘤体积(mm3)。注意不要让每个肿瘤的肿瘤负荷超过2,000 mm 3或总体积为3,000 mm3。
注意:在癌症研究中使用小鼠的指南因地点而异。请参阅研究人员所在机构的动物护理和使用政策。
5. 药物治疗
- 根据hCD45嵌合,hCD3嵌合和hCD8嵌合将HIS小鼠分配到等效的治疗组中。一旦肿瘤平均达到100mm3 ,就开始药物治疗。
注意:每组的小鼠数量基于从CB生成的HIS小鼠数量。建议每组至少四只小鼠。非二分多组匹配(例如,在R-vivo Manila软件中)对于该分组28是有用的。 - 用药途径和频率
- 静脉内(腹膜内)注射抗PD-1抑制剂(纳武利尤单抗,帕博利珠单抗),单次治疗每周1次,单次治疗每周20mg / kg,联合治疗每周10-15mg / kg 2次。
- 根据实验设计给予联合疗法,例如靶向治疗、化疗和照射。靶向治疗和化疗可以通过口服强饲法、腹腔注射或食物给予。
注意:剂量可以根据公布的数据和肿瘤模型变化和优化。在HIS小鼠研究之前,通常在免疫缺陷的接受者中测试剂量研究。
- 每周至少监测小鼠3次健康变化,如体重减轻、粪便松散、驼背姿势、活动能力下降和皮毛脱落。一些症状可能是药物毒性或 GVHD 的迹象,可能需要减少或停止药物剂量。根据需要根据动物护理和使用政策对小鼠实施安乐死。
6.研究结束时收获小鼠组织和肿瘤
- 根据机构和兽医指南,使用流速为 2.75 L/min 的压缩CO 2 气体单独对小鼠实施安乐死。监测死亡后在CO2 中保持1分钟的小鼠,然后进行颈椎脱位作为安乐死的继发形式。
- 采血
- 通过心内穿刺 采集 血液。将鼠标保持在直立位置,并将带有25 G针头的1 mL注射器从中线左侧和肋骨下方的线直接插入心脏。最好通过一次长抽将血液收集到注射器中,然后转移到标记的 1.5 mL 管中。
注意:可以进行额外的针头插入,以小心地从肺腔的角落收集额外的血液。 - 将血液在4°C下放置1小时,然后将血液在微量离心机中以7,800× g离心6分钟。将血液界面上方的透明液体(血清)收集到第二个清洁并标记的 1.5 mL 管中。将血清储存在-20°C以进行下游分析,例如人和小鼠炎性细胞因子或免疫球蛋白滴度。
- 通过心内穿刺 采集 血液。将鼠标保持在直立位置,并将带有25 G针头的1 mL注射器从中线左侧和肋骨下方的线直接插入心脏。最好通过一次长抽将血液收集到注射器中,然后转移到标记的 1.5 mL 管中。
- 组织解剖
- 在小鼠中注射和生长肿瘤细胞并给予药物治疗后,收获组织。将小鼠放在泡沫解剖板上,用销钉将它们固定到位,手臂和腿以 45° 角伸展。在躯干中间做一个切口,从骨盆附近开始,延伸到下巴,尽量避免切腹膜(尽管这不是必需的)。将皮肤拉到边缘并用别针固定到位。
- 使用细镊子按以下顺序提取淋巴结(LN):腹股沟,腋窝,宫颈,肠系膜,裂孔。
注意:在HIS小鼠中,LN通常非常小,类似于肛门,或"发炎",具有与野生型小鼠不同的独特外观。因此,从每个部位获取类似于LN的组织。外周LN通常表现为充满液体的"球",而肠系膜LN则更密集。肠系膜LN是最明显和一致的,并且被观察为一个或两个不同的密度较大的节点,而不是一个字符串。 - 将LN放在磨砂载玻片的一侧,置于培养皿中的8 mL收获培养基中。以垂直角度握住载玻片,磨砂边缘向内,轻轻按压组织,直到释放细胞内容物。
- 通过将载玻片拉开并一起冲洗几次,以释放最大数量的细胞。用 5 英寸玻璃移液管收集细胞,并通过 9 英寸棉塞移液管将其过滤到标记的 15 mL 锥形管中。
- 使用两对镊子或镊子和剪刀从腹部左上角取出脾脏。注意脾脏的大小作为重悬培养基体积的估计值。与LN一样,使用磨砂载玻片通过机械消化收集和过滤脾脏。
注意:可以使用任何制备单细胞悬浮液组织的技术。 - 如下所述对组织样品中的细胞进行计数和重悬。
- 在4°C下以360× g 离心淋巴细胞10分钟。 吸出液体并将细胞沉淀重悬于含有 DNase 的 1 mL 收获培养基中。
- 通过在室温下与 3 mL ACK 裂解缓冲液孵育 3 分钟,然后加入 10 mL 收获培养基/DNase,从脾细胞中去除红细胞。再次离心脾细胞,吸出上清液,并根据脾脏大小将细胞重悬于 1-10 mL 收获培养基/DNase 中(例如,对于非常小的脾脏,最多 10 mL 对于最大的脾脏)。
- 将 10 μL 等分试样的细胞悬液添加到 90 μL 培养基中,并计数血细胞计数器。离心LN和脾细胞,吸出上清液,并以1 x 108 个细胞/ mL或至少80μL的浓度将细胞重悬于收获培养基中。
- 提取肿瘤。
- 用镊子握住肿瘤,同时用解剖剪刀缓慢剪断肿瘤边缘,从开放的侧腹去除肿瘤。
- 切除肿瘤后,称量并取出 1/4 进行 RNA 和免疫组织化学 (IHC) 处理。将1/4肿瘤分成两半;将一半(整个肿瘤的1/8)放入冷冻管中,在液体N 2中快速冷冻,并储存在-80°C用于下游基因组研究。
- 将肿瘤的其他 1/8 放入含有 10% 福尔马林的标记标本管中。第二天,冲洗并用70%乙醇重悬组织,直到将来使用。将剩余的 3/4 肿瘤放入 6 厘米的培养皿中,并使用手术刀刀片切成 ~1 毫米的碎片。
- 将肿瘤碎片转运到解离管中(参见 材料表),用5mL不完全肿瘤浸润白细胞(TIL)培养基冲洗培养皿,然后加入解离管中。
注意:对于重量>0.4 g的肿瘤,用10 mL TIL不完全培养基冲洗培养皿并添加到解离管中。 - 将终浓度为50mg / mL的胶原酶制剂(参见 材料表)添加到解离管中的组织中。根据肿瘤的硬度,在37°C下机械解离组织30分钟至1小时。
- 解离后,将悬浮液通过 100 μm 过滤器进入 50 mL 锥形管中,并用 10 mL TIL 完全培养基冲洗过滤器。该培养基中的血清将阻止胶原酶反应并保护细胞免受进一步降解。
- 在4°C下以360× g 离心单细胞悬液10分钟。 将沉淀重悬于含有DNase的足够收获培养基中,以便细胞悬液可以轻松通过P1000移液器吸头并记录体积以进行下游分析。
注意:较小的体积会增加肿瘤免疫细胞的收集,但更容易受到流式细胞仪堵塞的影响。
7. 细胞染色和流式细胞术分析
- 染色剂制备和细胞电镀
- 准备染色鸡尾酒:在收获当天,将样品数量添加到染色工作表中(表2;"常规流动 A 面板"、"光谱流 B 面板"和"常规流动 C 面板"工作表)用于所有染色和打印。在染色缓冲液(SB)中制备染色剂A和B的表面染色混合物,方法是用新的尖端单独添加每种抗体,在旅途中标记每种试剂,并储存在4°C直至需要。在无叠氮化物PBS中制备适当的活性染料,并储存在4°C直至需要(使用前加热至室温)。在第 2 天在 SB 中制备表面染色剂 C 鸡尾酒,并在各自的透化缓冲液中制备细胞内染色剂 B 和 C。
- 为染色工作表中的所有样品创建板布局,并将 100 μL 无叠氮化物 PBS 等分到孔中。包括每个组织和染色的未染色对照(用于光谱细胞术)。
- 将细胞添加到含有 50 μL PBS 的 96 孔板中。对于染色A,如染色工作表上所述,将每个组织组重悬于适当的体积,并储存在4°C直至同一天在流式细胞仪上采集。对于染色剂 B 和 C,用 PBS 向孔中加入 25 μL 淋巴液和 60 μL 非淋巴组织细胞悬浮液。
- 对细胞因子进行 体外 刺激,以使用染色C进行细胞内染色进行检测。
- 将步骤7.1.3中的染色C 96孔板在4°C下以680× g 离心3分钟。 向每个孔中加入 200 μL TIL 完全培养基(RPMI 1640,10 mM HEPES [pH 7],10% FBS)。将带有细胞悬液的板在4°C下储存过夜。
- 第二天清晨,在完全TIL培养基中稀释细胞刺激鸡尾酒(见 材料表)1:500。将含有细胞悬液的板以680 x g 离心以沉淀细胞并轻弹以除去培养基。将细胞重悬于200μL制备的细胞刺激混合物中,并在37°C下孵育1小时。
- 在完全TIL培养基中以1:1,000稀释度加入25μL含有莫能菌素的蛋白质转运抑制剂溶液,混合细胞,并在37°C下再孵育4小时以允许细胞因子的细胞内积累。
- 进行细胞染色。
- 对于染色剂A和B(第1天)以及染色剂C(第2天),在4°C下以680× g 离心3分钟。 轻弹板并将适当的活性染料添加到孔中。用多通道移液器轻轻上下移液,充分混合,并在室温下孵育15分钟。
- 离心板(如步骤7.1.5.1),然后在板中加入适当的表面染色剂,并用多通道移液器移液轻轻混合。在4°C孵育15分钟,然后再次离心。轻弹板,用 150 μL SB 轻轻上下移液洗涤细胞,然后离心。
- 轻弹板,用 150 μL SB 轻轻上下移液重复洗涤,并在 4 °C 下以 680 x g 离心 3 分钟。 对于染色A,如染色工作表上所示,将每个组织组重悬于适当的体积,并储存在4°C。 对于染色B,用FoxP3转录因子试剂盒固定剂(参见 材料表)在室温下固定30分钟。对于染色C,在室温下固定在SB中的1%(v / v)多聚甲醛中30分钟。
- 在4°C下以480× g 离心固定板3分钟。 在SB中洗涤1次。对于染色剂B,细胞可以放置过夜。
- 透化细胞:将孔重悬于150μL用于染色B的FoxP3转录因子试剂盒透化缓冲液中,在SB中的0.5%(w / v)皂苷中用于染色C.在室温下孵育15分钟。 将固定板在4°C下以480× g 离心3分钟。
- 轻弹板并加入相应的细胞内染色混合物用于染色B和染色C.在室温下孵育30分钟。
- 在4°C下以480× g 离心固定板3分钟,然后轻弹板。用 150 μL 相应的透化缓冲液(染色剂 B、FoxP3 转录因子试剂盒透化缓冲液;染色剂 C、皂苷)洗涤细胞。
- 轻弹板并通过在 150 μL SB 中上下移液洗涤。 在 4 °C 下以 480 x g 离心 3 分钟。 轻弹板,按组织组将细胞重悬于SB中,以染色工作表上注明的适当体积。
注意:样品现在已准备好通过光谱流式细胞术采集。 - 设置流式细胞仪(参见 材料表),为每个染色剂设置适当的单染色质控品,为每个组织组设置未染色样品,以解释解混合过程中自发荧光的差异。按照染色工作表(表2)中的定义获取每个组织组的适当体积并导出.fcs文件。
- 流式细胞术数据分析
- 使用流式细胞术分析软件(参见 材料表),创建一个新的工作空间。为每个器官(LN、脾脏和 TIL)创建新组。将每个机构的 .fcs 文件导入到组中。
- 创建二元点图,将轴设置为 (FSC-A x SSC-A),并将多边形门应用于像元事件,避免边缘上的事件(所有像元门)。选择蜂窝事件,将轴更改为 (FSC-A x FSC-H),并将多边形门应用于线性对角线上的事件,排除偏离对角线的事件以生成"单线"门。选择"单线"门并将轴更改为 (hCD45 x mCD45)。将多边形门应用于hCD45和mCD45阳性事件,并分别将它们命名为"人类"和"小鼠"。
- 选择人口并将 Y 轴更改为活/死水。将多边形门应用于活/死阴性hCD45阳性群体,并将其命名为"活人"。选择鼠标数量并将 X 轴更改为活/死水。将多边形门应用于活/死阴性mCD45阳性群体,并将其命名为"活小鼠"。
- 以类似的方式,选择"常规流A门控","光谱流B门控"和"常规流C门控"工作表(表2)中概述的父门以及X轴和Y轴,以分离指示的群体(例如,人B细胞,活化的T细胞)。
注意:每个污渍(出血,A,B,C)的代表浇口包含在 补充文件2中。 - 在流式细胞术分析软件中为所有群体创建计数和频率导出表,并导出到电子表格软件。频率的父群体如 表2所示。
- 使用数据根据实验治疗组生成图表。
注意:数据也可以使用分析软件中的R包进行分析。可以使用连接功能创建来自所有要分析的样品的单个 .fcs 文件。可以使用T-SNE算法对这些数据进行维度缩减,同时为组织类型和治疗组添加关键字参数。然后,可以使用 FlowSOM 算法对种群进行聚类,并使用聚类资源管理器工具识别种群。新的细胞群可以通过这种方式鉴定,目视比较,并在治疗组之间或各种组织内进行定量。 - 将同一治疗组中肿瘤的免疫参数与该肿瘤的生长相关联,以确定与肿瘤生长抑制相关的免疫类型。通过该肿瘤的比生长速率(SGR)量化肿瘤生长,该测量考虑了指定时间内肿瘤体积的差异。该测量使由于小鼠健康和治疗开始日期而在不同日期收获的肿瘤标准化。
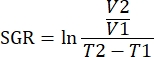
结果
按照侧腹肿瘤方案和实验时间表(图1),在两种不同的人结直肠癌(CRC)PDX中研究了肿瘤生长和对靶向酪氨酸激酶抑制剂(TKI)治疗和纳武利尤单抗联合治疗的免疫反应。TKI药物已在免疫缺陷宿主中进行了研究,以评估肿瘤生长仅29。该模型能够单独研究TKI免疫反应的变化,更重要的是,与抗PD-1联合使用。这项研究的重点是两个不同实验中的联合治疗队列...
讨论
在过去的6年中,利用我们在免疫学和人源化小鼠方面的专业知识,我们的研究团队开发了一个急需的临床前模型来测试免疫疗法对各种人类肿瘤3,7,30,31。该协议强调考虑模型的可变性,特别关注以免疫治疗为中心的人类T细胞群。在该协议中,描述了HIS小鼠的产生,以及其淋巴器官和肿瘤的免疫?...
披露声明
没有。
致谢
我们要感谢动物研究机构(OLAR)对我们小鼠的照顾,以及我们研究所癌症中心支持补助金(P30CA046934)支持的流式细胞术共享资源,感谢他们对我们所有工作的巨大帮助。我们还感谢Gail Eckhardt和Anna Capasso在我们的HIS-BRGS模型中研究人类PDX免疫疗法的首次合作。这项研究得到了美国国立卫生研究院P30CA06934癌症中心支持基金的部分支持,并使用PHISM(临床前人类免疫系统小鼠模型)共享资源,RRID:SCR_021990和流式细胞术共享资源,RRID:SCR_022035。这项研究得到了美国国立卫生研究院NIAID的部分支持,合同号为75N93020C00058。
材料
| Name | Company | Catalog Number | Comments |
| 1 mL syringe w/needles | McKesson | 1031815 | |
| 15 mL tubes | Grenier Bio-One | 188271 | |
| 2-mercaptoethanol | Sigma | M6250 | |
| 50 mL tubes | Grenier Bio-One | 227261 | |
| AutoMACS Pro Separator | Miltenyi | 130-092-545 | |
| BD Golgi Stop Protein Transport Inhibitor with monensin | BD Bioscience | BDB563792 | |
| BSA | Fisher Scientific | BP1600100 | |
| Cell Stim Cocktail | Life Technologies | 509305 | |
| Chill 15 Rack | Miltenyi | 130-092-952 | |
| Cotton-plugged glass pipettes | Fisher Scientific | 13-678-8B | |
| Cultrex Basement membrane extract | R&D Systems | 363200502 | |
| Cytek Aurora | Cytek | ||
| DNase | Sigma | 9003-98-9 | |
| eBioscience FoxP3/Transcription Factor Staining Buffer Set | Invitrogen | 00-5523-00 | |
| Embryonic Stemcell FCS | Gibco | 10439001 | |
| Eppendorf Tubes; 1.5 mL volume | Grenier Bio-One | 616201 | |
| Excel | Microsoft | ||
| FBS | Benchmark | 100-106 500mL | |
| Ficoll Hypaque | GE Healthcare | 45001752 | |
| FlowJo Software | BD Biosciences | ||
| Forceps - fine | Roboz Surgical | RS5045 | |
| Forceps normal | Dumont | RS4919 | |
| Formaldehyde | Fisher | F75P1GAL | |
| Frosted Glass Slides | Corning | 1255310 | |
| Gentlemacs C-Tubes | Miltenyi | 130-096-334 | |
| GentleMACS Dissociator | Miltenyi | 130-093-235 | |
| glass pipettes | DWK Life Sciences | 63A53 | |
| Glutamax | Gibco | 11140050 | |
| HBSS w/ Ca & Mg | Sigma | 55037C | |
| HEPES | Corning | MT25060CI | |
| IgG standard | Sigma | I2511 | |
| IgM standard | Sigma | 401108 | |
| IMDM | Gibco | 12440053 | |
| Liberase DL | Roche | 5466202001 | |
| LIVE/DEAD Fixable Blue | Thermo | L23105 | |
| MDA-MB-231 | ATCC | HTB-26 | |
| MEM | Gibco | 1140050 | |
| mouse anti-human IgG-AP | Southern Biotech | JDC-10 | |
| mouse anti-human IgG-unabeled | Southern Biotech | H2 | |
| mouse anti-human IgM-AP | Southern Biotech | UHB | |
| mouse anti-human IgM-unlabeled | Southern Biotech | SA-DA4 | |
| MultiRad 350 | Precision X-Ray | ||
| PBS | Corning | 45000-446 | |
| Pen Strep | Gibco | 15140122 | |
| Petri Dishes | Fisher Scientific | FB0875713A | |
| p-nitrophenyl substrate | Thermo | 34045 | |
| PRISM | Graphpad | ||
| Rec Hu FLT3L | R&D systems | 308-FK-005/CF | |
| Rec Hu IL6 | R&D systems | 206-IL-010/CF | |
| Rec Hu SCF | R&D systems | 255SC010 | |
| RPMI 1640 | Corning | 45000-39 | |
| Saponin | Sigma | 8047-15-2 | |
| Scissors | McKesson | 862945 | |
| Serological pipettes 25 mL | Fisher Scientific | 1367811 | |
| Sterile filter | Nalgene | 567-0020 | |
| Sterile molecular water | Sigma | 7732-18-5 | |
| Yeti Cell Analyzer | Bio-Rad | 12004279 | |
| Zombie Green | biolegend | 423112 |
参考文献
- Chulpanova, D. S., Kitaeva, K. V., Rutland, C. S., Rizvanov, A. A., Solovyeva, V. V. Mouse tumor models for advanced cancer immunotherapy. International Journal of Molecular Sciences. 21 (11), 4118 (2020).
- Olson, B., Li, Y., Lin, Y., Liu, E. T., Patnaik, A. Mouse models for cancer immunotherapy research. Cancer Discovery. 8 (11), 1358-1365 (2018).
- Marin-Jimenez, J. A., et al. Testing cancer immunotherapy in a human immune system mouse model: correlating treatment responses to human chimerism, therapeutic variables and immune cell phenotypes. Frontiers in Immunology. 12, 607282 (2021).
- Yin, L., Wang, X. J., Chen, D. X., Liu, X. N., Wang, X. J. Humanized mouse model: a review on preclinical applications for cancer immunotherapy. American Journal of Cancer Research. 10 (12), 4568-4584 (2020).
- Cogels, M. M., et al. Humanized mice as a valuable pre-clinical model for cancer immunotherapy research. Frontiers in Oncology. 11, 784947 (2021).
- Jin, K. T., et al. Development of humanized mouse with patient-derived xenografts for cancer immunotherapy studies: A comprehensive review. Cancer Science. 112 (7), 2592-2606 (2021).
- Capasso, A., et al. Characterization of immune responses to anti-PD-1 mono and combination immunotherapy in hematopoietic humanized mice implanted with tumor xenografts. Journal for Immunotherapy of Cancer. 7 (1), 37 (2019).
- Wang, M., et al. Humanized mice in studying efficacy and mechanisms of PD-1-targeted cancer immunotherapy. The FASEB Journal. 32 (3), 1537-1549 (2018).
- Yong, K. S. M., et al. Humanized mouse as a tool to predict immunotoxicity of human biologics. Frontiers in Immunology. 11, 553362 (2020).
- Shen, H. W., Jiang, X. L., Gonzalez, F. J., Yu, A. M. Humanized transgenic mouse models for drug metabolism and pharmacokinetic research. Current Drug Metabolism. 12 (10), 997-1006 (2011).
- Bosma, G. C., Custer, R. P., Bosma, M. J. A severe combined immunodeficiency mutation in the mouse. Nature. 301 (5900), 527-530 (1983).
- Shultz, L. D., et al. Multiple defects in innate and adaptive immunologic function in NOD/LtSz-scid mice. The Journal of Immunology. 154 (1), 180-191 (1995).
- Legrand, N., et al. Functional CD47/signal regulatory protein alpha (SIRP(alpha)) interaction is required for optimal human T- and natural killer- (NK) cell homeostasis in vivo. Proceedings of the National Academy of Sciences. 108 (32), 13224-13229 (2011).
- Ishikawa, F., et al. Development of functional human blood and immune systems in NOD/SCID/IL2 receptor {gamma} chain(null) mice. Blood. 106 (5), 1565-1573 (2005).
- Ito, M., et al. NOD/SCID/gamma(c)(null) mouse: an excellent recipient mouse model for engraftment of human cells. Blood. 100 (9), 3175-3182 (2002).
- Shultz, L. D., et al. Human lymphoid and myeloid cell development in NOD/LtSz-scid IL2R gamma null mice engrafted with mobilized human hemopoietic stem cells. The Journal of Immunology. 174 (10), 6477-6489 (2005).
- Traggiai, E., et al. Development of a human adaptive immune system in cord blood cell-transplanted mice. Science. 304 (5667), 104-107 (2004).
- Theocharides, A. P., Rongvaux, A., Fritsch, K., Flavell, R. A., Manz, M. G. Humanized hemato-lymphoid system mice. Haematologica. 101 (1), 5-19 (2016).
- Goldman, J. P., et al. Enhanced human cell engraftment in mice deficient in RAG2 and the common cytokine receptor gamma chain. British Journal of Haematology. 103 (2), 335-342 (1998).
- Stripecke, R., et al. Innovations, challenges, and minimal information for standardization of humanized mice. EMBO Molecular Medicine. 12 (7), (2020).
- Allen, T. M., et al. Humanized immune system mouse models: progress, challenges and opportunities. Nature Immunology. 20 (7), 770-774 (2019).
- Gammelgaard, O. L., Terp, M. G., Preiss, B., Ditzel, H. J. Human cancer evolution in the context of a human immune system in mice. Molecular Oncology. 12 (10), 1797-1810 (2018).
- Rios-Doria, J., Stevens, C., Maddage, C., Lasky, K., Koblish, H. K. Characterization of human cancer xenografts in humanized mice. Journal for Immunotherapy of Cancer. 8 (1), 000416 (2020).
- Gombash Lampe, S. E., Kaspar, B. K., Foust, K. D. Intravenous injections in neonatal mice. Journal of Visualized Experiments. (93), e52037 (2014).
- Lang, J., Weiss, N., Freed, B. M., Torres, R. M., Pelanda, R. Generation of hematopoietic humanized mice in the newborn BALB/c-Rag2null Il2rγnull mouse model: a multivariable optimization approach. Clinical Immunology. 140 (1), 102-116 (2011).
- Laskowski, T. J., Hazen, A. L., Collazo, R. S., Haviland, D. Rigor and reproducibility of cytometry practices for immuno-oncology: a multifaceted challenge. Cytometry Part A. 97 (2), 116-125 (2020).
- Bagby, S., et al. Development and maintenance of a preclinical patient derived tumor xenograft model for the investigation of novel anti-cancer therapies. Journal of Visualized Experiments. (115), e54393 (2016).
- Laajala, T. D., et al. Optimized design and analysis of preclinical intervention studies in vivo. Scientific Reports. 6, 30723 (2016).
- Na, Y. S., et al. Establishment of patient-derived xenografts from patients with gastrointestinal stromal tumors: analysis of clinicopathological characteristics related to engraftment success. Scientific Reports. 10 (1), 7996 (2020).
- Tentler, J. J., et al. RX-5902, a novel beta-catenin modulator, potentiates the efficacy of immune checkpoint inhibitors in preclinical models of triple-negative breast cancer. BMC Cancer. 20 (1), 1063 (2020).
- Lang, J., et al. Development of an adrenocortical cancer humanized mouse model to characterize anti-PD1 effects on tumor microenvironment. The Journal of Clinical Endocrinology & Metabolism. 105 (1), 26-42 (2020).
- Lang, J., et al. Studies of lymphocyte reconstitution in a humanized mouse model reveal a requirement of T cells for human B cell maturation. The Journal of Immunology. 190 (5), 2090-2101 (2013).
- Katano, I., et al. NOD-Rag2null IL-2Rγnull mice: an alternative to NOG mice for generation of humanized mice. Experimental Animalas. 63 (3), 321-330 (2014).
- Brehm, M. A., et al. Parameters for establishing humanized mouse models to study human immunity: analysis of human hematopoietic stem cell engraftment in three immunodeficient strains of mice bearing the IL2rγ(null) mutation. Clinical Immunology. 135 (1), 84-98 (2010).
- Hasgur, S., Aryee, K. E., Shultz, L. D., Greiner, D. L., Brehm, M. A. Generation of immunodeficient mice bearing human immune systems by the engraftment of hematopoietic stem cells. Methods in Molecular Biology. 1438, 67-78 (2016).
- Andre, M. C., et al. Long-term human CD34+ stem cell-engrafted nonobese diabetic/SCID/IL-2Rγnull mice show impaired CD8+ T cell maintenance and a functional arrest of immature NK cells. The Journal of Immunology. 185 (5), 2710-2720 (2010).
- Wunderlich, M., et al. Improved multilineage human hematopoietic reconstitution and function in NSGS mice. PLoS One. 13 (12), 0209034 (2018).
- Lee, J., Brehm, M. A., Greiner, D., Shultz, L. D., Kornfeld, H. Engrafted human cells generate adaptive immune responses to Mycobacterium bovis BCG infection in humanized mice. BMC Immunology. 14, 53 (2013).
- Masse-Ranson, G., et al. Accelerated thymopoiesis and improved T-cell responses in HLA-A2/-DR2 transgenic BRGS-based human immune system mice. European Journal of Immunology. 49 (6), 954-965 (2019).
- Oswald, E., et al. Immune cell infiltration pattern in non-small cell lung cancer PDX models is a model immanent feature and correlates with a distinct molecular and phenotypic make-up. Journal for Immunotherapy of Cancer. 10 (4), 004412 (2022).
Erratum
Formal Correction: Erratum: Testing Cancer Immunotherapeutics in a Humanized Mouse Model Bearing Human Tumors
Posted by JoVE Editors on 5/25/2023. Citeable Link.
An erratum was issued for: Testing Cancer Immunotherapeutics in a Humanized Mouse Model Bearing Human Tumors. The Authors section was updated from:
Jordi M. Lanis1
Matthew S. Lewis1
Hannah Strassburger1
Stacey M. Bagby2
Adrian T. A. Dominguez2
Juan A. Marín-Jiménez3
Roberta Pelanda1
Todd M. Pitts2
Julie Lang1
1Department of Immunology and Microbiology, School of Medicine, University of Colorado Denver Anschutz Medical Campus
2Division of Oncology, School of Medicine, University of Colorado Denver Anschutz Medical Campus
3Department of Medical Oncology, Catalan Institute of Oncology (ICO-L’Hospitalet)
to:
Jordi M. Lanis1
Matthew S. Lewis1
Hannah Strassburger1
Kristina Larsen1
Stacey M. Bagby2
Adrian T. A. Dominguez2
Juan A. Marín-Jiménez3
Roberta Pelanda1
Todd M. Pitts2
Julie Lang1
1Department of Immunology and Microbiology, School of Medicine, University of Colorado Denver Anschutz Medical Campus
2Division of Oncology, School of Medicine, University of Colorado Denver Anschutz Medical Campus
3Department of Medical Oncology, Catalan Institute of Oncology (ICO-L’Hospitalet)
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。