A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
בדיקת אימונותרפיה לסרטן במודל עכבר אנושי הנושא גידולים אנושיים
* These authors contributed equally
In This Article
Erratum Notice
Summary
פרוטוקול זה מתאר את הדור של עכברי מערכת החיסון האנושית (HIS) עבור מחקרים אימונו-אונקולוגיים. הוראות ושיקולים בשימוש במודל זה לבדיקת אימונותרפיה אנושית על גידולים אנושיים המושתלים במודל זה מוצגים בדגש על אפיון התגובה של מערכת החיסון האנושית לגידול.
Abstract
היפוך האופי החיסוני של המיקרו-סביבה של הגידול הוא קריטי לטיפול מוצלח בסרטן באמצעות תרופות אימונותרפיות. מודלים של סרטן מורין מוגבלים מאוד במגוון שלהם וסובלים מתרגום לקוי למרפאה. כדי לשמש מודל פרה-קליני פיזיולוגי יותר למחקרים אימונותרפיים, פרוטוקול זה פותח כדי להעריך את הטיפול בגידולים אנושיים בעכבר שהורכב מחדש עם מערכת החיסון האנושית. פרוטוקול ייחודי זה מדגים התפתחות של עכברי מערכת החיסון האנושית (HIS, "אנושיים"), ולאחר מכן השתלה של גידול אנושי, או xenograft נגזר קו התא (CDX) או xenograft נגזר המטופל (PDX). העכברים שלו נוצרים על ידי הזרקת CD34+ תאי גזע המטופויטיים אנושיים שבודדו מדם טבורי לתוך BRGS בילוד (BALB/c Rag2-/- IL2RγC-/- NODSIRPα) עכברים בעלי כשל חיסוני גבוה המסוגלים גם לקבל גידול קסנוגני. מודגשת חשיבות הקינטיקה ומאפייני התפתחות מערכת החיסון האנושית והשתלת הגידול. לבסוף, מתוארת הערכה מעמיקה של המיקרו-סביבה של הגידול באמצעות ציטומטריית זרימה. במחקרים רבים המשתמשים בפרוטוקול זה, נמצא כי מיקרו-סביבה של גידולים בודדים משוחזרת בעכברי HIS-PDX; גידולים "חמים" מציגים חדירה חיסונית גדולה בעוד גידולים "קרים" לא. מודל זה משמש כשדה ניסויים לאימונותרפיה משולבת למגוון רחב של גידולים אנושיים ומהווה כלי חשוב בחיפוש אחר רפואה מותאמת אישית.
Introduction
מודלים של סרטן עכברים חשובים לביסוס מנגנונים בסיסיים של צמיחת הגידול ובריחה חיסונית. עם זאת, מחקרי טיפול בסרטן במודלים של עכברים הניבו תרגום סופי למרפאה בשל מודלים סינגניים מוגבלים והבדלים ספציפיים למין 1,2. הופעתם של טיפולים חיסוניים כגישה דומיננטית לשליטה בגידולים חזרה על הצורך במודל in vivo עם מערכת חיסון אנושית מתפקדת. ההתקדמות בעכברי מערכת החיסון האנושית (עכברי HIS ) בעשור האחרון אפשרה לחקור אימונו-אונקולוגיה in vivo במגוון רחב של סוגי סרטן וחומרים אימונותרפיים 3,4,5,6. מודלים של גידולים אנושיים, כולל xenografts שמקורם בקו תאים וקסנוגרפטים שמקורם בחולה (CDX ו-PDX, בהתאמה), גדלים היטב בעכברי HIS וברוב המקרים כמעט זהים לגידולם בפונדקאי החיסוני חסר קליטה המטופויטית אנושית 7,8. בהתבסס על ממצא מפתח זה, חוקרים השתמשו במודל העכבר HIS כדי לחקור אימונותרפיות אנושיות, כולל טיפולים משולבים שנועדו לשנות את המיקרו-סביבה של הגידול (TME) כדי להפחית את הדיכוי החיסוני ובכך להגביר את הרג הגידול המכוון על ידי מערכת החיסון. מודלים פרה-קליניים אלה מסייעים לטפל בבעיות של הטרוגניות של סרטן אנושי, ויכולים גם לחזות הצלחה בטיפול, כמו גם לעקוב אחר רעילות תרופות הקשורות למערכת החיסון 9,10.
ייצור מודל עכבר עם מערכת חיסון אנושית באמצעות הכנסת תאי גזע המטופויטיים אנושיים דורש עכבר מושתל מדוכא חיסון שלא ידחה את הקסנוגרפט. המודלים הנוכחיים של עכברי HIS נגזרים מזני עכברים מדוכאי חיסון שדווחו לפני יותר מ-30 שנה. זן העכבר הראשון עם כשל חיסוני שתואר היה עכברי SCID שהיו חסרים תאי T ו-B11, ואחריו NOD-SCID היברידי עם פולימורפיזם SIRPα האחראי לסבילות מקרופאגים של עכברים לתאים אנושיים, עקב קשירה מוגברת של אלל NOD SIRPα למולקולת CD47 האנושית12,13. בתחילת שנות ה-2000, מחיקת שרשרת הגמא הנפוצה של קולטן IL-2 (IL-2Rγc) בשני הזנים BALB/c ו-NOD שינתה את כללי המשחק עבור קליטה אנושית משופרת, עקב מחיקות גנטיות שאסרו על התפתחות תאי NK מארחים14,15,16,17. מודלים חלופיים, כגון עכברי BRG ו-NRG, משיגים מחסור בתאי T ו-B באמצעות מחיקה של הגן Rag1 או Rag2, הדרוש לסידור מחדש של גנים של קולטני תאי T ו-B ובכך להבשלה והישרדות של לימפוציטים18,19. עכבר BRGS (BALB/c -Rag2 null Il2R γCnullSirpα NOD) המשמש כאן משלב את חסר שרשרת IL-2Rγ ואת אללNOD SIRPα על רקע Rag2-/- וכתוצאה מכך עכבר בעל כשל חיסוני גבוה ללא תאי T, B או NK, אך עם מספיק מרץ ובריאות כדי לאפשר קליטה לטווח ארוך של יותר מ -30 שבועות13.
עכברי HIS יכולים להיווצר בדרכים רבות, כאשר הזרקת PBMC אנושית היא השיטה הישירה ביותר15,18,20. עם זאת, לעכברים אלה יש התרחבות בולטת של תאי T אנושיים פעילים שגורמת למחלת השתל לעומת המאכסן (GVHD) עד גיל 12 שבועות, מה שמונע מחקרים ארוכי טווח. לחלופין, תאי גזע המטופויטיים אנושיים מדם טבורי (CB), מח עצם וכבד עוברי יכולים לשמש גם לקליטה וייצור של מערכת החיסון האנושית דה נובו. במערכת זו, תאי הגזע ההמטופויטיים מייצרים מערכת חיסון אנושית מרובת שושלות עם דור של תאי T, B, ותאי חיסון מולדים שהם סובלניים מאוד לפונדקאי העכבר, בהשוואה לעכברי PBMC שמפתחים בעיקר תאי T. לכן, GVHD נעדר או מתעכב מאוד, וניתן להרחיב את הלימודים לעכברים עד גיל 10 חודשים. CB מספק מקור קל, נגיש ולא פולשני של תאי גזע המטופויטיים אנושיים CD34+ המאפשר השתלה של עכברי HIS מרובים עם מערכת חיסון זהה גנטית 17,18,20,21. במהלך השנים האחרונות, מודלים של עכברי HIS שימשו באופן נרחב לחקר אימונותרפיה ו- TME 3,4,5,6. למרות התפתחות מערכת החיסון שמקורה בבני אדם בעכברים אלה, גידולי קסנוגרפט אנושיים גדלים בקצב דומה בהשוואה לעכברי ביקורת מדוכאי חיסון ומאפשרים את יחסי הגומלין המורכבים בין תאי הסרטן לתאי מערכת החיסון, החשובה לשמירה על המיקרו-סביבה של PDX 3,7,8 המושתל . פרוטוקול זה שימש לביצוע למעלה מ-50 מחקרים שבדקו טיפולים בעכברי HIS-BRGS עם PDX ו-CDX. מסקנה חשובה היא שגידולים אנושיים בעכברי HIS שומרים על ה-TME הייחודי שלהם כפי שהוגדר על ידי הערכה מולקולרית של הגידול ביחס לדגימת החולה הראשונית ומאפייני החדירה החיסונית 3,22,23. הקבוצה שלנו מתמקדת בהערכה מעמיקה של HIS הן באיברי החיסון והן בגידול באמצעות ציטומטריית זרימה מרובת פרמטרים. במאמר זה אנו מתארים פרוטוקול להומניזציה של עכברי BRGS, הערכת כימריזם, השתלת גידולים אנושיים, מדידות גדילת גידולים, מתן טיפול בסרטן וניתוח תאי HIS לפי ציטומטריית זרימה.
Protocol
כל העבודה בבעלי חיים בוצעה תחת פרוטוקולים של בעלי חיים שאושרו על ידי הוועדה המוסדית לטיפול ושימוש בבעלי חיים באוניברסיטת קולורדו דנוור (IACUC Protocols #00593 ו- #00021). כל עבודות בעלי החיים בוצעו בהתאם למשרד משאבי חיות מעבדה (OLAR), מתקן מוכר על ידי האגודה האמריקאית לטיפול בחיות מעבדה, בקמפוס הרפואי של אוניברסיטת קולורדו דנוור אנשוץ. כל דגימות הדם הטבורי האנושי התקבלו כתרומות מתורמים שזהותם הוסרה ולכן אינן כפופות לאישור ועדת האתיקה של המחקר האנושי.
הערה: הרכבי כל המדיות והפתרונות המוזכרים בפרוטוקול כלולים בקובץ משלים 1. איור 1 מדגים את הפרוטוקול הכולל ליצירה ולניתוח של תגובות חיסוניות לגידולים בעכברי HIS-BRGS.
1. דור העכברים שלו
- גידול עכברים של עכברי BALB/c -Rag2 null Il2RγCnull SirpαNOD (BRGS)
הערה: זן זה הוא בעל כשל חיסוני קיצוני, ללא תאי T, B או NK. לכן, יש להשתמש באמצעים מחמירים כדי למנוע זיהומים אופורטוניסטיים. לשמור על המושבה על דיאטה המכילה trimethoprim ו sulfadiazine על לוח זמנים לסירוגין 2 שבועות עם דיאטה רגילה. יש לשמור על חדר דיור ברמת הזהירות הגבוהה ביותר האפשרית (למשל, מתקן מקלחת מחסום עם גישה מוגבלת).- שמור על מושבות של עכברי BALB/c -Rag2 null Il2RγC null Sirpα NOD (BRGS) ו- BALB/c Rag2 null Il2RγC null Sirpa Balb/c (BRG) עכברים הומוזיגוטיים כמגדלים.
- גזע BRGS N/N×BRG B/B כדי ליצור גורי BRGSB/N, שישמשו כמושתלים של תאי גזע אנושיים. במושבה זו, BRGSB/N בריאים יותר מ-BRGS N/N, ומשתלים ברמות שוות ערך (יותר מ-BRG).
- CD34+ בידוד תאי גזע אנושיים מ- CB טבורי
הערה: לא נעשה שימוש באנטיביוטיקה עבור הליך זה. לכן, טכניקה סטרילית טובה היא הכרחית.- הניחו מתלה צינורות חרוטי 50 מ"ל, כמו גם צינורות חרוטיים 3x 15 מ"ל ו~ 10x 50 מ"ל בארון בטיחות ביולוגית מעוקר (BSC). רססו שקית איסוף דם עם 70% אתנול ותנו לה להתייבש ב-BSC.
- חשב את מספר הצינורות החרוטיים של 50 מ"ל הדרושים לבידוד שיפוע צפיפות CB = נפח CB/15, מעוגל כלפי מעלה למספר צינור זוגי. חישוב נפח דם לצינור = נפח CB / מספר צינורות. יוצקים דם בזהירות משקית CB לכל צינור חרוט; זהו מקסימום של 15 מ"ל לכל צינור. השתמש פיפטור אוטומטי פיפטה סרולוגית 25 מ"ל כדי לערבב את הדם 1: 1 עם PBS סטרילי על ידי pipeting למעלה ולמטה.
- השתמש בפיפטטור אוטומטי במהירות נמוכה ופיפטה סרולוגית של 10 מ"ל כדי לכסות את הדם באיטיות בתמיסת שיפוע צפיפות של 1.077 גרם / מ"ל בטמפרטורת החדר (ראה טבלת חומרים) מבלי להפריע לממשק. שמור על קצה פיפטה מלגעת בתחתית הצינור. חזור על הפעולה עבור כל הצינורות. לאחר מכן צנטריפוגה למשך 30 דקות ב 850 x גרם, ללא בלימה, ב- RT כדי להבטיח שמירה על שיפוע הצפיפות.
- דמיינו את שכבת הבאפי התאית על גבי שיפוע הצפיפות של 1.077 גרם/מ"ל כשכבה לבנה עכורה. יש להסיר ולהשליך את שכבת הפלזמה עד לכ-10 מ"ל מעל הפרווה הבאפית באמצעות פיפטה סרולוגית בנפח 25 מ"ל ופיפטור אוטומטי.
- אספו את המעיל האפי עם העברה סטרילית או פיפטה סרולוגית. השתמש פיפטה כמו מרית כדי לגרד את התאים מהצד של צינור חרוטי תוך שחרור הנורה (או pipetting לאט) כדי למשוך את התאים למעלה. שלב את המעילים הבאפיים משני צינורות חרוטיים של 50 מ"ל לצינור חרוטי חדש אחד של 50 מ"ל.
- לשטוף את התאים על ידי שפיכת 45 מ"ל של HBSS סטרילי המכיל 2% FBS לתוך כל צינור חרוט. צנטריפוגה למשך 11 דקות ב- 360 x גרם ב- RT.
- יש לשאוף את אמצעי השטיפה עד לגלולה בכל הצינורות. השתמש פיפטה סרולוגית 10 מ"ל פיפטור אוטומטי כדי להשעות מחדש את הגלולה הראשונה ב 10 מ"ל של HBSS המכיל 2% FBS. השהה מחדש כל גלולה באותו 10 מ"ל של HBSS, ושטוף כל צינור עם 10 מ"ל נוספים של HBSS כדי לאסוף את כל התאים לתוך צינור אחד.
- יוצקים 45 מ"ל של HBSS סטרילי המכיל 2% FBS בצינור החרוט. צנטריפוגה למשך 10 דקות ב 360 x גרם, ב 4 ° C.
- שאפו את חיץ השטיפה עד לגלולת התא והשהו מחדש את הגלולה ב-20 מ"ל של מאגר מפריד תאים מגנטי (ראו טבלת חומרים). הסר aliquot קטן כדי לספור את התאים עם hemacytometer בדילול 1:20 בכחול methylene. הוסף את מספר התאים הכחולים והלבנים. צנטריפוגה ב 360 x גרם, במשך 10 דקות ב 4 ° C.
הערה: פרוטוקול זה משתמש בטכנולוגיית חרוזים מגנטיים (ראה טבלת חומרים). ניתן לשנות את הפרוטוקול לשימוש עם כל טכנולוגיית הפרדת תאים, עם טוהר ותנובה מספיקים של תאי גזע CD34+. - שאפו את הסופרנאטנט והשהו מחדש את גלולת התא CD34+ שבודדה מדם טבורי ב 300 מיקרוליטר של מאגר מפריד תאים מגנטי לכל 1 x 108 תאים. הוסף 100 μL של מגיב חוסם FcR תחילה, ולאחר מכן 100 μL של CD34+ חרוזים מגנטיים לכל 1 x 108 תאים. יש לדגור בטמפרטורה של 4°C למשך 30 דקות (ללא קרח).
- הוסף 5 מ"ל של מאגר מפריד תאים מגנטי לכל 1 x 108 תאים וסחרור ב 360 x גרם במשך 10 דקות ב 4 ° C. חזור על שלב השטיפה והשהה מחדש את הגלולה ב 500 μL של מאגר מפריד תאים מגנטי לכל 1 x 108 תאים בצינור חרוטי 15 מ"ל שכותרתו "unfractionated".
- תווית שני צינורות חרוטי 15 מ"ל נוספים "CD34-" ו "CD34+". הניחו את שלושת הצינורות החרוטיים בנפח 15 מ"ל (ללא הפרקציה, CD34 ו-CD34+) לחריצים A1, B1 ו-C1, בהתאמה, על מדף קירור (ראו טבלת חומרים). הפרד את התאים באמצעות תוכנית הבחירה החיובית בת שתי העמודות במפריד תאים מגנטי אוטומטי (ראה טבלת חומרים) ב- BSC, בהתאם להוראות המכשיר של היצרן.
- הרחבה והקפאה של תאי גזע אנושיים CD34+
- Aliquot 10 μL של תרחיף התאים CD34+ התאושש (2 מ"ל) על שקופית hemocytometer ולספור את התאים תחת הגדלה 10x. חשב את המספר הכולל של תאי CD34+ על ידי הכפלת ספירת התאים ב- 2 x 104. חלק את מספר התאים הכולל של CD34+ ב- 250,000 כדי לחשב את מספר הבקבוקונים שיש להקפיא (50,000 תאים לכל גור עכבר לפני הרחבת המבחנה ).
- הכן CB בינוני FCS של 10% Iscove (בתוספת 1 מ"ל נוסף לאובדן סינון), בתוספת גורם תאי גזע 40 ng/mL, 20 ng/mL Flt3L ו- 10 ng/mL IL-6, ועבור דרך מסנן 0.22 מיקרומטר. להשהות מחדש את תאי CD34+ ב 100,000 לכל מ"ל של CB בינוני, ולדגור ב 37 ° C. ביום השלישי, הוסף נפח שווה ערך של מדיום CB ללא ציטוקינים לבקבוק המכיל את התאים ואת תווך CB עם ציטוקינים.
הערה: הוספת ציטוקינים אלה למדיום CB מקדמת הישרדות והרחבה של תאי CD34+ תוך מניעת התמיינות. - קצור את תאי CD34+ המורחבים ביום 5. פיפטה את תרחיף התא למעלה ולמטה ולאסוף בצינור חרוטי 50 מ"ל. מוסיפים מספיק CB בינוני כדי לכסות את החלק התחתון של הצלוחית. באמצעות מגרד התא, לגרד את כל החלק התחתון של הצלוחית. אסוף את כל המדיה לתוך אותו צינור 50 מ"ל, וצנטריפוגה ב 360 x גרם במשך 11 דקות.
- להשעות את התאים ב 2 מ"ל של מדיום CB. שומרים את הטיפה האחרונה מהפיפטה לצלחת של 96 בארות לספירה. לדלל את התאים 1:1 בכחול טריפאן ולהוסיף 10 μL להמאציטומטר, ולאחר מכן לספור וממוצע תאים מארבעה רבעים. חשב את המספר הכולל של תאי CD34+ על ידי הכפלת ספירת התאים ב- 4 x 104, ורשום את הכדאיות.
- צור n+1 מ"ל של מדיום הקפאה, כאשר n הוא מספר בקבוקוני ההקפאה המחושב בשלב 1.3.1. הכינו אמצעי הקפאה על ידי הוספת 10% (v/v) DMSO ל-FBS ושמרו על קרח. תייג את הקריובלים עם CB#, CD34+ d5 ותאריך.
- סובב את תאי CD34+ במהירות של 360 x גרם למשך 10 דקות ב- 4 ° C. שואפים את התווך עד לגלולה ומשעיפים מחדש את גלולת התא בתווך הקפאה. Aliquot 1 מ"ל של תרחיף תאים לכל בקבוקון ולחלק כל שארית שווה בין הבקבוקונים. הוסיפו את הבקבוקונים למקפיא תאי איזופרופנול מקורר ל-4°C, הניחו בטמפרטורה של -80°C והעבירו לחנקן נוזלי לאחסון למשך >90 יום.
- הקרנה של גורי עכברים
- אספו את גורי BRGSB/N , 1-3 ימים לאחר ההמלטה, לתוך קופסת פלסטיק אוטוקלאבית עם ריפוד. הוסיפו כמות קטנה של מצעים עם הגורים. תייגו את הקופסה עם מספר הכלוב ומספר הגורים.
- הגדר את המקרין (ראה טבלת חומרים) למנה של 300 ראד. הכניסו את קופסת הגורים למקרין וחשפו אותם ל-300 ראד. החזירו את הגורים לכלוב, הניחו אותם בערימה וכסו אותם במצעים.
- זריקות גור והכנת תאי CD34+
- התחל הכנת תאים CD34+ ~ 3 שעות לאחר הקרנה. חם 10 מ"ל של מדיה CB בצינור חרוטי 50 מ"ל. בצע את כל השלבים ב- BSC סטרילי.
- אחזר בקבוקון אחד של תאי CD34+ מורחבים וקפואים במבחנה לכל ארבעה עד שישה גורים להזרקה. הפשירו במהירות ב 55 מעלות צלזיוס, עד שרק כמות קטנה של קרח נראית לעין, והוסיפו את התאים למדיום CB המחומם (הבקבוקון עדיין צריך להיות קריר למגע). השתמש 1 מ"ל של בינוני כדי לשטוף כל בקבוקון ולסובב את התאים ב 360 x גרם במשך 12 דקות ב 4 ° C.
הערה: הפשרה מהירה ב-55°C נמצאה כמניבה כדאיות תאים טובה יותר (90%-95%) מאשר הפשרה ב-37°C. - שאפו את המדיום בזהירות. להשהות מחדש את הגלולה (הקטנה) ב 2 מ"ל של מדיה CB, לערבב בעדינות, ולהוסיף ~ 30 μL של תרחיף התא לבאר אחת בצלחת ספירה. לדלל 1:1 בכחול טריפאן, ואז להוסיף 10 μL להמוציטומטר ולספור ולממוצע את התאים מארבעה רבעים.
- חשב את המספר הכולל של תאי CD34+ על ידי הכפלת ספירת התאים ב- 4 x 104 ולאחר מכן רשום את הכדאיות. סחור ב 360 x גרם במשך 12 דקות ב 4 ° C.
- שאפו את המדיום בזהירות והשעו מחדש את כדורית התא ב-100 מיקרוליטר של PBS סטרילי לכל n+1 גורים להזרקה, והתוצאה היא 250,000-450,000 תאי CD34+ לכל עכבר. מניחים את הצינור החרוטי על קרח במיכל הובלה ונוסעים לוויבריום להזרקת גורים.
- הביאו מנורת חום, חיתולים, מזרק 1 מ"ל, מחט 18 גרם, מחט 30 גרם והכנת תא CD34+ במיכלים סטריליים לוויבריום BSC. מניחים חיתול סטרילי ~ 2 רגל מתחת למנורת החום. יש להחזיר את הכלוב עם הפסולת להזרקה ולהניח ב-BSC.
- להרכיב את המזרק עם מחט משופעת 18 גרם. התאמת זווית הצינור החרוטי עם שיפוע המחט, מערבבים בעדינות ומושכים את מתלה התא. הניחו את הגורים על החיתול לחימום (שימו לב להתחממות יתר). הסר אוויר מהמזרק והחלף את מחט 18 גרם במחט 30 גרם, ולאחר מכן דחוף בזהירות את המזרק עד שתרחיף התא נמצא רק בקצה המחט.
הערה: לחלופין, ניתן להשתמש במזרק אינסולין. - קחו גור אחד בכל פעם לקצה החיתול הרחק ממנורת החום. יש לשתק את הגור על צדו מתחת לאגודל ולאצבע, ולאפשר מבט ברור על הפנים. שימו לב לווריד על פני הלחי מתחת למקום שבו האוזן תהיה. הכנס את המחט באופן רדוד לתוך הווריד (IV) הקרוב ביותר לעין, ולהזריק לאט 50 μL של תאים.
- בדוק אם נוצרת בועה מהזרקה תת עורית. אם כן, הכנס את המחט עמוק יותר והמשך להזריק תאים. טיפה קטנה של דם/המטומה תיראה לעין כאשר תצליח.
הערה: עיין בהליך של Gombash Lampe et al.24 בנוגע להזרקת גור. - כאשר הגור עדיין משותק, בצע זריקה תוך כבדית (IH) עם עוד 50 μL של תאים (100 μL בסך הכל לכל גור של IV+IH). ניתן לדמיין את הכבד כנקודה כהה בין רצועת החלב הלבנה לכלוב בית החזה. הניחו את הגור המוזרק על חיתול רחוק יותר מהגורים שלא הוזרקו ומחממים.
הערה: הזרקת IV מביאה לכימריזם ארוך טווח טוב יותר מאשר הזרקת IH בלבד25, אך זריקות IV לא תמיד מצליחות. לכן, פיצול ההזרקה בין IV ל-IH מבטיח קליטה לאחוז גדול יותר של עכברים. - חזור על זריקות ורידים פנים ו- IH עבור כל הגורים. נקו כל דם, החזירו גורים לקן בכלוב שלהם וכסו במצעים.
2. בדיקת כימריזם אנושי בדם
- בדוק כימריזם בדמם של עכברי HIS בגיל 10 ו -14 שבועות. לאסוף 50 μL של דם דרך הווריד רטרו-אורביטלי או באמצעות שיטה חלופית שאושרה על ידי IACUC.
- לדימומים רטרו-מסלוליים, יש להרדים עכברים באמצעות וופורייזר איזופלורן המוגדר ל-5 למשך 1-2 דקות ולאחר מכן להנמיך את הגדרת הוופורייזר ל-4. כבו את מכשיר האידוי לפי הצורך כדי לאפשר לעכברים להישאר מחומצנים מספיק בזמן ההרדמה. אין להחזיק את העכברים מתחת לאיזופלורן למשך יותר מ-5 דקות.
- מניחים את אפו של העכבר המורדם לתוך חיבור חרוט האף של אידוי איזופלורן ומניחים טיפה של משכך כאבים (0.5% proparacaine HCl פתרון אופתלמי USP) על העין.
- לאחר 1 דקה, להסיר את proparacaine באמצעות גזה סטרילית, proptose את העין, ולהכניס צינור hematocrit heparinized 75 מ"מ רטרו אורביטלי לאסוף 50 μL של דם. להוציא את הדם לתוך צינור microfuge 1.5 מ"ל המכיל 50 μL של הפרין ולערבב בעדינות.
- צבוט את העין סגורה עם גזה סטרילית כדי לעצור את הדימום ולהחיל טיפה של proparacaine. הסר את העכבר מאיזופלורן והתאושש בכלוב נקי.
- בידוד PBMC מדם עכברים
- ערבבו את הדם/הפרין על ידי פיטום עדין למעלה ולמטה ושכבה איטית על גבי 500 μL של שיפוע צפיפות של 1.077 גרם/מ"ל, תוך זהירות שלא להפריע לממשק. צנטריפוגו את הצינורות במהירות של 1,220 x גרם למשך 20 דקות ב-RT ללא בלמים.
- דמיינו את מעטפת האפי התאית כשכבה עכורה על גבי שיפוע צפיפות של 1.077 גרם/מ"ל, מתחת לפלזמה. הסר כמה שיותר תאים מהפרווה הבאפית עם פיפטה של 200 מיקרוליטר והוסף לצינורות חדשים של 1.5 מ"ל המכילים 750 מיקרוליטר של מדיום הקציר. צנטריפוגה ב 360 x גרם במשך 11 דקות ב RT.
- שאפו את התווך עד 50 מיקרוליטר והשהו מחדש את הגלולה ב-750 מיקרוליטר של מדיום הקציר. צנטריפוגה ב 360 x גרם במשך 10 דקות ב 4 ° C, ולשאוף שוב למטה 50 μL. התאים מוכנים להשעיה מחדש בכתם פני השטח.
- צביעת פני שטח וניתוח ציטומטרי זרימה
- מלא את גליון העבודה של לוח הצביעה (טבלה 1; גליון עבודה "Spectral Flow Bleed Panel") עם מספרי עכברים והכן את קוקטייל צביעת הנוגדנים על ידי הוספת כל הנוגדנים הפלואורסצנטיים למאגר הצביעה (קובץ משלים 1). הכינו פריסת צלחת כדי להוסיף את הדגימות ללוח תחתון U בעל 96 בארות. סמן את תחתית הבארות באמצעות סמן קבוע. נוגדני טיטרט בהליך סטנדרטי לפני הצביעה לקביעת הריכוז המתאים26.
- הוסף 62 μL של קוקטייל כתמים פני השטח לכל באר של צלחת U 96 באר. להשעות מחדש את התאים ב 50 μL שנותרו בצינור ולהוסיף כל דגימה לבאר המתאימה שלה. כלול באר לבקרת צביעה חיובית (PBMCs אנושיים + טחול עכבר, 1 x 106 תאים כל אחד) כדי להכתים לצד הדגימות. מערבבים על ידי פיפטינג ודוגרים על התערובת במשך 15 דקות ב 4 מעלות צלזיוס.
- צנטריפוגה ב 680 x גרם במשך 3 דקות ב 4 ° C. העיפו את הצלחת לתוך הכיור כדי להסיר את הסופרנטנט, ושטפו את התאים על ידי השעיה מחדש של 150 מיקרוליטר של חיץ צביעה על ידי פיפטציה עדינה ~ 10x. סובבו והשעו מחדש כל באר ב-150 מיקרוליטר של חיץ צביעה.
- קבל את הנתונים עבור 100 μL של כל דגימה בציטומטר זרימה (ראה טבלת חומרים) וייצא את קובצי .fcs. יבא את קובצי ה- .fcs לתוכנה לעריכת נתוני זרימה (ראה טבלת חומרים). החל שער מצולע על תרשים FSC-A x SSC-A המקיף את התאים, למעט פסולת. בחר את התאים בתוך השער (ראה טבלה 1; גליון עבודה "Spectral Flow bleed gating").
- שנה את הצירים ל- (FSC-A x FSC-H) ושער את התאים הכלולים באלכסון הליניארי, למעט הכפילות הבולטות מהקו. בחר תאים אלה ושנה את הצירים ל- (hCD45 x mCD45).
- החל שער מצולע על אוכלוסיית hCD45+ והחל את השם "אדם". החל שער מצולע על אוכלוסיית mCD45+ והחל את השם "עכבר". צור סטטיסטיקת ספירה הן עבור אוכלוסיית האדם והן עבור אוכלוסיית העכברים.
- בחר את האוכלוסייה האנושית ושנה את הצירים ל- (CD19 x CD3). החל שער מצולע על תאי CD19+ וקרא לו "תאי B". החל שער מצולע על אוכלוסיית CD3+ וקרא לו "תאי T". החילו שער מצולע על האוכלוסייה השלילית הכפולה וקראו לה "NonTB".
- בחר את אוכלוסיית תאי T ושנה את הצירים ל- (CD8 x CD4). החל שער מצולע על אוכלוסיות CD4 ו- CD8 חיוביות וקרא להן "CD4+" ו- "CD8+", בהתאמה.
- בחר את אוכלוסיית NonTB ושנה את הצירים ל- (CD56 x myeloid). החל שער מצולע על כלל האוכלוסייה החיובית CD56 כולל האירועים החיוביים הכפולים וקרא לו "תאי NK". החל שער מצולע על האוכלוסייה CD56 שלילי ומיאלואיד חיובי וקרא לו "מיאלואיד".
- צור טבלה עבור סטטיסטיקת האחוזים והספירה של כל האוכלוסיות וייצא לתוכנת גיליון אלקטרוני (ראה טבלת חומרים). חישוב %hCD45 כימריזם = %hCD45/(%hCD45 + mCD45).
- לא לכלול עכברי HIS שהם <20% hCD45+ (של mCD45 + hCD45) לניסויים נוספים.
הערה: במחקר זה, PBMCs הוכנו באמצעות הפרדת שיפוע צפיפות של 1.077 גרם/מ"ל עבור דלדול RBC נקי יותר. הליך זה לא כלל גרנולוציטים אנושיים ועכבר משכבת PBMC. לחלופין, ניתן להשתמש בליזיס RBC.
3. הזרקת גידולים לעכברים
- לפני הזרקת הגידול, אשר את מספרי תאי T מנתוני הדימום של 14 שבועות. גידולים מוזרקים כדי להיות מוכנים לקציר בין 20-26 שבועות אם תאי T הם >20%, ובין 24-28 שבועות אם תאי T הם <20% מכלל אוכלוסיית תאי החיסון. תזמון הזרקה זה מבטיח שהעכברים יהיו בני 20-28 שבועות ויהיו להם מספר מספיק של תאי T בסוף המחקר.
- הזרקה של xenografts נגזר קו התא (CDX)
הערה: ההליך מתואר באמצעות תאי אדנוקרצינומה של השד MDA-MB-231 (ראה טבלת חומרים) כדוגמה.- הפשיר aliquot של תאים קפואים, לשטוף 1x על ידי resuspending ב 10 מ"ל של DMEM בתוספת 10% FBS, 1% PenStrep, ו 1% חומצות אמינו לא חיוניות, וצנטריפוגה ב 360 x גרם במשך 10 דקות ב 4 ° C. לשאוף את המדיום ולהשהות מחדש ב 10 מ"ל של DMEM בתוספת 10% FBS, 1% PenStrep, ו 1% חומצות אמינו לא חיוניות בבקבוק T25 לדגור ב 37 ° C עם 5% CO2.
הערה: קווי התאים מאומתים באמצעות PCR כדי להבטיח סוג תא נכון. סופרנאטנטים של תאים נבדקים עבור מיקופלסמה באמצעות בדיקה ביוכימית לפני ההזרקה. - מעבר והרחבה של התאים בשלב הצמיחה המעריכית במפגש של כ-80%.
- שאפו את המדיום, שטפו את התאים עם 5-10 מ"ל של PBS סטרילי (pH 7.2), ודגרו עם 1 מ"ל של 0.25% טריפסין-EDTA למשך 1-5 דקות עד שהתאים יתנתקו מהבקבוק.
- מוסיפים 5 מ"ל של אותו DMEM ומערבבים על ידי pipetting למעלה ולמטה. יש להעביר את כל 6 מ"ל תרחיף התאים לתרבית רקמה חדשה המטופלת בבקבוק T75 (דילול 1:3) ולהוסיף 10 מ"ל נוספים של DMEM.
- מעבר התאים כל 2-3 ימים במפגש של 80% בציפוי דילול 1:3 ב- DMEM כדי להרחיב את התאים.
- קצרו את התאים עם 0.25% טריפסין-EDTA במהלך שלב הגידול המעריכי בתוך שישה מעברים ושטפו עם PBS. מערבבים PBS ותמצית קרום מרתף (ראו טבלת חומרים) ביחס של 1:1 ומוסיפים לתאים בריכוז סופי של 5 x 107 תאים/מ"ל.
- להרדים את העכברים עם isoflurane כמתואר בשלב 2.1.1. תת עורית להזריק 100 μL (5 x 106 תאים) של תרחיף תאי הגידול לתוך כל צד באמצעות מחט 23 G.
- הפשיר aliquot של תאים קפואים, לשטוף 1x על ידי resuspending ב 10 מ"ל של DMEM בתוספת 10% FBS, 1% PenStrep, ו 1% חומצות אמינו לא חיוניות, וצנטריפוגה ב 360 x גרם במשך 10 דקות ב 4 ° C. לשאוף את המדיום ולהשהות מחדש ב 10 מ"ל של DMEM בתוספת 10% FBS, 1% PenStrep, ו 1% חומצות אמינו לא חיוניות בבקבוק T25 לדגור ב 37 ° C עם 5% CO2.
- בצע הזרקה של xenografts נגזר המטופל (PDX) באמצעות trocars. הליך ההזרקה והוראות פיתוח ותחזוקה אחרות לדגם PDX זמינים בספרות27.
4. מדידת צמיחת הגידול
- בדוק את התקדמות הגידול פעם בשבוע לאחר ההשתלה על ידי תחושה לאורך האגף לצמיחת הגידול. ברגע שהגידולים מוחשיים, מרדימים את העכברים עם איזופלורן (כמתואר בשלב 2.1.1) ומגלחים בכל צד עם גוזם חשמלי, תוך הקפדה סביב הגידול כדי למנוע כיבים ככל שהגידול גדל.
הערה: ניתן לגלח עכברים לפני הזרקת הגידול כדי למנוע פציעות בעור סביב הגידולים; עם זאת, קצב צמיחת השיער מחדש עלול לחסום את מדידות הגידול. - למדוד את אורך ורוחב הגידולים פעמיים בשבוע באמצעות קליפרים ולרשום את המדידות במ"מ. דווח על מדידות הגידול כנפח הגידול (מ"מ3) באמצעות הנוסחה
 . יש להקפיד שלא לאפשר לנטל הגידול לעלות על 2,000 מ"מ 3 לכל גידול בודד או נפח משולב של 3,000 מ"מ3.
. יש להקפיד שלא לאפשר לנטל הגידול לעלות על 2,000 מ"מ 3 לכל גידול בודד או נפח משולב של 3,000 מ"מ3.
הערה: ההנחיות לשימוש בעכברים בחקר הסרטן משתנות בהתאם למיקום. אנא עיין במדיניות טיפול ושימוש בבעלי חיים במוסד החוקר.
5. טיפולים תרופתיים
- הקצו את עכברי HIS לקבוצות טיפול שוות ערך המבוססות על כימריזם hCD45, כימריזם hCD3 וכימריזם hCD8. ברגע שהגידולים מגיעים ל-100 מ"מ3 בממוצע, מתחילים בטיפולים תרופתיים.
הערה: מספר העכברים לקבוצה מבוסס על מספר עכברי HIS שנוצרו מה-CB. מומלץ לפחות ארבעה עכברים בכל קבוצה. התאמת קבוצות מרובות לא דו-צדדיות (למשל, בתוכנת R-vivo Manila) שימושית עבור קיבוץזה 28. - מסלול ותדירות סמים
- הזריקו מעכבי אנטי-PD-1 (nivolumab, pembrolizumab) באופן תוך-צפקי (i.p.) במינון של 30 מ"ג/ק"ג פעם אחת בשבוע או 20 מ"ג/ק"ג פעמיים בשבוע עבור טיפולים בודדים, או 10-15 מ"ג/ק"ג פעמיים בשבוע עבור טיפולים משולבים.
- מינון הטיפולים המשולבים, כגון טיפולים ממוקדים, כימותרפיות והקרנות, בהתאם לתכנון הניסוי. טיפולים ממוקדים וכימותרפיות יכולים להינתן באמצעות gavage אוראלי, i.p. הזרקה, או מזון.
הערה: ניתן לגוון את המינונים ולייעל אותם בהתאם לנתונים שפורסמו ולמודל הגידול. מחקרי מינון נבדקים לעתים קרובות בקרב מושתלים מדוכאי חיסון לפני מחקרי עכברי HIS .
- עקוב אחר העכברים לפחות 3 פעמים בשבוע לשינויים בריאותיים כגון ירידה במשקל, צואה רופפת, יציבה כפופה, ניידות מופחתת ונשירת פרווה. חלק מהתסמינים יכולים להיות סימנים של רעילות סמים או GVHD, ומינון התרופות עשוי להזדקק להפחתה או להפסקה. יש להרדים עכברים לפי הצורך בהתאם למדיניות הטיפול והשימוש בבעלי חיים.
6. קצירת רקמות עכברים וגידולים בסוף המחקר
- יש להרדים את העכברים בנפרד על פי הנחיות מוסדיות ווטרינריות באמצעות גזCO2 דחוס עם קצב זרימה של 2.75 ליטר/דקה. עקוב אחר העכברים המוחזקים ב- CO2 במשך דקה אחת לאחר המוות ולאחר מכן בצע נקע צוואר הרחם כצורה משנית של המתת חסד.
- איסוף דם
- לאסוף דם באמצעות ניקוב תוך לבבי. החזק את העכבר במצב זקוף והכנס מזרק 1 מ"ל עם מחט 25 G ישירות לתוך הלב מקו משמאל לקו האמצע ומתחת לצלעות. לאסוף את הדם לתוך מזרק באופן אידיאלי דרך משיכה אחת ארוכה ולהעביר לתוך צינור מסומן 1.5 מ"ל.
הערה: ניתן לבצע החדרת מחטים נוספות כדי לאסוף דם נוסף מזוויות חלל הריאה בזהירות. - השאר את הדם ב 4 ° C במשך 1 שעה, ולאחר מכן צנטריפוגה את הדם במיקרוצנטריפוגה במשך 6 דקות ב 7,800 x גרם. אספו את הנוזל השקוף (sera) מעל ממשק הדם לצינור שני נקי ומסומן 1.5 מ"ל. אחסנו את הסרום בטמפרטורה של -20°C לניתוח במורד הזרם, כגון ציטוקינים דלקתיים בבני אדם ובעכברים או טיטרים אימונוגלובולינים.
- לאסוף דם באמצעות ניקוב תוך לבבי. החזק את העכבר במצב זקוף והכנס מזרק 1 מ"ל עם מחט 25 G ישירות לתוך הלב מקו משמאל לקו האמצע ומתחת לצלעות. לאסוף את הדם לתוך מזרק באופן אידיאלי דרך משיכה אחת ארוכה ולהעביר לתוך צינור מסומן 1.5 מ"ל.
- דיסקציה של רקמות
- לאחר הזרקה וצמיחה של תאים סרטניים בעכברים ומתן טיפולים תרופתיים, לקצור את הרקמות. הניחו את העכברים על לוח דיסקציה מוקצף, עם פינים שיחזיקו אותם במקומם, והידיים והרגליים יושיטו בזוויות של 45°. בצע חתך באמצע פלג הגוף העליון, החל ליד האגן ונמשך עד הסנטר, מנסה להימנע חיתוך הצפק (אם כי זה לא חיוני). משוך את העור לקצה והחזק במקומו עם סיכות.
- חלץ את בלוטות הלימפה (LNs) באמצעות מלקחיים עדינים בסדר הבא: מפשעתי, בית השחי, צוואר הרחם, mesenteric, hiatal.
הערה: אצל העכברים שלו, ה-LNs הם לעתים קרובות קטנים מאוד, דומים לאנלאז', או "מודלקים" עם מראה שונה מזה של עכבר מסוג פרא. לכן, רקמות הדומות LNs נלקח מכל אתר. ה- LN ההיקפי מופיע לעתים קרובות כ"כדורים" מלאים בנוזל, בעוד שה- LN המזנטריים צפופים יותר. ה- LN המזנטרי הוא הברור והעקבי ביותר ונצפה כצומת אחד או שניים צפופים נפרדים, בניגוד למיתר. - הניחו את ה-LN בצד אחד של מגלשות זכוכית חלבית ב-8 מ"ל של מדיום קציר בצלחת פטרי. מחזיקים את המגלשות בזוויות ניצבות עם הקצוות החלביים פנימה, לוחצים בעדינות על הרקמות עד לשחרור התוכן הסלולרי.
- שטפו את המגלשות מספר פעמים על ידי מפרידתן זו מזו ויחד כדי לשחרר את כמות התאים המרבית. אספו את התאים עם פיפטה מזכוכית בגודל 5 אינץ' וסננו אותם דרך פיפטה מחוברת כותנה 9 לצינור חרוטי מסומן של 15 מ"ל.
- חלצו את הטחול מהצד השמאלי העליון של הבטן באמצעות שני זוגות מלקחיים או מלקחיים ומספריים. שימו לב לגודל הטחול כאומדן לנפח אמצעי התלייה. לאסוף ולסנן את הטחול על ידי עיכול מכני באמצעות שקופיות זכוכית חלבית, כמו עם LNs.
הערה: ניתן להשתמש בכל טכניקה להכנת רקמות להשעיות של תא בודד. - לבצע ספירה והשעיה של התאים מדגימות רקמה כמתואר להלן.
- צנטריפוגה את תאי הלימפה ב 360 x גרם במשך 10 דקות ב 4 °C. שאפו את הנוזל והשעו מחדש את גלולת התא ב 1 מ"ל של מדיום הקציר עם DNase.
- הסר אריתרוציטים מתאי הטחול על ידי דגירה עם 3 מ"ל של חיץ ליזיס ACK ב- RT למשך 3 דקות, ואחריו תוספת של 10 מ"ל של מדיום הקציר / DNase. צנטריפוגו שוב את תאי הטחול, שאפו את הסופר-נטנט, והשהו מחדש את התאים ב-1-10 מ"ל של מדיית הקציר/DNase, בהתבסס על גודל הטחול (למשל, 1 מ"ל לטחול קטן מאוד ועד 10 מ"ל לטחול הגדול ביותר).
- הוסף aliquot 10 μL של תרחיף התא ל 90 μL של מדיה ולסמוך על המוציטומטר. צנטריפוגות את תאי ה-LN והטחול, שואפים את הסופרנאטנטים, ומרחפים מחדש את התאים במדיום הקציר בריכוז של 1 x 108 תאים/מ"ל, או מינימום של 80 מיקרוליטר.
- לחלץ את הגידולים.
- הסר את הגידול מהאגף הפתוח על ידי החזקת הגידול במלקחיים תוך חיתוך איטי בשולי הגידול עם מספריים לנתיחה.
- לאחר הסרת הגידול, שקלו אותו והסירו 1/4 לצורך עיבוד RNA ואימונוהיסטוכימיה (IHC). לחלק את הגידול 1/4 לשניים; מניחים מחצית אחת (1/8 מהגידול כולו) בהקפאת הבזק בנוזל N2, ומאחסנים בטמפרטורה של -80°C למחקרים גנומיים במורד הזרם.
- הניחו את 1/8 הנותרים של הגידול בצינור דגימה מסומן המכיל 10% פורמלין. למחרת, שטפו והשעו מחדש את הרקמה באתנול 70% עד לשימוש עתידי. מניחים את 3/4 הגידול הנותרים לתוך צלחת 6 ס"מ וטוחנים לחתיכות ~ 1 מ"מ באמצעות להב אזמל.
- מעבירים את חתיכות הגידול לתוך צינור דיסוציאציה (ראו טבלת חומרים), שוטפים את הכלי עם 5 מ"ל של תווך גידול לא שלם החודר לויקוציטים (TIL), ומוסיפים לצינור הדיסוציאציה.
הערה: עבור גידולים במשקל >0.4 גרם, שטפו את הכלי עם 10 מ"ל של מדיה לא שלמה של TIL והוסיפו לצינור דיסוציאציה. - מוסיפים תכשיר collagenase (ראה טבלת חומרים) בריכוז סופי של 50 מ"ג / מ"ל לרקמה בצינור הדיסוציאציה. נתק את הרקמה באמצעות דיסוציאציה מכנית ב 37 ° C למשך 30 דקות עד 1 שעות, בהתאם מוצקות הגידול.
- לאחר הדיסוציאציה, העבירו את המתלה מעל מסנן של 100 מיקרומטר לתוך צינור חרוטי של 50 מ"ל ושטפו את המסנן עם 10 מ"ל של מדיה מלאה של TIL. הסרום במדיה זו יעצור את תגובת הקולגנאז ויגן על התאים מפני פירוק נוסף.
- צנטריפוגה את מתלה התא היחיד ב 360 x גרם במשך 10 דקות ב 4 ° C. השהה מחדש את הגלולה באמצעי קציר מספיק עם DNase כך שתרחיף התא יוכל לעבור בקלות דרך קצה פיפטה P1000 ולהקליט את עוצמת הקול לניתוח במורד הזרם.
הערה: נפח קטן יותר מגדיל את אוסף תאי החיסון של הגידול, אך רגיש יותר לסתימות ציטומטר זרימה.
7. צביעת תאים וניתוחים ציטומטריים של זרימה
- הכנת כתמים וציפוי תאים
- הכינו קוקטיילים לצביעה: ביום הקטיף, הוסיפו את מספר הדגימות לגליון העבודה של צביעה (טבלה 2; גליונות עבודה מסוג "Conventional Flow A", "Spectral Flow B" ו-"Conventional Flow C panel") עבור כל הכתמים וההדפסה. הכינו קוקטיילים לכתמים A ו-B בחיץ הצביעה (SB) על ידי הוספת כל נוגדן בנפרד עם קצה חדש, סימון כל מגיב תוך כדי תנועה, ואחסנו בטמפרטורה של 4°C עד לצורך. הכינו את צבעי הכדאיות המתאימים ב-PBS נטול אזיד ואחסנו בטמפרטורה של 4°C עד לצורך (חממו ל-RT לפני השימוש). הכינו קוקטייל כתמים C ביום השני ב-SB יחד עם כתמים תוך-תאיים B ו-C במאגרי החדירה המתאימים שלהם.
- צור פריסת לוחות עבור כל הדגימות בגליון העבודה של צביעה ו- aliquot 100 μL של PBS ללא אזיד לבארות. כלול פקדים לא מוכתמים עבור כל רקמה וכתם (עבור ציטומטריה ספקטרלית).
- הוסף את התאים ללוחות 96 בארות המכילים 50 μL של PBS. עבור כתם A, יש להשהות מחדש כל קבוצת רקמות בנפח המתאים, כפי שמצוין בגליון העבודה של הצביעה, ולאחסן בטמפרטורה של 4°C עד לרכישה על ציטומטר זרימה באותו יום. עבור כתמים B ו- C, הוסף 25 μL של לימפה ו 60 μL של תאים רקמה שאינם לימפה מתלים לבארות עם PBS.
- ביצוע גירוי חוץ גופי של ציטוקינים לזיהוי על ידי צביעה תוך תאית באמצעות כתם C.
- צנטריפוגה את צלחת הכתם C 96-well משלב 7.1.3 ב 680 x גרם במשך 3 דקות ב 4 ° C. הוסף 200 μL של מדיה מלאה TIL (RPMI 1640, 10 mM HEPES [pH 7], 10% FBS) לכל באר. אחסנו את הצלחת עם מתלה התא בטמפרטורה של 4°C למשך הלילה.
- מוקדם בבוקר שלמחרת, דללו את קוקטייל גירוי התא (ראו טבלת חומרים) בקנ"מ 1:500 במדיית TIL מלאה. צנטריפוגה את הצלחת המכילה את תרחיף התא ב 680 x גרם כדי לגלול את התאים ולהעיף כדי להסיר את המדיה. להשהות מחדש את התאים ב 200 μL של קוקטייל גירוי התא מוכן לדגור ב 37 ° C במשך 1 שעה.
- הוסף 25 μL של תמיסת מעכבי העברת חלבונים המכילה מוננסין בדילול של 1:1,000 במדיית TIL מלאה, ערבב את התאים ודגר ב-37°C למשך 4 שעות נוספות כדי לאפשר הצטברות תוך-תאית של ציטוקינים.
- בצע צביעת תאים.
- עבור כתמים A ו- B (יום 1), ועבור כתמים C (יום 2), צנטריפוגה ב 680 x גרם במשך 3 דקות ב 4 ° C. מעבירים את הצלחות ומוסיפים את צבעי הכדאיות המתאימים לבארות. מערבבים היטב על ידי פיפטה עדינה למעלה ולמטה עם פיפטה רב ערוצית ודגרים במשך 15 דקות ב- RT.
- צנטריפוגו את הצלחות (כמו בשלב 7.1.5.1), לאחר מכן הוסיפו כתמי משטח מתאימים לצלחות וערבבו בעדינות על ידי פיפטה רב ערוצית. יש לדגור במשך 15 דקות ב-4°C ולצנטריפוגה שוב. להעיף את הצלחות, לשטוף את התאים על ידי pipeting בעדינות למעלה ולמטה עם 150 μL של SB, וצנטריפוגה.
- החלק את הצלחות, חזור על השטיפה על ידי פיטום עדין למעלה ולמטה עם 150 μL של SB, וצנטריפוגה ב 680 x גרם במשך 3 דקות ב 4 ° C. עבור כתם A, השהה מחדש כל קבוצת רקמות בנפח המתאים, כפי שצוין בדף העבודה של הצביעה, ואחסן בטמפרטורה של 4°C. עבור כתם B, תקן עם ערכת גורם שעתוק FoxP3 מקבע (ראה טבלת חומרים) למשך 30 דקות ב- RT. עבור כתם C, תקן 1% (v/v) paraformaldehyde ב- SB למשך 30 דקות ב- RT.
- צנטריפוגה את הלוחות הקבועים ב 480 x גרם במשך 3 דקות ב 4 ° C. יש לכבס פעם אחת ב-SB. עבור כתם B, ניתן להשאיר את התאים למשך הלילה.
- חדיר את התאים: השהה מחדש את הבארות ב 150 μL של ערכת גורם שעתוק FoxP3 חיץ חדירה עבור כתם B וב 0.5% (w/v) saponin ב SB עבור Stain C. לדגור במשך 15 דקות ב RT. צנטריפוגה את הלוחות הקבועים ב 480 x גרם במשך 3 דקות ב 4 ° C.
- העיפו את הצלחות והוסיפו את קוקטיילים הצביעה התוך-תאיים המתאימים לכתם B וכתם C. דגרו במשך 30 דקות ב-RT.
- צנטריפוגו את הלוחות הקבועים ב 480 x גרם במשך 3 דקות ב 4 ° C ו להעיף את הצלחות. לשטוף את התאים עם 150 μL של מאגרי permeabilization המתאים (כתם B, FoxP3 transcription factor kit permeabilization buffer; כתם C, saponin).
- החלק את הצלחות ושטוף על ידי פיפטציה למעלה ולמטה ב 150 μL של SB. צנטריפוגה ב 480 x גרם במשך 3 דקות ב 4 ° C. החלק את הלוחות והשהה מחדש את התאים ב- SB לפי קבוצת רקמות באמצעי האחסון המתאימים שצוינו בגליון העבודה של צביעה.
הערה: הדגימות מוכנות כעת לרכישה על ידי ציטומטריית זרימה ספקטרלית. - הגדר את ציטומטר הזרימה (ראה טבלת חומרים) עם פקדים מוכתמים בודדים מתאימים עבור כל כתם ודגימות לא מוכתמות עבור כל קבוצת רקמה כדי להסביר הבדלים באוטופלואורסצנטיות במהלך הערבוב. השג את אמצעי האחסון המתאימים לכל קבוצת רקמות כפי שהוגדרו בגליון העבודה של צביעה (טבלה 2) וייצא את קבצי ה- .fcs.
- ניתוח נתוני ציטומטריה של זרימה
- באמצעות התוכנה לניתוח ציטומטריית זרימה (ראה טבלת חומרים), צור סביבת עבודה חדשה. צור קבוצות חדשות עבור כל איבר (LN, טחול ו- TIL). יבא את קבצי ה- .fcs עבור כל איבר לקבוצה.
- צור תרשים נקודות דו-משתני, הגדר את הצירים ל- (FSC-A x SSC-A) והחל שער מצולע על אירועים תאיים, תוך הימנעות מאירועים בקצוות (שער כל התאים). בחרו באירועים התאיים, שנו את הצירים ל- (FSC-A x FSC-H) והחילו שער מצולע על האירועים באלכסון הליניארי, למעט אירועים החורגים מהאלכסון ליצירת שער הסינגלטים. בחר את שער "סינגלים" ושנה את הצירים ל- (hCD45 x mCD45). החל שערי מצולע על האירועים החיוביים hCD45 ו- mCD45, וקרא להם "אדם" ו"עכבר", בהתאמה.
- בחר את האוכלוסייה האנושית ושנה את ציר ה- Y ל- Live / Dead Aqua. החל שער מצולע על האוכלוסייה השלילית חי/מת, hCD45 חיובי וקרא לה "אדם חי". בחר את אוכלוסיית העכבר ושנה את ציר ה- X ל- Live/Dead Aqua. החל שער מצולע על האוכלוסייה השלילית החיה/מתה, mCD45 חיובית וקרא לה "עכבר חי".
- באופן דומה, בחר את שער האב ואת צירי X ו- Y כמתואר בגליונות העבודה "Conventional Flow A Gating", "Spectral Flow B Gating" ו- "Conventional Flow C Gating" (טבלה 2) כדי לבודד את האוכלוסיות שצוינו (לדוגמה, תאי B אנושיים, תאי T פעילים).
הערה: גזירה מייצגת עבור כל כתם (Bleed, A, B, C) כלולה בקובץ משלים 2. - צור טבלאות ייצוא ספירה ותדירות בתוכנת ניתוח ציטומטריית זרימה לכל האוכלוסיות וייצא לתוכנת גיליון אלקטרוני. אוכלוסיית האב לתדרים מצוינת בלוח 2.
- השתמש בנתונים כדי ליצור גרפים המבוססים על קבוצות טיפול ניסיוניות.
הערה: ניתן לנתח את הנתונים גם באמצעות חבילות R בתוכנת הניתוח. ניתן ליצור קובץ .fcs יחיד מכל הדגימות שיש לנתח באמצעות התכונה 'שרשור'. ניתן להפחית נתונים אלה באופן ממדי באמצעות אלגוריתם T-SNE תוך הוספת פרמטרים של מילות מפתח עבור סוג הרקמה וקבוצת הטיפול. לאחר מכן ניתן להשתמש באלגוריתם FlowSOM כדי לקבץ אוכלוסיות ולהשתמש בכלי ClusterExplorer כדי לזהות את האוכלוסיות. ניתן לזהות אוכלוסיות תאים חדשות באופן זה, להשוות חזותית ולכמת בין קבוצות טיפול או בתוך רקמות שונות. - מתאם פרמטרים חיסוניים לגידולים באותה קבוצת טיפול, עם הגידול עבור אותו גידול כדי להגדיר אימונוטיפים המתואמים עם עיכוב צמיחת הגידול. כמת את צמיחת הגידול לפי קצב הגידול הספציפי (SGR) עבור אותו גידול, מדידה הלוקחת בחשבון את ההבדל בנפחי הגידול על פני זמן מוגדר. מדידה זו מנרמלת גידולים שנקצרו בימים שונים עקב בריאות העכבר ותאריכי תחילת הטיפול.
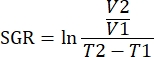
תוצאות
בעקבות פרוטוקול הגידול האגפי וציר הזמן הניסויי (איור 1), צמיחת הגידול והתגובה החיסונית לטיפול ממוקד מעכב טירוזין קינאז (TKI) ולטיפול משולב בניבולומאב נחקרו בשני PDX שונים של סרטן המעי הגס האנושי (CRC). תרופות TKI נחקרו בפונדקאים מדוכאי חיסון כדי להעריך את צמיחת הגידול רק...
Discussion
במהלך 6 השנים האחרונות, תוך שימוש במומחיות שלנו הן באימונולוגיה והן בעכברים אנושיים, צוות המחקר שלנו פיתח מודל פרה-קליני נחוץ מאוד לבדיקת אימונותרפיה על מגוון גידולים אנושיים 3,7,30,31. פרוטוקול זה מדגיש את ההתחשבות בשונות...
Disclosures
ללא.
Acknowledgements
ברצוננו להודות הן למתקן לחקר בעלי חיים (OLAR) על הטיפול בעכברים שלנו, והן למשאב המשותף של Flow Cytometry הנתמך על ידי מענק התמיכה של מרכז הסרטן (P30CA046934) במכון שלנו על עזרתם העצומה בכל עבודתנו. אנו מודים גם לגייל אקהרדט ולאנה קאפאסו על שיתוף הפעולה הראשון שלנו בחקר אימונותרפיה לחולי PDX אנושיים במודל HIS-BRGS שלנו. מחקר זה נתמך בחלקו על ידי מענק התמיכה של מרכז הסרטן P30CA06934 של המכונים הלאומיים לבריאות עם שימוש במשאב המשותף PHISM (מודלים פרה-קליניים של עכברי מערכת החיסון האנושית), RRID: SCR_021990 ו- Flow Cytometry Shared Resource, RRID: SCR_022035. מחקר זה נתמך בחלקו על ידי NIAID של המכונים הלאומיים לבריאות תחת חוזה מספר 75N93020C00058.
Materials
| Name | Company | Catalog Number | Comments |
| 1 mL syringe w/needles | McKesson | 1031815 | |
| 15 mL tubes | Grenier Bio-One | 188271 | |
| 2-mercaptoethanol | Sigma | M6250 | |
| 50 mL tubes | Grenier Bio-One | 227261 | |
| AutoMACS Pro Separator | Miltenyi | 130-092-545 | |
| BD Golgi Stop Protein Transport Inhibitor with monensin | BD Bioscience | BDB563792 | |
| BSA | Fisher Scientific | BP1600100 | |
| Cell Stim Cocktail | Life Technologies | 509305 | |
| Chill 15 Rack | Miltenyi | 130-092-952 | |
| Cotton-plugged glass pipettes | Fisher Scientific | 13-678-8B | |
| Cultrex Basement membrane extract | R&D Systems | 363200502 | |
| Cytek Aurora | Cytek | ||
| DNase | Sigma | 9003-98-9 | |
| eBioscience FoxP3/Transcription Factor Staining Buffer Set | Invitrogen | 00-5523-00 | |
| Embryonic Stemcell FCS | Gibco | 10439001 | |
| Eppendorf Tubes; 1.5 mL volume | Grenier Bio-One | 616201 | |
| Excel | Microsoft | ||
| FBS | Benchmark | 100-106 500mL | |
| Ficoll Hypaque | GE Healthcare | 45001752 | |
| FlowJo Software | BD Biosciences | ||
| Forceps - fine | Roboz Surgical | RS5045 | |
| Forceps normal | Dumont | RS4919 | |
| Formaldehyde | Fisher | F75P1GAL | |
| Frosted Glass Slides | Corning | 1255310 | |
| Gentlemacs C-Tubes | Miltenyi | 130-096-334 | |
| GentleMACS Dissociator | Miltenyi | 130-093-235 | |
| glass pipettes | DWK Life Sciences | 63A53 | |
| Glutamax | Gibco | 11140050 | |
| HBSS w/ Ca & Mg | Sigma | 55037C | |
| HEPES | Corning | MT25060CI | |
| IgG standard | Sigma | I2511 | |
| IgM standard | Sigma | 401108 | |
| IMDM | Gibco | 12440053 | |
| Liberase DL | Roche | 5466202001 | |
| LIVE/DEAD Fixable Blue | Thermo | L23105 | |
| MDA-MB-231 | ATCC | HTB-26 | |
| MEM | Gibco | 1140050 | |
| mouse anti-human IgG-AP | Southern Biotech | JDC-10 | |
| mouse anti-human IgG-unabeled | Southern Biotech | H2 | |
| mouse anti-human IgM-AP | Southern Biotech | UHB | |
| mouse anti-human IgM-unlabeled | Southern Biotech | SA-DA4 | |
| MultiRad 350 | Precision X-Ray | ||
| PBS | Corning | 45000-446 | |
| Pen Strep | Gibco | 15140122 | |
| Petri Dishes | Fisher Scientific | FB0875713A | |
| p-nitrophenyl substrate | Thermo | 34045 | |
| PRISM | Graphpad | ||
| Rec Hu FLT3L | R&D systems | 308-FK-005/CF | |
| Rec Hu IL6 | R&D systems | 206-IL-010/CF | |
| Rec Hu SCF | R&D systems | 255SC010 | |
| RPMI 1640 | Corning | 45000-39 | |
| Saponin | Sigma | 8047-15-2 | |
| Scissors | McKesson | 862945 | |
| Serological pipettes 25 mL | Fisher Scientific | 1367811 | |
| Sterile filter | Nalgene | 567-0020 | |
| Sterile molecular water | Sigma | 7732-18-5 | |
| Yeti Cell Analyzer | Bio-Rad | 12004279 | |
| Zombie Green | biolegend | 423112 |
References
- Chulpanova, D. S., Kitaeva, K. V., Rutland, C. S., Rizvanov, A. A., Solovyeva, V. V. Mouse tumor models for advanced cancer immunotherapy. International Journal of Molecular Sciences. 21 (11), 4118 (2020).
- Olson, B., Li, Y., Lin, Y., Liu, E. T., Patnaik, A. Mouse models for cancer immunotherapy research. Cancer Discovery. 8 (11), 1358-1365 (2018).
- Marin-Jimenez, J. A., et al. Testing cancer immunotherapy in a human immune system mouse model: correlating treatment responses to human chimerism, therapeutic variables and immune cell phenotypes. Frontiers in Immunology. 12, 607282 (2021).
- Yin, L., Wang, X. J., Chen, D. X., Liu, X. N., Wang, X. J. Humanized mouse model: a review on preclinical applications for cancer immunotherapy. American Journal of Cancer Research. 10 (12), 4568-4584 (2020).
- Cogels, M. M., et al. Humanized mice as a valuable pre-clinical model for cancer immunotherapy research. Frontiers in Oncology. 11, 784947 (2021).
- Jin, K. T., et al. Development of humanized mouse with patient-derived xenografts for cancer immunotherapy studies: A comprehensive review. Cancer Science. 112 (7), 2592-2606 (2021).
- Capasso, A., et al. Characterization of immune responses to anti-PD-1 mono and combination immunotherapy in hematopoietic humanized mice implanted with tumor xenografts. Journal for Immunotherapy of Cancer. 7 (1), 37 (2019).
- Wang, M., et al. Humanized mice in studying efficacy and mechanisms of PD-1-targeted cancer immunotherapy. The FASEB Journal. 32 (3), 1537-1549 (2018).
- Yong, K. S. M., et al. Humanized mouse as a tool to predict immunotoxicity of human biologics. Frontiers in Immunology. 11, 553362 (2020).
- Shen, H. W., Jiang, X. L., Gonzalez, F. J., Yu, A. M. Humanized transgenic mouse models for drug metabolism and pharmacokinetic research. Current Drug Metabolism. 12 (10), 997-1006 (2011).
- Bosma, G. C., Custer, R. P., Bosma, M. J. A severe combined immunodeficiency mutation in the mouse. Nature. 301 (5900), 527-530 (1983).
- Shultz, L. D., et al. Multiple defects in innate and adaptive immunologic function in NOD/LtSz-scid mice. The Journal of Immunology. 154 (1), 180-191 (1995).
- Legrand, N., et al. Functional CD47/signal regulatory protein alpha (SIRP(alpha)) interaction is required for optimal human T- and natural killer- (NK) cell homeostasis in vivo. Proceedings of the National Academy of Sciences. 108 (32), 13224-13229 (2011).
- Ishikawa, F., et al. Development of functional human blood and immune systems in NOD/SCID/IL2 receptor {gamma} chain(null) mice. Blood. 106 (5), 1565-1573 (2005).
- Ito, M., et al. NOD/SCID/gamma(c)(null) mouse: an excellent recipient mouse model for engraftment of human cells. Blood. 100 (9), 3175-3182 (2002).
- Shultz, L. D., et al. Human lymphoid and myeloid cell development in NOD/LtSz-scid IL2R gamma null mice engrafted with mobilized human hemopoietic stem cells. The Journal of Immunology. 174 (10), 6477-6489 (2005).
- Traggiai, E., et al. Development of a human adaptive immune system in cord blood cell-transplanted mice. Science. 304 (5667), 104-107 (2004).
- Theocharides, A. P., Rongvaux, A., Fritsch, K., Flavell, R. A., Manz, M. G. Humanized hemato-lymphoid system mice. Haematologica. 101 (1), 5-19 (2016).
- Goldman, J. P., et al. Enhanced human cell engraftment in mice deficient in RAG2 and the common cytokine receptor gamma chain. British Journal of Haematology. 103 (2), 335-342 (1998).
- Stripecke, R., et al. Innovations, challenges, and minimal information for standardization of humanized mice. EMBO Molecular Medicine. 12 (7), (2020).
- Allen, T. M., et al. Humanized immune system mouse models: progress, challenges and opportunities. Nature Immunology. 20 (7), 770-774 (2019).
- Gammelgaard, O. L., Terp, M. G., Preiss, B., Ditzel, H. J. Human cancer evolution in the context of a human immune system in mice. Molecular Oncology. 12 (10), 1797-1810 (2018).
- Rios-Doria, J., Stevens, C., Maddage, C., Lasky, K., Koblish, H. K. Characterization of human cancer xenografts in humanized mice. Journal for Immunotherapy of Cancer. 8 (1), 000416 (2020).
- Gombash Lampe, S. E., Kaspar, B. K., Foust, K. D. Intravenous injections in neonatal mice. Journal of Visualized Experiments. (93), e52037 (2014).
- Lang, J., Weiss, N., Freed, B. M., Torres, R. M., Pelanda, R. Generation of hematopoietic humanized mice in the newborn BALB/c-Rag2null Il2rγnull mouse model: a multivariable optimization approach. Clinical Immunology. 140 (1), 102-116 (2011).
- Laskowski, T. J., Hazen, A. L., Collazo, R. S., Haviland, D. Rigor and reproducibility of cytometry practices for immuno-oncology: a multifaceted challenge. Cytometry Part A. 97 (2), 116-125 (2020).
- Bagby, S., et al. Development and maintenance of a preclinical patient derived tumor xenograft model for the investigation of novel anti-cancer therapies. Journal of Visualized Experiments. (115), e54393 (2016).
- Laajala, T. D., et al. Optimized design and analysis of preclinical intervention studies in vivo. Scientific Reports. 6, 30723 (2016).
- Na, Y. S., et al. Establishment of patient-derived xenografts from patients with gastrointestinal stromal tumors: analysis of clinicopathological characteristics related to engraftment success. Scientific Reports. 10 (1), 7996 (2020).
- Tentler, J. J., et al. RX-5902, a novel beta-catenin modulator, potentiates the efficacy of immune checkpoint inhibitors in preclinical models of triple-negative breast cancer. BMC Cancer. 20 (1), 1063 (2020).
- Lang, J., et al. Development of an adrenocortical cancer humanized mouse model to characterize anti-PD1 effects on tumor microenvironment. The Journal of Clinical Endocrinology & Metabolism. 105 (1), 26-42 (2020).
- Lang, J., et al. Studies of lymphocyte reconstitution in a humanized mouse model reveal a requirement of T cells for human B cell maturation. The Journal of Immunology. 190 (5), 2090-2101 (2013).
- Katano, I., et al. NOD-Rag2null IL-2Rγnull mice: an alternative to NOG mice for generation of humanized mice. Experimental Animalas. 63 (3), 321-330 (2014).
- Brehm, M. A., et al. Parameters for establishing humanized mouse models to study human immunity: analysis of human hematopoietic stem cell engraftment in three immunodeficient strains of mice bearing the IL2rγ(null) mutation. Clinical Immunology. 135 (1), 84-98 (2010).
- Hasgur, S., Aryee, K. E., Shultz, L. D., Greiner, D. L., Brehm, M. A. Generation of immunodeficient mice bearing human immune systems by the engraftment of hematopoietic stem cells. Methods in Molecular Biology. 1438, 67-78 (2016).
- Andre, M. C., et al. Long-term human CD34+ stem cell-engrafted nonobese diabetic/SCID/IL-2Rγnull mice show impaired CD8+ T cell maintenance and a functional arrest of immature NK cells. The Journal of Immunology. 185 (5), 2710-2720 (2010).
- Wunderlich, M., et al. Improved multilineage human hematopoietic reconstitution and function in NSGS mice. PLoS One. 13 (12), 0209034 (2018).
- Lee, J., Brehm, M. A., Greiner, D., Shultz, L. D., Kornfeld, H. Engrafted human cells generate adaptive immune responses to Mycobacterium bovis BCG infection in humanized mice. BMC Immunology. 14, 53 (2013).
- Masse-Ranson, G., et al. Accelerated thymopoiesis and improved T-cell responses in HLA-A2/-DR2 transgenic BRGS-based human immune system mice. European Journal of Immunology. 49 (6), 954-965 (2019).
- Oswald, E., et al. Immune cell infiltration pattern in non-small cell lung cancer PDX models is a model immanent feature and correlates with a distinct molecular and phenotypic make-up. Journal for Immunotherapy of Cancer. 10 (4), 004412 (2022).
Erratum
Formal Correction: Erratum: Testing Cancer Immunotherapeutics in a Humanized Mouse Model Bearing Human Tumors
Posted by JoVE Editors on 5/25/2023. Citeable Link.
An erratum was issued for: Testing Cancer Immunotherapeutics in a Humanized Mouse Model Bearing Human Tumors. The Authors section was updated from:
Jordi M. Lanis1
Matthew S. Lewis1
Hannah Strassburger1
Stacey M. Bagby2
Adrian T. A. Dominguez2
Juan A. Marín-Jiménez3
Roberta Pelanda1
Todd M. Pitts2
Julie Lang1
1Department of Immunology and Microbiology, School of Medicine, University of Colorado Denver Anschutz Medical Campus
2Division of Oncology, School of Medicine, University of Colorado Denver Anschutz Medical Campus
3Department of Medical Oncology, Catalan Institute of Oncology (ICO-L’Hospitalet)
to:
Jordi M. Lanis1
Matthew S. Lewis1
Hannah Strassburger1
Kristina Larsen1
Stacey M. Bagby2
Adrian T. A. Dominguez2
Juan A. Marín-Jiménez3
Roberta Pelanda1
Todd M. Pitts2
Julie Lang1
1Department of Immunology and Microbiology, School of Medicine, University of Colorado Denver Anschutz Medical Campus
2Division of Oncology, School of Medicine, University of Colorado Denver Anschutz Medical Campus
3Department of Medical Oncology, Catalan Institute of Oncology (ICO-L’Hospitalet)
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved