Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Erprobung von Krebsimmuntherapeutika in einem humanisierten Mausmodell mit menschlichen Tumoren
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Erratum Notice
Zusammenfassung
Dieses Protokoll beschreibt die Erzeugung von Mäusen mit menschlichem Immunsystem (KIS) für immunonkologische Studien. Anweisungen und Überlegungen zur Verwendung dieses Modells zum Testen von humanen Immuntherapeutika an menschlichen Tumoren, die in dieses Modell implantiert wurden, werden vorgestellt, wobei der Schwerpunkt auf der Charakterisierung der Reaktion des menschlichen Immunsystems auf den Tumor liegt.
Zusammenfassung
Die Umkehrung der immunsuppressiven Natur der Tumormikroumgebung ist entscheidend für die erfolgreiche Behandlung von Krebserkrankungen mit Immuntherapeutika. Mauskrebsmodelle sind in ihrer Vielfalt extrem begrenzt und leiden unter einer schlechten Translation in die Klinik. Um als physiologisches präklinisches Modell für Immuntherapiestudien zu dienen, wurde dieses Protokoll entwickelt, um die Behandlung menschlicher Tumore in einer Maus zu bewerten, die mit einem menschlichen Immunsystem rekonstituiert wurde. Dieses einzigartige Protokoll demonstriert die Entwicklung von Mäusen des menschlichen Immunsystems (HIS, "humanisiert") und anschließend die Implantation eines menschlichen Tumors, entweder eines von der Zelllinie abgeleiteten Xenotransplantats (CDX) oder eines vom Patienten abgeleiteten Xenotransplantats (PDX). HIS-Mäuse werden durch Injektion von CD34+ humanen hämatopoetischen Stammzellen, die aus Nabelschnurblut isoliert wurden, in neonatale BRGS (BALB/c Rag2-/- IL2RγC-/- NODSIRPα) stark immundefiziente Mäuse erzeugt, die auch in der Lage sind, einen xenogenen Tumor zu akzeptieren. Die Bedeutung der Kinetik und Eigenschaften der Entwicklung des menschlichen Immunsystems und der Tumorimplantation wird betont. Abschließend wird eine eingehende Beurteilung der Tumormikroumgebung mittels Durchflusszytometrie beschrieben. In zahlreichen Studien, in denen dieses Protokoll verwendet wurde, wurde festgestellt, dass die Tumormikroumgebung einzelner Tumore in HIS-PDX-Mäusen rekapituliert wird; "heiße" Tumore weisen eine große Immuninfiltration auf, während "kalte" Tumore dies nicht tun. Dieses Modell dient als Testfeld für Kombinationsimmuntherapien für ein breites Spektrum menschlicher Tumore und stellt ein wichtiges Werkzeug auf dem Weg zur personalisierten Medizin dar.
Einleitung
Krebsmodelle von Mäusen sind wichtig für die Aufklärung grundlegender Mechanismen des Tumorwachstums und der Immunflucht. Krebsbehandlungsstudien in Mausmodellen haben jedoch aufgrund begrenzter syngener Modelle und speziesspezifischer Unterschiede zu einer begrenzten Translation in die Klinik geführt 1,2. Das Aufkommen von Immuntherapien als dominanter Ansatz zur Kontrolle von Tumoren hat die Notwendigkeit eines In-vivo-Modells mit einem funktionierenden menschlichen Immunsystem erneut verdeutlicht. Fortschritte bei Mäusen mit menschlichem Immunsystem (HIS-Mäuse) in den letzten zehn Jahren haben es ermöglicht, die Immunonkologie in vivo bei einer Vielzahl von Krebsarten und Immuntherapeutika zu untersuchen 3,4,5,6. Humane Tumormodelle, einschließlich von Zelllinien und Patienten stammender Xenotransplantate (CDX bzw. PDX), wachsen in HIS-Mäusen gut und sind in den meisten Fällen nahezu identisch mit ihrem Wachstum im immundefizienten Wirt, dem die humane hämatopoetische Transplantation fehlt 7,8. Basierend auf dieser zentralen Erkenntnis haben die Forscher das HIS-Mausmodell verwendet, um menschliche Immuntherapien zu untersuchen, einschließlich Kombinationstherapien, die darauf ausgelegt sind, die Tumormikroumgebung (TME) zu verändern, um die Immunsuppression zu verringern und so die immungerichtete Tumorabtötung zu verbessern. Diese präklinischen Modelle tragen dazu bei, die Probleme der Heterogenität menschlicher Krebserkrankungen zu lösen, und können auch den Behandlungserfolg vorhersagen sowie immunbedingte Arzneimitteltoxizitäten überwachen 9,10.
Die Herstellung eines Mausmodells mit menschlichem Immunsystem durch die Einführung menschlicher hämatopoetischer Stammzellen erfordert eine immundefiziente Maus, die das Xenotransplantat nicht abstößt. Aktuelle HIS-Mausmodelle basieren auf immundefizienten Mausstämmen, über die vor über 30 Jahren berichtet wurde. Der erste beschriebene immundefiziente Mausstamm waren SCID-Mäuse, denen T- und B-Zellen fehlten11, gefolgt von einem hybriden NOD-SCID mit einem SIRPα-Polymorphismus, der für die Toleranz von Mausmakrophagen gegenüber menschlichen Zellen verantwortlich ist, aufgrund einer erhöhten Bindung des NOD SIRPα-Allels an das menschliche CD47-Molekül12,13. In den frühen 2000er Jahren war die Deletion der gemeinsamen Gammakette des IL-2-Rezeptors (IL-2Rγc) sowohl auf immundefizienten BALB/c- als auch auf NOD-Stämmen ein Wendepunkt für eine verbesserte menschliche Transplantation, da genetische Deletionen die Entwicklung von Wirts-NK-Zellen verhinderten14,15,16,17. Alternative Modelle, wie BRG- und NRG-Mäuse, erreichen T- und B-Zell-Defizienz durch Deletion des Rag1- oder Rag2-Gens, das für T- und B-Zell-Rezeptor-Genumlagerungen und damit für die Reifung und das Überleben von Lymphozyten erforderlich ist18,19. Die hier verwendete BRGS-Maus (BALB/c-Rag2 nullIl2RγCnullSirpα NOD) kombiniert die IL-2Rγ-Kettendefizienz und das NOD-SIRPα-Allel auf dem Rag2-/- Hintergrund, was zu einer hochgradig immundefizienten Maus ohne T-, B- oder NK-Zellen führt, jedoch mit ausreichender Vitalität und Gesundheit, um ein langfristiges Transplantat von mehr als 30 Wochen zu ermöglichen13.
HIS-Mäuse können auf verschiedene Arten erzeugt werden, wobei die menschliche PBMC-Injektion die direkteste Methode ist15,18,20. Diese Mäuse weisen jedoch eine ausgeprägte Ausdehnung aktivierter menschlicher T-Zellen auf, die im Alter von 12 Wochen zu einer Graft-versus-Host-Krankheit (GVHD) führt, was Langzeitstudien verhindert. Alternativ können auch humane hämatopoetische Stammzellen aus Nabelschnurblut (CB), Knochenmark und fetaler Leber für die Transplantation und Produktion des menschlichen Immunsystems de novo verwendet werden. In diesem System produzieren die hämatopoetischen Stammzellen ein menschliches Immunsystem mit mehreren Linien mit der Bildung von T-, B- und angeborenen Immunzellen, die im Vergleich zu den PBMC-Mäusen, die hauptsächlich T-Zellen entwickeln, gegenüber dem Mauswirt sehr tolerant sind. Daher fehlt die GVHD oder ist stark verzögert, und die Studien können auf Mäuse bis zu einem Alter von 10 Monaten ausgeweitet werden. CB bietet eine einfache, zugängliche und nicht-invasive Quelle von CD34+ humanen hämatopoetischen Stammzellen, die die Transplantation mehrerer KIS-Mäuse mit genetisch identischem Immunsystem erleichtert 17,18,20,21. In den letzten Jahren wurden HIS-Mausmodelle ausgiebig zur Untersuchung der Immuntherapie und des TME 3,4,5,6 eingesetzt. Trotz der Entwicklung eines vom Menschen abgeleiteten Immunsystems in diesen Mäusen wachsen menschliche Xenotransplantat-Tumore im Vergleich zu den immundefizienten Kontrollmäusen mit ähnlichen Geschwindigkeiten und ermöglichen das komplexe Zusammenspiel zwischen den Krebszellen und den Immunzellen, das für die Aufrechterhaltung der Mikroumgebung des transplantierten PDX wichtig ist 3,7,8 . Dieses Protokoll wurde verwendet, um über 50 Studien durchzuführen, in denen Behandlungen an HIS-BRGS-Mäusen mit PDXs und CDXs getestet wurden. Eine wichtige Schlussfolgerung ist, dass die humanen Tumore in den HIS-Mäusen ihre einzigartige TME beibehalten, wie sie durch die molekulare Bewertung des Tumors in Bezug auf die ursprüngliche Patientenprobe und die Eigenschaften des Immuninfiltrats definiert wird 3,22,23. Unsere Gruppe konzentriert sich auf die eingehende Evaluierung des KIS sowohl in Immunorganen als auch im Tumor mittels Multiparameter-Durchflusszytometrie. In dieser Arbeit beschreiben wir ein Protokoll für die Humanisierung von BRGS-Mäusen, die Bewertung von Chimärismus, die Implantation von humanen Tumoren, Tumorwachstumsmessungen, die Verabreichung von Krebsbehandlungen und die Analyse der HIS-Zellen mittels Durchflusszytometrie.
Protokoll
Alle Tierarbeiten wurden gemäß Tierprotokollen durchgeführt, die vom Institutional Animal Care and Use Committee der University of Colorado Denver genehmigt wurden (IACUC-Protokolle #00593 und #00021). Alle Tierarbeiten wurden in Übereinstimmung mit dem Office of Laboratory Animal Resources (OLAR) durchgeführt, einer von der American Association for Laboratory Animal Care akkreditierten Einrichtung auf dem Denver Anschutz Medical Campus der University of Colorado. Alle menschlichen Nabelschnurblutproben wurden als Spenden von anonymisierten Spendern gewonnen und unterliegen daher nicht der Genehmigung durch die Ethikkommission für die Humanforschung.
HINWEIS: Zusammensetzungen aller im Protokoll erwähnten Medien und Lösungen sind in Supplemental File 1 enthalten. Abbildung 1 zeigt das Gesamtprotokoll zur Erzeugung und Analyse von Immunantworten auf Tumore in HIS-BRGS-Mäusen.
1. Generation von KIS-Mäusen
- Mäusehaltung von BALB/c -Rag2 null Il2RγCnull SirpαNOD (BRGS) Mäusen
HINWEIS: Dieser Stamm ist extrem immundefizient und enthält keine T-, B- oder NK-Zellen. Daher müssen rigorose Maßnahmen ergriffen werden, um opportunistische Infektionen zu verhindern. Halten Sie die Kolonie auf einer Diät, die Trimethoprim und Sulfadiazinin enthält, abwechselnd 2 Wochen mit einer normalen Diät. Halten Sie einen möglichst vorsorglichen Wohnraum vor (z. B. eine barrierefreie Duschmöglichkeit mit eingeschränktem Zugang).- Kolonien von BALB/c -Rag2 null Il2RγC null Sirpα NOD (BRGS) und BALB/c Rag2 null Il2RγC null SirpaBalb/c (BRG) homozygoten Mäusen als Züchter erhalten.
- Züchten Sie BRGS N/N×BRG B/B, um BRGSB/N-Welpen zu erzeugen, die als Empfänger menschlicher Stammzellen verwendet werden können. In dieser Kolonie sind BRGSB/N gesünder als BRGS N/N und transplantieren in gleichem Maße (mehr als BRG).
- CD34+ Isolierung menschlicher Stammzellen aus Nabelschnur-CB
HINWEIS: Bei diesem Verfahren werden keine Antibiotika verwendet. Daher ist eine gute sterile Technik unerlässlich.- Platzieren Sie ein konisches 50-ml-Röhrchengestell sowie 3x 15-ml- und ~10 x 50-ml-konische Röhrchen in einer sterilisierten Biosicherheitswerkbank (BSC). Besprühen Sie einen Blutentnahmebeutel mit 70%igem Ethanol und lassen Sie ihn im BSC trocknen.
- Berechnen Sie die Anzahl der konischen 50-ml-Röhrchen, die für die CB-Dichtegradientenisolation = CB-Volumen/15 erforderlich sind, aufgerundet auf eine gerade Röhrchenzahl. Berechnen Sie das Blutvolumen pro Röhrchen = CB-Volumen/Anzahl der Röhrchen. Gießen Sie vorsichtig Blut aus dem CB-Beutel in jedes konische Röhrchen. dies sind maximal 15 ml pro Röhrchen. Verwenden Sie eine automatische Pipette und eine serologische 25-ml-Pipette, um das Blut 1:1 mit sterilem PBS zu mischen, indem Sie auf und ab pipettieren.
- Verwenden Sie eine automatische Pipette bei niedriger Geschwindigkeit und eine serologische 10-ml-Pipette, um das Blut langsam mit einer Dichtegradientenlösung von 1,077 g/ml bei Raumtemperatur (RT) (siehe Materialtabelle) zu unterlegen, ohne die Grenzfläche zu stören. Achten Sie darauf, dass die Pipettenspitze den Röhrchenboden nicht berührt. Wiederholen Sie den Vorgang für alle Röhrchen. Dann zentrifugieren Sie 30 Minuten lang bei 850 x g, ohne zu bremsen, bei RT, um die Aufrechterhaltung des Dichtegradienten zu gewährleisten.
- Stellen Sie sich den zellulären Buffy-Mantel über dem Dichtegradienten von 1,077 g/ml als wolkige weiße Schicht vor. Entfernen und entsorgen Sie die Plasmaschicht bis auf etwa 10 ml über dem Buffy-Coat mit einer serologischen 25-ml-Pipette und einer automatischen Pipette.
- Sammeln Sie den Buffy-Coat mit einer sterilen Transferpipette oder einer serologischen Pipette. Verwenden Sie die Pipette wie einen Spatel, um die Zellen von der Seite des konischen Röhrchens abzukratzen, während Sie den Kolben loslassen (oder langsam pipettieren), um die Zellen nach oben zu ziehen. Kombinieren Sie die Buffy-Coats aus zwei konischen 50-ml-Röhrchen zu einem neuen konischen 50-ml-Röhrchen.
- Waschen Sie die Zellen, indem Sie 45 ml steriles HBSS mit 2 % FBS in jedes konische Röhrchen gießen. Zentrifugieren Sie für 11 min bei 360 x g bei RT.
- Saugen Sie die Waschmedien in allen Röhrchen bis auf das Pellet ab. Verwenden Sie eine serologische 10-ml-Pipette und eine automatische Pipette, um das erste Pellet in 10 ml HBSS mit 2 % FBS zu resuspendieren. Resuspendieren Sie jedes Pellet in denselben 10 ml HBSS und spülen Sie jedes Röhrchen mit zusätzlichen 10 ml HBSS, um alle Zellen in einem einzigen Röhrchen zu sammeln.
- Gießen Sie 45 ml steriles HBSS mit 2 % FBS in das konische Röhrchen. 10 min bei 360 x g bei 4 °C zentrifugieren.
- Saugen Sie den Waschpuffer bis zum Zellpellet ab und resuspendieren Sie das Pellet in 20 ml Magnetzellenseparatorpuffer (siehe Materialtabelle). Entfernen Sie ein kleines Aliquot, um die Zellen mit einem Hämazytometer bei einer Verdünnung von 1:20 in Methylenblau zu zählen. Addieren Sie die Anzahl der blauen und weißen Zellen. Zentrifugieren bei 360 x g, für 10 min bei 4 °C.
HINWEIS: Dieses Protokoll verwendet die Magnetperlentechnologie (siehe Materialtabelle). Das Protokoll kann so modifiziert werden, dass es mit jeder Zelltrennungstechnologie verwendet werden kann, mit ausreichender Reinheit und Ausbeute der CD34+-Stammzellen. - Aspirieren Sie den Überstand und resuspendieren Sie das aus Nabelschnurblut isolierte CD34+-Zellpellet in 300 μl Magnetzellseparatorpuffer pro 1 x 108 Zellen . Fügen Sie zuerst 100 μl FcR-blockierendes Reagenz und dann 100 μl CD34+ magnetische Beads pro 1 x 108 Zellen hinzu . Bei 4 °C für 30 min inkubieren (kein Eis).
- Fügen Sie 5 ml Magnetzellenseparatorpuffer pro 1 x 108 Zellen hinzu und schleudern Sie 10 Minuten lang bei 4 °C bei 360 x g . Wiederholen Sie den Waschschritt und resuspendieren Sie das Pellet in 500 μl Magnetzellenseparatorpuffer pro 1 x 108 Zellen in einem konischen 15-ml-Röhrchen mit der Aufschrift "unfraktioniert".
- Beschriften Sie zwei weitere konische 15-ml-Röhrchen mit "CD34-" und "CD34+". Platzieren Sie die drei konischen 15-ml-Röhrchen (unfraktioniert, CD34- und CD34+) in den Schlitzen A1, B1 bzw. C1 auf einem Kühlregal (siehe Materialtabelle). Trennen Sie die Zellen mit dem zweispaltigen Positivauswahlprogramm auf einem automatischen Magnetzellenseparator (siehe Materialtabelle) in einem BSC gemäß den Geräteanweisungen des Herstellers.
- Expansion und Einfrieren von CD34+ humanen Stammzellen
- Aliquotieren Sie 10 μl der gewonnenen CD34+-Zellsuspension (2 ml) auf einem Hämozytometer-Objektträger und zählen Sie die Zellen unter 10-facher Vergrößerung. Berechnen Sie die Gesamtzahl der CD34+-Zellen, indem Sie die Zellzahl mit 2 x 104 multiplizieren. Teilen Sie die Gesamtzahl der CD34+-Zellen durch 250.000, um die Anzahl der einzufrierenden Fläschchen zu berechnen (50.000 Zellen pro Mauswelpe vor der In-vitro-Expansion ).
- Bereiten Sie die 10 % FCS des CB-Mediums Iscove (plus 1 ml extra für den Filterverlust) vor, ergänzt mit 40 ng/ml Stammzellfaktor, 20 ng/ml Flt3L und 10 ng/ml IL-6, und passieren Sie einen 0,22 μm Filter. Die CD34+-Zellen werden bei 100.000 ml CB-Medium resuspendiert und bei 37 °C inkubiert. An Tag 3 wird ein äquivalentes Volumen des CB-Mediums ohne Zytokine in den Kolben mit den Zellen und das CB-Medium mit den Zytokinen gegeben.
HINWEIS: Die Zugabe dieser Zytokine zum CB-Medium fördert das Überleben und die Expansion der CD34+-Zellen und verhindert gleichzeitig die Differenzierung. - Ernte die expandierten CD34+ Zellen an Tag 5. Pipettieren Sie die Zellsuspension auf und ab und sammeln Sie sie in einem konischen 50-ml-Röhrchen. Fügen Sie so viel CB-Medium hinzu, dass der Boden des Kolbens bedeckt ist. Kratzen Sie mit einem Zellschaber den gesamten Boden des Kolbens ab. Sammeln Sie alle Medien in demselben 50-ml-Röhrchen und zentrifugieren Sie es 11 Minuten lang bei 360 x g .
- Resuspendieren Sie die Zellen in 2 ml CB-Medium. Bewahren Sie den letzten Tropfen aus der Pipette zum Zählen in einer 96-Well-Platte auf. Verdünnen Sie die Zellen 1:1 in Trypanblau und geben Sie 10 μl in das Hämazytometer, dann zählen und mitteln Sie die Zellen aus vier Quadranten. Berechnen Sie die Gesamtzahl der CD34+-Zellen, indem Sie die Zellzahl mit 4 x 104 multiplizieren, und zeichnen Sie die Viabilität auf.
- Stellen Sie n+1 ml Gefriermedium her, wobei n die Anzahl der in Schritt 1.3.1 berechneten Gefrierfläschchen ist. Bereiten Sie das Gefriermedium vor, indem Sie 10 % (v/v) DMSO zu FBS hinzufügen und auf Eis aufbewahren. Beschriften Sie die Kryoflaschen mit CB#, CD34+ d5 und Datum.
- Schleudern Sie die CD34+-Zellen bei 360 x g für 10 min bei 4 °C herunter. Saugen Sie das Medium bis zum Pellet ab und resuspendieren Sie das Zellpellet im Gefriermedium. Aliquotieren Sie 1 ml Zellsuspension in jede Durchstechflasche und verteilen Sie den Rest gleichmäßig auf die Durchstechflaschen. Die Durchstechflaschen in einen auf 4 °C gekühlten Isopropanol-Zellen-Gefrierschrank geben, bei -80 °C aufstellen und in flüssigen Stickstoff umfüllen, um sie >90 Tage lang zu lagern.
- Bestrahlung von Mäusewelpen
- Sammeln Sie die BRGSB/N-Welpen 1-3 Tage nach der Geburt in einer autoklavierten Plastikbox mit Polsterung. Fügen Sie den Welpen eine kleine Menge Einstreu hinzu. Beschriften Sie die Box mit der Käfignummer und der Anzahl der Welpen.
- Stellen Sie den Bestrahler (siehe Materialtabelle) auf eine Dosis von 300 rad ein. Stellen Sie die Schachtel mit den Welpen in den Strahler und setzen Sie sie 300 Rad aus. Bringen Sie die Welpen zurück in ihren Käfig, legen Sie sie auf einen Haufen und decken Sie sie mit Einstreu ab.
- Welpeninjektionen und CD34+-Zellpräparation
- Beginnen Sie mit der CD34+-Zellpräparation ~3 h nach der Bestrahlung. Erwärmen Sie 10 ml CB-Medien in einem konischen 50-ml-Röhrchen. Führen Sie alle Schritte in einem sterilen BSC durch.
- Entnehmen Sie ein Fläschchen mit in vitro expandierten und eingefrorenen CD34+-Zellen für jeweils vier bis sechs Welpen zur Injektion. Bei 55 °C schnell auftauen, bis nur noch eine kleine Menge Eis sichtbar ist, und die Zellen in das erwärmte CB-Medium geben (die Durchstechflasche sollte sich noch kühl anfühlen). Verwenden Sie 1 ml Medium, um jede Durchstechflasche zu spülen, und drehen Sie die Zellen 12 Minuten lang bei 4 °C bei 360 x g .
HINWEIS: Es wurde festgestellt, dass schnelles Auftauen bei 55 °C zu einer besseren Zellviabilität (90%-95%) führt als zum Auftauen bei 37 °C. - Saugen Sie das Medium vorsichtig ab. Resuspendieren Sie das (kleine) Pellet in 2 ml CB-Medium, mischen Sie es vorsichtig und geben Sie ~30 μl der Zellsuspension in eine einzelne Vertiefung in einer Zählplatte. 1:1 in Trypanblau verdünnen, dann 10 μl in ein Hämozytometer geben und die Zellen aus vier Quadranten zählen und mitteln.
- Berechnen Sie die Gesamtzahl der CD34+-Zellen, indem Sie die Zellzahl mit 4 x 104 multiplizieren, und zeichnen Sie dann die Viabilität auf. Bei 360 x g 12 min bei 4 °C schleudern.
- Saugen Sie das Medium vorsichtig ab und resuspendieren Sie das Zellpellet in 100 μl sterilem PBS pro n+1 Welpen zur Injektion, was zu 250.000-450.000 CD34+-Zellen pro Maus führt. Legen Sie den konischen Schlauch in einem Transportbehälter auf Eis und reisen Sie zur Injektion des Welpen zum Vivarium.
- Bringen Sie eine Wärmelampe, Windeln, eine 1-ml-Spritze, eine 18-g-Nadel, eine 30-g-Nadel und das CD34+-Zellpräparat in sterilen Behältern zum Vivarium BSC. Legen Sie eine sterile Windel ~2 ft unter die Wärmelampe. Holen Sie den Käfig mit der zu injizierenden Einstreu heraus und legen Sie ihn in die BSC.
- Setzen Sie die Spritze mit einer abgeschrägten 18-G-Nadel zusammen. Passen Sie den Winkel des konischen Röhrchens an die Abschrägung der Nadel an, mischen und ziehen Sie die Zellsuspension vorsichtig auf. Legen Sie die Welpen zum Aufwärmen auf die Windel (achten Sie auf Überhitzung). Entfernen Sie die Luft aus der Spritze und ersetzen Sie die 18-G-Nadel durch die 30-G-Nadel und drücken Sie dann vorsichtig auf die Spritze, bis sich die Zellsuspension gerade an der Nadelspitze befindet.
HINWEIS: Alternativ kann auch eine Insulinspritze verwendet werden. - Bringen Sie einen Welpen nach dem anderen an den Rand der Windel, weg von der Wärmelampe. Fixieren Sie den Welpen auf der Seite unter Daumen und Zeigefinger, um eine klare Sicht auf das Gesicht zu ermöglichen. Achte auf die Vene quer über die Wange, unter der sich das Ohr befinden wird. Führen Sie die Nadel flach in die Vene (IV) ein, die dem Auge am nächsten liegt, und injizieren Sie langsam 50 μl Zellen.
- Prüfen Sie, ob sich durch eine subkutane Injektion eine Blase bildet. Wenn ja, führen Sie die Nadel tiefer ein und fahren Sie mit der Injektion von Zellen fort. Ein kleiner Tropfen Blut/Hämatom wird sichtbar sein, wenn es erfolgreich ist.
HINWEIS: Beachten Sie das Verfahren von Gombash Lampe et al.24 in Bezug auf die Injektion von Jungtieren. - Wenn der Welpe noch immobilisiert ist, führen Sie eine intrahepatische Injektion (IH) mit weiteren 50 μl Zellen durch (insgesamt 100 μl pro Welpe IV+IH). Die Leber kann als dunkler Fleck zwischen dem weißen Milchband und dem Brustkorb dargestellt werden. Legen Sie den injizierten Welpen auf eine Windel, die weiter von den nicht injizierten Welpen entfernt ist, und erhitzen Sie ihn.
HINWEIS: Die intravenöse Injektion führt zu einem besseren langfristigen Chimärismus als die IH-Injektion allein25, aber intravenöse Injektionen sind nicht immer erfolgreich. Daher wird durch die Aufteilung der Injektion zwischen IV und IH sichergestellt, dass ein größerer Prozentsatz der Mäuse transplantiert wird. - Wiederholen Sie sowohl die Gesichtsvenen- als auch die IH-Injektion für alle Welpen. Reinigen Sie jegliches Blut, bringen Sie die Welpen in ihrem Käfig in das Nest zurück und decken Sie sie mit Einstreu ab.
2. Testen des menschlichen Chimärismus im Blut
- Testen Sie Chimärismus im Blut von KIS-Mäusen im Alter von 10 und 14 Wochen. Entnahme von 50 μl Blut über die Vena retroorbitalis oder mit einer alternativen, von der IACUC zugelassenen Methode.
- Für retroorbitale Blutungen betäuben Sie Mäuse mit einem Isofluran-Verdampfer, der 1-2 Minuten lang auf 5 eingestellt ist, und drehen Sie dann die Verdampfereinstellung auf 4 herunter. Drehen Sie den Verdampfer nach Bedarf herunter, damit die Mäuse unter Narkose ausreichend mit Sauerstoff versorgt bleiben. Halten Sie die Mäuse nicht länger als 5 Minuten unter Isofluran.
- Setzen Sie die Nase der anästhesierten Maus in den Nasenkonusaufsatz des Isofluran-Verdampfers ein und geben Sie einen Tropfen des Analgetikums (0,5% Proparacain-HCl-Augenlösung USP) auf das Auge.
- Nach 1 Minute wird das Proparacain mit einer sterilen Gaze entfernt, das Auge gestützt und ein 75-mm-Hämatokritröhrchen retroorbital eingeführt, um 50 μl Blut zu sammeln. Das Blut wird in ein 1,5-ml-Mikrofugenröhrchen mit 50 μl Heparin ausgestoßen und vorsichtig gemischt.
- Drücken Sie das Auge mit steriler Gaze zu, um die Blutung zu stoppen, und tragen Sie einen Tropfen Proparacain auf. Entfernen Sie die Maus von Isofluran und erholen Sie sich in einem sauberen Käfig.
- PBMC-Isolierung aus Mäuseblut
- Mischen Sie das Blut/Heparin, indem Sie es vorsichtig auf und ab pipettieren und langsam auf 500 μl mit einem Dichtegradienten von 1,077 g/ml auftragen, wobei Sie darauf achten müssen, die Grenzfläche nicht zu stören. Zentrifugieren Sie die Röhrchen bei 1.220 x g für 20 min bei RT ohne Bremsen.
- Stellen Sie sich den zellulären Buffy-Coat als eine wolkige Schicht über dem Dichtegradienten von 1,077 g/ml unterhalb des Plasmas vor. Entfernen Sie so viele Zellen wie möglich mit einer 200-μl-Pipette aus dem Buffy-Coat und geben Sie sie in neue 1,5-ml-Röhrchen mit 750 μl Erntemedium. Zentrifugieren Sie bei 360 x g für 11 min bei RT.
- Saugen Sie das Medium auf 50 μl ab und resuspendieren Sie das Pellet in 750 μl Erntemedium. 10 min bei 4 °C bei 360 x g zentrifugieren und wieder auf 50 μl absaugen. Die Zellen sind bereit, in der Oberflächenbeize resuspendiert zu werden.
- Oberflächenfärbung und durchflusszytometrische Analyse
- Füllen Sie das Arbeitsblatt für die Färbetafel aus (Tabelle 1; Arbeitsblatt "Spectral Flow Bleed Panel") mit Mausnummern und bereiten Sie den Antikörper-Färbecocktail vor, indem Sie alle fluoreszierenden Antikörper in den Färbepuffer geben (Supplemental File 1). Erstellen Sie ein Plattenlayout, um die Proben zu einer 96-Well-U-Bodenplatte hinzuzufügen. Markieren Sie die Böden von Brunnen mit einem Permanentmarker. Antikörper werden vor der Färbung mit einem Standardverfahren titriert, um die geeignete Konzentrationzu bestimmen 26.
- Geben Sie 62 μl des Oberflächenfleckencocktails in jede Vertiefung der 96-Well-U-Bodenplatte. Resuspendieren Sie die Zellen in den 50 μl, die im Röhrchen verbleiben, und geben Sie jede Probe in die entsprechende Vertiefung. Fügen Sie eine Vertiefung für eine positive Färbekontrolle (humane PBMCs + Maussplenozyten, je 1 x 106 Zellen) hinzu, um sie neben den Proben zu färben. Durch Pipettieren mischen und 15 min bei 4 °C inkubieren.
- Bei 680 x g für 3 min bei 4 °C zentrifugieren. Schieben Sie die Platte in die Spüle, um den Überstand zu entfernen, und waschen Sie die Zellen, indem Sie sie in 150 μl Färbepuffer resuspendieren, indem Sie ~10x vorsichtig pipettieren. Jede Vertiefung wird in 150 μl Färbepuffer geschleudert und resuspendiert.
- Erfassen Sie die Daten für 100 μl jeder Probe auf einem Durchflusszytometer (siehe Materialtabelle) und exportieren Sie die .fcs-Dateien. Importieren Sie die .fcs-Dateien in die Fließdatenbearbeitungssoftware (siehe Materialtabelle). Wenden Sie ein Polygon-Gate auf ein FSC-A x SSC-A-Diagramm an, das die Zellen umgibt, und schließen Sie dabei Rückstände aus. Wählen Sie die Zellen innerhalb des Tors aus (siehe Tabelle 1; Arbeitsblatt "Spectral Flow Bleed Gating").
- Ändern Sie die Achsen in (FSC-A x FSC-H) und schließen Sie die Zellen, die auf der linearen Diagonale enthalten sind, mit Ausnahme der Dubletten, die aus der Linie herausragen. Wählen Sie diese Zellen aus, und ändern Sie die Achsen in (hCD45 x mCD45).
- Wenden Sie ein Polygon-Gate auf die hCD45+-Population an und wenden Sie den Namen "Mensch" an. Wenden Sie ein Polygon-Gate auf die mCD45+-Population an und wenden Sie den Namen "Maus" an. Erstellen Sie eine Zählstatistik sowohl für die menschliche als auch für die Mauspopulation.
- Wählen Sie die menschliche Grundgesamtheit aus und ändern Sie die Achsen in (CD19 x CD3). Wenden Sie ein Polygon-Gate auf die CD19+-Zellen an und nennen Sie es "B-Zellen". Wenden Sie ein Polygon-Gate auf die CD3+-Population an und nennen Sie es "T-Zellen". Wenden Sie ein Polygon-Gate auf die doppelt negative Grundgesamtheit an, und nennen Sie es "NonTB".
- Wählen Sie die T-Zellpopulation aus, und ändern Sie die Achsen in (CD8 x CD4). Wenden Sie ein Polygon-Gate auf die CD4- und CD8-positiven Populationen an und nennen Sie sie "CD4+" bzw. "CD8+".
- Wählen Sie die Nicht-TB-Population aus, und ändern Sie die Achsen in (CD56 x myeloid). Wenden Sie ein Polygon-Gate auf die gesamte CD56-positive Population einschließlich der doppelt positiven Ereignisse an und nennen Sie es "NK-Zellen". Wenden Sie ein Polygon-Gate auf die CD56-negative und myeloisch-positive Population an und nennen Sie es "myeloide".
- Erstellen Sie eine Tabelle für die Prozent- und Zählstatistiken aller Populationen und exportieren Sie sie in ein Tabellenkalkulationsprogramm (siehe Materialtabelle). Berechnen Sie %hCD45 Chimärismus = %hCD45/(%hCD45 + mCD45).
- Für weitere Experimente werden KIS-Mäuse mit einem hCD45+-Anteil von <20 % (von mCD45 + hCD45) ausgeschlossen.
HINWEIS: In dieser Studie wurden PBMCs unter Verwendung einer Dichtegradiententrennung von 1,077 g/ml für eine sauberere Erythrozytenverarmung hergestellt. Bei diesem Verfahren wurden Granulozyten von Mensch und Maus aus der PBMC-Schicht ausgeschlossen. Alternativ kann auch die Erythrozytenlyse eingesetzt werden.
3. Injektion von Tumoren in Mäuse
- Bestätigen Sie vor der Tumorinjektion die T-Zellzahlen aus den 14-wöchigen Blutungsdaten. Tumore werden injiziert, um zwischen 20 und 26 Wochen erntereif zu sein, wenn die T-Zellen >20 % betragen, und zwischen 24 und 28 Wochen, wenn die T-Zellen <20 % der gesamten Immunzellpopulation ausmachen. Dieser Injektionszeitpunkt stellt sicher, dass die Mäuse 20-28 Wochen alt sind und am Ende der Studie eine ausreichende Anzahl von T-Zellen aufweisen.
- Injektion von Zelllinien-abgeleiteten Xenotransplantaten (CDX)
HINWEIS: Das Verfahren wird am Beispiel von MDA-MB-231-Adenokarzinomzellen der Brust (siehe Materialtabelle) beschrieben.- Tauen Sie ein Aliquot gefrorener Zellen auf, waschen Sie 1x durch Resuspendierung in 10 ml DMEM, ergänzt mit 10 % FBS, 1 % PenStreptokokken und 1 % nicht-essentiellen Aminosäuren, und zentrifugieren Sie 10 Minuten lang bei 4 °C bei 360 x g . Das Medium wird abgesaugt und in 10 ml DMEM, ergänzt mit 10 % FBS, 1 % PenStreptokokken und 1 % nicht-essentiellen Aminosäuren, in einem T25-Kolben resuspendiert und bei 37 °C mit 5 % CO2 inkubiert.
HINWEIS: Die Zelllinien werden mittels PCR authentifiziert, um den korrekten Zelltyp zu gewährleisten. Zellüberstände werden vor der Injektion durch einen biochemischen Assay auf Mykoplasmen getestet. - Passage und Ausdehnung der Zellen während der exponentiellen Wachstumsphase bei etwa 80% Konfluenz.
- Das Medium wird angesaugt, die Zellen mit 5-10 ml sterilem PBS (pH 7,2) gespült und mit 1 ml 0,25%igem Trypsin-EDTA für 1-5 min inkubiert, bis sich die Zellen vom Kolben lösen.
- Fügen Sie 5 ml desselben DMEM hinzu und mischen Sie durch Auf- und Abpipettieren. Die gesamten 6 ml Zellsuspension werden in einen neuen T75-Kolben mit Gewebekultur (1:3 Verdünnung) gegeben und weitere 10 ml DEM hinzugefügt.
- Die Zellen werden alle 2-3 Tage bei 80% Konfluenz bei 1:3 Verdünnung in DMEM durchgelassen, um die Zellen zu expandieren.
- Ernte die Zellen mit 0,25% Trypsin-EDTA während der exponentiellen Wachstumsphase innerhalb von sechs Durchgängen und wasche sie mit PBS. Mischen Sie PBS und Basalmembranextrakt (siehe Materialtabelle) im Verhältnis 1:1 und geben Sie es in einer Endkonzentration von 5 x 107 Zellen/ml zu den Zellen.
- Betäuben Sie die Mäuse mit Isofluran wie in Schritt 2.1.1 beschrieben. 100 μL (5 x 10,6 Zellen) Tumorzellsuspension mit einer 23-G-Nadel subkutan in jede Flanke injizieren.
- Tauen Sie ein Aliquot gefrorener Zellen auf, waschen Sie 1x durch Resuspendierung in 10 ml DMEM, ergänzt mit 10 % FBS, 1 % PenStreptokokken und 1 % nicht-essentiellen Aminosäuren, und zentrifugieren Sie 10 Minuten lang bei 4 °C bei 360 x g . Das Medium wird abgesaugt und in 10 ml DMEM, ergänzt mit 10 % FBS, 1 % PenStreptokokken und 1 % nicht-essentiellen Aminosäuren, in einem T25-Kolben resuspendiert und bei 37 °C mit 5 % CO2 inkubiert.
- Injektion von patienteneigenen Xenotransplantaten (PDX) mit Trokaren. Das Einspritzverfahren und weitere Entwicklungs- und Wartungsanweisungen für das PDX-Modell sind in der Literatur27 verfügbar.
4. Messung des Tumorwachstums
- Überprüfen Sie den Tumorfortschritt einmal pro Woche nach der Implantation, indem Sie entlang der Flanke nach Tumorwachstum tasten. Sobald die Tumore tastbar sind, betäuben Sie die Mäuse mit Isofluran (wie in Schritt 2.1.1 beschrieben) und rasieren Sie jede Flanke mit einem elektrischen Trimmer, wobei Sie darauf achten müssen, dass der Tumor nicht zu Geschwüren kommt, wenn der Tumor wächst.
Anmerkungen: Mäuse können vor der Tumorinjektion rasiert werden, um Verletzungen der Haut um die Tumore herum zu vermeiden. Die Geschwindigkeit des Haarnachwachsens könnte jedoch Tumormessungen behindern. - Messen Sie die Länge und Breite der Tumore zweimal pro Woche mit Messschiebern und notieren Sie die Maße in mm. Geben Sie die Tumormessungen als Tumorvolumen (mm3) mit der Formel
 an. Achten Sie darauf, dass die Tumorlast 2.000mm3 pro Einzeltumor oder ein Gesamtvolumen von 3.000mm3 nicht überschreitet.
an. Achten Sie darauf, dass die Tumorlast 2.000mm3 pro Einzeltumor oder ein Gesamtvolumen von 3.000mm3 nicht überschreitet.
HINWEIS: Die Richtlinien für den Einsatz von Mäusen in der Krebsforschung variieren je nach Standort. Bitte beachten Sie die Richtlinien für Tierpflege und -nutzung in der Einrichtung des Forschers.
5. Medikamentöse Behandlungen
- Ordnen Sie die KIS-Mäuse auf der Grundlage von hCD45-Chimärismus, hCD3-Chimärismus und hCD8-Chimärismus in gleichwertige Behandlungsgruppen ein. Sobald die Tumore durchschnittlich 100mm3 erreichen, beginnen Sie mit einer medikamentösen Behandlung.
HINWEIS: Die Anzahl der Mäuse pro Gruppe basiert auf der Anzahl der KIS-Mäuse, die aus dem CB generiert wurden. Es wird empfohlen, mindestens vier Mäuse pro Gruppe zu verwenden. Nicht-bipartites Multigruppen-Matching (z. B. in der R-vivo-Manila-Software) ist für diese Gruppierungnützlich 28. - Arzneimittelweg und -häufigkeit
- Injektion von Anti-PD-1-Hemmern (Nivolumab, Pembrolizumab) intraperitonisch (i.p.) in einer Dosierung von 30 mg/kg 1x pro Woche oder 20 mg/kg 2x pro Woche für Einzelbehandlungen oder 10-15 mg/kg 2x pro Woche für Kombinationsbehandlungen.
- Die Kombinationstherapien, wie zielgerichtete Therapien, Chemotherapien und Bestrahlung, werden entsprechend dem Versuchsaufbau dosiert. Zielgerichtete Therapien und Chemotherapien können durch orale Infusion, i.p. Injektion oder Nahrung verabreicht werden.
HINWEIS: Die Dosen können je nach veröffentlichten Daten und dem Tumormodell variiert und optimiert werden. Dosisstudien werden häufig an immundefizienten Empfängern vor HIS-Mausstudien getestet.
- Überwachen Sie die Mäuse mindestens 3x pro Woche auf gesundheitliche Veränderungen wie Gewichtsverlust, losen Kot, gekrümmte Körperhaltung, eingeschränkte Mobilität und Fellverlust. Einige Symptome können Anzeichen von Arzneimitteltoxizitäten oder GVHD sein, und die Medikamentendosierung muss möglicherweise reduziert oder gestoppt werden. Euthanasieren Sie Mäuse nach Bedarf gemäß den Richtlinien für Tierpflege und -nutzung.
6. Entnahme von Mausgewebe und Tumoren am Ende der Studie
- Die Mäuse werden einzeln nach institutionellen und veterinärmedizinischen Richtlinien mit komprimiertem CO 2 -Gas mit einer Durchflussrate von 2,75 l/min eingeschläfert. Überwachen Sie die Mäuse, die nach dem Tod 1 Minute lang in CO2 gehalten werden, und führen Sie dann eine Zervixluxation als sekundäre Form der Euthanasie durch.
- Blutentnahme
- Blutentnahme durch intrakardiale Punktion. Halten Sie die Maus in einer aufrechten Position und führen Sie eine 1-ml-Spritze mit einer 25-G-Nadel direkt in das Herz ein, und zwar von einer Linie direkt links von der Mittellinie und unterhalb der Rippen. Sammeln Sie das Blut in einer Spritze, idealerweise durch einen langen Zug, und füllen Sie es in ein beschriftetes 1,5-ml-Röhrchen um.
Anmerkungen: Zusätzliche Nadelstiche können durchgeführt werden, um zusätzliches Blut aus den Ecken der Lungenhöhle mit Vorsicht zu entnehmen. - Lassen Sie das Blut 1 h bei 4 °C stehen und zentrifugieren Sie das Blut dann 6 min lang in einer Mikrozentrifuge bei 7.800 x g. Sammeln Sie die klare Flüssigkeit (Seren) über der Blutgrenzfläche in einem zweiten sauberen und beschrifteten 1,5-ml-Röhrchen. Lagern Sie das Serum bei -20 °C für nachgelagerte Analysen, z. B. inflammatorische Zytokin- oder Immunglobulintiter bei Mensch und Maus.
- Blutentnahme durch intrakardiale Punktion. Halten Sie die Maus in einer aufrechten Position und führen Sie eine 1-ml-Spritze mit einer 25-G-Nadel direkt in das Herz ein, und zwar von einer Linie direkt links von der Mittellinie und unterhalb der Rippen. Sammeln Sie das Blut in einer Spritze, idealerweise durch einen langen Zug, und füllen Sie es in ein beschriftetes 1,5-ml-Röhrchen um.
- Gewebedissektion
- Nach der Injektion und dem Wachstum von Tumorzellen in den Mäusen und der Verabreichung von medikamentösen Behandlungen wird das Gewebe entnommen. Legen Sie die Mäuse auf ein Sezierbrett aus Schaumstoff, mit Stiften, um sie an Ort und Stelle zu halten, und strecken Sie die Arme und Beine in einem Winkel von 45° aus. Machen Sie einen Schnitt in der Mitte des Rumpfes, beginnend in der Nähe des Beckens und bis zum Kinn, um zu vermeiden, dass das Bauchfell durchtrennt wird (obwohl dies nicht unbedingt erforderlich ist). Ziehen Sie die Haut an den Rand und halten Sie sie mit Stecknadeln fest.
- Extrahieren Sie die Lymphknoten (LNs) mit einer feinen Pinzette in folgender Reihenfolge: inguinal, axillar, zervikal, mesenterial, Hiatal.
ANMERKUNG: Bei HIS-Mäusen sind die LNs oft sehr klein, ähneln einer Anlage oder sind "entzündet" und haben ein ausgeprägtes Aussehen, das sich von dem einer Wildtyp-Maus unterscheidet. Daher wird an jeder Stelle Gewebe entnommen, das LNs ähnelt. Die peripheren LNs erscheinen oft als flüssigkeitsgefüllte "Kugeln", während die mesenterialen LNs dichter sind. Die mesenterialen LNs sind die offensichtlichsten und konsistentesten und werden als ein oder zwei unterschiedliche dichtere Knoten im Gegensatz zu einem String betrachtet. - Legen Sie die LNs auf eine Seite der Milchglasobjektträger in 8 ml Erntemedium in eine Petrischale. Halten Sie die Objektträger in einem senkrechten Winkel mit den mattierten Kanten nach innen und drücken Sie vorsichtig auf das Gewebe, bis der Zellinhalt freigesetzt wird.
- Spülen Sie die Objektträger mehrmals aus, indem Sie sie auseinander und zusammen ziehen, um die maximale Menge an Zellen freizusetzen. Sammeln Sie die Zellen mit einer 5-Zoll-Glaspipette und filtern Sie sie durch eine 9-Zoll-Pipette mit Wattestopfen in ein beschriftetes konisches 15-ml-Röhrchen.
- Ziehen Sie die Milz von der oberen linken Seite des Bauches entweder mit zwei Zangenpaaren oder mit einer Pinzette und einer Schere heraus. Beachten Sie die Größe der Milz als Schätzung des Volumens des Resuspensionsmediums. Sammeln und filtrieren Sie die Milz durch mechanischen Aufschluss mit Milchglasobjektträgern, wie bei den LNs.
HINWEIS: Es kann jede Technik zur Herstellung von Geweben für Einzelzellsuspensionen verwendet werden. - Führen Sie die Zählung und Resuspension der Zellen aus Gewebeproben wie unten beschrieben durch.
- Zentrifugieren Sie die Lymphzellen bei 360 x g für 10 min bei 4 °C. Saugen Sie die Flüssigkeit an und resuspendieren Sie das Zellpellet in 1 ml Erntemedium mit DNase.
- Entfernen Sie die Erythrozyten aus den Milzzellen, indem Sie 3 Minuten lang mit 3 ml ACK-Lysepuffer bei RT inkubieren, gefolgt von 10 ml Erntemedium/DNase. Zentrifugieren Sie die Milzzellen erneut, saugen Sie den Überstand ab und resuspendieren Sie die Zellen in 1-10 ml Erntemedien/DNase, basierend auf der Milzgröße (z. B. 1 ml für sehr kleine Milz und bis zu 10 ml für die größte Milz).
- Fügen Sie ein Aliquot von 10 μl Zellsuspension zu 90 μl Medium hinzu und rechnen Sie mit einem Hämozytometer. Zentrifugieren Sie die LNs und Milzzellen, saugen Sie die Überstände an und resuspendieren Sie die Zellen in Erntemedium in einer Konzentration von 1 x 108 Zellen/ml oder mindestens 80 μl.
- Extrahieren Sie die Tumore.
- Entfernen Sie den Tumor aus der offenen Flanke, indem Sie den Tumor mit einer Pinzette festhalten, während Sie mit einer Dissektionsschere langsam an den Tumorrändern abschneiden.
- Sobald der Tumor entfernt ist, wiegen Sie ihn und entfernen Sie 1/4 für die RNA- und Immunhistochemie (IHC)-Verarbeitung. Teilen Sie den 1/4-Tumor in zwei Hälften; Eine Hälfte (1/8 des gesamten Tumors) in ein Kryogefäß geben, in flüssigem N2 einfrieren und bei -80 °C für nachgelagerte genomische Studien lagern.
- Das andere 1/8 des Tumors wird in ein markiertes Probenröhrchen mit 10 % Formalin gegeben. Spülen Sie das Gewebe am nächsten Tag ab und resuspendieren Sie es bis zur nächsten Verwendung in 70%igem Ethanol. Die restlichen 3/4 des Tumors in eine 6 cm große Schüssel geben und mit einer Skalpellklinge in ~1 mm große Stücke zerkleinern.
- Transportieren Sie die Tumorstücke in ein Dissoziationsröhrchen (siehe Materialtabelle), spülen Sie die Schale mit 5 ml unvollständigem tumorinfiltrierendem Leukozytenmedium (TIL) aus und geben Sie sie in das Dissoziationsröhrchen.
HINWEIS: Bei Tumoren mit einem Gewicht von >0,4 g wird die Schale mit 10 ml unvollständigen TIL-Medien gespült und in das Dissoziationsröhrchen gegeben. - Das Kollagenasepräparat (siehe Materialtabelle) wird in einer Endkonzentration von 50 mg/ml in das Gewebe im Dissoziationsröhrchen gegeben. Dissoziieren Sie das Gewebe durch mechanische Dissoziation bei 37 °C für 30 min bis 1 h, je nach Festigkeit des Tumors.
- Nach der Dissoziation wird die Suspension über einen 100-μm-Filter in ein konisches 50-ml-Röhrchen geleitet und der Filter mit 10 ml TIL-Komplettmedien gespült. Das Serum in diesem Medium stoppt die Kollagenase-Reaktion und schützt die Zellen vor weiterem Abbau.
- Zentrifugieren Sie die Einzelzellsuspension bei 360 x g für 10 min bei 4 °C. Resuspendieren Sie das Pellet in gerade so viel Erntemedium mit DNase, dass die Zellsuspension problemlos durch eine P1000-Pipettenspitze passieren und das Volumen für die nachgeschaltete Analyse aufzeichnen kann.
HINWEIS: Ein kleineres Volumen erhöht die Ansammlung von Tumorimmunzellen, ist aber anfälliger für Durchflusszytometer-Verstopfungen.
7. Zellfärbung und durchflusszytometrische Analysen
- Färbungsvorbereitung und Zellbeschichtung
- Färbecocktails zubereiten: Am Tag der Ernte wird die Anzahl der Proben in das Färbearbeitsblatt eingetragen (Tabelle 2; Arbeitsblätter "Konventionelles Flow-A-Panel", "Spectral-Flow-B-Panel" und "Konventionelles Flow-C-Panel") für alle Flecken und Drucke. Bereiten Sie Oberflächenfärbecocktails für die Färbungen A und B im Färbepuffer (SB) vor, indem Sie jeden Antikörper einzeln mit einer neuen Spitze hinzufügen, jedes Reagenz unterwegs markieren und bis zur Verwendung bei 4 °C lagern. Bereiten Sie die geeigneten Viabilitätsfarbstoffe in azidfreiem PBS vor und lagern Sie sie bis zur Verwendung bei 4 °C (vor Gebrauch auf RT erwärmen). Bereiten Sie an Tag 2 in SB den Cocktail der Oberflächenfärbung C zusammen mit den intrazellulären Färbungen B und C in ihren jeweiligen Permeabilisierungspuffern vor.
- Erstellen Sie ein Plattenlayout für alle Proben im Färbearbeitsblatt und aliquotieren Sie 100 μl azidfreies PBS in die Wells. Fügen Sie ungefärbte Kontrollen für jedes Gewebe und jede Färbung hinzu (für die spektrale Zytometrie).
- Fügen Sie die Zellen zu 96-Well-Platten hinzu, die 50 μl PBS enthalten. Für Färbung A wird jede Gewebegruppe im entsprechenden Volumen, wie auf dem Färbearbeitsblatt vermerkt, resuspendiert und bei 4 °C bis zur Aufnahme auf dem Durchflusszytometer am selben Tag gelagert. Für die Färbungen B und C geben Sie 25 μl Lymphe und 60 μl Zellsuspensionen aus Nicht-Lymphgewebe in die Vertiefungen mit PBS.
- Durchführung einer In-vitro-Stimulation von Zytokinen zum Nachweis durch intrazelluläre Färbung mit Färbung C.
- Die Färbeplatte C 96-well aus Schritt 7.1.3 wird bei 680 x g für 3 min bei 4 °C zentrifugiert. Geben Sie 200 μl TIL-Komplettmedien (RPMI 1640, 10 mM HEPES [pH 7], 10 % FBS) in jede Vertiefung. Lagern Sie die Platte mit der Zellsuspension über Nacht bei 4 °C.
- Früh am nächsten Morgen wird der Zellstimulationscocktail (siehe Materialtabelle) im Maßstab 1:500 in vollständigen TIL-Medien verdünnt. Zentrifugieren Sie die Platte mit der Zellsuspension bei 680 x g , um die Zellen zu pelletieren, und schnippen Sie, um das Medium zu entfernen. Die Zellen werden in 200 μL des vorbereiteten Zellstimulationscocktails resuspendiert und bei 37 °C 1 h inkubiert.
- Fügen Sie 25 μl eine Monensin-haltige Proteintransportinhibitorlösung in einer Verdünnung von 1:1.000 in vollständigen TIL-Medien hinzu, mischen Sie die Zellen und inkubieren Sie sie bei 37 °C für weitere 4 h, um eine intrazelluläre Akkumulation von Zytokinen zu ermöglichen.
- Führe eine Zellfärbung durch.
- Für die Färbungen A und B (Tag 1) und für Färbung C (Tag 2) zentrifugieren Sie bei 680 x g für 3 min bei 4 °C. Schnippen Sie die Platten und geben Sie die entsprechenden Viabilitätsfarbstoffe in die Vertiefungen. Durch vorsichtiges Auf- und Abpipettieren mit einer Mehrkanalpipette gut mischen und 15 Minuten bei RT inkubieren.
- Zentrifugieren Sie die Platten (wie in Schritt 7.1.5.1), fügen Sie dann geeignete Oberflächenflecken auf die Platten auf und mischen Sie sie vorsichtig durch Pipettieren mit einer Mehrkanalpipette. 15 min bei 4 °C inkubieren und erneut zentrifugieren. Schnippen Sie die Platten, waschen Sie die Zellen, indem Sie sie vorsichtig mit 150 μl SB auf und ab pipettieren, und zentrifugieren Sie.
- Schnippen Sie die Platten, wiederholen Sie den Waschvorgang, indem Sie vorsichtig mit 150 μl SB auf und ab pipettieren, und zentrifugieren Sie 3 Minuten lang bei 4 °C bei 680 x g. Für Färbung A wird jede Gewebegruppe im entsprechenden Volumen, wie auf dem Färbearbeitsblatt vermerkt, resuspendiert und bei 4 °C gelagert. Für Färbung B fixieren Sie das Fixiermittel mit dem FoxP3-Transkriptionsfaktor-Kit (siehe Materialtabelle) für 30 min bei RT. Für Färbung C fixieren Sie 1% (v/v) Paraformaldehyd in SB für 30 min bei RT.
- Zentrifugieren Sie die festen Platten bei 480 x g für 3 min bei 4 °C. 1x in SB waschen. Bei Färbung B können die Zellen über Nacht belassen werden.
- Permeabilisieren der Zellen: Resuspendieren Sie die Vertiefungen in 150 μl FoxP3-Transkriptionsfaktor-Kit-Permeabilisierungspuffer für Färbung B und in 0,5 % (w/v) Saponin in SB für Färbung C. 15 min bei RT inkubieren. Zentrifugieren Sie die festen Platten bei 480 x g für 3 min bei 4 °C.
- Schnippen Sie die Platten und fügen Sie die entsprechenden intrazellulären Färbecocktails für Färbung B und Färbung C hinzu. Inkubieren Sie für 30 min bei RT.
- Zentrifugieren Sie die festen Platten bei 480 x g für 3 min bei 4 °C und schnippen Sie die Platten. Waschen Sie die Zellen mit 150 μL der entsprechenden Permeabilisierungspuffer (Färbung B, FoxP3-Transkriptionsfaktor-Kit Permeabilisierungspuffer; Färbung C, Saponin).
- Schnippen Sie die Platten und waschen Sie sie durch Auf- und Abpipettieren in 150 μl SB. Zentrifugieren Sie 3 Minuten lang bei 4 °C bei 480 x g . Schnippen Sie die Platten und resuspendieren Sie die Zellen in SB nach Gewebegruppen in den entsprechenden Volumina, die auf dem Färbearbeitsblatt angegeben sind.
HINWEIS: Die Proben sind nun bereit für die Erfassung mittels spektraler Durchflusszytometrie. - Stellen Sie das Durchflusszytometer (siehe Materialtabelle) mit geeigneten Einzelfärbungskontrollen für jede Färbung und ungefärbten Proben für jede Gewebegruppe auf, um Unterschiede in der Autofluoreszenz während der Entmischung zu berücksichtigen. Erfassen Sie die entsprechenden Volumina pro Gewebegruppe, wie im Färbearbeitsblatt (Tabelle 2) definiert, und exportieren Sie die .fcs-Dateien.
- Datenanalyse der Durchflusszytometrie
- Erstellen Sie mit der Durchflusszytometrie-Analysesoftware (siehe Materialtabelle) einen neuen Arbeitsbereich. Erstellen Sie neue Gruppen für jedes Organ (LN, Milz und TIL). Importieren Sie die .fcs-Dateien für jedes Organ in die Gruppe.
- Erstellen Sie ein bivariates Punktdiagramm, legen Sie die Achsen auf (FSC-A x SSC-A) fest, und wenden Sie ein Polygon-Gate auf zelluläre Ereignisse an, um Ereignisse an den Kanten (Gate für alle Zellen) zu vermeiden. Wählen Sie die zellulären Ereignisse aus, ändern Sie die Achsen in (FSC-A x FSC-H) und wenden Sie ein Polygon-Gate auf die Events auf der linearen Diagonale an, wobei Events, die von der Diagonalen abweichen, ausgeschlossen werden, um das "Singulett"-Gate zu generieren. Wählen Sie das "Singlets"-Gatter aus und ändern Sie die Achsen in (hCD45 x mCD45). Wenden Sie Polygon-Gatter auf die positiven Ereignisse hCD45 und mCD45 an, und nennen Sie sie "Mensch" bzw. "Maus".
- Wählen Sie die menschliche Population aus und ändern Sie die Y-Achse in Lebendes/Totes Aqua. Wenden Sie ein Polygon-Gate auf die Lebend/Tot-negative, hCD45-positive Population an und nennen Sie es "lebender Mensch". Wählen Sie die Mauspopulation aus und ändern Sie die X-Achse in Live/Dead Aqua. Wenden Sie ein Polygon-Gate auf die Live/Dead-negative, mCD45-positive Population an und nennen Sie es "lebende Maus".
- Wählen Sie auf ähnliche Weise das übergeordnete Gate und die X- und Y-Achse aus, wie in den Arbeitsblättern "Conventional Flow A Gating", "Spectral Flow B Gating" und "Conventional Flow C Gating" (Tabelle 2) beschrieben, um die angegebenen Populationen (z. B. menschliche B-Zellen, aktivierte T-Zellen) zu isolieren.
HINWEIS: Eine repräsentative Anspritzung für jede Färbung (Beschnitt, A, B, C) ist in der Zusatzdatei 2 enthalten. - Erstellen Sie Zähl- und Häufigkeitsexporttabellen in der Durchflusszytometrie-Analysesoftware für alle Populationen und exportieren Sie sie in eine Tabellenkalkulationssoftware. Die übergeordnete Grundgesamtheit für Häufigkeiten ist in Tabelle 2 angegeben.
- Verwenden Sie die Daten, um Diagramme basierend auf experimentellen Behandlungsgruppen zu erstellen.
HINWEIS: Die Daten können auch mithilfe von R-Paketen in der Analysesoftware analysiert werden. Eine einzelne .fcs-Datei aus allen zu analysierenden Proben kann mit der Verkettungsfunktion erstellt werden. Diese Daten können mit dem T-SNE-Algorithmus unter Hinzufügung von Schlüsselwortparametern für Gewebetyp und Behandlungsgruppe dimensional reduziert werden. Der FlowSOM-Algorithmus kann dann verwendet werden, um Populationen zu clustern, und das ClusterExplorer-Tool kann verwendet werden, um die Populationen zu identifizieren. Neuartige Zellpopulationen können auf diese Weise identifiziert, visuell verglichen und zwischen Behandlungsgruppen oder innerhalb verschiedener Gewebe quantifiziert werden. - Korrelieren Sie Immunparameter für Tumore innerhalb derselben Behandlungsgruppe mit dem Wachstum dieses Tumors, um Immuntypen zu definieren, die mit der Hemmung des Tumorwachstums korrelieren. Quantifizieren Sie das Tumorwachstum anhand der spezifischen Wachstumsrate (SGR) für diesen Tumor, eine Messung, die den Unterschied im Tumorvolumen über einen bestimmten Zeitraum berücksichtigt. Diese Messung normalisiert Tumore, die aufgrund der Gesundheit der Mäuse und des Startdatums der Behandlung an unterschiedlichen Tagen entnommen wurden.
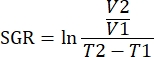
Ergebnisse
In Anlehnung an das Flankentumorprotokoll und den experimentellen Zeitplan (Abbildung 1) wurden das Tumorwachstum und die Immunantwort auf eine zielgerichtete Tyrosinkinase-Inhibitor-Therapie (TKI) und eine Nivolumab-Kombinationstherapie in zwei verschiedenen PDXs von humanem Darmkrebs (CRC) untersucht. Die TKI-Medikamente wurden in immundefizienten Wirten untersucht, um das Tumorwachstum zu beurteilennur 29. Dieses Modell ermöglichte die Untersuchung von Veränderun...
Diskussion
In den letzten 6 Jahren hat unser Forschungsteam mit unserer Expertise sowohl in der Immunologie als auch an humanisierten Mäusen ein dringend benötigtes präklinisches Modell entwickelt, um Immuntherapien an einer Vielzahl von menschlichen Tumoren zu testen 3,7,30,31. Dieses Protokoll betont die Berücksichtigung der Variabilität des Modells, mit besonderem Augenmerk auf die immuntherapieze...
Offenlegungen
Nichts.
Danksagungen
Wir bedanken uns sowohl bei der Animal Research Facility (OLAR) für die Betreuung unserer Mäuse als auch bei der Flow Cytometry Shared Resource, die durch den Cancer Center Support Grant (P30CA046934) an unserem Institut unterstützt wird, für ihre immense Hilfe bei all unserer Arbeit. Wir danken auch Gail Eckhardt und Anna Capasso für unsere erste Zusammenarbeit bei der Untersuchung von Immuntherapien gegen humane PDXs in unserem HIS-BRGS-Modell. Diese Studie wurde teilweise durch den National Institutes of Health P30CA06934 Cancer Center Support Grant unter Verwendung der PHISM (Pre-clinical Human Immune System Mouse Models) Shared Resource, RRID: SCR_021990 and Flow Cytometry Shared Resource, RRID: SCR_022035, unterstützt. Diese Forschung wurde zum Teil vom NIAID der National Institutes of Health unter der Vertragsnummer 75N93020C00058 unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 1 mL syringe w/needles | McKesson | 1031815 | |
| 15 mL tubes | Grenier Bio-One | 188271 | |
| 2-mercaptoethanol | Sigma | M6250 | |
| 50 mL tubes | Grenier Bio-One | 227261 | |
| AutoMACS Pro Separator | Miltenyi | 130-092-545 | |
| BD Golgi Stop Protein Transport Inhibitor with monensin | BD Bioscience | BDB563792 | |
| BSA | Fisher Scientific | BP1600100 | |
| Cell Stim Cocktail | Life Technologies | 509305 | |
| Chill 15 Rack | Miltenyi | 130-092-952 | |
| Cotton-plugged glass pipettes | Fisher Scientific | 13-678-8B | |
| Cultrex Basement membrane extract | R&D Systems | 363200502 | |
| Cytek Aurora | Cytek | ||
| DNase | Sigma | 9003-98-9 | |
| eBioscience FoxP3/Transcription Factor Staining Buffer Set | Invitrogen | 00-5523-00 | |
| Embryonic Stemcell FCS | Gibco | 10439001 | |
| Eppendorf Tubes; 1.5 mL volume | Grenier Bio-One | 616201 | |
| Excel | Microsoft | ||
| FBS | Benchmark | 100-106 500mL | |
| Ficoll Hypaque | GE Healthcare | 45001752 | |
| FlowJo Software | BD Biosciences | ||
| Forceps - fine | Roboz Surgical | RS5045 | |
| Forceps normal | Dumont | RS4919 | |
| Formaldehyde | Fisher | F75P1GAL | |
| Frosted Glass Slides | Corning | 1255310 | |
| Gentlemacs C-Tubes | Miltenyi | 130-096-334 | |
| GentleMACS Dissociator | Miltenyi | 130-093-235 | |
| glass pipettes | DWK Life Sciences | 63A53 | |
| Glutamax | Gibco | 11140050 | |
| HBSS w/ Ca & Mg | Sigma | 55037C | |
| HEPES | Corning | MT25060CI | |
| IgG standard | Sigma | I2511 | |
| IgM standard | Sigma | 401108 | |
| IMDM | Gibco | 12440053 | |
| Liberase DL | Roche | 5466202001 | |
| LIVE/DEAD Fixable Blue | Thermo | L23105 | |
| MDA-MB-231 | ATCC | HTB-26 | |
| MEM | Gibco | 1140050 | |
| mouse anti-human IgG-AP | Southern Biotech | JDC-10 | |
| mouse anti-human IgG-unabeled | Southern Biotech | H2 | |
| mouse anti-human IgM-AP | Southern Biotech | UHB | |
| mouse anti-human IgM-unlabeled | Southern Biotech | SA-DA4 | |
| MultiRad 350 | Precision X-Ray | ||
| PBS | Corning | 45000-446 | |
| Pen Strep | Gibco | 15140122 | |
| Petri Dishes | Fisher Scientific | FB0875713A | |
| p-nitrophenyl substrate | Thermo | 34045 | |
| PRISM | Graphpad | ||
| Rec Hu FLT3L | R&D systems | 308-FK-005/CF | |
| Rec Hu IL6 | R&D systems | 206-IL-010/CF | |
| Rec Hu SCF | R&D systems | 255SC010 | |
| RPMI 1640 | Corning | 45000-39 | |
| Saponin | Sigma | 8047-15-2 | |
| Scissors | McKesson | 862945 | |
| Serological pipettes 25 mL | Fisher Scientific | 1367811 | |
| Sterile filter | Nalgene | 567-0020 | |
| Sterile molecular water | Sigma | 7732-18-5 | |
| Yeti Cell Analyzer | Bio-Rad | 12004279 | |
| Zombie Green | biolegend | 423112 |
Referenzen
- Chulpanova, D. S., Kitaeva, K. V., Rutland, C. S., Rizvanov, A. A., Solovyeva, V. V. Mouse tumor models for advanced cancer immunotherapy. International Journal of Molecular Sciences. 21 (11), 4118 (2020).
- Olson, B., Li, Y., Lin, Y., Liu, E. T., Patnaik, A. Mouse models for cancer immunotherapy research. Cancer Discovery. 8 (11), 1358-1365 (2018).
- Marin-Jimenez, J. A., et al. Testing cancer immunotherapy in a human immune system mouse model: correlating treatment responses to human chimerism, therapeutic variables and immune cell phenotypes. Frontiers in Immunology. 12, 607282 (2021).
- Yin, L., Wang, X. J., Chen, D. X., Liu, X. N., Wang, X. J. Humanized mouse model: a review on preclinical applications for cancer immunotherapy. American Journal of Cancer Research. 10 (12), 4568-4584 (2020).
- Cogels, M. M., et al. Humanized mice as a valuable pre-clinical model for cancer immunotherapy research. Frontiers in Oncology. 11, 784947 (2021).
- Jin, K. T., et al. Development of humanized mouse with patient-derived xenografts for cancer immunotherapy studies: A comprehensive review. Cancer Science. 112 (7), 2592-2606 (2021).
- Capasso, A., et al. Characterization of immune responses to anti-PD-1 mono and combination immunotherapy in hematopoietic humanized mice implanted with tumor xenografts. Journal for Immunotherapy of Cancer. 7 (1), 37 (2019).
- Wang, M., et al. Humanized mice in studying efficacy and mechanisms of PD-1-targeted cancer immunotherapy. The FASEB Journal. 32 (3), 1537-1549 (2018).
- Yong, K. S. M., et al. Humanized mouse as a tool to predict immunotoxicity of human biologics. Frontiers in Immunology. 11, 553362 (2020).
- Shen, H. W., Jiang, X. L., Gonzalez, F. J., Yu, A. M. Humanized transgenic mouse models for drug metabolism and pharmacokinetic research. Current Drug Metabolism. 12 (10), 997-1006 (2011).
- Bosma, G. C., Custer, R. P., Bosma, M. J. A severe combined immunodeficiency mutation in the mouse. Nature. 301 (5900), 527-530 (1983).
- Shultz, L. D., et al. Multiple defects in innate and adaptive immunologic function in NOD/LtSz-scid mice. The Journal of Immunology. 154 (1), 180-191 (1995).
- Legrand, N., et al. Functional CD47/signal regulatory protein alpha (SIRP(alpha)) interaction is required for optimal human T- and natural killer- (NK) cell homeostasis in vivo. Proceedings of the National Academy of Sciences. 108 (32), 13224-13229 (2011).
- Ishikawa, F., et al. Development of functional human blood and immune systems in NOD/SCID/IL2 receptor {gamma} chain(null) mice. Blood. 106 (5), 1565-1573 (2005).
- Ito, M., et al. NOD/SCID/gamma(c)(null) mouse: an excellent recipient mouse model for engraftment of human cells. Blood. 100 (9), 3175-3182 (2002).
- Shultz, L. D., et al. Human lymphoid and myeloid cell development in NOD/LtSz-scid IL2R gamma null mice engrafted with mobilized human hemopoietic stem cells. The Journal of Immunology. 174 (10), 6477-6489 (2005).
- Traggiai, E., et al. Development of a human adaptive immune system in cord blood cell-transplanted mice. Science. 304 (5667), 104-107 (2004).
- Theocharides, A. P., Rongvaux, A., Fritsch, K., Flavell, R. A., Manz, M. G. Humanized hemato-lymphoid system mice. Haematologica. 101 (1), 5-19 (2016).
- Goldman, J. P., et al. Enhanced human cell engraftment in mice deficient in RAG2 and the common cytokine receptor gamma chain. British Journal of Haematology. 103 (2), 335-342 (1998).
- Stripecke, R., et al. Innovations, challenges, and minimal information for standardization of humanized mice. EMBO Molecular Medicine. 12 (7), (2020).
- Allen, T. M., et al. Humanized immune system mouse models: progress, challenges and opportunities. Nature Immunology. 20 (7), 770-774 (2019).
- Gammelgaard, O. L., Terp, M. G., Preiss, B., Ditzel, H. J. Human cancer evolution in the context of a human immune system in mice. Molecular Oncology. 12 (10), 1797-1810 (2018).
- Rios-Doria, J., Stevens, C., Maddage, C., Lasky, K., Koblish, H. K. Characterization of human cancer xenografts in humanized mice. Journal for Immunotherapy of Cancer. 8 (1), 000416 (2020).
- Gombash Lampe, S. E., Kaspar, B. K., Foust, K. D. Intravenous injections in neonatal mice. Journal of Visualized Experiments. (93), e52037 (2014).
- Lang, J., Weiss, N., Freed, B. M., Torres, R. M., Pelanda, R. Generation of hematopoietic humanized mice in the newborn BALB/c-Rag2null Il2rγnull mouse model: a multivariable optimization approach. Clinical Immunology. 140 (1), 102-116 (2011).
- Laskowski, T. J., Hazen, A. L., Collazo, R. S., Haviland, D. Rigor and reproducibility of cytometry practices for immuno-oncology: a multifaceted challenge. Cytometry Part A. 97 (2), 116-125 (2020).
- Bagby, S., et al. Development and maintenance of a preclinical patient derived tumor xenograft model for the investigation of novel anti-cancer therapies. Journal of Visualized Experiments. (115), e54393 (2016).
- Laajala, T. D., et al. Optimized design and analysis of preclinical intervention studies in vivo. Scientific Reports. 6, 30723 (2016).
- Na, Y. S., et al. Establishment of patient-derived xenografts from patients with gastrointestinal stromal tumors: analysis of clinicopathological characteristics related to engraftment success. Scientific Reports. 10 (1), 7996 (2020).
- Tentler, J. J., et al. RX-5902, a novel beta-catenin modulator, potentiates the efficacy of immune checkpoint inhibitors in preclinical models of triple-negative breast cancer. BMC Cancer. 20 (1), 1063 (2020).
- Lang, J., et al. Development of an adrenocortical cancer humanized mouse model to characterize anti-PD1 effects on tumor microenvironment. The Journal of Clinical Endocrinology & Metabolism. 105 (1), 26-42 (2020).
- Lang, J., et al. Studies of lymphocyte reconstitution in a humanized mouse model reveal a requirement of T cells for human B cell maturation. The Journal of Immunology. 190 (5), 2090-2101 (2013).
- Katano, I., et al. NOD-Rag2null IL-2Rγnull mice: an alternative to NOG mice for generation of humanized mice. Experimental Animalas. 63 (3), 321-330 (2014).
- Brehm, M. A., et al. Parameters for establishing humanized mouse models to study human immunity: analysis of human hematopoietic stem cell engraftment in three immunodeficient strains of mice bearing the IL2rγ(null) mutation. Clinical Immunology. 135 (1), 84-98 (2010).
- Hasgur, S., Aryee, K. E., Shultz, L. D., Greiner, D. L., Brehm, M. A. Generation of immunodeficient mice bearing human immune systems by the engraftment of hematopoietic stem cells. Methods in Molecular Biology. 1438, 67-78 (2016).
- Andre, M. C., et al. Long-term human CD34+ stem cell-engrafted nonobese diabetic/SCID/IL-2Rγnull mice show impaired CD8+ T cell maintenance and a functional arrest of immature NK cells. The Journal of Immunology. 185 (5), 2710-2720 (2010).
- Wunderlich, M., et al. Improved multilineage human hematopoietic reconstitution and function in NSGS mice. PLoS One. 13 (12), 0209034 (2018).
- Lee, J., Brehm, M. A., Greiner, D., Shultz, L. D., Kornfeld, H. Engrafted human cells generate adaptive immune responses to Mycobacterium bovis BCG infection in humanized mice. BMC Immunology. 14, 53 (2013).
- Masse-Ranson, G., et al. Accelerated thymopoiesis and improved T-cell responses in HLA-A2/-DR2 transgenic BRGS-based human immune system mice. European Journal of Immunology. 49 (6), 954-965 (2019).
- Oswald, E., et al. Immune cell infiltration pattern in non-small cell lung cancer PDX models is a model immanent feature and correlates with a distinct molecular and phenotypic make-up. Journal for Immunotherapy of Cancer. 10 (4), 004412 (2022).
Erratum
Formal Correction: Erratum: Testing Cancer Immunotherapeutics in a Humanized Mouse Model Bearing Human Tumors
Posted by JoVE Editors on 5/25/2023. Citeable Link.
An erratum was issued for: Testing Cancer Immunotherapeutics in a Humanized Mouse Model Bearing Human Tumors. The Authors section was updated from:
Jordi M. Lanis1
Matthew S. Lewis1
Hannah Strassburger1
Stacey M. Bagby2
Adrian T. A. Dominguez2
Juan A. Marín-Jiménez3
Roberta Pelanda1
Todd M. Pitts2
Julie Lang1
1Department of Immunology and Microbiology, School of Medicine, University of Colorado Denver Anschutz Medical Campus
2Division of Oncology, School of Medicine, University of Colorado Denver Anschutz Medical Campus
3Department of Medical Oncology, Catalan Institute of Oncology (ICO-L’Hospitalet)
to:
Jordi M. Lanis1
Matthew S. Lewis1
Hannah Strassburger1
Kristina Larsen1
Stacey M. Bagby2
Adrian T. A. Dominguez2
Juan A. Marín-Jiménez3
Roberta Pelanda1
Todd M. Pitts2
Julie Lang1
1Department of Immunology and Microbiology, School of Medicine, University of Colorado Denver Anschutz Medical Campus
2Division of Oncology, School of Medicine, University of Colorado Denver Anschutz Medical Campus
3Department of Medical Oncology, Catalan Institute of Oncology (ICO-L’Hospitalet)
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten