A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
استشعار ميكانو-نود-مسام: منصة سريعة وخالية من الملصقات لقياسات لزجة مرنة أحادية الخلية متعددة المعلمات
* These authors contributed equally
In This Article
Summary
تظهر هنا طريقة للنمط الظاهري للخلايا المفردة ميكانيكيا باستخدام منصة موائع دقيقة قائمة على الإلكترونيات تسمى استشعار العقدة الميكانيكية (mechano-NPS). تحافظ هذه المنصة على إنتاجية معتدلة من 1-10 خلايا / ثانية مع قياس كل من الخصائص الفيزيائية الحيوية المرنة واللزجة للخلايا.
Abstract
تشارك الخواص الميكانيكية الخلوية في مجموعة واسعة من العمليات والأمراض البيولوجية ، بدءا من تمايز الخلايا الجذعية إلى ورم خبيث السرطان. الطرق التقليدية لقياس هذه الخصائص ، مثل مجهر القوة الذرية (AFM) وشفط الماصة الدقيقة (MA) ، تلتقط معلومات غنية ، تعكس الاستجابة اللزجة المرنة الكاملة للخلية. ومع ذلك ، فإن هذه الطرق محدودة بسبب الإنتاجية المنخفضة جدا. يمكن للنهج عالية الإنتاجية ، مثل قياس التشوه الخلوي في الوقت الفعلي (RT-DC) ، قياس المعلومات الميكانيكية المحدودة فقط ، حيث غالبا ما تقتصر على قراءات أحادية المعلمة تعكس فقط الخصائص المرنة للخلية. على النقيض من هذه الطرق ، فإن استشعار العقدة الميكانيكية والمسام (mechano-NPS) عبارة عن منصة مرنة وخالية من الموائع الدقيقة تعمل على سد الفجوة في تحقيق قياسات لزجة مرنة متعددة المعلمات لخلية ذات إنتاجية معتدلة. يستخدم قياس التيار المباشر (DC) لمراقبة الخلايا أثناء عبورها قناة الموائع الدقيقة ، وتتبع حجمها وسرعتها قبل وأثناء وبعد إجبارها من خلال انقباض ضيق. تستخدم هذه المعلومات (أي الحجم والسرعة) لتحديد التشوه العرضي لكل خلية ، ومقاومة التشوه ، والتعافي من التشوه. بشكل عام ، توفر منصة الموائع الدقيقة القائمة على الإلكترونيات خصائص خلية لزجة مرنة متعددة ، وبالتالي صورة أكثر اكتمالا للحالة الميكانيكية للخلية. نظرا لأنه يتطلب الحد الأدنى من تحضير العينة ، ويستخدم قياسا إلكترونيا مباشرا (على عكس الكاميرا عالية السرعة) ، ويستفيد من تصنيع الطباعة الحجرية الناعمة القياسية ، فإن تنفيذ هذه المنصة بسيط ويمكن الوصول إليه وقابل للتكيف مع التحليل النهائي. وقد وفرت مرونة هذه المنصة وفائدتها وحساسيتها معلومات ميكانيكية فريدة عن مجموعة متنوعة من الخلايا، مع إمكانية العديد من التطبيقات في العلوم الأساسية والتشخيص السريري.
Introduction
الخلايا المفردة هي مواد ديناميكية لزجة مرنة1. تؤثر العديد من العمليات الداخلية والخارجية ، (على سبيل المثال ، بداية الانقسام أو إعادة تشكيل المصفوفة خارج الخلية [ECM]) ، على هيكلها وتكوينها2،3،4 ، وغالبا ما تؤدي إلى خصائص فيزيائية حيوية مميزة تكمل حالتها الحالية. على وجه الخصوص ، ثبت أن الخواص الميكانيكية هي مؤشرات حيوية مهمة للتطور الخلوي وعلم وظائف الأعضاء وعلم الأمراض ، مما ينتج عنه معلومات كمية قيمة يمكن أن تكمل الأساليب الجزيئية والجينية الكنسية5،6،7. على سبيل المثال ، وصف Li et al. مؤخرا الاختلافات الميكانيكية بين خلايا سرطان الدم النخاعي الحادة المقاومة للأدوية والمستجيبة للأدوية ، بينما استخدم أيضا RNA-seq للكشف عن الجينات المرتبطة بالهيكل الخلويالمعبر عنها بشكل تفاضلي 8. من خلال فهم التفاعل المعقد بين ميكانيكا الخلية الواحدة والوظيفة الخلوية ، فإن التنميط الميكانيكي له تطبيقات أوسع في تحويل العلوم الأساسية والتشخيص السريري9.
الأداة الأكثر اعتمادا على نطاق واسع لقياس ميكانيكا الخلية الواحدة هي مجهر القوة الذرية (AFM). بينما يتيح AFM قياسا موضعيا عالي الدقة للخصائص الميكانيكية الخلوية ، فإنه يظل محدودا بإنتاجية <0.01 خلية / ثانية10. بدلا من ذلك ، تقتصر النقالات الضوئية ، التي تستخدم حزمتي ليزر متباينتين لاحتجاز وتشويه الخلايا المفردةالمعلقة 11 ، على إنتاجية أعلى بشكل هامشي من <1 خلية / خلايا12. مكنت التطورات الحديثة في تقنيات الموائع الدقيقة جيلا جديدا من الأجهزة للتقييم الميكانيكي السريع أحادي الخلية12,13. تستخدم هذه التقنيات قنوات انقباض ضيقة 14،15 ، أو تدفق القص 16 ، أو التمدد الهيدروديناميكي 17 لتشويه الخلايا بسرعة عند إنتاجية 10-1000 خلية / ثانية 18. وفي حين أن معدل قياس هذه النهج أسرع بكثير من التقنيات التقليدية، فإنها غالبا ما تتاجر بقدرات إنتاجية عالية لقراءات ميكانيكية محدودة (الجدول التكميلي 1). تركز جميع طرق الموائع الدقيقة السريعة المذكورة أعلاه على المقاييس الأساسية أحادية المعلمة ، مثل وقت العبور أو نسب التشوه ، والتي تعكس فقط الخصائص المرنة للخلية. ومع ذلك ، نظرا للطبيعة اللزجة المرنة الجوهرية للخلايا المفردة ، فإن التوصيف الميكانيكي القوي والشامل للخلايا يتطلب النظر ليس فقط في المكونات المرنة ولكن أيضا في الاستجابات اللزجة.
استشعار العقدة الميكانيكية للمسام (mechano-NPS)2,8 (الشكل 1A) عبارة عن منصة موائع دقيقة تعالج القيود الحالية باستخدام التنميط الميكانيكي أحادي الخلية. تتيح هذه الطريقة قياس معلمات فيزيائية حيوية متعددة في وقت واحد ، بما في ذلك قطر الخلية ، والتشوه النسبي ، ووقت التعافي من التشوه ، مع إنتاجية معتدلة من 1-10 خلايا / ثانية. تعتمد هذه التقنية على استشعار مسام العقدة (NPS) 19،20،21،22،23،24 ، والذي يتضمن استخدام قياس مسبار من أربع نقاط لقياس نبضة التيار المعدل التي تنتجها خلية تعبر قناة الموائع الدقيقة التي تم تقسيمها حسب مناطق أوسع ، يشار إليها باسم "العقد". نبضة التيار المعدل هي نتيجة للخلية التي تمنع جزئيا تدفق التيار في الأجزاء (أي "المسام") والعقد ، مع حظر المزيد من التيار في السابق أكثر من الأخير. في mechano-NPS ، يكون جزء واحد ، "قناة الانكماش" ، أضيق من قطر الخلية. وبالتالي ، يجب أن تتشوه الخلية لعبور القناة بأكملها (الشكل 1 ب). يمكن تحديد قطر الخلية من خلال حجم النبضة الفرعية الناتجة عندما تعبر الخلية مسام العقدة قبل قناة الانكماش (الأشكال 1B ، C). هنا ، |ΔInp | ، الانخفاض الحالي عندما تكون الخلية في المسام ، يتناسب مع نسبة حجم الخلية إلى المسام ، V cell /V المسام2،8،19. يمكن تحديد صلابة الخلية بواسطة ΔTc ، وهي مدة النبضة الفرعية الأكبر بشكل كبير التي تنتج عندما تعبر الخلية قناة الانكماش (الأشكال 1B ، C). ستستغرق الخلية الأكثر صلابة وقتا أطول لعبور القناة من الخلية الأكثر ليونة 2,8. أخيرا ، يمكن تحديد "استرداد" الخلية ، وقدرة الخلية على العودة إلى حجمها الأصلي وشكلها بعد التشوه ، من خلال سلسلة النبضات الفرعية الناتجة عندما تعبر الخلية مسام العقدة بعد قناة الانكماش (الأشكال 1B ، C). وقت الاسترداد ، ΔTr ، هو الوقت الذي تستغرقه النبضات الفرعية الحالية للعودة إلى حجم النبضات الفرعية السابقة ، قبل ضغط الخلية. بشكل عام ، يتم تسجيل نبضات التيار المعدل الناتجة عن عبور الخلية لقناة الموائع الدقيقة وتحليلها لاستخراج المعلمات الميكانيكية أحادية الخلية ذات الصلة (الشكل 1D) 2,8.
تم إثبات قابلية التكاثر وسهولة استخدام منصة الموائع الدقيقة القائمة على الإلكترونيات سابقا25. بالإضافة إلى ذلك ، تقدم المنصة حاجزا منخفضا أمام دخول التنميط الميكانيكي أحادي الخلية. يتم استخدام الطباعة الحجرية اللينة القياسية لتصنيع أجهزة الموائع الدقيقة. تتكون أجهزة القياس من مكونات غير مكلفة ، بما في ذلك لوحة الدوائر المطبوعة البسيطة (PCB) ، وإمدادات الطاقة ، والمضخم الأولي ، ولوحة الحصول على البيانات (DAQ) ، والكمبيوتر. أخيرا ، يتوفر رمز سهل الاستخدام للحصول على البيانات وتحليلها ، مما يتيح التنفيذ المباشر. يمكن لتقنية التنميط الميكانيكي هذه التمييز بين مجموعات خطوط الخلايا الظهارية غير الخبيثة والخبيثة في الثدي والرئة ، والتمييز بين السلالات الفرعية في الخلايا الظهارية الثديية البشرية الأولية ، وتوصيف آثار الاضطرابات الهيكلية الخلوية والعوامل الدوائية الأخرى 2,8. بشكل عام ، تعد هذه المنصة طريقة فعالة للتنميط الميكانيكي للخلايا المفردة.
Protocol
1. تصميم هندسة الجهاز
- اختر عرض أجزاء التحجيم والاسترداد بحيث تكون أوسع من قطر أكبر الخلايا المراد قياسها ولكنها تحافظ أيضا على نسبة إشارة إلى ضوضاء كافية (SNR). انظر الجدول التكميلي 2 للحصول على أمثلة لعروض مقاطع التحجيم والاسترداد المختلفة لخطوط الخلايا المختلفة.
- اختر عرض مقطع الانكماش لتطبيق سلالة 30٪ -40٪ على متوسط حجم الخلايا التي ستخضع للتنميط الميكانيكي. يتم تعريف الإجهاد على أنه
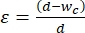 ، حيث d هو قطر الخلية و wc هو عرض قناة الانكماش 2,8. انظر الجدول التكميلي 2 لمعرفة عروض مقطع الانكماش المختلفة لخطوط الخلايا المختلفة.
، حيث d هو قطر الخلية و wc هو عرض قناة الانكماش 2,8. انظر الجدول التكميلي 2 لمعرفة عروض مقطع الانكماش المختلفة لخطوط الخلايا المختلفة.
ملاحظة: إذا رغب المرء في مقارنة أنواع الخلايا أو ظروفها بأقطار مختلفة اختلافا جوهريا ، فيجب استخدام تصميمات منفصلة للأجهزة مع عرض مقطع انكماش خاص بكل نوع / حالة خلية. - تصميم جهاز مرجعي لكل هندسة جهاز فريدة. هذا ضروري لتحديد De ، القطر الفعال لجزء المسام التحجيم لقناة الموائع الدقيقة.
ملاحظة: يستخدم الجهاز المرجعي نفس الشكل الهندسي مثل الجهاز الأساسي. التعديل الوحيد هو أن جزء الانكماش يجب أن يكون مساويا في العرض لجزء مسام التحجيم للسماح بالمعايرة مع حبات البوليسترين ذات الحجم المعروف. يؤدي توسيع الانكماش إلى منع حبات البوليسترين من انسداد قناة الانكماش أثناء المعايرة. يتم وصف عملية المعايرة بمزيد من التفصيل في الخطوتين 4.1 و 5.3.1. يمكن أيضا تحقيق المعايرة باستخدام عداد خلوي متاح تجاريا ، وفي هذه الحالة ، لا يلزم وجود جهاز مرجعي. يتم وصف هذه العملية في الخطوة 4.2. - اختر ارتفاع القناة بحيث يمكن لأكبر الخلايا ذات الأهمية أن تستطيل تماما دون قيود داخل جزء الانكماش2. تأكد من أن ارتفاع القناة أكبر من hmin
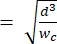 (يفترض هذا أن الخلية كروية قبل التشوه ، وأن التشوه متساوي القياس يحدث على طول القناة وارتفاعها أثناء التشوه).
(يفترض هذا أن الخلية كروية قبل التشوه ، وأن التشوه متساوي القياس يحدث على طول القناة وارتفاعها أثناء التشوه).
ملاحظة: بالنظر إلى حجم النبضة الفرعية الحالية ، كلما زاد حجم hmin ،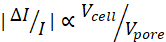 انخفض إجمالي نسبة الإشارة إلى الضوضاء (SNR).
انخفض إجمالي نسبة الإشارة إلى الضوضاء (SNR). - تصميم وإنشاء قناع ضوئي باستخدام برنامج تصميم بمساعدة الكمبيوتر مع عرض القناة المختارة. يتم توفير ملف مثال في الملف التكميلي 1. قم بقياس تصميم قناع الموائع الدقيقة بنسبة 1.5٪ لحساب انكماش polydimethylsiloxane (PDMS) بعد التقشير من المعلم السلبي.
ملاحظة: يمكن تضمين مجموعة من الأجهزة على قناع واحد طالما أن المصفوفة الإجمالية لا تتجاوز حجم الرقاقة (الشكل التكميلي 1 أ). - تصميم وإنشاء قناع ضوئي بأقطاب كهربائية سيتم استخدامها لإجراء قياس مسبار من أربع نقاط لتيار جهاز الموائع الدقيقة (الشكل 1 د). يتم توفير ملف مثال في الملف التكميلي 1.
ملاحظة: يمكن تضمين مجموعة من الأقطاب الكهربائية على قناع واحد طالما أن المصفوفة لا تتجاوز حجم الشريحة الزجاجية (الشكل التكميلي 1B).
2. تصنيع الأجهزة (الشكل 2)
- إعداد أنماط القطب على الركيزة الزجاجية.
- قم بتدوير طبقة ونمط ومعالجة مقاومة ضوئية إيجابية على شريحة زجاجية عادية وفقا لورقة بيانات المنتج. ويرد مثال على هذا الإجراء في الملف التكميلي 2.
- أداء ترسيب المعادن ، والرفع ، وحفر الذهب.
- قم بإجراء ترسيب الأغشية الرقيقة ل 75 Å Ti و 250 Å Pt و 250 Å Au على الشريحة. مثال على هذا الإجراء باستخدام تبخر مسدس الإلكترون موضح في الملف التكميلي 3.
- اغمر الشريحة في الأسيتون لمدة 15 دقيقة لأداء رفع المعدن الزائد.
- في غطاء الدخان ، استخدم ماصة يمكن التخلص منها لإسقاط حفر الذهب المصبوب على منطقة الأقطاب الكهربائية التي ستتعرض لقناة الموائع الدقيقة ، كما هو موضح في الشكل التكميلي 2. كن حذرا لتجنب إسقاط etchant في مكان آخر على الشريحة.
تنبيه: يمكن أن يسبب الذهب تهيج الجلد والعين. لا تتنفس الأبخرة ، ولا تبتلع. تعامل بحذر ، وارتد معدات الحماية الشخصية المناسبة (PPE) ، وتخلص من النفايات وفقا للوائح التخلص المحلية. - اشطف الشريحة بالماء منزوع الأيونات (DI) وجففها بالنيتروجين الجاف (N2).
- إذا تمت طباعة أقطاب كهربائية متعددة على نفس الشريحة الزجاجية ، فقم بتقسيم الشريحة إلى شرائح فردية.
- استخدم أداة قطع الزجاج لتسجيل الشريحة على طول حدود القطب المنقوش.
- كسر الزجاج على طول النتيجة لتقسيم الشريحة إلى رقائق فردية.
- افحص بصريا الأقطاب الكهربائية تحت المجهر. تأكد من أن الأقطاب الكهربائية الفردية ليست مفتوحة كهربائيا أو أن الأقطاب الكهربائية لا تقصر معا.
- تصنيع قالب رئيسي سلبي للقنوات.
- قم بتدوير طبقة ونمط ومعالجة مقاومة الإيبوكسي SU-8 على رقاقة سيليكون مصقولة وفقا لورقة بيانات المنتج. ويرد مثال على هذا الإجراء في الملف التكميلي 2.
- قم بقياس ارتفاعات الميزات باستخدام مقياس الملف الشخصي وافحص بصريا الميزات تحت المجهر (الشكل التكميلي 3). تأكد من أن الأشكال الهندسية المطلوبة محددة جيدا.
- قنوات PDMS العفن مع الطباعة الحجرية الناعمة.
- قم بإعداد PDMS عن طريق وزن المطاط الصناعي والرابط المتشابك بنسبة كتلة 10: 1 في كوب يمكن التخلص منه.
ملاحظة: بالنسبة للرقاقة التي يبلغ قطرها 3 ، يكفي 30 جم من PDMS. - امزج PDMS بقوة لمدة 30 ثانية باستخدام شوكة يمكن التخلص منها ، حتى يصبح PDMS معتما بالفقاعات.
- قم بإزالة الغاز من PDMS في غرفة مفرغة لمدة 30-90 دقيقة تقريبا ، أو حتى يصبح PDMS شفافا بدون فقاعات مرئية.
- ضع الرقاقة مع القالب الرئيسي SU-8 في طبق بتري يمكن التخلص منه واسكب PDMS فوق وسط الرقاقة.
- ضع طبق بتري الذي يحتوي على PDMS والرقاقة في غرفة مفرغة وتخلص من الغاز لمدة 30 دقيقة تقريبا ، أو حتى لا تبقى فقاعات في PDMS.
- اخبز PDMS على حرارة 80 درجة مئوية لمدة 2 ساعة في فرن أو على طبق ساخن.
- باستخدام شفرة حادة ، قم بقص وإزالة PDMS من المعلم السلبي SU-8.
- قم بتقطيع لوح PDMS المصبوب إلى قوالب فردية باستخدام شفرة حادة
- قلب فتحات الوصول إلى المدخل والمخرج باستخدام لكمة خزعة يمكن التخلص منها. للحصول على أفضل النتائج ، استخدم لكمة جديدة لكل لوح PDMS. تنتج اللكمة الأكثر حدة ثقوبا ذات حواف ناعمة ، مما يقلل من الجسيمات التي يمكن أن تعيق قناة الانكماش.
ملاحظة: يجب أن يكون قطر فتحات الوصول أقل بقليل من القطر الخارجي للأنبوب. على سبيل المثال ، في حالة استخدام أنابيب polytetrafluoroethylene (PTFE) بقطر خارجي 1/32 بوصة ، يجب ثقب ثقب 1.5 مم.
- قم بإعداد PDMS عن طريق وزن المطاط الصناعي والرابط المتشابك بنسبة كتلة 10: 1 في كوب يمكن التخلص منه.
- اربط ركيزة زجاجية / كهربائية بقنوات PDMS.
- نظف شرائح زجاج القطب بالميثانول (≥99.8٪). تجف مع الجافة N2.
- قم بتنظيف جهاز PDMS بشريط سكوتش ، متبوعا بشطف بكحول الأيزوبروبيل (IPA) والماء منزوع الأيونات (DI ؛ 18 MΩ / cm2). تجف مع الجافة N2. ثم نظف بشريط سكوتش مرة أخرى.
- ضع الركيزة الزجاجية بأقطاب كهربائية مسبقة الصنع وقالب PDMS المحضر (جانب الميزة لأعلى) في منظف البلازما.
- تعريض كليهما لبلازما الأكسجين لمدة 2 دقيقة (100-300 mTorr ، 30 W).
- قم بمحاذاة قالب PDMS ووضعه بحيث يكون الجانب المميز متجها لأسفل على الركيزة الزجاجية باستخدام أقطاب كهربائية مسبقة الصنع.
ملاحظة: يكون الترابط فوريا بمجرد ملامسة PDMS المعالج بالبلازما والزجاج ؛ وبالتالي ، لن يكون من الممكن إجراء المزيد من تعديلات المحاذاة. لتسهيل المحاذاة ، يمكن سحب 20 ميكرولتر من تخفيف 2: 1 من الميثانول في ماء DI على سطح الزجاج المعالج بالبلازما. يعمل محلول الميثانول كحاجز مادي بين الزجاج المعالج ونظام PDMS ، مما يسمح بتعديلات المحاذاة. في حالة استخدام الميثانول ، اخبز الجهاز المحاذي والتزاوج عند 50 درجة مئوية لمدة 2 ساعة لتبخير المحلول وإكمال عملية الترابط. - افحص بصريا الجهاز المستعبدين تحت المجهر. تأكد من محاذاة الأقطاب الكهربائية وهندسة القناة بشكل صحيح.
3. قياس الخلايا (الشكل 1 د)
- قم بإعداد مصدر الضغط وثنائي الفينيل متعدد الكلور وأجهزة الطاولة وبرامج الحصول على البيانات.
- قم بتوصيل جهاز الموائع الدقيقة بثنائي الفينيل متعدد الكلور باستخدام المشبك. يتم توفير مثال على ثنائي الفينيل متعدد الكلور في الملف التكميلي 4 (ملفات GERBER) والملف التكميلي 5 (ملفات قائمة الأجزاء التخطيطية واللوحة وثنائي الفينيل متعدد الكلور).
- قم بمحاذاة دبابيس المشبك المحملة بنابض مع وسادات تلامس القطب على جهاز الموائع الدقيقة وقم بمحاذاة دبابيس رأس المشبك مع الثقوب الموجودة على ثنائي الفينيل متعدد الكلور.
- أدخل دبابيس رأس المشبك بإحكام في فتحات ثنائي الفينيل متعدد الكلور ، مع التأكد من بقاء المسامير المحملة بنابض محاذية لوسادات تلامس القطب الكهربائي.
- إعداد وتوصيل الأجهزة الإلكترونية.
- قم بتوصيل اثنين من منافذ إخراج مصدر الطاقة بمنفذ جهد إمداد ثنائي الفينيل متعدد الكلور باستخدام محول أنثى مزدوج من قابس الموز إلى حربة Neill-Concelman (BNC) وكابل BNC.
- قم بتشغيل مصدر الطاقة. اضبط الإخراج المتصل بالموصل الداخلي ل BNC على +15 فولت واضبط الإخراج الآخر على -15 فولت. قم بتمكين كلا المخرجين لتشغيل الدائرة.
- قم بتوصيل ثلث منافذ إخراج مصدر الطاقة بمنفذ جهد الدخل لثنائي الفينيل متعدد الكلور باستخدام كابل BNC. اضبط الإخراج على الجهد المطبق المطلوب ، لكن لا تقم بتمكينه حتى بدء التجربة.
- قم بتوصيل منفذ تيار الإخراج الخاص ب PCB بإدخال المضخم الأولي الحالي باستخدام كابل BNC.
- قم بتوصيل إخراج المضخم الأولي الحالي بإدخال تناظري واحد على كتلة محطة BNC لنظام الحصول على البيانات باستخدام كابل BNC. اختياريا ، قم بتوصيل مرشح ترددات منخفضة تناظري بما يتماشى مع كبل BNC لتصفية التداخل عالي التردد.
ملاحظة: لتحسين نسبة الإشارة إلى الضوضاء (SNR) ، يمكن وضع ثنائي الفينيل متعدد الكلور والجهاز داخل حاوية معدنية سميكة. يمكن توجيه جميع كابلات BNC والأنابيب السائلة من خلال ثقوب محفورة في العلبة.
- تثبيت وإعداد البرنامج المطلوب على الكمبيوتر الشخصي (PC)
- قم بتشغيل وتوصيل وحدة التحكم في الضغط بجهاز الكمبيوتر. قم بتثبيت أي برنامج تحكم في الضغط مطلوب وفقا لتعليمات الشركة المصنعة.
- قم بتثبيت MATLAB وصندوق أدوات الحصول على البيانات على جهاز الكمبيوتر. تأكد من تثبيت برامج التشغيل المطلوبة لنظام الحصول على البيانات حتى تتمكن واجهة MATLAB Data Acquisition Toolbox من اكتشافها.
- قم بتنزيل البرنامج النصي للحصول على البيانات المضمن ، "NPS.m" ، من https://github.com/sohnlab/node-pore-sensing-public.
- افتح البرنامج النصي للحصول على البيانات وقم بتكوينه.
- قم بتعيين القيم الصحيحة لتهيئة جلسة الحصول على البيانات، والتي تتضمن معرف المورد ومعرف جهاز DAQ ورقم قناة الإدخال التمثيلية (الأسطر 34-36 في البرنامج النصي المضمن).
ملاحظة: يمكن العثور على معرف الجهاز باستخدام الدالة "daq.getDevices" أو "daqlist". - قم بتعيين معدل العينة المطلوب للاكتساب (السطر 23 في البرنامج النصي المضمن). للحصول على أفضل النتائج ، يجب ضبطه على 10 كيلو هرتز على الأقل.
- قم بتعيين القيم الصحيحة لتهيئة جلسة الحصول على البيانات، والتي تتضمن معرف المورد ومعرف جهاز DAQ ورقم قناة الإدخال التمثيلية (الأسطر 34-36 في البرنامج النصي المضمن).
- قم بتوصيل جهاز الموائع الدقيقة بثنائي الفينيل متعدد الكلور باستخدام المشبك. يتم توفير مثال على ثنائي الفينيل متعدد الكلور في الملف التكميلي 4 (ملفات GERBER) والملف التكميلي 5 (ملفات قائمة الأجزاء التخطيطية واللوحة وثنائي الفينيل متعدد الكلور).
- تحضير تعليق الخلية.
- تحضير محلول من مصل بقري جنيني 2٪ (FBS) في محلول ملحي مخزن بالفوسفات 1x (PBS) ، وقم بترشيحه بمرشح 0.22 ميكرومتر.
- زراعة وإعداد الخلايا وفقا لبروتوكول زراعة الخلايا المناسب لخط الخلية المختار. الخلايا في المحلول المحضر بنسبة 2٪ FBS في 1x PBS بتركيز 1-5 × 105 خلايا / مل. الحفاظ على الخلايا على الجليد طوال مدة التجارب.
- قياس الخصائص الفيزيائية للخلايا.
- قم بتحميل عينة الخلية في الأنبوب وقم بتوصيلها بمدخل الجهاز.
- قطع 30 سم من أنابيب PTFE بشفرة حلاقة أو سكين حاد.
- قم بتوصيل أحد طرفي الأنبوب بحقنة قفل لور. استخدم المحقنة لسحب عينة الخلية في الطرف الآخر من الأنبوب.
- أدخل الأنبوب بعناية في مدخل الجهاز.
- قم بتوصيل الطرف المقابل للأنبوب بجهاز التحكم في ضغط الموائع الدقيقة.
ملاحظة: يمكن إضافة مرشح بين وحدة التحكم في ضغط الموائع الدقيقة والأنبوب لمنع ارتجاع السائل إلى وحدة التحكم في الضغط.
- قم بتشغيل التجربة.
- اضبط ضغط القيادة الثابت المطلوب على برنامج التحكم في الضغط واترك العينة تملأ الجهاز.
ملاحظة: الضغط عادة 2-21 كيلو باسكال. يجب أن تكون سرعة التدفق بطيئة بما يكفي للسماح بنبضات محددة بوضوح ولكنها سريعة بما يكفي للسماح بالإنتاجية الكافية.- إذا تشكلت فقاعات في قنوات الموائع الدقيقة ، فاستخدم حشوة مسدودة: قم بتوصيل منفذ الجهاز وتطبيق ضغط منخفض على المدخل لإجبار الهواء على الخروج من خلال PDMS المنفذ للغاز. سيؤدي ترك الفقاعات في القناة إلى خط أساس تيار غير مستقر ويمنع القياسات الدقيقة.
- إذا كان الحطام يسد قناة الموائع الدقيقة ، فقم بإزاحته عن طريق الضغط برفق على الجزء العلوي من جهاز PDMS أثناء تطبيق ضغط القيادة ، أو "نبض" ضغط أعلى عن طريق تبديل الضغط وإيقاف تشغيله ، أو إزالة الأنبوب وإعادة إدخاله. إذا بقي الحطام ، فقد يكون من الضروري التبديل إلى جهاز جديد.
- اضبط الجهد المطلوب عن طريق تدوير مقبض الجهد على مصدر الطاقة وتمكين الجهد بالضغط على زر التشغيل .
ملاحظة: الجهد عادة ما يكون 1-5 فولت. اختر أقل جهد ضروري للحصول على نسبة الإشارة إلى الضوضاء (SNR) المناسبة. يجب استخدام نفس الجهد في جميع الظروف للمقارنة. - قم بتشغيل المضخم الأولي الحالي واضبط الحساسية (A / V) عند أدنى مستوى ممكن ؛ بدلا من ذلك ، اضبط الكسب (V / A) على أعلى مستوى ممكن دون التحميل الزائد على المضخم الأولي أو تجاوز الحد الأقصى لجهد الدخل التناظري ل DAQ. في هذه الدراسة ، تم ضبط الحساسية على 10-7 A / V.
ملاحظة: ستعتمد قيمة الحساسية / الكسب المناسبة على كل من الجهد المطبق وكذلك مقاومة خط الأساس لقناة الموائع الدقيقة. - اضغط على الزر " تشغيل" الأخضر في قائمة شريط MATLAB لبدء البرنامج النصي للحصول على البيانات NPS.m والبدء في أخذ العينات وحفظ البيانات.
- لإنهاء التجربة ، اضغط على الزر إيقاف في الزاوية اليسرى السفلية من نافذة الشكل لإيقاف البرنامج النصي للحصول على البيانات. قم بتعطيل خرج مصدر الطاقة بالضغط على الزر تشغيل . اضبط مصدر الضغط على ضغط صفري في برنامج التحكم في الضغط.
- في هذه المرحلة، يمكن إيقاف التجربة مؤقتا للقيام بواحد أو أكثر مما يلي:
- استبدل الجهاز الحالي بجهاز جديد.
- أعد تحميل الأنبوب بمزيد من عينات الخلايا.
ملاحظة: لتجنب التلوث المتبادل للعينة ، استخدم أجهزة جديدة لقياس الخلايا من أنواع أو ظروف مختلفة. - قم بفك الجهاز من ثنائي الفينيل متعدد الكلور وفحص حالة القناة تحت المجهر. لإعادة تشغيل التجربة باستخدام نفس الجهاز ، يجب الحرص على عدم إدخال فقاعات الهواء. قد يكون من الضروري الضغط برفق على مكبس المحقنة للحفاظ على عينة الخلية في نهاية الأنبوب أثناء إدخالها في مدخل الجهاز.
- اضبط ضغط القيادة الثابت المطلوب على برنامج التحكم في الضغط واترك العينة تملأ الجهاز.
- قم بتحميل عينة الخلية في الأنبوب وقم بتوصيلها بمدخل الجهاز.
4. معايرة جهاز الموائع الدقيقة
- الخيار 1: قياس حبات البوليسترين في الأجهزة المرجعية.
- اختر حجم حبة البوليسترين أصغر من قناة التحجيم.
- أضف 1.5٪ من حبات التوين والبوليسترين إلى محلول PBS و FBS المصفى المستخدم أثناء تجارب الخلية ، بتركيز 1-3 × 105 خرز / مل.
- تابع التجربة كما هو موضح في القسم 3 ، باستخدام الجهاز المرجعي الموضح في الخطوة 1.3 ، وقم بتطبيق نفس الجهد المستخدم أثناء التجربة. استخدم متوسط حجم القطرة الحالية الناتجة أثناء عبور الخرز لمسام التحجيم والقطر المعروف للخرز لحساب De ، كما هو موضح في القسم 5.
- الخيار 2: قم بقياس حجم الخلية بشكل مستقل باستخدام جهاز قياس منفصل.
- بدلا من اتباع البروتوكول في الخطوة 4.1، استخدم أداة قياس حجم الخلية المتاحة تجاريا لقياس متوسط حجم الخلايا في العينة. في هذه الحالة ، ليست هناك حاجة إلى جهاز مرجعي. استخدم متوسط انخفاض التيار الناتج أثناء عبور الخلايا لمسام التحجيم ومتوسط قطر الخلية المقاس لحساب De كما هو موضح في القسم 5.
5. تحليل البيانات لاستخراج الأنماط الظاهرية للخلية
ملاحظة: يمكن إجراء معالجة البيانات باستخدام ملف برنامج واجهة سطر الأوامر MATLAB mNPS_procJOVE.m في https://github.com/sohnlab/NPS-analysis-JOVE. انظر الملف التكميلي 6 لمزيد من التعليمات.
- المعالجة المسبقة للبيانات (الشكل 3 أ).
- احسب التيار الكهربائي المقاس من خلال تطبيق قيمة الكسب المستخدمة في مضخم التيار إلى الجهد على البيانات الأولية التي حصل عليها DAQ.
- قم بإزالة الضوضاء عالية التردد عن طريق تطبيق وظيفة تجانس مستطيلة و / أو مرشح تمرير منخفض على قياس التيار الخام. بعد ذلك، أعد تشكيل البيانات التي تمت تصفيتها إلى معدل عينة أقل. أيضا ، احسب بيانات الطابع الزمني المقابلة بمعدل العينة المنخفض هذا.
- احسب إشارة تيار خط الأساس المجهزة من خلال تطبيق طريقة مثل تنعيم المربعات الصغرى غير المتماثلة26.
- احسب المشتق الأول التقريبي (إشارة الفرق) للبيانات الحالية المعالجة مسبقا عن طريق أخذ الفرق بين نقاط البيانات اللاحقة.
- تحديد أحداث الخلية واستخراج بيانات النبض الفرعي (الشكل 3 ب).
- ابحث عن أحداث الخلية المرشحة عن طريق فحص البيانات المعالجة مسبقا. رفض أحداث الخلية التي تتداخل مع أحداث الخلية الأخرى (أي أحداث الصدفة) (الشكل التكميلي 4) ، أو تظهر ملاءمة أساسية ضعيفة ، أو يكون لها شكل نبض غير متوقع أو خاطئ (على سبيل المثال ، حيث قد يكون هناك انسداد في القناة).
- استخراج بيانات النبض الفرعي لكل حدث خلية.
- سيظهر كل مقطع من مسام العقدة كنبضة فرعية مقابلة داخل نبضة الإشارة الكلية (الشكلان 1B ، C). حدد بداية كل نبضة فرعية عن طريق حساب النقطة الزمنية عندما تصل إشارة الفرق إلى قيمة دنيا محلية. حدد نهاية كل نبضة فرعية عن طريق حساب النقطة الزمنية عندما تصل إشارة الفرق إلى قيمة قصوى محلية.
- حدد عرض كل نبضة فرعية كالوقت المنقضي بين نقطتي وقت البدء والانتهاء. حدد سعة كل نبضة فرعية عن طريق حساب متوسط الفرق بين التيار المقاس وتيار خط الأساس لجميع نقاط البيانات بين نقطتي وقت البداية والانتهاء.
- تحديد النمط الميكانيكي للخلية لكل حدث خلية بناء على بيانات النبضة الفرعية.
- أوجد قطر الخلية d بناء على المعادلة المعرفة بواسطة Deblois و Bean24:
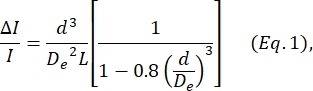
حيث ΔI / I هو متوسط نسبة سعة النبضة الفرعية إلى تيار خط الأساس في النبضات الفرعية للحجم ، De هو القطر الفعال للقناة (يقاس في الخطوة 4) ، و L هو الطول الإجمالي لقناة مسام العقدة.- يتم تحديد D e عن طريق حساب متوسط ΔI / I الناتج عن مجموعة من الجسيمات ذات القطر المعروف (إما الخلايا أو الخرز ، انظر الخطوة 4) ، باستخدام هذا القطر المعروف باسم d ، وحل Eq. 1 ل De.
- تحديد مقاومة الخلية للتشوه.
- حدد سرعة تدفق السائل U عن طريق حساب متوسط سرعة الخلية في النبضات الفرعية للتحجيم ، باستخدام أطوال الأجزاء المعروفة والمدة المقاسة لكل نبضة فرعية.
- حدد مؤشر تشوه الخلية الكاملة (wCDI) ، الذي حدده Kim et al.2 على النحو التالي:
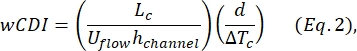
حيث L c هو طول قطعة الانكماش ، والقناة h هي ارتفاع القناة ، و ΔTc هي مدة النبضة الفرعية للانكماش.
- حدد وقت تعافي الخلية من التشوه ، والذي يعرف بأنه أول نبضة استرداد فرعية بسعة في حدود 8٪ من متوسط السعة من النبضة الفرعيةللحجم 2.
- احسب التشوه المستعرض للخلية داخل الجزء الانكماشي.
- احسب القطر الفعال لمقطع الانكماش (De ، c) كما هو محدد بواسطة Kim et al.2:
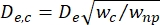 ، حيث w c هو عرض قطعة الانكماش و wnp هو عرض جميع الأجزاء الأخرى.
، حيث w c هو عرض قطعة الانكماش و wnp هو عرض جميع الأجزاء الأخرى. - احسب القطر الكروي المكافئ dc للخلية داخل الانكماش باستخدام المعادلة المعرفة بواسطة Deblois و Bean24:
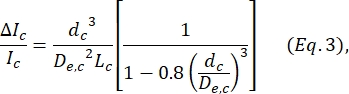
حيث ΔI c / I c هي نسبة سعة النبضة الفرعية إلى تيار خط الأساس في النبضة الفرعية للانكماش و Lc هي طول مقطع الانكماش. - احسب طول استطالة الخلية Lكما هو موضح بواسطة Kim et al.2:
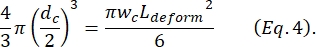
- أخيرا ، احسب التشوه العرضي للخلية δالتشوه ، والذي حدده Kim et al.2 على أنه
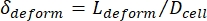 .
.
- احسب القطر الفعال لمقطع الانكماش (De ، c) كما هو محدد بواسطة Kim et al.2:
- أوجد قطر الخلية d بناء على المعادلة المعرفة بواسطة Deblois و Bean24:
النتائج
منصة التنميط الميكانيكي المعروضة هنا هي طريقة بسيطة ومتعددة الاستخدامات لقياس الخصائص الفيزيائية الحيوية للخلايا المفردة ذات الإنتاجية المعتدلة. تتدفق الخلايا عبر قناة الموائع الدقيقة (الشكل 1 أ) باستخدام تدفق ثابت مدفوع بالضغط. أثناء عبور الخلايا ، يتم تسجيل طول قناة ال...
Discussion
يتكون قياس الخواص الميكانيكية للخلايا المفردة باستخدام تقنية التنميط الميكانيكي هذه من ثلاث مراحل: تصنيع الجهاز ، والحصول على البيانات ، وتحليل البيانات. في كل مرحلة ، هناك جوانب بارزة قد تؤثر بشكل كبير على النتائج التجريبية. أثناء تصنيع الجهاز ، تعد هندسة القناة المتسقة والتوحيد من جهاز...
Disclosures
يحمل L. L. S براءة الاختراع الأمريكية رقم 11,383,241: "استشعار العقدة الميكانيكية للمسام" ، J. Kim و S. Han و L. L. Sohn ، الصادرة في 12 يوليو 2022.
Acknowledgements
تم دعم هذا البحث بمنح من NIBIB 1R01EB024989-01 و NCI 1R01CA190843-01. تم دعم A. L. و R. R. من خلال زمالة أبحاث الدراسات العليا لجمعية H2H8. تم دعم K. L. C. من خلال زمالة أبحاث الدراسات العليا لمؤسسة العلوم الوطنية وزمالة Siebel Scholar.
Materials
| Name | Company | Catalog Number | Comments |
| Acetone | J.T. Baker | 5356-05 | Purity (GC) ≥ 99.5% (https://us.vwr.com/store/product/6057739/acetone-99-5-vlsi-j-t-baker) |
| Aluminum Foil | n/a | n/a | |
| Analog Low-Pass Filter | ThorLabs | EF504 | ≤240 kHz Passband, Coaxial BNC Feedthrough (https://www.thorlabs.com/thorproduct.cfm?partnumber=EF504#ad-image-0) |
| Biopsy Punch | Integra Miltex | 33-31AA-P/25 | 1mm, Disposable, with Plunger (https://mms.mckesson.com/product/573313/Miltex-33-31AA-P25) |
| Blade | n/a | n/a | |
| BNC Cable | Pomona Electronics | 2249-C-12 | https://www.digikey.com/en/products/detail/pomona-electronics/2249-C-12/603323?utm_adgroup=Coaxial%20Cables%20%28RF%29&utm_source=google&utm_ medium=cpc&utm_campaign= Shopping_Product_Cable%20Assemblies_NEW&utm_term= &utm_content=Coaxial%20Cables%20%28RF%29&gclid=Cj0KCQjwlK-WBhDjARIsAO2sErQqnVJ pj5OXVObuTI8ZUf1ZeIn7zvzGnx mCWdePrG6SdEJMF3X6ubUaAs w-EALw_wcB |
| Cleanroom Polyester Swab | Thermo Fisher Scientific | 18383 | https://www.fishersci.com/shop/products/texwipe-cleantip-alpha-polyester-series-swabs-6/18383 |
| Current Preamplifier | DL Instruments | 1211 | https://www.brltest.com/index.php?main_page=product_info&products_ id=1419 |
| Custom PCB (w/ components) | n/a | n/a | see Supplemental files 4 and 5 |
| DAQ Terminal Block | National Instruments | BNC-2120 | https://www.ni.com/en-in/support/model.bnc-2120.html |
| DAQ to BNC-2110 cable | National Instruments | SHC68-68-EPM | https://www.ni.com/en-in/support/model.shc68-68-epm.html |
| Data Acquisition Board (DAQ) | National Instruments | PCI-6251 | https://www.ni.com/docs/en-US/bundle/pci-6251-feature/page/overview.html |
| Dessicator | Thermo Fisher Scientific | 5311-0250 | https://www.thermofisher.com/order/catalog/product/5311-0250 |
| Female BNC To Banana Plug Adapter | Pomona Electronics | 72909 | https://www.digikey.com/en/products/detail/pomona-electronics/72909/1196318 |
| Fetal Bovine Serum (FBS) | VWR | 89510-186 | https://us.vwr.com/store/product/18706419/avantor-seradigm-select-grade-usda-approved-origin-fetal-bovine-serum-fbs |
| Glass Cutter | Chemglass | CG-1179-21 | https://chemglass.com/plate-glass-cutters-diamond-tips |
| Gold Etchant TFA | Transene | NC0977944 | https://www.fishersci.com/shop/products/NC0977944/NC0977944 |
| Hot Plate | Thermo Fisher Scientific | SP131825 | |
| Isopropyl Alcohol | Spectrum Chemical | I1056-4LTPL | Purity (GC) ≥99.5% (https://www.spectrumchemical.com/isopropyl-alcohol-99-percent-fcc-i1056) |
| Metal Hardware Enclosure | Hammond Manufacturing | EJ12126 | https://www.digikey.com/en/products/detail/hammond-manufacturing/EJ12126/2423415 |
| Methanol | Sigma-Aldrich | 34860 | Purity (GC) ≥99.8% (https://www.sigmaaldrich.com/IN/en/substance/methanol320467561) |
| MF-321 Developer | Kayaku Advanced Materials | n/a | https://kayakuam.com/products/mf-321/ |
| MICROPOSIT S1813 Positive Photoresist | DuPont | n/a | https://kayakuam.com/products/microposit-s1800-g2-series-photoresists/ |
| Phosphate Buffered Saline (PBS) | Thermo Fisher Scientific | 10010049 | https://www.thermofisher.com/order/catalog/product/10010049?SID=srch-hj-10010049 |
| Photomask | Fineline Imaging | n/a | Photomask are custom ordered from our CAD designs (https://www.fineline-imaging.com/) |
| Plain Glass Microscope Slide | Fisher Scientific | 12-553-5B | Material: Soda Lime, L75 x W50 mm, Thickness: 0.90–1.10 mm |
| Plasma Cleaner | Harrick Plasma | PDC-001 | https://harrickplasma.com/plasma-cleaners/expanded-plasma-cleaner/ |
| Plastic Petri Dish | Thermo Fisher Scientific | FB0875712 | 100 mm (https://www.fishersci.com/shop/products/fisherbrand-petri-dishes-clear-lid-raised-ridge-100-x-15mm/FB0875712) |
| Pressure Controller | Fluigent | MFCS-EZ | https://www.fluigent.com/research/instruments/pressure-flow-controllers/mfcs-series/ |
| Pressure Controller Software | Fluigent | MAESFLO | |
| Programming & Computation Software | MATLAB | R2021b | for data acquisition and analysis (https://www.mathworks.com/products/matlab.html) |
| PTFE Tubing | Cole Parmer | 06417-31 | 0.032" ID x 0.056" (https://www.coleparmer.com/i/masterflex-transfer-tubing-microbore-ptfe-0-032-id-x-0-056-od-100-ft-roll/0641731) |
| Scepter 2.0 Handheld Automatic Cell Counter | Millapore Sigma | PHCC20060 | https://www.sigmaaldrich.com/IN/en/product/mm/phcc20060 |
| Silicon Wafer | Wafer World | 2885 | 76.2 mm, Single Side Polished (https://www.waferworld.com/product/2885) |
| Spin Coater | n/a | n/a | |
| SU-8 3025 Negative Photoresist | Kayaku Advanced Materials | n/a | https://kayakuam.com/products/su-8-2000/ |
| SU8 Developer | Kayaku Advanced Materials | n/a | https://kayakuam.com/products/su-8-developer/ |
| Sygard 184 Polydimethlysiloxane | Dow Chemical | 4019862 | https://www.ellsworth.com/products/by-market/consumer-products/encapsulants/silicone/dow-sylgard-184-silicone-encapsulant-clear-0.5-kg-kit/ |
| Tape | Scotch | 810-341296 | https://www.staples.com/Scotch-Magic-Tape-810-3-4-x-36-yds-1-Core/product_130567?cid=PS:GS:SBD:PLA:OS&gclid= Cj0KCQjwlK-WBhDjARIsAO 2sErRwzrrgjU0NjFkDkne1xm vT7ekS3tdzvAgiMDwPoxocgH VTQZi7vJgaAvQZEALw_wcB |
| Titanium, Platinum, Gold | n/a | n/a | |
| Triple Output Power Supply | Keysight | E36311A | https://www.newark.com/keysight-technologies/e36311a/dc-power-supply-3o-p-6v-5a-prog/dp/15AC9653 |
| UV Mask Aligner | Karl Suss America | MJB3 Mask Aligner |
References
- Pegoraro, A. F., Janmey, P., Weitz, D. A. Mechanical properties of the cytoskeleton and cells. Cold Spring Harbor Perspectives in Biology. 9 (11), 022038 (2017).
- Kim, J., et al. Characterizing cellular mechanical phenotypes with mechano-node-pore sensing. Microsystems & Nanoengineering. 4, 17091 (2018).
- Mierke, C. T. Bidirectional mechanical response between cells and their microenvironment. Frontiers in Physics. 9, 619 (2021).
- Kumar, S., Weaver, V. M. Mechanics, malignancy, and metastasis: The force journey of a tumor cell. Cancer and Metastasis Reviews. 28 (1), 113-127 (2009).
- Nia, H. T., Munn, L. L., Jain, R. K. Physical traits of cancer. Science. 370 (6516), (2020).
- Fletcher, D. A., Mullins, R. D. Cell mechanics and the cytoskeleton. Nature. 463 (7280), 485-492 (2010).
- Wirtz, D., Konstantopoulos, K., Searson, P. C. The physics of cancer: The role of physical interactions and mechanical forces in metastasis. Nature Reviews Cancer. 11 (7), 512-522 (2011).
- Li, B., et al. Mechanical phenotyping reveals unique biomechanical responses in retinoic acid-resistant acute promyelocytic leukemia. iScience. 25 (2), 103772 (2022).
- Kozminsky, M., Sohn, L. L. The promise of single-cell mechanophenotyping for clinical applications. Biomicrofluidics. 14 (3), 031301 (2020).
- Li, M., Dang, D., Liu, L., Xi, N., Wang, Y. Atomic force microscopy in characterizing cell mechanics for biomedical applications: A review. IEEE Transactions on Nanobioscience. 16 (6), 523-540 (2017).
- Wottawah, F., et al. Optical rheology of biological cells. Physical Review Letters. 94 (9), 1-4 (2005).
- Darling, E. M., Di Carlo, D. High-throughput assessment of cellular mechanical properties. Annual Review of Biomedical Engineering. 17 (1), 35-62 (2015).
- Carey, T. R., Cotner, K. L., Li, B., Sohn, L. L. Developments in label-free microfluidic methods for single-cell analysis and sorting. Wiley Interdisciplinary Reviews: Nanomedicine and Nanobiotechnology. 11 (1), 1529 (2019).
- Bagnall, J. S., et al. Deformability of tumor cells versus blood cells. Scientific Reports. 5, 18542 (2015).
- Byun, S., et al. Characterizing deformability and surface friction of cancer cells. Proceedings of the National Academy of Sciences. 110 (19), 7580-7585 (2013).
- Otto, O., et al. Real-time deformability cytometry: On-the-fly cell mechanical phenotyping. Nature Methods. 12 (3), 199-202 (2015).
- Gossett, D. R., et al. Hydrodynamic stretching of single cells for large population mechanical phenotyping. Proceedings of the National Academy of Sciences. 109 (20), 7630-7635 (2012).
- Guck, J., Chilvers, E. R. Mechanics meets medicine. Science Translational Medicine. 5 (212), 3-6 (2013).
- Balakrishnan, K. R., et al. Node-pore sensing: A robust, high-dynamic range method for detecting biological species. Lab on a Chip. 13 (7), 1302-1307 (2013).
- Carbonaro, A., Sohn, L. L. A resistive-pulse sensor chip for multianalyte immunoassays. Lab on a Chip. 5 (10), 1155-1160 (2005).
- Saleh, O. A., Sohn, L. L. Direct detection of antibody-antigen binding using an on-chip artificial pore. Proceedings of the National Academy of Sciences. 100 (3), 820-824 (2003).
- Saleh, O. A., Sohn, L. L. An artificial nanopore for molecular sensing. Nano Letters. 3 (1), 37-38 (2003).
- Saleh, O. A., Sohn, L. L. Quantitative sensing of nanoscale colloids using a microchip Coulter counter. Review of Scientific Instruments. 72 (12), 4449-4451 (2001).
- DeBlois, R. W., Bean, C. P. Counting and sizing of submicron particles by the resistive pulse technique. Review of Scientific Instruments. 41 (7), 909-916 (1970).
- Li, B., et al. Evaluating sources of technical variability in the mechano-node-pore sensing pipeline and their effect on the reproducibility of single-cell mechanical phenotyping. PLoS ONE. 16 (10), 0258982 (2021).
- Zhang, Z. M., Chen, S., Liang, Y. Z. Baseline correction using adaptive iteratively reweighted penalized least squares. Analyst. 135 (5), 1138-1146 (2010).
- Alibert, C., Goud, B., Manneville, J. B. Are cancer cells really softer than normal cells. Biology of the Cell. 109 (5), 167-189 (2017).
- Fujiwara, I., Zweifel, M. E., Courtemanche, N., Pollard, T. D. Latrunculin A accelerates actin filament depolymerization in addition to sequestering actin monomers. Current Biology. 28 (19), 3183-3192 (2018).
- Saleh, O. A. . A novel resistive pulse sensor for biological measurements. , (2003).
- Dokukin, M. E., Guz, N. V., Sokolov, I. Quantitative study of the elastic modulus of loosely attached cells in AFM indentation experiments. Biophysical Journal. 104 (10), 2123-2131 (2013).
- Li, Q., Lim, C. T., Goh, J. C. H., et al. Probing the elasticity of breast cancer cells using AFM. 13th International Conference on Biomedical Engineering. IFMBE Proceedings. 23, 2122-2125 (2009).
- Rother, J., et al. Atomic force microscopy-based microrheology reveals significant differences in the viscoelastic response between malign and benign cell lines. Open Biology. 4 (5), 140046 (2014).
- Li, Q., et al. AFM indentation study of breast cancer cells. Biochemical and Biophysical Research Communications. 374 (4), 609-613 (2008).
- Xu, C., et al. Elasticity measurement of breast cancer cells by atomic force microscopy. Proc. SPIE 9230. Twelfth International Conference on Photonics and Imaging in Biology and Medicine. (PIBM 2014). 92300, (2014).
- Alcaraz, J., et al. Microrheology of human lung epithelial cells measured by atomic force microscopy. Biophysical Journal. 84 (3), 2071-2079 (2003).
- Li, M., Dang, D., Liu, L., Xi, N., Wang, Y. Atomic force microscopy in characterizing cell mechanics for biomedical applications: A review. IEEE Transactions on Nanobioscience. 16 (6), 523-540 (2017).
- Urbanska, M., et al. A comparison of microfluidic methods for high-throughput cell deformability measurements. Nature Methods. 17, 587-593 (2020).
- Hill, R. T., Chilkoti, A. Surface Patterning. Biomaterials Science: An Introduction to Materials: Third Edition. , 276-301 (2013).
- Wang, Z., Volinsky, A. A., Gallant, N. D. Crosslinking effect on polydimethylsiloxane elastic modulus measured by custom-built compression instrument. Journal of Applied Polymer Science. 131 (22), 41050 (2014).
- Gibson, L. J. The hierarchical structure and mechanics of plant materials. Journal of the Royal Society Interface. 9 (76), 2749-2766 (2012).
- Stephens, A. D., Banigan, E. J., Adam, S. A., Goldman, R. D., Marko, J. F. Chromatin and lamin a determine two different mechanical response regimes of the cell nucleus. Molecular Biology of the Cell. 28 (14), 1984-1996 (2017).
- Rosenbluth, M. J., Lam, W. A., Fletcher, D. A. Force microscopy of nonadherent cells: A comparison of leukemia cell deformability. Biophysical Journal. 90 (8), 2994-3003 (2006).
- Evers, T. M. J., Holt, L. J., Alberti, S., Mashaghi, A. Reciprocal regulation of cellular mechanics and metabolism. Nature Metabolism. 3 (4), 456-468 (2021).
- Balakrishnan, K. R., et al. Node-pore sensing enables label-free surface-marker profiling of single cells. Analytical Chemistry. 87 (5), 2988-2995 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved