A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
חישת נקבוביות Mechano-node: פלטפורמה מהירה ונטולת תוויות למדידות ויסקואלסיות של תאים בודדים מרובי פרמטרים
* These authors contributed equally
In This Article
Summary
מוצגת כאן שיטה לפנוטיפ מכני של תאים בודדים באמצעות פלטפורמה מיקרופלואידית מבוססת אלקטרוניקה הנקראת חישת נקבוביות מכאנו-צומת (mechano-NPS). פלטפורמה זו שומרת על תפוקה מתונה של 1-10 תאים לשנייה תוך מדידת התכונות הביופיזיות האלסטיות והצמיגיות של התאים.
Abstract
תכונות מכניות תאיות מעורבות במגוון רחב של תהליכים ביולוגיים ומחלות, החל מהתמיינות תאי גזע ועד גרורות סרטניות. שיטות קונבנציונליות למדידת תכונות אלה, כגון מיקרוסקופיית כוח אטומי (AFM) ושאיפת מיקרופיפטה (MA), לוכדות מידע עשיר, המשקף את התגובה הצמיגית המלאה של התא; עם זאת, שיטות אלה מוגבלות על ידי תפוקה נמוכה מאוד. גישות בעלות תפוקה גבוהה, כגון ציטומטריה של עיוות בזמן אמת (RT-DC), יכולות למדוד רק מידע מכני מוגבל, מכיוון שלעתים קרובות הן מוגבלות לקריאות של פרמטר יחיד המשקפות רק את התכונות האלסטיות של התא. בניגוד לשיטות אלה, חישת נקבוביות מכאנו-צומת (mechano-NPS) היא פלטפורמה מיקרופלואידית גמישה, נטולת תוויות, המגשרת על הפער בהשגת מדידות ויסקו-אלסטיות מרובות פרמטרים של תא בעל תפוקה מתונה. מדידת זרם ישר (DC) משמשת לניטור תאים בזמן שהם עוברים בתעלה מיקרופלואידית, ועוקבת אחר גודלם ומהירותם לפני, במהלך ואחרי שהם נאלצים לעבור התכווצות צרה. מידע זה (כלומר, גודל ומהירות) משמש לכימות העיוות הרוחבי של כל תא, עמידות בפני דפורמציה והתאוששות מעיוות. באופן כללי, פלטפורמה מיקרופלואידית זו, המבוססת על אלקטרוניקה, מספקת תכונות ויסקו-אלסטיות מרובות של התא, ובכך תמונה מלאה יותר של המצב המכני של התא. מכיוון שהיא דורשת הכנת דגימה מינימלית, משתמשת במדידה אלקטרונית פשוטה (בניגוד למצלמה במהירות גבוהה), ומנצלת את ייצור הליתוגרפיה הרכה הסטנדרטית, היישום של פלטפורמה זו הוא פשוט, נגיש וניתן להתאמה לניתוח במורד הזרם. הגמישות, התועלת והרגישות של פלטפורמה זו סיפקו מידע מכני ייחודי על מגוון רחב של תאים, עם פוטנציאל ליישומים רבים נוספים במדע בסיסי ובאבחון קליני.
Introduction
תאים בודדים הם חומרים דינמיים, ויסקואלסטיים1. ריבוי תהליכים פנימיים וחיצוניים (למשל, הופעת מיטוזה או שיפוץ מחדש של המטריצה החוץ-תאית [ECM]), משפיעים על המבנה וההרכב שלהם 2,3,4, ולעתים קרובות התוצאה היא תכונות ביופיזיות נפרדות המשלימות את מצבם הנוכחי. בפרט, תכונות מכניות הוכחו כסמנים ביולוגיים חשובים של התפתחות תאים, פיזיולוגיה ופתולוגיה, המניבים מידע כמותי רב ערך שיכול להשלים גישות מולקולריות וגנטיות קנוניות 5,6,7. לדוגמה, Li et al. תיארו לאחרונה את ההבדלים המכניים בין תאי לוקמיה פרומיאלוציטיים חריפים עמידים לתרופות ומגיבים לתרופות, תוך שימוש ב-RNA-seq כדי לחשוף גנים הקשורים לציטוסקלטון8 המתבטאים באופן דיפרנציאלי. על ידי הבנת יחסי הגומלין המורכבים בין מכניקת התא הבודד לבין תפקוד התא, למכנופנוטיפינג יש יישומים רחבים יותר בשינוי המדע הבסיסי והאבחון הקליני9.
הכלי הנפוץ ביותר למדידת מכניקה של תא בודד הוא מיקרוסקופיית כוח אטומי (AFM). בעוד ש-AFM מאפשר מדידה מקומית ברזולוציה גבוהה של תכונות מכניות סלולריות, הוא נותר מוגבל לתפוקה של <0.01 תאים לשנייה10. לחלופין, אלונקות אופטיות, המשתמשות בשתי קרני לייזר מסתעפות כדי ללכוד ולעוות תאים בודדים תלויים11, מוגבלות לתפוקה גבוהה יותר באופן שולי של <1 תאים/שנייה12. ההתקדמות האחרונה בטכנולוגיות מיקרופלואידיות אפשרה דור חדש של התקנים להערכה מכנית מהירה, חד-תאית,12,13. טכניקות אלה משתמשות בתעלות כיווץ צרות 14,15, זרימת גזירה 16, או מתיחה הידרודינמית17 כדי לעוות תאים במהירות בתפוקות של 10-1,000 תאים לשנייה 18. בעוד שקצב המדידה של גישות אלה מהיר משמעותית מטכניקות קונבנציונליות, לעתים קרובות הן מחליפות יכולות תפוקה גבוהה עבור קריאות מכניות מוגבלות (טבלה משלימה 1). כל השיטות המיקרופלואידיות המהירות שהוזכרו לעיל מתמקדות במדדים בסיסיים בעלי פרמטר יחיד, כגון זמן מעבר או יחסי עיוות, המשקפים רק את התכונות האלסטיות של התא. עם זאת, בהתחשב באופי הצמיגי הפנימי של תאים בודדים, אפיון מכני חזק ויסודי של תאים דורש התחשבות לא רק ברכיבים אלסטיים אלא גם בתגובות צמיגות.
חישת נקבוביות מכאנו-צומת (mechano-NPS)2,8 (איור 1A) היא פלטפורמה מיקרופלואידית שמטפלת במגבלות הקיימות באמצעות מכנופנוטיפ חד-תאי. שיטה זו מאפשרת מדידה של מספר פרמטרים ביופיזיים בו זמנית, כולל קוטר התא, עיוות יחסי וזמן התאוששות מעיוות, עם תפוקה מתונה של 1-10 תאים לשנייה. טכניקה זו מבוססת על חישת נקבוביות צמתים (NPS)19,20,21,22,23,24, הכוללת שימוש במדידת בדיקה בת ארבע נקודות כדי למדוד את פולס הזרם המווסת המיוצר על ידי תא העובר בתעלה מיקרופלואידית אשר פולחה על ידי אזורים רחבים יותר, המכונים "צמתים". פולס הזרם המווסת הוא תוצאה של התא שחוסם חלקית את זרימת הזרם במקטעים (כלומר, "נקבוביות") ובצמתים, כאשר יותר זרם חסום בראשון מאשר באחרון. במכאנו-NPS, מקטע אחד, "תעלת הכיווץ", צר יותר מקוטר התא; כתוצאה מכך, תא חייב להתעוות כדי לעבור את כל הערוץ (איור 1B). ניתן לקבוע את קוטר התא על ידי גודל התת-פולס שנוצר כאשר התא עובר את נקבוביות הצומת לפני ערוץ ההתכווצות (איורים 1B,C). כאן, |ΔInp|, הטיפה הנוכחית כאשר התא נמצא בנקבובית, פרופורציונלית ליחס הנפח של התא לנקבובית, נקבובית תא/V 2,8,19. ניתן לקבוע את קשיחות התא על ידי ΔTc, משך הזמן של תת-הדופק הגדול יותר באופן דרמטי שנוצר כאשר התא עובר את תעלת הכיווץ (איורים 1B,C). תא נוקשה יותר ייקח זמן רב יותר לעבור את התעלה מאשר תא רךיותר 2,8. לבסוף, "התאוששות" התא, יכולתו של התא לחזור לגודלו ולצורתו המקוריים לאחר העיוות, יכולה להיקבע על-ידי סדרת תת-הפולסים המיוצרים כאשר התא עובר את נקבוביות הצומת לאחר ערוץ ההתכווצות (איורים 1B,C). זמן ההחלמה, ΔTr, הוא הזמן שלוקח לתת-פולסים הנוכחיים לחזור לגודל של תת-הפולסים הקודמים, לפני שהתא נסחט. באופן כללי, פולסי הזרם המווסתים המיוצרים כאשר תא עובר את התעלה המיקרופלואידית מתועדים ומנותחים כדי לחלץ את הפרמטרים המכניים הרלוונטיים של תא יחיד (איור 1D)2,8.
יכולת השחזור וקלות השימוש בפלטפורמה מיקרופלואידית מבוססת אלקטרוניקה זו הודגמו בעבר25. בנוסף, הפלטפורמה מהווה חסם כניסה נמוך עבור מכנופנוטיפינג חד-תאי. ליתוגרפיה רכה סטנדרטית משמשת לייצור התקנים מיקרופלואידיים. חומרת המדידה מורכבת מרכיבים זולים, כולל מעגל מודפס פשוט (PCB), ספק כוח, preamplifier, לוח איסוף נתונים (DAQ) ומחשב. לבסוף, קוד ידידותי למשתמש זמין לרכישה וניתוח של נתונים, ומאפשר יישום פשוט. טכניקה זו של מכניופנוטיפינג יכולה להבחין בין אוכלוסיות של קווי תאי אפיתל שדיים וריאות לא ממאירים וממאירים, להבחין בין תת-שומנות בתאי אפיתל ראשוניים של יונקים אנושיים, ולאפיין את ההשפעות של הפרעות ציטוסקלטליות וחומרים פרמקולוגיים אחרים 2,8. באופן כללי, פלטפורמה זו היא גישה יעילה עבור mechanophenotyping של תאים בודדים.
Protocol
1. עיצוב גיאומטריה של המכשיר
- בחר את רוחב מקטעי הגודל והשחזור כך שיהיה רחב יותר מקוטר התאים הגדולים ביותר שיש למדוד, אך גם שומר על יחס אות לרעש (SNR) מספיק. ראה טבלה משלימה 2 לקבלת דוגמאות לרוחב מקטעי גודל ושחזור שונים עבור קווי תאים שונים.
- בחר את רוחב מקטע הכיווץ כדי להחיל זן של 30%-40% על הגודל הממוצע של התאים שאמורים לעבור מכנופנוטיפ. זן מוגדר כ
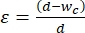 - , כאשר d הוא קוטר התא ו- wc הוא רוחב ערוץ הכיווץ 2,8. ראה טבלה משלימה 2 לרוחבי מקטעי כיווץ שונים עבור קווי תאים שונים.
- , כאשר d הוא קוטר התא ו- wc הוא רוחב ערוץ הכיווץ 2,8. ראה טבלה משלימה 2 לרוחבי מקטעי כיווץ שונים עבור קווי תאים שונים.
הערה: אם רוצים להשוות סוגי תאים או תנאים עם קטרים שונים באופן מהותי, יש להשתמש בעיצובי מכשירים נפרדים עם רוחבי מקטעי כיווץ ספציפיים לכל סוג/מצב תא. - תכנן התקן ייחוס עבור כל גיאומטריה ייחודית של התקן. זה הכרחי לקביעת De, הקוטר האפקטיבי של קטע נקבוביות גודל של הערוץ microfluidic.
הערה: התקן הייחוס משתמש באותה גיאומטריה כמו ההתקן הראשי. השינוי היחיד הוא שמקטע הכיווץ צריך להיות שווה ברוחבו למקטע הנקבוביות הגודל כדי לאפשר כיול עם חרוזי פוליסטירן בגודל ידוע. הרחבת הכיווץ מונעת מחרוזי הפוליסטירן לסתום את תעלת הכיווץ במהלך הכיול. תהליך הכיול מתואר בהרחבה בשלבים 4.1 ו- 5.3.1. כיול יכול להתבצע גם באמצעות מונה תאים זמין מסחרית, ובמקרה זה, אין צורך במכשיר ייחוס. תהליך זה מתואר בשלב 4.2. - בחר את גובה הערוץ כך שהתאים הגדולים ביותר בעלי העניין יוכלו להתארך באופן מלא ללא הגבלה בתוך מקטע הכיווץ2. ודא שגובה התעלה גדול מ-h min
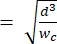 (זאת בהנחה שהתא הוא כדורי לפני דפורמציה, ושהעיוות האיזומטרי מתרחש לאורך התעלה וגובהה במהלך העיוות).
(זאת בהנחה שהתא הוא כדורי לפני דפורמציה, ושהעיוות האיזומטרי מתרחש לאורך התעלה וגובהה במהלך העיוות).
הערה: בהינתן הגודל של תת-פולס נוכחי, , ככל ש-h min גדול יותר,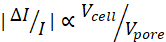 כך ה-SNR הכולל יהיה נמוך יותר.
כך ה-SNR הכולל יהיה נמוך יותר. - תכנן וצור מסיכת צילום באמצעות תוכנת עיצוב בעזרת מחשב עם רוחב הערוצים שנבחר. קובץ לדוגמה מופיע בקובץ משלים 1. הגדילו את עיצוב המסכה המיקרופלואידית ב-1.5% כדי להסביר את ההתכווצות של פולידימתילסילוקסן (PDMS) לאחר קילוף מהמאסטר השלילי.
הערה: ניתן לכלול מערך התקנים על מסכה אחת כל עוד המערך הכולל אינו חורג מגודל הוופל (איור משלים 1A). - תכננו וצרו מסכת פוטו עם אלקטרודות שישמשו לביצוע מדידה של ארבע נקודות של זרם המכשיר המיקרופלואידי (איור 1D). קובץ לדוגמה מופיע בקובץ משלים 1.
הערה: ניתן לכלול מערך של אלקטרודות על מסכה אחת כל עוד המערך אינו חורג מגודל שקופית הזכוכית (איור משלים 1B).
2. התקני ייצור (איור 2)
- הכינו תבניות אלקטרודה על מצע זכוכית.
- סובבו את הציפוי, התבנית ועבדו פוטו-סיסט חיובי על גבי שקופית זכוכית רגילה בהתאם לגיליון נתוני המוצר. דוגמה להליך זה מתוארת בקובץ משלים 2.
- בצע תצהיר מתכת, הרמה ותחריט זהב.
- בצע תצהיר סרט דק של 75 Å Ti, 250 Å Pt ו- 250 Å Au על המגלשה. דוגמה להליך זה באמצעות אידוי אקדח אלקטרונים מתוארת בקובץ משלים 3.
- יש לטבול את המגלשה באצטון למשך 15 דקות כדי לבצע הרמה של עודפי מתכת.
- במכסה אדים, השתמשו בפיפטה חד-פעמית כדי להפיל יציקת זהב על אזור האלקטרודות שייחשפו לתעלה המיקרופלואידית, כפי שמוצג באיור משלים 2. היזהר כדי להימנע מהשמטת etchant במקום אחר בשקופית.
אזהרה: אצטרובל זהב עלול לגרום לגירוי בעור ובעיניים. אין לנשום אדים, ואין לבלוע. טפלו בזהירות, לבשו ציוד מגן אישי מתאים (PPE) והשליכו פסולת בהתאם לתקנות הסילוק המקומיות. - שטפו את המגלשה במים שעברו דה-יוניזציה (DI) ויבשו אותה בחנקן יבש (N2).
- אם מספר אלקטרודות מודפסות על אותה שקופית זכוכית, חפרו את השקופית לשבבים בודדים.
- השתמש בכלי חיתוך זכוכית כדי להבקיע את השקופית לאורך גבולות האלקטרודה המעוצבת.
- שברו את הזכוכית לאורך הציון כדי לחלק את השקופית לשבבים בודדים.
- בדוק חזותית את האלקטרודות תחת מיקרוסקופ. ודא שאלקטרודות בודדות אינן פתוחות חשמלית או שאלקטרודות אינן מקוצרות זו לזו.
- לייצר תבנית אב שלילית עבור ערוצים.
- סובבו את הציפוי, התבנית ועבדו התנגדות אפוקסי SU-8 על פרוסת סיליקון מלוטשת בהתאם לגיליון נתוני המוצר. דוגמה להליך זה מתוארת בקובץ משלים 2.
- מדוד גבהי תכונות באמצעות פרופילומטר ובדוק באופן חזותי את התכונות תחת מיקרוסקופ (איור משלים 3). ודא שהגיאומטריות הרצויות מוגדרות היטב.
- עובש ערוצי PDMS עם ליתוגרפיה רכה.
- הכינו PDMS על ידי שקילת אלסטומר וקרוסלינקר ביחס מסה של 10:1 בכוס חד פעמית.
הערה: עבור רקיק בקוטר 3 אינץ ', 30 גרם של PDMS מספיק. - ערבבו את ה-PDMS במרץ במשך 30 שניות עם מזלג חד פעמי, עד שה-PDMS אטום עם בועות.
- נטרלו את הגז PDMS בתא ואקום למשך כ-30-90 דקות, או עד שה-PDMS יהיה שקוף ללא בועות נראות לעין.
- מניחים את הוופל עם התבנית הראשית SU-8 לתוך צלחת פטרי חד פעמית ויוצקים PDMS על מרכז הוופל.
- מניחים את צלחת הפטרי המכילה את ה-PDMS ואת הוופל בתא ואקום ומנטרלים את הגז למשך כ-30 דקות, או עד שלא נשארות בועות ב-PDMS.
- אופים את ה-PDMS בטמפרטורה של 80 מעלות צלזיוס במשך שעתיים בתנור או על פלטה חשמלית.
- עם להב חד, לחתוך ולהסיר את PDMS מן המאסטר שלילי SU-8.
- חותכים את לוח ה-PDMS המעוצב לתבניות נפרדות באמצעות להב חד
- ליבת חורי הגישה לכניסה וליציאה באמצעות ניקוב ביופסיה חד פעמי. לקבלת התוצאות הטובות ביותר, השתמש בניקוב חדש עבור כל לוח PDMS. ניקוב חד יותר מייצר חורים בעלי קצוות חלקים, הממזערים חלקיקים שעלולים לחסום את תעלת הכיווץ.
הערה: קוטר חורי הגישה צריך להיות מעט פחות מהקוטר החיצוני של הצינורות. לדוגמה, אם משתמשים בצינורות polytetrafluoroethylene (PTFE) בקוטר חיצוני של 1/32 אינץ ', יש לנקב חור של 1.5 מ"מ.
- הכינו PDMS על ידי שקילת אלסטומר וקרוסלינקר ביחס מסה של 10:1 בכוס חד פעמית.
- חברו מצע זכוכית/אלקטרודה לערוצי PDMS.
- נקו את שקופיות הזכוכית האלקטרודה עם מתנול (≥99.8%). יבש עם יבש N2.
- נקו את מכשיר ה-PDMS עם סרט סקוטש, ולאחר מכן שטפו אותו עם איזופרופיל אלכוהול (IPA) ומים שעברו דה-יוניזציה (DI; 18 MΩ/cm2). יבש עם יבש N2. לאחר מכן, לנקות עם סרט סקוטש פעם נוספת.
- הניחו את מצע הזכוכית עם אלקטרודות טרומיות ואת תבנית PDMS המוכנה (צד תכונה כלפי מעלה) לתוך חומר ניקוי פלזמה.
- חשוף את שניהם לפלסמה חמצן למשך 2 דקות (100-300 mTorr, 30 W).
- יישרו והניחו את תבנית ה-PDMS כשצד התכונה פונה כלפי מטה על מצע הזכוכית עם אלקטרודות טרומיות.
הערה: ההדבקה מתבצעת באופן מיידי ברגע שה-PDMS והזכוכית המטופלים בפלזמה באים במגע; כתוצאה מכך, שינויי יישור נוספים לא יתאפשרו. כדי להקל על היישור, ניתן להעביר 20 μL של דילול 2:1 של מתנול במי DI על משטח הזכוכית המטופל בפלזמה. תמיסת המתנול משמשת כמחסום פיזי בין הזכוכית המטופלת לבין PDMS, ומאפשרת התאמות יישור. אם משתמשים במתנול, אופים את המכשיר המיושר והמזווג בטמפרטורה של 50°C למשך שעתיים כדי לאדות את התמיסה ולהשלים את תהליך ההדבקה. - בדוק חזותית את המכשיר מלוכד תחת מיקרוסקופ. ודא שהאלקטרודות וגיאומטריות הערוץ מיושרות כהלכה.
3. מדידת תאים (איור 1D)
- הכן את מקור הלחץ, ה- PCB, חומרת הספסל ותוכנת איסוף הנתונים.
- חבר את ההתקן המיקרופלואידי ללוח המעגלים המודפסים באמצעות המהדק. דוגמה ל- PCB מופיעה בקובץ משלים 4 (קבצי GERBER) ובקובץ משלים 5 (קבצי רשימה סכמטיים, לוחות וחלקי PCB).
- יישר את הפינים הטעונים בקפיץ של המהדק עם רפידות המגע של האלקטרודה במכשיר המיקרופלואידי ויישר את פיני ראש המהדק עם החורים בלוח המעגלים המודפסים.
- הכנס בחוזקה את פיני הראש של המהדק לתוך חורי ה- PCB, וודא שהפינים הטעונים בקפיץ נשארים מיושרים עם רפידות המגע של האלקטרודה.
- הגדר וחבר את החומרה האלקטרונית.
- חבר שתיים מיציאות הפלט של ספק הכוח ליציאת מתח האספקה של ה-PCB באמצעות מתאם נקבה כפול של בננה ל-Baynet-Neill-Concelman (BNC) וכבל BNC.
- הפעל את ספק הכוח. הגדר את הפלט המחובר למוליך הפנימי של ה-BNC ל-+15 V והגדר את הפלט השני ל-15 V. אפשר לשתי היציאות להפעיל את המעגל.
- חבר את השלישי מבין יציאות היציאה של ספק הכוח ליציאת מתח הכניסה של ה- PCB באמצעות כבל BNC. הגדר את הפלט למתח המופעל הרצוי, אך אל תפעיל אותו עד לתחילת הניסוי.
- חבר את יציאת זרם הפלט של ה- PCB לקלט של קדם-המגבר הנוכחי באמצעות כבל BNC.
- חבר את הפלט של קדם-המגבר הנוכחי לכניסה אנלוגית אחת בבלוק מסוף BNC של מערכת רכישת הנתונים באמצעות כבל BNC. לחלופין, חבר מסנן אנלוגי בעל מעבר נמוך בקו עם כבל BNC כדי לסנן הפרעות בתדר גבוה.
הערה: כדי לשפר את ה-SNR, ייתכן שה-PCB וההתקן מאוחסנים בתוך מארז מתכת עבה. ניתן לנתב את כל כבלי BNC וצינורות נוזליים דרך חורים שנקדחו לתוך המארז.
- התקן והגדר את התוכנה הנדרשת במחשב האישי (PC)
- הפעל וחבר את בקר הלחץ למחשב. התקן את כל תוכנות בקר הלחץ הנדרשות בהתאם להוראות היצרן.
- התקן את MATLAB ואת ארגז הכלים לרכישת נתונים במחשב. ודא שמנהלי ההתקנים הדרושים עבור מערכת רכישת הנתונים מותקנים כך שממשק ארגז הכלים לרכישת נתונים של MATLAB יוכל לזהות אותה.
- הורד את סקריפט רכישת הנתונים הכלול, "NPS.m", מתוך https://github.com/sohnlab/node-pore-sensing-public.
- פתח וקבע את התצורה של קובץ ה- Script לרכישת נתונים.
- הגדר את הערכים הנכונים לאתחול הפעלת רכישת הנתונים, הכוללת את מזהה הספק, מזהה ההתקן של ה- DAQ ומספר ערוץ הקלט האנלוגי (שורות 34-36 בסקריפט הכלול).
הערה: ניתן למצוא את מזהה המכשיר באמצעות הפונקציה "daq.getDevices" או "daqlist". - הגדר את קצב הדגימה הרצוי לרכישה (שורה 23 בסקריפט הכלול). לקבלת תוצאות אופטימליות, זה צריך להיות מוגדר לפחות 10 קילוהרץ.
- הגדר את הערכים הנכונים לאתחול הפעלת רכישת הנתונים, הכוללת את מזהה הספק, מזהה ההתקן של ה- DAQ ומספר ערוץ הקלט האנלוגי (שורות 34-36 בסקריפט הכלול).
- חבר את ההתקן המיקרופלואידי ללוח המעגלים המודפסים באמצעות המהדק. דוגמה ל- PCB מופיעה בקובץ משלים 4 (קבצי GERBER) ובקובץ משלים 5 (קבצי רשימה סכמטיים, לוחות וחלקי PCB).
- הכן את השעיית התא.
- הכינו תמיסה של 2% סרום בקר עוברי (FBS) בתמיסת מלח 1x עם אגירת פוספט (PBS), וסננו עם מסנן של 0.22 מיקרומטר.
- תרבית והכן את התאים על פי פרוטוקול תרבית התאים המתאים של קו התאים המועדף. להשעות את התאים בתמיסה מוכנה של 2% FBS ב 1x PBS בריכוז של 1-5 x 105 תאים / מ"ל. שמור את התאים על הקרח למשך הניסויים.
- מדוד את התכונות הפיזיקליות של התאים.
- טען את דגימת התא לתוך הצינורות וחבר אותה לכניסת המכשיר.
- חותכים 30 ס"מ של צינורות PTFE בעזרת סכין גילוח או סכין חדה.
- חברו קצה אחד של הצינורות למזרק מנעול לואר. השתמש במזרק כדי למשוך את דגימת התא לקצה השני של הצינור.
- הכנס בזהירות את הצינורות לתוך הכניסה של המכשיר.
- חבר את הקצה הנגדי של הצינורות לבקר הלחץ המיקרופלואידי.
הערה: ניתן להוסיף מסנן בין בקר הלחץ המיקרופלואידי לבין הצינורות כדי למנוע זרימה חוזרת של נוזלים לבקר הלחץ.
- הפעל את הניסוי.
- הגדר את לחץ הנהיגה הקבוע הרצוי בתוכנת בקר הלחץ ואפשר לדגימה למלא את המכשיר.
הערה: הלחץ הוא בדרך כלל 2-21 kPa. מהירות הזרימה חייבת להיות איטית מספיק כדי לאפשר פולסים מוגדרים בבירור, אך מהירה מספיק כדי לאפשר תפוקה מספקת.- אם נוצרות בועות בתעלות המיקרופלואידיות, השתמש במילוי ללא מוצא: חבר את שקע ההתקן והפעל לחץ נמוך על הכניסה כדי להוציא אוויר דרך ה-PDMS החדיר לגז. השארת בועות בערוץ תוביל לקו בסיס זרם לא יציב ותמנע מדידות מדויקות.
- אם פסולת סותמת את התעלה המיקרופלואידית, יש לנתק אותה על-ידי לחיצה קלה על החלק העליון של התקן ה-PDMS תוך כדי הפעלת לחץ הנהיגה, "פעימת" לחץ גבוה יותר על-ידי הפעלה וכיבוי של הלחץ, או הסרת הצינור והכנסתו מחדש. אם הפסולת נשארת, ייתכן שיהיה צורך לעבור למכשיר חדש.
- הגדר את המתח הרצוי על-ידי סיבוב כפתור המתח בספק הכוח והפעל את המתח על-ידי לחיצה על לחצן מופעל .
הערה: המתח הוא בדרך כלל 1-5 V. בחר את המתח הנמוך ביותר הדרוש עבור SNR הולם. יש להשתמש באותו מתח בכל התנאים להשוואה. - הפעל את קדם-המגבר הנוכחי והגדר את הרגישות (A/V) נמוכה ככל האפשר; לחלופין, הגדר את הרווח (V/A) גבוה ככל האפשר מבלי להעמיס יתר על המידה על הקדם-אמפליפייר או לחרוג ממתח הכניסה האנלוגי המרבי של ה-DAQ. במחקר זה, הרגישות הוגדרה ל-10-7 A/V.
הערה: ערך הרגישות/רווח הנכון יהיה תלוי הן במתח המופעל והן בהתנגדות הבסיסית של התעלה המיקרופלואידית. - לחץ על לחצן ההפעלה הירוק בתפריט רצועת הכלים MATLAB כדי להתחיל את סקריפט רכישת הנתונים NPS.m ולהתחיל לדגום ולשמור את הנתונים.
- כדי לסיים את הניסוי, לחץ על לחצן עצור בפינה השמאלית התחתונה של חלון האיור כדי לעצור את סקריפט רכישת הנתונים. השבת את פלט ספק הכוח על-ידי לחיצה על לחצן מופעל . הגדר את מקור הלחץ ללחץ אפס בתוכנת בקר הלחץ.
- בשלב זה, ניתן להשהות את הניסוי כדי לבצע אחת או יותר מהפעולות הבאות:
- החלף את ההתקן הנוכחי בהתקן חדש.
- טען מחדש את הצינורות עם דגימות תאים נוספות.
הערה: כדי למנוע זיהום צולב לדוגמה, השתמש בהתקנים חדשים כדי למדוד תאים מסוגים או תנאים שונים. - שחרר את המכשיר מה- PCB ובדוק את מצב הערוץ תחת מיקרוסקופ. כדי להפעיל מחדש את הניסוי באמצעות אותו מכשיר, יש להיזהר שלא להכניס בועות אוויר. ייתכן שיהיה צורך להפעיל לחץ עדין על בוכנת המזרק כדי לשמור על דגימת התא בקצה הצינור תוך הכנסתה לכניסת המכשיר.
- הגדר את לחץ הנהיגה הקבוע הרצוי בתוכנת בקר הלחץ ואפשר לדגימה למלא את המכשיר.
- טען את דגימת התא לתוך הצינורות וחבר אותה לכניסת המכשיר.
4. כיול המכשיר המיקרופלואידי
- אפשרות 1: מדוד את חרוזי הפוליסטירן במכשירי ייחוס.
- בחר גודל חרוז פוליסטירן הקטן מערוץ הגודל.
- הוסיפו 1.5% חרוזי טווין ופוליסטירן לתמיסת PBS ו-FBS המסוננת המשמשת במהלך ניסויי התא, בריכוז של 1-3 x 105 חרוזים/מ"ל.
- המשך בניסוי כמתואר בסעיף 3, תוך שימוש בהתקן הייחוס המתואר בשלב 1.3, והפעל את אותו מתח המשמש במהלך הניסוי. השתמש בגודל הממוצע של הטיפה הנוכחית המיוצרת כאשר חרוזים עוברים את נקבוביות הגודל ואת הקוטר הידוע של החרוזים כדי לחשב את D e, כמתואר בסעיף 5.
- אפשרות 2: מדוד באופן עצמאי את גודל התא באמצעות מכשיר מדידה נפרד.
- במקום לעקוב אחר הפרוטוקול בשלב 4.1, השתמש במכשיר מסחרי למדידת גודל התא כדי למדוד את הגודל הממוצע של התאים בדגימה. במקרה זה, אין צורך במכשיר ייחוס. השתמש בטיפת הזרם הממוצעת הנוצרת כאשר תאים עוברים את נקבובית הגודל ואת קוטר התא הממוצע הנמדד כדי לחשב את De כמתואר בסעיף 5.
5. ניתוח נתונים לחילוץ פנוטיפים של תאים
הערה: ניתן לבצע עיבוד נתונים באמצעות קובץ תוכנית ממשק שורת הפקודה MATLAB mNPS_procJOVE.m בשעה https://github.com/sohnlab/NPS-analysis-JOVE. ראה קובץ משלים 6 לקבלת הוראות נוספות.
- עיבוד מקדים של הנתונים (איור 3A).
- חשב את הזרם החשמלי הנמדד על-ידי החלת ערך הרווח המשמש בקדם-אמפליפייר מזרם למתח על הנתונים הגולמיים הנרכשים על-ידי ה- DAQ.
- הסר רעשים בתדר גבוה על-ידי החלת פונקציית החלקה מלבנית ו/או מסנן מעבר נמוך על מדידת הזרם הגולמי. לאחר מכן, דגום מחדש את הנתונים המסוננים לקצב דגימה נמוך יותר. כמו כן, חשב את נתוני חותמת הזמן המתאימים בקצב דגימה נמוך זה.
- חשב אות זרם בסיסי מותאם על-ידי יישום שיטה כגון החלקת ריבועים מינימליים אסימטריים26.
- חשב את הנגזרת הראשונה המשוערת (אות ההפרש) של הנתונים הנוכחיים המעובדים מראש על-ידי לקיחת ההפרש בין נקודות הנתונים הבאות.
- זהה אירועים בתאים וחלץ נתוני תת-פולסים (איור 3B).
- חפש אירועים סלולריים מועמדים על ידי בחינת הנתונים המעובדים מראש. דחיית אירועי תאים החופפים לאירועי תא אחרים (כלומר, אירועי צירוף מקרים) (איור משלים 4), הצגת התאמה בסיסית ירודה, או צורת פולס בלתי צפויה או שגויה (לדוגמה, כאשר ייתכן שסתום היה נוכח בערוץ).
- חלץ נתוני תת-פולס עבור כל אירוע תא.
- כל מקטע נקבוביות של צומת יופיע כתת-פולס מתאים בתוך פולס האות הכולל (איורים 1B, C). זהה את ההתחלה של כל תת-פולס על-ידי חישוב נקודת הזמן שבה אות ההפרש מגיע לערך מינימלי מקומי. זהה את הקצה של כל תת-פולס על-ידי חישוב נקודת הזמן שבה אות ההפרש מגיע לערך מרבי מקומי.
- קבע את הרוחב של כל תת-פולס כזמן שחלף בין נקודות זמן ההתחלה והסיום. קבע את המשרעת של כל תת-מתח על-ידי חישוב ממוצע ההפרש בין הזרם הנמדד לזרם הבסיסי עבור כל נקודות הנתונים בין נקודות זמן ההתחלה והסיום.
- קבע את המכנופנוטיפ של התא עבור כל אירוע תא בהתבסס על נתוני תת-התנועה.
- קבע את קוטר התא d בהתבסס על המשוואה שהוגדרה על ידי Deblois ו- Bean24:
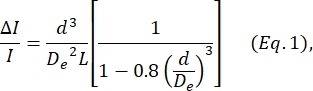
כאשר ΔI/I הוא היחס הממוצע בין משרעת תת-פולס לזרם בסיסי בתת-פולסים של הגודל, De הוא הקוטר האפקטיבי של הערוץ (נמדד בשלב 4), ו-L הוא האורך הכולל של ערוץ הצומת-נקבובית.- D e נקבע על ידי חישוב ה-ΔI/I הממוצע המיוצר על ידי קבוצה של חלקיקים בקוטר ידוע (תאים או חרוזים, ראה שלב 4), תוך שימוש בקוטר ידוע זה כ-d, ופתרון Eq. 1 עבור De.
- לכמת את עמידות התא בפני דפורמציה.
- קבע את מהירות הנוזל U זרימה על ידי חישוב מהירות התא הממוצעת בתת-פולסים של גודל, באמצעות אורכי המקטעים הידועים ומשך הזמן הנמדד של כל תת-פולס.
- קבע את מדד העיוותים של התא כולו (wCDI), המוגדר על ידי Kim et al.2 כ:
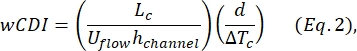
כאשר L c הוא אורך מקטע הכיווץ, ערוץ h הוא גובה הערוץ, ו- ΔTc הוא משך תת-ההתכווצות.
- זהה את זמן ההתאוששות של התא מעיוות, המוגדר כתת-ההתאוששות הראשון עם משרעת בטווח של 8% מהמשרעת הממוצעת מתת-העוצמה2.
- חשב את העיוות הרוחבי של התא בתוך מקטע הכיווץ.
- חשב את הקוטר האפקטיבי של מקטע הכיווץ (De,c) כפי שהוגדר על ידי Kim et al.2:
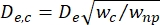 , כאשר w c הוא רוחב מקטע הכיווץ ו-w np הוא הרוחב של כל המקטעים האחרים.
, כאשר w c הוא רוחב מקטע הכיווץ ו-w np הוא הרוחב של כל המקטעים האחרים. - חשב את הקוטר הכדורי המקביל dc של התא בתוך הכיווץ על ידי שימוש חוזר במשוואה שהוגדרה על ידי Deblois ו- Bean24:
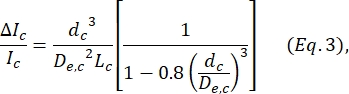
כאשר ΔI c/I c הוא היחס בין משרעת תת-פולס לזרם בסיסי בתת-הכיווץ ו-Lc הוא אורך מקטע הכיווץ. - חישוב אורך ההתארכות של התא L מעוות כפי שתואר על ידי Kim et al.2:
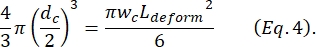
- לבסוף, מחשב את העיוות הרוחבי של התא δמעוות, המוגדר על ידי Kim et al.2 להיות .
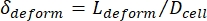
- חשב את הקוטר האפקטיבי של מקטע הכיווץ (De,c) כפי שהוגדר על ידי Kim et al.2:
- קבע את קוטר התא d בהתבסס על המשוואה שהוגדרה על ידי Deblois ו- Bean24:
תוצאות
פלטפורמת המכנופנוטיפינג המוצגת כאן היא גישה פשוטה ורב-תכליתית למדידת התכונות הביופיזיות של תאים בודדים עם תפוקה מתונה. תאים מוזרמים דרך התעלה המיקרופלואידית (איור 1A) באמצעות זרימה מונעת לחץ קבוע. כאשר התאים עוברים, אורך התעלה המיקרופלואידית והפולסים הנוכחיים המיוצרים נר...
Discussion
מדידת התכונות המכניות של תאים בודדים באמצעות טכניקת מכנופנוטיפינג זו מורכבת משלושה שלבים: ייצור מכשירים, איסוף נתונים וניתוח נתונים. בתוך כל שלב, ישנם היבטים בולטים שעשויים להשפיע באופן משמעותי על תוצאות הניסוי. במהלך ייצור התקנים, גיאומטריות ערוצים עקביות ואחידות בין התקן להתקן חיוניים...
Disclosures
L. L. S מחזיקה בפטנט אמריקאי מס' 11,383,241: "חישת נקבוביות Mechano-no", J. Kim, S. Han ו- L. L. Sohn, שהונפק ב-12 ביולי 2022.
Acknowledgements
מחקר זה נתמך על ידי מענקים מ- NIBIB 1R01EB024989-01 ו- NCI 1R01CA190843-01. א' ל' ור' ר' נתמכו על ידי מלגת מחקר לתארים מתקדמים של אגודת H2H8. K. L. C. נתמך על ידי מלגת מחקר לתארים מתקדמים של הקרן הלאומית למדע ומלגת Siebel Scholar.
Materials
| Name | Company | Catalog Number | Comments |
| Acetone | J.T. Baker | 5356-05 | Purity (GC) ≥ 99.5% (https://us.vwr.com/store/product/6057739/acetone-99-5-vlsi-j-t-baker) |
| Aluminum Foil | n/a | n/a | |
| Analog Low-Pass Filter | ThorLabs | EF504 | ≤240 kHz Passband, Coaxial BNC Feedthrough (https://www.thorlabs.com/thorproduct.cfm?partnumber=EF504#ad-image-0) |
| Biopsy Punch | Integra Miltex | 33-31AA-P/25 | 1mm, Disposable, with Plunger (https://mms.mckesson.com/product/573313/Miltex-33-31AA-P25) |
| Blade | n/a | n/a | |
| BNC Cable | Pomona Electronics | 2249-C-12 | https://www.digikey.com/en/products/detail/pomona-electronics/2249-C-12/603323?utm_adgroup=Coaxial%20Cables%20%28RF%29&utm_source=google&utm_ medium=cpc&utm_campaign= Shopping_Product_Cable%20Assemblies_NEW&utm_term= &utm_content=Coaxial%20Cables%20%28RF%29&gclid=Cj0KCQjwlK-WBhDjARIsAO2sErQqnVJ pj5OXVObuTI8ZUf1ZeIn7zvzGnx mCWdePrG6SdEJMF3X6ubUaAs w-EALw_wcB |
| Cleanroom Polyester Swab | Thermo Fisher Scientific | 18383 | https://www.fishersci.com/shop/products/texwipe-cleantip-alpha-polyester-series-swabs-6/18383 |
| Current Preamplifier | DL Instruments | 1211 | https://www.brltest.com/index.php?main_page=product_info&products_ id=1419 |
| Custom PCB (w/ components) | n/a | n/a | see Supplemental files 4 and 5 |
| DAQ Terminal Block | National Instruments | BNC-2120 | https://www.ni.com/en-in/support/model.bnc-2120.html |
| DAQ to BNC-2110 cable | National Instruments | SHC68-68-EPM | https://www.ni.com/en-in/support/model.shc68-68-epm.html |
| Data Acquisition Board (DAQ) | National Instruments | PCI-6251 | https://www.ni.com/docs/en-US/bundle/pci-6251-feature/page/overview.html |
| Dessicator | Thermo Fisher Scientific | 5311-0250 | https://www.thermofisher.com/order/catalog/product/5311-0250 |
| Female BNC To Banana Plug Adapter | Pomona Electronics | 72909 | https://www.digikey.com/en/products/detail/pomona-electronics/72909/1196318 |
| Fetal Bovine Serum (FBS) | VWR | 89510-186 | https://us.vwr.com/store/product/18706419/avantor-seradigm-select-grade-usda-approved-origin-fetal-bovine-serum-fbs |
| Glass Cutter | Chemglass | CG-1179-21 | https://chemglass.com/plate-glass-cutters-diamond-tips |
| Gold Etchant TFA | Transene | NC0977944 | https://www.fishersci.com/shop/products/NC0977944/NC0977944 |
| Hot Plate | Thermo Fisher Scientific | SP131825 | |
| Isopropyl Alcohol | Spectrum Chemical | I1056-4LTPL | Purity (GC) ≥99.5% (https://www.spectrumchemical.com/isopropyl-alcohol-99-percent-fcc-i1056) |
| Metal Hardware Enclosure | Hammond Manufacturing | EJ12126 | https://www.digikey.com/en/products/detail/hammond-manufacturing/EJ12126/2423415 |
| Methanol | Sigma-Aldrich | 34860 | Purity (GC) ≥99.8% (https://www.sigmaaldrich.com/IN/en/substance/methanol320467561) |
| MF-321 Developer | Kayaku Advanced Materials | n/a | https://kayakuam.com/products/mf-321/ |
| MICROPOSIT S1813 Positive Photoresist | DuPont | n/a | https://kayakuam.com/products/microposit-s1800-g2-series-photoresists/ |
| Phosphate Buffered Saline (PBS) | Thermo Fisher Scientific | 10010049 | https://www.thermofisher.com/order/catalog/product/10010049?SID=srch-hj-10010049 |
| Photomask | Fineline Imaging | n/a | Photomask are custom ordered from our CAD designs (https://www.fineline-imaging.com/) |
| Plain Glass Microscope Slide | Fisher Scientific | 12-553-5B | Material: Soda Lime, L75 x W50 mm, Thickness: 0.90–1.10 mm |
| Plasma Cleaner | Harrick Plasma | PDC-001 | https://harrickplasma.com/plasma-cleaners/expanded-plasma-cleaner/ |
| Plastic Petri Dish | Thermo Fisher Scientific | FB0875712 | 100 mm (https://www.fishersci.com/shop/products/fisherbrand-petri-dishes-clear-lid-raised-ridge-100-x-15mm/FB0875712) |
| Pressure Controller | Fluigent | MFCS-EZ | https://www.fluigent.com/research/instruments/pressure-flow-controllers/mfcs-series/ |
| Pressure Controller Software | Fluigent | MAESFLO | |
| Programming & Computation Software | MATLAB | R2021b | for data acquisition and analysis (https://www.mathworks.com/products/matlab.html) |
| PTFE Tubing | Cole Parmer | 06417-31 | 0.032" ID x 0.056" (https://www.coleparmer.com/i/masterflex-transfer-tubing-microbore-ptfe-0-032-id-x-0-056-od-100-ft-roll/0641731) |
| Scepter 2.0 Handheld Automatic Cell Counter | Millapore Sigma | PHCC20060 | https://www.sigmaaldrich.com/IN/en/product/mm/phcc20060 |
| Silicon Wafer | Wafer World | 2885 | 76.2 mm, Single Side Polished (https://www.waferworld.com/product/2885) |
| Spin Coater | n/a | n/a | |
| SU-8 3025 Negative Photoresist | Kayaku Advanced Materials | n/a | https://kayakuam.com/products/su-8-2000/ |
| SU8 Developer | Kayaku Advanced Materials | n/a | https://kayakuam.com/products/su-8-developer/ |
| Sygard 184 Polydimethlysiloxane | Dow Chemical | 4019862 | https://www.ellsworth.com/products/by-market/consumer-products/encapsulants/silicone/dow-sylgard-184-silicone-encapsulant-clear-0.5-kg-kit/ |
| Tape | Scotch | 810-341296 | https://www.staples.com/Scotch-Magic-Tape-810-3-4-x-36-yds-1-Core/product_130567?cid=PS:GS:SBD:PLA:OS&gclid= Cj0KCQjwlK-WBhDjARIsAO 2sErRwzrrgjU0NjFkDkne1xm vT7ekS3tdzvAgiMDwPoxocgH VTQZi7vJgaAvQZEALw_wcB |
| Titanium, Platinum, Gold | n/a | n/a | |
| Triple Output Power Supply | Keysight | E36311A | https://www.newark.com/keysight-technologies/e36311a/dc-power-supply-3o-p-6v-5a-prog/dp/15AC9653 |
| UV Mask Aligner | Karl Suss America | MJB3 Mask Aligner |
References
- Pegoraro, A. F., Janmey, P., Weitz, D. A. Mechanical properties of the cytoskeleton and cells. Cold Spring Harbor Perspectives in Biology. 9 (11), 022038 (2017).
- Kim, J., et al. Characterizing cellular mechanical phenotypes with mechano-node-pore sensing. Microsystems & Nanoengineering. 4, 17091 (2018).
- Mierke, C. T. Bidirectional mechanical response between cells and their microenvironment. Frontiers in Physics. 9, 619 (2021).
- Kumar, S., Weaver, V. M. Mechanics, malignancy, and metastasis: The force journey of a tumor cell. Cancer and Metastasis Reviews. 28 (1), 113-127 (2009).
- Nia, H. T., Munn, L. L., Jain, R. K. Physical traits of cancer. Science. 370 (6516), (2020).
- Fletcher, D. A., Mullins, R. D. Cell mechanics and the cytoskeleton. Nature. 463 (7280), 485-492 (2010).
- Wirtz, D., Konstantopoulos, K., Searson, P. C. The physics of cancer: The role of physical interactions and mechanical forces in metastasis. Nature Reviews Cancer. 11 (7), 512-522 (2011).
- Li, B., et al. Mechanical phenotyping reveals unique biomechanical responses in retinoic acid-resistant acute promyelocytic leukemia. iScience. 25 (2), 103772 (2022).
- Kozminsky, M., Sohn, L. L. The promise of single-cell mechanophenotyping for clinical applications. Biomicrofluidics. 14 (3), 031301 (2020).
- Li, M., Dang, D., Liu, L., Xi, N., Wang, Y. Atomic force microscopy in characterizing cell mechanics for biomedical applications: A review. IEEE Transactions on Nanobioscience. 16 (6), 523-540 (2017).
- Wottawah, F., et al. Optical rheology of biological cells. Physical Review Letters. 94 (9), 1-4 (2005).
- Darling, E. M., Di Carlo, D. High-throughput assessment of cellular mechanical properties. Annual Review of Biomedical Engineering. 17 (1), 35-62 (2015).
- Carey, T. R., Cotner, K. L., Li, B., Sohn, L. L. Developments in label-free microfluidic methods for single-cell analysis and sorting. Wiley Interdisciplinary Reviews: Nanomedicine and Nanobiotechnology. 11 (1), 1529 (2019).
- Bagnall, J. S., et al. Deformability of tumor cells versus blood cells. Scientific Reports. 5, 18542 (2015).
- Byun, S., et al. Characterizing deformability and surface friction of cancer cells. Proceedings of the National Academy of Sciences. 110 (19), 7580-7585 (2013).
- Otto, O., et al. Real-time deformability cytometry: On-the-fly cell mechanical phenotyping. Nature Methods. 12 (3), 199-202 (2015).
- Gossett, D. R., et al. Hydrodynamic stretching of single cells for large population mechanical phenotyping. Proceedings of the National Academy of Sciences. 109 (20), 7630-7635 (2012).
- Guck, J., Chilvers, E. R. Mechanics meets medicine. Science Translational Medicine. 5 (212), 3-6 (2013).
- Balakrishnan, K. R., et al. Node-pore sensing: A robust, high-dynamic range method for detecting biological species. Lab on a Chip. 13 (7), 1302-1307 (2013).
- Carbonaro, A., Sohn, L. L. A resistive-pulse sensor chip for multianalyte immunoassays. Lab on a Chip. 5 (10), 1155-1160 (2005).
- Saleh, O. A., Sohn, L. L. Direct detection of antibody-antigen binding using an on-chip artificial pore. Proceedings of the National Academy of Sciences. 100 (3), 820-824 (2003).
- Saleh, O. A., Sohn, L. L. An artificial nanopore for molecular sensing. Nano Letters. 3 (1), 37-38 (2003).
- Saleh, O. A., Sohn, L. L. Quantitative sensing of nanoscale colloids using a microchip Coulter counter. Review of Scientific Instruments. 72 (12), 4449-4451 (2001).
- DeBlois, R. W., Bean, C. P. Counting and sizing of submicron particles by the resistive pulse technique. Review of Scientific Instruments. 41 (7), 909-916 (1970).
- Li, B., et al. Evaluating sources of technical variability in the mechano-node-pore sensing pipeline and their effect on the reproducibility of single-cell mechanical phenotyping. PLoS ONE. 16 (10), 0258982 (2021).
- Zhang, Z. M., Chen, S., Liang, Y. Z. Baseline correction using adaptive iteratively reweighted penalized least squares. Analyst. 135 (5), 1138-1146 (2010).
- Alibert, C., Goud, B., Manneville, J. B. Are cancer cells really softer than normal cells. Biology of the Cell. 109 (5), 167-189 (2017).
- Fujiwara, I., Zweifel, M. E., Courtemanche, N., Pollard, T. D. Latrunculin A accelerates actin filament depolymerization in addition to sequestering actin monomers. Current Biology. 28 (19), 3183-3192 (2018).
- Saleh, O. A. . A novel resistive pulse sensor for biological measurements. , (2003).
- Dokukin, M. E., Guz, N. V., Sokolov, I. Quantitative study of the elastic modulus of loosely attached cells in AFM indentation experiments. Biophysical Journal. 104 (10), 2123-2131 (2013).
- Li, Q., Lim, C. T., Goh, J. C. H., et al. Probing the elasticity of breast cancer cells using AFM. 13th International Conference on Biomedical Engineering. IFMBE Proceedings. 23, 2122-2125 (2009).
- Rother, J., et al. Atomic force microscopy-based microrheology reveals significant differences in the viscoelastic response between malign and benign cell lines. Open Biology. 4 (5), 140046 (2014).
- Li, Q., et al. AFM indentation study of breast cancer cells. Biochemical and Biophysical Research Communications. 374 (4), 609-613 (2008).
- Xu, C., et al. Elasticity measurement of breast cancer cells by atomic force microscopy. Proc. SPIE 9230. Twelfth International Conference on Photonics and Imaging in Biology and Medicine. (PIBM 2014). 92300, (2014).
- Alcaraz, J., et al. Microrheology of human lung epithelial cells measured by atomic force microscopy. Biophysical Journal. 84 (3), 2071-2079 (2003).
- Li, M., Dang, D., Liu, L., Xi, N., Wang, Y. Atomic force microscopy in characterizing cell mechanics for biomedical applications: A review. IEEE Transactions on Nanobioscience. 16 (6), 523-540 (2017).
- Urbanska, M., et al. A comparison of microfluidic methods for high-throughput cell deformability measurements. Nature Methods. 17, 587-593 (2020).
- Hill, R. T., Chilkoti, A. Surface Patterning. Biomaterials Science: An Introduction to Materials: Third Edition. , 276-301 (2013).
- Wang, Z., Volinsky, A. A., Gallant, N. D. Crosslinking effect on polydimethylsiloxane elastic modulus measured by custom-built compression instrument. Journal of Applied Polymer Science. 131 (22), 41050 (2014).
- Gibson, L. J. The hierarchical structure and mechanics of plant materials. Journal of the Royal Society Interface. 9 (76), 2749-2766 (2012).
- Stephens, A. D., Banigan, E. J., Adam, S. A., Goldman, R. D., Marko, J. F. Chromatin and lamin a determine two different mechanical response regimes of the cell nucleus. Molecular Biology of the Cell. 28 (14), 1984-1996 (2017).
- Rosenbluth, M. J., Lam, W. A., Fletcher, D. A. Force microscopy of nonadherent cells: A comparison of leukemia cell deformability. Biophysical Journal. 90 (8), 2994-3003 (2006).
- Evers, T. M. J., Holt, L. J., Alberti, S., Mashaghi, A. Reciprocal regulation of cellular mechanics and metabolism. Nature Metabolism. 3 (4), 456-468 (2021).
- Balakrishnan, K. R., et al. Node-pore sensing enables label-free surface-marker profiling of single cells. Analytical Chemistry. 87 (5), 2988-2995 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved