需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
机械节点孔传感:用于多参数单细胞粘弹性测量的快速、无标记平台
* 这些作者具有相同的贡献
摘要
这里介绍的是一种使用称为机械节点孔传感(mechano-NPS)的基于电子学的微流体平台对单个细胞进行机械表型分析的方法。该平台保持1-10个细胞/秒的中等通量,同时测量细胞的弹性和粘性生物物理特性。
摘要
细胞力学特性涉及各种生物过程和疾病,从干细胞分化到癌症转移。测量这些特性的常规方法,如原子力显微镜(AFM)和微量移液器抽吸(MA),捕获了丰富的信息,反映了细胞的全粘弹性响应;但是,这些方法受到非常低的吞吐量的限制。实时变形性细胞术(RT-DC)等高通量方法只能测量有限的机械信息,因为它们通常仅限于仅反映细胞弹性特性的单参数读数。与这些方法相比,机械节点孔传感(mechano-NPS)是一种灵活的无标记微流体平台,可在实现中等通量的细胞的多参数粘弹性测量方面弥合差距。直流 (DC) 测量用于监测细胞通过微流体通道时,跟踪它们在被迫通过狭窄收缩之前、期间和之后的大小和速度。该信息(即大小和速度)用于量化每个细胞的横向变形、抗变形能力和变形恢复。通常,这种基于电子学的微流体平台提供多种粘弹性电池特性,从而更完整地了解电池的机械状态。由于它需要最少的样品制备,采用简单的电子测量(与高速相机相比),并利用标准的软光刻制造,因此该平台的实施简单易用,并且适用于下游分析。该平台的灵活性、实用性和灵敏度为各种细胞提供了独特的机械信息,在基础科学和临床诊断中具有更多应用的潜力。
引言
单细胞是动态的粘弹性材料1。许多内部和外部过程(例如,有丝分裂的发作或细胞外基质[ECM]的重塑)影响其结构和组成2,3,4,通常导致补充其当前状态的独特生物物理特性。特别是,机械性能已被证明是细胞发育,生理学和病理学的重要生物标志物,产生有价值的定量信息,可以补充规范的分子和遗传方法5,6,7。例如,Li等人最近描述了耐药性和药物反应性急性早幼粒细胞白血病细胞之间的机械差异,同时还使用RNA-seq揭示了差异表达的细胞骨架相关基因8。通过了解单细胞力学和细胞功能之间的复杂相互作用,机械分型在改变基础科学和临床诊断方面具有更广泛的应用9。
测量单细胞力学的最广泛采用的工具是原子力显微镜(AFM)。虽然AFM能够对细胞机械特性进行高分辨率的局部测量,但它仍然局限于<0.01个细胞/秒10的通量。或者,光学拉伸器使用两个发散的激光束来捕获和变形悬浮的单个细胞11,仅限于略高的吞吐量<1细胞/秒12。微流体技术的最新进展使新一代设备能够进行快速,单细胞,机械评估12,13。这些技术采用窄收缩通道14,15,剪切流16或流体动力拉伸17,以10-1,000个细胞/秒的吞吐量快速变形细胞18。虽然这些方法的测量速度比传统技术快得多,但它们经常以高通量能力换取有限的机械读数(补充表1)。所有上述快速微流体方法都侧重于基本的单参数指标,例如传输时间或变形率,这些指标仅反映细胞的弹性特性。然而,鉴于单细胞的内在粘弹性,对细胞进行稳健而彻底的机械表征不仅需要考虑弹性成分,还需要考虑粘性响应。
机械节点孔传感(机械NPS)2,8(图1A)是一种微流体平台,可解决单细胞机械化存在的局限性。该方法可以同时测量多个生物物理参数,包括细胞直径、相对变形性和变形恢复时间,吞吐量适中,为 1-10 个细胞/秒。该技术基于节点孔传感(NPS)19,20,21,22,23,24,它涉及使用四点探针测量来测量细胞通过微流体通道产生的调制电流脉冲,该通道已被更广泛的区域(称为"节点")分割。调制电流脉冲是电池部分阻塞段(即"孔隙")和节点中的电流的结果,前者比后者阻挡的电流更多。在机械NPS中,一个片段,即"收缩通道",比细胞直径窄;因此,细胞必须变形才能通过整个通道(图1B)。细胞直径可以通过细胞在收缩通道之前通过节点孔时产生的亚脉冲的大小来确定(图1B,C)。这里,|ΔInp|,当细胞在孔中时的电流下降,与细胞与孔的体积比成正比,V细胞/V孔2,8,19。细胞刚度可以通过Δ T c来确定,ΔTc是细胞通过收缩通道时产生的明显较大的亚脉冲的持续时间(图1B,C)。较硬的细胞比较软的细胞需要更长的时间来通过通道2,8。最后,细胞"恢复",即细胞在变形后恢复到其原始大小和形状的能力,可以通过细胞在收缩通道后通过节点孔时产生的一系列亚脉冲来确定(图1B,C)。恢复时间ΔTr是在电池被挤压之前电流子脉冲恢复到先前子脉冲幅度所需的时间。总体而言,记录和分析电池通过微流体通道时产生的调制电流脉冲,以提取相关的单电池机械参数(图1D)2,8。
这种基于电子的微流体平台的可重复性和易用性先前已得到证明25。此外,该平台为单细胞机械化提供了较低的进入门槛。采用标准软光刻技术来制造微流体器件。测量 硬件 由 廉价 的 组 件 组成, 包括 简单 的 印刷 电路板 (PCB)、 电源、 前 置 放大器、 数据 采集 板 (DAQ) 和 计算机。最后,用户友好的代码可用于数据采集和分析,从而实现直接实施。这种机械分型技术可以区分非恶性和恶性乳肺上皮细胞系的群体,区分原代人乳腺上皮细胞的亚谱系,并表征细胞骨架扰动和其他药理学因素的影响2,8。总体而言,该平台是单细胞机械分型的有效方法。
研究方案
1. 设计设备几何形状
- 选择大小调整和恢复段的宽度,使其宽于要测量的最大单元的直径,同时保持足够的信噪比(SNR)。有关各种细胞系的不同大小和回收段宽度的示例,请参阅 补充表2 。
- 选择收缩段宽度以将30%-40%的应变施加到要进行机械化处理的细胞的平均大小上。应变定义为
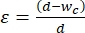 ,其中 d 是细胞直径, wc 是收缩通道宽度2,8。有关不同细胞系的不同收缩段宽度,请参阅 补充表2 。
,其中 d 是细胞直径, wc 是收缩通道宽度2,8。有关不同细胞系的不同收缩段宽度,请参阅 补充表2 。
注意:如果希望比较直径大不相同的细胞类型或条件,则应使用单独的设备设计,并针对每种细胞类型/条件使用收缩段宽度。 - 为每个唯一的设备几何图形设计一个参考设备。这对于确定 De,即微流体通道的定量孔段的有效直径是必要的。
注: 参考设备使用与主设备相同的几何图形。唯一的修改是收缩段的宽度应等于施胶孔段的宽度,以便使用已知尺寸的聚苯乙烯珠进行校准。加宽收缩可防止聚苯乙烯微珠在校准过程中堵塞收缩通道。校准过程在步骤4.1和5.3.1中进一步描述。校准也可以使用市售的细胞计数器来实现,在这种情况下,不需要参考设备。此过程在步骤 4.2 中描述。 - 选择通道高度,使最大的感兴趣细胞可以在收缩段2 内不受限制地完全伸长。确保通道高度大于 hmin
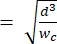 (这假设像元是球形预变形,并且在变形过程中沿通道长度和高度发生等距变形)。
(这假设像元是球形预变形,并且在变形过程中沿通道长度和高度发生等距变形)。
注意:给定电流子脉冲的大小,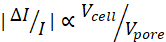 hmin越大,总SNR越低。
hmin越大,总SNR越低。 - 使用计算机辅助设计软件设计和创建具有所选通道宽度的光掩模。补充文件 1 中提供了一个示例 文件。将微流体掩模设计缩放 1.5%,以考虑从负母版剥离后的聚二甲基硅氧烷 (PDMS) 收缩。
注意:只要整个阵列不超过晶圆的尺寸,就可以在单个掩模上包含器件阵列(补充图1A)。 - 设计并创建带有电极的光掩模,用于对微流体器件电流进行四点探针测量(图1D)。补充文件 1 中提供了一个示例 文件。
注意:只要阵列不超过载玻片的尺寸,就可以在单个掩模上包含一个电极阵列(补充图1B)。
2. 制造设备(图 2)
- 在玻璃基板上制备电极图案。
- 根据产品数据表将正性光刻胶旋转涂覆、图案化并加工到普通载玻片上。 补充文件 2 中概述了此过程的示例。
- 执行金属沉积、提脱和金蚀刻。
- 在载玻片上沉积 75 Å Ti、250 Å Pt 和 250 Å Au 的薄膜。使用电子枪蒸发的此过程的示例在 补充文件3中概述。
- 将载玻片浸入丙酮中15分钟,以去除多余的金属。
- 在通风橱中,使用一次性移液器将金蚀刻剂滴铸到将暴露于微流体通道的电极区域,如 补充图2所示。小心避免将蚀刻剂掉落在载玻片的其他地方。
注意:金蚀刻剂会引起皮肤和眼睛刺激。不要吸入蒸气,也不要摄入。小心处理,穿戴适当的个人防护装备(PPE),并根据当地处置规定丢弃废物。 - 用去离子(DI)水冲洗载玻片,然后用干氮气(N2)干燥。
- 如果在同一载玻片上印有多个电极,请将载玻片切成单独的芯片。
- 使用玻璃切割工具沿图案化的电极边界对载玻片进行划痕。
- 沿着分数打破玻璃,将载玻片分成单独的芯片。
- 在显微镜下目视检查电极。确保单个电极未电开或电极未短接在一起。
- 为通道制造负母模。
- 根据产品数据表,将SU-8环氧抗蚀剂旋涂、图案化和加工到抛光硅晶圆上。 补充文件 2 中概述了此过程的示例。
- 使用轮廓仪测量特征高度,并在显微镜下目视检查特征(补充图3)。确保所需的几何形状已明确定义。
- 使用软光刻技术模塑PDMS通道。
- 通过在一次性杯中以 10:1 的质量比称量弹性体和交联剂来制备 PDMS。
注意:对于直径为 3 英寸的晶圆,30 g PDMS 就足够了。 - 用一次性叉子将PDMS剧烈混合30秒,直到PDMS不透明,有气泡。
- 在真空室中对PDMS脱气约30-90分钟,或直到PDMS透明且没有可见气泡。
- 将带有SU-8母模的晶片放入一次性培养皿中,然后将PDMS倒在晶圆的中心。
- 将含有PDMS和晶片的培养皿放入真空室中并脱气约30分钟,或直到PDMS中没有气泡残留。
- 将PDMS在80°C下在烤箱或热板上烘烤2小时。
- 用锋利的刀片,从SU-8负主版上切割并取出PDMS。
- 使用锋利的刀片将模制的PDMS板坯切成单独的模具
- 使用一次性活检打孔对入口和出口检修孔进行取芯。为获得最佳效果,请为每个 PDMS 板使用新的冲头。更锋利的冲头会产生光滑的边缘孔,最大限度地减少可能阻塞收缩通道的颗粒。
注意: 检修孔的直径应略小于卡套管的外径。例如,如果使用外径为 1/32 英寸的聚四氟乙烯 (PTFE) 管,则应打一个 1.5 毫米的孔。
- 通过在一次性杯中以 10:1 的质量比称量弹性体和交联剂来制备 PDMS。
- 将玻璃/电极基板粘合到PDMS通道。
- 用甲醇(≥99.8%)清洁电极载玻片。用干的N2干燥。
- 用透明胶带清洁PDMS设备,然后用异丙醇(IPA)和去离子水(DI;18 MΩ/cm2)冲洗。用干的N2干燥。然后,再次用透明胶带清洁。
- 将带有预制电极的玻璃基板和准备好的PDMS模具(特征面朝上)放入等离子清洁器中。
- 将两者暴露在氧气等离子体中2分钟(100-300 mTorr,30 W)。
- 对齐PDMS模具,并将特征面朝下放置在带有预制电极的玻璃基板上。
注意:一旦等离子处理的PDMS和玻璃接触,粘合是瞬间的;因此,无法进一步的对齐修改。为了便于对齐,可以将 20 μL 2:1 稀释的甲醇去离子水中移液到等离子处理的玻璃表面上。甲醇溶液充当处理过的玻璃和PDMS之间的物理屏障,允许对准调整。如果使用甲醇,则将对齐和配合的装置在50°C下烘烤2小时以蒸发溶液并完成粘合过程。 - 在显微镜下目视检查粘合的设备。确保电极和通道几何形状正确对齐。
3. 测量细胞(图 1D)
- 准备压力源、PCB、台式硬件和数据采集软件。
- 使用夹具将微流体装置连接到PCB。 补充文件 4 (GERBER 文件)和 补充文件 5 (原理图、电路板和 PCB 零件列表文件)中提供了 PCB 的示例。
- 将夹具的弹簧加载引脚与微流体装置上的电极接触垫对齐,并将夹具的针座引脚与PCB上的孔对齐。
- 将夹具的针脚牢固地插入 PCB 孔中,确保弹簧加载的引脚与电极接触垫保持对齐。
- 设置并连接电子硬件。
- 使用双香蕉插头到卡口尼尔-康塞尔曼 (BNC) 母适配器和 BNC 电缆将电源的两个输出端口连接到 PCB 的电源电压端口。
- 打开电源。将连接到BNC内部导体的输出设置为+15 V,将另一个输出设置为-15 V。 使能两个输出为电路供电。
- 使用 BNC 电缆将电源的第三个输出端口连接到 PCB 的输入电压端口。将输出设置为所需的施加电压,但在开始实验之前不要启用它。
- 使用 BNC 电缆将 PCB 的输出电流端口连接到电流前置放大器的输入端。
- 使用BNC电缆将电流前置放大器的输出连接到数据采集系统BNC接线端子上的一个模拟输入。或者,将模拟低通滤波器与 BNC 电缆连接,以滤除高频干扰。
注:为了提高信噪比,PCB和设备可以安装在厚金属外壳内。所有 BNC 电缆和流体管都可以通过钻入外壳的孔进行布线。
- 在个人计算机 (PC) 上安装和设置所需的软件
- 打开电源并将压力控制器连接到 PC。按照制造商的说明安装任何所需的压力控制器软件。
- 在PC上安装MATLAB和数据采集工具箱。确保安装了数据采集系统所需的驱动程序,以便 MATLAB 数据采集工具箱接口可以检测到它。
- 从 https://github.com/sohnlab/node-pore-sensing-public 下载随附的数据采集脚本"NPS.m"。
- 打开并配置数据采集脚本。
- 设置正确的值以初始化数据采集会话,其中包括供应商ID,DAQ的设备ID和模拟输入通道号(包含脚本中的第34-36行)。
注意:可以使用"daq.getDevices"或"daqlist"功能找到设备 ID。 - 设置所需的采集采样率(随附脚本中的第 23 行)。为获得最佳结果,应将其设置为至少 10 kHz。
- 设置正确的值以初始化数据采集会话,其中包括供应商ID,DAQ的设备ID和模拟输入通道号(包含脚本中的第34-36行)。
- 使用夹具将微流体装置连接到PCB。 补充文件 4 (GERBER 文件)和 补充文件 5 (原理图、电路板和 PCB 零件列表文件)中提供了 PCB 的示例。
- 准备细胞悬液。
- 在1x磷酸盐缓冲盐水(PBS)中制备2%胎牛血清(FBS)的溶液,并用0.22μm过滤器过滤。
- 根据所选细胞系的适当细胞培养方案培养和制备细胞。将细胞悬浮在1x PBS中的2%FBS制备溶液中,浓度为1-5 x 105 个细胞/ mL。在实验期间将细胞保持在冰上。
- 测量细胞的物理特性。
- 将细胞样品装入管中并将其连接到设备入口。
- 用剃须刀片或锋利的刀切割 30 厘米的 PTFE 管。
- 将管子的一端连接到鲁尔锁注射器上。使用注射器将细胞样品吸入管子的另一端。
- 小心地将管子插入设备的入口。
- 将管道的另一端连接到微流体压力控制器。
注意: 可以在微流体压力控制器和管道之间添加过滤器,以防止液体回流到压力控制器中。
- 运行实验。
- 在压力控制器软件上设置所需的恒定驱动压力,并允许样品填充设备。
注意:压力通常为 2-21 kPa。流速必须足够慢,以允许明确定义的脉冲,但又足够快以允许足够的吞吐量。- 如果在微流体通道中形成气泡,请使用死角填充:堵塞设备出口并向入口施加低压,以迫使空气通过透气性 PDMS 排出。在通道中留下气泡会导致电流基线不稳定,并妨碍准确测量。
- 如果碎屑堵塞了微流体通道,请在施加驱动压力的同时轻轻按压PDMS设备的顶部,通过打开和关闭压力来"脉冲"更高的压力,或者移除管道并重新插入,将其移开。如果碎片仍然存在,则可能需要切换到新设备。
- 通过旋转电源上的电压旋钮来设置所需的 电压 ,并通过按 On 按钮启用电压。
注意:电压通常为 1-5 V。选择获得足够 SNR 所需的最低电压。在所有要比较的条件下都应使用相同的电压。 - 打开电流前置放大器,将灵敏度(A/V)设置得尽可能低;或者,将增益(V/A)设置得尽可能高,而不会使前置放大器过载或超过DAQ的最大模拟输入电压。在这项研究中,灵敏度设置为10-7 A / V。
注意:适当的灵敏度/增益值将取决于施加的电压以及微流体通道的基线电阻。 - 按 MATLAB 功能区菜单中的绿色 "运行 "按钮开始数据采集脚本 NPS.m 并开始采样和保存数据。
- 要结束实验,请按图形窗口左下角的 "停止" 按钮以停止数据采集脚本。按 开 按钮禁用电源输出。在压力控制器软件中将压力源设置为零压力。
- 此时,可以暂停实验以执行以下一项或多项操作:
- 将当前设备更换为新设备。
- 用更多细胞样品重新加载管子。
注意:为避免样品交叉污染,请使用新设备测量不同类型或条件的细胞。 - 从PCB上松开器件,在显微镜下检查通道的状况。要使用相同的设备重新开始实验,必须注意不要引入气泡。可能需要对注射器柱塞施加温和的压力,以将细胞样品保持在管道的最末端,同时将其插入设备入口。
- 在压力控制器软件上设置所需的恒定驱动压力,并允许样品填充设备。
- 将细胞样品装入管中并将其连接到设备入口。
4. 校准微流控装置
- 选项 1:测量参考设备中的聚苯乙烯珠。
- 选择小于施胶槽的聚苯乙烯珠尺寸。
- 向细胞实验期间使用的过滤PBS和FBS溶液中加入1.5%吐温和聚苯乙烯珠,浓度为1-3 x 105 珠/ mL。
- 使用步骤1.3中描述的参考器件,按照第3节所述进行实验,并施加实验期间使用的相同电压。使用磁珠通过施胶孔时产生的电流下降的平均大小和磁珠的已知直径来计算 De,如第5节所述。
- 选项 2:使用单独的测量设备独立测量细胞大小。
- 不要遵循步骤4.1中的方案,而是使用市售的细胞大小测量仪器来测量样品中细胞的平均大小。在这种情况下,不需要参考设备。使用电池通过施胶孔时产生的平均电流降和测量的平均电池直径来计算 De,如第5节所述。
5. 分析数据以提取细胞表型
注意:可以使用 MATLAB 命令行界面程序文件 mNPS_procJOVE.m at https://github.com/sohnlab/NPS-analysis-JOVE 执行数据处理。有关更多说明,请参阅补充文件 6 。
- 预处理数据(图3A)。
- 通过将电流-电压前置放大器中使用的增益值应用于DAQ采集的原始数据来计算测量的电流。
- 通过将矩形平滑功能和/或低通滤波器应用于原始电流测量来消除高频噪声。然后,将过滤后的数据重新采样为较低的采样率。此外,以较低的采样率计算相应的时间戳数据。
- 通过应用非对称最小二乘平滑26 等方法计算拟合的基线电流信号。
- 通过取后续数据点之间的差值来计算预处理电流数据的近似一阶导数(差分信号)。
- 识别细胞事件并提取亚脉冲数据(图3B)。
- 通过检查预处理的数据来搜索候选单元格事件。剔除与其他细胞事件重叠的细胞事件(即巧合事件)(补充图4),表现出较差的基线拟合,或具有意外或错误的脉冲形状(例如,通道中可能存在堵塞)。
- 提取每个细胞事件的亚脉冲数据。
- 每个节点-孔段将在整个信号脉冲中显示为相应的子脉冲(图1B,C)。通过计算差分信号达到局部最小值时的时间点来识别每个子脉冲的开始。通过计算差分信号达到局部最大值时的时间点来识别每个子脉冲的结束。
- 确定每个子脉冲的宽度作为开始时间和结束时间点之间的经过时间。通过计算开始和结束时间点之间所有数据点的测量电流与基线电流之差的平均值来确定每个子脉冲的幅度。
- 根据亚脉冲数据确定每个细胞事件的细胞机械类型。
- 根据Deblois和Bean24定义的方程确定细胞直径d:
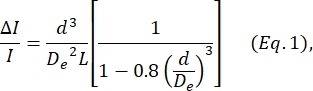
其中 ΔI/I 是定量子脉冲中子脉冲幅度与基线电流的平均比率, De 是通道的有效直径(在步骤4中测量), L 是节点孔隙通道的总长度。- D e 是通过计算一组已知直径的颗粒(细胞或磁珠,参见步骤 4)产生的平均 ΔI/I 来确定的,使用该已知直径为 d,并求解 De 的方程 1。
- 量化细胞的抗变形能力。
- 通过使用已知的段长度和每个子脉冲的测量持续时间,计算定量子脉冲中的平均细胞速度来确定流体速度 U流 。
- 确定全细胞变形指数(wCDI),由Kim等人2定义为:
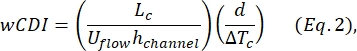
其中L c是收缩段的长度,h通道是通道高度,ΔTc是收缩子脉冲的持续时间。
- 确定细胞从变形中恢复的时间,定义为第一个恢复子脉冲,其幅度在大小子脉冲2 平均振幅的 8% 以内。
- 计算细胞在收缩段内的横向变形。
- 计算Kim等人定义的收缩段(De,c)的有效直径2:
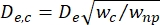 ,其中w c是收缩段的宽度,wnp是所有其他段的宽度。
,其中w c是收缩段的宽度,wnp是所有其他段的宽度。 - 再次使用 Deblois 和Bean 24 定义的方程计算收缩内细胞的等效球形直径 dc:
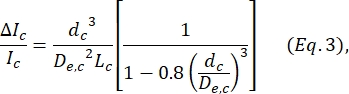
其中ΔI c/I c是收缩子脉冲中子脉冲幅度与基线电流的比值,Lc是收缩段的长度。 - 计算细胞的伸长长度 L变形 ,如Kim等人2所述:
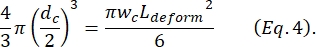
- 最后,计算细胞的横向变形δ变形,由Kim等人
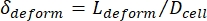 2定义为。
2定义为。
- 计算Kim等人定义的收缩段(De,c)的有效直径2:
- 根据Deblois和Bean24定义的方程确定细胞直径d:
结果
这里介绍的机械分型平台是一种简单而通用的方法,用于测量具有中等通量的单个细胞的生物物理特性。使用恒压驱动流将细胞流过微流体通道(图1A)。当细胞过境时,使用数据采集硬件记录微流体通道的长度和产生的电流脉冲。然后使用MATLAB上的自定义软件处理采集的信号(图1B,C),以提取相关的单电池机械性能。 ?...
讨论
使用这种机械分型技术测量单细胞的机械性能包括三个阶段:设备制造、数据采集和数据分析。在每个阶段中,都有可能显着影响实验结果的显着方面。在器件制造过程中,一致的通道几何形状和器件间均匀性对于准确和可重复的结果至关重要。具体来说,每个设备的侧壁应该相对光滑(图4Ai),并且复制设备的通道高度应该相当。任何具有部分阻碍细胞流动的缺陷的装置,...
披露声明
L. L. S 持有美国专利号 11,383,241:"机械节点孔隙传感",J. Kim、S. Han 和 L. L. Sohn,于 2022 年 7 月 12 日发布。
致谢
这项研究得到了NIBIB 1R01EB024989-01和NCI 1R01CA190843-01的资助。A.L.和R.R.得到了H2H8协会研究生研究奖学金的支持。K. L. C. 得到了美国国家科学基金会研究生研究奖学金和 Siebel 学者奖学金的支持。
材料
| Name | Company | Catalog Number | Comments |
| Acetone | J.T. Baker | 5356-05 | Purity (GC) ≥ 99.5% (https://us.vwr.com/store/product/6057739/acetone-99-5-vlsi-j-t-baker) |
| Aluminum Foil | n/a | n/a | |
| Analog Low-Pass Filter | ThorLabs | EF504 | ≤240 kHz Passband, Coaxial BNC Feedthrough (https://www.thorlabs.com/thorproduct.cfm?partnumber=EF504#ad-image-0) |
| Biopsy Punch | Integra Miltex | 33-31AA-P/25 | 1mm, Disposable, with Plunger (https://mms.mckesson.com/product/573313/Miltex-33-31AA-P25) |
| Blade | n/a | n/a | |
| BNC Cable | Pomona Electronics | 2249-C-12 | https://www.digikey.com/en/products/detail/pomona-electronics/2249-C-12/603323?utm_adgroup=Coaxial%20Cables%20%28RF%29&utm_source=google&utm_ medium=cpc&utm_campaign= Shopping_Product_Cable%20Assemblies_NEW&utm_term= &utm_content=Coaxial%20Cables%20%28RF%29&gclid=Cj0KCQjwlK-WBhDjARIsAO2sErQqnVJ pj5OXVObuTI8ZUf1ZeIn7zvzGnx mCWdePrG6SdEJMF3X6ubUaAs w-EALw_wcB |
| Cleanroom Polyester Swab | Thermo Fisher Scientific | 18383 | https://www.fishersci.com/shop/products/texwipe-cleantip-alpha-polyester-series-swabs-6/18383 |
| Current Preamplifier | DL Instruments | 1211 | https://www.brltest.com/index.php?main_page=product_info&products_ id=1419 |
| Custom PCB (w/ components) | n/a | n/a | see Supplemental files 4 and 5 |
| DAQ Terminal Block | National Instruments | BNC-2120 | https://www.ni.com/en-in/support/model.bnc-2120.html |
| DAQ to BNC-2110 cable | National Instruments | SHC68-68-EPM | https://www.ni.com/en-in/support/model.shc68-68-epm.html |
| Data Acquisition Board (DAQ) | National Instruments | PCI-6251 | https://www.ni.com/docs/en-US/bundle/pci-6251-feature/page/overview.html |
| Dessicator | Thermo Fisher Scientific | 5311-0250 | https://www.thermofisher.com/order/catalog/product/5311-0250 |
| Female BNC To Banana Plug Adapter | Pomona Electronics | 72909 | https://www.digikey.com/en/products/detail/pomona-electronics/72909/1196318 |
| Fetal Bovine Serum (FBS) | VWR | 89510-186 | https://us.vwr.com/store/product/18706419/avantor-seradigm-select-grade-usda-approved-origin-fetal-bovine-serum-fbs |
| Glass Cutter | Chemglass | CG-1179-21 | https://chemglass.com/plate-glass-cutters-diamond-tips |
| Gold Etchant TFA | Transene | NC0977944 | https://www.fishersci.com/shop/products/NC0977944/NC0977944 |
| Hot Plate | Thermo Fisher Scientific | SP131825 | |
| Isopropyl Alcohol | Spectrum Chemical | I1056-4LTPL | Purity (GC) ≥99.5% (https://www.spectrumchemical.com/isopropyl-alcohol-99-percent-fcc-i1056) |
| Metal Hardware Enclosure | Hammond Manufacturing | EJ12126 | https://www.digikey.com/en/products/detail/hammond-manufacturing/EJ12126/2423415 |
| Methanol | Sigma-Aldrich | 34860 | Purity (GC) ≥99.8% (https://www.sigmaaldrich.com/IN/en/substance/methanol320467561) |
| MF-321 Developer | Kayaku Advanced Materials | n/a | https://kayakuam.com/products/mf-321/ |
| MICROPOSIT S1813 Positive Photoresist | DuPont | n/a | https://kayakuam.com/products/microposit-s1800-g2-series-photoresists/ |
| Phosphate Buffered Saline (PBS) | Thermo Fisher Scientific | 10010049 | https://www.thermofisher.com/order/catalog/product/10010049?SID=srch-hj-10010049 |
| Photomask | Fineline Imaging | n/a | Photomask are custom ordered from our CAD designs (https://www.fineline-imaging.com/) |
| Plain Glass Microscope Slide | Fisher Scientific | 12-553-5B | Material: Soda Lime, L75 x W50 mm, Thickness: 0.90–1.10 mm |
| Plasma Cleaner | Harrick Plasma | PDC-001 | https://harrickplasma.com/plasma-cleaners/expanded-plasma-cleaner/ |
| Plastic Petri Dish | Thermo Fisher Scientific | FB0875712 | 100 mm (https://www.fishersci.com/shop/products/fisherbrand-petri-dishes-clear-lid-raised-ridge-100-x-15mm/FB0875712) |
| Pressure Controller | Fluigent | MFCS-EZ | https://www.fluigent.com/research/instruments/pressure-flow-controllers/mfcs-series/ |
| Pressure Controller Software | Fluigent | MAESFLO | |
| Programming & Computation Software | MATLAB | R2021b | for data acquisition and analysis (https://www.mathworks.com/products/matlab.html) |
| PTFE Tubing | Cole Parmer | 06417-31 | 0.032" ID x 0.056" (https://www.coleparmer.com/i/masterflex-transfer-tubing-microbore-ptfe-0-032-id-x-0-056-od-100-ft-roll/0641731) |
| Scepter 2.0 Handheld Automatic Cell Counter | Millapore Sigma | PHCC20060 | https://www.sigmaaldrich.com/IN/en/product/mm/phcc20060 |
| Silicon Wafer | Wafer World | 2885 | 76.2 mm, Single Side Polished (https://www.waferworld.com/product/2885) |
| Spin Coater | n/a | n/a | |
| SU-8 3025 Negative Photoresist | Kayaku Advanced Materials | n/a | https://kayakuam.com/products/su-8-2000/ |
| SU8 Developer | Kayaku Advanced Materials | n/a | https://kayakuam.com/products/su-8-developer/ |
| Sygard 184 Polydimethlysiloxane | Dow Chemical | 4019862 | https://www.ellsworth.com/products/by-market/consumer-products/encapsulants/silicone/dow-sylgard-184-silicone-encapsulant-clear-0.5-kg-kit/ |
| Tape | Scotch | 810-341296 | https://www.staples.com/Scotch-Magic-Tape-810-3-4-x-36-yds-1-Core/product_130567?cid=PS:GS:SBD:PLA:OS&gclid= Cj0KCQjwlK-WBhDjARIsAO 2sErRwzrrgjU0NjFkDkne1xm vT7ekS3tdzvAgiMDwPoxocgH VTQZi7vJgaAvQZEALw_wcB |
| Titanium, Platinum, Gold | n/a | n/a | |
| Triple Output Power Supply | Keysight | E36311A | https://www.newark.com/keysight-technologies/e36311a/dc-power-supply-3o-p-6v-5a-prog/dp/15AC9653 |
| UV Mask Aligner | Karl Suss America | MJB3 Mask Aligner |
参考文献
- Pegoraro, A. F., Janmey, P., Weitz, D. A. Mechanical properties of the cytoskeleton and cells. Cold Spring Harbor Perspectives in Biology. 9 (11), 022038 (2017).
- Kim, J., et al. Characterizing cellular mechanical phenotypes with mechano-node-pore sensing. Microsystems & Nanoengineering. 4, 17091 (2018).
- Mierke, C. T. Bidirectional mechanical response between cells and their microenvironment. Frontiers in Physics. 9, 619 (2021).
- Kumar, S., Weaver, V. M. Mechanics, malignancy, and metastasis: The force journey of a tumor cell. Cancer and Metastasis Reviews. 28 (1), 113-127 (2009).
- Nia, H. T., Munn, L. L., Jain, R. K. Physical traits of cancer. Science. 370 (6516), (2020).
- Fletcher, D. A., Mullins, R. D. Cell mechanics and the cytoskeleton. Nature. 463 (7280), 485-492 (2010).
- Wirtz, D., Konstantopoulos, K., Searson, P. C. The physics of cancer: The role of physical interactions and mechanical forces in metastasis. Nature Reviews Cancer. 11 (7), 512-522 (2011).
- Li, B., et al. Mechanical phenotyping reveals unique biomechanical responses in retinoic acid-resistant acute promyelocytic leukemia. iScience. 25 (2), 103772 (2022).
- Kozminsky, M., Sohn, L. L. The promise of single-cell mechanophenotyping for clinical applications. Biomicrofluidics. 14 (3), 031301 (2020).
- Li, M., Dang, D., Liu, L., Xi, N., Wang, Y. Atomic force microscopy in characterizing cell mechanics for biomedical applications: A review. IEEE Transactions on Nanobioscience. 16 (6), 523-540 (2017).
- Wottawah, F., et al. Optical rheology of biological cells. Physical Review Letters. 94 (9), 1-4 (2005).
- Darling, E. M., Di Carlo, D. High-throughput assessment of cellular mechanical properties. Annual Review of Biomedical Engineering. 17 (1), 35-62 (2015).
- Carey, T. R., Cotner, K. L., Li, B., Sohn, L. L. Developments in label-free microfluidic methods for single-cell analysis and sorting. Wiley Interdisciplinary Reviews: Nanomedicine and Nanobiotechnology. 11 (1), 1529 (2019).
- Bagnall, J. S., et al. Deformability of tumor cells versus blood cells. Scientific Reports. 5, 18542 (2015).
- Byun, S., et al. Characterizing deformability and surface friction of cancer cells. Proceedings of the National Academy of Sciences. 110 (19), 7580-7585 (2013).
- Otto, O., et al. Real-time deformability cytometry: On-the-fly cell mechanical phenotyping. Nature Methods. 12 (3), 199-202 (2015).
- Gossett, D. R., et al. Hydrodynamic stretching of single cells for large population mechanical phenotyping. Proceedings of the National Academy of Sciences. 109 (20), 7630-7635 (2012).
- Guck, J., Chilvers, E. R. Mechanics meets medicine. Science Translational Medicine. 5 (212), 3-6 (2013).
- Balakrishnan, K. R., et al. Node-pore sensing: A robust, high-dynamic range method for detecting biological species. Lab on a Chip. 13 (7), 1302-1307 (2013).
- Carbonaro, A., Sohn, L. L. A resistive-pulse sensor chip for multianalyte immunoassays. Lab on a Chip. 5 (10), 1155-1160 (2005).
- Saleh, O. A., Sohn, L. L. Direct detection of antibody-antigen binding using an on-chip artificial pore. Proceedings of the National Academy of Sciences. 100 (3), 820-824 (2003).
- Saleh, O. A., Sohn, L. L. An artificial nanopore for molecular sensing. Nano Letters. 3 (1), 37-38 (2003).
- Saleh, O. A., Sohn, L. L. Quantitative sensing of nanoscale colloids using a microchip Coulter counter. Review of Scientific Instruments. 72 (12), 4449-4451 (2001).
- DeBlois, R. W., Bean, C. P. Counting and sizing of submicron particles by the resistive pulse technique. Review of Scientific Instruments. 41 (7), 909-916 (1970).
- Li, B., et al. Evaluating sources of technical variability in the mechano-node-pore sensing pipeline and their effect on the reproducibility of single-cell mechanical phenotyping. PLoS ONE. 16 (10), 0258982 (2021).
- Zhang, Z. M., Chen, S., Liang, Y. Z. Baseline correction using adaptive iteratively reweighted penalized least squares. Analyst. 135 (5), 1138-1146 (2010).
- Alibert, C., Goud, B., Manneville, J. B. Are cancer cells really softer than normal cells. Biology of the Cell. 109 (5), 167-189 (2017).
- Fujiwara, I., Zweifel, M. E., Courtemanche, N., Pollard, T. D. Latrunculin A accelerates actin filament depolymerization in addition to sequestering actin monomers. Current Biology. 28 (19), 3183-3192 (2018).
- Saleh, O. A. . A novel resistive pulse sensor for biological measurements. , (2003).
- Dokukin, M. E., Guz, N. V., Sokolov, I. Quantitative study of the elastic modulus of loosely attached cells in AFM indentation experiments. Biophysical Journal. 104 (10), 2123-2131 (2013).
- Li, Q., Lim, C. T., Goh, J. C. H., et al. Probing the elasticity of breast cancer cells using AFM. 13th International Conference on Biomedical Engineering. IFMBE Proceedings. 23, 2122-2125 (2009).
- Rother, J., et al. Atomic force microscopy-based microrheology reveals significant differences in the viscoelastic response between malign and benign cell lines. Open Biology. 4 (5), 140046 (2014).
- Li, Q., et al. AFM indentation study of breast cancer cells. Biochemical and Biophysical Research Communications. 374 (4), 609-613 (2008).
- Xu, C., et al. Elasticity measurement of breast cancer cells by atomic force microscopy. Proc. SPIE 9230. Twelfth International Conference on Photonics and Imaging in Biology and Medicine. (PIBM 2014). 92300, (2014).
- Alcaraz, J., et al. Microrheology of human lung epithelial cells measured by atomic force microscopy. Biophysical Journal. 84 (3), 2071-2079 (2003).
- Li, M., Dang, D., Liu, L., Xi, N., Wang, Y. Atomic force microscopy in characterizing cell mechanics for biomedical applications: A review. IEEE Transactions on Nanobioscience. 16 (6), 523-540 (2017).
- Urbanska, M., et al. A comparison of microfluidic methods for high-throughput cell deformability measurements. Nature Methods. 17, 587-593 (2020).
- Hill, R. T., Chilkoti, A. Surface Patterning. Biomaterials Science: An Introduction to Materials: Third Edition. , 276-301 (2013).
- Wang, Z., Volinsky, A. A., Gallant, N. D. Crosslinking effect on polydimethylsiloxane elastic modulus measured by custom-built compression instrument. Journal of Applied Polymer Science. 131 (22), 41050 (2014).
- Gibson, L. J. The hierarchical structure and mechanics of plant materials. Journal of the Royal Society Interface. 9 (76), 2749-2766 (2012).
- Stephens, A. D., Banigan, E. J., Adam, S. A., Goldman, R. D., Marko, J. F. Chromatin and lamin a determine two different mechanical response regimes of the cell nucleus. Molecular Biology of the Cell. 28 (14), 1984-1996 (2017).
- Rosenbluth, M. J., Lam, W. A., Fletcher, D. A. Force microscopy of nonadherent cells: A comparison of leukemia cell deformability. Biophysical Journal. 90 (8), 2994-3003 (2006).
- Evers, T. M. J., Holt, L. J., Alberti, S., Mashaghi, A. Reciprocal regulation of cellular mechanics and metabolism. Nature Metabolism. 3 (4), 456-468 (2021).
- Balakrishnan, K. R., et al. Node-pore sensing enables label-free surface-marker profiling of single cells. Analytical Chemistry. 87 (5), 2988-2995 (2015).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。