Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Mekano-Düğüm-Gözenek Algılama: Çok Parametreli Tek Hücreli Viskoelastik Ölçümler için Hızlı, Etiketsiz Bir Platform
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Burada sunulan, mekano-düğüm-gözenek algılama (mekano-NPS) adı verilen elektronik tabanlı bir mikroakışkan platform kullanarak tek hücreleri mekanik olarak fenotiplemek için bir yöntemdir. Bu platform, hücrelerin hem elastik hem de viskoz biyofiziksel özelliklerini ölçerken 1-10 hücre / s'nin ılımlı verimini korur.
Özet
Hücresel mekanik özellikler, kök hücre farklılaşmasından kanser metastazına kadar çok çeşitli biyolojik süreçlerde ve hastalıklarda rol oynar. Atomik kuvvet mikroskobu (AFM) ve mikropipet aspirasyonu (MA) gibi bu özellikleri ölçmek için kullanılan geleneksel yöntemler, bir hücrenin tam viskoelastik tepkisini yansıtan zengin bilgileri yakalar; ancak, bu yöntemler çok düşük aktarım hızı ile sınırlıdır. Gerçek zamanlı deforme olabilirlik sitometrisi (RT-DC) gibi yüksek verimli yaklaşımlar, genellikle yalnızca bir hücrenin elastik özelliklerini yansıtan tek parametreli okumalarla sınırlı olduklarından, yalnızca sınırlı mekanik bilgileri ölçebilir. Bu yöntemlerin aksine, mekano-düğüm-gözenek algılama (mekano-NPS), orta verime sahip bir hücrenin çok parametreli viskoelastik ölçümlerini elde etmedeki boşluğu dolduran esnek, etiketsiz bir mikroakışkan platformdur. Doğru akım (DC) ölçümü, hücreleri mikroakışkan bir kanaldan geçerken izlemek, dar bir daralmadan önce, sırasında ve sonrasında boyutlarını ve hızlarını izlemek için kullanılır. Bu bilgi (yani, boyut ve hız), her hücrenin enine deformasyonunu, deformasyona karşı direncini ve deformasyondan iyileşmesini ölçmek için kullanılır. Genel olarak, bu elektronik tabanlı mikroakışkan platform, çoklu viskoelastik hücre özellikleri ve böylece bir hücrenin mekanik durumunun daha eksiksiz bir resmini sağlar. Minimum numune hazırlama gerektirdiğinden, basit bir elektronik ölçüm kullandığından (yüksek hızlı bir kameranın aksine) ve standart yumuşak litografi imalatından yararlandığından, bu platformun uygulanması basit, erişilebilir ve aşağı akış analizine uyarlanabilir. Bu platformun esnekliği, kullanışlılığı ve hassasiyeti, temel bilim ve klinik teşhiste daha birçok uygulama potansiyeli ile çeşitli hücreler hakkında benzersiz mekanik bilgiler sağlamıştır.
Giriş
Tek hücreler dinamik, viskoelastik malzemelerdir1. Çok sayıda iç ve dış süreç (örneğin, mitozun başlangıcı veya hücre dışı matrisin [ECM] yeniden şekillendirilmesi), yapılarını ve kompozisyonlarınıetkiler 2,3,4, genellikle mevcut durumlarını tamamlayan farklı biyofiziksel özelliklerle sonuçlanır. Özellikle, mekanik özelliklerin hücresel gelişim, fizyoloji ve patolojinin önemli biyobelirteçleri olduğu ve kanonik moleküler ve genetik yaklaşımları destekleyebilecek değerli nicel bilgiler sağladığı gösterilmiştir 5,6,7. Örneğin, Li ve ark. yakın zamanda ilaca dirençli ve ilaca duyarlı akut promiyelositik lösemi hücreleri arasındaki mekanik farklılıkları tanımlarken, aynı zamanda farklı şekilde eksprese edilen sitoiskeletle ilişkili genleri ortaya çıkarmak için RNA-seq kullanmışlardır8. Tek hücreli mekanik ve hücresel fonksiyon arasındaki karmaşık etkileşimi anlayarak, mekanofenotiplemenin temel bilim ve klinik teşhisin dönüştürülmesinde daha geniş uygulamaları vardır9.
Tek hücreli mekaniği ölçmek için en yaygın olarak benimsenen araç atomik kuvvet mikroskobudur (AFM). AFM, hücresel mekanik özelliklerin yüksek çözünürlüklü, lokalize bir ölçümünü mümkün kılarken, 0,01 hücre / s10 < bir verim ile sınırlı kalır. Alternatif olarak, asılı tek hücreleri 11 yakalamak ve deforme etmek için iki farklı lazer ışını kullanan optik sedyeler,<1 hücre / s12'nin marjinal olarak daha yüksek verimleriyle sınırlıdır. Mikroakışkan teknolojilerindeki son gelişmeler, hızlı, tek hücreli, mekanik değerlendirme için yeni nesil cihazları mümkün kılmıştır12,13. Bu teknikler,10-1.000 hücre / s 18 veriminde hücreleri hızlı bir şekilde deforme etmek için dar daralma kanalları 14,15, kesme akışı 16 veya hidrodinamik germe 17 kullanır. Bu yaklaşımların ölçüm oranı geleneksel tekniklerden oldukça hızlı olsa da, genellikle sınırlı mekanik okumalar için yüksek verimli yetenekler ticareti yaparlar (Ek Tablo 1). Yukarıda belirtilen tüm hızlı mikroakışkan yöntemler, yalnızca bir hücrenin elastik özelliklerini yansıtan geçiş süresi veya deforme olabilirlik oranları gibi temel, tek parametreli metriklere odaklanır. Bununla birlikte, tek hücrelerin içsel viskoelastik doğası göz önüne alındığında, hücrelerin sağlam ve kapsamlı bir mekanik karakterizasyonu, sadece elastik bileşenlerin değil, aynı zamanda viskoz tepkilerin de dikkate alınmasını gerektirir.
Mekano-düğüm-gözenek algılama (mekano-NPS)2,8 (Şekil 1A), tek hücreli mekanofenotipleme ile mevcut sınırlamaları ele alan mikroakışkan bir platformdur. Bu yöntem, hücre çapı, bağıl deforme edilebilirlik ve deformasyondan geri kazanım süresi de dahil olmak üzere çoklu biyofiziksel parametrelerin aynı anda ölçülmesini sağlar ve 1-10 hücre/sn ılımlı bir verime sahiptir. Bu teknik, düğüm-gözenek algılama (NPS) 19,20,21,22,23,24 dayanmaktadır; bu, "düğümler" olarak adlandırılan daha geniş bölgeler tarafından bölümlere ayrılmış bir mikroakışkan kanaldan geçen bir hücre tarafından üretilen modüle edilmiş akım darbesini ölçmek için dört noktalı bir prob ölçümü kullanılmasını içerir. Modüle edilmiş akım darbesi, hücrenin segmentlerdeki (yani "gözenekler") ve düğümlerdeki akım akışını kısmen bloke etmesinin bir sonucudur ve birincisinde ikincisinden daha fazla akım bloke edilir. Mekano-NPS'de, bir segment, "kasılma kanalı", bir hücre çapından daha dardır; Sonuç olarak, bir hücrenin tüm kanalı geçmek için deforme olması gerekir (Şekil 1B). Hücre çapı, hücre kasılma kanalından önce düğüm gözeneklerini geçtiğinde üretilen alt darbenin büyüklüğü ile belirlenebilir (Şekil 1B, C). Burada, |ΔInp|, hücre gözenekteyken geçerli düşüş, hücrenin gözenek içindeki hacim oranıyla orantılıdır, V hücresi / Vgözenek 2,8,19. Hücre sertliği, hücre kasılma kanalını geçtiğinde üretilen önemli ölçüde daha büyük alt darbenin süresi olanΔ T c ile belirlenebilir (Şekil 1B, C). Daha sert bir hücrenin kanalı geçmesi daha yumuşak bir hücredendaha uzun sürecektir 2,8. Son olarak, hücrenin deformasyon sonrası orijinal boyutuna ve şekline dönme kabiliyeti olan hücre "geri kazanımı", hücre kasılma kanalından sonra düğüm gözeneklerini geçerken üretilen alt darbeler dizisi ile belirlenebilir (Şekil 1B, C). İyileşme süresi, ΔTr, mevcut alt darbelerin, hücre sıkıştırılmadan önce önceki alt darbelerin büyüklüğüne dönmesi için geçen süredir. Genel olarak, bir hücrenin mikroakışkan kanaldan geçişi olarak üretilen modüle edilmiş akım darbeleri, ilgili tek hücreli mekanik parametreleri çıkarmak için kaydedilir ve analiz edilir (Şekil 1D)2,8.
Bu elektronik tabanlı mikroakışkan platformun tekrarlanabilirliği ve kullanım kolaylığı daha önce gösterilmiştir25. Ek olarak, platform tek hücreli mekanofenotipleme için giriş için düşük bir engel sunar. Mikroakışkan cihazları imal etmek için standart yumuşak litografi kullanılır. Ölçüm donanımı, basit bir baskılı devre kartı (PCB), güç kaynağı, ön amplifikatör, veri toplama kartı (DAQ) ve bilgisayar dahil olmak üzere ucuz bileşenlerden oluşur. Son olarak, veri toplama ve analizi için kullanıcı dostu kod mevcuttur ve bu da basit bir uygulama sağlar. Bu mekanofenotipleme tekniği, malign olmayan ve malign meme ve akciğer epitel hücre hatlarının popülasyonlarını ayırt edebilir, primer insan meme epitel hücrelerinde alt soylar arasında ayrım yapabilir ve sitoiskelet pertürbasyonlarının ve diğer farmakolojik ajanların etkilerini karakterize edebilir 2,8. Genel olarak, bu platform tek hücrelerin mekanofenotiplenmesi için etkili bir yaklaşımdır.
Protokol
1. Tasarım cihazı geometrisi
- Boyutlandırma ve geri kazanım segmentlerinin genişliğini, ölçülecek en büyük hücrelerin çapından daha geniş olacak şekilde seçin, ancak aynı zamanda yeterli bir sinyal-gürültü oranını (SNR) korur. Çeşitli hücre satırları için farklı boyutlandırma ve kurtarma segmenti genişliklerine örnekler için Ek Tablo 2'ye bakın.
- Mekanofenotiplemeye tabi tutulacak hücrelerin ortalama boyutuna %30-%40'lık bir gerinim uygulamak için büzülme segmenti genişliğini seçin. Gerinim, d'nin hücre çapı ve wc'nin büzülme kanalı genişliği 2,8 olduğu
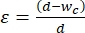 durumlarda tanımlanır. Çeşitli hücre hatları için farklı büzülme segmenti genişlikleri için Ek Tablo 2'ye bakın.
durumlarda tanımlanır. Çeşitli hücre hatları için farklı büzülme segmenti genişlikleri için Ek Tablo 2'ye bakın.
NOT: Önemli ölçüde farklı çaplara sahip hücre tiplerini veya koşullarını karşılaştırmak istenirse, her hücre tipine / durumuna özgü büzülme segmenti genişlikleriyle ayrı cihaz tasarımları kullanılmalıdır. - Her benzersiz cihaz geometrisi için bir referans cihaz tasarlayın. Bu, mikroakışkan kanalın boyutlandırma gözenek segmentinin etkili çapı olan De'yi belirlemek için gereklidir.
NOT: Referans cihaz, birincil cihazla aynı geometriyi kullanır. Tek değişiklik, büzülme segmentinin, bilinen bir boyuttaki polistiren boncuklarla kalibrasyona izin vermek için boyutlandırma gözenek segmentine genişlikte eşit olması gerektiğidir. Kasılmanın genişletilmesi, polistiren boncukların kalibrasyon sırasında kasılma kanalını tıkamasını önler. Kalibrasyon işlemi 4.1 ve 5.3.1 numaralı adımlarda daha ayrıntılı olarak açıklanmıştır. Kalibrasyon, piyasada satılan bir hücre sayacı kullanılarak da gerçekleştirilebilir, bu durumda referans cihazına gerek yoktur. Bu işlem adım 4.2'de açıklanmıştır. - Kanal yüksekliğini, ilgilenilen en büyük hücrelerin büzülme segmenti2 içinde kısıtlama olmaksızın tamamen uzayabileceği şekilde seçin. Kanal yüksekliğinin hmin'den
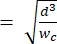 daha büyük olduğundan emin olun (bu, hücrenin küresel ön deformasyon olduğunu ve deformasyon sırasında kanal uzunluğu ve yüksekliği boyunca izometrik deformasyonun meydana geldiğini varsayar).
daha büyük olduğundan emin olun (bu, hücrenin küresel ön deformasyon olduğunu ve deformasyon sırasında kanal uzunluğu ve yüksekliği boyunca izometrik deformasyonun meydana geldiğini varsayar).
NOT: Bir akım alt darbesinin büyüklüğü göz önüne alındığında, hmin ne kadar büyükse, genel SNR o kadar düşük olacaktır.
hmin ne kadar büyükse, genel SNR o kadar düşük olacaktır. - Seçilen kanal genişliklerine sahip bilgisayar destekli tasarım yazılımını kullanarak bir fotoğraf maskesi tasarlayın ve oluşturun. Ek Dosya 1'de örnek bir dosya verilmiştir. Negatif master'dan soyulduktan sonra polidimetilsiloksan (PDMS) büzülmesini hesaba katmak için mikroakışkan maske tasarımını% 1,5 oranında ölçeklendirin.
NOT: Bir dizi cihaz, genel dizi gofret boyutunu aşmadığı sürece tek bir maskeye dahil edilebilir (Ek Şekil 1A). - Mikroakışkan cihaz akımının dört noktalı prob ölçümünü gerçekleştirmek için kullanılacak elektrotlarla bir fotomaske tasarlayın ve oluşturun (Şekil 1D). Ek Dosya 1'de örnek bir dosya verilmiştir.
NOT: Bir elektrot dizisi, dizi cam kızağın boyutunu aşmadığı sürece tek bir maskeye dahil edilebilir (Ek Şekil 1B).
2. Fabrikasyon cihazları (Şekil 2)
- Bir cam substrat üzerinde elektrot desenleri hazırlayın.
- Pozitif bir fotodirenci düz cam bir slayt üzerine ürün veri sayfasına göre püskürtün, desenleyin ve işleyin. Bu yordamın bir örneği Ek Dosya 2'de özetlenmiştir.
- Metal biriktirme, kaldırma ve altın aşındırma işlemlerini gerçekleştirin.
- Slayta 75 şTi, 250 şPt ve 250 şAu ince film biriktirme işlemi gerçekleştirin. Elektron tabancası buharlaşmasını kullanan bu prosedürün bir örneği Ek Dosya 3'te özetlenmiştir.
- Fazla metalin kaldırılmasını gerçekleştirmek için slaytı 15 dakika boyunca asetona batırın.
- Bir duman davlumbazında, Ek Şekil 2'de gösterildiği gibi, mikroakışkan kanala maruz kalacak elektrotların bölgesine altın kazıntıyı dökmek için tek kullanımlık bir pipet kullanın. Slaytın başka bir yerinde kazıntıların düşmesini önlemek için dikkatli olun.
DİKKAT: Altın kazıma cilt ve göz tahrişine neden olabilir. Buharları solumayın ve yutmayın. Dikkatli kullanın, uygun kişisel koruyucu ekipman (KKD) giyin ve yerel bertaraf yönetmeliklerine göre atıkları atın. - Slaytı deiyonize (DI) suyla durulayın ve kuru azotla (N2) kurulayın.
- Aynı cam slayta birden fazla elektrot basılmışsa, slaytı tek tek yongalara doğrayın.
- Desenli elektrot sınırları boyunca slaytı puanlamak için bir cam kesici alet kullanın.
- Slaytı tek tek yongalara bölmek için camı skor boyunca kırın.
- Elektrotları mikroskop altında görsel olarak inceleyin. Tek tek elektrotların elektriksel olarak açık olmadığından veya elektrotların birlikte kısaltılmadığından emin olun.
- Kanallar için negatif bir ana kalıp imal edin.
- Ürün veri sayfasına göre bir SU-8 epoksi direncini cilalı bir silikon gofret üzerine döndürün, desenleyin ve işleyin. Bu yordamın bir örneği Ek Dosya 2'de özetlenmiştir.
- Bir profilometre kullanarak özellik yüksekliklerini ölçün ve özellikleri mikroskop altında görsel olarak inceleyin (Ek Şekil 3). İstenilen geometrilerin iyi tanımlandığından emin olun.
- Yumuşak litografi ile kalıp PDMS kanalları.
- Tek kullanımlık bir kapta bir elastomer ve bir çapraz bağlayıcıyı 10:1 kütle oranında tartarak PDMS'yi hazırlayın.
NOT: Çapı 3 olan bir gofret için 30 g PDMS yeterlidir. - PDMS kabarcıklarla opak olana kadar PDMS'yi tek kullanımlık bir çatalla 30 saniye boyunca kuvvetlice karıştırın.
- PDMS'yi bir vakum odasında yaklaşık 30-90 dakika boyunca veya PDMS görünür kabarcıklar olmadan şeffaf hale gelene kadar gazdan arındırın.
- Gofreti SU-8 ana kalıbı ile tek kullanımlık bir Petri kabına yerleştirin ve PDMS'yi gofretin ortasına dökün.
- PDMS ve gofret içeren Petri kabını bir vakum odasına yerleştirin ve yaklaşık 30 dakika boyunca veya PDMS'de kabarcık kalmayana kadar gazı çözün.
- PDMS'yi 80 °C'de bir fırında veya sıcak plakada 2 saat pişirin.
- Keskin bir bıçakla, PDMS'yi SU-8 negatif master'dan kesin ve çıkarın.
- Kalıplanmış PDMS levhayı keskin bir bıçak kullanarak ayrı kalıplara doğrayın
- Giriş ve çıkış erişim deliklerini tek kullanımlık bir biyopsi zımbalama kullanarak çekirdek oluşturun. En iyi sonuçları elde etmek için, her PDMS levhası için yeni bir zımba kullanın. Daha keskin bir zımba, pürüzsüz kenarlı delikler üreterek büzülme kanalını engelleyebilecek partikülleri en aza indirir.
NOT: Erişim deliklerinin çapı, borunun dış çapından biraz daha az olmalıdır. Örneğin, dış çapı 1/32 inç olan politetrafloroetilen (PTFE) boru kullanılıyorsa, 1,5 mm'lik bir delik açılmalıdır.
- Tek kullanımlık bir kapta bir elastomer ve bir çapraz bağlayıcıyı 10:1 kütle oranında tartarak PDMS'yi hazırlayın.
- PDMS kanallarına bir cam/elektrot substratı bağlayın.
- Elektrot camı kızaklarını metanol ile temizleyin (≥% 99.8). Kuru N2 ile kurulayın.
- PDMS cihazını viski bandı ile temizleyin, ardından izopropil alkol (IPA) ve deiyonize su (DI; 18 MΩ /cm2) ile durulayın. Kuru N2 ile kurulayın. Ardından, viski bandı ile bir kez daha temizleyin.
- Cam substratı prefabrik elektrotlarla ve hazırlanan PDMS kalıbıyla (özellik tarafı yukarı) bir plazma temizleyiciye yerleştirin.
- Her ikisini de 2 dakika boyunca oksijen plazmasına maruz bırakın (100-300 mTorr, 30 W).
- PDMS kalıbını, özellik tarafı aşağı bakacak şekilde hizalayın ve prefabrik elektrotlarla cam alt tabakanın üzerine yerleştirin.
NOT: Plazma ile işlenmiş PDMS ve cam temas ettiğinde yapıştırma anlıktır; sonuç olarak, daha fazla hizalama modifikasyonu mümkün olmayacaktır. Hizalamayı kolaylaştırmak için, DI suyundaki 2: 1 metanolün 20 μL'lik seyreltilmesi, plazma ile muamele edilmiş cam yüzeye pipetlenebilir. Metanol çözeltisi, işlenmiş cam ve PDMS arasında fiziksel bir bariyer görevi görerek hizalama ayarlamalarına izin verir. Metanol kullanıyorsanız, çözeltiyi buharlaştırmak ve yapıştırma işlemini tamamlamak için hizalanmış ve çiftleştirilmiş cihazı 50 ° C'de 2 saat pişirin. - Bağlı cihazı mikroskop altında görsel olarak inceleyin. Elektrotların ve kanal geometrilerinin düzgün bir şekilde hizalandığından emin olun.
3. Hücreleri ölçün (Şekil 1D)
- Basınç kaynağını, PCB'yi, tezgah üstü donanımı ve veri toplama yazılımını hazırlayın.
- Kelepçeyi kullanarak mikroakışkan cihazı PCB'ye bağlayın. PCB'nin bir örneği Ek Dosya 4'te (GERBER dosyaları) ve Ek Dosya 5'te (şematik, kart ve PCB parça listesi dosyaları) verilmiştir.
- Kelepçenin yaylı pimlerini mikroakışkan cihazdaki elektrot temas pedleriyle hizalayın ve kelepçenin başlık pimlerini PCB üzerindeki deliklerle hizalayın.
- Kelepçenin başlık pimlerini PCB deliklerine sıkıca yerleştirerek yaylı pimlerin elektrot temas pedleriyle aynı hizada kalmasını sağlayın.
- Elektronik donanımı kurun ve bağlayın.
- Güç kaynağının çıkış bağlantı noktalarından ikisini, çift muz fişli Bayonet Neill-Concelman (BNC) dişi adaptörü ve BNC kablosuyla PCB'nin besleme voltajı bağlantı noktasına bağlayın.
- Güç kaynağını açın. BNC'nin iç iletkenine bağlı çıkışı +15 V'a ayarlayın ve diğer çıkışı -15 V'a ayarlayın.
- Güç kaynağının çıkış bağlantı noktalarının üçüncüsünü BNC kablosuyla PCB'nin giriş voltajı bağlantı noktasına bağlayın. Çıkışı istenen uygulanan voltaja ayarlayın, ancak deneye başlayana kadar etkinleştirmeyin.
- PCB'nin çıkış akımı portunu bir BNC kablosuyla akım ön amplifikatörünün girişine bağlayın.
- Mevcut ön amplifikatörün çıkışını, bir BNC kablosuyla veri toplama sisteminin BNC terminal bloğundaki bir analog girişe bağlayın. İsteğe bağlı olarak, yüksek frekanslı paraziti filtrelemek için BNC kablosuyla aynı hizada bir analog alçak geçirgen filtre bağlayın.
NOT: SNR'yi iyileştirmek için, PCB ve cihaz kalın bir metal muhafaza içine yerleştirilebilir. Tüm BNC kabloları ve akışkan borular, muhafazaya açılan deliklerden yönlendirilebilir.
- Gerekli yazılımı kişisel bilgisayara (PC) yükleyin ve kurun
- Basınç kontrol cihazını açın ve PC'ye bağlayın. Gerekli tüm basınç kontrol cihazı yazılımlarını üreticinin talimatlarına göre kurun.
- MATLAB'ı ve Veri Toplama Araç Kutusu'nu PC'ye yükleyin. MATLAB Veri Toplama Araç Kutusu arabiriminin algılayabilmesi için veri toplama sistemi için gerekli sürücülerin yüklendiğinden emin olun.
- Birlikte verilen veri toplama komut dosyası "NPS.m"yi https://github.com/sohnlab/node-pore-sensing-public'dan indirin.
- Veri alma komut dosyasını açın ve yapılandırın.
- Satıcı Kimliği, DAQ'ın Cihaz Kimliği ve analog giriş kanalı numarasını (dahil edilen komut dosyasında 34-36. satırlar) içeren veri toplama oturumunu başlatmak için doğru değerleri ayarlayın.
NOT: Cihaz Kimliği, "daq.getDevices" veya "daqlist" işlevi kullanılarak bulunabilir. - Edinme için istenen örnekleme hızını ayarlayın (dahil edilen komut dosyasında satır 23). En iyi sonuçlar için en az 10 kHz'e ayarlanmalıdır.
- Satıcı Kimliği, DAQ'ın Cihaz Kimliği ve analog giriş kanalı numarasını (dahil edilen komut dosyasında 34-36. satırlar) içeren veri toplama oturumunu başlatmak için doğru değerleri ayarlayın.
- Kelepçeyi kullanarak mikroakışkan cihazı PCB'ye bağlayın. PCB'nin bir örneği Ek Dosya 4'te (GERBER dosyaları) ve Ek Dosya 5'te (şematik, kart ve PCB parça listesi dosyaları) verilmiştir.
- Hücre süspansiyonunu hazırlayın.
- 1x fosfat tamponlu salin (PBS) içinde% 2'lik bir fetal sığır serumu (FBS) çözeltisi hazırlayın ve 0.22 μm filtre ile filtreleyin.
- Hücreleri kültüre alır ve tercih edilen hücre hattının uygun hücre kültürü protokolüne göre hazırlar. Hazırlanan %2 FBS çözeltisindeki hücreleri, 1-5 x 105 hücre/ mL konsantrasyonda 1x PBS içinde askıya alın. Deney süresince hücreleri buz üzerinde tutun.
- Hücrelerin fiziksel özelliklerini ölçün.
- Hücre örneğini boruya yükleyin ve cihaz girişine bağlayın.
- 30 cm'lik PTFE borusunu tıraş bıçağı veya keskin bıçakla kesin.
- Borunun bir ucunu bir luer kilit şırıngasına takın. Hücre örneğini borunun diğer ucuna çekmek için şırıngayı kullanın.
- Boruyu cihazın girişine dikkatlice yerleştirin.
- Borunun karşı ucunu mikroakışkan basınç kontrol cihazına bağlayın.
NOT: Basınç kontrolörüne sıvı geri akışını önlemek için mikroakışkan basınç kontrolörü ile boru arasına bir filtre eklenebilir.
- Denemeyi çalıştırın.
- Basınç kontrol cihazı yazılımı üzerinde istenen sabit sürüş basıncını ayarlayın ve numunenin cihazı doldurmasına izin verin.
NOT: Basınç tipik olarak 2-21 kPa'dır. Akış hızı, açıkça tanımlanmış darbelere izin verecek kadar yavaş, ancak yeterli verime izin verecek kadar hızlı olmalıdır.- Mikroakışkan kanallarda kabarcıklar oluşursa, çıkmaz doldurma kullanın: cihaz çıkışını takın ve gaz geçirgen PDMS'den havayı dışarı çıkmaya zorlamak için girişe düşük bir basınç uygulayın. Kanalda kabarcıklar bırakmak, dengesiz bir akım taban çizgisine yol açacak ve doğru ölçümleri önleyecektir.
- Enkaz mikroakışkan kanalı tıkarsa, sürüş basıncını uygularken PDMS cihazının üstüne hafifçe bastırarak, basıncı açıp kapatarak veya boruyu çıkarıp yeniden yerleştirerek daha yüksek bir basıncı "darbeleyerek" yerinden çıkarın. Enkaz kalırsa, yeni bir cihaza geçmek gerekebilir.
- Güç kaynağındaki Voltaj düğmesini döndürerek istediğiniz voltajı ayarlayın ve Açma düğmesine basarak voltajı etkinleştirin.
NOT: Voltaj tipik olarak 1-5 V'tur. Yeterli bir SNR için gereken en düşük voltajı seçin. Karşılaştırılacak tüm koşullarda aynı voltaj kullanılmalıdır. - Mevcut ön amplifikatörü açın ve hassasiyeti (A / V) mümkün olduğunca düşük ayarlayın; alternatif olarak, ön amplifikatörü aşırı yüklemeden veya DAQ'nın maksimum analog giriş voltajını aşmadan kazancı (V / A) mümkün olduğunca yükseğe ayarlayın. Bu çalışmada duyarlılık 10-7 A/V olarak ayarlandı.
NOT: Uygun hassasiyet/kazanç değeri, hem uygulanan voltaja hem de mikroakışkan kanalın temel direncine bağlı olacaktır. - NPS.m veri toplama komut dosyasını başlatmak ve verileri örneklemeye ve kaydetmeye başlamak için MATLAB şerit menüsündeki yeşil Çalıştır düğmesine basın.
- Denemeyi sonlandırmak için, veri toplama komut dosyasını durdurmak üzere şekil penceresinin sol alt köşesindeki Durdur düğmesine basın. Açık düğmesine basarak güç kaynağı çıkışını devre dışı bırakın. Basınç kontrol cihazı yazılımında basınç kaynağını sıfır basınca ayarlayın.
- Bu noktada, deneme aşağıdakilerden birini veya birkaçını yapmak için duraklatılabilir:
- Mevcut cihazı yenisiyle değiştirin.
- Boruyu daha fazla hücre örneğiyle yeniden yükleyin.
NOT: Numunenin çapraz kontaminasyonunu önlemek için, farklı tipteki veya koşullardaki hücreleri ölçmek üzere yeni cihazlar kullanın. - Cihazı PCB'den çıkarın ve kanalın durumunu mikroskop altında inceleyin. Aynı cihazı kullanarak deneyi yeniden başlatmak için, hava kabarcıklarının ortaya çıkmamasına dikkat edilmelidir. Hücre örneğini cihaz girişine yerleştirirken tüpün en sonunda tutmak için şırınga pistonuna hafif basınç uygulamak gerekebilir.
- Basınç kontrol cihazı yazılımı üzerinde istenen sabit sürüş basıncını ayarlayın ve numunenin cihazı doldurmasına izin verin.
- Hücre örneğini boruya yükleyin ve cihaz girişine bağlayın.
4. Mikroakışkan cihazı kalibre edin
- 1. Seçenek: Referans cihazlardaki polistiren boncukları ölçün.
- Boyutlandırma kanalından daha küçük bir polistiren boncuk boyutu seçin.
- Hücre deneyleri sırasında kullanılan filtrelenmiş PBS ve FBS çözeltisine, 1-3 x 10 5 boncuk / mL konsantrasyonunda%1,5 Ara ve polistiren boncuklar ekleyin.
- Bölüm 3'te belirtildiği gibi, adım 1.3'te açıklanan referans cihazı kullanarak deneye devam edin ve deneme sırasında kullanılan voltajın aynısını uygulayın. Bölüm 5'te açıklandığı gibi, boncuklar boyutlandırma gözeneklerini geçerken üretilen mevcut düşüşün ortalama büyüklüğünü ve D e'yi hesaplamak için boncukların bilinen çapını kullanın.
- 2. Seçenek: Hücre boyutunu ayrı bir ölçüm cihazıyla bağımsız olarak ölçün.
- Adım 4.1'deki protokolü takip etmek yerine, numunedeki hücrelerin ortalama boyutunu ölçmek için ticari olarak temin edilebilen bir hücre boyutu ölçüm cihazı kullanın. Bu durumda, referans cihazına gerek yoktur. Bölüm 5'te açıklandığı gibi D e'yi hesaplamak için hücreler boyutlandırma gözeneklerini ve ölçülen ortalama hücre çapını geçerken üretilen ortalama akım düşüşünü kullanın.
5. Hücre fenotiplerini çıkarmak için verileri analiz edin
NOT: Veri işleme, mNPS_procJOVE https://github.com/sohnlab/NPS-analysis-JOVE.m adresindeki MATLAB komut satırı arabirim program dosyası kullanılarak gerçekleştirilebilir. Daha fazla talimat için Ek Dosya 6'ya bakın.
- Verileri önceden işleyin (Şekil 3A).
- Akım-gerilim preamplifikatöründe kullanılan kazanç değerini DAQ tarafından elde edilen ham verilere uygulayarak ölçülen elektrik akımını hesaplayın.
- Ham akım ölçümüne dikdörtgen yumuşatma fonksiyonu ve/veya alçak geçirgen filtre uygulayarak yüksek frekanslı gürültüyü giderin. Ardından, filtrelenen verileri daha düşük bir örnekleme hızına yeniden örnekleyin. Ayrıca, karşılık gelen zaman damgası verilerini bu düşük örnekleme hızında hesaplayın.
- 26'yı yumuşatan asimetrik en küçük kareler gibi bir yöntem uygulayarak takılı bir taban çizgisi akım sinyalini hesaplayın.
- Sonraki veri noktaları arasındaki farkı alarak önceden işlenmiş geçerli verilerin yaklaşık ilk türevini (fark sinyali) hesaplayın.
- Hücre olaylarını tanımlayın ve alt darbe verilerini ayıklayın (Şekil 3B).
- Önceden işlenmiş verileri inceleyerek aday hücre olaylarını arayın. Diğer hücre olaylarıyla (yani, tesadüf olayları) çakışan hücre olaylarını reddedin (Ek Şekil 4), zayıf bir taban çizgisi uyumu sergileyen veya beklenmeyen ya da hatalı bir darbe şekline sahip olan (örneğin, kanalda bir tıkanıklık mevcut olabilir).
- Her hücre olayı için alt darbe verilerini ayıklayın.
- Her düğüm-gözenek segmenti, genel sinyal darbesi içinde karşılık gelen bir alt darbe olarak görünecektir (Şekil 1B, C). Fark sinyali yerel bir minimum değere ulaştığında zaman noktasını hesaplayarak her bir alt darbenin başlangıcını tanımlayın. Fark sinyali yerel bir maksimum değere ulaştığında zaman noktasını hesaplayarak her bir alt darbenin sonunu tanımlayın.
- Her bir alt darbenin genişliğini, başlangıç ve bitiş zaman noktaları arasında geçen süre olarak belirleyin. Başlangıç ve bitiş zaman noktaları arasındaki tüm veri noktaları için ölçülen akım ile taban çizgisi akımı arasındaki farkın ortalamasını hesaplayarak her bir alt darbenin genliğini belirleyin.
- Alt darbe verilerine dayanarak her hücre olayı için hücre mekanofenotipini belirleyin.
- Deblois ve Bean24 tarafından tanımlanan denkleme dayanarak d hücre çapını belirleyin:
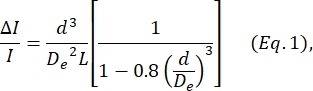
burada ΔI / I , boyutlandırma alt darbelerinde alt darbe genliğinin taban çizgisi akımına ortalama oranıdır, De kanalın etkin çapıdır (adım 4'te ölçülür) ve L , düğüm-gözenek kanalının toplam uzunluğudur.- D e, bilinen bir çaptaki (hücreler veya boncuklar, bkz. adım 4) bir dizi parçacık tarafından üretilen ortalama ΔI / I'nin hesaplanmasıyla, bilinen çapı d olarak kullanarak ve De için Eq 1'i çözerek belirlenir.
- Hücrenin deformasyona karşı direncini ölçün.
- Bilinen segment uzunluklarını ve her bir alt darbenin ölçülen süresini kullanarak, boyutlandırma alt darbelerindeki ortalama hücre hızını hesaplayarak akışkan hızı Uakışını belirleyin.
- Kim ve ark.2 tarafından tanımlanan tüm hücre deforme edilebilirlik indeksini (wCDI) belirleyin:
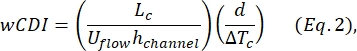
burada Lc , büzülme segmentinin uzunluğu, hkanalı kanal yüksekliği ve ΔTc , büzülme alt darbesinin süresidir.
- Hücrenin, boyutlandırma alt darbesi2'den ortalama genliğin% 8'inde bir genliğe sahip ilk kurtarma alt darbesi olarak tanımlanan deformasyondan iyileşme süresini tanımlayın.
- Kasılma segmenti içindeki hücrenin enine deformasyonunu hesaplayın.
- Kim ve ark.2 tarafından tanımlandığı gibi büzülme segmentinin (De,c) etkin çapını hesaplayın:
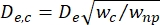 burada w c, büzülme segmentinin genişliğidir ve wnp, diğer tüm segmentlerin genişliğidir.
burada w c, büzülme segmentinin genişliğidir ve wnp, diğer tüm segmentlerin genişliğidir. - Kasılma içindeki hücrenin eşdeğer küresel çapını d c'yi, Deblois ve Bean24 tarafından tanımlanan denklemi kullanarak tekrar hesaplayın:
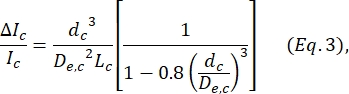
burada ΔI c/I c, büzülme alt darbesindeki alt darbe genliğinin temel akıma oranıdır ve Lc, büzülme segmentinin uzunluğudur. - Kim ve ark.2 tarafından açıklandığı gibi hücrenin uzama uzunluğu L'nindeforme olduğunu hesaplayın:
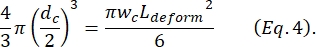
- Son olarak, hücrenin enine deformasyonunu hesaplayın δ Kim ve ark.2 tarafından tanımlanan deforme .
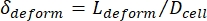
- Kim ve ark.2 tarafından tanımlandığı gibi büzülme segmentinin (De,c) etkin çapını hesaplayın:
- Deblois ve Bean24 tarafından tanımlanan denkleme dayanarak d hücre çapını belirleyin:
Sonuçlar
Burada sunulan mekanofenotipleme platformu, orta verime sahip tek hücrelerin biyofiziksel özelliklerini ölçmek için basit ve çok yönlü bir yaklaşımdır. Hücreler, sabit basınç güdümlü akış kullanılarak mikroakışkan kanaldan (Şekil 1A) akar. Hücreler geçiş yaparken, mikroakışkan kanalın uzunluğu ve üretilen akım darbeleri, veri toplama donanımı kullanılarak kaydedilir. Elde edilen sinyal (Şekil 1B, C) daha sonra...
Tartışmalar
Bu mekanofenotipleme tekniğini kullanarak tek hücrelerin mekanik özelliklerinin ölçülmesi üç aşamadan oluşur: cihaz üretimi, veri toplama ve veri analizi. Her aşamada, deneysel sonuçları önemli ölçüde etkileyebilecek dikkate değer yönler vardır. Cihaz üretimi sırasında, tutarlı kanal geometrileri ve cihazdan cihaza homojenlik, doğru ve tekrarlanabilir sonuçlar için gereklidir. Özellikle, her aygıtın yan duvarları nispeten düzgün olmalıdır (Şekil 4Ai) ve ?...
Açıklamalar
L. L. S, ABD patent No. 11,383,241'e sahiptir: "Mechano-node-pore sensing", J. Kim, S. Han ve L. L. Sohn, 12 Temmuz 2022'de yayınlanmıştır.
Teşekkürler
Bu araştırma NIBIB 1R01EB024989-01 ve NCI 1R01CA190843-01 hibeleri ile desteklenmiştir. A. L. ve R. R., H2H8 Derneği Lisansüstü Araştırma Bursu tarafından desteklenmiştir. K. L. C., Ulusal Bilim Vakfı Lisansüstü Araştırma Bursu ve Siebel Scholar Bursu tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Acetone | J.T. Baker | 5356-05 | Purity (GC) ≥ 99.5% (https://us.vwr.com/store/product/6057739/acetone-99-5-vlsi-j-t-baker) |
| Aluminum Foil | n/a | n/a | |
| Analog Low-Pass Filter | ThorLabs | EF504 | ≤240 kHz Passband, Coaxial BNC Feedthrough (https://www.thorlabs.com/thorproduct.cfm?partnumber=EF504#ad-image-0) |
| Biopsy Punch | Integra Miltex | 33-31AA-P/25 | 1mm, Disposable, with Plunger (https://mms.mckesson.com/product/573313/Miltex-33-31AA-P25) |
| Blade | n/a | n/a | |
| BNC Cable | Pomona Electronics | 2249-C-12 | https://www.digikey.com/en/products/detail/pomona-electronics/2249-C-12/603323?utm_adgroup=Coaxial%20Cables%20%28RF%29&utm_source=google&utm_ medium=cpc&utm_campaign= Shopping_Product_Cable%20Assemblies_NEW&utm_term= &utm_content=Coaxial%20Cables%20%28RF%29&gclid=Cj0KCQjwlK-WBhDjARIsAO2sErQqnVJ pj5OXVObuTI8ZUf1ZeIn7zvzGnx mCWdePrG6SdEJMF3X6ubUaAs w-EALw_wcB |
| Cleanroom Polyester Swab | Thermo Fisher Scientific | 18383 | https://www.fishersci.com/shop/products/texwipe-cleantip-alpha-polyester-series-swabs-6/18383 |
| Current Preamplifier | DL Instruments | 1211 | https://www.brltest.com/index.php?main_page=product_info&products_ id=1419 |
| Custom PCB (w/ components) | n/a | n/a | see Supplemental files 4 and 5 |
| DAQ Terminal Block | National Instruments | BNC-2120 | https://www.ni.com/en-in/support/model.bnc-2120.html |
| DAQ to BNC-2110 cable | National Instruments | SHC68-68-EPM | https://www.ni.com/en-in/support/model.shc68-68-epm.html |
| Data Acquisition Board (DAQ) | National Instruments | PCI-6251 | https://www.ni.com/docs/en-US/bundle/pci-6251-feature/page/overview.html |
| Dessicator | Thermo Fisher Scientific | 5311-0250 | https://www.thermofisher.com/order/catalog/product/5311-0250 |
| Female BNC To Banana Plug Adapter | Pomona Electronics | 72909 | https://www.digikey.com/en/products/detail/pomona-electronics/72909/1196318 |
| Fetal Bovine Serum (FBS) | VWR | 89510-186 | https://us.vwr.com/store/product/18706419/avantor-seradigm-select-grade-usda-approved-origin-fetal-bovine-serum-fbs |
| Glass Cutter | Chemglass | CG-1179-21 | https://chemglass.com/plate-glass-cutters-diamond-tips |
| Gold Etchant TFA | Transene | NC0977944 | https://www.fishersci.com/shop/products/NC0977944/NC0977944 |
| Hot Plate | Thermo Fisher Scientific | SP131825 | |
| Isopropyl Alcohol | Spectrum Chemical | I1056-4LTPL | Purity (GC) ≥99.5% (https://www.spectrumchemical.com/isopropyl-alcohol-99-percent-fcc-i1056) |
| Metal Hardware Enclosure | Hammond Manufacturing | EJ12126 | https://www.digikey.com/en/products/detail/hammond-manufacturing/EJ12126/2423415 |
| Methanol | Sigma-Aldrich | 34860 | Purity (GC) ≥99.8% (https://www.sigmaaldrich.com/IN/en/substance/methanol320467561) |
| MF-321 Developer | Kayaku Advanced Materials | n/a | https://kayakuam.com/products/mf-321/ |
| MICROPOSIT S1813 Positive Photoresist | DuPont | n/a | https://kayakuam.com/products/microposit-s1800-g2-series-photoresists/ |
| Phosphate Buffered Saline (PBS) | Thermo Fisher Scientific | 10010049 | https://www.thermofisher.com/order/catalog/product/10010049?SID=srch-hj-10010049 |
| Photomask | Fineline Imaging | n/a | Photomask are custom ordered from our CAD designs (https://www.fineline-imaging.com/) |
| Plain Glass Microscope Slide | Fisher Scientific | 12-553-5B | Material: Soda Lime, L75 x W50 mm, Thickness: 0.90–1.10 mm |
| Plasma Cleaner | Harrick Plasma | PDC-001 | https://harrickplasma.com/plasma-cleaners/expanded-plasma-cleaner/ |
| Plastic Petri Dish | Thermo Fisher Scientific | FB0875712 | 100 mm (https://www.fishersci.com/shop/products/fisherbrand-petri-dishes-clear-lid-raised-ridge-100-x-15mm/FB0875712) |
| Pressure Controller | Fluigent | MFCS-EZ | https://www.fluigent.com/research/instruments/pressure-flow-controllers/mfcs-series/ |
| Pressure Controller Software | Fluigent | MAESFLO | |
| Programming & Computation Software | MATLAB | R2021b | for data acquisition and analysis (https://www.mathworks.com/products/matlab.html) |
| PTFE Tubing | Cole Parmer | 06417-31 | 0.032" ID x 0.056" (https://www.coleparmer.com/i/masterflex-transfer-tubing-microbore-ptfe-0-032-id-x-0-056-od-100-ft-roll/0641731) |
| Scepter 2.0 Handheld Automatic Cell Counter | Millapore Sigma | PHCC20060 | https://www.sigmaaldrich.com/IN/en/product/mm/phcc20060 |
| Silicon Wafer | Wafer World | 2885 | 76.2 mm, Single Side Polished (https://www.waferworld.com/product/2885) |
| Spin Coater | n/a | n/a | |
| SU-8 3025 Negative Photoresist | Kayaku Advanced Materials | n/a | https://kayakuam.com/products/su-8-2000/ |
| SU8 Developer | Kayaku Advanced Materials | n/a | https://kayakuam.com/products/su-8-developer/ |
| Sygard 184 Polydimethlysiloxane | Dow Chemical | 4019862 | https://www.ellsworth.com/products/by-market/consumer-products/encapsulants/silicone/dow-sylgard-184-silicone-encapsulant-clear-0.5-kg-kit/ |
| Tape | Scotch | 810-341296 | https://www.staples.com/Scotch-Magic-Tape-810-3-4-x-36-yds-1-Core/product_130567?cid=PS:GS:SBD:PLA:OS&gclid= Cj0KCQjwlK-WBhDjARIsAO 2sErRwzrrgjU0NjFkDkne1xm vT7ekS3tdzvAgiMDwPoxocgH VTQZi7vJgaAvQZEALw_wcB |
| Titanium, Platinum, Gold | n/a | n/a | |
| Triple Output Power Supply | Keysight | E36311A | https://www.newark.com/keysight-technologies/e36311a/dc-power-supply-3o-p-6v-5a-prog/dp/15AC9653 |
| UV Mask Aligner | Karl Suss America | MJB3 Mask Aligner |
Referanslar
- Pegoraro, A. F., Janmey, P., Weitz, D. A. Mechanical properties of the cytoskeleton and cells. Cold Spring Harbor Perspectives in Biology. 9 (11), 022038 (2017).
- Kim, J., et al. Characterizing cellular mechanical phenotypes with mechano-node-pore sensing. Microsystems & Nanoengineering. 4, 17091 (2018).
- Mierke, C. T. Bidirectional mechanical response between cells and their microenvironment. Frontiers in Physics. 9, 619 (2021).
- Kumar, S., Weaver, V. M. Mechanics, malignancy, and metastasis: The force journey of a tumor cell. Cancer and Metastasis Reviews. 28 (1), 113-127 (2009).
- Nia, H. T., Munn, L. L., Jain, R. K. Physical traits of cancer. Science. 370 (6516), (2020).
- Fletcher, D. A., Mullins, R. D. Cell mechanics and the cytoskeleton. Nature. 463 (7280), 485-492 (2010).
- Wirtz, D., Konstantopoulos, K., Searson, P. C. The physics of cancer: The role of physical interactions and mechanical forces in metastasis. Nature Reviews Cancer. 11 (7), 512-522 (2011).
- Li, B., et al. Mechanical phenotyping reveals unique biomechanical responses in retinoic acid-resistant acute promyelocytic leukemia. iScience. 25 (2), 103772 (2022).
- Kozminsky, M., Sohn, L. L. The promise of single-cell mechanophenotyping for clinical applications. Biomicrofluidics. 14 (3), 031301 (2020).
- Li, M., Dang, D., Liu, L., Xi, N., Wang, Y. Atomic force microscopy in characterizing cell mechanics for biomedical applications: A review. IEEE Transactions on Nanobioscience. 16 (6), 523-540 (2017).
- Wottawah, F., et al. Optical rheology of biological cells. Physical Review Letters. 94 (9), 1-4 (2005).
- Darling, E. M., Di Carlo, D. High-throughput assessment of cellular mechanical properties. Annual Review of Biomedical Engineering. 17 (1), 35-62 (2015).
- Carey, T. R., Cotner, K. L., Li, B., Sohn, L. L. Developments in label-free microfluidic methods for single-cell analysis and sorting. Wiley Interdisciplinary Reviews: Nanomedicine and Nanobiotechnology. 11 (1), 1529 (2019).
- Bagnall, J. S., et al. Deformability of tumor cells versus blood cells. Scientific Reports. 5, 18542 (2015).
- Byun, S., et al. Characterizing deformability and surface friction of cancer cells. Proceedings of the National Academy of Sciences. 110 (19), 7580-7585 (2013).
- Otto, O., et al. Real-time deformability cytometry: On-the-fly cell mechanical phenotyping. Nature Methods. 12 (3), 199-202 (2015).
- Gossett, D. R., et al. Hydrodynamic stretching of single cells for large population mechanical phenotyping. Proceedings of the National Academy of Sciences. 109 (20), 7630-7635 (2012).
- Guck, J., Chilvers, E. R. Mechanics meets medicine. Science Translational Medicine. 5 (212), 3-6 (2013).
- Balakrishnan, K. R., et al. Node-pore sensing: A robust, high-dynamic range method for detecting biological species. Lab on a Chip. 13 (7), 1302-1307 (2013).
- Carbonaro, A., Sohn, L. L. A resistive-pulse sensor chip for multianalyte immunoassays. Lab on a Chip. 5 (10), 1155-1160 (2005).
- Saleh, O. A., Sohn, L. L. Direct detection of antibody-antigen binding using an on-chip artificial pore. Proceedings of the National Academy of Sciences. 100 (3), 820-824 (2003).
- Saleh, O. A., Sohn, L. L. An artificial nanopore for molecular sensing. Nano Letters. 3 (1), 37-38 (2003).
- Saleh, O. A., Sohn, L. L. Quantitative sensing of nanoscale colloids using a microchip Coulter counter. Review of Scientific Instruments. 72 (12), 4449-4451 (2001).
- DeBlois, R. W., Bean, C. P. Counting and sizing of submicron particles by the resistive pulse technique. Review of Scientific Instruments. 41 (7), 909-916 (1970).
- Li, B., et al. Evaluating sources of technical variability in the mechano-node-pore sensing pipeline and their effect on the reproducibility of single-cell mechanical phenotyping. PLoS ONE. 16 (10), 0258982 (2021).
- Zhang, Z. M., Chen, S., Liang, Y. Z. Baseline correction using adaptive iteratively reweighted penalized least squares. Analyst. 135 (5), 1138-1146 (2010).
- Alibert, C., Goud, B., Manneville, J. B. Are cancer cells really softer than normal cells. Biology of the Cell. 109 (5), 167-189 (2017).
- Fujiwara, I., Zweifel, M. E., Courtemanche, N., Pollard, T. D. Latrunculin A accelerates actin filament depolymerization in addition to sequestering actin monomers. Current Biology. 28 (19), 3183-3192 (2018).
- Saleh, O. A. . A novel resistive pulse sensor for biological measurements. , (2003).
- Dokukin, M. E., Guz, N. V., Sokolov, I. Quantitative study of the elastic modulus of loosely attached cells in AFM indentation experiments. Biophysical Journal. 104 (10), 2123-2131 (2013).
- Li, Q., Lim, C. T., Goh, J. C. H., et al. Probing the elasticity of breast cancer cells using AFM. 13th International Conference on Biomedical Engineering. IFMBE Proceedings. 23, 2122-2125 (2009).
- Rother, J., et al. Atomic force microscopy-based microrheology reveals significant differences in the viscoelastic response between malign and benign cell lines. Open Biology. 4 (5), 140046 (2014).
- Li, Q., et al. AFM indentation study of breast cancer cells. Biochemical and Biophysical Research Communications. 374 (4), 609-613 (2008).
- Xu, C., et al. Elasticity measurement of breast cancer cells by atomic force microscopy. Proc. SPIE 9230. Twelfth International Conference on Photonics and Imaging in Biology and Medicine. (PIBM 2014). 92300, (2014).
- Alcaraz, J., et al. Microrheology of human lung epithelial cells measured by atomic force microscopy. Biophysical Journal. 84 (3), 2071-2079 (2003).
- Li, M., Dang, D., Liu, L., Xi, N., Wang, Y. Atomic force microscopy in characterizing cell mechanics for biomedical applications: A review. IEEE Transactions on Nanobioscience. 16 (6), 523-540 (2017).
- Urbanska, M., et al. A comparison of microfluidic methods for high-throughput cell deformability measurements. Nature Methods. 17, 587-593 (2020).
- Hill, R. T., Chilkoti, A. Surface Patterning. Biomaterials Science: An Introduction to Materials: Third Edition. , 276-301 (2013).
- Wang, Z., Volinsky, A. A., Gallant, N. D. Crosslinking effect on polydimethylsiloxane elastic modulus measured by custom-built compression instrument. Journal of Applied Polymer Science. 131 (22), 41050 (2014).
- Gibson, L. J. The hierarchical structure and mechanics of plant materials. Journal of the Royal Society Interface. 9 (76), 2749-2766 (2012).
- Stephens, A. D., Banigan, E. J., Adam, S. A., Goldman, R. D., Marko, J. F. Chromatin and lamin a determine two different mechanical response regimes of the cell nucleus. Molecular Biology of the Cell. 28 (14), 1984-1996 (2017).
- Rosenbluth, M. J., Lam, W. A., Fletcher, D. A. Force microscopy of nonadherent cells: A comparison of leukemia cell deformability. Biophysical Journal. 90 (8), 2994-3003 (2006).
- Evers, T. M. J., Holt, L. J., Alberti, S., Mashaghi, A. Reciprocal regulation of cellular mechanics and metabolism. Nature Metabolism. 3 (4), 456-468 (2021).
- Balakrishnan, K. R., et al. Node-pore sensing enables label-free surface-marker profiling of single cells. Analytical Chemistry. 87 (5), 2988-2995 (2015).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır