Method Article
توليد فعال ومتسق لظهارة صبغية شبكية العين / المشيمية من العين البشرية للتحليل النسيجي
In This Article
Summary
نحن نصف طريقة لفصل ظهارة الشبكية الصبغية (RPE) بكفاءة عن شبكية العين في عيون الإنسان وتوليد حوامل مسطحة RPE / المشيمية كاملة للتحليلات النسيجية والمورفومترية ل RPE.
Abstract
ظهارة الشبكية الصبغية (RPE) والشبكية هي أنسجة متصلة وظيفيا وهيكليا تعمل معا لتنظيم إدراك الضوء والرؤية. ترتبط البروتينات الموجودة على السطح القمي RPE ارتباطا وثيقا بالبروتينات الموجودة على سطح الجزء الخارجي للمستقبلات الضوئية ، مما يجعل من الصعب فصل RPE باستمرار عن المستقبلات الضوئية / شبكية العين. لقد طورنا طريقة لفصل شبكية العين بكفاءة عن RPE للعيون البشرية لتوليد RPE / المشيمية والشبكية الكاملة للتحليل الخلوي المنفصل للمستقبلات الضوئية وخلايا RPE. أدى الحقن داخل الجسم الزجاجي لمحلول عالي الأسمولية من D-mannitol ، وهو سكر لا ينقله RPE ، إلى فصل RPE والشبكية عبر الغرفة الخلفية بأكملها دون التسبب في تلف تقاطعات خلايا RPE. لم يلاحظ وجود بقع RPE متصلة بالشبكية. أظهر وضع علامات Phalloidin على الأكتين الحفاظ على شكل RPE وسمح بالتحليل المورفومتري للظهارة بأكملها. تم تطوير برنامج قائم على الذكاء الاصطناعي (الذكاء الاصطناعي) للتعرف بدقة على حدود خلية RPE وتقسيمها وتحديد 30 مقياسا مختلفا للشكل. طريقة التشريح هذه قابلة للتكرار بشكل كبير ويمكن تمديدها بسهولة إلى نماذج حيوانية أخرى.
Introduction
ترتبط ظهارة الشبكية الصبغية (RPE) والشبكية العصبية ارتباطا وثيقا ببعضهما البعض بسبب الاعتماد الفسيولوجي القوي للمستقبلات الضوئية على RPE. أثناء التشريح ، يتسبب الفصل الميكانيكي للشبكية العصبية عن RPE في تمزق خلايا RPE ، مع بقاء الأجزاء القمية من RPE متصلة بالأجزاء الخارجية للمستقبلات الضوئية للشبكية. مدى التصاق الشبكية RPE كبير جدا لدرجة أن كمية الصباغ المتبقية على الشبكية بعد الانفصال تستخدم لتحديد قوة التصاق الشبكية1. على وجه التحديد ، تنقطع التقاطعات الضيقة RPE وهيكل الأكتين الذي يربطها ، والتي تقع على الجانب القمي ، أثناء الفصل الميكانيكي. لذلك ، يؤدي تلطيخ RPE Flatmounts لحدود الخلية إلى طبقة أحادية غير مكتملة يكون فيها للعديد من الخلايا حدود مفقودة. يتفاقم هذا التأثير عندما يتم تثبيت الأنسجة مع بارافورمالدهيد (PFA) قبل التشريح ، حيث تصبح البروتينات متشابكة.
أظهرت الدراسات التي أجريت على توصيل الدواء داخل الجسم الزجاجي أن حقن المحاليل المفرطة التناضح في الغرفة الخلفية تحفز انفصال الشبكية 2,3. في هذه التجارب ، تسبب حقن 50 ميكرولتر من المحاليل المختلفة ، التي تتراوح من 1000 mOsm إلى 2400 mOsm ، في منتصف الجسم الزجاجي في انفصال الشبكية في غضون دقائق. والجدير بالذكر أنه حتى بعد التعرض الطويل لمحاليل الأسمولية العالية ، ظهرت التقاطعات الضيقة RPE سليمة في الصور المجهرية الإلكترونية المرسلة لكل من عيون الأرانب والقرود3. باتباع استراتيجية مماثلة ، حقننا في منتصف الجسم الزجاجي محلول فرط التناضح من D-mannitol للحث على انفصال الشبكية الفعال قبل إجراء تشريح RPE. نظرا لأن D-mannitol لا يتم نقله بواسطة RPE4 ، يتم الحفاظ على تركيز عال داخل الجسم الزجاجي ، مما يولد تدرجا تناضحيا. يضمن الفصل الفعال ل RPE والشبكية عبر الغرفة الخلفية بأكملها الحفاظ على الوصلات الخلوية RPE ويسمح بدراسة مورفومترية RPE على الحامل المسطح بأكمله. بالإضافة إلى ذلك ، قمنا بتطوير برنامج قائم على الذكاء الاصطناعي (الذكاء الاصطناعي) يتعرف على حدود خلايا RPE المسماة بالفلورسنت ويقسمها ، ويحدد 30 مقياسا مختلفا للشكل ، وينتج خرائط حرارية لكل مقياس للتصور 5,6.
Protocol
تم الحصول على الكرات البشرية للجثث من شبكة الرؤية المتقدمة (برمنغهام ، ألاباما). يعفى العمل المنجز على أنسجة الجثث من قبل مجلس المراجعة المؤسسية للمعاهد الوطنية للصحة من لجنة أخلاقيات البحث.
1. شحنة العين الكرة الأرضية
- بعد الاستئصال ، اشحن كرات العين الطازجة في حاوية مملوءة بالثلج المثلج DPBS 1x مع Ca 2+ و Mg2+.
ملاحظة: من الأفضل تشريح العين في غضون 24 ساعة بعد الاستئصال. لا يتم تغيير مورفولوجيا RPE خلال هذه النافذة الزمنية.
2. إعداد قالب السيليكون
- قطع الجزء السفلي 20 مم من أنبوب دائري القاع بقطر 25 مم. ضعه في قاعدة قارب وزن مربع (81 مم × 81 مم × 25 مم).
- امزج مكونين من مجموعة المطاط الصناعي السيليكوني بنسبة 10: 1 ، مع الانتباه إلى عدم حبس الهواء. صب المزيج في وعاء الوزن الذي يحتوي على القطعة الكروية للأنبوب المستدير القاع.
- علاج السيليكون في درجة حرارة الغرفة بين عشية وضحاها. قم بإزالة قارب الوزن والأنبوب المستدير القاع من قالب السيليكون المعالج.
3. تشريح RPE
- تنظيف الصلبة من كرة العين الطازجة من العضلات والأنسجة الضامة. ثبت العين على قالب السيليكون باستخدام إبر 27 جم ملولبة عبر الصلبة. املأ تجويف القالب ب DPBS 1x مع Ca 2+ و Mg2+.
ملاحظة: انتبه لعدم اختراق حجرة العين. يجب أن تمر الإبر فقط عبر الصلبة. - استخدم حقنة سعة 1 مل وإبرة 21 جم لحقن ~ 400 ميكرولتر من محلول D-mannitol 1700 mOsm في الجسم الزجاجي. أدخل الإبرة من خلال pars plana لتجنب ثقب الغرفة الأمامية للعين. اترك العين في درجة حرارة الغرفة لمدة ~ 45 دقيقة.
- قطع فتح الغرفة الأمامية على مستوى pars plana باستخدام زوج من المقص الدقيق والملقط. املأ حجرة العين الخلفية ب DPBS 1x ب Ca 2+ و Mg2+. تحت المجهر المجسم ، قم بتوطين البقعة (البقعة الصفراء على شبكية العين).
- في حالة توفر قاطع زجاجي جراحي ، قم بإزالة الجسم الزجاجي واستبدله ب DPBS 1x ب Ca 2+ و Mg2+. بدلا من ذلك ، حاول رفع الجسم الزجاجي بالملقط وقصه بمقص ناعم.
- مع الانتباه إلى الحفاظ على المنطقة البقعية ، قم بقص العين إلى أرباع: الأنف ، الزماني ، العلوي ، والأدنى. قم بإزالة الإبر إذا كانت في الطريق.
- انقل الحجرة الخلفية للعين إلى طبق بتري 100 مم يحتوي على DPBS 1x مع Ca 2+ و Mg2+. قبل إزالة الشبكية ، ضع علامة على البتلة التي تحتوي على البقعة عن طريق عمل قطع صغير (على شكل حرف V) في الهامش الهدبي. رفع وقطع كل الجسم الزجاجي الذي يضع على شبكية العين.
- ارفع الشبكية برفق من جوانب متعددة باستخدام ملعقة منحنية أو زوج من الملقط للتحقق مما إذا كانت الشبكية قد انفصلت عن RPE وللسماح لبعض السوائل بالدوران بين الطبقتين.
ملاحظة: ستظل شبكية العين متصلة في المحيط (الحواف الهدبية) وفي العصب البصري. - قطع شبكية العين من الهوامش الهدبية في جميع بتلات ، وضمان عدم خدش RPE. ضع الأنسجة في 4٪ PFA واحتضانها لمدة ~ 1 ساعة. اغسل 3x مع DPBS 1x مع Ca 2+ و Mg2+. انقل المنديل إلى وعاء مملوء ب DPBS 1x مع Ca 2+ و Mg2+ وقم بتخزينه في 4 درجات مئوية.
ملاحظة: في هذه المرحلة ، يتم توصيل الشبكية فقط بالعصب البصري. هذه نقطة توقف في هذه التجربة. - انقل العينة إلى طبق بتري 100 مم يحتوي على DPBS 1x مع Ca 2+ و Mg2+. لكمة رأس العصب البصري مع لكمة خزعة 1.5 ملم وجمع شبكية العين. قم بتخزين شبكية العين العصبية في DPBS 1x مع Ca 2+ و Mg2+ عند 4 درجات مئوية.
ملاحظة: قبل لكمة رأس العصب البصري ، تأكد من قطع العصب البصري قدر الإمكان على جانب الصلبة. سيؤدي ذلك إلى زيادة دقة اللكمة. إن تثقيب العصب البصري بعد تثبيت التثبيت المسطح في 4٪ PFA يقلل من تلف خلايا RPE الموجودة حول العصب البصري. - قم بإزالة الصلبة من RPE / المشيمية عن طريق رفع طبقة RPE / المشيمية برفق من المحيط وقطع الأوعية المشيمية والأنسجة الضامة الموجودة بين الصلبة و RPE باستخدام مقص زنبركي Vannas. بمجرد فصل RPE / المشيمية تماما عن الصلبة ، قم بتجميع طبقة RPE / المشيمية. انقل المنديل إلى وعاء مملوء ب DPBS 1x مع Ca 2+ و Mg2+ وقم بتخزينه في 4 درجات مئوية.
ملاحظة: في هذا الوقت، يمكن إيقاف التجربة مؤقتا.
4. تلطيخ
- انقل RPE / المشيمية إلى بئر واحد من لوحة 6 آبار. قم بحظر العينة واختراقها في DPBS 1x باستخدام Ca 2+ و Mg 2+ مع 1٪ ألبومين مصل بقري (BSA) و 0.5٪ توين20 و 0.5٪ Triton X-100 لمدة 1 ساعة في درجة حرارة الغرفة.
- احتضان العينة مع phalloidin مترافق مع 647 فلوروفور عند تخفيف 1: 250 في DPBS 1x مع Ca 2+ و Mg 2+ مع 1٪ BSA و 0.5٪ توين20 و 0.5٪ Triton X-100 لمدة 1 ساعة في درجة حرارة الغرفة. اغسل 3x في DPBS 1x مع Ca 2+ و Mg2+.
- انقل عينة RPE / المشيمية إلى شريحة زجاجية مقاس 50 مم × 75 مم وقم بتسطيحها. قطع كل "بتلة" إلى قسمين لجعل العينة أكثر تملقا. إيلاء الاهتمام للبقعة. ارسم محيطا من الحامل المسطح بقلم كاره للماء.
- لإخماد التألق الذاتي للليبوفوسين ، أضف 500 ميكرولتر من محلول إخماد التألق الذاتي المخفف إلى 1:20 في 70٪ إيثانول واحتضانه في درجة حرارة الغرفة لمدة دقيقتين.
- اغسل جيدا (3x على الأقل) في DPBS 1x مع Ca 2+ و Mg2+. قم بإزالة DPBS وأضف وسيط التركيب. ضع غطاء زجاجي على الحامل المسطح وأغلقه بطلاء الأظافر.
- قم بتصوير الحامل المسطح باستخدام مجهر مضان (يفضل استخدام هدف 10x أو 20x).
5. تحليل REShAPE
ملاحظة: نظرا لأن الخوارزمية المستندة إلى REShAPE المستندة إلى الذكاء الاصطناعي تم تدريبها على صور 10x و 20x ، فمن المستحسن بشدة استخدام هدف 10x أو 20x عند التصوير. إذا لم يكن الأمر كذلك ، فستحتاج الصور إلى إعادة قياسها وفقا لذلك.
- إذا تم الحصول على الصور بأكثر من قناة فلورية واحدة ، فقم بعزل القناة المستخدمة للحصول على حدود الخلية. قم بتصدير الصور كملفات TIF بتدرج الرمادي 16 بت.
ملاحظة: لا يلزم تصدير الصور التي تم الحصول عليها بملحق الملف .czi كملفات TIF ولكن لا تزال القناة التي تحتوي على حدود الخلية بحاجة إلى عزلها. - قم بتثبيت البرنامج على أنظمة Windows x64 أو Linux (Centos 7).
ملاحظة: يمكن العثور على البرنامج والتعليمات الخاصة بالتثبيت في https://github.com/nih-nei/REShAPE. - افتح البرنامج (الشكل 1).
- في علامة التبويب الدلائل ، حدد مجلدات الإدخال والإخراج. في دليل الإدخال، حدد المجلد الذي يحتوي على الصور. في دليل الإخراج ، دع البرنامج يغير المسار تلقائيا إلى "دليل الإدخال / المعالجة". بدلا من ذلك ، قم بتغيير دليل الإخراج يدويا.
ملاحظة: سيقوم البرنامج بالتكرار من خلال جميع الصور الموجودة في مجلد الإدخال. - في علامة التبويب خيارات تجزئة NN ، اختر الإعدادات التالية لتجزئة الصورة:
- حجم الدفعة: اكتب قيمة 20 في مربع النص كنقطة بداية جيدة ، ولكن قم بخفضها إذا نفد النظام من وحدات معالجة الرسومات (GPUs).
ملاحظة: يتم تقسيم الصورة الأصلية إلى مربعات أصغر للمعالجة. يحدد حجم الدفعة عدد المربعات التي يمكن معالجتها مرة واحدة. - استخدام GPU؟: إذا لم يكن لدى النظام موارد GPU كافية ، فحدد المربع لا.
- مقياس داخلي: باستخدام القائمة المنسدلة ، قم بتغيير القياس الداخلي من لا شيء في الحالات التي لم يتم فيها الحصول على الصور بهدف 10x أو 20x. على سبيل المثال ، قم بتصغير حجم الصور 40x إلى نصف الحجم باستخدام زر 1/2 . خيارات إعادة القياس المتاحة في القائمة المنسدلة هي كما يلي: 5x ، 2x ، لا شيء ، 1/2 ، 1/5.
ملاحظة: تم تدريب التعلم الآلي على صور 10x و 20x. قد لا يتعرف على حدود الخلية من الصور الملتقطة بتكبيرات أخرى. في هذه الحالة ، ستظهر الصور الثنائية سوداء تماما. - مرشح Arti: استخدم علامة تبويب مرشح القطع الأثرية لإزالة الجسيمات شديدة السطوع (الحطام أو أجزاء صغيرة من شبكية العين أو النسيج الضام حول العصب البصري) التي قد تكون موجودة في الصورة وقد تتداخل مع تجزئة حدود الخلية. لا يتم استخدام أي مرشح بشكل افتراضي. خيارات التصفية الاصطناعية في القائمة المنسدلة هي كما يلي: منتظم وقوي وضعيف.
- حجم الدفعة: اكتب قيمة 20 في مربع النص كنقطة بداية جيدة ، ولكن قم بخفضها إذا نفد النظام من وحدات معالجة الرسومات (GPUs).
- في صفحة خيار الصورة المتجانبة ، قم بإدراج قيمة في مربع النص لتحديد مقدار التداخل بين بلاطة الصورة عن طريق ضبط معلمة بلاط اللوحة حسب . عادة ما يعمل تداخل 100 بكسل بشكل جيد.
- في علامة التبويب خيارات رسم الإخراج ، قم بضبط إعدادات إنشاء خريطة الحرارة:
- إعادة بناء الصور المتجانبة؟: إذا لم يكن لدى النظام موارد كافية لتحليل الصور الكبيرة ، فحدد المربع لا للسماح للبرنامج بإكمال التحليل عن طريق حفظ المربعات الفردية دون إعادة بناء الصورة بأكملها.
- إنشاء صور ملونة: لإنشاء خرائط حرارية ، حدد الكل من القائمة المنسدلة.
- بالنسبة للتلوين ، اختر أيا من لوحات الألوان المختلفة المتوفرة في القائمة المنسدلة: حراري ، أخضر ، Mpl-magma ، طور ، حريق ، جيت ، سماوي ساخن.
- بالنسبة إلى تنسيق الصورة، احفظ الصور بتنسيق TIF أو PNG عن طريق تحديد أحد الخيارات في علامة التبويب.
- فيما يتعلق باستخدام الحدود اليدوية؟ ، حدد المربع لا للسماح للبرنامج باستخدام الحد الأدنى والحد الأقصى للقيم المكتشفة في كل صورة. حدد المربع نعم لضبط نطاق القيم يدويا لكل خريطة حرارية مترية للشكل ، وانقر فوق الزر "تعيين حدود " لاختيار نطاقات للمعلمات الفردية عن طريق إدراج قيم في مربعات النص. بعد تغيير قيم الاهتمام ، انقر فوق حفظ. انقر فوق تحميل الإعدادات الافتراضية لإعادة تعيين جميع الحدود.
ملاحظة: استخدم الحدود اليدوية إذا كانت هناك حاجة إلى مقارنة خرائط الحرارة من صور متعددة ، مثل عند مقارنة تأثيرات المركبات المختلفة على شكل الخلية. بهذه الطريقة ، يتم استخدام نفس نطاق القيم. تختلف مجموعة القيم التي سيتم إدخالها يدويا حسب نوع العينة. يوصى بتشغيل بعض التكرارات لاختيار النطاق الأمثل.
- في علامة التبويب قيود حجم الخلية للتحليل، حدد عتبة حجم الخلية للتحليل:
- في حجم الخلية السفلي، أدرج في مربع النص حجم أصغر خلية ليتم تضمينها في التحليل.
- في حجم الخلية العلوي، أدرج في مربع النص حجم أكبر خلية ليتم تضمينها في التحليل.
ملاحظة: تتغير وحدة حجم الخلية من وحدات البكسل إلى الميكرومترات المربعة وفقا للخيار الذي تم اختياره في علامة التبويب تحويل تلقائي للوحدات .
- في علامة التبويب التحويل الآلي للوحدات ، اختر الوحدة المفضلة للتحليل:
- في تحويل وحدات البكسل إلى وحدات حقيقية؟، حدد المربع لا لتشغيل التحليل بوحدات البكسل. حدد مربع نعم لتشغيل التحليل بالميكرومتر.
- في شريط طول القياس (بيكسل)، أدخل قيمة البيكسل في مربع النص.
- في شريط طول المقياس (ميكرون) ، أدخل في مربع النص المسافة المقابلة بالميكرومتر.
- لبدء التحليل ، اضغط على Go For It.
ملاحظة: يمكن للبرنامج أيضا قياس صلاحية الخلية عندما تكون الخلايا ملطخة ب 4',6-diamidino-2-phenylindole (DAPI) ويوديد البروبيديوم (علامة تبويب خيارات CZI ) ، ولكن هذا لا ينطبق على RPE flatmounts.
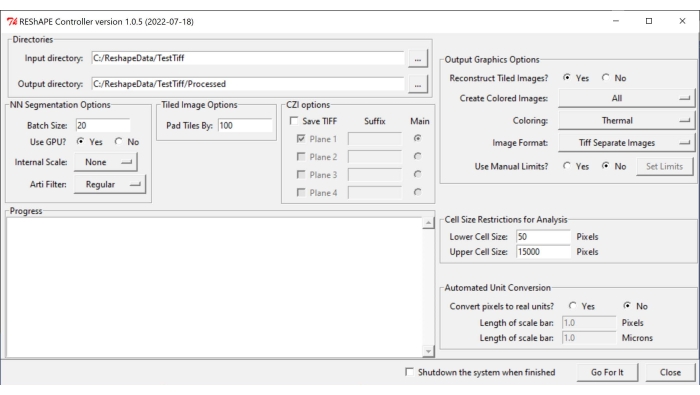
الشكل 1: واجهة المستخدم الرسومية REShAPE. تحتوي واجهة المستخدم الرسومية على علامات تبويب مختلفة لتحديد أدلة العمل (علامة تبويب الدلائل ) ، وتعديل خيارات التجزئة (خيارات تجزئة NN وعلامات تبويب خيارات الصورة المتجانبة ) ، وتحديد معلمات التحليل (قيود حجم الخلية للتحليل وعلامات تبويب تحويل الوحدة الآلي ) ، ولإنشاء خريطة حرارية (علامة التبويب خيارات رسومات الإخراج ). اختصار: واجهة المستخدم الرسومية = واجهة المستخدم الرسومية. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
النتائج
ينتج عن هذا البروتوكول صورة أحادية المستوى لحامل مسطح ، حيث يتم قياس موقع الخلية ومقاييس الشكل 30 لكل خلية RPE محددة بشكل صحيح (الشكل 2). يتم إنشاء مجلد باسم "تمت المعالجة" تلقائيا داخل دليل الإدخال. يحتوي هذا المجلد على أربعة أدلة فرعية، تسمى "تحليل" و"ترميز ملون" و"ملفات مجمعة" و"صور مجزأة" وبعض الملفات المؤقتة التي تم إنشاؤها أثناء التحليل. يحتوي مجلد "الملفات المدمجة" على جدول بيانات يحتوي على جميع قياسات الأشكال وجدول بيانات بترددات عدد الخلايا المجاورة لجميع الملفات مجتمعة. يحتوي مجلد "التحليل" على جدول بيانات يحتوي على جميع قياسات الشكل وجدول بيانات بترددات أعداد الخلايا المجاورة لكل صورة على حدة. يحتوي دليل "الصور المجزأة" على الأقنعة الثنائية النهائية لحدود خلية RPE ؛ يمكن استخدامه لتقييم جودة التجزئة. يحتوي دليل "Color Coded" على خرائط حرارية لكل قياس شكل لتصور أنماط الأشكال في كل صورة. يمكن العثور على تعريفات واختصارات مقياس الشكل في الجدول 1.
في بعض الأحيان ، يمكن أن تحتوي حوامل RPE المسطحة على قطع متبقية من شبكية العين لم تتم إزالتها بشكل نظيف ، خاصة حول العصب البصري. ينتج عن تلطيخ القضيب في العينة إشارة قوية قادمة من شبكية العين ، وهذا يمكن أن يسبب مشاكل لتجزئة حدود خلية RPE. ستظهر بعض المربعات سوداء تماما ، بينما ستظهر البلاط المحيط تجزؤا طبيعيا. الكائنات الساطعة الأخرى التي قد تكون موجودة في الصورة ستتسبب أيضا في توليد بلاط أسود (الشكل 3). في هذه الحالات ، سيؤدي اختيار أحد خيارات التصفية (ضعيف ، عادي ، قوي) المتاح في القائمة المنسدلة Arti Filter إلى منع تكوين البلاط الأسود.
يأخذ REShAPE صورا بتدرج الرمادي 8 بت أو 16 بت كمدخلات ولكن ليس صور RGB. سيؤدي استخدام صور RGB لتحليل REShAPE إلى إنتاج صور ثنائية سوداء بالكامل. في حالة حدوث ذلك ، سيؤدي تحويل صور RGB إلى تدرج رمادي إلى إنتاج صور ثنائية مجزأة بشكل صحيح (الشكل 4). في بعض الحالات التي لا يتم فيها التعرف على حدود RPE بشكل صحيح ، على سبيل المثال ، إذا لم يكن التلوين مثاليا أو إذا تعرضت العينة للتلف بسبب خدش (الشكل 5 أ) ، يمكن تحديد كتل كبيرة من الخلايا كخلية واحدة كبيرة جدا (الشكل 5 ب). في هذه الحالة ، يمكن استبعاد الكائنات الكبيرة من التحليل عن طريق تقليل عتبة حجم الخلية (الشكل 5C). يمكن تحقيق ذلك عن طريق إدراج قيمة أقل في مربع النص حجم الخلية العلوي . ومع ذلك ، سيؤدي ذلك إلى تغيير في نطاق خريطة الحرارة. إذا اختار الباحث القيام بذلك ، فمن الممكن أيضا الحفاظ على نطاق خريطة الحرارة الأصلي (الشكل 5D) عن طريق تحديد المربع نعم في ميزة استخدام الحدود اليدوية؟. بعد ذلك ، يجب على الباحث النقر بزر الماوس الأيسر على زر تعيين الحدود وإدراج القيم المطلوبة في مربعات النص لتحديد الحدود اليدوية.
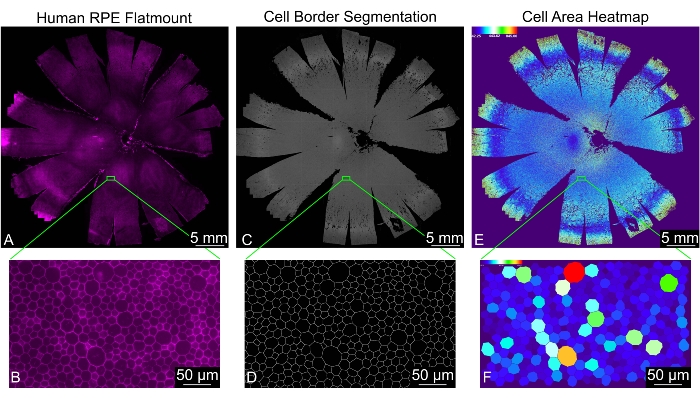
الشكل 2: تحليل مورفومتري كامل لطبقة RPE أحادية الإنسان بالكامل. (أ) عرض تكبير منخفض لحامل مسطح RPE / مشيمي بشري كامل (أرجواني: phalloidin). (ب) منظر مكبر لخلايا RPE الملطخة بالقضيب. (ج) تجزئة حدود خلية RPE الناتجة عن REShAPE لحامل مسطح RPE / مشيمي بشري كامل و (د) العرض المكبر المقابل. (ه) خريطة حرارية تم إنشاؤها بواسطة برنامج توضح مساحة الخلية لخلايا RPE الفردية في الحامل البشري المسطح بأكمله. يوضح المقياس الحراري في الزاوية العلوية اليسرى نطاق القيم المستخدمة. (F) طريقة العرض المكبرة المقابلة التي تعرض خلايا RPE الفردية الملونة حسب المنطقة. قضبان المقياس = (B ، D ، F) 50 ميكرومتر ، (A ، C ، E) 5 مم. اختصار: RPE = ظهارة الصباغ الشبكية. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
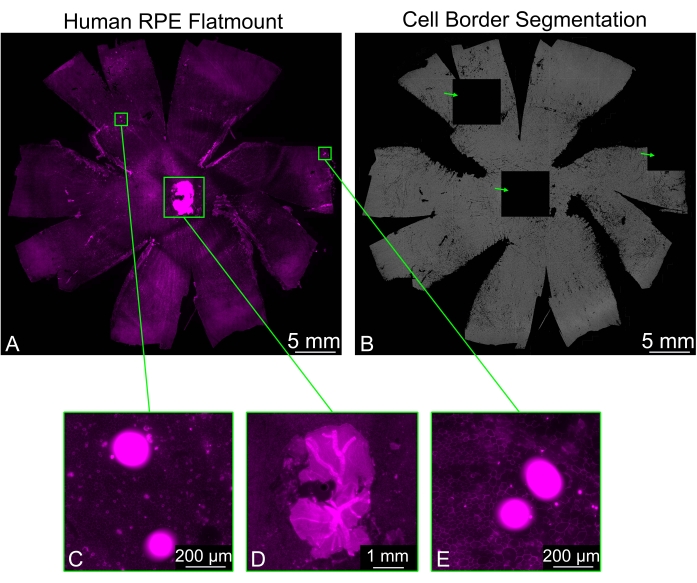
الشكل 3: تصفية القطع الأثرية الساطعة. (أ) يمكن أن يقدم حامل RPE البشري المسطح الملطخ لحدود الخلية (أرجواني: phalloidin) مناطق ساطعة (مستطيلات خضراء) تتداخل مع التجزئة. (ب) يحتوي تجزئة حدود خلية RPE للحامل المسطح بأكمله على ثلاثة بلاطات سوداء تماما (أسهم خضراء) تتوافق مع مناطق ساطعة من التألق. (ج، هاء) يتوافق اثنان من البلاط الأسود مع المناطق التي تحتوي على نقاط ساطعة ، والتي ربما تكون بعض الحطام. (د) نشأ أحد البلاطات السوداء بواسطة قطعة من الشبكية العصبية حول العصب البصري لم تتم إزالتها بشكل صحيح. قطع شبكية العين العصبية أكثر إشراقا بكثير من طبقة RPE وتعيق تجزئة الخلايا. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.

الشكل 4: صورة الإدخال المطلوبة. تم حفظ خلايا RPE الملطخة لحدود الخلايا ك (A) RGB أو (B) صور 16 بت بتدرج الرمادي لتحليل REShAPE. (ج) ناتج تحليل صورة RBG هو صورة ثنائية سوداء ، (د) بينما ينتج عن تحليل الصورة ذات التدرج الرمادي صورة ثنائية مجزأة بشكل صحيح لحدود الخلية. يمكن ل REShAPE تحليل الصور ذات التدرج الرمادي 8 بت أو 16 بت فقط. قضبان المقياس = 50 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.

الشكل 5: نتائج دون المستوى الأمثل . (أ) صورة لجزء من الطبقة الأحادية RPE حيث تم خدش الخلايا الملطخة بالفالويدين عن طريق الخطأ. ب: خريطة حرارية لخلايا RPE ملونة ببعد مساحة الخلية. تتضمن عتبة حجم الخلية العلوية الكبيرة كائنات كبيرة في التحليل. (ج) خريطة حرارية لمنطقة الخلية تم فيها اختيار عتبة أصغر لحجم الخلية العلوي لاستبعاد الأجسام الكبيرة من التحليل. (د) خريطة حرارية لمنطقة الخلية تم فيها اختيار عتبة أصغر لحجم الخلية العلوي وتم تعيين حدود يدوية للحفاظ على نطاق خريطة الحرارة المستخدم في الأصل. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
الجدول 1: بارامترات REShAPE. يبين الجدول تعريف كل معلمة والاختصارات المستخدمة في جداول البيانات الأولية (ملفات "_Data.csv") ولخرائط الحرارة. الرجاء الضغط هنا لتحميل هذا الجدول.
Discussion
يمكن تحقيق الفصل المتسق والفعال بين RPE البشري وشبكية العين باستخدام هذا البروتوكول. تسمح هذه الطريقة بدراسة الاختلافات الإقليمية في شكل RPE عبر شبكية العين البشرية بأكملها5. خطوة حاسمة في البروتوكول هي الفصل المادي ل RPE وشبكية العين. إذا لم يتم فصل النسيجين تماما في بعض المناطق ، فيجب على المرء رفع شبكية العين برفق ، مما يضمن عدم كسر الأنسجة. قد يتطلب تحليل REShAPE للحوامل المسطحة الكبيرة استخدام أنظمة ذات موارد ذاكرة وصول عشوائي كبيرة. في هذه الحالة ، يمكن تعطيل إعادة تجميع الصورة بأكملها للسماح للبرنامج بإنهاء التحليل بنجاح على الرغم من نقص موارد المعالجة.
يتمثل القيد الرئيسي لاستخدام REShAPE لتقسيم حوامل RPE البشرية في أن خوارزمية الذكاء الاصطناعي تم تدريبها في الغالب على صور RPE المستحثة المشتقة من الخلايا الجذعية متعددة القدرات. نتيجة لذلك ، فإن تجزئة حوامل RPE البشرية أقل دقة. تحتوي خلايا RPE من المتبرعين المسنين على كمية كبيرة من lipofuscin7 ، ويتداخل الطيف الواسع من التألق الذاتي مع تجزئة حدود الخلية. في المستقبل ، سيتم استخدام المزيد من صور RPE flatmounts لتحسين تجزئة حدود الخلية في هذا النوع من العينات. على الرغم من هذا القيد، تم تدريب REShAPE خصيصا للتعرف على حدود خلايا RPE وتقسيمها وأداء أفضل من الطرق الأخرى الموجودة، مثل تجزئة خلايا RPE من Voronoi8 و CellProfiler9 .
علاوة على ذلك ، مقارنة بالتجزئة اليدوية 10 ، يوفر REShAPE ميزة تحليل الصور الكبيرة بسرعة (تم اختبار ~ 130,000 بكسل ×130,000 بكسل). في الختام ، طريقة التشريح هذه قابلة للتكرار بشكل كبير ويمكن تمديدها بسهولة إلى نماذج حيوانية أخرى. بالإضافة إلى ذلك ، يمكن استخدام البرنامج لدراسة شكل RPE في حوامل العين المسطحة أو في نماذج زراعة الخلايا لفحص تأثير بعض العلاجات. أخيرا ، تعدد استخدامات REShAPE يجعلها قابلة للتطبيق على نطاق واسع لتحليل أنواع أخرى من الخلايا الظهارية.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للكشف عنه.
Acknowledgements
نشكر المعهد الوطني للعيون (NEI) مركز الأنسجة على استخدام Zeiss Axio Scan.Z1. كما نشكر المتبرعين وعائلاتهم وشبكة البصر المتقدم ومعهد ليونز للعيون على كرمهم. تم دعم هذا العمل من قبل صناديق NEI IRP (رقم المنحة ZIA EY000533-04).
Materials
| Name | Company | Catalog Number | Comments |
| Biopsy punch 1.5 mm | Acuderm Inc. | P1525 | |
| Bovine albumin | MP Biomedicals | 160069 | |
| Coverglass 50 x 75 mm, #1.5 thickness | Brain Research Laboratories | 5075-1.5D | |
| Curved spatula | Katena | K3-6600 | |
| D-Mannitol | Sigma | M9546 | |
| DPBS 1x with Ca2+ and Mg2+ | Gibco | 14040-133 | |
| Fine Scissors | Fine Science Tools | 14558-11 | |
| Fluormount-G | Southern Biotech | 0100-01 | |
| Forceps - Dumont #5 | Fine Science Tools | 11252-23 | |
| Microscope slides 50 x 75 x 1.2 mm | Brain Research Laboratories | 5075 | |
| Needles 21 G x 1-1/2" hypodermic | Becton Dickinson (BD) | 305167 | |
| Needles 27 G x 1-1/4" hypodermic | Becton Dickinson (BD) | 305136 | |
| Paraformaldehyde 16% | Electron Microscopy Sciences | 15710 | |
| Petri dish 100 mm | Corning | 430167 | |
| Phalloidin-iFluor 647 | Abcam | ab176759 | |
| Razor blades | PAL (Personna) | 62-0177 | |
| Round bottom tubes 50 mL | Newegg | 9SIA4SR9M88854 | |
| Silicon Elastomer Kit | Dow Corning Corporation | 4019862 | |
| Square weighing boat (81 mm x 81 mm x 25 mm) | Sigma | W2876 | |
| Surgical Vitrectomy System | BD Visitrec | 585100 | optional |
| Syringe 1 mL | Becton Dickinson (BD) | 309659 | |
| Triton X-100 | Sigma | T9284 | |
| TrueBlack | Biotium | 23007 | autofluorescence quencher |
| Tween 20 | Affymetrix | 20605 | |
| Vannas Spring Scissors - 3 mm cutting edge | Fine Science Tools | 15000-10 |
References
- Endo, E. G., Yao, X. Y., Marmor, M. F. Pigment adherence as a measure of retinal adhesion: Dependence on temperature. Investigative Ophthalmology and Visual Science. 29 (9), 1390-1396 (1988).
- Marmor, M. F. Retinal detachment from hyperosmotic intravitreal injection. Investigative Ophthalmology and Visual Science. 18 (12), 1237-1244 (1979).
- Marmor, M. F., Martin, L. J., Tharpe, S. Osmotically induced retinal detachment in the rabbit and primate. Electron microscopy of the pigment epithelium. Investigative Ophthalmology and Visual Science. 19 (9), 1016-1029 (1980).
- Ban, Y., Rizzolo, L. A culture model of development reveals multiple properties of RPE tight junctions. Molecular Vision. 3, 18(1997).
- Ortolan, D., et al. Single-cell-resolution map of human retinal pigment epithelium helps discover subpopulations with differential disease sensitivity. Proceedings of the National Academy of Sciences of the United States of America. 119 (19), 2117553119(2022).
- Schaub, N. J., et al. Deep learning predicts function of live retinal pigment epithelium from quantitative microscopy. Journal of Clinical Investigation. 130 (2), 1010-1023 (2020).
- Beatty, S., Koh, H. -H., Phil, M., Henson, D., Boulton, M. The role of oxidative stress in the pathogenesis of age-related macular degeneration. Survey of Ophthalmology. 45 (2), 115-134 (2000).
- Liu, Z., Kocaoglu, O. P., Miller, D. T. 3D imaging of retinal pigment epithelial cells in the living human retina. Investigative Ophthalmology and Visual Science. 57 (9), 533-543 (2016).
- Bhatia, S. K., et al. Analysis of RPE morphometry in human eyes. Molecular Vision. 22, 898-916 (2016).
- vonder Emde, L., et al. Histologic cell shape descriptors for the retinal pigment epithelium in age-related macular degeneration: A comparison to unaffected eyes. Translational Vision Science & Technology. 11 (8), 19(2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved