Method Article
Эффективная и последовательная генерация пигментных эпителиев сетчатки / плоских гор сосудистой оболочки из глаз человека для гистологического анализа
В этой статье
Резюме
Описан метод эффективного отделения пигментного эпителия сетчатки (RPE) от сетчатки в глазах человека и генерации целых RPE/хориоидных плоских маунтов для гистологического и морфометрического анализа RPE.
Аннотация
Пигментный эпителий сетчатки (RPE) и сетчатка являются функционально и структурно связанными тканями, которые работают вместе, чтобы регулировать восприятие света и зрение. Белки на апикальной поверхности RPE тесно связаны с белками на поверхности наружного сегмента фоторецептора, что затрудняет последовательное отделение RPE от фоторецепторов / сетчатки. Мы разработали метод эффективного отделения сетчатки от RPE человеческих глаз для генерации полных RPE / сосудистой оболочки и плоской сетчатки для раздельного клеточного анализа фоторецепторов и клеток RPE. Интравитреальная инъекция высокоосмолярного раствора D-маннита, сахара, не транспортируемого RPE, индуцировала разделение RPE и сетчатки по всей задней камере, не вызывая повреждения клеточных соединений RPE. Никаких пятен RPE, прикрепленных к сетчатке, не наблюдалось. Фаллоидиновая маркировка актина показала сохранение формы RPE и позволила провести морфометрический анализ всего эпителия. Программное обеспечение на основе искусственного интеллекта (ИИ) было разработано для точного распознавания и сегментирования границ ячеек RPE и количественной оценки 30 различных показателей формы. Этот метод рассечения является высоковоспроизводимым и может быть легко распространен на другие модели животных.
Введение
Пигментный эпителий сетчатки (RPE) и нервная сетчатка тесно взаимосвязаны друг с другом из-за сильной физиологической зависимости фоторецепторов от RPE. Во время рассечения механическое отделение нервной сетчатки от RPE вызывает разрыв клеток RPE, при этом апикальные части RPE остаются прикрепленными к внешним сегментам фоторецепторов сетчатки. Степень адгезии RPE-сетчатки настолько велика, что количество пигмента, оставшегося на сетчатке после разделения, используется для количественной оценки силы адгезии сетчатки1. В частности, плотные соединения RPE и соединяющая их актиновая структура, которые расположены на апикальной стороне, разрываются при механическом разделении. Таким образом, окрашивание плоских креплений RPE для границ ячеек приводит к образованию пятнистого монослоя, в котором многие ячейки имеют отсутствующие границы. Этот эффект усугубляется, когда ткань фиксируется параформальдегидом (PFA) перед рассечением, поскольку белки становятся сшитыми.
Исследования по интравитреальной доставке препарата показали, что инъекции гиперосмотических растворов в заднюю камеру индуцируют отслоение сетчатки 2,3. В этих экспериментах 50 мкл различных растворов, в диапазоне от 1000 мОсм до 2 400 мОсм, введенных в середину стекловидного тела, вызывали отслоение сетчатки в течение нескольких минут. Примечательно, что даже после длительного воздействия высокоосмолярных растворов плотные соединения RPE оказались нетронутыми на просвечивающих электронных микроскопических изображениях глаз кролика иобезьяны 3. Следуя аналогичной стратегии, мы ввели в середину стекловидного тела гиперосмотический раствор D-маннитола, чтобы вызвать эффективное отслоение сетчатки перед выполнением рассечения RPE. Поскольку D-маннит не транспортируется RPE4, поддерживается высокая интравитреальная концентрация, генерирующая осмотический градиент. Эффективное разделение RPE и сетчатки по всей задней камере гарантирует сохранение клеточных соединений RPE и позволяет изучать морфометрию RPE на всей плоской горе. Кроме того, мы разработали программное обеспечение на основе искусственного интеллекта (ИИ), которое распознает и сегментирует флуоресцентно помеченные границы ячеек RPE, количественно оценивает 30 различных показателей формы и создает тепловые карты каждой метрики для визуализации 5,6.
протокол
Трупные человеческие глобусы были получены из Advanced Sight Network (Бирмингем, Алабама). Работа, выполненная на трупной ткани, освобождается Советом по институциональному обзору NIH от комитета по этике исследований.
1. Доставка глазного глобуса
- После энуклеации отправьте свежие глазные шары в контейнер, наполненный ледяным DPBS 1x с Ca2+ и Mg2+.
ПРИМЕЧАНИЕ: Лучше рассечь глаз в течение 24 ч после энуклеации. Морфология RPE не изменяется в течение этого временного окна.
2. Подготовка силиконовой формы
- Вырежьте дно 20 мм из трубки круглого дна диаметром 25 мм. Поместите его у основания квадратной весовой лодки (81 мм x 81 мм x 25 мм).
- Смешайте два компонента silicon Elastomer Kit в соотношении 10:1, обращая внимание на то, чтобы не засорять воздух. Вылейте смесь в весовую лодку, содержащую сферический кусок трубки с круглым дном.
- Отверните силикон при комнатной температуре на ночь. Снимите весовую лодку и трубку с круглым дном из отвержденной силиконовой формы.
3. Рассечение РПЭ
- Очистите склеру свежего глаза, глобус мышц и соединительной ткани. Прикрепите глаз к силиконовой форме с помощью игл 27 г, продетых через склеру. Заполните полость формы DPBS 1x с Ca2+ и Mg2+.
ПРИМЕЧАНИЕ: Обратите внимание, чтобы не нарушить глазную камеру. Иглы должны проходить только через склеру. - Используйте шприц 1 мл и иглу 21 г для введения ~ 400 мкл раствора D-маннита 1 700 мОсм в стекловидное тело. Вставьте иглу через pars plana, чтобы избежать прокалывания передней камеры глаза. Оставьте глаз при комнатной температуре на ~45 мин.
- Разрежьте переднюю камеру на уровне pars plana с помощью тонких ножниц и щипцов. Заполните заднюю камеру глаза DPBS 1x с Ca2+ и Mg2+. Под стереомикроскопом локализуют макулу (желтое пятно на сетчатке).
- Если доступен хирургический резак для стекловидного тела, удалите стекловидное тело и замените его DPBS 1x с Ca2+ и Mg2+. Как вариант, попробуйте поднять стекловидное тело щипцами и разрезать его тонкими ножницами.
- Обращая внимание на сохранение макулярной области, разрезайте глаз на квадранты: носовой, височный, верхний и нижний. Удалите иглы, если они мешают.
- Перенесите заднюю камеру глаза в 100-миллиметровую чашку Петри, содержащую DPBS 1x с Ca2+ и Mg2+. Перед удалением сетчатки отметьте лепесток, содержащий макулу, сделав небольшой разрез (V-образный) в цилиарном крае. Поднимите и срежьте все стекловидное тело, которое лежит на сетчатке.
- Осторожно поднимите сетчатку с нескольких сторон с помощью изогнутого шпателя или пары щипцов, чтобы проверить, отделилась ли сетчатка от RPE, и позволить некоторой жидкости циркулировать между двумя слоями.
ПРИМЕЧАНИЕ: Сетчатка по-прежнему будет прикреплена на самой периферии (цилиарные края) и на зрительном нерве. - Отрежьте сетчатку от цилиарных краев во всех лепестках, следя за тем, чтобы не поцарапать РПЭ. Поместите ткань в 4% PFA и инкубируйте в течение ~ 1 ч. Стирка 3x с DPBS 1x с Ca2+ и Mg2+. Переложите ткань в контейнер, наполненный DPBS 1x с Ca2+ и Mg2+ и храните его при 4 °C.
ПРИМЕЧАНИЕ: В этот момент сетчатка прикреплена только к зрительному нерву. Это точка паузы в этом эксперименте. - Перенесите образец на чашку Петри толщиной 100 мм, содержащую DPBS 1x с Ca2+ и Mg2+. Выбивайте головку зрительного нерва с помощью биопсийного пунша 1,5 мм и соберите сетчатку. Храните нервную сетчатку в DPBS 1x с Ca2+ и Mg2+ при 4 °C.
ПРИМЕЧАНИЕ: Прежде чем пробивать головку зрительного нерва, убедитесь, что зрительный нерв как можно больше разрезает на склеральной стороне. Это повысит точность удара. Выбивание зрительного нерва после того, как плоское крепление зафиксировано в 4% PFA, уменьшает повреждение клеток RPE, расположенных вокруг зрительного нерва. - Удалите склеру из RPE / сосудистой оболочки, осторожно подняв слой RPE / сосудистой оболочки с периферии и разрезав сосуды сосудистой оболочки и соединительную ткань, которые находятся между склерой и RPE с помощью пружинных ножниц Vannas. Как только RPE / сосудистая оболочка будет полностью отделена от склеры, соберите слой RPE / сосудистой оболочки. Переложите ткань в контейнер, наполненный DPBS 1x с Ca2+ и Mg2+ , и храните его при 4°C.
ПРИМЕЧАНИЕ: В это время эксперимент можно приостановить.
4. Окрашивание
- Перенесите RPE/сосудистую оболочку в одну лунку из 6-луночной пластины. Блокируют и пермеабилизируют образец в DPBS 1x с Ca2+ и Mg2+ с 1% бычьим сывороточным альбумином (BSA), 0,5% Tween 20 и 0,5% Triton X-100 в течение 1 ч при комнатной температуре.
- Инкубируют образец с фаллоидином, сопряженным с флуорофором 647 в разведении 1:250 в DPBS 1x с Ca2+ и Mg2+ с 1% BSA, 0,5% Tween 20 и 0,5% Triton X-100 в течение 1 ч при комнатной температуре. Стирайте 3x в DPBS 1x с Ca2+ и Mg2+.
- Перенесите образец RPE/сосудистой оболочки на стеклянный слайд размером 50 мм x 75 мм и сгладите его. Разрежьте каждый «лепесток» на две части, чтобы образец был более плоским. Обратите внимание на макулу. Нарисуйте контур плоского крепления гидрофобным пером.
- Для гашения автофлуоресценции липофусцина добавляют 500 мкл раствора автофлуоресцентного гасителя, разбавленного до 1:20 в 70% этаноле и инкубируют при комнатной температуре в течение 2 мин.
- Тщательно вымойте (не менее 3x) в DPBS 1x с Ca2+ и Mg2+. Извлеките DPBS и добавьте монтажный носитель. Поместите накладное стекло на плоское крепление и запечатайте лаком для ногтей.
- Изобразите плоское крепление с помощью флуоресцентного микроскопа (предпочтительно с использованием объектива 10x или 20x).
5. Анализ RESHAPE
ПРИМЕЧАНИЕ: Поскольку алгоритм на основе REShAPE AI был обучен на изображениях 10x и 20x, поэтому настоятельно рекомендуется использовать объектив 10x или 20x при визуализации. Если нет, изображения необходимо будет соответствующим образом масштабировать.
- Если изображения получены с помощью более чем одного флуоресцентного канала, изолируйте канал, используемый для получения границ клеток. Экспортируйте изображения в виде 16-битных TIF-файлов в оттенках серого.
ПРИМЕЧАНИЕ: Изображения, полученные с расширением .czi, не нужно экспортировать как файлы TIF, но канал, содержащий границы ячеек, по-прежнему необходимо изолировать. - Установите программное обеспечение на платформах Windows x64 или Linux (Centos 7).
ПРИМЕЧАНИЕ: Программное обеспечение и инструкции по установке можно найти на https://github.com/nih-nei/REShAPE. - Откройте программное обеспечение (рисунок 1).
- На вкладке Каталоги выберите входные и выходные папки. Во входном каталоге выберите папку, содержащую изображения. В выходном каталоге пусть программное обеспечение автоматически изменит путь на "input directory/Processed". Кроме того, можно изменить выходной каталог вручную.
ПРИМЕЧАНИЕ: Программное обеспечение будет перебирать все изображения, содержащиеся во входной папке. - На вкладке Параметры сегментации NN выберите следующие параметры сегментации изображений:
- Размер пакета: введите значение 20 в текстовом поле в качестве хорошей отправной точки, но уменьшите его, если в системе закончатся графические процессоры (GPU).
ПРИМЕЧАНИЕ: Исходное изображение разделено на более мелкие плитки для обработки. Размер пакета определяет, сколько плиток может быть обработано одновременно. - Использовать GPU?: Если в системе недостаточно ресурсов ГРАФИЧЕСКОГО ПРОЦЕССОРА, установите флажок Нет.
- Внутреннее масштабирование: используя раскрывающееся меню, измените внутреннее масштабирование с Нет в тех случаях, когда изображения не были получены с целью 10x или 20x. Например, уменьшите масштаб изображений в 40 раз до половины размера с помощью кнопки 1/2 . Параметры масштабирования, доступные в раскрывающемся меню: 5x, 2x, None, 1/2, 1/5.
ПРИМЕЧАНИЕ: Машинное обучение было обучено с 10x и 20x изображениями. Он может не распознавать границы клеток по изображениям, сделанным при других увеличениях. В этом случае двоичные изображения будут выглядеть полностью черными. - Arti Filter: Используйте вкладку фильтра артефактов для удаления очень ярких частиц (обломков или небольших частей сетчатки или соединительной ткани вокруг зрительного нерва), которые могут присутствовать на изображении и могут мешать сегментации границ клеток. По умолчанию фильтр не используется. Параметры искусственного фильтра в раскрывающемся меню следующие: Обычный, Сильный и Слабый.
- Размер пакета: введите значение 20 в текстовом поле в качестве хорошей отправной точки, но уменьшите его, если в системе закончатся графические процессоры (GPU).
- На вкладке Параметр мозаичного изображения вставьте в текстовое поле значение, чтобы указать степень перекрытия между плитками изображения, настроив параметр Pad Tiles By . Перекрытие в 100 пикселей обычно работает хорошо.
- На вкладке Параметры выходного рисунка настройте параметры для создания тепловой карты:
- Reconstruct Tiled Images?: если в системе недостаточно ресурсов для анализа больших изображений, установите флажок Нет , чтобы позволить программному обеспечению завершить анализ, сохранив отдельные плитки без реконструкции всего изображения.
- Создание цветных изображений: чтобы создать тепловые карты, выберите Все в раскрывающемся меню.
- Для параметра «Раскраска» выберите любую из различных цветовых палитр, доступных в раскрывающемся меню: «Термальный», «Зеленый», «Mpl-магма», «Фаза», «Огонь», «Струя», «Голубой горячий».
- В поле Формат изображения сохраните изображения в формате TIF или PNG, выбрав один из параметров на вкладке.
- Что касается функции Use Manual Limits? , установите флажок Нет , чтобы программное обеспечение использовало минимальные и максимальные значения, обнаруженные в каждом изображении. Установите флажок Да , чтобы вручную настроить диапазон значений для каждой метрической тепловой карты фигуры, и нажмите кнопку Установить ограничения , чтобы выбрать диапазоны для отдельных параметров, вставив значения в текстовые поля. После изменения интересующих значений нажмите кнопку Сохранить. Нажмите Загрузить значения по умолчанию, чтобы сбросить все ограничения.
ПРИМЕЧАНИЕ: Используйте ручные ограничения, если необходимо сравнивать тепловые карты из нескольких изображений, например, при сравнении влияния различных соединений на форму ячейки. Таким образом, используется один и тот же диапазон значений. Набор значений, вводимых вручную, зависит от типа образца. Рекомендуется выполнить несколько итераций, чтобы выбрать оптимальный диапазон.
- На вкладке Ограничения размера ячейки для анализа выберите пороговое значение размера ячейки для анализа.
- В поле Нижний размер ячейки вставьте в текстовое поле размер наименьшей ячейки, которая будет включена в анализ.
- В поле Верхний размер ячейки вставьте в текстовое поле размер самой большой ячейки, которая будет включена в анализ.
ПРИМЕЧАНИЕ: Единица измерения размера ячейки изменяется от пикселей до микрометров в квадрате в зависимости от опции, выбранной на вкладке Автоматическое преобразование единиц измерения.
- На вкладке Автоматическое преобразование единиц выберите предпочтительную единицу измерения для анализа:
- В разделе Преобразовать пиксели в реальные единицы? установите флажок Нет , чтобы выполнить анализ в пиксельных единицах. Установите флажок Да , чтобы запустить анализ в микрометрах.
- В поле Длина шкалы (пиксели) введите значение пикселя в текстовом поле.
- В поле Длина шкалы (микрон) введите в текстовое поле соответствующее расстояние в микрометрах.
- Чтобы начать анализ, нажмите кнопку Go For It.
ПРИМЕЧАНИЕ: Программное обеспечение также может измерять жизнеспособность клеток, когда клетки окрашены 4',6-диамидино-2-фенилиндолом (DAPI) и йодидом пропидия (вкладка параметров CZI ), но это не относится к плоским креплениям RPE.
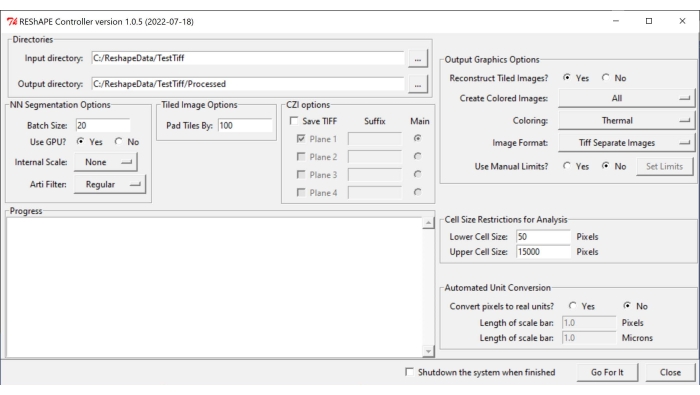
Рисунок 1: Графический интерфейс пользователя REShAPE. Графический интерфейс пользователя имеет различные вкладки для выбора рабочих каталогов (вкладка «Каталоги »), изменения параметров сегментации (вкладки «Параметры сегментации NN» и «Параметры мозаичного изображения »), указания параметров анализа (вкладки «Ограничения размера ячеек для анализа » и «Автоматическое преобразование единиц измерения») и для создания тепловой карты (вкладка «Параметры выходной графики »). Аббревиатура: GUI = графический интерфейс пользователя. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Результаты
Этот протокол приводит к одноплоскостному изображению плоского крепления, где местоположение ячейки и 30 показателей формы измеряются для каждой правильно идентифицированной ячейки RPE (рисунок 2). Папка с именем "Processed" автоматически генерируется внутри входного каталога. Эта папка содержит четыре подкаталога с именами «Анализ», «Цветовая кодировка», «Объединенные файлы» и «Сегментированные изображения», а также некоторые временные файлы, созданные во время анализа. Папка «Объединенные файлы» содержит электронную таблицу со всеми измерениями формы и электронную таблицу с частотами количества соседей ячеек всех объединенных файлов. Папка «Анализ» содержит электронную таблицу со всеми измерениями формы и электронную таблицу с частотами подсчета соседей ячеек для каждого изображения отдельно. Каталог "Сегментированные изображения" содержит окончательные двоичные маски границ ячеек RPE; его можно использовать для оценки качества сегментации. Каталог "Color Coded" содержит тепловые карты для каждого измерения фигуры для визуализации узоров фигур на каждом изображении. Определения и сокращения метрик формы можно найти в таблице 1.
Иногда плоские крепления RPE могут содержать остаточные кусочки сетчатки, которые не были удалены чисто, особенно вокруг зрительного нерва. Окрашивание образца фаллоидином приводит к сильному сигналу, поступающему от сетчатки, и это может вызвать проблемы с сегментацией границы клеток RPE. Некоторые плитки будут выглядеть полностью черными, в то время как окружающие плитки будут демонстрировать нормальную сегментацию. Другие яркие объекты, которые могут присутствовать на изображении, также вызовут генерацию черных плиток (рисунок 3). В этих случаях выбор одного из вариантов фильтрации (Слабый, Обычный, Сильный), доступных в раскрывающемся меню Фильтр Арти , предотвратит образование черных плиток.
REShAPE принимает 8-битные или 16-битные изображения в градациях серого в качестве входных данных, но не RGB-изображения. Использование RGB-изображений для анализа REShAPE приведет к созданию полностью черных двоичных изображений. Если это произойдет, преобразование изображений RGB в оттенки серого приведет к правильно сегментированным двоичным изображениям (рисунок 4). В некоторых случаях, когда границы RPE распознаются неправильно, например, если окрашивание не является оптимальным или если образец поврежден царапиной (рисунок 5A), большие скопления клеток могут быть идентифицированы как одна очень большая ячейка (рисунок 5B). В этом случае крупные объекты могут быть исключены из анализа путем уменьшения порога размера ячейки (рисунок 5C). Этого можно достичь, вставив меньшее значение в текстовое поле Верхний размер ячейки . Однако это приведет к изменению диапазона тепловой карты. Если исследователь решит сделать это, можно также сохранить исходный диапазон тепловой карты (рисунок 5D), установив флажок Да в функции Use Manual Limits? . Впоследствии исследователь должен щелкнуть левой кнопкой мыши кнопку «Установить пределы» и вставить нужные значения в текстовые поля, чтобы указать ручные ограничения.
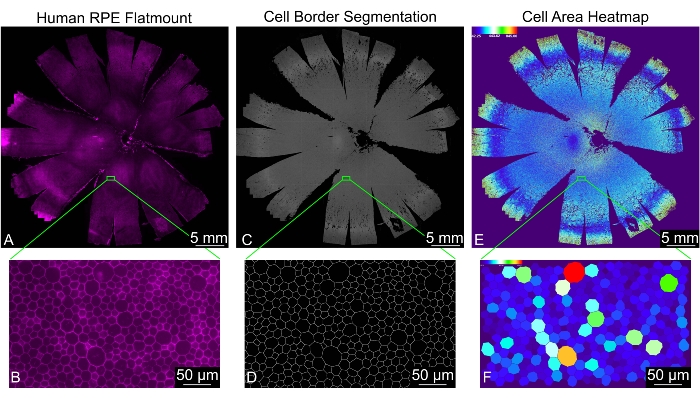
Рисунок 2: Полный морфометрический анализ всего монослоя RPE человека. (A) Вид с низким увеличением всего человеческого RPE / сосудистой оболочки плоской горы (пурпурный: фаллоидин). (B) Увеличенный вид окрашенных фаллоидином клеток RPE. (C) Сгенерированная REShAPE сегментация границ клеток RPE для всего плоского расстояния RPE/сосудистой оболочки человека и (D) соответствующего увеличенного представления. (E) Созданная программным обеспечением тепловая карта, иллюстрирующая площадь отдельных клеток RPE во всей плоской горе человека. Тепловая шкала в левом верхнем углу показывает диапазон используемых значений. (F) Соответствующее увеличенное представление, показывающее отдельные ячейки RPE, окрашенные по площади. Шкала стержней = (B,D,F) 50 мкм, (A,C,E) 5 мм. Аббревиатура: RPE = пигментный эпителий сетчатки. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
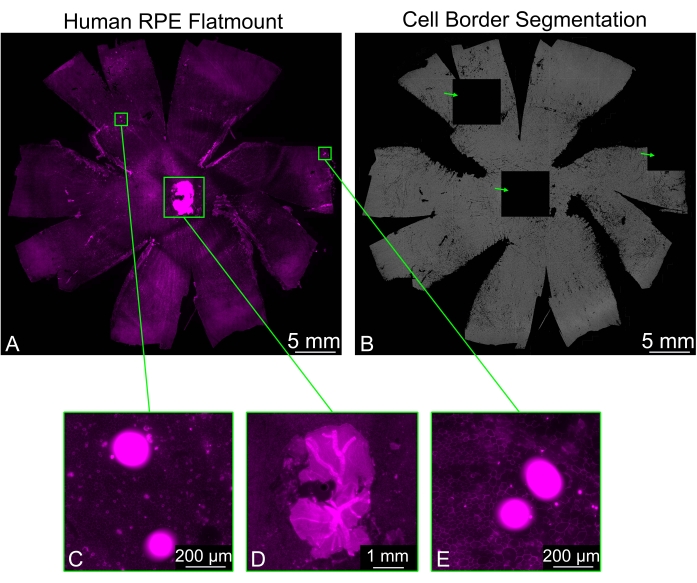
Рисунок 3: Фильтрация ярких артефактов. (A) Человеческий RPE, окрашенный для границ клеток (пурпурный: фаллоидин), может представлять яркие области (зеленые прямоугольники), которые мешают сегментации. (B) Сегментация границы ячейки RPE всего плоского крепления содержит три полностью черные плитки (зеленые стрелки), соответствующие ярким областям флуоресценции. (С,Э) Две черные плитки соответствуют областям, содержащим яркие точки, которые, возможно, являются каким-то мусором. (D) Одна из черных плиток была сгенерирована куском нервной сетчатки вокруг зрительного нерва, который не был правильно удален. Кусочки нервной сетчатки значительно ярче слоя RPE и препятствуют сегментации клеток. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 4: Требование входного изображения. Ячейки RPE, окрашенные для границ ячеек, были сохранены в виде (A) RGB или (B) 16-битных изображений в оттенках серого для анализа REShAPE. (C) Результатом анализа изображения RBG является черное двоичное изображение (D), в то время как анализ изображения в оттенках серого создает правильно сегментированный двоичный файл границ ячеек. REShAPE может анализировать только 8-битные или 16-битные изображения в оттенках серого. Шкала = 50 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 5: Неоптимальные результаты. (A) Изображение части монослоя RPE, где клетки, окрашенные фаллоидином, были случайно поцарапаны. (B) Тепловая карта ячеек RPE, окрашенных размером площади ячейки. Большой верхний порог размера ячейки включает в анализ большие объекты. (C) Тепловая карта площади ячейки, в которой был выбран меньший порог верхнего размера ячейки для исключения крупных объектов из анализа. (D) Тепловая карта площади ячеек, в которой был выбран меньший верхний порог размера ячейки и установлены ручные ограничения для поддержания диапазона тепловой карты, используемого первоначально. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Таблица 1: Параметры REShAPE. В таблице указано определение каждого параметра и аббревиатуры, используемые в необработанных электронных таблицах (файлы «_Data.csv») и для тепловых карт. Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
Обсуждение
Последовательное и эффективное разделение RPE человека и сетчатки может быть достигнуто с помощью этого протокола. Этот метод позволяет изучать региональные различия в форме RPE по всей сетчатке человека5. Решающим шагом в протоколе является физическое разделение RPE и сетчатки. Если две ткани не полностью отделились в некоторых областях, следует осторожно приподнять сетчатку, следя за тем, чтобы не сломать ткани. Анализ REShAPE больших плоских креплений может потребовать использования систем со значительными ресурсами оперативной памяти. В этом случае повторная сборка всего изображения может быть отключена, чтобы позволить программному обеспечению успешно завершить анализ, несмотря на нехватку ресурсов обработки.
Основным ограничением использования REShAPE для сегментации плоских маунтов RPE человека является то, что алгоритм ИИ был в основном обучен на изображениях индуцированного плюрипотентного RPE, полученного из стволовых клеток. Как следствие, сегментация плоских маунтов RPE человека менее точна. Клетки RPE от пожилых доноров содержат большое количество липофусцина7, а широкий спектр его аутофуоресценции препятствует сегментации границ клеток. В будущем для улучшения сегментации границ ячеек в этом виде будет использоваться больше изображений плоских маунтов RPE. Несмотря на это ограничение, REShAPE был специально обучен распознавать и сегментировать границы клеток RPE и работает лучше, чем другие существующие методы, такие как сегментация клеток RPE Voronoi8 и CellProfiler9 .
Более того, по сравнению с ручной сегментацией10, REShAPE обеспечивает преимущество быстрого анализа больших изображений (было протестировано ~ 130 000 пикселей x 130 000 пикселей). В заключение, этот метод рассечения является высоковоспроизводимым и может быть легко распространен на другие модели животных. Кроме того, программное обеспечение может быть использовано для изучения формы RPE в плоских горах глаз или в моделях клеточных культур для изучения эффекта определенных методов лечения. Наконец, универсальность REShAPE делает его широко применимым для анализа других типов эпителиальных клеток.
Раскрытие информации
У авторов нет конфликта интересов для раскрытия.
Благодарности
Мы благодарим гистологическое ядро Национального института глаз (NEI) за использование Zeiss Axio Scan.Z1. Мы также благодарим доноров, их семьи, сеть Advancing Sight Network и Институт Львиного Глаза за их щедрость. Эта работа была поддержана фондами NEI IRP (номер гранта ZIA EY000533-04).
Материалы
| Name | Company | Catalog Number | Comments |
| Biopsy punch 1.5 mm | Acuderm Inc. | P1525 | |
| Bovine albumin | MP Biomedicals | 160069 | |
| Coverglass 50 x 75 mm, #1.5 thickness | Brain Research Laboratories | 5075-1.5D | |
| Curved spatula | Katena | K3-6600 | |
| D-Mannitol | Sigma | M9546 | |
| DPBS 1x with Ca2+ and Mg2+ | Gibco | 14040-133 | |
| Fine Scissors | Fine Science Tools | 14558-11 | |
| Fluormount-G | Southern Biotech | 0100-01 | |
| Forceps - Dumont #5 | Fine Science Tools | 11252-23 | |
| Microscope slides 50 x 75 x 1.2 mm | Brain Research Laboratories | 5075 | |
| Needles 21 G x 1-1/2" hypodermic | Becton Dickinson (BD) | 305167 | |
| Needles 27 G x 1-1/4" hypodermic | Becton Dickinson (BD) | 305136 | |
| Paraformaldehyde 16% | Electron Microscopy Sciences | 15710 | |
| Petri dish 100 mm | Corning | 430167 | |
| Phalloidin-iFluor 647 | Abcam | ab176759 | |
| Razor blades | PAL (Personna) | 62-0177 | |
| Round bottom tubes 50 mL | Newegg | 9SIA4SR9M88854 | |
| Silicon Elastomer Kit | Dow Corning Corporation | 4019862 | |
| Square weighing boat (81 mm x 81 mm x 25 mm) | Sigma | W2876 | |
| Surgical Vitrectomy System | BD Visitrec | 585100 | optional |
| Syringe 1 mL | Becton Dickinson (BD) | 309659 | |
| Triton X-100 | Sigma | T9284 | |
| TrueBlack | Biotium | 23007 | autofluorescence quencher |
| Tween 20 | Affymetrix | 20605 | |
| Vannas Spring Scissors - 3 mm cutting edge | Fine Science Tools | 15000-10 |
Ссылки
- Endo, E. G., Yao, X. Y., Marmor, M. F. Pigment adherence as a measure of retinal adhesion: Dependence on temperature. Investigative Ophthalmology and Visual Science. 29 (9), 1390-1396 (1988).
- Marmor, M. F. Retinal detachment from hyperosmotic intravitreal injection. Investigative Ophthalmology and Visual Science. 18 (12), 1237-1244 (1979).
- Marmor, M. F., Martin, L. J., Tharpe, S. Osmotically induced retinal detachment in the rabbit and primate. Electron microscopy of the pigment epithelium. Investigative Ophthalmology and Visual Science. 19 (9), 1016-1029 (1980).
- Ban, Y., Rizzolo, L. A culture model of development reveals multiple properties of RPE tight junctions. Molecular Vision. 3, 18(1997).
- Ortolan, D., et al. Single-cell-resolution map of human retinal pigment epithelium helps discover subpopulations with differential disease sensitivity. Proceedings of the National Academy of Sciences of the United States of America. 119 (19), 2117553119(2022).
- Schaub, N. J., et al. Deep learning predicts function of live retinal pigment epithelium from quantitative microscopy. Journal of Clinical Investigation. 130 (2), 1010-1023 (2020).
- Beatty, S., Koh, H. -H., Phil, M., Henson, D., Boulton, M. The role of oxidative stress in the pathogenesis of age-related macular degeneration. Survey of Ophthalmology. 45 (2), 115-134 (2000).
- Liu, Z., Kocaoglu, O. P., Miller, D. T. 3D imaging of retinal pigment epithelial cells in the living human retina. Investigative Ophthalmology and Visual Science. 57 (9), 533-543 (2016).
- Bhatia, S. K., et al. Analysis of RPE morphometry in human eyes. Molecular Vision. 22, 898-916 (2016).
- vonder Emde, L., et al. Histologic cell shape descriptors for the retinal pigment epithelium in age-related macular degeneration: A comparison to unaffected eyes. Translational Vision Science & Technology. 11 (8), 19(2022).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены