Method Article
組織学的分析のためのヒトの眼からの網膜色素上皮/脈絡膜フラットマウントの効率的かつ一貫した生成
要約
ヒトの眼の網膜から網膜色素上皮(RPE)を効率的に分離し、RPEの組織学的および形態学的解析のためにRPE/脈絡膜フラットマウント全体を生成する方法について説明します。
要約
網膜色素上皮(RPE)と網膜は、機能的および構造的に接続された組織であり、光の知覚と視覚を調節するために連携して機能します。RPE頂端表面のタンパク質は、視細胞外側セグメント表面のタンパク質と密接に関連しているため、RPEを光受容体/網膜から一貫して分離することは困難です。ヒトの眼のRPEから網膜を効率的に分離し、光受容体とRPE細胞を別々の細胞解析のために完全なRPE/脈絡膜および網膜フラットマウントを生成する方法を開発しました。RPEによって輸送されない糖であるD-マンニトールの高浸透圧溶液の硝子体内注射は、RPE細胞接合部に損傷を与えることなく、後房全体にわたってRPEと網膜の分離を誘導した。網膜に付着したRPEパッチは観察されなかった。アクチンのファロイジン標識はRPE形状保存を示し、上皮全体の形態測定分析を可能にした。人工知能(AI)ベースのソフトウェアが開発され、RPEセルの境界を正確に認識してセグメント化し、30の異なる形状メトリックを定量化しました。この解剖法は再現性が高く、他の動物モデルにも容易に拡張することができます。
概要
網膜色素上皮(RPE)と神経網膜は、光受容体のRPEへの強い生理学的依存性のために、互いに強く相互接続されています。解剖中、RPEからの神経網膜の機械的分離はRPE細胞の裂傷を引き起こし、RPEの頂端部分は網膜光受容体の外側セグメントに付着したままである。RPEと網膜の癒着の程度は非常に大きいため、分離後に網膜に残る色素の量を使用して、網膜の癒着の強さを定量化します1。具体的には、頂端側に位置するRPEタイトジャンクションとそれらをつなぐアクチン構造は、機械的分離中に切断される。したがって、細胞境界のRPEフラットマウントを染色すると、多くの細胞に境界が欠落している斑状の単分子膜が得られます。この効果は、タンパク質が架橋されるようになるにつれて、解剖前に組織がパラホルムアルデヒド(PFA)で固定されると悪化する。
硝子体内薬物送達に関する研究は、後房への高浸透圧溶液の注射が網膜剥離を誘発することを示した2,3。これらの実験では、1,000 mOsmから2,400 mOsmの範囲の50 μLの異なる溶液を硝子体中央部に注入すると、数分以内に網膜剥離を引き起こしました。特に、高浸透圧溶液に長時間さらされた後でも、RPEタイトジャンクションはウサギとサルの両方の目の透過型電子顕微鏡画像に無傷で現れました3。同様の戦略に従って、RPE解離を行う前に、D-マンニトールの高浸透圧溶液を硝子体中部に注入して、効率的な網膜剥離を誘導しました。D-マンニトールはRPE4によって輸送されないため、硝子体内濃度が高く維持され、浸透圧勾配が生成されます。後房全体にわたるRPEと網膜の効率的な分離は、RPE細胞接合の保存を保証し、フラットマウント全体のRPE形態測定の研究を可能にします。さらに、蛍光標識されたRPE細胞の境界を認識してセグメント化し、30の異なる形状メトリックを定量化し、視覚化のために各メトリックのヒートマップを生成する人工知能(AI)ベースのソフトウェアを開発しました5,6。
プロトコル
死体の人間球は、Advanced Sight Network(アラバマ州バーミンガム)から入手しました。死体組織で行われた作業は、NIH治験審査委員会によって研究倫理委員会から免除されます。
1.アイグローブの出荷
- 除核後、新鮮なアイグローブを氷冷したDPBS 1xとCa2+とMg2+で満たされた容器に入れて出荷します。
注:除核後24時間以内に目を解剖することをお勧めします。RPEの形態は、この時間枠の間は変更されません。
2.シリコーン型の準備
- 直径25mmの丸底チューブの底部20mmを切り取ります。正方形の計量ボート(81 mm x 81 mm x 25 mm)のベースに置きます。
- シリコンエラストマーキットの2つのコンポーネントを10:1の比率で混合し、空気を閉じ込めないように注意してください。丸底チューブの球形部分を含む計量ボートにミックスを注ぎます。
- 室温で一晩シリコーンを硬化させます。硬化したシリコーン型から計量ボートと丸底チューブを取り外します。
3. RPE解剖
- 筋肉と結合組織の新鮮な目の球の強膜をきれいにします。強膜に通した27Gの針を使用して、目をシリコーン型に固定します。金型のキャビティに、Ca 2+およびMg2+を含むDPBS 1xを充填します。
注意: 眼腔を壊さないように注意してください。針は強膜のみを通過する必要があります。 - 1 mLシリンジと21 G針を使用して、~400 μLの1,700 mOsm D-マンニトール溶液を硝子体に注入します。目の前房に穴を開けないように、扁平に針を挿入します。室温で~45分間放置します。
- 細かいハサミと鉗子を使用して、パースプラナの高さで前房を切り開きます。後眼腔にCa 2+およびMg2+を含むDPBS 1xを充填する。実体顕微鏡下で、黄斑(網膜上の黄色い斑点)を局在化させる。
- 外科用硝子体カッターが利用可能な場合は、硝子体を取り外し、Ca 2+およびMg2+を含むDPBS 1xと交換します。または、鉗子で硝子体を持ち上げ、細かいハサミで切るようにしてください。
- 黄斑部を保存することに注意を払い、目を鼻、側頭、上、下象限に切ります。針が邪魔になる場合は取り外します。
- 目の蝶の後房を、Ca2 +およびMg2+を含むDPBS 1xを含む100mmのペトリ皿に移します。網膜を取り除く前に、毛様体縁に小さな切り込み(V字型)を入れて、黄斑を含む花びらに印を付けます。網膜に横たわるすべての硝子体を持ち上げて切ります。
- 湾曲したヘラまたは鉗子で網膜を複数の側面からゆっくりと持ち上げて、網膜がRPEから外れたかどうかを確認し、2つの層の間を液体を循環させます。
注:網膜は依然として非常に周辺(毛様体縁)と視神経に付着します。 - すべての花びらの毛様体縁から網膜を切り取り、RPEを傷つけないようにします。組織を4%PFAに入れ、~1時間インキュベートします。DPBSで3回洗浄し、Ca2+ およびMg2+で1回洗浄します。組織をCa2+ およびMg2+ を含むDPBS 1xを充填した容器に移し、4°Cで保存します。
注:この時点で、網膜は視神経にのみ付着しています。これは、この実験の一時停止ポイントです。 - サンプルを、Ca 2+およびMg2+を含むDPBS 1xを含む100 mmペトリ皿に移します。1.5mm生検パンチで視神経乳頭を打ち抜き、網膜を採取します。神経網膜を、Ca2+ およびMg2+ と共にDPBS 1xに4°Cで保存します。
注意: 視神経乳頭を打ち抜く前に、強膜側で視神経をできるだけ切断してください。これにより、パンチの精度が向上します。フラットマウントを4%PFAに固定した後に視神経を打ち抜くと、視神経の周囲にあるRPE細胞への損傷が軽減されます。 - RPE /脈絡膜層を周辺からそっと持ち上げ、強膜とRPEの間にある脈絡膜血管と結合組織をバンナスプリングハサミで切断することにより、RPE /脈絡膜から強膜を取り除きます。RPE/脈絡膜が強膜から完全に分離したら、RPE/脈絡膜層を採取します。組織をCa 2+およびMg2+を含むDPBS 1xで満たされた容器に移し、4°Cで保管します。
注: この時点で、実験を一時停止できます。
4.染色
- RPE/コロイドを6ウェルプレートの1ウェルに移します。DPBS 1xで、1%ウシ血清アルブミン(BSA)、0.5%トゥイーン20、および0.5%トリトンX-100を含むCa 2+およびMg2+で、室温で1時間ブロックして透過処理します。
- サンプルをファロイジンと結合させたファロイジンを、Ca 2+およびMg 2+を含むDPBS 1x、1%BSA、0.5%トゥイーン20、および0.5%Triton X-100で1:250希釈し、室温で1時間インキュベートします。DPBS 1xで3回、Ca2+およびMg2+で洗浄します。
- RPE/脈絡膜サンプルを50 mm x 75 mmのスライドガラスに移し、平らにします。各「花びら」を2つにカットして、サンプルをより平らにします。黄斑に注意してください。疎水性ペンでフラットマウントの輪郭を描きます。
- リポフスチンの自家蛍光を消光するには、70%エタノール中で1:20に希釈した自家蛍光消光器溶液500 μLを加え、室温で2分間インキュベートします。
- DPBS 1xでCa2+およびMg2+で徹底的に(少なくとも3x)洗浄します。DPBSを取り外し、封入剤を追加します。フラットマウントにカバーガラスを置き、マニキュアで密封します。
- フラットマウントを蛍光顕微鏡で画像化します(できれば10倍または20倍の対物レンズを使用)。
5. REShAPE分析
注:REShAPE AIベースのアルゴリズムは10倍と20倍の画像でトレーニングされているため、画像撮影時には 10倍または20倍の対物レンズを使用することを強くお勧めします 。そうでない場合は、それに応じて画像を再スケーリングする必要があります。
- 画像が複数の蛍光チャンネルで取得される場合は、セル境界の取得に使用したチャンネルを分離します。画像を16ビットグレースケールTIFファイルとしてエクスポートします。
注: ファイル拡張子が .czi の画像は、TIF ファイルとしてエクスポートする必要はありませんが、セルの境界線を含むチャネルを分離する必要があります。 - Windows x64 または Linux (Centos 7) プラットフォームにソフトウェアをインストールします。
注意: ソフトウェアとインストールの手順は、https://github.com/nih-nei/REShAPE にあります。 - ソフトウェアを開きます(図1)。
- [ディレクトリ] タブで、入力フォルダーと出力フォルダーを選択します。入力ディレクトリで、イメージを含むフォルダーを選択します。出力ディレクトリで、ソフトウェアにパスを自動的に「入力ディレクトリ/処理済み」に変更させます。または、出力ディレクトリを手動で変更します。
注:ソフトウェアは、入力フォルダに含まれるすべての画像を反復処理します。 - [NN セグメンテーション オプション] タブで、イメージ セグメンテーションの次の設定を選択します。
- バッチ サイズ: 適切な開始点としてテキスト ボックスに値 20 を入力しますが、システムがグラフィックス処理装置 (GPU) を使い果たした場合は値を小さくします。
注:元の画像は、処理のために小さなタイルに分割されます。バッチ サイズは、一度に処理できるタイルの数を指定します。 - GPUを使用?: システムに十分なGPUリソースがない場合は、[ いいえ]チェックボックスをオンにします。
- 内部スケール:ドロップダウンメニューを使用して、画像が10倍または20倍の対物レンズで取得されなかった場合は、内部スケーリングを[なし]から変更します。たとえば、1/2ボタンを使用して40倍の画像を半分のサイズに縮小します。ドロップダウンメニューで使用できる再スケーリングオプションは次のとおりです:5x、2x、なし、1/2、1/5。
注: 機械学習は、10 倍と 20 倍の画像でトレーニングされました。他の倍率で撮影した画像からはセルの境界線が認識されない場合があります。この場合、バイナリ画像は完全に黒で表示されます。 - Arti フィルター:アーティファクトフィルタータブを使用して、画像に存在し、細胞の境界セグメンテーションを妨げる可能性のある非常に明るい粒子(網膜または視神経の周りの結合組織の破片または小さな部分)を除去します。既定では、フィルターは使用されません。ドロップダウンメニューの人工フィルターオプションは次のとおりです:通常、強、弱。
- バッチ サイズ: 適切な開始点としてテキスト ボックスに値 20 を入力しますが、システムがグラフィックス処理装置 (GPU) を使い果たした場合は値を小さくします。
- [ タイル イメージ オプション ] タブで、テキスト ボックスに値を挿入し、[ パッド タイル] パラメーターを調整して、イメージ タイル間のオーバーラップの量を指定します。通常、100ピクセルのオーバーラップがうまく機能します。
- [ 出力グラフィックオプション] タブで、ヒートマップ生成の設定を調整します。
- タイル画像の再構築: 大きな画像の解析に十分なリソースがシステムにある場合は、[ いいえ ]チェックボックスをオンにして、画像全体を再構築せずに個々のタイルを保存して解析を完了できるようにします。
- カラー画像の作成:ヒートマップを生成するには、ドロップダウンメニューから [すべて ]を選択します。
- [カラーリング]で、ドロップダウンメニューで使用可能なさまざまなカラーパレットのいずれかを選択します:サーマル、グリーン、Mpl-マグマ、フェーズ、ファイア、ジェット、シアンホット。
- [画像形式] で、タブ内のオプションの 1 つを選択して、画像を TIF または PNG として保存します。
- [ 手動制限を使用] 機能に関しては、[ いいえ ]チェックボックスをオンにして、各画像で検出された最小値と最大値をソフトウェアが使用できるようにします。[ はい ] チェックボックスをオンにして各形状メトリック ヒートマップの値の範囲を手動で調整し、[ 制限の設定] ボタンをクリックして、テキスト ボックスに値を挿入して個々のパラメーターの範囲を選択します。目的の値を変更したら、[ 保存]をクリックします。[ デフォルトのロード] をクリックして、すべての制限をリセットします。
注:細胞の形状に対するさまざまな化合物の影響を比較する場合など、複数の画像のヒートマップを比較する必要がある場合は、手動制限を使用します。この方法では、同じ範囲の値が使用されます。手動で入力する値のセットは、サンプルのタイプによって異なります。最適な範囲を選択するために、数回の反復を実行することをお勧めします。
- [解析のセル サイズ制限]タブで、解析のセル サイズのしきい値 を選択します。
- [小さいセル サイズ] で、分析に含める最小のセルのサイズをテキスト ボックスに挿入します。
- [上位セル サイズ] で、分析に含める最大のセルのサイズをテキスト ボックスに挿入します。
注 : セル サイズの単位は、[ 自動単位変換] タブで選択したオプションに応じて、ピクセルからマイクロメートルの 2 乗に変わります。
- [自動単位変換]タブで、解析に使用する単位を選択します。
- [ ピクセルを実単位に変換] で、[ いいえ ] チェックボックスをオンにして、ピクセル単位で解析を実行します。[ はい ] チェックボックスをオンにして、マイクロメートル単位で分析を実行します。
- [縮尺記号の長さ (ピクセル)] で、テキスト ボックスにピクセル値を入力します。
- [縮尺記号の長さ (ミクロン)] に、テキスト ボックスに対応する距離をマイクロメートル単位で入力します。
- 分析を開始するには、[ Go For It] を押します。
注:このソフトウェアは、細胞が4',6-ジアミジノ-2-フェニルインドール(DAPI)およびヨウ化プロピジウム(CZIオプション タブ)で染色されている場合の細胞生存率を測定することもできますが、これはRPEフラットマウントには適用されません。
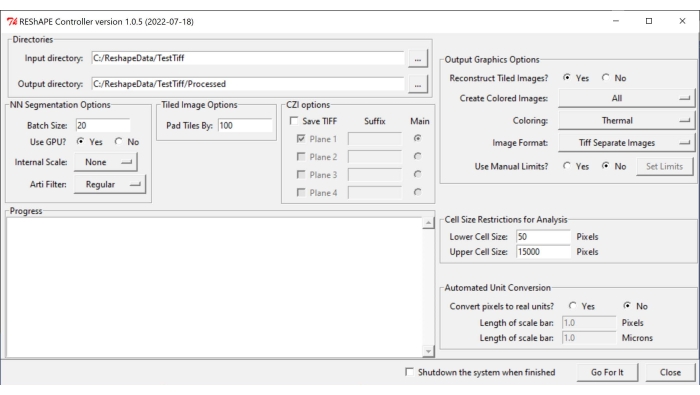
図1:REShAPEグラフィカルユーザーインターフェイス。 GUI には、作業ディレクトリの選択 ([ディレクトリ ] タブ)、セグメンテーション オプションの変更 ([NN セグメンテーション オプション] タブと [ タイル イメージ オプション] タブ)、解析のパラメーターの指定 ([解析のセル サイズ制限 ] タブと [ 自動単位変換 ] タブ)、およびヒートマップ生成 ([出力グラフィックス オプション] タブ) を行うためのさまざまなタブがあります。省略形: GUI = グラフィカル ユーザー インターフェイス。 この図の拡大版を表示するには、ここをクリックしてください。
結果
このプロトコルにより、フラットマウントのシングルプレーン画像が作成され、正しく識別されたRPEセルごとにセルの位置と30の形状メトリックが測定されます(図2)。入力ディレクトリ内に「処理済み」という名前のフォルダが自動的に生成されます。このフォルダーには、「分析」、「色分け」、「結合ファイル」、「セグメント化された画像」という名前の 4 つのサブディレクトリと、分析中に生成されたいくつかの一時ファイルが含まれています。「結合されたファイル」フォルダには、すべての形状測定値を含むスプレッドシートと、結合されたすべてのファイルのセル近傍数の頻度を含むスプレッドシートが含まれています。「分析」フォルダには、すべての形状測定値を含むスプレッドシートと、各画像のセル近傍数の頻度を個別に含むスプレッドシートが含まれています。「セグメント化された画像」ディレクトリには、RPEセルの境界線の最後のバイナリマスクが含まれています。セグメンテーションの品質を評価するために使用できます。「色分け」ディレクトリには、各画像の形状パターンを視覚化するための各形状測定のヒートマップが含まれています。形状メトリックの定義と略語は 、表 1 に記載されています。
RPEフラットマウントには、特に視神経の周りで、きれいに除去されなかった網膜の残留片が含まれている場合があります。サンプルのファロイジン染色は、網膜からの強いシグナルをもたらし、これはRPE細胞境界セグメンテーションに問題を引き起こす可能性があります。一部のタイルは完全に黒で表示されますが、周囲のタイルは通常のセグメンテーションを示します。画像に存在する可能性のある他の明るいオブジェクトも、黒いタイルの生成を引き起こします(図3)。このような場合、[Arti Filter]ドロップダウンメニューで使用可能なフィルタリングオプション(弱、通常、強)のいずれかを選択すると、黒いタイルの形成を防ぐことができます。
REShAPE は、8 ビットまたは 16 ビットのグレースケール画像を入力として受け取りますが、RGB 画像は受け取りません。REShAPE分析にRGB画像を使用すると、完全に黒いバイナリ画像が生成されます。この場合、RGB画像をグレースケールに変換すると、正しくセグメント化されたバイナリ画像が生成されます(図4)。染色が最適でない場合や、サンプルが傷によって損傷した場合(図5A)、細胞の大きな塊が単一の非常に大きな細胞として識別される場合があります(図5B)。この場合、セルサイズの閾値を小さくすることで、大きなオブジェクトを解析から除外できます(図5C)。これは、[上限セル サイズ] テキスト ボックスに小さい値を挿入することで実現できます。ただし、これによりヒートマップの範囲が変更されます。研究者がそうすることを選択した場合、手動制限の使用の[はい]チェックボックスをオンにすることで、元のヒートマップ範囲(図5D)を維持することもできます。その後、研究者は[制限の設定]ボタンを左クリックし、テキストボックスに目的の値を挿入して、手動の制限を指定する必要があります。
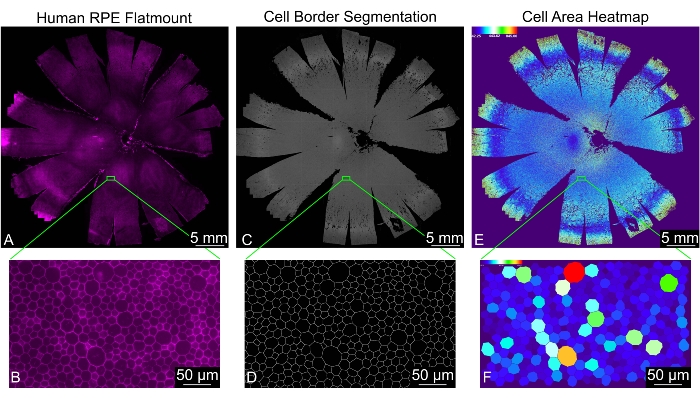
図2:ヒトRPE単層全体の完全な形態測定解析。 (A)ヒトRPE/脈絡膜フラットマウント全体の低倍率図(マゼンタ:ファロイジン)。(B)ファロイジン染色RPE細胞のズームインビュー。(C)REShAPEが生成したヒトRPE /脈絡膜フラットマウント全体のRPE細胞境界のセグメンテーション、および(D)対応するズームインビュー。(E)人間のフラットマウント全体における個々のRPEセルのセル領域を示すソフトウェア生成ヒートマップ。左上隅の温度スケールは、使用される値の範囲を示します。(F)領域によって色分けされた個々のRPEセルを示す対応するズームインビュー。スケールバー = (B、D、F) 50 μm、(A、C、E) 5 mm。略称:RPE =網膜色素上皮。 この図の拡大版を表示するには、ここをクリックしてください。
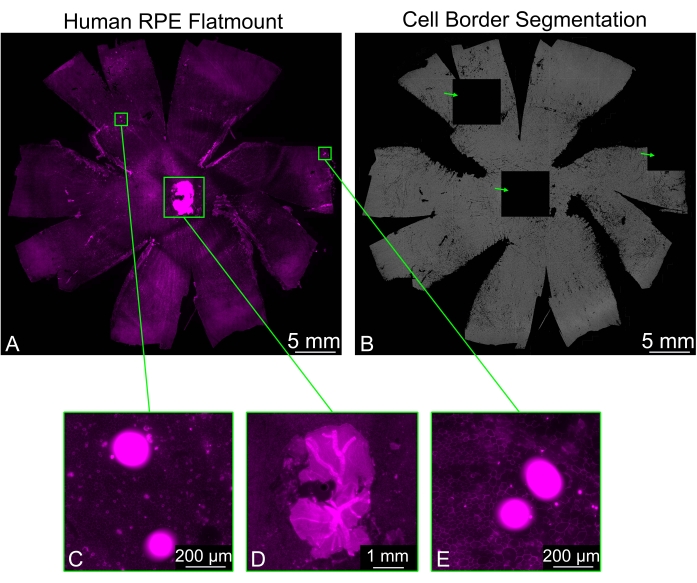
図3:明るいアーティファクトのフィルタリング。 (A)細胞境界(マゼンタ:ファロイジン)で染色されたヒトRPEフラットマウントは、セグメンテーションを妨げる明るい領域(緑色の長方形)を示す可能性があります。(B)フラットマウント全体のRPE細胞境界セグメンテーションには、蛍光の明るい領域に対応する3つの完全に黒いタイル(緑色の矢印)が含まれています。(C,E)黒いタイルのうち2つは、明るい点を含む領域に対応しており、おそらく破片です。(D)黒いタイルの1つは、視神経の周りの神経網膜片によって生成され、正しく除去されませんでした。神経網膜の断片はRPE層よりもかなり明るく、細胞のセグメンテーションを妨げます。この図の拡大版を表示するには、ここをクリックしてください。

図4:入力画像の必要条件。 細胞境界について染色されたRPE細胞は、REShAPE分析のために(A)RGBまたは(B)グレースケール16ビット画像として保存されました。(C)RBG画像解析の出力は黒バイナリ画像であり、(D)グレースケール画像の解析はセル境界の正しくセグメント化されたバイナリを生成する。REShAPEは、8ビットまたは16ビットのグレースケール画像のみを分析できます。スケールバー= 50μm。 この図の拡大版を表示するには、ここをクリックしてください。

図5:最適ではない結果 。 (A)ファロイジンで染色した細胞が誤って傷ついたRPE単分子膜の一部の画像。(B)セル面積の次元で色分けされたRPEセルのヒートマップ。セル サイズの上限閾値が大きい場合は、解析に大きなオブジェクトが含まれます。(C) 解析から大きなオブジェクトを除外するために、セル サイズの上限閾値を小さく選択したセル領域のヒートマップ。(D)セル領域のヒートマップで、セルサイズの上限しきい値を小さくし、手動で制限を設定して、元々使用されていたヒートマップ範囲を維持します。 この図の拡大版を表示するには、ここをクリックしてください。
表 1: REShAPE パラメータ。 この表には、各パラメータの定義と、生のスプレッドシート(「_Data.csv」ファイル)およびヒートマップで使用される略語が報告されています。 この表をダウンロードするには、ここをクリックしてください。
ディスカッション
ヒトRPEと網膜の一貫した効率的な分離は、このプロトコルを使用して達成できます。この方法により、ヒト網膜全体にわたるRPE形状の地域差の研究が可能になります5。プロトコルの重要なステップは、RPEと網膜の物理的な分離です。2つの組織が一部の領域で完全に剥離していない場合は、網膜を静かに持ち上げて、組織を壊さないようにする必要があります。大型フラットマウントのREShAPE解析では、かなりのRAMリソースを備えたシステムの使用が必要になる場合があります。この場合、画像全体の再構成を無効にして、処理リソースが不足しているにもかかわらず、ソフトウェアが分析を正常に完了できるようにすることができます。
REShAPEを使用してヒトRPEフラットマウントをセグメント化することの主な制限は、AIアルゴリズムが主に人工多能性幹細胞由来RPEの画像でトレーニングされたことです。その結果、人間のRPEフラットマウントのセグメンテーションの精度が低下します。高齢ドナー由来のRPE細胞には大量のリポフスチン7が含まれており、その自家蛍光の広いスペクトルが細胞境界セグメンテーションを妨げます。将来的には、この種のサンプルの細胞境界セグメンテーションを改善するために、RPEフラットマウントのより多くの画像が使用される予定です。この制限にもかかわらず、REShAPEはRPE細胞の境界を認識してセグメント化するように特別に訓練されており、RPE細胞のボロノイ8 やセルプロファイラー9 セグメンテーションなどの他の既存の方法よりも優れたパフォーマンスを発揮します。
さらに、手動セグメンテーション10と比較して、REShAPEは大きな画像を迅速に分析できるという利点があります(~130,000ピクセルx 130,000ピクセルがテストされました)。結論として、この解剖方法は再現性が高く、他の動物モデルに容易に拡張することができます。さらに、このソフトウェアを使用して、目のフラットマウントまたは細胞培養モデルでRPE形状を研究し、特定の治療の効果を調べることができます。最後に、REShAPEの汎用性により、他のタイプの上皮細胞の分析に広く適用できます。
開示事項
著者は開示する利益相反を持っていません。
謝辞
Zeiss Axio Scan.Z1を使用してくださった国立眼科研究所(NEI)の組織学コアに感謝します。また、寄付者とその家族、アドバンス・サイト・ネットワーク、ライオンズ眼科研究所の寛大さにも感謝します。この作業は、NEI IRP基金(助成金番号ZIA EY000533-04)によって支援されました。
資料
| Name | Company | Catalog Number | Comments |
| Biopsy punch 1.5 mm | Acuderm Inc. | P1525 | |
| Bovine albumin | MP Biomedicals | 160069 | |
| Coverglass 50 x 75 mm, #1.5 thickness | Brain Research Laboratories | 5075-1.5D | |
| Curved spatula | Katena | K3-6600 | |
| D-Mannitol | Sigma | M9546 | |
| DPBS 1x with Ca2+ and Mg2+ | Gibco | 14040-133 | |
| Fine Scissors | Fine Science Tools | 14558-11 | |
| Fluormount-G | Southern Biotech | 0100-01 | |
| Forceps - Dumont #5 | Fine Science Tools | 11252-23 | |
| Microscope slides 50 x 75 x 1.2 mm | Brain Research Laboratories | 5075 | |
| Needles 21 G x 1-1/2" hypodermic | Becton Dickinson (BD) | 305167 | |
| Needles 27 G x 1-1/4" hypodermic | Becton Dickinson (BD) | 305136 | |
| Paraformaldehyde 16% | Electron Microscopy Sciences | 15710 | |
| Petri dish 100 mm | Corning | 430167 | |
| Phalloidin-iFluor 647 | Abcam | ab176759 | |
| Razor blades | PAL (Personna) | 62-0177 | |
| Round bottom tubes 50 mL | Newegg | 9SIA4SR9M88854 | |
| Silicon Elastomer Kit | Dow Corning Corporation | 4019862 | |
| Square weighing boat (81 mm x 81 mm x 25 mm) | Sigma | W2876 | |
| Surgical Vitrectomy System | BD Visitrec | 585100 | optional |
| Syringe 1 mL | Becton Dickinson (BD) | 309659 | |
| Triton X-100 | Sigma | T9284 | |
| TrueBlack | Biotium | 23007 | autofluorescence quencher |
| Tween 20 | Affymetrix | 20605 | |
| Vannas Spring Scissors - 3 mm cutting edge | Fine Science Tools | 15000-10 |
参考文献
- Endo, E. G., Yao, X. Y., Marmor, M. F. Pigment adherence as a measure of retinal adhesion: Dependence on temperature. Investigative Ophthalmology and Visual Science. 29 (9), 1390-1396 (1988).
- Marmor, M. F. Retinal detachment from hyperosmotic intravitreal injection. Investigative Ophthalmology and Visual Science. 18 (12), 1237-1244 (1979).
- Marmor, M. F., Martin, L. J., Tharpe, S. Osmotically induced retinal detachment in the rabbit and primate. Electron microscopy of the pigment epithelium. Investigative Ophthalmology and Visual Science. 19 (9), 1016-1029 (1980).
- Ban, Y., Rizzolo, L. A culture model of development reveals multiple properties of RPE tight junctions. Molecular Vision. 3, 18(1997).
- Ortolan, D., et al. Single-cell-resolution map of human retinal pigment epithelium helps discover subpopulations with differential disease sensitivity. Proceedings of the National Academy of Sciences of the United States of America. 119 (19), 2117553119(2022).
- Schaub, N. J., et al. Deep learning predicts function of live retinal pigment epithelium from quantitative microscopy. Journal of Clinical Investigation. 130 (2), 1010-1023 (2020).
- Beatty, S., Koh, H. -H., Phil, M., Henson, D., Boulton, M. The role of oxidative stress in the pathogenesis of age-related macular degeneration. Survey of Ophthalmology. 45 (2), 115-134 (2000).
- Liu, Z., Kocaoglu, O. P., Miller, D. T. 3D imaging of retinal pigment epithelial cells in the living human retina. Investigative Ophthalmology and Visual Science. 57 (9), 533-543 (2016).
- Bhatia, S. K., et al. Analysis of RPE morphometry in human eyes. Molecular Vision. 22, 898-916 (2016).
- vonder Emde, L., et al. Histologic cell shape descriptors for the retinal pigment epithelium in age-related macular degeneration: A comparison to unaffected eyes. Translational Vision Science & Technology. 11 (8), 19(2022).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved