Method Article
从人眼高效、一致地生成视网膜色素上皮/脉络膜平面安装,用于组织学分析
摘要
我们描述了一种有效地将视网膜色素上皮(RPE)与人眼视网膜分离并生成整个RPE /脉络膜平板安装以用于RPE的组织学和形态学分析的方法。
摘要
视网膜色素上皮(RPE)和视网膜是功能和结构上相连的组织,它们共同调节光感知和视觉。RPE顶端表面上的蛋白质与感光器外段表面上的蛋白质紧密相关,因此难以始终如一地将RPE与感光器/视网膜分开。我们开发了一种有效地将视网膜与人眼的RPE分离的方法,以产生完整的RPE /脉络膜和视网膜平面安装,用于光感受器和RPE细胞的单独细胞分析。玻璃体内注射D-甘露醇的高渗透压溶液(一种不由RPE转运的糖)诱导RPE和视网膜在整个后房分离,而不会对RPE细胞连接造成损害。没有观察到附着在视网膜上的RPE贴片。肌动蛋白的鬼笔环肽标记显示RPE形状保留,并允许对整个上皮进行形态测量分析。开发了一种基于人工智能 (AI) 的软件,用于准确识别和分割 RPE 细胞边界并量化 30 种不同的形状指标。这种解剖方法具有高度可重复性,可以很容易地扩展到其他动物模型。
引言
视网膜色素上皮(RPE)和神经视网膜由于光感受器对RPE的强烈生理依赖性而相互紧密相连。在解剖过程中,神经视网膜与RPE的机械分离导致RPE细胞撕裂,RPE的顶端部分仍然附着在视网膜光感受器的外段上。RPE-视网膜粘附的程度如此之大,以至于分离后残留在视网膜上的色素量被用来量化视网膜粘附的强度1。具体来说,RPE紧密连接和连接它们的肌动蛋白结构位于顶端侧,在机械分离过程中断裂。因此,对细胞边界的RPE平面贴片进行染色会导致斑片状单层,其中许多细胞缺少边界。当在解剖前用多聚甲醛(PFA)固定组织时,这种效应会加剧,因为蛋白质会交联。
玻璃体内药物递送研究表明,在后房注射高渗溶液可诱导视网膜脱离2,3。在这些实验中,将 50 μL 不同的溶液(范围从 1,000 mOsm 到 2,400 mOsm)注射到玻璃体中,几分钟内导致视网膜脱离。值得注意的是,即使在长时间暴露于高渗透压溶液后,RPE紧密连接在兔眼和猴眼的透射电子显微镜图像中也完好无损3。遵循类似的策略,我们在进行RPE解剖之前将D-甘露醇的高渗溶液注入玻璃体中段,以诱导有效的视网膜脱离。由于 D-甘露醇不通过 RPE4 转运,因此保持高玻璃体内浓度,产生渗透压梯度。RPE和视网膜在整个后房中的有效分离保证了RPE细胞连接的保存,并允许在整个平板上研究RPE形态测量。此外,我们开发了一种基于人工智能 (AI) 的软件,该软件可以识别和分割荧光标记的 RPE 细胞边界,量化 30 种不同的形状指标,并为可视化5,6 生成每个指标的热图。
研究方案
尸体人体地球仪是从先进视力网络(阿拉巴马州伯明翰)获得的。对尸体组织进行的工作由NIH机构审查委员会从研究伦理委员会豁免。
1. 眼球出货
- 眼球摘除后,将新鲜眼球装在装有冰冷的DPBS 1x的容器中,其中含有Ca 2+和Mg2+。
注意:最好在眼球摘除后24小时内解剖眼睛。在此时间窗口内,RPE 形态不会改变。
2.硅胶模具准备
- 切割直径为 25 mm 的圆底管的底部 20 mm。将其放在方形称重船(81 mm x 81 mm x 25 mm)的底部。
- 以 10:1 的比例混合硅弹性体套件的两种成分,注意不要滞留空气。将混合物倒入装有圆底管球形片的称量舟中。
- 将硅胶在室温下固化过夜。从固化的硅胶模具中取出称量舟和圆底管。
3. RPE 解剖
- 清洁新鲜眼球的巩膜肌肉和结缔组织。使用穿过巩膜的 27 G 针将眼睛固定在硅胶模具上。用DPBS 1x填充模具的型腔,其中Ca 2+和Mg2+。
注意:注意不要破坏眼腔。针头只能穿过巩膜。 - 使用 1 mL 注射器和 21 G 针头将 ~400 μL 1,700 mOsm D-甘露醇溶液注入玻璃体。将针头插入扁平部,以避免刺穿眼睛的前房。在室温下离开眼睛~45分钟。
- 用一把细剪刀和镊子在扁平处切开前房。用 DPBS 1x 填充后眼室,其中含有Ca 2+ 和 Mg2+。在体视显微镜下,定位黄斑(视网膜上的黄色斑点)。
- 如果有手术玻璃体切割器,请取出玻璃体并用含有Ca 2+ 和 Mg2+ 的 DPBS 1x 替换玻璃体。或者,尝试用镊子提起玻璃体并用细剪刀剪开。
- 注意保留黄斑区域,将眼睛切成象限:鼻,颞,上和下。如果针头挡住了,请取下针头。
- 将蝴蝶状的眼睛后房转移到含有DPBS 1x的100mm培养皿中,其中Ca2 + 和Mg2+。在移除视网膜之前,通过在睫状边缘做一个小切口(V形)来标记包含黄斑的花瓣。抬起并切开视网膜上的所有玻璃体。
- 用弯曲的刮刀或一对镊子从多个侧面轻轻抬起视网膜,以检查视网膜是否已从RPE中分离,并让一些液体在两层之间循环。
注意:视网膜仍将附着在最外围(睫状边缘)和视神经处。 - 从所有花瓣的睫状边缘切下视网膜,确保不会划伤 RPE。将组织置于4%PFA中并孵育~1小时。用 DPBS 清洗 3 倍 1x 与钙2+ 和镁2+。将组织转移到装有DPBS 1x的容器中,并储存在4°C。
注意:此时,视网膜仅附着在视神经处。这是本实验中的一个暂停点。 - 将样品转移到含有DPBS 1x的100mm培养皿中,其中Ca 2+和Mg2+。用 1.5 mm 活检打孔打出视神经头并收集视网膜。将神经视网膜储存在DPBS 1x中,在4°C下含有Ca2 +和Mg2+。
注意:在冲出视神经头之前,请确保尽可能在巩膜侧切断视神经。这将提高冲头的精度。在平贴固定在 4% PFA 中后,冲出视神经可减少对位于视神经周围的 RPE 细胞的损伤。 - 通过从外围轻轻提起 RPE/脉络膜层并用一把 Vannas弹簧剪刀切割巩膜和 RPE 之间的脉络膜血管和结缔组织,从 RPE/脉络膜上去除巩膜。一旦 RPE/脉络膜与巩膜完全分离,收集 RPE/脉络膜层。将组织转移到装有 DPBS 1x 的容器中,其中装有Ca 2+ 和 Mg2+ ,并将其储存在 4°C。
注意:此时,实验可以暂停。
4. 染色
- 将RPE /脉络膜转移到 6 孔板的一个孔中。在室温下用 Ca 2+ 和 Mg 2+ 用 1% 牛血清白蛋白 (BSA)、0.5% 吐温20 和 0.5% Triton X-100 在 DPBS 1x 中封闭和透化样品 1 小时。
- 将样品与与647荧光团偶联的鬼笔环肽在DPBS 1x中以1:250稀释度与Ca2 +和Mg 2+与1%BSA,0.5%吐温20 和0.5%Triton X-100在室温下孵育1小时。在 DPBS 1x 中用Ca 2+ 和 Mg2+ 洗涤 3 倍。
- 将 RPE/脉络膜样品转移到 50 mm x 75 mm 载玻片上并压平。将每个"花瓣"切成两片,使样品更平坦。注意黄斑。用疏水笔绘制平面安装的轮廓。
- 要淬灭脂褐素自发荧光,加入 500 μL 在 70% 乙醇中稀释至 1:20 的自发荧光淬灭剂溶液,并在室温下孵育 2 分钟。
- 在DPBS 1x中用Ca 2+和Mg2+彻底清洗(至少3倍)。取下 DPBS 并添加安装介质。将盖玻片放在平板上并用指甲油密封。
- 用荧光显微镜对平面安装进行成像(最好使用10倍或20倍物镜)。
5. 研究分析
注意:由于基于 REShAPE AI 的算法是在 10x 和 20x 图像上训练的,因此强烈建议在成像时使用 10x 或 20x 物镜 。如果没有,则需要相应地重新缩放图像。
- 如果使用多个荧光通道采集图像,请隔离用于获取细胞边界的通道。将图像导出为 16 位灰度 TIF 文件。
注意:使用文件扩展名为 .czi 获取的图像不需要导出为 TIF 文件,但仍需要隔离包含单元格边框的通道。 - 在 Windows x64 或 Linux (Centos 7) 平台上安装软件。
注:软件和安装说明可在 https://github.com/nih-nei/REShAPE 中找到。 - 打开软件(图1)。
- 在 目录 选项卡中,选择输入和输出文件夹。在 输入目录中,选择包含图像的文件夹。在 输出目录中,让软件自动将路径更改为"输入目录/已处理"。或者,手动更改输出目录。
注意:软件将循环访问输入文件夹中包含的所有图像。 - 在" NN 分割选项" 选项卡中,选择以下图像分割 设置 :
- 批大小:在文本框中键入值 20 作为良好的起点,但如果系统图形处理单元 (GPU) 用完,则减小该值。
注意:原始图像被拆分为较小的图块进行处理。批大小指定一次可以处理的切片数。 - 使用 GPU?:如果系统没有足够的 GPU 资源,请选中 "否"框。
- 内部缩放:使用下拉菜单,在图像不是使用 10x 或 20x 物镜采集的情况下,将内部缩放比例从无更改为 无 。例如,使用 1/2 按钮将 40 倍图像缩小到一半大小。下拉菜单中可用的重新缩放选项如下: 5x,2x,无,1/2,1/5。
注意:机器学习是使用 10x 和 20x 图像训练的。它可能无法从以其他放大倍率拍摄的图像中识别细胞边界。在这种情况下,二进制图像将显示为完全黑色。 - 伪影滤镜:使用伪影滤镜选项卡去除图像中可能存在的非常明亮的颗粒(视网膜碎片或视网膜或视神经周围的结缔组织的小部分),并可能干扰细胞边界分割。默认情况下不使用任何筛选器。下拉菜单中的人工过滤器选项如下: 常规、强和 弱。
- 批大小:在文本框中键入值 20 作为良好的起点,但如果系统图形处理单元 (GPU) 用完,则减小该值。
- 在平 铺图像选项 选项卡中,在文本框中插入一个值,以通过调整拼 贴依据 参数来指定图像拼贴之间的重叠量。100 像素的重叠通常效果很好。
- 在 输出图形选项 选项卡中,调整热图生成的设置:
- 重建平铺图像?:如果系统没有足够的资源来分析大图像,请选中 "否 "框以允许软件通过保存单个切片而不重建整个图像来完成分析。
- 创建彩色图像:要生成热图,请从下拉菜单中选择 全部 。
- 对于 着色,请选择下拉菜单中可用的任何不同调色板: 热、绿色、MPL 岩浆、相位、火、喷射、青色热。
- 对于 图像格式,通过选择选项卡中的选项之一将图像另存为 TIF 或 PNG。
- 关于 "使用手动限制?" 功能,选中 "否 "框,让软件使用在每个图像中检测到的最小值和最大值。选中" 是 "框以手动调整每个形状指标热图的值范围,然后单击 "设置限制 "按钮,通过在文本框中插入值来选择各个参数的范围。更改感兴趣的值后,单击 保存。单击加载 默认值 以重置所有限制。
注意:如果需要比较来自多个图像的热图,例如在比较不同化合物对细胞形状的影响时,请使用手动限制。这样,将使用相同的值范围。要手动输入的值集因样品类型而异。建议运行几次迭代以选择最佳范围。
- 在 分析的像元大小限制 选项卡中,选择用于分析的 像元大小阈值 :
- 在 "较低的像元大小"中,在文本框中插入要包含在分析中的最小像元的大小。
- 在 "上单元格大小"中,在文本框中插入要包含在分析中的最大单元格的大小。
注意:像元大小的单位从像素变为微米平方,具体取决于在 "自动单位转换 "选项卡中选择的选项。
- 在 "自动单位换算 "选项卡中,选择分析的首选单位:
- 在 将像素转换为实数单位?中,选中 否 框以像素单位运行分析。选中 是 框以微米为单位运行分析。
- 在 比例尺长度(像素)中,在文本框中输入像素值。
- 在 比例尺长度(微米)中,在文本框中输入相应的距离(以微米为单位)。
- 要开始分析,请按"开始"。
注意:当用4',6-二脒基-2-苯基吲哚(DAPI)和碘化丙啶(CZI选项 选项卡)染色细胞时,该软件还可以测量细胞活力,但这不适用于RPE平板安装。
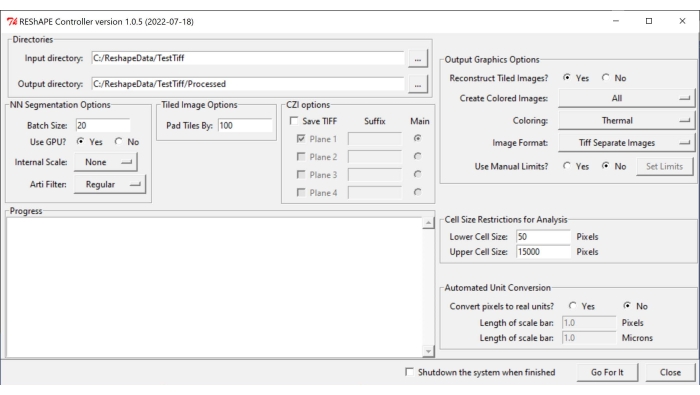
图 1:REShAPE 图形用户界面。 GUI 具有不同的选项卡,用于选择工作目录(目录 选项卡)、修改分割选项(NN 分割 选项和平 铺图像 选项选项卡)、指定分析参数(分析的像元大小限制 和 自动单位转换 选项卡)以及热图生成(输出图形选项 选项卡)。缩写:GUI = 图形用户界面。 请点击此处查看此图的大图。
结果
该协议产生平面贴装的单平面图像,其中测量每个正确识别的RPE单元的单元位置和30个形状指标(图2)。在输入目录中自动生成一个名为"已处理"的文件夹。此文件夹包含四个子目录,分别名为"分析"、"颜色编码"、"组合文件"和"分割图像",以及分析期间生成的一些临时文件。"合并文件"文件夹包含一个包含所有形状测量值的电子表格和一个包含所有文件合并的单元格邻居计数频率的电子表格。"分析"文件夹包含一个包含所有形状测量值的电子表格和一个电子表格,其中包含每个图像的相邻单元格计数频率。"分段图像"目录包含 RPE 单元格边框的最终二进制掩码;它可用于评估细分的质量。"颜色编码"目录包含每个形状测量的热图,以可视化每个图像中的形状图案。形状度量定义和缩写可在 表 1 中找到。
有时 RPE 平板安装可能包含未干净去除的残余视网膜碎片,尤其是在视神经周围。样品的鬼笔环肽染色导致来自视网膜的强信号,这可能会导致RPE细胞边界分割的问题。有些图块将显示为完全黑色,而周围的图块将显示正常的分割。图像中可能存在的其他明亮物体也会导致黑色瓷砖的生成(图3)。在这些情况下,选择 Arti 过滤器下拉菜单中可用的过滤选项之一(弱、常规、强)将防止形成黑色图块。
REShAPE 采用 8 位或 16 位灰度图像作为输入,但不接受 RGB 图像。使用RGB图像进行REShAPE分析将产生完全黑色的二进制图像。如果发生这种情况,将RGB图像转换为灰度将产生正确分割的二进制图像(图4)。在某些无法正确识别RPE边界的情况下,例如,如果染色不是最佳的,或者如果样品被划痕损坏(图5A),可以将大细胞团块识别为单个非常大的细胞(图5B)。在这种情况下,可以通过减小细胞大小阈值从分析中排除大型物体(图5C)。这可以通过在"单元格大小上限"文本框中插入较低的值来实现。但是,这将导致热图范围发生变化。如果研究人员选择这样做,也可以通过选中"使用手动限制?"功能中的"是"框来保持原始热图范围(图 5D)。随后,研究人员必须左键单击"设置限制"按钮,并在文本框中插入所需的值以指定手动限制。
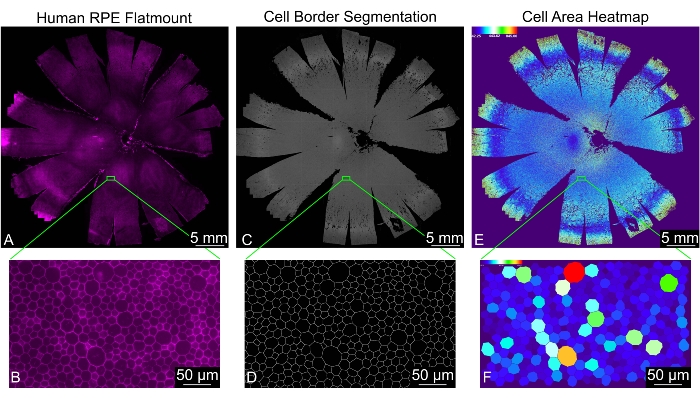
图 2:整个人类 RPE 单层的完整形态测量分析。 (A) 整个人类 RPE/脉络膜平面安装(洋红色:鬼笔环肽)的低放大倍率视图。(B)鬼笔环肽染色的RPE细胞的放大视图。(C) REShAPE 生成的整个人类 RPE/脉络膜平面安装的 RPE 细胞边界分割和 (D) 相应的放大视图。(E)软件生成的热图,说明整个人类平板安装中单个RPE细胞的细胞面积。左上角的热刻度显示使用的值范围。(F) 相应的放大视图,显示按区域着色的各个 RPE 单元格。比例尺 = (B,D,F) 50 μm, (A,C,E) 5 mm。缩写:RPE = 视网膜色素上皮。请点击此处查看此图的大图。
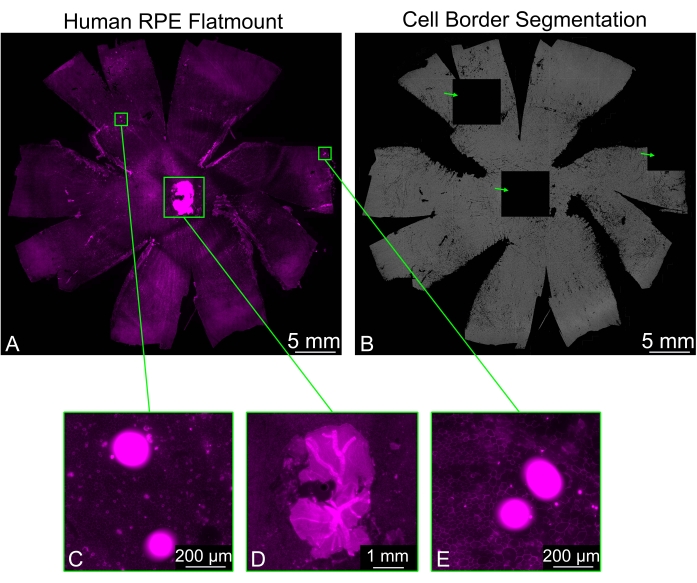
图 3:过滤明亮伪影。 (A)对细胞边界(洋红色:鬼笔环肽)进行染色的人RPE平面安装可以呈现干扰分割的明亮区域(绿色矩形)。(B)整个平板安装的RPE单元边界分割包含三个完全黑色的瓷砖(绿色箭头),对应于明亮的荧光区域。(中,E)其中两个黑色瓷砖对应于包含亮点的区域,这些亮点可能是一些碎片。(D)其中一块黑色瓷砖是由视神经周围的一块神经视网膜产生的,该视网膜未被正确移除。神经视网膜的碎片比RPE层亮得多,阻碍了细胞分割。请点击此处查看此图的大图。

图 4:输入图像要求。 将染色为细胞边界的RPE细胞保存为(A)RGB或(B)灰度16位图像,用于REShAPE分析。(C)RBG图像分析的输出是黑色二值图像,(D)而灰度图像的分析产生正确分割的细胞边界二进制。REShAPE只能分析8位或16位灰度图像。比例尺 = 50 μm。 请点击此处查看此图的大图。

图 5:次优结果 。 (A)RPE单层的一部分的图像,其中用鬼笔环肽染色的细胞被意外划伤。(B) 按细胞面积维度着色的 RPE 细胞的热图。较大的像元大小上限阈值包括分析中的大型对象。(C) 细胞区域热图,其中选择较小的上单元大小阈值以从分析中排除大型对象。(D) 细胞区域热图,其中选择较小的细胞大小上限阈值并设置手动限制以保持最初使用的热图范围。 请点击此处查看此图的大图。
表 1:REShAPE 参数。 该表报告了每个参数的定义以及原始电子表格("_Data.csv"文件)和热图中使用的缩写。 请按此下载此表格。
讨论
使用该协议可以实现人类RPE和视网膜的一致和有效的分离。该方法允许研究整个人类视网膜中RPE形状的区域差异5。该方案中的一个关键步骤是RPE和视网膜的物理分离。如果两个组织在某些区域没有完全分离,则应轻轻抬起视网膜,确保不会破坏组织。大型平板安装的REShAPE分析可能需要使用具有大量RAM资源的系统。在这种情况下,可以禁用整个图像的重新组装,以允许软件在缺乏处理资源的情况下成功完成分析。
使用 REShAPE 分割人类 RPE 平板安装的主要限制是,AI 算法主要是在诱导多能干细胞衍生 RPE 的图像上进行训练的。因此,人类RPE平板安装的分割不太准确。来自老年供体的RPE细胞含有大量的脂褐素7,其自发荧光的广谱干扰细胞边界分割。将来,更多的RPE平面安装图像将用于改善此类样品中的细胞边界分割。尽管存在这种限制,REShAPE经过专门培训,可以识别和分割RPE细胞边界,并且比其他现有方法(例如RPE细胞的Voronoi8 和CellProfiler9 分割)表现更好。
此外,与手动分割10相比,REShAPE提供了快速分析大图像的优势(测试了~130,000像素x 130,000像素)。总之,这种解剖方法是高度可重复的,可以很容易地扩展到其他动物模型。此外,该软件还可用于研究眼部平板或细胞培养模型中的RPE形状,以检查某些治疗的效果。最后,REShAPE的多功能性使其广泛适用于其他类型的上皮细胞的分析。
披露声明
作者没有利益冲突需要披露。
致谢
我们感谢美国国家眼科研究所(NEI)组织学核心使用蔡司Axio Scan.Z1。我们还要感谢捐赠者、他们的家人、推进视力网络和狮子会眼科研究所的慷慨解囊。这项工作得到了NEI IRP基金的支持(授权号ZIA EY000533-04)。
材料
| Name | Company | Catalog Number | Comments |
| Biopsy punch 1.5 mm | Acuderm Inc. | P1525 | |
| Bovine albumin | MP Biomedicals | 160069 | |
| Coverglass 50 x 75 mm, #1.5 thickness | Brain Research Laboratories | 5075-1.5D | |
| Curved spatula | Katena | K3-6600 | |
| D-Mannitol | Sigma | M9546 | |
| DPBS 1x with Ca2+ and Mg2+ | Gibco | 14040-133 | |
| Fine Scissors | Fine Science Tools | 14558-11 | |
| Fluormount-G | Southern Biotech | 0100-01 | |
| Forceps - Dumont #5 | Fine Science Tools | 11252-23 | |
| Microscope slides 50 x 75 x 1.2 mm | Brain Research Laboratories | 5075 | |
| Needles 21 G x 1-1/2" hypodermic | Becton Dickinson (BD) | 305167 | |
| Needles 27 G x 1-1/4" hypodermic | Becton Dickinson (BD) | 305136 | |
| Paraformaldehyde 16% | Electron Microscopy Sciences | 15710 | |
| Petri dish 100 mm | Corning | 430167 | |
| Phalloidin-iFluor 647 | Abcam | ab176759 | |
| Razor blades | PAL (Personna) | 62-0177 | |
| Round bottom tubes 50 mL | Newegg | 9SIA4SR9M88854 | |
| Silicon Elastomer Kit | Dow Corning Corporation | 4019862 | |
| Square weighing boat (81 mm x 81 mm x 25 mm) | Sigma | W2876 | |
| Surgical Vitrectomy System | BD Visitrec | 585100 | optional |
| Syringe 1 mL | Becton Dickinson (BD) | 309659 | |
| Triton X-100 | Sigma | T9284 | |
| TrueBlack | Biotium | 23007 | autofluorescence quencher |
| Tween 20 | Affymetrix | 20605 | |
| Vannas Spring Scissors - 3 mm cutting edge | Fine Science Tools | 15000-10 |
参考文献
- Endo, E. G., Yao, X. Y., Marmor, M. F. Pigment adherence as a measure of retinal adhesion: Dependence on temperature. Investigative Ophthalmology and Visual Science. 29 (9), 1390-1396 (1988).
- Marmor, M. F. Retinal detachment from hyperosmotic intravitreal injection. Investigative Ophthalmology and Visual Science. 18 (12), 1237-1244 (1979).
- Marmor, M. F., Martin, L. J., Tharpe, S. Osmotically induced retinal detachment in the rabbit and primate. Electron microscopy of the pigment epithelium. Investigative Ophthalmology and Visual Science. 19 (9), 1016-1029 (1980).
- Ban, Y., Rizzolo, L. A culture model of development reveals multiple properties of RPE tight junctions. Molecular Vision. 3, 18(1997).
- Ortolan, D., et al. Single-cell-resolution map of human retinal pigment epithelium helps discover subpopulations with differential disease sensitivity. Proceedings of the National Academy of Sciences of the United States of America. 119 (19), 2117553119(2022).
- Schaub, N. J., et al. Deep learning predicts function of live retinal pigment epithelium from quantitative microscopy. Journal of Clinical Investigation. 130 (2), 1010-1023 (2020).
- Beatty, S., Koh, H. -H., Phil, M., Henson, D., Boulton, M. The role of oxidative stress in the pathogenesis of age-related macular degeneration. Survey of Ophthalmology. 45 (2), 115-134 (2000).
- Liu, Z., Kocaoglu, O. P., Miller, D. T. 3D imaging of retinal pigment epithelial cells in the living human retina. Investigative Ophthalmology and Visual Science. 57 (9), 533-543 (2016).
- Bhatia, S. K., et al. Analysis of RPE morphometry in human eyes. Molecular Vision. 22, 898-916 (2016).
- vonder Emde, L., et al. Histologic cell shape descriptors for the retinal pigment epithelium in age-related macular degeneration: A comparison to unaffected eyes. Translational Vision Science & Technology. 11 (8), 19(2022).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。