Method Article
ייצור יעיל ועקבי של אפיתל פיגמנט רשתית/כורואיד שטוח מעיני אדם לניתוח היסטולוגי
In This Article
Summary
אנו מתארים שיטה להפרדה יעילה של אפיתל פיגמנט הרשתית (RPE) מהרשתית בעיניים אנושיות ויצירת שטוחים שלמים של RPE/כורואידים לצורך ניתוחים היסטולוגיים ומורפומטריים של ה-RPE.
Abstract
אפיתל פיגמנט הרשתית (RPE) והרשתית הן רקמות המחוברות מבחינה תפקודית ומבנית הפועלות יחד כדי לווסת את תפיסת האור והראייה. חלבונים על פני השטח האפיקליים של RPE קשורים קשר הדוק לחלבונים על פני השטח של המקטע החיצוני של הפוטורצפטור, מה שמקשה על הפרדה עקבית בין ה-RPE לבין הפוטורצפטורים/הרשתית. פיתחנו שיטה להפרדה יעילה של הרשתית מה-RPE של עיניים אנושיות כדי ליצור RPE/כורואיד ורשתית שטוחים שלמים לצורך אנליזה תאית נפרדת של הפוטורצפטורים ותאי ה-RPE. הזרקה תוך-גופית של תמיסה בעלת אוסמולריות גבוהה של D-מניטול, סוכר שאינו מועבר על ידי ה-RPE, גרמה להפרדת ה-RPE והרשתית על פני כל התא האחורי מבלי לגרום נזק לצמתים של תאי ה-RPE. לא נצפו טלאי RPE מחוברים לרשתית. תיוג פאלוידין של אקטין הראה שימור צורת RPE ואיפשר ניתוח מורפומטרי של האפיתל כולו. תוכנה מבוססת בינה מלאכותית (AI) פותחה כדי לזהות ולפלח במדויק את גבולות תאי ה-RPE ולכמת 30 מדדי צורה שונים. שיטת דיסקציה זו ניתנת לשחזור וניתן להרחיב אותה בקלות למודלים אחרים של בעלי חיים.
Introduction
אפיתל פיגמנט הרשתית (RPE) והרשתית העצבית קשורים זה בזה בחוזקה בגלל התלות הפיזיולוגית החזקה של הפוטורצפטורים ב-RPE. במהלך הדיסקציה, ההפרדה המכנית של הרשתית העצבית מה-RPE גורמת לקרע של תאי ה-RPE, כאשר החלקים האפיקליים של ה-RPE נותרים מחוברים למקטעים החיצוניים של הפוטורצפטורים ברשתית. היקף ההידבקות ברשתית RPE הוא כה גדול, עד שכמות הפיגמנט שנותרה על הרשתית לאחר ההפרדה משמשת לכימות עוצמת הידבקות הרשתית1. באופן ספציפי, צמתים הדוקים RPE ומבנה האקטין המחבר ביניהם, הממוקמים בצד האפיקלי, מתנתקים במהלך הפרדה מכנית. לכן, צביעת משטחי RPE עבור גבולות התא גורמת לחד-שכבתי מטושטש שבו לתאים רבים יש גבולות חסרים. השפעה זו מחריפה כאשר הרקמה קבועה עם paraformaldehyde (PFA) לפני דיסקציה, כמו חלבונים להיות crosslinked.
מחקרים על מתן תרופות תוך-ורידיות הראו כי זריקות של תמיסות היפרוסמוטיות בתא האחורי גורמות לניתוק רשתית 2,3. בניסויים אלה, 50 μL של פתרונות שונים, החל מ-1,000 mOsm ועד 2,400 mOsm, שהוזרקו באמצע הזגוגית, גרמו לניתוק הרשתית תוך דקות. יש לציין כי גם לאחר חשיפות ארוכות לתמיסות בעלות אוסמולריות גבוהה, הצמתים ההדוקים של RPE הופיעו שלמים בתמונות מיקרוסקופיות של אלקטרונים של ארנב וקוף3. בעקבות אסטרטגיה דומה, הזרקנו לתוך הזגוגית האמצעית תמיסה היפרוסמוטית של D-מניטול כדי לגרום לניתוק יעיל של הרשתית לפני ביצוע דיסקציה של RPE. מכיוון שמניטול D אינו מועבר על ידי RPE4, נשמר ריכוז תוך-ורידי גבוה, היוצר שיפוע אוסמוטי. ההפרדה היעילה של ה-RPE והרשתית על פני כל התא האחורי מבטיחה את שימור הצמתים הסלולריים של ה-RPE ומאפשרת לחקור את המורפומטריה של RPE על כל המשטח השטוח. בנוסף, פיתחנו תוכנה מבוססת בינה מלאכותית (AI) שמזהה ומפלחת גבולות תא RPE המסומנים באופן פלואורסצנטי, מכמתת 30 מדדי צורה שונים ומייצרת מפות חום של כל מדד להדמיה 5,6.
Protocol
גלובוסים אנושיים של Cadaver התקבלו מרשת הראייה המתקדמת (ברמינגהאם, AL). עבודה המבוצעת על רקמת מטמון פטורה על ידי ועדת הביקורת המוסדית של NIH מוועדת האתיקה של המחקר.
1. משלוח גלובוס עיניים
- לאחר ההשבה, שלחו גלובוסים טריים לעיניים במיכל מלא ב-DPBS קר כקרח 1x עם Ca 2+ ו-Mg2+.
הערה: עדיף לנתח את העין תוך 24 שעות לאחר האנוקלציה. המורפולוגיה של RPE אינה משתנה במהלך חלון זמן זה.
2. הכנת תבנית סיליקון
- חותכים את 20 מ"מ התחתונים של צינור תחתון עגול בקוטר 25 מ"מ. מניחים אותו בבסיס סירת שקילה מרובעת (81 מ"מ x 81 מ"מ x 25 מ"מ).
- ערבבו את שני המרכיבים של ערכת הסיליקון אלסטומר ביחס של 10:1, תוך שימת לב לא ללכוד אוויר. יוצקים את התערובת לתוך סירת השקילה המכילה את החלק הכדורי של הצינור בעל התחתית העגולה.
- לרפא את הסיליקון בטמפרטורת החדר במשך הלילה. הסר את סירת השקילה ואת הצינור התחתון העגול מתבנית הסיליקון שנרפאה.
3. דיסקציה RPE
- נקו את הסקלרה של גלובוס העיניים הטרי של השרירים ורקמות החיבור. הדקו את העין לתבנית הסיליקון באמצעות מחטי 27 G המושחלות דרך הסקלרה. מלאו את חלל התבנית ב-DPBS 1x עם Ca 2+ ו-Mg2+.
הערה: שימו לב לא לפרוץ את תא העין. המחטים צריכות לעבור רק דרך הסקלרה. - השתמש במזרק של 1 מ"ל ובמחט של 21 גרם כדי להזריק ~ 400 μL של תמיסת D-מניטול של 1,700 mOsm לתוך הזגוגית. הכנס את המחט דרך pars plana כדי למנוע ניקוב החדר הקדמי של העין. השאירו את העין בטמפרטורת החדר למשך ~ 45 דקות.
- חותכים את החדר הקדמי ברמה של pars plana באמצעות זוג מספריים עדינים ומלקחיים. מלאו את תא העיניים האחורי ב-DPBS 1x עם Ca 2+ ו-Mg2+. תחת הסטריאומיקרוסקופ, למקם את המקולה (הכתם הצהוב על הרשתית).
- אם יש חותך זגוגית ניתוחי, הסר את הזגוגית והחלף אותה ב- DPBS 1x עם Ca 2+ ו- Mg2+. לחלופין, נסו להרים את הזגוגית עם מלקחיים ולחתוך אותה במספריים עדינים.
- לשים לב לשמירה על האזור המקולרי, לחתוך את העין לרביעים: האף, טמפורלי, מעולה, נחות. הסר את המחטים אם הם מפריעים.
- מעבירים את התא האחורי של העין לצלחת פטרי בקוטר 100 מ"מ המכילה DPBS 1x עם Ca 2+ ו-Mg2+. לפני הסרת הרשתית, מסמנים את עלי הכותרת המכילים את המקולה על ידי ביצוע חתך קטן (בצורת V) בשוליים הציליאריים. מרימים וחותכים את כל הזגוגית שמונחת על הרשתית.
- הרימו בעדינות את הרשתית ממספר צדדים בעזרת מרית מעוקלת או זוג מלקחיים כדי לבדוק אם הרשתית התנתקה מה-RPE ולאפשר לנוזל לזרום בין שתי השכבות.
הערה: הרשתית עדיין תהיה מחוברת בפריפריה (שוליים צילאריים) ובעצב הראייה. - חותכים את הרשתית מהשוליים הציליאריים בכל עלי הכותרת, ומבטיחים לא לגרד את ה- RPE. מניחים את הרקמה ב-4% PFA ודוגרים במשך ~1 שעות. יש לכבס 3x עם DPBS 1x עם Ca 2+ ו-Mg2+. מעבירים את הרקמה למיכל מלא ב-DPBS 1x עם Ca 2+ ו-Mg2+ ומאחסנים אותה ב-4 מעלות צלזיוס.
הערה: בשלב זה, הרשתית מחוברת רק בעצב הראייה. זוהי נקודת עצירה בניסוי זה. - העבירו את הדגימה לצלחת פטרי בקוטר 100 מ"מ המכילה DPBS 1x עם Ca 2+ ו-Mg2+. אגרוף את ראש עצב הראייה עם אגרוף ביופסיה 1.5 מ"מ ולאסוף את הרשתית. אחסן את הרשתית העצבית ב- DPBS 1x עם Ca 2+ ו- Mg2+ ב- 4 °C.
הערה: לפני ניקוב ראש עצב הראייה, הקפד לחתוך את עצב הראייה ככל האפשר בצד הסקלרלי. זה יגדיל את הדיוק של האגרוף. ניקוב עצב הראייה לאחר קיבוע השטוח ב-4% PFA מפחית את הנזק לתאי ה-RPE הממוקמים סביב עצב הראייה. - הסר את הסקלרה מה-RPE/choroid על ידי הרמה עדינה של שכבת ה-RPE/choroid מהפריפריה וחיתוך כלי הדם הכורואידיים ורקמת החיבור שנמצאים בין הסקלרה ל-RPE בעזרת זוג מספריים קפיציים של Vannas. לאחר שה-RPE/choroid מופרד לחלוטין מהסקלרה, אספו את שכבת ה-RPE/choroid. העבירו את הרקמה למיכל מלא ב-DPBS 1x עם Ca 2+ ו-Mg2+ ואחסנו אותה בטמפרטורה של 4 מעלות צלזיוס.
הערה: בשלב זה, ניתן להשהות את הניסוי.
4. מכתים
- מעבירים את ה-RPE/choroid לבאר אחת מתוך צלחת של 6 בארות. יש לחסום ולחדור את הדגימה ב-DPBS 1x עם Ca 2+ וב-Mg 2+ עם אלבומין (BSA) מסרום בקר (BSA), 0.5% טווין20 ו-0.5% טריטון X-100 למשך שעה אחת בטמפרטורת החדר.
- דגירה של הדגימה עם פלואידין מצומד עם פלואורופור 647 בדילול של 1:250 ב-DPBS 1x עם Ca 2+ ו-Mg 2+ עם 1% BSA, 0.5% טווין20 ו-0.5% טריטון X-100 למשך שעה אחת בטמפרטורת החדר. יש לשטוף 3x ב-DPBS 1x עם Ca 2+ ו-Mg2+.
- העבירו את דגימת ה-RPE/choroid למגלשת זכוכית בגודל 50 מ"מ x 75 מ"מ ושטחו אותה. חותכים כל "עלי כותרת" לשניים כדי להפוך את המדגם לחמיא יותר. שימו לב למקולה. ציירו קו מתאר של השטוח בעזרת עט הידרופובי.
- כדי להרוות את ה-lipofuscin autofluorescence, יש להוסיף 500 μL מתמיסת ה-autofluorescence quencher המדוללת ל-1:20 ב-70% אתנול ולדגור בטמפרטורת החדר למשך 2 דקות.
- יש לשטוף ביסודיות (לפחות 3x) ב-DPBS 1x עם Ca 2+ ו-Mg2+. הסר את ה- DPBS והוסף את מדיום ההרכבה. יש להניח את הכיסוי על הפתח ולאטום בעזרת לק.
- דמיינו את המשטח באמצעות מיקרוסקופ פלואורסצנטי (רצוי באמצעות מטרה של 10x או 20x).
5. ניתוח REShAPE
הערה: מכיוון שהאלגוריתם מבוסס הבינה המלאכותית REShAPE אומן על תמונות 10x ו- 20x, לכן מומלץ מאוד להשתמש במטרה של פי 10 או 20 בעת הדמיה. אם לא, יהיה צורך לשנות את קנה המידה של התמונות בהתאם.
- אם התמונות נרכשות עם יותר מערוץ פלואורסצנטי אחד, בודדו את הערוץ המשמש לרכישת גבולות התא. ייצא את התמונות כקובצי TIF בגווני אפור של 16 סיביות.
הערה: אין צורך לייצא תמונות שנרכשו עם סיומת הקובץ .czi כקובצי TIF, אך עדיין יש לבודד את הערוץ המכיל את גבולות התא. - התקן את התוכנה בפלטפורמות x64 או Linux (Centos 7).
הערה: ניתן למצוא את התוכנה ואת הוראות ההתקנה בכתובת https://github.com/nih-nei/REShAPE. - פתח את התוכנה (איור 1).
- בכרטיסייה ספריות, בחר את תיקיות הקלט והפלט. בספריית הקלט, בחר את התיקיה המכילה את התמונות. בספריית הפלט, אפשר לתוכנה לשנות באופן אוטומטי את הנתיב ל"ספריית קלט/מעובד". לחלופין, שנה את ספריית הפלט באופן ידני.
הערה: התוכנה תחזור על כל התמונות הכלולות בתיקיית הקלט. - בכרטיסייה ' אפשרויות סגמנטציה של NN' , בחרו בקביעות הבאות עבור פילוח תמונות:
- גודל אצווה: הקלד ערך של 20 בתיבת הטקסט כנקודת התחלה טובה, אך הקטן אותו אם למערכת נגמרות יחידות העיבוד הגרפי (GPU).
הערה: התמונה המקורית מפוצלת לאריחים קטנים יותר לצורך עיבוד. גודל האצווה מציין כמה אריחים ניתן לעבד בו-זמנית. - השתמש ב- GPU?: אם למערכת אין מספיק משאבי GPU, סמן את התיבה לא.
- קנה מידה פנימי: באמצעות התפריט הנפתח, שנה את שינוי קנה המידה הפנימי מ'ללא' במקרים שבהם התמונות לא נרכשו עם מטרה של 10x או 20x. לדוגמה, הקטן את קנה המידה של תמונות בגודל 40x למחצית הגודל באמצעות לחצן 1/2. אפשרויות שינוי קנה המידה הזמינות בתפריט הנפתח הן כדלקמן: 5x, 2x, ללא, 1/2, 1/5.
הערה: למידת המכונה אומנה עם תמונות פי 10 ו-20x. ייתכן שהוא לא יזהה גבולות תא מתמונות שצולמו בהגדלות אחרות. במקרה זה, תמונות בינאריות יופיעו שחורות לחלוטין. - Arti Filter: השתמש בכרטיסיית מסנן החפצים כדי להסיר חלקיקים בהירים מאוד (פסולת או חלקים קטנים של הרשתית או רקמת החיבור סביב עצב הראייה) שעשויים להימצא בתמונה ועלולים להפריע לסגמנטציה של גבול התא. לא נעשה שימוש במסנן כברירת מחדל. אפשרויות המסנן המלאכותי בתפריט הנפתח הן כדלקמן: רגיל, חזק וחלש.
- גודל אצווה: הקלד ערך של 20 בתיבת הטקסט כנקודת התחלה טובה, אך הקטן אותו אם למערכת נגמרות יחידות העיבוד הגרפי (GPU).
- בכרטיסייה 'אפשרות תמונה פרושה ', הוסיפו ערך בתיבת המלל כדי לציין את מידת החפיפה בין אריחי התמונה באמצעות התאמת הפרמטר Pad Tiles By . חפיפה של 100 פיקסלים בדרך כלל עובדת היטב.
- בכרטיסייה 'אפשרויות גרפיקת פלט' , כווננו את ההגדרות ליצירת מפת חום:
- שחזור תמונות אריחים?: אם למערכת אין מספיק משאבים לניתוח תמונות גדולות, סמן את התיבה לא כדי לאפשר לתוכנה להשלים את הניתוח על ידי שמירת אריחים בודדים מבלי לשחזר את התמונה כולה.
- צור תמונות צבע: כדי ליצור מפות חום, בחר הכל מהתפריט הנפתח.
- עבור צביעה, בחר כל אחת מלוחות הצבעים השונים הזמינים בתפריט הנפתח: תרמי, ירוק, Mpl-מאגמה, שלב, אש, סילון, ציאן חם.
- בתיבה 'תבנית תמונה', שמרו את התמונות כ- TIF או PNG באמצעות בחירה באחת מהאפשרויות בכרטיסייה.
- ביחס למגבלות הידניות של השימוש? תכונה, סמן את התיבה לא כדי לאפשר לתוכנה להשתמש בערכי המינימום והמקסימום שזוהו בכל תמונה. סמן את התיבה כן כדי להתאים באופן ידני את טווח הערכים עבור כל מפת חום מטרית של צורה, ולחץ על הלחצן הגדר מגבלות כדי לבחור טווחים עבור הפרמטרים הבודדים על-ידי הוספת ערכים לתיבות הטקסט. לאחר שינוי ערכי העניין, לחץ על שמור. לחץ על טען ברירות מחדל כדי לאפס את כל המגבלות.
הערה: השתמש במגבלות ידניות אם יש צורך להשוות מפות חום מתמונות מרובות, למשל בעת השוואת ההשפעות של תרכובות שונות על צורת התא. בדרך זו, נעשה שימוש באותו טווח ערכים. קבוצת הערכים שיש להזין באופן ידני משתנה בהתאם לסוג הדגימה. מומלץ להריץ כמה איטרציות כדי לבחור את הטווח האופטימלי.
- בכרטיסיה הגבלות גודל תא עבור ניתוח, בחר סף גודל תא עבור הניתוח:
- תחת גודל תא תחתון, הוסף בתיבת הטקסט את גודל התא הקטן ביותר שייכלל בניתוח.
- תחת גודל תא עליון, הוסף בתיבת הטקסט את גודל התא הגדול ביותר שייכלל בניתוח.
הערה: יחידת גודל התא משתנה מפיקסלים למיקרומטרים בריבוע בהתאם לאפשרות שנבחרה בכרטיסייה המרת יחידה אוטומטית .
- בכרטיסייה המרת יחידה אוטומטית , בחר את היחידה המועדפת לניתוח:
- בהמרת פיקסלים ליחידות אמיתיות?, סמן את התיבה ללא כדי להפעיל את הניתוח ביחידות פיקסלים. סמן את התיבה כן כדי להפעיל את הניתוח במיקרומטרים.
- בתיבה ' אורך סרגל קנה מידה' (פיקסלים), הזינו את ערך הפיקסלים בתיבת המלל.
- בתיבה אורך סרגל קנה מידה (מיקרונים), הזן בתיבת הטקסט את המרחק המתאים במיקרומטרים.
- כדי להתחיל בניתוח, לחץ על Go For It.
הערה: התוכנה יכולה גם למדוד את כדאיות התאים כאשר התאים מוכתמים ב-4',6-diamidino-2-phenylindole (DAPI) ופרופידיום יודיד (לשונית אפשרויות CZI ), אך הדבר אינו חל על משטחי RPE.
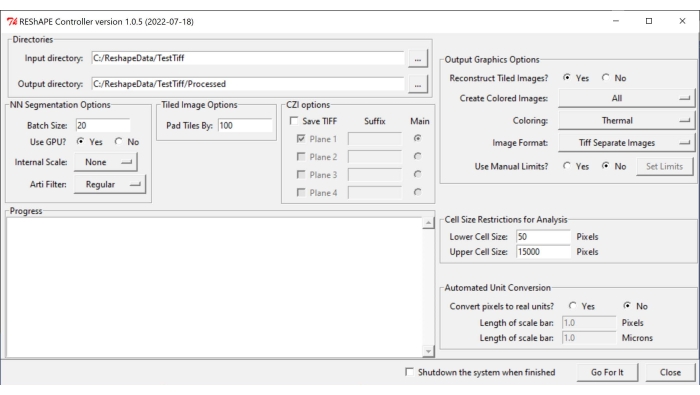
איור 1: ממשק משתמש גרפי של REShAPE. לממשק המשתמש הגרפי יש כרטיסיות שונות לבחירת ספריות העבודה (הכרטיסייה Directories ), שינוי אפשרויות הפילוח (הכרטיסיות 'אפשרויות סגמנטציה של NN ' ו'אפשרויות תמונה באריחים '), ציון הפרמטרים לניתוח (הגבלות גודל תא לכרטיסיות ניתוח והמרת יחידות אוטומטית ) וליצירת מפת חום (הכרטיסייה 'אפשרויות גרפיקת פלט'). קיצור: GUI = ממשק משתמש גרפי. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
תוצאות
פרוטוקול זה יוצר תמונה חד-מישורית של משטח שטוח, שבו מיקום התא ו-30 מדדי הצורה נמדדים עבור כל תא RPE שזוהה כהלכה (איור 2). תיקיה בשם "מעובד" נוצרת באופן אוטומטי בתוך ספריית הקלט. תיקיה זו מכילה ארבע ספריות משנה, הנקראות "ניתוח", "מקודד צבע", "קבצים משולבים" ו"תמונות מקוטעות", וכמה קבצים זמניים שנוצרו במהלך הניתוח. התיקייה "קבצים משולבים" מכילה גיליון אלקטרוני עם כל מדידות הצורה וגיליון אלקטרוני עם התדרים של ספירות שכנות התאים של כל הקבצים יחד. התיקייה "Analysis" מכילה גיליון אלקטרוני עם כל מדידות הצורה וגיליון אלקטרוני עם התדרים של השכן לתא סופר עבור כל תמונה בנפרד. ספריית "תמונות מקוטעות" מכילה את המסכות הבינאריות הסופיות של גבולות תא RPE; ניתן להשתמש בו כדי להעריך את איכות הסגמנטציה. הספריה "מקודד צבע" מכילה מפות חום עבור כל מדידת צורה כדי להמחיש את תבניות הצורה בכל תמונה. ניתן למצוא את ההגדרות והקיצורים של מדדי הצורה בטבלה 1.
לפעמים RPE flatmounts יכול להכיל שאריות של חתיכות רשתית שלא הוסרו בצורה נקייה, במיוחד סביב עצב הראייה. צביעת פלוידין של הדגימה גורמת לאות חזק המגיע מהרשתית, וזה יכול לגרום לבעיות לסגמנטציה של גבול תא RPE. אריחים מסוימים ייראו שחורים לחלוטין, בעוד שהאריחים שמסביב יציגו סגמנטציה רגילה. עצמים בהירים אחרים שעשויים להיות נוכחים בתמונה יגרמו גם הם ליצירת אריחים שחורים (איור 3). במקרים אלה, בחירה באחת מאפשרויות הסינון (חלש, רגיל, חזק) הזמינות בתפריט הנפתח Arti Filter תמנע היווצרות אריחים שחורים.
REShAPE מצלם תמונות בגווני אפור של 8 סיביות או 16 סיביות כקלט, אך לא תמונות RGB. שימוש בתמונות RGB לניתוח REShAPE יפיק תמונות בינאריות שחורות לחלוטין. במקרה כזה, המרת תמונות RGB לגווני אפור תפיק תמונות בינאריות מפולחות כהלכה (איור 4). במקרים מסוימים שבהם גבולות ה-RPE אינם מזוהים כראוי, לדוגמה, אם הכתם אינו אופטימלי או אם הדגימה ניזוקה משריטה (איור 5A), גושים גדולים של תאים עשויים להיות מזוהים כתא אחד גדול מאוד (איור 5B). במקרה זה, ניתן להוציא עצמים גדולים מהניתוח על-ידי הקטנת סף גודל התא (איור 5C). ניתן להשיג זאת על-ידי הוספת ערך נמוך יותר בתיבת הטקסט גודל תא עליון . עם זאת, זה יגרום לשינוי בטווח של מפת החום. אם חוקר בוחר לעשות זאת, ניתן גם לשמור על טווח מפת החום המקורי (איור 5D) על ידי סימון התיבה כן בתכונה השתמש במגבלות ידניות. לאחר מכן, על החוקר ללחוץ לחיצה ימנית על הלחצן Set Limits ולהכניס את הערכים הרצויים בתיבות הטקסט כדי לציין את המגבלות הידניות.
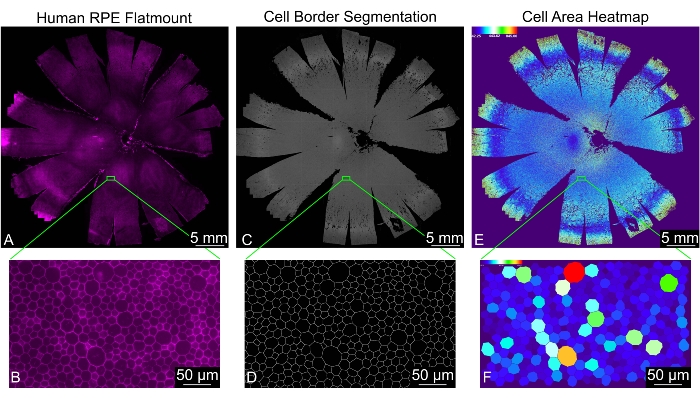
איור 2: ניתוח מורפומטרי מלא של מונולייר RPE אנושי שלם. (A) תצוגת הגדלה נמוכה של RPE/כורואיד אנושי שלם (מגנטה: phalloidin). (B) תצוגה מוגדלת של תאי RPE מוכתמים בפלוידין. (C) סגמנטציה שנוצרה על-ידי REShAPE של גבולות תא ה-RPE עבור משטח RPE/כורואיד אנושי שלם ו-(D) התצוגה המוגדלת המתאימה. (E) מפת חום שנוצרה על-ידי תוכנה הממחישה את שטח התא של תאי ה-RPE הבודדים בכל השטח האנושי. קנה המידה התרמי בפינה השמאלית העליונה מציג את טווח הערכים שבהם נעשה שימוש. (F) התצוגה המוגדלת המתאימה מציגה תאי RPE בודדים בצבע לפי אזור. פסי קנה מידה = (B,D,F) 50 מיקרומטר, (A,C,E) 5 מ"מ. קיצור: RPE = אפיתל פיגמנט רשתית. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
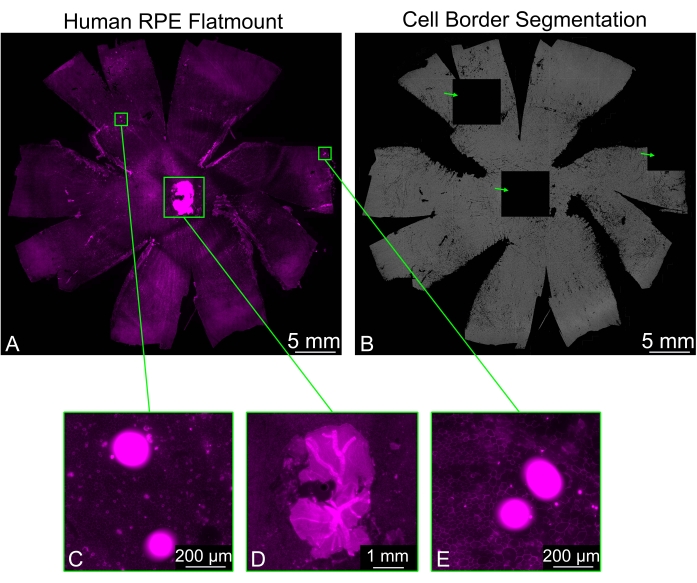
איור 3: סינון של ממצאים בהירים. (A) משטח RPE אנושי המוכתם בגבולות התא (מגנטה: פלוידין) יכול להציג אזורים בהירים (מלבנים ירוקים) המפריעים לסגמנטציה. (B) סגמנטציית גבול תא ה-RPE של כל המשטח מכילה שלושה אריחים שחורים לחלוטין (חיצים ירוקים) המתאימים לאזורים בהירים של פלואורסצנציה. (ג,ה) שניים מהאריחים השחורים מתאימים לאזורים המכילים נקודות בהירות, שהן אולי חלק מהפסולת. (D) אחד האריחים השחורים נוצר על ידי פיסת רשתית עצבית סביב עצב הראייה שלא הוסרה כראוי. החלקים של הרשתית העצבית בהירים במידה ניכרת משכבת ה-RPE ומעכבים את פילוח התאים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 4: דרושה תמונת קלט. תאי RPE המוכתמים בגבולות תא נשמרו כתמונות (A) RGB או כתמונות בגווני אפור (B) של 16 סיביות לצורך ניתוח REShAPE. (C) הפלט של ניתוח התמונה RBG הוא תמונה בינארית שחורה, (D) ואילו הניתוח של התמונה בגווני אפור מייצר תמונה בינארית מקוטעת נכונה של גבולות התא. REShAPE יכול לנתח רק תמונות בגווני אפור של 8 סיביות או 16 סיביות. סרגלי קנה מידה = 50 מיקרומטר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 5: תוצאות לא אופטימליות . (A) תמונה של חלק מהחד-שכבתי RPE שבו התאים המוכתמים בפלוידין נשרטו בטעות. (B) מפת חום של תאי RPE הצבועים לפי ממד שטח התא. סף גדול של גודל תא עליון כולל אובייקטים גדולים בניתוח. (C) מפת חום של אזור תא שבה נבחר סף קטן יותר של גודל תא עליון כדי לא לכלול עצמים גדולים בניתוח. (D) מפת חום של אזור תא שבה נבחר סף קטן יותר של גודל תא עליון ונקבעו מגבלות ידניות כדי לשמור על טווח מפת החום ששימש במקור. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
טבלה 1: פרמטרים של REShAPE. הטבלה מדווחת על ההגדרה של כל פרמטר ועל הקיצורים המשמשים בגיליונות האלקטרוניים הגולמיים (קבצי "_Data.csv") ובמפות החום. אנא לחץ כאן כדי להוריד טבלה זו.
Discussion
ההפרדה העקבית והיעילה של RPE ורשתיות אנושיות יכולה להיות מושגת באמצעות פרוטוקול זה. שיטה זו מאפשרת לחקור הבדלים אזוריים בצורת RPE על פני כל הרשתיות האנושיות5. שלב מכריע בפרוטוקול הוא ההפרדה הפיזית של ה-RPE והרשתית. אם שתי הרקמות אינן מנותקות לחלוטין באזורים מסוימים, יש להרים בעדינות את הרשתית, תוך הקפדה שלא לשבור את הרקמות. ניתוח REShAPE של flatmounts גדולים עשוי לדרוש שימוש במערכות עם משאבי RAM ניכרים. במקרה זה, ניתן להשבית את ההרכבה מחדש של התמונה כולה כדי לאפשר לתוכנה לסיים בהצלחה את הניתוח למרות היעדר משאבי עיבוד.
המגבלה העיקרית של השימוש ב- REShAPE כדי לפלח שטוחות RPE אנושיות היא שאלגוריתם הבינה המלאכותית אומן בעיקר על תמונות של RPE המושרה שמקורו בתאי גזע פלוריפוטנטיים. כתוצאה מכך, הפילוח של שטוחי RPE אנושיים הוא פחות מדויק. תאי RPE מתורמים זקנים מכילים כמות גדולה של ליפופוסצין7, והספקטרום הרחב של האוטופלואורסצנציה שלו מפריע לסגמנטציה של גבול התא. בעתיד, תמונות נוספות של שטוחות RPE ישמשו לשיפור סגמנטציה של גבולות התא בדגימה מסוג זה. למרות מגבלה זו, REShAPE הוכשרה במיוחד לזהות ולפלח גבולות תאי RPE ומתפקדת טוב יותר משיטות קיימות אחרות, כגון וורונוי8 וסגמנטציה של תאי RPE CellProfiler9 .
יתר על כן, בהשוואה לסגמנטציה ידנית 10, REShAPE מספק את היתרון של ניתוח תמונות גדולות במהירות (~ 130,000 פיקסלים x130,000 פיקסלים נבדקו). לסיכום, שיטת דיסקציה זו ניתנת לשחזור וניתן להרחיב אותה בקלות למודלים אחרים של בעלי חיים. בנוסף, התוכנה יכולה לשמש לחקר צורת RPE בעיניים שטוחות או במודלים של תרביות תאים כדי לבחון את ההשפעה של טיפולים מסוימים. לבסוף, הרבגוניות של REShAPE הופכת אותו לישים באופן נרחב לניתוח של סוגים אחרים של תאי אפיתל.
Disclosures
למחברים אין ניגודי עניינים לחשוף.
Acknowledgements
אנו מודים לליבת ההיסטולוגיה של המכון הלאומי לעיניים (NEI) על השימוש ב-Zeiss Axio Scan.Z1. אנו מודים גם לתורמים, למשפחותיהם, לרשת הראייה המתקדמת ולמכון עין האריות על נדיבותם. עבודה זו נתמכה על ידי קרנות NEI IRP (מענק מספר ZIA EY000533-04).
Materials
| Name | Company | Catalog Number | Comments |
| Biopsy punch 1.5 mm | Acuderm Inc. | P1525 | |
| Bovine albumin | MP Biomedicals | 160069 | |
| Coverglass 50 x 75 mm, #1.5 thickness | Brain Research Laboratories | 5075-1.5D | |
| Curved spatula | Katena | K3-6600 | |
| D-Mannitol | Sigma | M9546 | |
| DPBS 1x with Ca2+ and Mg2+ | Gibco | 14040-133 | |
| Fine Scissors | Fine Science Tools | 14558-11 | |
| Fluormount-G | Southern Biotech | 0100-01 | |
| Forceps - Dumont #5 | Fine Science Tools | 11252-23 | |
| Microscope slides 50 x 75 x 1.2 mm | Brain Research Laboratories | 5075 | |
| Needles 21 G x 1-1/2" hypodermic | Becton Dickinson (BD) | 305167 | |
| Needles 27 G x 1-1/4" hypodermic | Becton Dickinson (BD) | 305136 | |
| Paraformaldehyde 16% | Electron Microscopy Sciences | 15710 | |
| Petri dish 100 mm | Corning | 430167 | |
| Phalloidin-iFluor 647 | Abcam | ab176759 | |
| Razor blades | PAL (Personna) | 62-0177 | |
| Round bottom tubes 50 mL | Newegg | 9SIA4SR9M88854 | |
| Silicon Elastomer Kit | Dow Corning Corporation | 4019862 | |
| Square weighing boat (81 mm x 81 mm x 25 mm) | Sigma | W2876 | |
| Surgical Vitrectomy System | BD Visitrec | 585100 | optional |
| Syringe 1 mL | Becton Dickinson (BD) | 309659 | |
| Triton X-100 | Sigma | T9284 | |
| TrueBlack | Biotium | 23007 | autofluorescence quencher |
| Tween 20 | Affymetrix | 20605 | |
| Vannas Spring Scissors - 3 mm cutting edge | Fine Science Tools | 15000-10 |
References
- Endo, E. G., Yao, X. Y., Marmor, M. F. Pigment adherence as a measure of retinal adhesion: Dependence on temperature. Investigative Ophthalmology and Visual Science. 29 (9), 1390-1396 (1988).
- Marmor, M. F. Retinal detachment from hyperosmotic intravitreal injection. Investigative Ophthalmology and Visual Science. 18 (12), 1237-1244 (1979).
- Marmor, M. F., Martin, L. J., Tharpe, S. Osmotically induced retinal detachment in the rabbit and primate. Electron microscopy of the pigment epithelium. Investigative Ophthalmology and Visual Science. 19 (9), 1016-1029 (1980).
- Ban, Y., Rizzolo, L. A culture model of development reveals multiple properties of RPE tight junctions. Molecular Vision. 3, 18(1997).
- Ortolan, D., et al. Single-cell-resolution map of human retinal pigment epithelium helps discover subpopulations with differential disease sensitivity. Proceedings of the National Academy of Sciences of the United States of America. 119 (19), 2117553119(2022).
- Schaub, N. J., et al. Deep learning predicts function of live retinal pigment epithelium from quantitative microscopy. Journal of Clinical Investigation. 130 (2), 1010-1023 (2020).
- Beatty, S., Koh, H. -H., Phil, M., Henson, D., Boulton, M. The role of oxidative stress in the pathogenesis of age-related macular degeneration. Survey of Ophthalmology. 45 (2), 115-134 (2000).
- Liu, Z., Kocaoglu, O. P., Miller, D. T. 3D imaging of retinal pigment epithelial cells in the living human retina. Investigative Ophthalmology and Visual Science. 57 (9), 533-543 (2016).
- Bhatia, S. K., et al. Analysis of RPE morphometry in human eyes. Molecular Vision. 22, 898-916 (2016).
- vonder Emde, L., et al. Histologic cell shape descriptors for the retinal pigment epithelium in age-related macular degeneration: A comparison to unaffected eyes. Translational Vision Science & Technology. 11 (8), 19(2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved