Method Article
조직학적 분석을 위해 인간의 눈에서 망막 색소 상피/맥락막 플랫마운트의 효율적이고 일관된 생성
요약
우리는 인간의 눈에서 망막 색소 상피 (RPE)를 효율적으로 분리하고 RPE의 조직 학적 및 형태 측정 분석을 위해 전체 RPE / 맥락막 플랫 마운트를 생성하는 방법을 설명합니다.
초록
망막 색소 상피(RPE)와 망막은 기능적으로나 구조적으로 연결된 조직으로 함께 작동하여 빛의 지각과 시력을 조절합니다. RPE 정점 표면의 단백질은 광수용체 외부 세그먼트 표면의 단백질과 밀접하게 연관되어 있어 RPE를 광수용체/망막에서 일관되게 분리하기 어렵습니다. 우리는 광수용체와 RPE 세포의 별도의 세포 분석을 위해 완전한 RPE/맥락막 및 망막 플랫마운트를 생성하기 위해 인간의 눈의 RPE에서 망막을 효율적으로 분리하는 방법을 개발했습니다. RPE에 의해 운반되지 않는 당인 D-만니톨의 고삼투압 용액의 유리체내 주사는 RPE 세포 접합부에 손상을 주지 않으면서 전체 후실에 걸쳐 RPE와 망막의 분리를 유도했습니다. 망막에 부착된 RPE 패치는 관찰되지 않았습니다. 액틴의 팔로이딘 표지는 RPE 모양 보존을 나타내고 전체 상피의 형태 측정 분석을 허용했습니다. 인공 지능(AI) 기반 소프트웨어는 RPE 셀 경계를 정확하게 인식 및 분할하고 30가지 모양 메트릭을 정량화하기 위해 개발되었습니다. 이 해부 방법은 재현성이 높으며 다른 동물 모델로 쉽게 확장 할 수 있습니다.
서문
망막 색소 상피 (RPE)와 신경 망막은 RPE에 대한 광 수용체의 강한 생리적 의존성 때문에 서로 강하게 상호 연결되어 있습니다. 해부 중에 RPE에서 신경 망막의 기계적 분리는 RPE 세포의 찢어짐을 유발하고 RPE의 정점 부분은 망막 광 수용체의 외부 세그먼트에 부착되어 있습니다. RPE-망막 접착의 정도가 너무 커서 분리 후 망막에 남아있는 색소의 양이 망막 접착의 강도를 정량화하는 데사용됩니다1. 특히, RPE 단단한 접합부와이를 연결하는 액틴 구조는 정점에 위치하여 기계적 분리 중에 끊어집니다. 따라서 세포 경계에 대해 RPE 플랫마운트를 염색하면 많은 세포에 테두리가 누락된 고르지 못한 단층이 생성됩니다. 이 효과는 단백질이 가교됨에 따라 해부 전에 조직이 파라 포름 알데히드 (PFA)로 고정 될 때 악화됩니다.
유리체 내 약물 전달에 대한 연구에 따르면 후실에 고 삼투압 용액을 주사하면 망막 박리가 유도됩니다 2,3. 이 실험에서 1,000mOsm에서 2,400mOsm 범위의 50μL의 서로 다른 용액을 유리체 중간에 주입하면 몇 분 안에 망막 박리가 발생했습니다. 특히, 고 삼투압 용액에 장시간 노출 된 후에도 RPE 단단한 접합은 토끼와 원숭이 눈3의 투과 전자 현미경 이미지에서 손상되지 않은 것으로 나타났습니다. 유사한 전략에 따라 RPE 해부를 수행하기 전에 효율적인 망막 박리를 유도하기 위해 D-만니톨의 고삼투압 용액을 중간 유리체에 주입했습니다. D-만니톨이 RPE4에 의해 수송되지 않기 때문에, 높은 유리체내 농도가 유지되어 삼투압 구배를 생성한다. 전체 후실에서 RPE와 망막의 효율적인 분리는 RPE 세포 접합부의 보존을 보장하고 전체 플랫마운트에서 RPE 형태 측정을 연구할 수 있도록 합니다. 또한 형광 표지된 RPE 세포 경계를 인식 및 분할하고, 30개의 서로 다른 모양 메트릭을 정량화하고, 시각화 5,6을 위한 각 메트릭의 히트맵을 생성하는 인공 지능(AI) 기반 소프트웨어를 개발했습니다.
프로토콜
시체 인간 지구본은 Advanced Sight Network (Birmingham, AL)에서 입수했습니다. 시체 조직에 대해 수행 된 작업은 NIH 기관 검토위원회에 의해 연구 윤리위원회에서 면제됩니다.
1. 아이 글로브 배송
- 핵 제거 후 Ca 2+ 및 Mg2+가 함유된 얼음처럼 차가운 DPBS 1x로 채워진 용기에 신선한 아이 글로브를 배송합니다.
알림: 핵 제거 후 24 시간 이내에 눈을 해부하는 것이 좋습니다. RPE 형태는 이 기간 동안 변경되지 않습니다.
2. 실리콘 몰드 준비
- 직경 25mm의 둥근 바닥 튜브의 바닥 20mm를 자릅니다. 정사각형 계량 보트 (81mm x 81mm x 25mm)의 바닥에 놓습니다.
- 실리콘 엘라스토머 키트의 두 구성 요소를 10:1 비율로 혼합하고 공기가 끼지 않도록 주의하십시오. 혼합물을 둥근 바닥 튜브의 구형 조각이 들어있는 계량 보트에 붓습니다.
- 실리콘을 실온에서 밤새 경화시킵니다. 경화된 실리콘 몰드에서 계량 보트와 둥근 바닥 튜브를 제거합니다.
3. RPE 해부
- 근육과 결합 조직의 신선한 눈 지구의 공막을 청소하십시오. 공막을 관통하는 27G 바늘을 사용하여 실리콘 몰드에 눈을 고정합니다. 금형의 캐비티를 DPBS 1x로 Ca 2+ 및 Mg2+로 채 웁니다.
알림: 안과를 뚫지 않도록 주의하십시오. 바늘은 공막을 통과해야합니다. - 1mL 주사기와 21G 바늘을 사용하여 ~400μL의 1,700mOsm D-만니톨 용액을 유리체에 주입합니다. 눈의 앞쪽에 구멍이 뚫리지 않도록 파스 플라나를 통해 바늘을 삽입하십시오. 눈을 실온에서 ~45분 동안 그대로 두십시오.
- 한 쌍의 미세한 가위와 집게를 사용하여 파 평면 수준에서 전방을 엽니 다. 후방 안과를 DPBS 1x에 Ca 2+ 및 Mg2+로 채웁니다. 실체 현미경으로 황반(망막의 노란색 점)을 국소화합니다.
- 수술용 유리체 절단기를 사용할 수 있는 경우 유리체를 제거하고 Ca 2+ 및 Mg2+가 있는 DPBS 1x로 교체하십시오. 또는 집게로 유리체를 들어 올리고 가위로 자르십시오.
- 황반 부위 보존에주의를 기울여 눈을 사분면으로 자릅니다 : 비강, 측두엽, 상급 및 하위. 방해가되는 경우 바늘을 제거하십시오.
- 버터 플라이 된 눈의 후방을 Ca100 + 및 Mg2+가 포함 된 DPBS 1x가 들어있는 2mm 페트리 접시에 옮깁니다. 망막을 제거하기 전에 섬모 가장자리에 약간의 컷 (V 자형)을 만들어 황반이 들어있는 꽃잎을 표시하십시오. 망막에있는 모든 유리체를 들어 올리고 자릅니다.
- 구부러진 주걱이나 한 쌍의 집게로 망막을 여러 면에서 부드럽게 들어 올려 망막이 RPE에서 분리되었는지 확인하고 두 층 사이에서 약간의 유체가 순환하도록 합니다.
알림: 망막은 여전히 주변(섬모 가장자리)과 시신경에 부착됩니다. - RPE가 긁히지 않도록 모든 꽃잎의 섬모 가장자리에서 망막을 자릅니다. 조직을 4% PFA에 넣고 ~1시간 동안 배양합니다. DPBS 1x로 Ca 2+ 및 Mg2+로 3x 세척하십시오. 조직을Ca 2+ 및 Mg2+로 DPBS 1x로 채워진 용기에 옮기고 4 ° C에서 보관합니다.
참고: 이 시점에서 망막은 시신경에만 부착됩니다. 이 실험의 일시 중지 지점입니다. - 샘플을 Ca2 + 및 Mg2+가 포함된 DPBS 1x가 포함된 100mm 페트리 접시로 옮깁니다. 1.5mm 생검 펀치로 시신경 머리를 펀치하고 망막을 수집합니다. 신경 망막을 4°C에서Ca2 + 및 Mg2+ 와 함께 DPBS 1x에 저장합니다.
알림: 시신경 헤드를 펀칭하기 전에 공막 쪽에서 가능한 한 시신경을 절단하십시오. 이렇게하면 펀치의 정밀도가 높아집니다. 플랫마운트가 4% PFA에 고정된 후 시신경을 펀칭하면 시신경 주위에 위치한 RPE 세포의 손상이 줄어듭니다. - 주변에서 RPE/맥락막 층을 부드럽게 들어 올리고 Vannas 스프링 가위로 공막과 RPE 사이에 있는 맥락막 혈관과 결합 조직을 절단하여 RPE/맥락막에서 공막을 제거합니다. RPE/맥락막이 공막에서 완전히 분리되면 RPE/맥락막 층을 수집합니다. 조직을 Ca2+ 및 Mg2+ 가 포함된 DPBS 1x로 채워진 용기에 옮기고 4°C에서 보관합니다.
참고: 이때 실험을 일시 중지할 수 있습니다.
4. 염색
- RPE/맥락막을 6웰 플레이트의 한 웰로 옮깁니다. DPBS 1x에서 샘플을 Ca 2+ 및 Mg 2+ 로 1% 소 혈청 알부민(BSA), 0.5% 트윈20 및 0.5% 트리톤 X-100으로 실온에서 1시간 동안 차단 및 투과화합니다.
- DPBS 1x에서 1:250 희석액으로 647 형광단과 접합된 팔로이딘과 샘플을 실온에서 1시간 동안 1% BSA, 0.5% 트윈 20 및 0.5% 트리톤 X-100으로Ca 2+ 및 Mg2+로 인큐베이션합니다. Ca 2+ 및 Mg2+로 DPBS 1x에서 3x 세척하십시오.
- RPE/맥락막 샘플을 50mm x 75mm 유리 슬라이드로 옮기고 평평하게 만듭니다. 각 "꽃잎"을 두 개로 잘라 샘플을 더 평평하게 만듭니다. 황반에주의하십시오. 소수성 펜으로 플랫 마운트의 윤곽을 그립니다.
- 리포푸신 자가형광을 담금질하려면 70% 에탄올에 1:20으로 희석한 자가형광 소광제 용액 500μL를 넣고 실온에서 2분 동안 배양합니다.
- Ca2 + 및 Mg2+로 DPBS 1x에서 철저히 (최소 3x) 세척하십시오. DPBS를 제거하고 장착 매체를 추가합니다. 플랫마운트에 커버글라스를 놓고 매니큐어로 밀봉합니다.
- 형광 현미경으로 플랫마운트를 이미지화합니다(가급적이면 10x 또는 20x 대물렌즈 사용).
5. 리샤프 분석
참고: REShAPE AI 기반 알고리즘은 10x 및 20x 이미지에 대해 훈련되었으므로 이미징할 때 10x 또는 20x 대물렌즈를 사용하는 것이 좋습니다 . 그렇지 않은 경우 그에 따라 이미지 크기를 다시 조정해야 합니다.
- 이미지가 둘 이상의 형광 채널로 획득되는 경우 셀 경계를 획득하는 데 사용되는 채널을 분리합니다. 이미지를 16비트 그레이스케일 TIF 파일로 내보냅니다.
참고: 파일 확장자가 .czi인 이미지는 TIF 파일로 내보낼 필요가 없지만 셀 테두리가 포함된 채널은 여전히 분리해야 합니다. - Windows x64 또는 Linux (Centos 7) 플랫폼에 소프트웨어를 설치하십시오.
참고: 소프트웨어 및 설치 지침은 https://github.com/nih-nei/REShAPE 에서 찾을 수 있습니다. - 소프트웨어를 엽니다(그림 1).
- 디렉터리 탭에서 입력 및 출력 폴더를 선택합니다. 입력 디렉터리에서 이미지가 포함된 폴더를 선택합니다. 출력 디렉토리에서 소프트웨어가 자동으로 경로를 "입력 디렉토리/처리됨"으로 변경하도록 합니다. 또는 출력 디렉터리를 수동으로 변경합니다.
알림: 소프트웨어는 입력 폴더에 포함 된 모든 이미지를 반복합니다. - NN 분할 옵션 탭에서 이미지 분할에 대해 다음 설정을 선택합니다.
- 일괄 처리 크기: 텍스트 상자에 값 20을 좋은 시작점으로 입력하되 시스템에 GPU(그래픽 처리 장치)가 부족한 경우 값을 낮춥니다.
참고: 원본 이미지는 처리를 위해 더 작은 타일로 분할됩니다. 일괄 처리 크기는 한 번에 처리할 수 있는 타일 수를 지정합니다. - GPU 사용?: 시스템에 GPU 리소스가 충분하지 않은 경우 아니요 확인란을 선택합니다.
- 내부 배율: 드롭다운 메뉴를 사용하여 10x 또는 20x 대물렌즈로 이미지를 획득하지 않은 경우 내부 배율을 없음에서 변경합니다. 예를 들어 1/2 버튼을 사용하여 40x 이미지를 절반 크기로 축소합니다. 드롭다운 메뉴에서 사용할 수 있는 크기 조정 옵션은 5x, 2x, 없음, 1/2, 1/5입니다.
참고: 기계 학습은 10x 및 20x 이미지로 학습되었습니다. 다른 배율로 촬영한 이미지에서 셀 경계를 인식하지 못할 수 있습니다. 이 경우 이진 이미지는 완전히 검은 색으로 나타납니다. - Arti Filter: 아티팩트 필터 탭을 사용하여 이미지에 존재할 수 있고 세포 경계 분할을 방해할 수 있는 매우 밝은 입자(망막의 파편 또는 작은 부분 또는 시신경 주변의 결합 조직)를 제거합니다. 기본적으로 필터가 사용되지 않습니다. 드롭다운 메뉴의 인공 필터 옵션은 일반, 강함 및 약함입니다.
- 일괄 처리 크기: 텍스트 상자에 값 20을 좋은 시작점으로 입력하되 시스템에 GPU(그래픽 처리 장치)가 부족한 경우 값을 낮춥니다.
- 바둑판식 배열 이미지 옵션 탭에서 텍스트 상자에 값을 삽입하여 Pad Tiles 기준 매개 변수를 조정하여 이미지 타일 간의 겹침 정도를 지정합니다. 일반적으로 100픽셀이 겹치면 잘 작동합니다.
- 출력 그래픽 옵션 탭에서 히트맵 생성을 위한 설정을 조정합니다.
- 바둑판식 이미지 재구성?: 시스템에 큰 이미지 분석을 위한 리소스가 충분하지 않은 경우 아니요 확인란을 선택하여 소프트웨어가 전체 이미지를 재구성하지 않고 개별 타일을 저장하여 분석을 완료할 수 있도록 합니다.
- 컬러 이미지 만들기: 히트맵을 생성하려면 드롭다운 메뉴에서 모두를 선택합니다.
- 색상 지정의 경우 드롭다운 메뉴에서 사용할 수 있는 다양한 색상 팔레트( 열, 녹색, Mpl-마그마, 위상, 불, 제트, 청록색 핫) 중 하나를 선택합니다.
- 이미지 형식의 경우 탭에서 옵션 중 하나를 선택하여 이미지를 TIF 또는 PNG로 저장합니다.
- 수동 제한 사용? 기능과 관련하여 소프트웨어가 각 이미지에서 감지된 최소값과 최대값을 사용할 수 있도록 하려면 아니요 확인란을 선택합니다. 예 확인란을 선택하여 각 모양 메트릭 히트맵의 값 범위를 수동으로 조정하고 Set Limits(제한 설정) 버튼을 클릭하여 텍스트 상자에 값을 삽입하여 개별 매개 변수의 범위를 선택합니다. 관심 있는 값을 변경한 후 저장을 클릭합니다. 기본값 로드를 클릭하여 모든 제한을 재설정합니다.
참고: 여러 이미지의 히트맵을 비교해야 하는 경우(예: 셀 모양에 대한 다른 화합물의 영향을 비교할 때) 수동 제한을 사용합니다. 이렇게 하면 동일한 범위의 값이 사용됩니다. 수동으로 입력할 값 집합은 샘플 유형에 따라 다릅니다. 최적의 범위를 선택하기 위해 몇 번의 반복을 실행하는 것이 좋습니다.
- 분석에 대한 셀 크기 제한 탭에서 분석 에 대한 셀 크기 임계값 을 선택합니다.
- [셀 크기 축소]에서 텍스트 상자에 분석에 포함할 가장 작은 셀의 크기를 삽입합니다.
- [위쪽 셀 크기]에서 텍스트 상자에 분석에 포함할 가장 큰 셀의 크기를 삽입합니다.
참고: 셀 크기의 단위는 자동 단위 변환 탭에서 선택한 옵션에 따라 픽셀에서 마이크로미터 제곱으로 변경됩니다.
- 자동 단위 변환 탭에서 분석에 사용할 기본 단위를 선택합니다.
- 픽셀을 실제 단위로 변환하시겠습니까?에서 아니요 상자를 선택하여 픽셀 단위로 분석을 실행합니다. 예 상자를 선택하여 마이크로미터 단위로 분석을 실행합니다.
- 배율 막대의 길이(픽셀)에서 텍스트 상자에 픽셀 값을 입력합니다.
- 눈금 막대의 길이(미크론)에서 텍스트 상자에 해당 거리를 마이크로미터 단위로 입력합니다.
- 분석을 시작하려면 Go For It을 누릅니다.
참고: 소프트웨어는 세포가 4',6-디아미디노-2-페닐인돌(DAPI) 및 요오드화프로피듐(CZI 옵션 탭)으로 염색될 때도 세포 생존율을 측정할 수 있지만 RPE 플랫마운트에는 적용되지 않습니다.
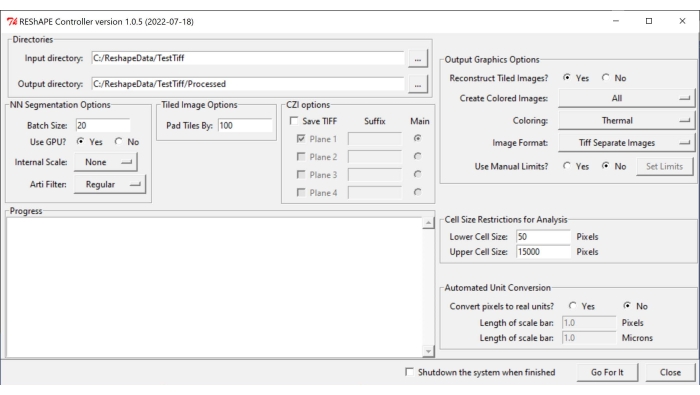
그림 1: REShAPE 그래픽 사용자 인터페이스. GUI에는 작업 디렉토리 선택(디렉토리 탭), 세그멘테이션 옵션 수정(NN 세그멘테이션 옵션 및 바둑판식 이미지 옵션 탭), 분석을 위한 매개변수 지정(분석 및 자동 단위 변환에 대한 셀 크기 제한) 및 히트맵 생성(출력 그래픽 옵션 탭)을 위한 다양한 탭이 있습니다. 약어: GUI = 그래픽 사용자 인터페이스. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
결과
이 프로토콜은 올바르게 식별된 모든 RPE 셀에 대해 셀 위치와 30개의 형상 메트릭이 측정되는 플랫마운트의 단일 평면 이미지를 생성합니다(그림 2). "처리됨"이라는 폴더가 입력 디렉터리 내에 자동으로 생성됩니다. 이 폴더에는 "분석", "색상 코드", "결합된 파일" 및 "세그먼트화된 이미지"라는 네 개의 하위 디렉터리와 분석 중에 생성된 일부 임시 파일이 포함되어 있습니다. "결합 된 파일"폴더에는 모든 모양 측정 값이 포함 된 스프레드 시트와 결합 된 모든 파일의 셀 이웃 횟수 빈도가있는 스프레드 시트가 포함되어 있습니다. "분석" 폴더에는 모든 모양 측정값이 포함된 스프레드시트와 각 이미지에 대한 셀 이웃 카운트의 빈도가 포함된 스프레드시트가 포함되어 있습니다. "세그먼트화된 이미지" 디렉토리에는 RPE 셀 테두리의 최종 이진 마스크가 포함되어 있습니다. 세분화의 품질을 평가하는 데 사용할 수 있습니다. "Color Coded" 디렉토리에는 각 이미지의 모양 패턴을 시각화하기 위한 각 모양 측정에 대한 히트맵이 포함되어 있습니다. 형상 메트릭 정의 및 약어는 표 1에서 찾을 수 있습니다.
때때로 RPE 플랫마운트에는 특히 시신경 주변에서 깨끗하게 제거되지 않은 잔여 망막 조각이 포함될 수 있습니다. 샘플의 팔로이딘 염색은 망막에서 강한 신호를 유발하며, 이는 RPE 세포 경계 분할에 문제를 일으킬 수 있습니다. 일부 타일은 완전히 검은색으로 표시되고 주변 타일은 일반 분할을 표시합니다. 이미지에 존재할 수 있는 다른 밝은 물체도 검은색 타일을 생성합니다(그림 3). 이러한 경우 Arti 필터 드롭다운 메뉴에서 사용할 수 있는 필터링 옵션(약함, 일반, 강함) 중 하나를 선택하면 검은색 타일이 형성되는 것을 방지할 수 있습니다.
REShAPE는 8비트 또는 16비트 그레이스케일 이미지를 입력으로 사용하지만 RGB 이미지는 사용하지 않습니다. REShAPE 분석에 RGB 이미지를 사용하면 완전히 검은색 이진 이미지가 생성됩니다. 이 경우 RGB 이미지를 그레이스케일로 변환하면 올바르게 분할된 이진 이미지가 생성됩니다(그림 4). RPE 경계가 올바르게 인식되지 않는 경우, 예를 들어 염색이 최적이 아니거나 샘플이 스크래치에 의해 손상된 경우(그림 5A), 큰 세포 덩어리가 하나의 매우 큰 세포로 식별될 수 있습니다(그림 5B). 이 경우 큰 물체는 세포 크기 임계 값을 줄임으로써 분석에서 제외 될 수 있습니다 (그림 5C). 이렇게 하려면 위쪽 셀 크기 텍스트 상자에 더 낮은 값을 삽입할 수 있습니다. 그러나 이로 인해 히트맵의 범위가 변경됩니다. 연구원이 그렇게 하기로 선택한 경우 수동 제한 사용? 기능에서 예 확인란을 선택하여 원래 히트맵 범위(그림 5D)를 유지할 수도 있습니다. 그런 다음 연구원은 Set Limits 버튼을 마우스 왼쪽 버튼으로 클릭하고 텍스트 상자에 원하는 값을 삽입하여 수동 한계를 지정해야 합니다.
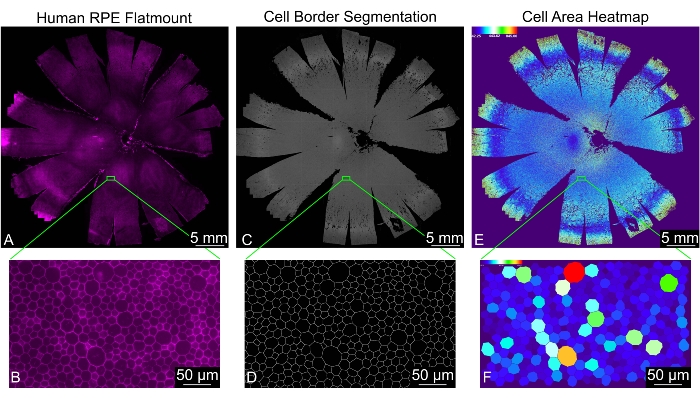
그림 2: 전체 인간 RPE 단층의 완전한 형태 분석 (A) 전체 인간 RPE/맥락막 플랫마운트(마젠타: 팔로이딘)의 저배율 보기. (B) 팔로이딘으로 염색된 RPE 세포의 확대 보기. (C) 전체 인간 RPE/맥락막 플랫마운트에 대한 RPE 셀 경계의 REShAPE 생성 분할 및 (D) 해당 확대 보기. (e) 전체 인간 플랫마운트에서 개별 RPE 셀의 셀 영역을 나타내는 소프트웨어 생성 히트맵. 왼쪽 상단 모서리의 열 눈금은 사용된 값의 범위를 보여줍니다. (F) 영역별로 색상이 지정된 개별 RPE 셀을 보여주는 해당 확대 보기. 스케일 바 = (B, D, F) 50 μm, (A, C, E) 5 mm. 약어 : RPE = 망막 색소 상피. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
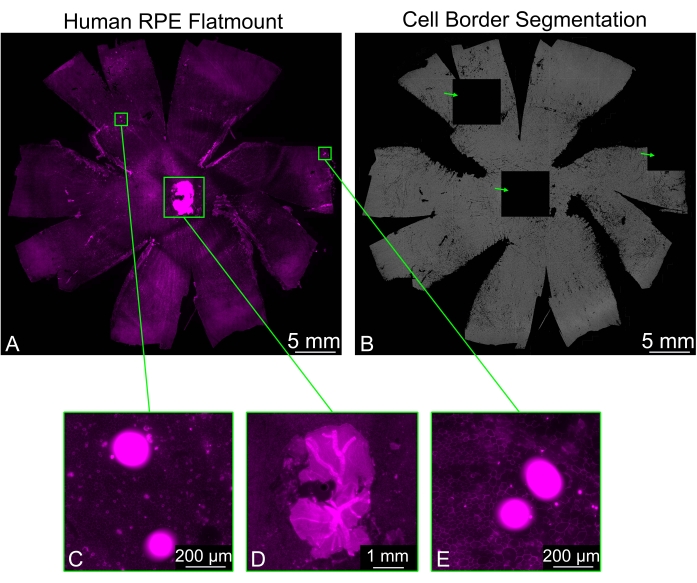
그림 3: 밝은 아티팩트 필터링. (A) 세포 경계 (자홍색 : phalloidin)에 대해 염색 된 인간 RPE 플랫 마운트는 분할을 방해하는 밝은 영역 (녹색 직사각형)을 나타낼 수 있습니다. (b) 전체 플랫마운트의 RPE 셀 경계 분할은 밝은 형광 영역에 해당하는 3개의 완전히 검은색 타일(녹색 화살표)을 포함합니다. (씨,이) 검은 색 타일 중 두 개는 밝은 점이 포함 된 영역에 해당하며 일부 파편 일 수 있습니다. (D) 검은 타일 중 하나가 올바르게 제거되지 않은 시신경 주위의 신경 망막 조각에 의해 생성되었습니다. 신경 망막 조각은 RPE 층보다 상당히 밝으며 세포 분할을 방해합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: 입력 이미지 필수 구성 요소 세포 경계에 대해 염색된 RPE 세포는 REShAPE 분석을 위해 (A) RGB 또는 (B) 그레이스케일 16비트 이미지로 저장되었습니다. (C) RBG 이미지 분석의 출력은 검은 색 이진 이미지이며, (D) 그레이 스케일 이미지의 분석은 셀 경계의 올바르게 분할 된 바이너리를 생성합니다. REShAPE는 8비트 또는 16비트 그레이스케일 이미지만 분석할 수 있습니다. 스케일 바 = 50 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5: 최적이 아닌 결과 . (A) 팔로이딘으로 염색된 세포가 우발적으로 긁힌 RPE 단층의 일부 이미지. (B) 셀 영역의 차원에 따라 색상이 지정된 RPE 셀의 히트맵. 큰 상위 셀 크기 임계값에는 분석에 큰 객체가 포함됩니다. (C) 분석에서 큰 객체를 제외하기 위해 더 작은 상위 셀 크기 임계값을 선택한 셀 영역 히트맵. (D) 더 작은 상위 셀 크기 임계값을 선택하고 원래 사용된 히트맵 범위를 유지하기 위해 수동 제한을 설정한 셀 영역 히트맵. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
표 1: REShAPE 매개변수. 이 표는 각 매개 변수의 정의와 원시 스프레드시트("_Data.csv" 파일) 및 히트맵에 사용된 약어를 보고합니다. 이 표를 다운로드하려면 여기를 클릭하십시오.
토론
인간 RPE와 망막의 일관되고 효율적인 분리는 이 프로토콜을 사용하여 달성할 수 있습니다. 이 방법을 사용하면 전체 인간 망막에서 RPE 모양의 지역적 차이를 연구 할 수 있습니다5. 프로토콜에서 중요한 단계는 RPE와 망막의 물리적 분리입니다. 두 조직이 일부 영역에서 완전히 분리되지 않은 경우 망막을 부드럽게 들어 올려 조직이 부러지지 않도록해야합니다. 대형 플랫마운트의 REShAPE 분석에는 상당한 RAM 리소스가 있는 시스템을 사용해야 할 수 있습니다. 이 경우 전체 이미지의 리어셈블리를 비활성화하여 처리 리소스가 부족함에도 불구하고 소프트웨어가 분석을 성공적으로 완료할 수 있습니다.
REShAPE를 사용하여 인간 RPE 플랫마운트를 분할할 때의 주요 한계는 AI 알고리즘이 대부분 유도만능줄기세포 유래 RPE의 이미지에 대해 훈련되었다는 것입니다. 결과적으로 인간 RPE 플랫마운트의 세분화는 덜 정확합니다. 노화 된 기증자의 RPE 세포에는 다량의 lipofuscin7이 포함되어 있으며자가 형광의 광범위한 스펙트럼은 세포 경계 분할을 방해합니다. 앞으로 RPE 플랫마운트의 더 많은 이미지가 이러한 종류의 샘플에서 세포 경계 분할을 개선하는 데 사용될 것입니다. 이러한 한계에도 불구하고 REShAPE는 RPE 세포 경계를 인식하고 분할하도록 특별히 훈련되었으며 RPE 세포의 Voronoi8 및 CellProfiler9 분할과 같은 다른 기존 방법보다 더 나은 성능을 발휘합니다.
또한 수동 분할 10에 비해 REShAPE는 큰 이미지를 빠르게 분석할 수 있는 이점을 제공합니다(~130,000픽셀 x130,000픽셀 테스트 완료). 결론적으로,이 해부 방법은 재현성이 높으며 다른 동물 모델로 쉽게 확장 할 수 있습니다. 또한 이 소프트웨어를 사용하여 아이 플랫마운트 또는 세포 배양 모델에서 RPE 모양을 연구하여 특정 치료의 효과를 검사할 수 있습니다. 마지막으로, REShAPE의 다양성은 다른 유형의 상피 세포 분석에 광범위하게 적용 할 수 있습니다.
공개
저자는 공개 할 이해 상충이 없습니다.
감사의 말
Zeiss Axio Scan.Z1을 사용해 주신 NEI(National Eye Institute) 조직학 코어에 감사드립니다. 또한 기부자, 그 가족, 전진 시력 네트워크 및 라이온스 안과 연수회에 대한 관대함에 감사드립니다. 이 작업은 NEI IRP 기금 (보조금 번호 ZIA EY000533-04)의 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| Biopsy punch 1.5 mm | Acuderm Inc. | P1525 | |
| Bovine albumin | MP Biomedicals | 160069 | |
| Coverglass 50 x 75 mm, #1.5 thickness | Brain Research Laboratories | 5075-1.5D | |
| Curved spatula | Katena | K3-6600 | |
| D-Mannitol | Sigma | M9546 | |
| DPBS 1x with Ca2+ and Mg2+ | Gibco | 14040-133 | |
| Fine Scissors | Fine Science Tools | 14558-11 | |
| Fluormount-G | Southern Biotech | 0100-01 | |
| Forceps - Dumont #5 | Fine Science Tools | 11252-23 | |
| Microscope slides 50 x 75 x 1.2 mm | Brain Research Laboratories | 5075 | |
| Needles 21 G x 1-1/2" hypodermic | Becton Dickinson (BD) | 305167 | |
| Needles 27 G x 1-1/4" hypodermic | Becton Dickinson (BD) | 305136 | |
| Paraformaldehyde 16% | Electron Microscopy Sciences | 15710 | |
| Petri dish 100 mm | Corning | 430167 | |
| Phalloidin-iFluor 647 | Abcam | ab176759 | |
| Razor blades | PAL (Personna) | 62-0177 | |
| Round bottom tubes 50 mL | Newegg | 9SIA4SR9M88854 | |
| Silicon Elastomer Kit | Dow Corning Corporation | 4019862 | |
| Square weighing boat (81 mm x 81 mm x 25 mm) | Sigma | W2876 | |
| Surgical Vitrectomy System | BD Visitrec | 585100 | optional |
| Syringe 1 mL | Becton Dickinson (BD) | 309659 | |
| Triton X-100 | Sigma | T9284 | |
| TrueBlack | Biotium | 23007 | autofluorescence quencher |
| Tween 20 | Affymetrix | 20605 | |
| Vannas Spring Scissors - 3 mm cutting edge | Fine Science Tools | 15000-10 |
참고문헌
- Endo, E. G., Yao, X. Y., Marmor, M. F. Pigment adherence as a measure of retinal adhesion: Dependence on temperature. Investigative Ophthalmology and Visual Science. 29 (9), 1390-1396 (1988).
- Marmor, M. F. Retinal detachment from hyperosmotic intravitreal injection. Investigative Ophthalmology and Visual Science. 18 (12), 1237-1244 (1979).
- Marmor, M. F., Martin, L. J., Tharpe, S. Osmotically induced retinal detachment in the rabbit and primate. Electron microscopy of the pigment epithelium. Investigative Ophthalmology and Visual Science. 19 (9), 1016-1029 (1980).
- Ban, Y., Rizzolo, L. A culture model of development reveals multiple properties of RPE tight junctions. Molecular Vision. 3, 18(1997).
- Ortolan, D., et al. Single-cell-resolution map of human retinal pigment epithelium helps discover subpopulations with differential disease sensitivity. Proceedings of the National Academy of Sciences of the United States of America. 119 (19), 2117553119(2022).
- Schaub, N. J., et al. Deep learning predicts function of live retinal pigment epithelium from quantitative microscopy. Journal of Clinical Investigation. 130 (2), 1010-1023 (2020).
- Beatty, S., Koh, H. -H., Phil, M., Henson, D., Boulton, M. The role of oxidative stress in the pathogenesis of age-related macular degeneration. Survey of Ophthalmology. 45 (2), 115-134 (2000).
- Liu, Z., Kocaoglu, O. P., Miller, D. T. 3D imaging of retinal pigment epithelial cells in the living human retina. Investigative Ophthalmology and Visual Science. 57 (9), 533-543 (2016).
- Bhatia, S. K., et al. Analysis of RPE morphometry in human eyes. Molecular Vision. 22, 898-916 (2016).
- vonder Emde, L., et al. Histologic cell shape descriptors for the retinal pigment epithelium in age-related macular degeneration: A comparison to unaffected eyes. Translational Vision Science & Technology. 11 (8), 19(2022).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유