Method Article
Agrobacterium tumefaciens- التحول الوراثي بوساطة لسان الحمل ضيق الأوراق
In This Article
Summary
بسبب تطبيقه المتنوع كنوع نموذجي في مختلف مجالات الدراسة ، هناك حاجة إلى مجموعة أدوات التحول الجيني في الموز ضيق الأوراق (Plantago lanceolata). هنا ، باستخدام التحول بوساطة Agrobacterium tumefaciens، يتم تقديم بروتوكول ينتج عنه خطوط محورة وراثية مستقرة بكفاءة تحويل تبلغ 20٪.
Abstract
الأنواع في جنس Plantago لها العديد من السمات الفريدة التي أدت إلى تكييفها كنباتات نموذجية في مختلف مجالات الدراسة. ومع ذلك ، فإن عدم وجود نظام التلاعب الجيني يمنع التحقيق المتعمق في وظيفة الجينات ، مما يحد من تنوع هذا الجنس كنموذج. هنا ، يتم تقديم بروتوكول تحويل ل Plantago lanceolata ، أكثر أنواع Plantago شيوعا. باستخدام التحول بوساطة Agrobacterium tumefaciens، أصيبت جذور نباتات P. lanceolata المزروعة بشكل معقم بالبكتيريا بالبكتيريا ، وتم تحضينها لمدة 2-3 أيام ، ثم تم نقلها إلى وسط تحريض الساق مع اختيار المضادات الحيوية المناسبة. ظهرت البراعم عادة من الوسط بعد شهر واحد ، وتطورت الجذور بعد 1-4 أسابيع من نقل البراعم إلى وسط تحريض الجذر. ثم تأقلمت النباتات مع بيئة التربة واختبرت لوجود جين محوري باستخدام مقايسة مراسل β-glucuronidase (GUS). كفاءة التحول للطريقة الحالية هي ~ 20٪ ، مع ظهور نباتين معدلين وراثيا لكل 10 أنسجة جذرية محولة. إن إنشاء بروتوكول تحويل لسان الحمل ضيق الأوراق سيسهل اعتماد هذا النبات كنوع نموذجي جديد في مناطق مختلفة.
Introduction
ظهر مفهوم استخدام الأنواع النموذجية للتحقيق في جوانب متعددة من بيولوجيا النبات مع الاستخدام الواسع النطاق ل Arabidopsis thaliana1. تم اختيار Arabidopsis في البداية لأنه يشترك في الميزات مع العديد من النباتات المزهرة الأخرى وله سمات متعددة تجعله مناسبا للدراسة في بيئة معملية ، مثل كونه صغيرا وله دورة جيل قصيرة. إن الحجم الكبير من الأوراق البحثية المنشورة معه كموضوع ، إلى جانب صغر حجم الجينوم وسهولة التحول الجيني2 ، يمكنه من الاستمرار ككائن تجريبي يستخدم على نطاق واسع. ومع ذلك ، يمكن أن يكون Arabidopsis محدودا كنموذج للأنواع ذات الخصائص المختلفة أو السمات الفريدة3. وقد دفع هذا إلى تطوير أنظمة نموذجية جديدة ، مثل الذرة (Zea mays) ، وهي نبات مهم لعلم الوراثة التنموية في أحاديات الفلقة4 ، والطماطم (Solanum lycopersicum) ، وهو نموذج مهم للدراسات التطورية ، وتطوير الفاكهة ، والإنتاج ، وهو تمثيل جيد لمحاصيل الخضروات5. طريقة التحول الوراثي هي شرط أساسي لنوع النبات ليكون بمثابة كائن نموذجي2. يعد التحول بوساطة Agrobacterium tumefaciens. وقد استخدم لتحويل عدد قليل من الأنواع النموذجية والمحاصيل الرئيسية، بما في ذلك التبغ (نيكوتيانا تاباكوم)6، والأرز (أوريزا ساتيفا)7، والقطن (جوسيبيوم هيرسوتوم)8، وفول الصويا (جلايسين ماكس)9، والبطاطا (Solanum tuberosum)10، والكانولا (براسيكا نابوس)11. الأنواع النباتية متغيرة للغاية في مدى نجاحها في الاستجابة لعدوى A. tumefaciens ، وغالبا ما تحتاج بروتوكولات التحويل إلى أن تكون مصممة بشكل فردي لكل نوع 6,12.
يشمل جنس Plantago ما مجموعه 256 نوعا من النباتات ، موزعة على نطاق واسع في جميع أنحاء العالم13. غالبا ما يكون للأنواع في هذا الجنس خصائص فريدة تجعلها مرغوبة كأنواع نموذجية لدراسة علم الوراثة ، والبيئة ، وفسيولوجيا الإجهاد ، والمستقلبات الثانوية ، والكيمياء الطبية ، والتفاعلات بين النبات والميكروبات ، وتطور النبات ، والتطور. كان Plantago lanceolata ، المعروف أيضا باسم لسان الحمل الضيق أو ريبورت ، نباتا شائعا ذا أهميةمنذ القرن 19 ، عندما تم استخدامه لأول مرة لوصف ظاهرة عقم الذكور14. مثل النباتات الأخرى من جنسه ، فقد تم استخدامه في الدراسات عبر مختلف مجالات البحث. في الآونة الأخيرة ، تم اقتراحه كنموذج لبيولوجيا الأوعية الدموية ، حيث يمكن جمع أنسجة الأوعية الدموية بسهولة15. P. lanceolata هو النوع الأكثر شيوعا في جنس Plantago. ذكرت مقالة عام 2021 أن هناك >1,400 منشور بما في ذلك أو يتعلق بهذا النوع في ذلك الوقت16 ، وتم نشر 102 مقالة إضافية منذ بداية عام 2022 ، وفقا لبحث PubMed الذي تم إجراؤه في 9ديسمبر 2022. النبات التالي الأكثر دراسة في الجنس ، P. Major ، هو موضوع 414 مقالة فقط عند البحث باستخدام نفس المعايير في نفس التاريخ.
على الرغم من الاهتمام البحثي ب P. lanceolata ، فإن الدراسات ، خاصة حول توصيف وظيفة الجينات ، غالبا ما تكون محدودة بسبب عدم وجود مجموعة أدوات للتلاعب الجيني للأنواع. بذل Pommerrienig et al. جهودا لتطوير بروتوكول تحويل ل P. major باستخدام تقنية غمس الأزهار17. ومع ذلك ، لا يمكن تطبيق هذه الطريقة على P. lanceolata بسبب خاصية عقم الذكور لهذا النوع18,19. على حد علمنا ، لا يوجد بروتوكول حالي لتحويل P. lanceolata.
تقدم هذه الدراسة بروتوكولا بسيطا للتحول بوساطة A. tumefaciensمن P. lanceolata. من خلال استهداف أنسجة الجذر ، يمكن إنشاء نباتات معدلة وراثيا كاملة النمو في غضون 3 أشهر من التحول.
Protocol
ملاحظة: يجب تنفيذ الخطوات 1.4-1.8 و 2.3-2.5 و 3.3-3.6 و 4.1-4.6 و 5.1-5.7 و 6.1-6.3 في ظروف معقمة ، باستخدام غطاء نظيف لمنع التلوث.
1. إكثار المواد النباتية للتحول
- ضع بذور لسان الحمل من النوع البري (WT) المتاحة تجاريا (انظر جدول المواد) في أنبوب طرد مركزي سعة 50 مل حتى خط 5 مل ، اعتمادا على عدد النباتات المطلوبة.
ملاحظة: بدلا من ذلك ، يمكن استخدام أنبوب طرد مركزي دقيق سعة 2 مل عند الحاجة إلى عدد صغير من البذور ، ولكن يجب ملؤه بحجم لا يزيد عن 0.1 مل ، لأن الكثير من البذور يمكن أن يقلل من كفاءة التعقيم. - اغمر البذور في 75٪ إيثانول لمدة 60 ثانية.
- تخلص من الإيثانول ، ثم اغمر البذور في 20٪ هيبوكلوريت الصوديوم (20٪ كلوريد الصوديوم ، 80٪ ماء معقم) لمدة 40 دقيقة ، مع قلب الأنبوب برفق حتى تتلامس جميع البذور مع المحلول.
ملاحظة: يجب أن يكون محلول هيبوكلوريت الصوديوم طازجا للحصول على أفضل النتائج. - تحت غطاء التدفق الصفحي ، تخلص من محلول هيبوكلوريت الصوديوم ، ثم اغسل البذور بالماء المقطر (خمس مرات). أضف كمية صغيرة من الماء إلى البذور بعد الشطف النهائي ، حيث يمكن أن يساعد ذلك في حركة النباتات على الألواح.
- باستخدام ملقط معقم ، انقل البذور إلى أطباق بتري معدة مسبقا مقاس 95 مم × 100 مم مع وسط MS صلب (الجدول 1). انشر البذور بالتساوي على سطح الطبق ، مع حوالي 1 سم بين كل بذرة لمنع اكتظاظ الشتلات النابتة (الشكل 1 أ).
- أغلق الألواح بطبقتين من فيلم البارافين لمنع التلوث ، ثم احتضانها تحت ضوء نمو أبيض بارد (انظر جدول المواد) في درجة حرارة الغرفة (22 درجة مئوية مع 50 ميكرومول م -2ثانية -1 ، 12 ساعة أيام). تنبت البذور عادة في غضون 5-6 أيام.
- عندما تنبت الشتلات وتكون كبيرة بما يكفي لنقلها (الشكل 1 ب) ، عادة بعد يومين أو 3 أيام من الإنبات ، استخدم ملقط معقم لنقل الشتلات إلى صناديق معقمة مع 50-100 مل من وسط MS (الجدول 1). من الناحية المثالية ، قم بزراعة خمس شتلات فقط لكل صندوق للحصول على أفضل جودة للجذور.
- أغلق الصناديق بشريط جراحي ، ثم اترك النباتات تنمو تحت ضوء نمو أبيض بارد (انظر جدول المواد) ، في نفس الظروف المذكورة في الخطوة 1.6. يجب أن تكون النباتات جاهزة للتحول في حوالي 3-4 أسابيع ، أو عندما تنمو الجذور الرئيسية بطول حوالي 2 سم وتظهر الجذور الجانبية بيضاء.
ملاحظة: يتم تضمين وصفات التحضير المتوسطة ومخزون الفيتامينات في الجدول 1 والجدول 2.
2. بناء البلازميد وتحويل الإشريكية القولونية
ملاحظة: يختلف إجراء بناء البلازميد الدقيق اعتمادا على الجين محل الاهتمام. في هذا الإجراء ، تم استخدام إنزيمات التقييد HindIII و SalII لإدخال محفز AtPP2 1.5 كيلو بايت في البلازميد الثنائي pBI101 (انظر جدول المواد) مع GUS ، باستخدام إجراء الاستنساخ القياسي20. AtPP2 (بروتين اللحاء 2) هو جين يتم التعبير عنه على وجه التحديد في اللحاء21.
- استنساخ المروج باستخدام أزواج التمهيدي 5'-AGTCAAGCTTCAAGTCCCTGTGGCTACTGAAC-3' (إلى الأمام) و 5'-AGTCGTCGACAAACCAACCAGATGATGATATTTATTTTTG-3' (عكس) من أرابيدوبسيس. يوضح الشكل 2 مخططا لمتجه البلازميد الثنائي مع إدراج AtPP2: GUS .
- بعد بناء البلازميد ، قم بتحويل البلازميدات إلى DH5a E. coli (انظر جدول المواد) الخلايا المختصة باستخدام طريقة الصدمة الحرارية22 ، ثم احتضانها لمدة 1.5 ساعة عند 37 درجة مئوية مع الاهتزاز (150 دورة في الدقيقة).
- خذ 150 ميكرولتر من كل مزرعة تحويل ، لوحة على ألواح وسائط أجار LB (الجدول 1) مع الاختيار المناسب (50 مجم / لتر كاناميسين للسلالة المستخدمة في هذا البروتوكول ؛ انظر جدول المواد) ، ثم احتضان الألواح لمدة 16-24 ساعة عند 37 درجة مئوية.
ملاحظة: السلالة البكتيرية المستخدمة في هذه الدراسة هي A. tumefaciens GV3101. - بعد ذلك ، استخدم مستعمرة PCR لفحص المستعمرات بحثا عن المؤتلفات الإيجابية23.
ملاحظة: في هذا البروتوكول ، تم استخدام البادئات التالية لتضخيم الجين المستهدف ؛ 5'-ATGTTACGTCCTGTAGAAACCCCAA-3'(إلى الأمام) و 5'-TCATTGTTTGCCTCCCTGCTGC-3' (عكسي).- قم بتشغيل التفاعل في دورة حرارية (انظر جدول المواد) مع ظروف دورة مدتها 3 دقائق عند 95 درجة مئوية ، تليها 35 دورة: 30 ثانية عند 95 درجة مئوية ، 30 ثانية عند 55 درجة مئوية ، 2 دقيقة عند 72 درجة مئوية ، وخطوة استطالة نهائية لمدة 10 دقائق عند 72 درجة مئوية.
- تلقيح المستعمرات الموجبة في 6 مل من مرق LB (الجدول 1) بالمضاد الحيوي المناسب (50 مجم / لتر كاناميسين) وتنمو عند 37 درجة مئوية طوال الليل ، عند 200-250 دورة في الدقيقة.
- بعد النمو بين عشية وضحاها ، استخراج البلازميدات من البكتيريا باستخدام الإجراءات القياسية24.
3. تحويل A. tumefaciens مع البلازميد
- بعد استخراج البلازميد ، استخدم التثقيب الكهربائي لتحويل البلازميد المعدل إلى السلالة المطلوبة من الخلايا المختصة. في هذا الإجراء ، تم استخدام سلالة A. tumefaciens GV3101. اتبع الطرق الموحدة لتقنيات التثقيب الكهربائي25.
- بعد التثقيب الكهربائي ، أعد تعليق الخلايا المختصة في 1 مل من مرق LB ثم احتضانها لمدة 2-4 ساعات عند 28 درجة مئوية عند 100 دورة في الدقيقة.
- اجمع الخلايا من خلال الطرد المركزي عند 6800 × جم لمدة 3 دقائق في جهاز طرد مركزي دقيق منضدية (انظر جدول المواد) في درجة حرارة الغرفة (22 درجة مئوية) ، ثم انشر 50-100 ميكرولتر على صفيحة أجار LB مع عامل اختيار مناسب (50 مجم / لتر كاناميسين للبلازميد المستخدم في هذا البروتوكول).
- بعد تحضين الخلايا لمدة يومين عند 28 درجة مئوية ، حدد المستعمرات الإيجابية التي تحتوي على الجين محل الاهتمام من خلال استخدام مستعمرة PCR. في هذا البروتوكول ، استخدم البادئات والشروط المذكورة في الخطوة 2.4.
- بعد ذلك ، استخدم المستعمرات الموجبة لرسم لوحة مخزون باستخدام وسائط LB agar + التحديد. يمكن تخزين اللوحة في 4 °C لمدة تصل إلى 1 شهر.
- بدلا من ذلك ، للتخزين طويل الأجل ، قم بتلقيح مستعمرة إيجابية بحجم صغير من LB مع الاختيار المناسب. رج المستنبتة الملقحة طوال الليل عند 28 درجة مئوية عند 200 دورة في الدقيقة ، ثم قم بإعداد مخزون الجلسرين (50٪ وزن / وزن من الجلسرين في مزيج 50:50 من البكتيريا والجلسرين) ، والذي يمكن تخزينه عند -80 درجة مئوية لمدة تصل إلى 10 سنوات.
4. إعداد A. tumefaciens
- قم بتحريك A. tumefaciens التي تحتوي على البلازميد المطلوب على ألواح LB صلبة مقاس 95 مم × 100 مم مع عامل الاختيار المناسب. في هذا البروتوكول ، تم استخدام السلالة البكتيرية GV3101 مع إدخال البلازميد AtPP2: GUS ، مع إضافة 50 مجم / لتر كاناميسين للاختيار.
- أغلق الألواح بغشاء البارافين ، ثم احتضانها عند 28 درجة مئوية لمدة تصل إلى 48 ساعة ، أو حتى تنمو البكتيريا بشكل كبير بما يكفي للقطف.
- استخدم طرف ماصة لاختيار مستعمرة البكتيريا قبل يومين من التحول ، وتلقيحها في أنبوب قاع دائري سعة 15 مل يحتوي على 6 مل من LB السائل مع الاختيار المناسب. رج العبوة بسرعة 200 دورة في الدقيقة في شاكر منضدية بدرجة حرارة 28 درجة مئوية طوال الليل ، حتى يصل OD600 إلى 0.6-0.7.
ملاحظة: يمكن تخزين الألواح والتلقيح البكتيري 6 مل عند 4 درجة مئوية لمدة تصل إلى 1 شهر. - عندما تصل البكتيريا إلى OD 600 الصحيح ، استخدم ماصة لنقل A. tumefaciens إلى دورق معقم يحتوي على100 مل من LB السائل مع عامل اختيار. عادة ما يكون 200 ميكرولتر من البكتيريا لكل 100 مل رطل مناسبا للتكاثر. رج العبوة عند 200 دورة في الدقيقة عند 28 درجة مئوية طوال الليل ، حتى يصل OD600 إلى 0.6-0.7.
- نقل البكتيريا إلى أنابيب طرد مركزي معقمة سعة 50 مل ، وأجهزة طرد مركزي عند 2200 xg لمدة 10 دقائق في درجة حرارة الغرفة (22 درجة مئوية) في جهاز طرد مركزي منضدية لجمع البكتيريا.
- تخلص من المادة الطافية باستخدام ماصة. أعد تعليق الحبيبات البكتيرية في 5 مل من محلول التعليق السائل (SS) بدرجة حرارة الغرفة (22 درجة مئوية) (الجدول 1) عن طريق السحب ، ثم أضف ما يصل إلى 50 مل من SS واقلبها عدة مرات للخلط. البكتيريا جاهزة الآن للتحول.
ملاحظة: يجب تحضير SS السائل طازجا ، في غضون 1 أسبوع من التحول.
تنبيه: يجب التخلص من جميع المواد التي تتلامس مع A. tumefaciens في صندوق نفايات بيولوجي. يمكن تعقيم السوائل المتبقية من الثقافات البكتيرية باستخدام هيبوكلوريت الصوديوم (التبييض) بتركيز 20٪ أو أعلى.
5. تحول جذور لسان الحمل
- عندما تصل النباتات إلى المرحلة المثالية للتحول (يبلغ عمر الشتلات 3 أسابيع) (الشكل 1 ج) ، استخدم ملقط ومقص معقم لفصل الجذور عن بقية النبات (الشكل 3 أ). تخلص من الأوراق والمواد الجذعية.
- مباشرة بعد القطع ، انقل قطع الجذر إلى صناديق معقمة تحتوي على ماء معقم باستخدام ملقط معقم. تسمح هذه الخطوة للجذور بالبقاء رطبة أثناء جمع جميع الأنسجة.
- عندما يتم قطع جميع الجذور ، صب تعليق A. tumefaciens/SS في أطباق بتري معقمة مقاس 150 مم × 15 مم يمكن التخلص منها. انقل الجذور إلى ثقافة A. tumefaciens وقم بتلقيحها لمدة 20 دقيقة على الأقل (الشكل 3 ب).
- أثناء الحضانة ، استخدم مشرطا معقما بشفرة حادة لقطع الجذور إلى شظايا 1 سم ، مع فصل الجذور الأولية عن الجذور الجانبية. قم بعمل جروح رقيقة ضحلة على سطح الجذور للسماح للبكتيريا بإصابة النبات.
ملاحظة: في حالة التعامل مع عدد كبير من النباتات ، انقل قطع الجذر إلى الثقافة البكتيرية على دفعات ، لضمان غمر جميع الجذور أثناء التلقيح. - بعد الحضانة ، استخدم الملقط المعقم لنقل قطع الجذر إلى مناشف ورقية معقمة لإزالة البكتيريا الزائدة. تجنب تجفيف الجذور لأكثر من 60 ثانية ، لأن هذا يمكن أن يسبب الجفاف ويتلف أنسجة الجذر. من الناحية المثالية ، يمكن تجفيف 10-15 جذور في وقت واحد (الشكل 3C).
- انقل الجذور المجففة إلى أطباق بتري 95 مم × 15 مم محضرة مع وسائط استزراع مشترك صلبة (الجدول 1) ، حوالي 10-20 جذور لكل طبق ، اعتمادا على حجم الجذور (الشكل 3 د).
- ختم الألواح بطبقتين من الفيلم البلاستيكي الشفاف ، ثم غطيها بورق الألمنيوم. احتضان في درجة حرارة الغرفة (22 درجة مئوية) لمدة 3 أيام. توفر هذه الخطوة وقتا للبكتيريا لإصابة الجذور دون وجود مجموعة من المضادات الحيوية (الشكل 3E).
6. اختيار وتجديد النبات كله
- بعد الحضانة في وسائط الاستزراع المشترك، انقل قطع الجذر إلى أطباق بتري المحضرة 95 مم × 15 مم مع وسائط تحريض الساق الصلبة (SIM) (الجدول 1) مع Timentin (500 مجم / لتر؛ انظر جدول المواد) واختيار المضادات الحيوية المناسبة. في هذا البروتوكول ، استخدمنا كاناميسين (100 مجم / لتر).
ملاحظة: يجب أن يتلامس الجزء السفلي من الجذور تماما مع الوسط. الجذور التي لا تلمس سطح الوسط طويلة جدا ويجب قطعها لمنع الأنسجة من الهروب من الاختيار. - أغلق الألواح بطبقتين من الفيلم البلاستيكي الشفاف ، ثم تنمو تحت ضوء النمو لمدة شهر واحد (انظر الخطوة 1.6 للظروف المناسبة) ، أو حتى تبدأ البراعم في الظهور.
ملاحظة: عادة ، يمكن ملاحظة الأحرف الأولى من تبادل لاطلاق النار بعد 2 أسابيع من النمو ، وعادة ما تكون البراعم مرئية بعد 1 شهر. - عندما يبلغ طول النباتات 1.5-2.0 سم (الشكل 1 د) ، انقلها إلى صناديق معقمة محضرة مع وسائط تحريض جذر صلبة (الجدول 1).
- قم بزراعة النباتات تحت ضوء النمو (انظر الخطوة 1.6 لمعرفة الظروف) لعدة أسابيع ، حتى تتشكل الجذور. يمكن رؤية الجذور عادة لأول مرة بعد 1 أسبوع.
ملاحظة: يوصى بالسماح للجذور بالنمو لعدة أسابيع قبل الانتقال إلى التربة ، حيث تميل النباتات ذات أنظمة الجذر الأكبر إلى أن يكون لها معدل بقاء أعلى في التربة.
7. نقل التربة
- عندما تصبح أنظمة الجذر كبيرة بما يكفي للنقل (الشكل 1E) ، عادة بعد شهر واحد من النمو ، انقل النباتات إلى 3.5 في أواني مربعة تحتوي على تربة مبللة مسبقا متعددة الأغراض (BM7). في هذا البروتوكول ، تم استخدام مزيج لحاء BM7 (انظر جدول المواد).
- قم بإزالة أي وسط يلتصق بالجذور عن طريق غسلها برفق في الماء.
ملاحظة: يمكن زراعة النباتات حتى النضج في دفيئة عند 800 إلى 1400 ميكرولتر فوتونات m-2 s-2 باستخدام مصابيح ضغط الصوديوم العالي 600 واط (انظر جدول المواد) ، أو في غرفة النمو في درجة حرارة الغرفة (22 درجة مئوية) مع أضواء بيضاء باردة عند 50 ميكرومول م -2 S-1 ، 12 ساعة أيام.
- قم بإزالة أي وسط يلتصق بالجذور عن طريق غسلها برفق في الماء.
- قم بتغطية النباتات بغطاء بلاستيكي ، ثم قم بتغطيتها بكيس بلاستيكي شفاف. تسمح هذه الخطوة للنباتات بالبقاء في بيئة رطبة أثناء تكيفها مع التربة.
- بعد حوالي 3-5 أيام ، قم بإزالة الكيس البلاستيكي ، ثم قم بإزالة الغطاء ببطء للسماح بالتأقلم مع البيئة الخارجية.
ملاحظة: اعتمادا على الوقت من السنة والبيئة التي يتم نقل النباتات إليها ، يمكن أن يختلف الوقت الذي تحتاجه النباتات للتكيف. يوصى بفحص النباتات يوميا وإضافة الماء إلى الأواني حسب الحاجة. - سقي النباتات بانتظام وأضف الأسمدة حسب الحاجة. يمكن أيضا نقل النباتات إلى أواني أكبر لمزيد من النمو (الشكل 1F).
8. تلطيخ β-جلوكورونيداز (GUS) النسيجي الكيميائي
- تحضير محلول تلطيخ β-glucuronidase (GUS) ، وفقا للبروتوكولات المنشورة15.
- عندما يبلغ طول الأحرف الأولى من اللقطة حوالي 0.5-1 سم ، قم بإزالة طرف صغير من ورقة صغيرة موسعة بالكامل (عادة ما يكون الطول <5 مم كافيا) وانقلها على الفور إلى 0.5-1 مل من محلول تلطيخ GUS في أنبوب طرد مركزي دقيق 1.5 أو 2 مل. يجب أن يغطي المحلول الأنسجة النباتية بالكامل.
- ضع الأنابيب المفتوحة في مجفف فراغ وفراغ عند 20-25 كيلو باسكال لمدة 5-10 دقائق. يجب أن تكون الفقاعات الصغيرة مرئية في المحلول أثناء إجراء الفراغ. هذا يسمح للحل بدخول خلايا النبات.
- اسمح للهواء بالترشيح مرة أخرى إلى مجفف التفريغ. أغلق الأنابيب واحتضانها عند 37 درجة مئوية طوال الليل (12 ساعة) ، أو حتى يصبح اللون الأزرق مرئيا.
ملاحظة: في هذه الدراسة ، كان نشاط GUS موضعيا في اللحاء ، مما يعني أنه في النباتات المتحولة إيجابيا ، يجب أن يكون التلوين الأزرق مرئيا فقط في أنسجة اللحاء. النباتات التي لا تحتوي على جين التحوير لا تعاني من تلطيخ (الشكل 4). - لتصور البقعة بشكل أفضل ، انقل النباتات إلى إيثانول 100٪ لإزالة الكلوروفيل. لزيادة كفاءة عملية إزالة الكلوروفيل ، احتضان الأنابيب عند 60 درجة مئوية لمدة 10 دقائق.
ملاحظة: قد يلزم تغيير الإيثانول عدة مرات قبل إزالة كل الكلوروفيل ، اعتمادا على حجم الورقة الملطخة.
النتائج
تم الإبلاغ عن بروتوكول بسيط هنا للحصول على نباتات P. lanceolata المعدلة وراثيا باستخدام التحويل بوساطة A. tumefaciens. يتم تحويل جين المراسل GUS (ترميز β-glucuronidase) ، مدفوعا بمروج اللحاء المعبر عنه ل AtPP2 ، إلى جذور P. lanceolata البالغة من العمر 3 أسابيع من خلال سلالة A. tumefaciens GV3101 (الشكل 2). تم اختيار محفز خاص باللحاء لأن اهتمامنا الرئيسي كان إنشاء نظام للجينوم الوظيفي للأنسجة الوعائية النباتية ، وخاصة اللحاء. تم اختبار الطريقة على أنسجة الجذر والأوراق والسويقات في التجربة الأولية. على الرغم من أنه يمكن إحداث الكالس في جميع أنواع الأنسجة ، إلا أن الأنسجة الجذرية فقط أنتجت الأحرف الأولى من تبادل لاطلاق النار (الشكل 5A) بعد 1 شهر في SIM. تحولت الورقة والسويقة إلى اللون البني وماتت (الشكل 5 ب). أدى ذلك إلى استنتاج مفاده أن أنسجة الجذر هي نوع الأنسجة الأمثل للاستخدام في طريقة التحول. تم تحضين الجذور في البكتيريا المحضرة التي أعيد تعليقها في محلول معلق (SS) (الجدول 1) لمدة لا تقل عن 20 دقيقة ، ثم حضنت في درجة حرارة الغرفة على ألواح SS صلبة لمدة تصل إلى 3 أيام في الظلام (الشكل 3E). ثم تم نقل الجذور إلى وسط تحريض الساق (SIM) والاحتفاظ بها تحت ضوء النمو ، في الظروف المشار إليها في البروتوكول (الخطوة 1.6). يوضح الشكل 1 والشكل 3 صورا تمثيلية لكل خطوة من خطوات البروتوكول كمرجع.
يوضح الشكل 6 تطور الأحرف الأولى من الساق الخارجة من الأنسجة المحولة ، من اليوم الأول الذي وضعت فيه الجذور على بطاقة SIM (الشكل 6 أ) إلى الوقت الذي كانت فيه البراعم جاهزة للتجذير (الشكل 6 د). بعد أسبوع واحد ، شكلت أنسجة الجذر الكالس (الشكل 6B) ، ويمكن ملاحظة بدايات الأحرف الأولى من تبادل لاطلاق النار (الشكل 6B1). استمرت البراعم في الظهور خلال الأسبوعين 2 و 3 (الشكل 6C) ، وبعد 4 أسابيع ، كانت البراعم جاهزة للانتقال إلى وسط تحريض الجذر (الشكل 6 د).
تم تحديد النباتات المعدلة وراثيا المفترضة باستخدام المقايسة الكيميائية النسيجية β-glucuronidase (GUS) ، باستخدام شرائح الأوراق المأخوذة بمجرد أن يبلغ طول البراعم حوالي 0.5 سم. أظهرت النباتات المحورة وراثيا الإيجابية نمط التلوين المتوقع في نسيج اللحاء الموضعي، كما هو موضح في الشكل 4. تم نقل البراعم الملطخة ب GUS الإيجابية إلى وسط تحريض الجذر ، حيث طوروا أنظمة تجذير قوية بعد 4 أسابيع (الشكل 1E). ثم تم نقل النباتات ذات الجذور إلى التربة. يوضح الشكل 4 نتيجة التلوين في لسان الحمل ضيق الأوراق الذي تم تحويله باستخدام محفز AtPP2 وجين β-glucuronidase (GUS) ، جنبا إلى جنب مع نوع بري وموز ضيق الأوراق تم تحويله مع محفز AtPP2 ، للمقارنة. تم تأكيد جميع البراعم التي ظهرت على أنها معدلة وراثيا. تم تحديد كفاءة التحويل بمتوسط 20٪ ، مع ظهور ما يقرب من اثنين من البراعم لكل 10 جذور تم تحويلها. تم نقل النباتات المعدلة وراثيا المؤكدة إلى أواني أكبر ونمت لمدة 4-8 أسابيع حتى وصلت إلى مرحلة البلوغ (الشكل 1F).
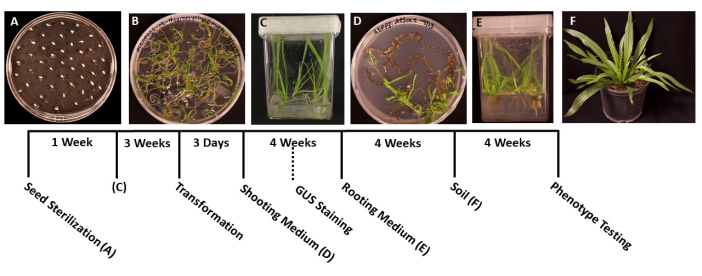
الشكل 1: الجدول الزمني لتحويل لسان الحمل لانسولاتا . صور تمثيلية لكل مرحلة من مراحل البروتوكول. (أ) البذور غير النابتة المطلية على صفيحة MS. (ب) البذور المنبتة بعد 1 أسبوع ، جاهزة للنقل إلى صناديق أرجوانية. (ج) النباتات في صناديق MS بعد 3 أسابيع من النمو. الجذور خضراء وصحية ، في المرحلة المثالية للتحول. (د) تكون البراعم في وسائط تحريض الساق بعد 4 أسابيع جاهزة للانتقال إلى وسط التجذير. في هذه المرحلة ، يمكن إجراء تلطيخ β-glucuronidase (GUS) الكيميائي النسيجي ، إن أمكن. ه: النباتات الموجودة في صناديق ذات وسائط تحريض جذرية، تتكون فيها الجذور بعد 4 أسابيع من النمو. (و) تزرع النباتات المحورة وراثيا بالطول الكامل بعد 4 أسابيع من النمو في التربة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
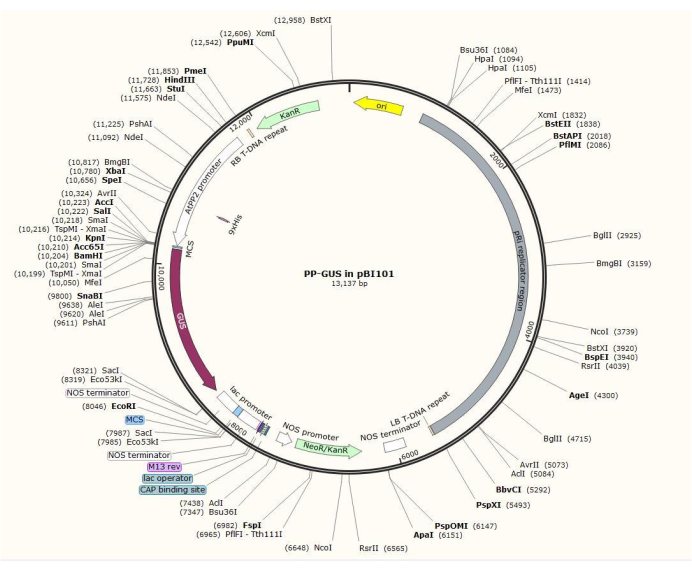
الشكل 2: رسم تخطيطي لبلازميد المتجه الثنائي pBI101 + β-glucuronidase (GUS) مع المروج الخاص باللحاء المدرج AtPP2. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
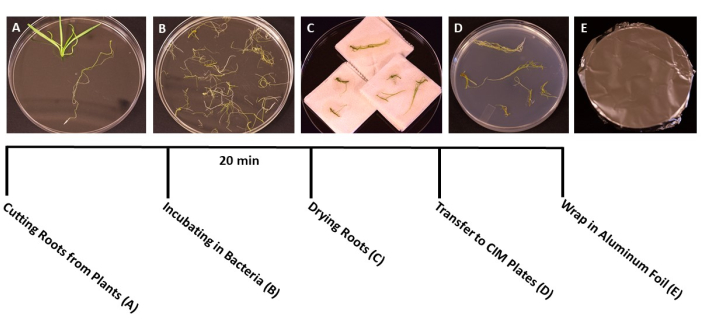
الشكل 3: خطوات التحول. صور تمثيلية لكل خطوة من خطوات التحول. أ: فصل الجذور عن البراعم أثناء التحولها. (ب) نقع الجذور في البكتيريا / معلق SS. ج: تجفيف الجذور على مناشف ورقية لإزالة البكتيريا الزائدة. (د) الجذور المطلية على وسط الاستزراع المشترك. (ه) ألواح SS ملفوفة بورق الألمنيوم. تم تحضين النباتات لمدة 2-3 أيام قبل نقلها إلى وسط الرماية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
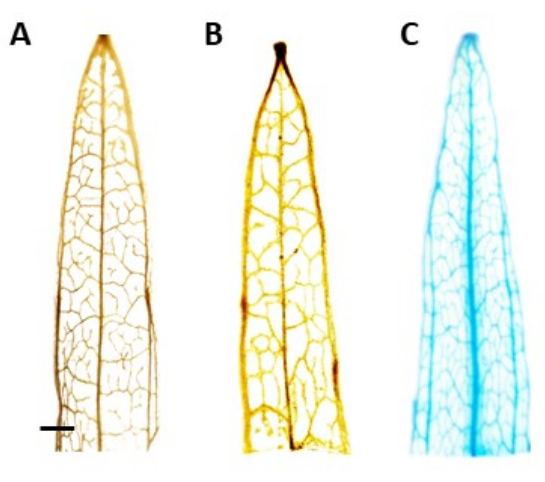
الشكل 4: تلطيخ GUS. β-glucuronidase (GUS) نتائج تلطيخ شرائح أوراق الموز ضيقة الأوراق. أ: النوع البري. (ب) تحول لسان الحمل ضيق الأوراق مع البلازميد الذي يحتوي على محفز AtPP2 (ناقل فارغ). (ج) تحول لسان الحمل ضيق الأوراق مع البلازميد الذي يحتوي على محفز AtPP2 وجين β-glucuronidase (GUS). تم تلطيخ كل ورقة باستخدام بروتوكول التلوين النسيجي الكيميائي GUS ، ثم تم تصويرها بكاميرا مجهرية. لا تظهر الصورتان (ب) و(ج) أي نمط تلطيخ بسبب غياب جين GUS. تظهر الصورة اليمنى نمط تلطيخ أزرق واضح في الأوردة ، مما يؤكد أن النباتات معدلة وراثيا. يمثل الشريط 1 مم ، ويبلغ طول كل قطعة ورقة حوالي 1 سم. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
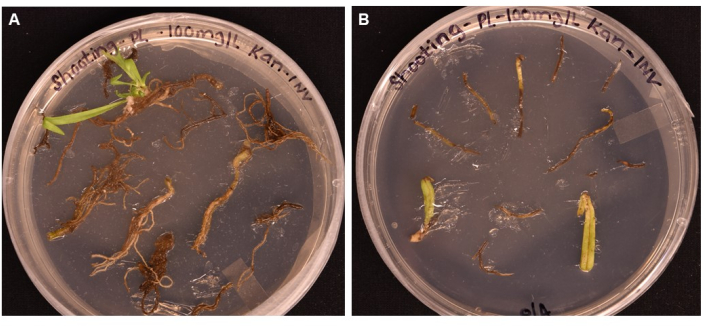
الشكل 5: مقارنة كفاءة التحول لأنواع الأنسجة المختلفة بعد حضانة >1 شهر على وسائط التصوير. أ: الأنسجة الجذرية بعد أكثر من شهر واحد من النمو. شهدت الجذور الكالس الموسع ، وظهرت الأحرف الأولى من التصوير. بدأ الكالس غير المحول في الموت استجابة لاختيار المضادات الحيوية. (ب) أنسجة الأوراق والسويقات بعد أكثر من 1 شهر من النمو. شهدت الأنسجة بعض توسع الكالس ولكن سرعان ما ماتت استجابة للمضاد الحيوي. لم تظهر براعم من أي من الأنسجة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
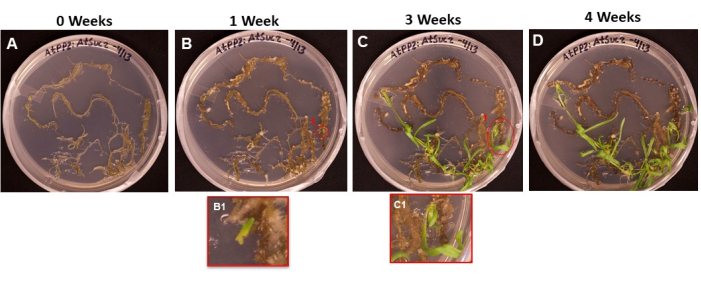
الشكل 6: ظهور الكالس والبراعم على الأنسجة المحولة. صور تمثيلية للأنسجة الموضوعة على وسط إطلاق النار بعد أطوال مختلفة من الحضانة. أ: الأنسجة الجذرية بعد وضعها مباشرة على وسط إطلاق النار. (ب) الأنسجة الجذرية بعد 1 أسبوع على وسط الرماية. يمكن ملاحظة توسع الكالس ، و (B1) بدأت الأحرف الأولى من اللقطة الأولى في الظهور. ج: الأنسجة الجذرية بعد 3 أسابيع على وسط إطلاق النار. ظهرت المزيد من الأحرف الأولى من التصوير. (ج1) تبادل لاطلاق النار التي ظهرت من B1 تبادل لاطلاق النار الأولي. د: الأنسجة الجذرية بعد 4 أسابيع من الحضانة. بدأت الأنسجة غير المحولة تتحول إلى اللون الأسود / البني وتموت ، وتستمر البراعم الناشئة في النمو. في هذه المرحلة ، تكون البراعم جاهزة للانتقال إلى وسط التجذير. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الجدول 1: وصفات تحضير الوسائط. وصف لكيفية إعداد الوسائط للتحول. يتم حساب كمية الفيتامينات المضافة بناء على تركيز محلول المخزون المشار إليه. انظر الجدول 2 لإعداد محلول مخزون الفيتامينات. بالنسبة لجميع الوسائط ، أضف الكواشف إلى 900 مل من H2O المقطر المزدوج ، ودرجة الحموضة إلى المستوى المحدد ، ثم أضف الماء إلى الحجم النهائي البالغ 1000 مل. * = إضافة بعد التعقيم. ** = درجة الحموضة مع 1 م كوه. = الرقم الهيدروجيني مع 1 M هيدروكسيد الصوديوم. الرجاء الضغط هنا لتنزيل هذا الجدول.
الجدول 2: مخزون الفيتامينات لوسط لسان الحمل . يجب تعقيم جميع الفيتامينات وتصنيفها بدقة قبل التخزين. عند الإشارة ، قم بإذابة المساحيق أولا في 1 N NaOH ، ثم قم بتكوين الحجم المطلوب باستخدام H2O. المقطر المزدوج الرجاء النقر هنا لتنزيل هذا الجدول.
Discussion
يحد عدم وجود بروتوكول تحول للنباتات في جنس Plantago من استخدام هذه النباتات كنماذج ، خاصة عندما يهتم الباحثون باستكشاف وظائف الجينات. تم اختيار P. lanceolata لتطوير بروتوكول التحول الجيني لأنه النبات الأكثر شيوعا في جنسه16. من المرجح أن يتم استخدام البروتوكول الذي تم تطويره كأداة لمزيد من الدراسات المتقدمة المتعلقة ببيولوجيا الأوعية الدموية ، والبيئة ، والتفاعلات بين النبات والحشرات ، وفسيولوجيا الإجهاد اللاأحيائي.
يحدد البروتوكول المقدم بوضوح الخطوات التي تسمح للمستخدم بالحصول على النباتات المحورة وراثيا. إلى جانب قدرة P. lanceolata على الازدهار في بيئة زراعة الأنسجة ، ساهمت عوامل متعددة في نجاح طريقة التحول لدينا. أولا ، لوحظت أهمية استخدام أنسجة جذر نباتية معقمة عالية الجودة للتحول. كان للجذور أعلى معدلات التحول عندما تم أخذها من نباتات عمرها 3-4 أسابيع ، وظهرت خضراء أو بيضاء شاحبة. غالبا ما أدت الجذور المأخوذة من الصناديق التي تحتوي على أي كمية من التلوث البكتيري أو الفطري إلى ثقافات إطلاق نار ملوثة ، ولم تؤد الجذور القديمة التي ظهرت بنية إلى تحول ناجح. كانت الأنسجة الجذرية هي أكثر أنواع الأنسجة كفاءة للتحول باستخدام الطريقة الحالية ، حيث لم تنجح أنسجة الأوراق والسويقات في تطوير البراعم.
ملاحظة أخرى مهمة هي أن الطريقة المثلى لجمع أنسجة الجذر للتحول هي وضع مادة جذرية مقطوعة حديثا في ماء معقم. سمحت هذه الخطوة بشكل فعال لمادة الجذر بالبقاء رطبة أثناء جمع ما تبقى من الأنسجة ، حيث تميل الجذور إلى الجفاف بسرعة عند إزالتها من حاويات نموها. ساعدت هذه الخطوة أيضا على زيادة معدل نجاح التحول ، لأنها سمحت بتحضين المزيد من الجذور في البكتيريا في وقت واحد.
يمكن تعديل هذا البروتوكول عن طريق تقليل الوقت الذي يحتضن فيه نسيج الجذر في وسائط الثقافة المشتركة إلى 2 أيام. وقد لوحظ أن فترة الحضانة لمدة 2 أو 3 أيام كافية للسماح بالعدوى التي تؤدي إلى الأحرف الأولى من اللقطة. ومع ذلك ، لا ينصح بأوقات حضانة أطول ، حيث لوحظ أن عدم وجود مثبط للمضادات الحيوية في وسائل الإعلام غالبا ما يؤدي إلى فرط نمو A. tumefaciens ، والذي يمكن أن يقتل الأنسجة الناشئة.
أحد قيود هذه الدراسة هو نقص البيانات المتاحة عن أداء طرق أو أنواع أخرى من A. tumefaciens في تحويل P. lanceolata للمقارنة. على حد علمنا ، هذا البروتوكول جديد. خلال التجارب الأولية ، لوحظت كفاءة تحويل عالية مع A. tumefaciens GV3101 ، وركزنا على تحسين التقنية باستخدام هذه السلالة بدلا من تجربة سلالات أخرى. كفاءة التحويل لدينا بنسبة 20٪ عالية نسبيا لتحويل النبات - العديد من الطرق التقليدية تعتبر أي شيء >1٪ ناجحا26،27،28. ومع ذلك ، فإن استخدام سلالة أخرى من A. tumefaciens، مثل A. rhizogenes، المعروف باستخدامه في تحويل الجذر في أنواع متعددة29،30،31، قد يؤدي إلى معدل نجاح أعلى. وستكون هناك حاجة إلى مزيد من التجارب لتقييم أثر استخدام سلالات أخرى لتعزيز زيادة كفاءة التحويل في P. lanceolata.
من المرجح أن يفيد التحول الناجح ل P. lanceolata العديد من مجالات الدراسة. إن كفاءة التحول العالية والنمو السريع للنبات في وسائط زراعة الأنسجة تجعل P. lanceolata مرشحا ممكنا لدراسات وظائف الجينات15.
Disclosures
ليس لدى المؤلفين ما يكشفون عنه.
Acknowledgements
تم دعم هذا العمل من قبل المؤسسة الوطنية للعلوم (EDGE IOS-1923557 إلى C.Z. و Y.Z.).
Materials
| Name | Company | Catalog Number | Comments |
| 14 mL Round Bottom TubeA4A2:A34 | ThermoFisher Scientific | 150268 | |
| 1-Naphthylacetic acid | Gold Biotechnology | N-780 | |
| 3M Micropore Surgical Paper Tape | ThermoFisher Scientific | 19-027761 | |
| 50 mL Centrifuge Tubes | Research Products International Corp. | 163227LC | |
| 600 Watt High Pressure Sodium Lights | Plantmax | PX-LU600 | |
| 6-Benzylaminopurine (6-BAP) | Gold Biotechnology | B-110 | |
| Aluminum Foil | ThermoFisher Scientific | 01-213-100 | |
| Bacto Agar | Thermofisher Scientific | 214010 | |
| Binary Plasmid pBI101 | Clontech, USA | 632522 | |
| Cool White Grow Light Sylvania LLC | Home Depot | 315952205 | |
| D-biotin | ThermoFisher Scientific | BP232-1 | |
| ddH2O | |||
| DH5a E. coli | Invitrogen, USA | 18258012 | |
| Disposable Petri Dishes, Sterile 150 x 16 mm | ThermoFisher Scientific | FB0875712 | |
| Disposable Petri Dishes, Sterile 95 x 15 mm | ThermoFisher Scientific | FB0875714G | |
| Dissecting Scissors | Leica Biosystems | 38DI12044 | |
| Ethanol 200 Proof | Decon Labs | 2705 | |
| Folic Acid | Fisher Scientific | BP2519-5 | |
| Forceps | Leica Biosystems | 38DI18031 | |
| Gelrite | Research Products International Corp. | G35020-1000 | |
| Glycerol | ThermoFisher Scientific | 17904 | |
| Glycine | Sigma | 241261 | |
| Incubated Tabletop Orbital Shaker | ThermoFisher Scientific | SHKE420HP | |
| Indole-3-Acetic Acid (IAA) | Gold Biotechnology | I-110 | |
| Indole-3-Butyric Acid (IBA) | Gold Biotechnology | I-180 | |
| Kanamycin Monosulfate | Gold Biotechnology | K-120 | |
| Macrocentrifuge | ThermoFisher Scientific | 75007210 | |
| Magenta Boxes | ThermoFisher Scientific | 50255176 | |
| Micro Pipet Tips 1000 µL | Corning | 4140 | |
| Micro Pipet Tips 200 µL | Corning | 4138 | |
| Micro Pipette Tips 10 µL | Corning | 4135 | |
| Microcentrifuge | ThermoFisher Scientific | 75002410 | |
| Micropipettor 0.5-10 µL | Corning | 4071 | |
| Micropipettor 100-1000 µL | Corning | 4075 | |
| Micropipettor 20-200 µL | Corning | 4074 | |
| Micropipettor 2-20 µL | Corning | 4072 | |
| Murashige & Skooge Basal Medium with Vitamins | PhytoTech | M519 | |
| Murashige & Skooge Basal Salt Mixture | PhytoTech | M524 | |
| myo-Inositol | Gold Biotechnology | I-25 | |
| Nicotinic acid | Sigma | N0761-100g | |
| Parafilm (paraffin film) | ThermoFisher Scientific | S37440 | |
| Potassium Hydroxide (KOH) | Research Products International Corp. | P44000 | |
| Pyridoxine HCl | Sigma | P6280-10g | |
| Scalpel Blade Handle | Leica Biosystems | 38DI36419 | |
| Scalpel Blades | Leica Biosystems | 3802181 | |
| Sodium Chloride, Crystal (NaCl) | Mallinckrodt Chemicals | 7581-06 | |
| Sodium Hydroxide (NaOH) | Research Products International Corp. | S24000 | |
| Sodium Hypochlorite | Walmart | 23263068401 | |
| Soil- Bark Mix | Berger, USA | BM7 | |
| Square Pots (3.5 inches squared) | Greenhouse Megastore | CN-TRK-1835 | |
| Sucrose | Research Products International Corp. | S24060 | |
| Thermocycler | ThermoFisher Scientific | A24811 | |
| Thiamine HCl | Sigma | T4625-5G | |
| Timentin Ticarcillin/Clavulanate (15/1) (Timentin) | Gold Biotechnology | T-104 | |
| trans-Zeatin Riboside (ZR) | Gold Biotechnology | Z-100 | |
| Tryptone | Thermofisher Scientific | 211705 | |
| Wild Type Plantago lanceolata seeds | Outsidepride Seed Source, OR, USA | F1296 | Outsidepride.com |
| Yeast Extract Granulated | Research Products International Corp. | Y20025-1000 |
References
- Koornneef, M., Meinke, D. The development of Arabidopsis as a model plant. The Plant Journal. 61 (6), 909-921 (2010).
- Bragg, J. N., Anderton, A., Nieu, R., Vogel, J. P. Brachypodium distachyon. Agrobacterium Protocols. , 17-33 (2015).
- Chang, C., Bowman, J. L., Meyerowitz, E. M. Field guide to plant model systems. Cell. 167 (2), 325-339 (2016).
- Müller, B., Grossniklaus, U. Model organisms-a historical perspective. Journal of Proteomics. 73 (11), 2054-2063 (2010).
- Ding, X., et al. Different fruit-specific promoters drive AtMYB12 expression to improve phenylpropanoid accumulation in tomato. Molecules. 27 (1), 317 (2022).
- Niedbała, G., Niazian, M., Sabbatini, P. Modeling agrobacterium-mediated gene transformation of tobacco (Nicotiana tabacum)-a model plant for gene transformation studies. Frontiers in Plant Science. 12, 695110 (2021).
- Kumari, D., Prasad, B., Dwivedi, P. . Genome Editing Platforms in Rice (Oryza sativa L.): Basic methodology and troubleshooting. , (2022).
- Zhang, B. Agrobacterium-mediated transformation of cotton. Transgenic Cotton. , 31-45 (2013).
- Tiwari, R., Singh, A. K., Rajam, M. V. Improved and reliable plant regeneration and Agrobacterium-mediated genetic transformation in soybean (Glycine max L). Journal of Crop Science and Biotechnology. , 1-10 (2022).
- Bakhsh, A. Development of efficient, reproducible and stable Agrobacterium-mediated genetic transformation of five potato cultivars. Food Technology and Biotechnology. 58 (1), 57-63 (2020).
- Bates, R., Craze, M., Wallington, E. J. Agrobacterium-mediated transformation of oilseed rape (Brassica napus). Current Protocols in Plant Biology. 2 (4), 287-298 (2017).
- Hopp, H. E., Spangenberg, G., Herrera-Estrella, L. Plant transformation. Frontiers in Plant Science. 13, 876671 (2022).
- Abdelmuhsin, A. A., Alghamdi, A. A., Ibrahim, N. A. Assessing the phenotypic and genotypic variations of Plantago ciliata in Ha'il region, Saudi Arabia. Entomology and Applied Science Letters. (1), 14-22 (2021).
- Coleman, N. Plantago Lanceolata. Botanical Bulletin. 1 (11), 45 (1876).
- Huang, J., et al. Tissue-specific transcriptomic profiling of Plantago major provides insights for the involvement of vasculature in phosphate deficiency responses. Molecular Genetics and Genomics. 294 (1), 159-175 (2019).
- Penczykowski, R. M., Sieg, R. D. Plantago spp. as models for studying the ecology and evolution of species interactions across environmental gradients. The American Naturalist. 198 (1), 158-176 (2021).
- Pommerrenig, B., et al. Common plantain. A collection of expressed sequence tags from vascular tissue and a simple and efficient transformation method. Plant Physiology. 142 (4), 1427-1441 (2006).
- Bergero, R., Levsen, N., Wolff, K., Charlesworth, D. Arms races with mitochondrial genome soft sweeps in a gynodioecious plant, Plantago lanceolata. Molecular Ecology. 28 (11), 2772-2785 (2019).
- Aalto, E. A., Koelewijn, H. P., Savolainen, O. Cytoplasmic male sterility contributes to hybrid incompatibility between subspecies of Arabidopsis lyrata. G3: Genes, Genomes, Genetics. 3 (10), 1727-1740 (2013).
- Bloch, K. D., Grossmann, B. Digestion of DNA with restriction endonucleases. Current Protocols in Molecular Biology. 3 (1), (1995).
- Du, C., et al. Prokaryotic expression, purification, physicochemical properties and antifungal activity analysis of phloem protein PP2-A1 from cucumber. International Journal of Biological Macromolecules. 194, 395-401 (2022).
- Deshmukh, S. 2. 2., Kulkarni, R., Bose, K. Transformation and protein expression. Textbook on Cloning, Expression and Purification of Recombinant Proteins. , 83-114 (2022).
- Bergkessel, M., Guthrie, C. Colony PCR. Methods in Enzymology. 529, 299-309 (2013).
- Broehan, G., Kroeger, T., Lorenzen, M., Merzendorfer, H. Functional analysis of the ATP-binding cassette (ABC) transporter gene family of Tribolium castaneum. BMC Genomics. 14, 6 (2013).
- Dong, Z., et al. Stable transformation of fluorescent proteins into Nosema bombycis by electroporation. Parasites & Vectors. 15 (1), 141 (2022).
- Li, S., et al. Optimization of Agrobacterium-mediated transformation in soybean. Frontiers in Plant Science. 8, 246 (2017).
- Manimaran, P., et al. Infection of early and young callus tissues of indica rice BPT 5204 enhances regeneration and transformation efficiency. Rice Science. 20 (6), 415-426 (2013).
- Wang, J., Nie, J., Pattanaik, S., Yuan, L. Efficient Agrobacterium-mediated transformation of Artemisia annua L. using young inflorescence. In Vitro Cellular & Developmental Biology-Plant. 52 (2), 204-211 (2016).
- Niazian, M., Belzile, F., Torkamaneh, D. CRISPR/Cas9 in planta hairy root transformation: a powerful platform for functional analysis of root traits in soybean. Plants. 11 (8), 1044 (2022).
- Geng, S., et al. An efficient root transformation system for CRISPR/Cas9-based analyses of shoot-root communication in cucurbit crops. Horticulture Research. 9, (2022).
- Xiao, Y., et al. Efficient Agrobacterium-mediated genetic transformation using cotyledons, hypocotyls and roots of 'Duli'(Pyrus betulifolia Bunge). Scientia Horticulturae. 296, 110906 (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved