Method Article
Transformación genética mediada por Agrobacterium tumefaciens del plátano de hoja estrecha
En este artículo
Resumen
Debido a su aplicación versátil como especie modelo en diversos campos de estudio, existe la necesidad de un conjunto de herramientas de transformación genética en plátano de hoja estrecha (Plantago lanceolata). Aquí, utilizando la transformación mediada por Agrobacterium tumefaciens, se presenta un protocolo que da como resultado líneas transgénicas estables con una eficiencia de transformación del 20%.
Resumen
Las especies del género Plantago tienen varios rasgos únicos que las han llevado a adaptarse como plantas modelo en varios campos de estudio. Sin embargo, la falta de un sistema de manipulación genética impide la investigación en profundidad de la función génica, lo que limita la versatilidad de este género como modelo. Aquí, se presenta un protocolo de transformación para Plantago lanceolata, la especie de Plantago más comúnmente estudiada. Usando la transformación mediada por Agrobacterium tumefaciens, las raíces de 3 semanas de edad de plantas de P. lanceolata cultivadas asépticamente se infectaron con bacterias, se incubaron durante 2-3 días y luego se transfirieron a un medio de inducción de brotes con la selección adecuada de antibióticos. Los brotes generalmente emergieron del medio después de 1 mes, y las raíces se desarrollaron de 1 a 4 semanas después de que los brotes se transfirieron al medio de inducción de la raíz. Luego, las plantas se aclimataron a un entorno de suelo y se probó la presencia de un transgen utilizando el ensayo reportero de β-glucuronidasa (GUS). La eficiencia de transformación del método actual es ~20%, con dos plantas transgénicas emergentes por cada 10 tejidos radiculares transformados. El establecimiento de un protocolo de transformación para el plátano de hoja estrecha facilitará la adopción de esta planta como una nueva especie modelo en diversas áreas.
Introducción
El concepto de usar especies modelo para investigar múltiples aspectos de la biología vegetal surgió con el uso generalizado de Arabidopsis thaliana1. Arabidopsis fue elegida inicialmente porque comparte características con muchas otras plantas con flores y tiene múltiples rasgos que la hacen conveniente para estudiar en un entorno de laboratorio, como ser pequeña y tener un ciclo de generación corto. El gran volumen de trabajos de investigación publicados con él como tema, junto con su pequeño tamaño genómico y facilidad de transformación genética2, le permiten persistir como un organismo experimental ampliamente utilizado. Sin embargo, Arabidopsis puede limitarse como modelo para especies con diferentes características o rasgos únicos3. Esto ha impulsado el desarrollo de nuevos sistemas modelo, como el maíz (Zea mays), una planta importante para la genética del desarrollo en monocotiledóneas4, y el tomate (Solanum lycopersicum), que es un modelo importante para estudios evolutivos, desarrollo de frutas y producción, y es una buena representación para cultivos de hortalizas5. Un método de transformación genética es un requisito previo para que una especie vegetal sirva como organismo modelo2. Una transformación mediada por Agrobacterium tumefaciens es una herramienta confiable en biología vegetal; se ha utilizado para transformar algunas especies modelo y cultivos principales, incluyendo el tabaco (Nicotiana tabacum)6, el arroz (Oryza sativa)7, el algodón (Gossypium hirsutum)8, la soja (Glycine max)9, la papa (Solanum tuberosum)10 y la canola (Brassica napus)11. Las especies de plantas son muy variables en cuanto al éxito con que responden a la infección por A. tumefaciens, y los protocolos de transformación a menudo deben adaptarse individualmente a cada especie 6,12.
El género Plantago incluye un total de 256 especies de plantas, ampliamente distribuidas en todo el mundo13. Las especies de este género a menudo tienen características únicas que las hacen deseables como especies modelo para estudiar genética, ecología, fisiología del estrés, metabolitos secundarios, química medicinal, interacciones planta-microbio, desarrollo de plantas y evolución. Plantago lanceolata , también llamado plátano de hoja estrecha o ribwort, ha sido una planta popular de interés desde elsiglo 19, cuando se utilizó por primera vez para describir el fenómeno de la esterilidad masculina14. Al igual que otras plantas de su género, se ha utilizado en estudios en diversos campos de investigación. Más recientemente, se ha propuesto como un modelo para la biología vascular, ya que su tejido vascular se puede recolectar fácilmente15. P. lanceolata es la especie más comúnmente estudiada en el género Plantago; un artículo de 2021 informó que había > 1,400 publicaciones que incluían o estaban relacionadas con esta especie en ese momento16, y se han publicado 102 artículos adicionales desde principios de 2022, según una búsqueda en PubMed realizada el 9 de diciembrede 2022. La siguiente planta más estudiada en el género, P. major, es objeto de solo 414 artículos cuando se busca utilizando los mismos criterios en la misma fecha.
A pesar del interés de investigación en P. lanceolata, los estudios, especialmente sobre la caracterización de la función génica, a menudo están limitados por la falta de un conjunto de herramientas de manipulación genética para la especie. Pommerrienig et al. hicieron esfuerzos para desarrollar un protocolo de transformación para P. major utilizando una técnica de inmersión floral17. Sin embargo, este método no puede ser aplicado a P. lanceolata debido a la esterilidad masculina característica de esta especie18,19. Hasta donde sabemos, no existe un protocolo para la transformación de P. lanceolata.
Este estudio presenta un protocolo simple para la transformación mediada por A. tumefaciens de P. lanceolata. Al dirigirse a los tejidos de la raíz, se pueden generar plantas transgénicas completamente desarrolladas dentro de los 3 meses posteriores a la transformación.
Protocolo
NOTA: Los pasos 1.4-1.8, 2.3-2.5, 3.3-3.6, 4.1-4.6, 5.1-5.7 y 6.1-6.3 deben realizarse en condiciones asépticas, utilizando una campana limpia para evitar la contaminación.
1. Propagación de material vegetal para transformación
- Coloque las semillas de Plantago lanceolata de tipo silvestre (WT) disponibles comercialmente (consulte la Tabla de materiales) en un tubo centrífugo de 50 ml hasta la línea de 5 ml, dependiendo del número de plantas deseadas.
NOTA: Alternativamente, se puede usar un tubo de microcentrífuga de 2 ml cuando se necesita un pequeño número de semillas, pero debe llenarse a un volumen no mayor de 0.1 ml, ya que demasiadas semillas pueden reducir la eficiencia de la esterilización. - Sumerja las semillas en etanol al 75% durante 60 s.
- Deseche el etanol, luego sumerja las semillas en hipoclorito de sodio al 20% (20% NaClO, 80% de agua estéril) durante 40 minutos, invirtiendo suavemente el tubo para que todas las semillas entren en contacto con la solución.
NOTA: La solución de hipoclorito de sodio debe estar recién hecha para obtener resultados óptimos. - Bajo una campana de flujo laminar, deseche la solución de hipoclorito de sodio, luego lave las semillas con agua destilada (cinco veces). Agregue un pequeño volumen de agua a las semillas después del enjuague final, ya que esto puede ayudar al movimiento de las plantas en los platos.
- Utilizando fórceps esterilizados, transfiera las semillas a placas de Petri de 95 mm x 100 mm preparadas previamente con medio sólido MS (Tabla 1). Extienda las semillas uniformemente a través de la superficie de la placa, con aproximadamente 1 cm entre cada semilla para evitar el hacinamiento de las plántulas germinadas (Figura 1A).
- Sellar las placas con dos capas de película de parafina para evitar la contaminación, luego incubar bajo una luz de cultivo blanca fría (ver Tabla de materiales) a temperatura ambiente (22 °C con 50 μmol m-2 s-1, 12 h días). Las semillas típicamente germinan dentro de 5-6 días.
- Cuando las plántulas hayan germinado y sean lo suficientemente grandes como para transferirlas (Figura 1B), típicamente 2 o 3 días después de la germinación, use fórceps esterilizados para transferir las plántulas a cajas estériles con los 50-100 ml de medio MS (Tabla 1). Lo ideal es plantar solo cinco plántulas por caja para obtener raíces de la mejor calidad.
- Selle las cajas con cinta quirúrgica, luego permita que las plantas crezcan bajo una luz de crecimiento blanca y fría (consulte la Tabla de materiales), en las mismas condiciones mencionadas en el paso 1.6. Las plantas deben estar listas para la transformación en aproximadamente 3-4 semanas, o cuando las raíces principales hayan crecido unos 2 cm de longitud y las raíces laterales aparezcan blancas.
NOTA: Las recetas de preparación mediana y las existencias de vitaminas se incluyen en la Tabla 1 y la Tabla 2.
2. Construcción de plásmidos y transformación de E. coli
NOTA: El procedimiento exacto de construcción del plásmido varía dependiendo del gen de interés. En este procedimiento, se utilizaron las enzimas de restricción Hind III y SalII para insertar el promotor AtPP2 de 1,5 kb en el plásmido binario pBI101 (ver Tabla de Materiales) con GUS, utilizando el procedimiento estándar declonación20. AtPP2 (proteína del floema 2) es un gen que se expresa específicamente en el floema21.
- Clone el promotor usando pares de cebadores 5'-AGTCAAGCTTCAAGTCCCTGTGGCTACTGAAC-3' (Forward) y 5'-AGTCGTCGACAAACCAGTATGATGTATTTTTG-3' (Reverso) de Arabidopsis. La Figura 2 muestra un diagrama del vector plásmido binario con el inserto AtPP2:GUS .
- Después de la construcción del plásmido, transformar los plásmidos en células competentes de DH5a E. coli (ver Tabla de materiales) utilizando el método de choque térmico22, y luego incubar durante 1,5 h a 37 °C con agitación (150 rpm).
- Tomar 150 μL de cada cultivo de transformación, colocar la placa en placas de medios de agar LB (Tabla 1) con la selección apropiada (50 mg/L de kanamicina para la cepa utilizada en este protocolo; ver Tabla de materiales), y luego incubar las placas durante 16-24 h a 37 °C.
NOTA: La cepa bacteriana utilizada en este estudio es A. tumefaciens GV3101. - A continuación, utilice la PCR de colonias para detectar recombinantes positivos en las colonias23.
NOTA: En este protocolo, se utilizaron los siguientes cebadores para amplificar el gen objetivo; 5'-ATGTTACGTCCTGTAGAAACCCCAA-3' (Adelante) y 5'-TCATTGTTTGCCTCCCTGCTGC-3' (Reverso).- Ejecute la reacción en un termociclador (consulte la Tabla de materiales) con condiciones de ciclo de 3 min a 95 °C, seguidas de 35 ciclos de: 30 s a 95 °C, 30 s a 55 °C, 2 min a 72 °C y un paso final de alargamiento de 10 min a 72 °C.
- Inocular las colonias positivas en 6 mL de caldo LB (Tabla 1) con el antibiótico apropiado (50 mg/L de kanamicina) y crecer a 37 °C durante la noche, a 200-250 rpm.
- Después del crecimiento nocturno, extraer los plásmidos de las bacterias utilizando procedimientos estándar24.
3. Transformación de A. tumefaciens con plásmido
- Después de la extracción del plásmido, utilice la electroporación para transformar el plásmido modificado en la cepa deseada de células competentes. En este procedimiento, se utilizó la cepa GV3101 de A. tumefaciens. Seguir métodos estandarizados para las técnicas de electroporación25.
- Después de la electroporación, resuspender las células competentes en 1 ml de caldo LB y luego incubar durante 2-4 h a 28 °C a 100 rpm.
- Recolectar las células a través de centrifugación a 6.800 x g durante 3 min en una microcentrífuga de mesa (ver Tabla de materiales) a temperatura ambiente (22 °C), luego extender 50-100 μL sobre una placa de agar LB con un agente de selección apropiado (50 mg/L de kanamicina para el plásmido utilizado en este protocolo).
- Después de que las células se hayan incubado durante 2 días a 28 °C, identificar colonias positivas que contengan el gen de interés mediante el uso de PCR de colonias. En este protocolo, utilice los cebadores y las condiciones mencionadas en el paso 2.4.
- A continuación, use las colonias positivas para rayar una placa de stock con medios de agar LB + selección. La placa se puede conservar a 4 °C durante un máximo de 1 mes.
- Alternativamente, para el almacenamiento a largo plazo, inocular una colonia positiva con un pequeño volumen de LB con la selección adecuada. Agitar el cultivo inoculado durante la noche a 28 °C a 200 rpm, luego preparar un stock de glicerol (50% p/v de glicerol en una mezcla 50:50 de bacterias y glicerol), que puede almacenarse a -80 °C durante un máximo de 10 años.
4. A. tumefaciens preparación
- Rayar A. tumefaciens que contengan el plásmido deseado sobre placas LB sólidas preparadas de 95 mm x 100 mm con el agente de selección apropiado. En este protocolo, se utilizó la cepa bacteriana GV3101 con el inserto plásmido AtPP2:GUS , con 50 mg/L de kanamicina añadida para la selección.
- Selle las placas con una película de parafina, luego incube a 28 ° C durante un máximo de 48 h, o hasta que la bacteria crezca lo suficiente como para recogerla.
- Use una punta de pipeta para recoger una colonia de bacterias 2 días antes de la transformación, e inocularla en un tubo de fondo redondo de 15 ml que contenga 6 ml de LB líquido con la selección adecuada. Agitar a 200 rpm en un agitador de sobremesa a 28 °C durante la noche, hasta que el OD600 alcance 0,6-0,7.
NOTA: Las placas y la inoculación bacteriana de 6 ml pueden almacenarse a 4 °C hasta por 1 mes. - Cuando las bacterias alcancen el OD 600 correcto, utilizar una pipeta para transferir A. tumefaciens a un matraz estéril que contenga100 ml de LB líquido con un agente seleccionador. Por lo general, 200 μL de bacterias por 100 ml LB es apropiado para la propagación. Agitar a 200 rpm a 28 °C durante la noche, hasta que el OD600 alcance 0,6-0,7.
- Transfiera las bacterias a tubos de centrífuga estériles de 50 ml y centrifugar a 2.200 xg durante 10 minutos a temperatura ambiente (22 °C) en una centrífuga de mesa para recoger las bacterias.
- Deseche el sobrenadante con una pipeta. Resuspender el pellet bacteriano en 5 ml de solución de suspensión líquida (SS) a temperatura ambiente (22 °C) (Tabla 1) por pipeteo, luego agregar hasta 50 ml de SS e invertir varias veces para mezclar. La bacteria ahora está lista para la transformación.
NOTA: El SS líquido debe prepararse fresco, dentro de 1 semana de la transformación.
PRECAUCIÓN: Todo el material que entra en contacto con A. tumefaciens debe desecharse en un contenedor de basura de riesgo biológico. Los líquidos sobrantes de cultivos bacterianos se pueden esterilizar con hipoclorito de sodio (lejía) a una concentración del 20% o más.
5. Transformación de las raíces de Plantago
- Cuando las plantas alcancen la etapa ideal para la transformación (las plántulas tienen 3 semanas de edad) (Figura 1C), use pinzas y tijeras estériles para separar las raíces del resto de la planta (Figura 3A). Deseche el material de la hoja y el tallo.
- Inmediatamente después del corte, transfiera las piezas de la raíz a cajas estériles que contengan agua estéril utilizando pinzas estériles. Este paso permite que las raíces permanezcan hidratadas mientras se recolecta todo el tejido.
- Cuando se corten todas las raíces, vierta la suspensión de A. tumefaciens/SS en placas de Petri desechables estériles de 150 mm x 15 mm. Transfiera las raíces al cultivo de A. tumefaciens e inocule durante al menos 20 min (Figura 3B).
- Durante la incubación, use un bisturí estéril con una cuchilla afilada para cortar las raíces en fragmentos de 1 cm, separando las raíces primarias de las raíces laterales. Haga cortes delgados y poco profundos en la superficie de las raíces para permitir que las bacterias infecten la planta.
NOTA: Si se trata de un gran número de plantas, transfiera las piezas de raíz al cultivo bacteriano en lotes, para asegurarse de que todas las raíces se sumerjan durante la inoculación. - Después de la incubación, use las pinzas estériles para transferir las piezas de raíz a toallas de papel estériles para eliminar el exceso de bacterias. Evite secar las raíces durante más de 60 s, ya que esto puede causar deshidratación y dañar el tejido de la raíz. Idealmente, se pueden secar simultáneamente 10-15 raíces (Figura 3C).
- Transfiera las raíces secas a placas de Petri preparadas de 95 mm x 15 mm con medios sólidos de cocultivo (Tabla 1), alrededor de 10-20 raíces por placa, dependiendo del tamaño de las raíces (Figura 3D).
- Selle las placas con dos capas de película de plástico transparente, luego cúbralas con papel de aluminio. Incubar a temperatura ambiente (22 °C) durante 3 días. Este paso proporciona tiempo para que las bacterias infecten las raíces sin la presencia de una selección de antibióticos (Figura 3E).
6. Selección y regeneración de toda la planta
- Después de la incubación en medios de cocultivo, transfiera las piezas de raíz a placas de Petri preparadas de 95 mm x 15 mm con medios de inducción de brotes sólidos (SIM) (Tabla 1) con Timentina (500 mg / L; ver Tabla de materiales) y selección adecuada de antibióticos. En este protocolo, utilizamos kanamicina (100 mg/L).
NOTA: La parte inferior de las raíces debe entrar en contacto completo con el medio. Las raíces que no tocan la superficie del medio son demasiado largas y deben cortarse para evitar que el tejido escape a la selección. - Selle las placas con dos capas de película plástica transparente, luego crezca bajo una luz de cultivo durante 1 mes (consulte el paso 1.6 para conocer las condiciones adecuadas) o hasta que los brotes comiencen a emerger.
NOTA: Por lo general, las iniciales de los brotes se pueden observar después de 2 semanas de crecimiento, y los brotes suelen ser visibles después de 1 mes. - Cuando las plántulas midan 1.5-2.0 cm de largo (Figura 1D), transfiéralas a cajas estériles preparadas con medios sólidos de inducción radicular (Tabla 1).
- Cultivar las plantas bajo una luz de cultivo (ver paso 1.6 para conocer las condiciones) durante varias semanas, hasta que se formen raíces. Por lo general, las raíces se pueden ver por primera vez después de 1 semana.
NOTA: Se recomienda permitir que las raíces crezcan durante varias semanas antes de pasar al suelo, ya que las plantas con sistemas de raíces más grandes tienden a tener una mayor tasa de supervivencia en el suelo.
7. Transferencia de suelo
- Cuando los sistemas radiculares se hayan vuelto lo suficientemente grandes como para transferirse (Figura 1E), generalmente después de 1 mes de crecimiento, transfiera las plantas a 3.5 en macetas cuadradas que contengan tierra prehumedecida para todo uso (BM7). En este protocolo, se utilizó la mezcla de corteza BM7 (ver Tabla de materiales).
- Retire cualquier medio que se adhiera a las raíces lavándolas suavemente en agua.
NOTA: Las plantas se pueden cultivar hasta la madurez en un invernadero a 800 a 1400 μmol fotones m-2 s-2 utilizando luces de alta presión de sodio de 600 W (ver Tabla de materiales), o en una cámara de crecimiento a temperatura ambiente (22 °C) con luces blancas frías a 50 μmol m-2 s-1, 12 h días.
- Retire cualquier medio que se adhiera a las raíces lavándolas suavemente en agua.
- Cubra las plantas con una cubierta de plástico para macetas, luego cúbralas con una bolsa de plástico transparente. Este paso permite que las plantas permanezcan en un ambiente húmedo a medida que se adaptan al suelo.
- Después de aproximadamente 3-5 días, retire la bolsa de plástico, luego retire lentamente la tapa para permitir la aclimatación al ambiente exterior.
NOTA: Dependiendo de la época del año y del entorno al que se transfieren las plantas, el tiempo que las plantas necesitan para adaptarse puede variar. Se recomienda revisar las plantas diariamente y agregar agua a las macetas según sea necesario. - Riegue las plantas regularmente y agregue fertilizante según sea necesario. Las plantas también se pueden transferir a macetas más grandes para un mayor crecimiento (Figura 1F).
8. Tinción histoquímica de β-glucuronidasa (GUS)
- Preparar la solución de tinción de β-glucuronidasa (GUS), de acuerdo con los protocolos publicados15.
- Cuando las iniciales del brote midan aproximadamente 0.5-1 cm de largo, retire una pequeña punta de una hoja joven completamente expandida (<5 mm de longitud suele ser suficiente) e inmediatamente transfiera a 0.5-1 ml de solución de tinción GUS en un tubo de microcentrífuga de 1.5 o 2 ml. La solución debe cubrir completamente el tejido vegetal.
- Coloque los tubos abiertos en un desecador de vacío y vacice a 20-25 kPa durante 5-10 min. Pequeñas burbujas deben ser visibles en la solución durante el procedimiento de vacío. Esto permite que la solución entre en las células de la planta.
- Permita que el aire se filtre de nuevo en el desecador de vacío. Cerrar los tubos e incubar a 37 °C durante la noche (12 h), o hasta que el color azul sea visible.
NOTA: En este estudio, la actividad de GUS se localizó en el floema, lo que significa que en las plantas transformadas positivamente, la tinción azul solo debe ser visible en el tejido del floema. Las plantas sin el transgén no experimentan tinción (Figura 4). - Para visualizar mejor la mancha, transfiera las plantas al 100% de etanol para eliminar la clorofila. Para aumentar la eficiencia del proceso de eliminación de clorofila, incubar los tubos a 60 °C durante 10 min.
NOTA: Es posible que sea necesario cambiar el etanol varias veces antes de eliminar toda la clorofila, dependiendo del tamaño de la hoja que se tiñe.
Resultados
Aquí se informa un protocolo simple para obtener plantas transgénicas de P. lanceolata utilizando la transformación mediada por A. tumefaciens. El gen reportero GUS (que codifica β-glucuronidasa) se transforma, impulsado por el promotor de AtPP2 expresado por el floema, en raíces de P. lanceolata de 3 semanas de edad a través de la cepa GV3101 de A. tumefaciens (Figura 2). Se eligió un promotor específico del floema porque nuestro principal interés era establecer un sistema para la genómica funcional de los tejidos vasculares de las plantas, particularmente el floema. El método se probó en el tejido de la raíz, la hoja y el pecíolo en el experimento preliminar. Aunque el callo pudo ser inducido en todos los tipos de tejido, sólo el tejido radicular produjo iniciales de brote (Figura 5A) después de 1 mes en SIM; la hoja y el pecíolo se volvieron marrones y murieron (Figura 5B). Esto llevó a la conclusión de que el tejido de la raíz era el tipo de tejido óptimo para su uso en el método de transformación. Las raíces se incubaron en las bacterias preparadas resuspendidas en solución de suspensión (SS) (Tabla 1) durante un mínimo de 20 min, luego se incubaron a temperatura ambiente en placas sólidas de SS durante un máximo de 3 días en la oscuridad (Figura 3E). Las raíces se transfirieron al medio de inducción de brotes (SIM) y se mantuvieron bajo una luz de crecimiento, en las condiciones indicadas en el protocolo (paso 1.6). La Figura 1 y la Figura 3 muestran imágenes representativas de cada paso del protocolo como referencia.
La Figura 6 muestra la progresión de las iniciales del brote que emergen del tejido transformado, desde el primer día en que se colocaron las raíces en la SIM (Figura 6A) hasta que los brotes estaban listos para ser enraizados (Figura 6D). Después de 1 semana, el tejido de la raíz formó callo (Figura 6B), y se pudieron observar los inicios de las iniciales del brote (Figura 6B1). Los brotes continuaron emergiendo durante las semanas 2 y 3 (Figura 6C), y después de 4 semanas, los brotes estaban listos para ser transferidos al medio de inducción de la raíz (Figura 6D).
La identificación de las plantas transgénicas putativas se realizó mediante el ensayo histoquímico de β-glucuronidasa (GUS), utilizando segmentos foliares tomados una vez que los brotes tenían alrededor de 0,5 cm de largo. Las plantas transgénicas positivas mostraron el patrón de tinción esperado en el tejido localizado del floema, demostrado en la Figura 4. Los brotes positivos teñidos con GUS se transfirieron al medio de inducción radicular, en el que desarrollaron sistemas de enraizamiento robustos después de 4 semanas (Figura 1E). Las plantas enraizadas fueron transferidas al suelo. La Figura 4 muestra el resultado de la tinción en un plátano de hoja estrecha transformado con el promotor AtPP2 y el gen de la β-glucuronidasa (GUS), junto con un plátano de tipo silvestre y un plátano de hoja estrecha transformados con el promotor AtPP2 , para la comparación. Todos los brotes que surgieron fueron confirmados como transgénicos. Se determinó que la eficiencia de transformación era un promedio del 20%, con aproximadamente dos brotes emergentes por cada 10 raíces que se transformaron. Las plantas transgénicas confirmadas se transfirieron a macetas más grandes y se cultivaron durante 4-8 semanas hasta que alcanzaron la etapa adulta (Figura 1F).
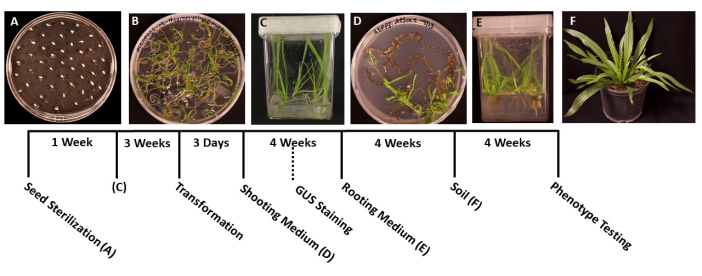
Figura 1: Cronología de la transformación de Plantago lanceolata . Imágenes representativas de cada etapa del protocolo. (A) Semillas sin germinar chapadas en un plato de MS. (B) Semillas germinadas después de 1 semana, listas para ser transferidas a cajas magenta. (C) Plantas en cajas MS después de 3 semanas de crecimiento. Las raíces son verdes y sanas, en la etapa ideal para la transformación. (D) Los brotes en medios de inducción de brotes después de 4 semanas están listos para ser transferidos al medio de enraizamiento. En esta etapa, se puede realizar una tinción histoquímica de β-glucuronidasa (GUS), si corresponde. (E) Plantas en cajas con medios de inducción radicular, donde las raíces se han formado después de 4 semanas de crecimiento. (F) Las plantas transgénicas se cultivan en longitud completa después de 4 semanas de crecimiento en el suelo. Haga clic aquí para ver una versión más grande de esta figura.
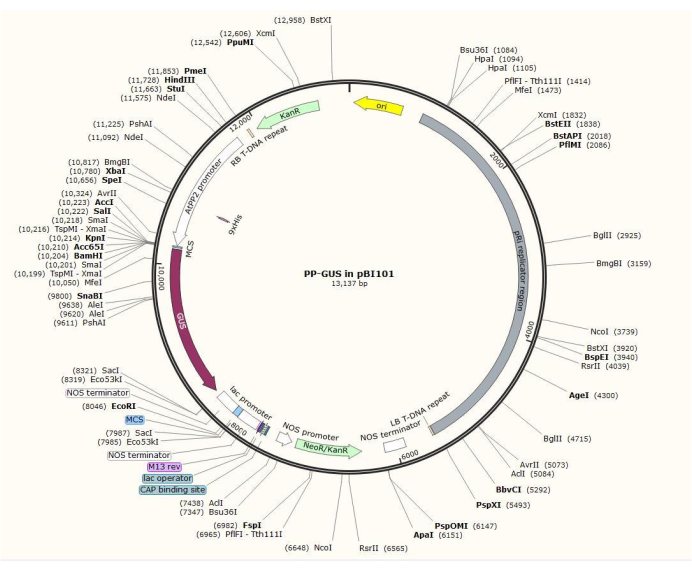
Figura 2: Diagrama del plásmido vectorial binario pBI101 + β-glucuronidasa (GUS) con el promotor específico del floema insertado AtPP2. Haga clic aquí para ver una versión más grande de esta figura.
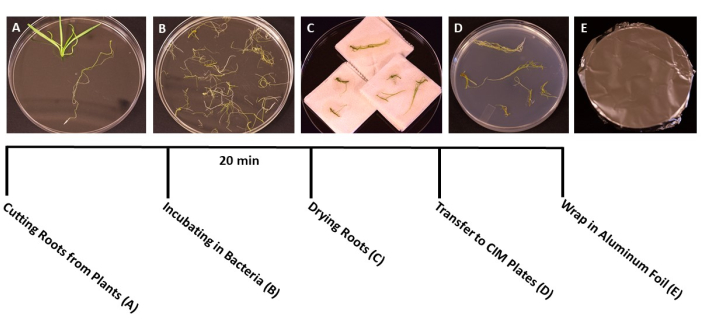
Figura 3: Pasos de transformación. Imágenes representativas de cada paso de la transformación. (A) Separar las raíces de los brotes durante la transformación. (B) Remojar las raíces en suspensión de bacterias/SS. (C) Secar las raíces en toallas de papel para eliminar el exceso de bacterias. (D) Raíces chapadas en medio de cocultivo. (E) Placas SS envueltas en papel de aluminio. Las plantas se incubaron durante 2-3 días antes de ser transferidas al medio de disparo. Haga clic aquí para ver una versión más grande de esta figura.
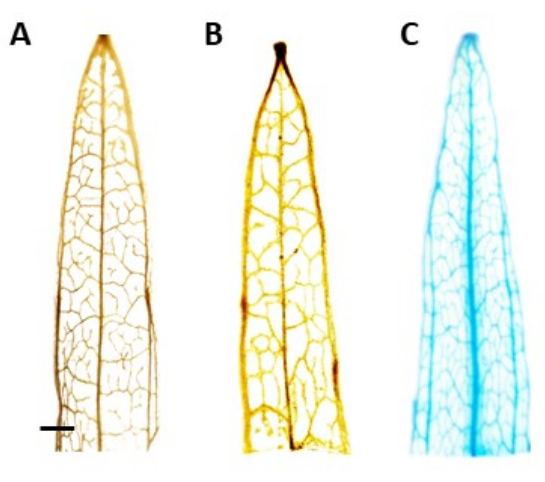
Figura 4: Tinción GUS. Resultados de la tinción de β-glucuronidasa (GUS) de segmentos foliares de plátano de hoja estrecha. (A) Tipo salvaje. (B) Plátano de hoja estrecha transformado con el plásmido que alberga el promotor AtPP2 (vector vacío). (C) Plátano de hoja estrecha transformado con el plásmido que alberga el promotor AtPP2 y el gen de la β-glucuronidasa (GUS). Cada hoja se tiñó utilizando el protocolo de tinción histoquímica GUS, luego se obtuvo una imagen con una cámara microscópica. Las imágenes (B) y (C) no muestran ningún patrón de tinción debido a la ausencia del gen GUS. La imagen de la derecha muestra un patrón de tinción azul claro en las venas, confirmando que las plantas son transgénicas. La barra representa 1 mm, con cada segmento de hoja midiendo aproximadamente 1 cm de longitud. Haga clic aquí para ver una versión más grande de esta figura.
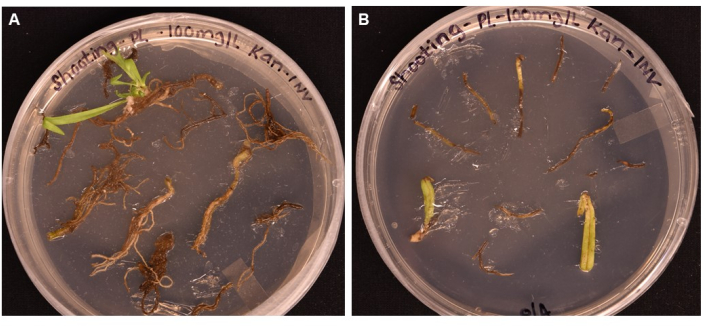
Figura 5: Comparación de la eficiencia de transformación de diferentes tipos de tejidos después de >1 mes de incubación en medios de disparo . (A) Tejidos radiculares después de más de 1 mes de crecimiento. Las raíces han experimentado callos expandidos y han surgido iniciales de brotes. El callo no transformado ha comenzado a morir en respuesta a la selección de antibióticos. (B) Tejidos de hojas y pecíolos después de más de 1 mes de crecimiento. Los tejidos experimentaron cierta expansión del callo, pero pronto murieron en respuesta al antibiótico. No surgieron brotes de ninguno de los tejidos. Haga clic aquí para ver una versión más grande de esta figura.
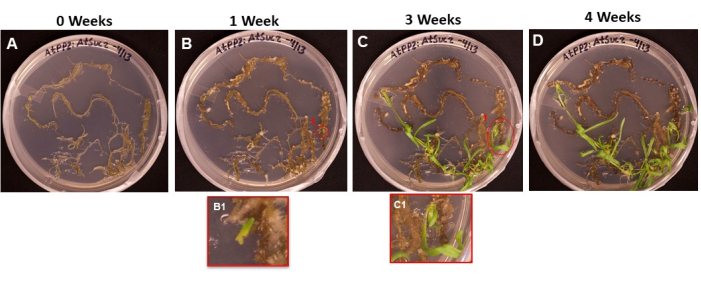
Figura 6: Aparición de callos y brotes sobre el tejido transformado. Imágenes representativas de tejidos colocados en medio de disparo después de diferentes longitudes de incubación. (A) Tejidos de la raíz justo después de haber sido chapados en el medio de disparo. (B) Tejidos radiculares después de 1 semana en medio de disparo. Se puede observar la expansión del callo, y (B1) las primeras iniciales del brote han comenzado a emerger. (C) Tejidos radiculares después de 3 semanas en medio de disparo. Han surgido más iniciales de disparo. (C1) El disparo que surgió de la inicial del rodaje B1. (D) Tejidos radiculares después de 4 semanas de incubación. El tejido no transformado ha comenzado a volverse negro / marrón y morir, y los brotes emergentes continúan creciendo. En esta etapa, los brotes están listos para ser movidos al medio de enraizamiento. Haga clic aquí para ver una versión más grande de esta figura.
Tabla 1: Recetas de preparación de medios. Una descripción de cómo preparar a los médiums para la transformación. La cantidad de vitaminas añadidas se calcula en función de la concentración de solución madre indicada. Ver Tabla 2 para la preparación de la solución madre de vitaminas. Para todos los medios, agregue reactivos a 900 ml de H2O doble destilado, pH al nivel indicado, y luego agregue agua a un volumen final de 1,000 ml. * = añadir después de la esterilización. ** = pH con 1 M KOH. = pH con 1 M NaOH. Haga clic aquí para descargar esta tabla.
Tabla 2: Existencias de vitaminas para los medios de Plantago . Todas las vitaminas deben ser esterilizadas por filtro y etiquetadas con precisión antes de su almacenamiento. Cuando esté indicado, disolver los polvos primero en 1 N NaOH, luego completar el volumen deseado con H2O doble destilado. Haga clic aquí para descargar esta tabla.
Discusión
La falta de un protocolo de transformación para las plantas del género Plantago limita el uso de estas plantas como modelos, particularmente cuando los investigadores están interesados en explorar las funciones de los genes. P. lanceolata fue elegida para desarrollar un protocolo de transformación genética porque es la planta más comúnmente estudiada de su género16. El protocolo que se ha desarrollado probablemente se utilizará como una herramienta para avanzar aún más en los estudios relacionados con la biología vascular, la ecología, las interacciones planta-insecto y la fisiología del estrés abiótico.
El protocolo presentado describe claramente los pasos que permiten a un usuario obtener plantas transgénicas. Además de la capacidad de P. lanceolata para prosperar en un entorno de cultivo de tejidos, múltiples factores contribuyeron al éxito de nuestro método de transformación. En primer lugar, se observó la importancia de utilizar tejido radicular vegetal estéril y de alta calidad para la transformación. Las raíces tenían las tasas de transformación más altas cuando se tomaron de plantas de 3-4 semanas de edad, y parecían verdes o blancas pálidas. Las raíces tomadas de cajas con cualquier cantidad de contaminación bacteriana o fúngica a menudo resultaron en cultivos de tiro contaminados, y las raíces más viejas que parecían marrones no resultaron en una transformación exitosa. El tejido de la raíz fue el tipo de tejido más eficiente para la transformación utilizando el método actual, ya que el tejido de la hoja y el pecíolo no tuvieron éxito en el desarrollo de brotes.
Otra observación importante fue que el método óptimo para recolectar tejido radicular para la transformación era colocar el material radicular recién cortado en agua estéril. Este paso permitió que el material de la raíz permaneciera hidratado mientras se recolectaba el resto del tejido, ya que las raíces tienden a secarse rápidamente cuando se retiran de sus contenedores de crecimiento. Este paso también ayudó a aumentar la tasa de éxito de la transformación, ya que permitió que se incubaran más raíces en las bacterias a la vez.
Este protocolo podría modificarse disminuyendo el tiempo que el tejido radicular incuba en los medios de cocultivo a 2 días. Se observó que un período de incubación de 2 o 3 días es suficiente para permitir la infección que resulta en iniciales de brotes. Sin embargo, no se recomiendan tiempos de incubación más largos, ya que se observó que la ausencia de un inhibidor antibiótico en los medios a menudo resulta en un crecimiento excesivo de A. tumefaciens , que puede matar el tejido emergente.
Una limitación de este estudio es la falta de datos disponibles sobre el rendimiento de otros métodos o especies de A. tumefaciens en la transformación de P. lanceolata para la comparación. Hasta donde sabemos, este protocolo es novedoso. Durante los ensayos iniciales, se observó una alta eficiencia de transformación con A. tumefaciens GV3101, y nos centramos en refinar la técnica utilizando esta cepa en lugar de experimentar con otras cepas. Nuestra eficiencia de transformación del 20% es relativamente alta para la transformación de la planta: muchos métodos convencionales consideran que cualquier cosa >1% es exitosa26,27,28. Sin embargo, el uso de otra cepa de A. tumefaciens, como A. rhizogenes, conocida por su uso en la transformación de raíces en múltiples especies 29,30,31, puede resultar en una tasa de éxito aún mayor. Se necesitaría más experimentación para evaluar el impacto del uso de otras cepas para promover una mayor eficiencia de transformación en P. lanceolata.
La transformación exitosa de P. lanceolata probablemente beneficiará a muchos campos de estudio. La alta eficiencia de transformación y el rápido crecimiento de la planta en medios de cultivo de tejidos, hacen de P. lanceolata un candidato factible para estudios de función génica15.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue apoyado por la National Science Foundation (EDGE IOS-1923557 a C.Z. y Y.Z.).
Materiales
| Name | Company | Catalog Number | Comments |
| 14 mL Round Bottom TubeA4A2:A34 | ThermoFisher Scientific | 150268 | |
| 1-Naphthylacetic acid | Gold Biotechnology | N-780 | |
| 3M Micropore Surgical Paper Tape | ThermoFisher Scientific | 19-027761 | |
| 50 mL Centrifuge Tubes | Research Products International Corp. | 163227LC | |
| 600 Watt High Pressure Sodium Lights | Plantmax | PX-LU600 | |
| 6-Benzylaminopurine (6-BAP) | Gold Biotechnology | B-110 | |
| Aluminum Foil | ThermoFisher Scientific | 01-213-100 | |
| Bacto Agar | Thermofisher Scientific | 214010 | |
| Binary Plasmid pBI101 | Clontech, USA | 632522 | |
| Cool White Grow Light Sylvania LLC | Home Depot | 315952205 | |
| D-biotin | ThermoFisher Scientific | BP232-1 | |
| ddH2O | |||
| DH5a E. coli | Invitrogen, USA | 18258012 | |
| Disposable Petri Dishes, Sterile 150 x 16 mm | ThermoFisher Scientific | FB0875712 | |
| Disposable Petri Dishes, Sterile 95 x 15 mm | ThermoFisher Scientific | FB0875714G | |
| Dissecting Scissors | Leica Biosystems | 38DI12044 | |
| Ethanol 200 Proof | Decon Labs | 2705 | |
| Folic Acid | Fisher Scientific | BP2519-5 | |
| Forceps | Leica Biosystems | 38DI18031 | |
| Gelrite | Research Products International Corp. | G35020-1000 | |
| Glycerol | ThermoFisher Scientific | 17904 | |
| Glycine | Sigma | 241261 | |
| Incubated Tabletop Orbital Shaker | ThermoFisher Scientific | SHKE420HP | |
| Indole-3-Acetic Acid (IAA) | Gold Biotechnology | I-110 | |
| Indole-3-Butyric Acid (IBA) | Gold Biotechnology | I-180 | |
| Kanamycin Monosulfate | Gold Biotechnology | K-120 | |
| Macrocentrifuge | ThermoFisher Scientific | 75007210 | |
| Magenta Boxes | ThermoFisher Scientific | 50255176 | |
| Micro Pipet Tips 1000 µL | Corning | 4140 | |
| Micro Pipet Tips 200 µL | Corning | 4138 | |
| Micro Pipette Tips 10 µL | Corning | 4135 | |
| Microcentrifuge | ThermoFisher Scientific | 75002410 | |
| Micropipettor 0.5-10 µL | Corning | 4071 | |
| Micropipettor 100-1000 µL | Corning | 4075 | |
| Micropipettor 20-200 µL | Corning | 4074 | |
| Micropipettor 2-20 µL | Corning | 4072 | |
| Murashige & Skooge Basal Medium with Vitamins | PhytoTech | M519 | |
| Murashige & Skooge Basal Salt Mixture | PhytoTech | M524 | |
| myo-Inositol | Gold Biotechnology | I-25 | |
| Nicotinic acid | Sigma | N0761-100g | |
| Parafilm (paraffin film) | ThermoFisher Scientific | S37440 | |
| Potassium Hydroxide (KOH) | Research Products International Corp. | P44000 | |
| Pyridoxine HCl | Sigma | P6280-10g | |
| Scalpel Blade Handle | Leica Biosystems | 38DI36419 | |
| Scalpel Blades | Leica Biosystems | 3802181 | |
| Sodium Chloride, Crystal (NaCl) | Mallinckrodt Chemicals | 7581-06 | |
| Sodium Hydroxide (NaOH) | Research Products International Corp. | S24000 | |
| Sodium Hypochlorite | Walmart | 23263068401 | |
| Soil- Bark Mix | Berger, USA | BM7 | |
| Square Pots (3.5 inches squared) | Greenhouse Megastore | CN-TRK-1835 | |
| Sucrose | Research Products International Corp. | S24060 | |
| Thermocycler | ThermoFisher Scientific | A24811 | |
| Thiamine HCl | Sigma | T4625-5G | |
| Timentin Ticarcillin/Clavulanate (15/1) (Timentin) | Gold Biotechnology | T-104 | |
| trans-Zeatin Riboside (ZR) | Gold Biotechnology | Z-100 | |
| Tryptone | Thermofisher Scientific | 211705 | |
| Wild Type Plantago lanceolata seeds | Outsidepride Seed Source, OR, USA | F1296 | Outsidepride.com |
| Yeast Extract Granulated | Research Products International Corp. | Y20025-1000 |
Referencias
- Koornneef, M., Meinke, D. The development of Arabidopsis as a model plant. The Plant Journal. 61 (6), 909-921 (2010).
- Bragg, J. N., Anderton, A., Nieu, R., Vogel, J. P. Brachypodium distachyon. Agrobacterium Protocols. , 17-33 (2015).
- Chang, C., Bowman, J. L., Meyerowitz, E. M. Field guide to plant model systems. Cell. 167 (2), 325-339 (2016).
- Müller, B., Grossniklaus, U. Model organisms-a historical perspective. Journal of Proteomics. 73 (11), 2054-2063 (2010).
- Ding, X., et al. Different fruit-specific promoters drive AtMYB12 expression to improve phenylpropanoid accumulation in tomato. Molecules. 27 (1), 317 (2022).
- Niedbała, G., Niazian, M., Sabbatini, P. Modeling agrobacterium-mediated gene transformation of tobacco (Nicotiana tabacum)-a model plant for gene transformation studies. Frontiers in Plant Science. 12, 695110 (2021).
- Kumari, D., Prasad, B., Dwivedi, P. . Genome Editing Platforms in Rice (Oryza sativa L.): Basic methodology and troubleshooting. , (2022).
- Zhang, B. Agrobacterium-mediated transformation of cotton. Transgenic Cotton. , 31-45 (2013).
- Tiwari, R., Singh, A. K., Rajam, M. V. Improved and reliable plant regeneration and Agrobacterium-mediated genetic transformation in soybean (Glycine max L). Journal of Crop Science and Biotechnology. , 1-10 (2022).
- Bakhsh, A. Development of efficient, reproducible and stable Agrobacterium-mediated genetic transformation of five potato cultivars. Food Technology and Biotechnology. 58 (1), 57-63 (2020).
- Bates, R., Craze, M., Wallington, E. J. Agrobacterium-mediated transformation of oilseed rape (Brassica napus). Current Protocols in Plant Biology. 2 (4), 287-298 (2017).
- Hopp, H. E., Spangenberg, G., Herrera-Estrella, L. Plant transformation. Frontiers in Plant Science. 13, 876671 (2022).
- Abdelmuhsin, A. A., Alghamdi, A. A., Ibrahim, N. A. Assessing the phenotypic and genotypic variations of Plantago ciliata in Ha'il region, Saudi Arabia. Entomology and Applied Science Letters. (1), 14-22 (2021).
- Coleman, N. Plantago Lanceolata. Botanical Bulletin. 1 (11), 45 (1876).
- Huang, J., et al. Tissue-specific transcriptomic profiling of Plantago major provides insights for the involvement of vasculature in phosphate deficiency responses. Molecular Genetics and Genomics. 294 (1), 159-175 (2019).
- Penczykowski, R. M., Sieg, R. D. Plantago spp. as models for studying the ecology and evolution of species interactions across environmental gradients. The American Naturalist. 198 (1), 158-176 (2021).
- Pommerrenig, B., et al. Common plantain. A collection of expressed sequence tags from vascular tissue and a simple and efficient transformation method. Plant Physiology. 142 (4), 1427-1441 (2006).
- Bergero, R., Levsen, N., Wolff, K., Charlesworth, D. Arms races with mitochondrial genome soft sweeps in a gynodioecious plant, Plantago lanceolata. Molecular Ecology. 28 (11), 2772-2785 (2019).
- Aalto, E. A., Koelewijn, H. P., Savolainen, O. Cytoplasmic male sterility contributes to hybrid incompatibility between subspecies of Arabidopsis lyrata. G3: Genes, Genomes, Genetics. 3 (10), 1727-1740 (2013).
- Bloch, K. D., Grossmann, B. Digestion of DNA with restriction endonucleases. Current Protocols in Molecular Biology. 3 (1), (1995).
- Du, C., et al. Prokaryotic expression, purification, physicochemical properties and antifungal activity analysis of phloem protein PP2-A1 from cucumber. International Journal of Biological Macromolecules. 194, 395-401 (2022).
- Deshmukh, S. 2. 2., Kulkarni, R., Bose, K. Transformation and protein expression. Textbook on Cloning, Expression and Purification of Recombinant Proteins. , 83-114 (2022).
- Bergkessel, M., Guthrie, C. Colony PCR. Methods in Enzymology. 529, 299-309 (2013).
- Broehan, G., Kroeger, T., Lorenzen, M., Merzendorfer, H. Functional analysis of the ATP-binding cassette (ABC) transporter gene family of Tribolium castaneum. BMC Genomics. 14, 6 (2013).
- Dong, Z., et al. Stable transformation of fluorescent proteins into Nosema bombycis by electroporation. Parasites & Vectors. 15 (1), 141 (2022).
- Li, S., et al. Optimization of Agrobacterium-mediated transformation in soybean. Frontiers in Plant Science. 8, 246 (2017).
- Manimaran, P., et al. Infection of early and young callus tissues of indica rice BPT 5204 enhances regeneration and transformation efficiency. Rice Science. 20 (6), 415-426 (2013).
- Wang, J., Nie, J., Pattanaik, S., Yuan, L. Efficient Agrobacterium-mediated transformation of Artemisia annua L. using young inflorescence. In Vitro Cellular & Developmental Biology-Plant. 52 (2), 204-211 (2016).
- Niazian, M., Belzile, F., Torkamaneh, D. CRISPR/Cas9 in planta hairy root transformation: a powerful platform for functional analysis of root traits in soybean. Plants. 11 (8), 1044 (2022).
- Geng, S., et al. An efficient root transformation system for CRISPR/Cas9-based analyses of shoot-root communication in cucurbit crops. Horticulture Research. 9, (2022).
- Xiao, Y., et al. Efficient Agrobacterium-mediated genetic transformation using cotyledons, hypocotyls and roots of 'Duli'(Pyrus betulifolia Bunge). Scientia Horticulturae. 296, 110906 (2022).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados