Method Article
Agrobacterium tumefaciens-Trasformazione genetica mediata della piantaggine a foglia stretta
In questo articolo
Riepilogo
A causa della sua versatile applicazione come specie modello in vari campi di studio, vi è la necessità di un kit di strumenti di trasformazione genetica nella piantaggine a foglia stretta (Plantago lanceolata). Qui, utilizzando la trasformazione mediata da Agrobacterium tumefaciens, viene presentato un protocollo che si traduce in linee transgeniche stabili con un'efficienza di trasformazione del 20%.
Abstract
Le specie del genere Plantago hanno diversi tratti unici che li hanno portati ad essere adattati come piante modello in vari campi di studio. Tuttavia, la mancanza di un sistema di manipolazione genetica impedisce un'indagine approfondita della funzione genica, limitando la versatilità di questo genere come modello. Qui viene presentato un protocollo di trasformazione per Plantago lanceolata, la specie di Plantago più comunemente studiata. Utilizzando la trasformazione mediata da Agrobacterium tumefaciens, le radici di 3 settimane di piante di P. lanceolata coltivate asetticamente sono state infettate da batteri, incubate per 2-3 giorni e quindi trasferite in un mezzo di induzione del germoglio con un'appropriata selezione antibiotica. I germogli in genere emergono dal terreno dopo 1 mese e le radici si sviluppano 1-4 settimane dopo che i germogli sono stati trasferiti al mezzo di induzione della radice. Le piante sono state quindi acclimatate in un ambiente del suolo e testate per la presenza di un transgene utilizzando il test reporter β-glucuronidasi (GUS). L'efficienza di trasformazione del metodo attuale è ~ 20%, con due piante transgeniche emergenti ogni 10 tessuti radicali trasformati. Stabilire un protocollo di trasformazione per la piantaggine a foglia stretta faciliterà l'adozione di questa pianta come nuova specie modello in varie aree.
Introduzione
Il concetto di utilizzare specie modello per indagare molteplici aspetti della biologia vegetale è emerso con l'uso diffuso di Arabidopsis thaliana1. Arabidopsis è stato inizialmente scelto perché condivide caratteristiche con molte altre piante da fiore e ha molteplici tratti che lo rendono conveniente da studiare in un ambiente di laboratorio, come essere piccolo e avere un ciclo di generazione breve. Il grande volume di articoli di ricerca pubblicati con esso come soggetto, insieme alle sue piccole dimensioni del genoma e alla facilità di trasformazione genetica2, gli consentono di persistere come organismo sperimentale ampiamente utilizzato. Tuttavia, Arabidopsis può essere limitato come modello per specie con caratteristiche diverse o tratti unici3. Ciò ha spinto lo sviluppo di nuovi sistemi modello, come il mais (Zea mays), una pianta importante per la genetica dello sviluppo nelle monocotiledoni4, e il pomodoro (Solanum lycopersicum), che è un modello importante per gli studi evolutivi, lo sviluppo dei frutti e la produzione, ed è una buona rappresentazione per le colture orticole5. Un metodo per la trasformazione genetica è un prerequisito affinché una specie vegetale funga da organismo modello2. Una trasformazione mediata da Agrobacterium tumefaciens è uno strumento affidabile in biologia vegetale; è stato usato per trasformare alcune specie modello e colture principali, tra cui tabacco (Nicotiana tabacum)6, riso (Oryza sativa)7, cotone (Gossypium hirsutum)8, soia (Glycine max)9, patata (Solanum tuberosum)10 e colza (Brassica napus)11. Le specie vegetali sono molto variabili nel modo in cui rispondono con successo all'infezione da A. tumefaciens e i protocolli di trasformazione spesso devono essere adattati individualmente a ciascuna specie 6,12.
Il genere Plantago comprende un totale di 256 specie di piante, ampiamente distribuite in tutto il mondo13. Le specie di questo genere hanno spesso caratteristiche uniche che le rendono desiderabili come specie modello per lo studio della genetica, dell'ecologia, della fisiologia dello stress, dei metaboliti secondari, della chimica farmaceutica, delle interazioni pianta-microbo, dello sviluppo e dell'evoluzione delle piante. Plantago lanceolata , chiamata anche piantaggine a foglia stretta o ribwort, è stata una pianta popolare di interesse dal 19° secolo, quando è stata usata per la prima volta per descrivere il fenomeno della sterilità maschile14. Come altre piante del suo genere, è stato utilizzato in studi in vari campi di ricerca. Più recentemente, è stato proposto come modello per la biologia vascolare, in quanto il suo tessuto vascolare può essere raccolto facilmente15. P. lanceolata è la specie più comunemente studiata del genere Plantago; un articolo del 2021 ha riferito che c'erano >1.400 pubblicazioni incluse o relative a questa specie in quel momento16, e altri 102 articoli sono stati pubblicati dall'inizio del 2022, secondo una ricerca PubMed condotta il 9dicembre 2022. La seconda pianta più studiata del genere, P. major, è oggetto di soli 414 articoli quando viene ricercata utilizzando gli stessi criteri nella stessa data.
Nonostante l'interesse della ricerca per P. lanceolata, gli studi, in particolare sulla caratterizzazione della funzione genica, sono spesso limitati dalla mancanza di un kit di strumenti di manipolazione genetica per la specie. Pommerrienig et al. hanno fatto sforzi per sviluppare un protocollo di trasformazione per P. major usando una tecnica di immersione floreale17. Tuttavia, questo metodo non può essere applicato a P. lanceolata a causa della sterilità maschile caratteristica di questa specie18,19. Per quanto ne sappiamo, non esiste un protocollo esistente per la trasformazione di P. lanceolata.
Questo studio presenta un semplice protocollo per la trasformazione mediata da A. tumefaciens di P. lanceolata. Prendendo di mira i tessuti radicali, le piante transgeniche completamente cresciute possono essere generate entro 3 mesi dalla trasformazione.
Protocollo
NOTA: i passaggi 1.4-1.8, 2.3-2.5, 3.3-3.6, 4.1-4.6, 5.1-5.7 e 6.1-6.3 devono essere eseguiti in condizioni asettiche, utilizzando un cappuccio pulito per evitare contaminazioni.
1. Propagazione del materiale vegetale per la trasformazione
- Collocare i semi di Plantago lanceolata wild-type (WT) disponibili in commercio (vedi Tabella dei materiali) in una provetta da centrifuga da 50 mL fino alla linea da 5 ml, a seconda del numero di piante desiderate.
NOTA: In alternativa, è possibile utilizzare una provetta da microcentrifuga da 2 ml quando è necessario un piccolo numero di semi, ma deve essere riempita a un volume non superiore a 0,1 ml, poiché troppi semi possono ridurre l'efficienza della sterilizzazione. - Immergere i semi in etanolo al 75% per 60 s.
- Scartare l'etanolo, quindi immergere i semi in ipoclorito di sodio al 20% (20% NaClO, 80% acqua sterile) per 40 minuti, capovolgendo delicatamente il tubo in modo che tutti i semi entrino in contatto con la soluzione.
NOTA: La soluzione di ipoclorito di sodio deve essere preparata di fresco per ottenere risultati ottimali. - Sotto una cappa a flusso laminare, scartare la soluzione di ipoclorito di sodio, quindi lavare i semi con acqua distillata (cinque volte). Aggiungi un piccolo volume d'acqua ai semi dopo il risciacquo finale, in quanto ciò può aiutare il movimento delle piante sui piatti.
- Utilizzando una pinza sterilizzata, trasferire i semi su piastre di Petri pre-preparate 95 mm x 100 mm con terreno solido MS (Tabella 1). Distribuire i semi uniformemente sulla superficie del piatto, con circa 1 cm tra ogni seme per evitare il sovraffollamento delle piantine germinate (Figura 1A).
- Sigillare le piastre con due strati di pellicola di paraffina per evitare la contaminazione, quindi incubare sotto una luce bianca fredda (vedi Tabella dei materiali) a temperatura ambiente (22 °C con 50 μmol m-2 s-1, 12 h giorni). I semi germinano tipicamente entro 5-6 giorni.
- Quando le piantine sono germinate e sono abbastanza grandi da essere trasferite (Figura 1B), in genere 2 o 3 giorni dopo la germinazione, utilizzare una pinza sterilizzata per trasferire le piantine in scatole sterili con 50-100 ml di terreno MS (Tabella 1). Idealmente, piantare solo cinque piantine per scatola per ottenere le migliori radici di qualità.
- Sigillare le scatole con nastro chirurgico, quindi lasciare che le piante crescano sotto una luce bianca fredda (vedi Tabella dei materiali), nelle stesse condizioni menzionate al punto 1.6. Le piante dovrebbero essere pronte per la trasformazione in circa 3-4 settimane, o quando le radici principali sono cresciute di circa 2 cm di lunghezza e le radici laterali appaiono bianche.
NOTA: Le ricette di preparazione media e le scorte di vitamine sono incluse nella Tabella 1 e nella Tabella 2.
2. Costruzione del plasmide e trasformazione di E. Coli
NOTA: L'esatta procedura di costruzione del plasmide varia a seconda del gene di interesse. In questa procedura, gli enzimi di restrizione HindIII e SalII sono stati utilizzati per inserire il promotore AtPP2 da 1,5 kb nel plasmide binario pBI101 (vedi Tabella dei Materiali) con GUS, utilizzando la procedura standard di clonazione20. AtPP2 (proteina floema 2) è un gene che è specificamente espresso nel floema21.
- Clonare il promotore usando le coppie di primer 5'-AGTCAAGCTTCAAGTCCCTGTGGCTACTGAAC-3' (Forward) e 5'-AGTCGTCGACACAAACCAGTATGATGTATTTATTTG-3' (Reverse) da Arabidopsis. La Figura 2 mostra un diagramma del vettore plasmidico binario con l'inserto AtPP2:GUS .
- Dopo la costruzione del plasmide, trasformare i plasmidi in cellule competenti per DH5a E. coli (vedi Tabella dei materiali) utilizzando il metodo dello shock termico22, quindi incubare per 1,5 ore a 37 °C con agitazione (150 rpm).
- Prelevare 150 μL di ciascuna coltura di trasformazione, placcare su piastre di supporti agar LB (Tabella 1) con la selezione appropriata (50 mg/L di kanamicina per il ceppo utilizzato in questo protocollo; vedi Tabella dei materiali) e quindi incubare le piastre per 16-24 ore a 37 °C.
NOTA: Il ceppo batterico utilizzato in questo studio è A. tumefaciens GV3101. - Successivamente, utilizzare la PCR delle colonie per esaminare le colonie per i ricombinanti positivi23.
NOTA: In questo protocollo, i seguenti primer sono stati utilizzati per amplificare il gene bersaglio; 5'-ATGTTACGTCCTGTAGAAACCCCAA-3' (avanti) e 5'-TCATTGTTTGCCTCCCTGCTGC-3' (rovescio).- Eseguire la reazione in un termociclatore (vedi tabella dei materiali) con condizioni di ciclo di 3 min a 95 °C, seguite da 35 cicli di: 30 s a 95 °C, 30 s a 55 °C, 2 min a 72 °C e una fase di allungamento finale di 10 min a 72 °C.
- Inoculare le colonie positive in 6 mL di brodo LB (Tabella 1) con l'antibiotico appropriato (50 mg/L di kanamicina) e crescere a 37 °C durante la notte, a 200-250 giri/min.
- Dopo la crescita durante la notte, estrarre i plasmidi dai batteri utilizzando procedure standard24.
3. Trasformazione di A. tumefaciens con plasmide
- Dopo l'estrazione del plasmide, utilizzare l'elettroporazione per trasformare il plasmide modificato nel ceppo desiderato di cellule competenti. In questa procedura è stato utilizzato il ceppo GV3101 di A. tumefaciens. Seguire metodi standardizzati per le tecniche di elettroporazione25.
- Dopo elettroporazione, risospendere le cellule competenti in 1 mL di brodo LB e quindi incubare per 2-4 ore a 28 °C a 100 rpm.
- Raccogliere le cellule mediante centrifugazione a 6.800 x g per 3 minuti in una microcentrifuga da tavolo (vedere Tabella dei materiali) a temperatura ambiente (22 °C), quindi distribuire 50-100 μL su una piastra di agar LB con un agente di selezione appropriato (50 mg/L di kanamicina per il plasmide utilizzato in questo protocollo).
- Dopo che le cellule sono state incubate per 2 giorni a 28 °C, identificare le colonie positive contenenti il gene di interesse attraverso l'uso della PCR di colonia. In questo protocollo, utilizzare i primer e le condizioni menzionate nel passaggio 2.4.
- Quindi, utilizzare le colonie positive per striare una piastra di riserva con LB agar media + selezione. La piastra può essere conservata a 4 °C per un massimo di 1 mese.
- In alternativa, per la conservazione a lungo termine, inoculare una colonia positiva con un piccolo volume di LB con una selezione appropriata. Agitare la coltura inoculata per una notte a 28 °C a 200 giri/min, quindi preparare uno stock di glicerolo (50% p/v di glicerolo in una miscela 50:50 di batteri e glicerolo), che può essere conservato a -80 °C per un massimo di 10 anni.
4. A. preparazione tumefaciens
- Striscia A. tumefaciens contenente il plasmide desiderato su piastre LB solide preparate 95 mm x 100 mm con l'agente di selezione appropriato. In questo protocollo, è stato utilizzato il ceppo batterico GV3101 con l'inserto plasmidico AtPP2:GUS , con 50 mg/L di kanamicina aggiunta per la selezione.
- Sigillare le piastre con pellicola di paraffina, quindi incubare a 28 °C per un massimo di 48 ore o fino a quando i batteri diventano abbastanza grandi da raccogliere.
- Utilizzare una punta di pipetta per prelevare una colonia di batteri 2 giorni prima della trasformazione e inocularla in una provetta inferiore rotonda da 15 ml contenente 6 ml di LB liquido con la selezione appropriata. Agitare a 200 giri/min in uno shaker da tavolo a 28 °C per tutta la notte, fino a quando OD600 raggiunge 0,6-0,7.
NOTA: Le piastre e l'inoculazione batterica da 6 ml possono essere conservati a 4 °C per un massimo di 1 mese. - Quando i batteri raggiungono l'OD 600 corretto, utilizzare una pipetta per trasferire A. tumefaciens in un matraccio sterile contenente100 ml di LB liquido con un agente di selezione. Tipicamente, 200 μL di batteri per 100 mL LB sono appropriati per la propagazione. Agitare a 200 giri/min a 28 °C durante la notte, fino a quando OD600 raggiunge 0,6-0,7.
- Trasferire i batteri in provette sterili da 50 ml e centrifugare a 2.200 xg per 10 minuti a temperatura ambiente (22 °C) in una centrifuga da tavolo per raccogliere i batteri.
- Eliminare il surnatante usando una pipetta. Risospendere il pellet batterico in 5 mL di soluzione di sospensione liquida (SS) a temperatura ambiente (22 °C) (Tabella 1) mediante pipettaggio, quindi aggiungere fino a 50 mL di SS e capovolgere più volte per miscelare. I batteri sono ora pronti per la trasformazione.
NOTA: Il liquido SS deve essere preparato fresco, entro 1 settimana dalla trasformazione.
ATTENZIONE: Tutto il materiale che entra in contatto con A. tumefaciens deve essere gettato in un cestino dei rifiuti a rischio biologico. I liquidi residui di colture batteriche possono essere sterilizzati con ipoclorito di sodio (candeggina) ad una concentrazione del 20% o superiore.
5. Trasformazione delle radici di Plantago
- Quando le piante raggiungono lo stadio ideale per la trasformazione (le piantine hanno 3 settimane) (Figura 1C), utilizzare pinze sterili e forbici per separare le radici dal resto della pianta (Figura 3A). Scartare il materiale della foglia e dello stelo.
- Immediatamente dopo il taglio, trasferire i pezzi di radice in scatole sterili contenenti acqua sterile usando una pinza sterile. Questo passaggio consente alle radici di rimanere idratate mentre tutto il tessuto viene raccolto.
- Quando tutte le radici sono state tagliate, versare la sospensione di A. tumefaciens/SS in piastre di Petri sterili da 150 x 15 mm. Trasferire le radici nella coltura di A. tumefaciens e inoculare per almeno 20 minuti (Figura 3B).
- Durante l'incubazione, utilizzare un bisturi sterile con una lama affilata per tagliare le radici in frammenti di 1 cm, separando le radici primarie dalle radici laterali. Fai tagli sottili e superficiali sulla superficie delle radici per consentire ai batteri di infettare la pianta.
NOTA: Se si tratta di un gran numero di piante, trasferire i pezzi di radice nella coltura batterica in lotti, per garantire che tutte le radici siano immerse durante l'inoculazione. - Dopo l'incubazione, utilizzare la pinza sterile per trasferire i pezzi di radice su asciugamani di carta sterili per rimuovere i batteri in eccesso. Evitare di essiccare le radici per più di 60 secondi, in quanto ciò può causare disidratazione e danneggiare il tessuto radicale. Idealmente, 10-15 radici possono essere essiccate contemporaneamente (Figura 3C).
- Trasferire le radici essiccate in piastre di Petri preparate 95 mm x 15 mm con terreni di coltura solidi (Tabella 1), circa 10-20 radici per piatto, a seconda delle dimensioni delle radici (Figura 3D).
- Sigillare le piastre con due strati di pellicola plastica trasparente, quindi coprire con un foglio di alluminio. Incubare a temperatura ambiente (22 °C) per 3 giorni. Questo passaggio fornisce il tempo ai batteri di infettare le radici senza la presenza di una selezione antibiotica (Figura 3E).
6. Selezione e rigenerazione dell'intera pianta
- Dopo l'incubazione in terreni di cocoltura, trasferire i pezzi di radice in piastre di Petri preparate 95 mm x 15 mm con terreno di induzione di germogli solidi (SIM) (Tabella 1) con Timentina (500 mg/L; vedi Tabella dei materiali) e selezione antibiotica appropriata. In questo protocollo, abbiamo usato kanamicina (100 mg / L).
NOTA: Il fondo delle radici deve entrare in completo contatto con il mezzo. Le radici che non toccano la superficie del mezzo sono troppo lunghe e devono essere tagliate per evitare che il tessuto sfugga alla selezione. - Sigillare le piastre con due strati di pellicola di plastica trasparente, quindi crescere sotto una luce di coltivazione per 1 mese (vedere il passaggio 1.6 per le condizioni appropriate) o fino a quando i germogli iniziano ad emergere.
NOTA: In genere, le iniziali dei germogli possono essere osservate dopo 2 settimane di crescita e i germogli sono in genere visibili dopo 1 mese. - Quando le piantine sono lunghe 1,5-2,0 cm (Figura 1D), trasferirle in scatole sterili preparate con mezzi di induzione radicale solidi (Tabella 1).
- Coltiva le piante sotto una luce di coltivazione (vedi passo 1.6 per le condizioni) per diverse settimane, fino a quando non si formano le radici. Le radici possono in genere essere viste per la prima volta dopo 1 settimana.
NOTA: Si raccomanda di lasciare crescere le radici per diverse settimane prima di spostarsi nel terreno, poiché le piante con sistemi radicali più grandi tendono ad avere un tasso di sopravvivenza più elevato nel terreno.
7. Trasferimento del suolo
- Quando i sistemi radicali sono diventati abbastanza grandi da trasferirsi (Figura 1E), in genere dopo 1 mese di crescita, trasferire le piante in 3,5 in vasi quadrati contenenti terreno multiuso pre-bagnato (BM7). In questo protocollo, è stata utilizzata la miscela di corteccia BM7 (vedi Tabella dei materiali).
- Rimuovere qualsiasi mezzo che si attacca alle radici lavandole delicatamente in acqua.
NOTA: Le piante possono essere coltivate fino alla maturità in una serra a 800-1400 μmol fotoni m-2 s-2 utilizzando lampade ad alta pressione di sodio da 600 W (vedi Tabella dei materiali), o in una camera di crescita a temperatura ambiente (22 °C) con luci bianche fredde a 50 μmol m-2 s-1, 12 ore giorni.
- Rimuovere qualsiasi mezzo che si attacca alle radici lavandole delicatamente in acqua.
- Coprire le piante con un coperchio di plastica, quindi coprirle con un sacchetto di plastica trasparente. Questo passaggio consente alle piante di rimanere in un ambiente umido mentre si adattano al terreno.
- Dopo circa 3-5 giorni, rimuovere il sacchetto di plastica, quindi rimuovere lentamente il coperchio per consentire l'acclimatazione all'ambiente esterno.
NOTA: A seconda del periodo dell'anno e dell'ambiente in cui le piante vengono trasferite, il tempo che le piante devono adattarsi può variare. Si consiglia di controllare le piante quotidianamente e aggiungere acqua ai vasi secondo necessità. - Innaffia regolarmente le piante e aggiungi fertilizzante se necessario. Le piante possono anche essere trasferite in vasi più grandi per un'ulteriore crescita (Figura 1F).
8. Colorazione istochimica β-glucuronidasi (GUS)
- Preparare la soluzione colorante β-glucuronidasi (GUS), secondo i protocolli pubblicati15.
- Quando le iniziali del germoglio sono lunghe circa 0,5-1 cm, rimuovere una piccola punta di una foglia giovane e completamente espansa (di solito sono sufficienti <5 mm di lunghezza) e trasferire immediatamente a 0,5-1 ml di soluzione colorante GUS in una provetta da microcentrifuga da 1,5 o 2 ml. La soluzione dovrebbe coprire completamente il tessuto vegetale.
- Posizionare i tubi aperti in un essiccatore sottovuoto e aspirare a 20-25 kPa per 5-10 minuti. Piccole bolle dovrebbero essere visibili nella soluzione durante la procedura di vuoto. Ciò consente alla soluzione di entrare nelle cellule della pianta.
- Lasciare filtrare nuovamente l'aria nell'essiccatore sottovuoto. Chiudere i tubi e incubare a 37 °C durante la notte (12 ore), o fino a quando il colore blu è visibile.
NOTA: In questo studio, l'attività del GUS è stata localizzata nel floema, il che significa che nelle piante trasformate positivamente, la colorazione blu dovrebbe essere visibile solo nel tessuto floematico. Le piante senza il transgene non subiscono colorazione (Figura 4). - Per visualizzare meglio la macchia, trasferire le piante al 100% di etanolo per rimuovere la clorofilla. Per aumentare l'efficienza del processo di rimozione della clorofilla, incubare i tubi a 60 °C per 10 minuti.
NOTA: Potrebbe essere necessario cambiare l'etanolo più volte prima che tutta la clorofilla venga rimossa, a seconda delle dimensioni della foglia da colorare.
Risultati
Un semplice protocollo è riportato qui per ottenere piante transgeniche di P. lanceolata utilizzando la trasformazione mediata da A. tumefaciens. Il gene reporter GUS (codificante per la β-glucuronidasi) viene trasformato, guidato dal promotore del floema espresso di AtPP2, in radici di P. lanceolata di 3 settimane attraverso il ceppo GV3101 di A. tumefaciens (Figura 2). È stato scelto un promotore specifico del floema perché il nostro interesse principale era quello di stabilire un sistema per la genomica funzionale dei tessuti vascolari vegetali, in particolare del floema. Il metodo è stato testato sulla radice, sulla foglia e sul tessuto del picciolo nell'esperimento preliminare. Sebbene il callo possa essere indotto in tutti i tipi di tessuto, solo il tessuto radicolare produce iniziali di germogli (Figura 5A) dopo 1 mese in SIM; la foglia e il picciolo divennero marroni e morirono (Figura 5B). Ciò ha portato alla conclusione che il tessuto radicale era il tipo di tessuto ottimale per l'uso nel metodo di trasformazione. Le radici sono state incubate nei batteri preparati risospesi in soluzione di sospensione (SS) (Tabella 1) per un minimo di 20 minuti, quindi incubate a temperatura ambiente su piastre SS solide per un massimo di 3 giorni al buio (Figura 3E). Le radici sono state poi trasferite sul mezzo di induzione del germoglio (SIM) e tenute sotto una luce di coltivazione, nelle condizioni indicate nel protocollo (fase 1.6). Le Figure 1 e 3 mostrano immagini rappresentative di ogni passaggio del protocollo come riferimento.
La Figura 6 mostra la progressione delle iniziali dei germogli che emergono dal tessuto trasformato, dal primo giorno in cui le radici sono state posizionate sulla SIM (Figura 6A) a quando i germogli erano pronti per essere radicati (Figura 6D). Dopo 1 settimana, il tessuto radicolare formava il callo (Figura 6B) e si potevano osservare gli inizi delle iniziali dei germogli (Figura 6B1). I germogli hanno continuato ad emergere durante le settimane 2 e 3 (Figura 6C) e, dopo 4 settimane, i germogli erano pronti per essere trasferiti al mezzo di induzione della radice (Figura 6D).
L'identificazione delle presunte piante transgeniche è stata condotta utilizzando il test istochimico della β-glucuronidasi (GUS), utilizzando segmenti fogliari prelevati una volta che i germogli erano lunghi circa 0,5 cm. Le piante transgeniche positive hanno mostrato il pattern di colorazione atteso nel tessuto localizzato del floema, dimostrato nella Figura 4. I germogli positivi colorati con GUS sono stati trasferiti al mezzo di induzione della radice, in cui hanno sviluppato robusti sistemi di radicazione dopo 4 settimane (Figura 1E). Le piante radicate sono state poi trasferite nel terreno. La Figura 4 mostra il risultato della colorazione in una piantaggine a foglia stretta trasformata con il promotore AtPP2 e il gene β-glucuronidasi (GUS), insieme a una piantaggine wild-type e una a foglia stretta trasformata con il promotore AtPP2, per confronto. Tutti i germogli che sono emersi sono stati confermati come transgenici. L'efficienza di trasformazione è stata determinata in media del 20%, con circa due germogli emergenti per ogni 10 radici trasformate. Le piante transgeniche confermate sono state trasferite in vasi più grandi e coltivate per 4-8 settimane fino a raggiungere lo stadio adulto (Figura 1F).
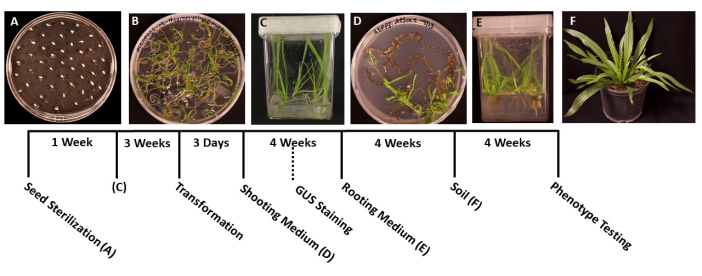
Figura 1: Cronologia della trasformazione di Plantago lanceolata . Immagini rappresentative di ogni fase del protocollo. A) Semi non germinati placcati su una piastra MS. (B) Semi germinati dopo 1 settimana, pronti per essere trasferiti in scatole magenta. (C) Piante in scatole per SM dopo 3 settimane di crescita. Le radici sono verdi e sane, nella fase ideale per la trasformazione. (D) I germogli in terreni di induzione dopo 4 settimane sono pronti per essere trasferiti nel terreno di radicazione. In questa fase, è possibile condurre la colorazione istochimica della β-glucuronidasi (GUS), se applicabile. (E) Piante in scatole con mezzi di induzione radicale, dove le radici si sono formate dopo 4 settimane di crescita. (F) Le piante transgeniche sono cresciute a tutta lunghezza dopo 4 settimane di crescita nel suolo. Fare clic qui per visualizzare una versione ingrandita di questa figura.
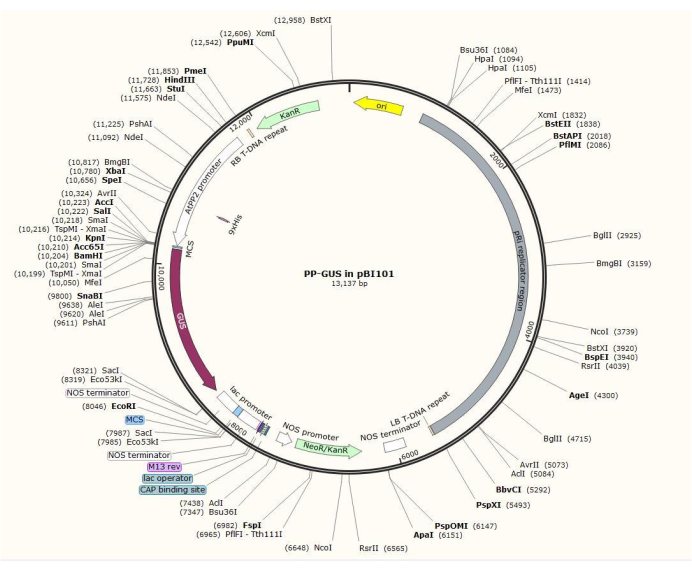
Figura 2: Diagramma del plasmide vettore binario pBI101 + β-glucuronidasi (GUS) con il promotore specifico del floema inserito AtPP2. Fare clic qui per visualizzare una versione più grande di questa figura.
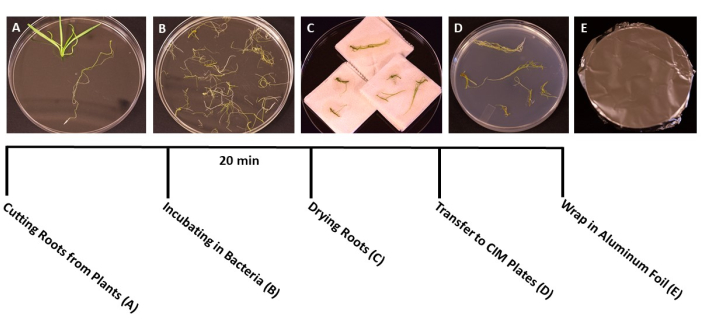
Figura 3: Fasi della trasformazione. Immagini rappresentative di ogni fase della trasformazione. (A) Separare le radici dai germogli durante la trasformazione. (B) Radici in ammollo in sospensione di batteri/SS. (C) Asciugare le radici su tovaglioli di carta per rimuovere i batteri in eccesso. (D) Radici placcate su terreno di cocoltura. (E) Piastre SS avvolte in un foglio di alluminio. Le piante sono state incubate per 2-3 giorni prima di essere trasferite al mezzo di tiro. Fare clic qui per visualizzare una versione ingrandita di questa figura.
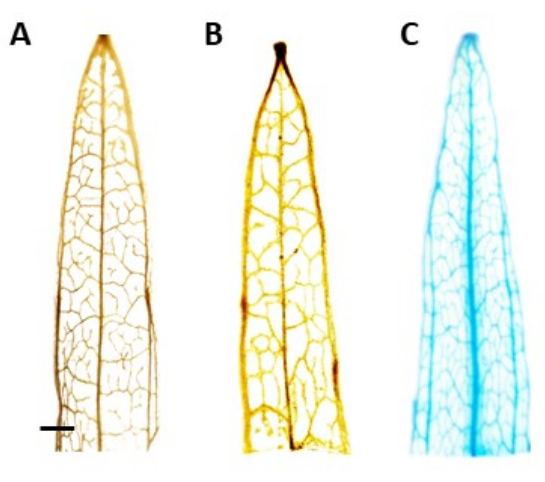
Figura 4: Colorazione GUS. Risultati della colorazione β-glucuronidasi (GUS) dei segmenti fogliari di piantaggine a foglia stretta. (A) Tipo selvatico. (B) Piantaggine a foglia stretta trasformata con il plasmide che ospita il promotore AtPP2 (vettore vuoto). (C) Piantaggine a foglia stretta trasformata con il plasmide che ospita il promotore AtPP2 e il gene della β-glucuronidasi (GUS). Ogni foglia è stata colorata utilizzando il protocollo di colorazione istochimica GUS, quindi ripresa con una fotocamera microscopica. Le immagini (B) e (C) non mostrano alcun pattern di colorazione a causa dell'assenza del gene GUS. L'immagine a destra mostra un chiaro motivo di colorazione blu nelle vene, confermando che le piante sono transgeniche. La barra rappresenta 1 mm, con ogni segmento fogliare che misura circa 1 cm di lunghezza. Fare clic qui per visualizzare una versione ingrandita di questa figura.
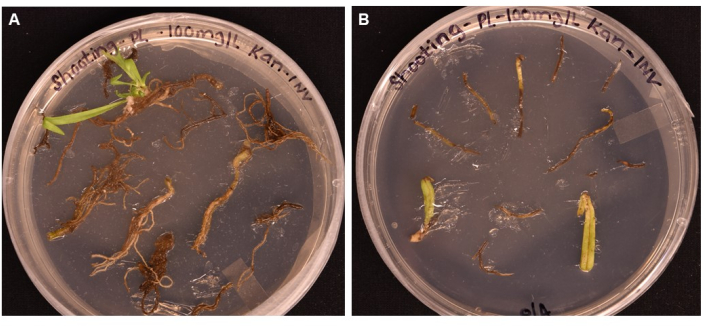
Figura 5: Confronto dell'efficienza di trasformazione di diversi tipi di tessuto dopo >1 mese di incubazione su supporti di ripresa . (A) Tessuti radicali dopo oltre 1 mese di crescita. Le radici hanno sperimentato un callo espanso e sono emerse le iniziali dei germogli. Il callo non trasformato ha iniziato a morire in risposta alla selezione antibiotica. (B) Tessuti fogliari e piccioli dopo oltre 1 mese di crescita. I tessuti hanno sperimentato una certa espansione del callo, ma presto sono morti in risposta all'antibiotico. Nessun germoglio è emerso da entrambi i tessuti. Fare clic qui per visualizzare una versione ingrandita di questa figura.
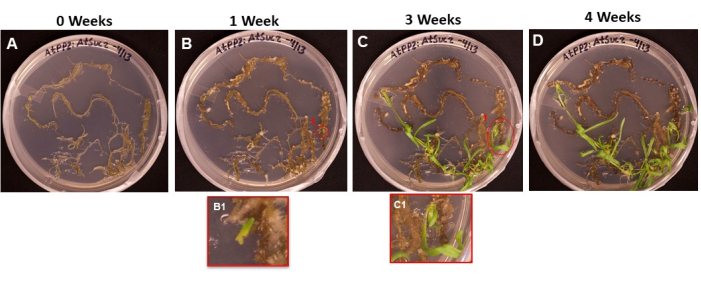
Figura 6: Comparsa di callo e germogli su tessuto trasformato. Immagini rappresentative di tessuti posti su un mezzo di ripresa dopo diverse lunghezze di incubazione. (A) Tessuti radicolari subito dopo essere stati placcati sul mezzo di tiro. (B) Tessuti radicolari dopo 1 settimana sul mezzo di ripresa. Si può osservare l'espansione del callo e (B1) le iniziali dei primi germogli hanno iniziato ad emergere. (C) Tessuti radicolari dopo 3 settimane sul terreno di tiro. Sono emerse altre iniziali di ripresa. (C1) Il germoglio emerso dall'iniziale dello scatto B1. (D) Tessuti radicali dopo 4 settimane di incubazione. Il tessuto non trasformato ha iniziato a diventare nero / marrone e morire e i germogli emergenti continuano a crescere. In questa fase, i germogli sono pronti per essere spostati sul mezzo di radicazione. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Tabella 1: Ricette per la preparazione dei supporti. Descrizione di come preparare i mezzi per la trasformazione. La quantità di vitamine aggiunte viene calcolata in base alla concentrazione indicata della soluzione madre. Vedere la Tabella 2 per la preparazione della soluzione madre di vitamine. Per tutti i mezzi, aggiungere i reagenti a 900 ml di H2O bidistillato, pH al livello indicato, quindi aggiungere acqua a un volume finale di 1.000 ml. * = aggiungere dopo la sterilizzazione. ** = pH con 1 M KOH. = pH con 1 M NaOH. Clicca qui per scaricare questa tabella.
Tabella 2: Scorte di vitamine per i terreni di Plantago . Tutte le vitamine devono essere sterilizzate con filtro ed etichettate accuratamente prima della conservazione. Dove indicato, sciogliere prima le polveri in 1 N NaOH, quindi portare il volume desiderato con H2O bidistillato. Clicca qui per scaricare questa tabella.
Discussione
La mancanza di un protocollo di trasformazione per le piante del genere Plantago limita l'uso di queste piante come modelli, in particolare quando i ricercatori sono interessati ad esplorare le funzioni geniche. P. lanceolata è stata scelta per sviluppare un protocollo di trasformazione genetica perché è la pianta più comunemente studiata del suo genere16. Il protocollo che è stato sviluppato sarà probabilmente utilizzato come strumento per far progredire ulteriormente gli studi relativi alla biologia vascolare, all'ecologia, alle interazioni pianta-insetto e alla fisiologia dello stress abiotico.
Il protocollo presentato delinea chiaramente i passaggi che consentono a un utente di ottenere piante transgeniche. Oltre alla capacità di P. lanceolata di prosperare in un ambiente di coltura tissutale, molteplici fattori hanno contribuito al successo del nostro metodo di trasformazione. In primo luogo, è stata osservata l'importanza di utilizzare tessuto radicale vegetale sterile di alta qualità per la trasformazione. Le radici hanno avuto i più alti tassi di trasformazione quando sono state prese da piante di 3-4 settimane e apparivano verdi o bianche pallide. Le radici prelevate da scatole con qualsiasi quantità di contaminazione batterica o fungina spesso hanno portato a colture di tiro contaminate e le radici più vecchie che apparivano marroni non hanno portato a una trasformazione di successo. Il tessuto radicale era il tipo di tessuto più efficiente per la trasformazione utilizzando il metodo attuale, poiché il tessuto fogliare e picciolo non aveva successo nello sviluppo di germogli.
Un'altra osservazione importante era che il metodo ottimale per raccogliere il tessuto radicale per la trasformazione era quello di mettere materiale radicolare appena tagliato in acqua sterile. Questo passaggio ha effettivamente permesso al materiale radicale di rimanere idratato mentre il resto del tessuto è stato raccolto, poiché le radici tendono ad asciugarsi rapidamente quando vengono rimosse dai loro contenitori di crescita. Questo passaggio ha anche contribuito ad aumentare il tasso di successo della trasformazione, perché ha permesso di incubare più radici nei batteri contemporaneamente.
Questo protocollo potrebbe essere modificato riducendo il tempo che il tessuto radicolare incuba nei terreni di co-coltura a 2 giorni. È stato osservato che un periodo di incubazione di 2 o 3 giorni è sufficiente per consentire l'infezione che si traduce in iniziali di germoglio. Tuttavia, i tempi di incubazione più lunghi non sono raccomandati, poiché è stato osservato che l'assenza di un inibitore antibiotico nei media spesso provoca una crescita eccessiva di A. tumefaciens , che può uccidere il tessuto emergente.
Una limitazione di questo studio è la mancanza di dati disponibili sulle prestazioni di altri metodi o specie di A. tumefaciens nella trasformazione di P. lanceolata per il confronto. Per quanto ne sappiamo, questo protocollo è nuovo. Durante le prove iniziali, è stata notata un'elevata efficienza di trasformazione con A. tumefaciens GV3101 e ci siamo concentrati sul perfezionamento della tecnica utilizzando questo ceppo invece di sperimentare con altri ceppi. La nostra efficienza di trasformazione del 20% è relativamente elevata per la trasformazione degli impianti: molti metodi convenzionali considerano qualsiasi >1% di successo26,27,28. Tuttavia, l'utilizzo di un altro ceppo di A. tumefaciens, come A. rhizogenes, noto per il suo uso nella trasformazione delle radici in più specie 29,30,31, può comportare un tasso di successo ancora più elevato. Saranno necessarie ulteriori sperimentazioni per valutare l'impatto dell'uso di altri ceppi per promuovere una maggiore efficienza di trasformazione in P. lanceolata.
Il successo della trasformazione di P. lanceolata andrà probabilmente a beneficio di molti campi di studio. L'elevata efficienza di trasformazione e la rapida crescita della pianta nei terreni di coltura tissutale rendono P. lanceolata un candidato fattibile per gli studi sulla funzione genica15.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è stato sostenuto dalla National Science Foundation (EDGE IOS-1923557 a C.Z. e Y.Z.).
Materiali
| Name | Company | Catalog Number | Comments |
| 14 mL Round Bottom TubeA4A2:A34 | ThermoFisher Scientific | 150268 | |
| 1-Naphthylacetic acid | Gold Biotechnology | N-780 | |
| 3M Micropore Surgical Paper Tape | ThermoFisher Scientific | 19-027761 | |
| 50 mL Centrifuge Tubes | Research Products International Corp. | 163227LC | |
| 600 Watt High Pressure Sodium Lights | Plantmax | PX-LU600 | |
| 6-Benzylaminopurine (6-BAP) | Gold Biotechnology | B-110 | |
| Aluminum Foil | ThermoFisher Scientific | 01-213-100 | |
| Bacto Agar | Thermofisher Scientific | 214010 | |
| Binary Plasmid pBI101 | Clontech, USA | 632522 | |
| Cool White Grow Light Sylvania LLC | Home Depot | 315952205 | |
| D-biotin | ThermoFisher Scientific | BP232-1 | |
| ddH2O | |||
| DH5a E. coli | Invitrogen, USA | 18258012 | |
| Disposable Petri Dishes, Sterile 150 x 16 mm | ThermoFisher Scientific | FB0875712 | |
| Disposable Petri Dishes, Sterile 95 x 15 mm | ThermoFisher Scientific | FB0875714G | |
| Dissecting Scissors | Leica Biosystems | 38DI12044 | |
| Ethanol 200 Proof | Decon Labs | 2705 | |
| Folic Acid | Fisher Scientific | BP2519-5 | |
| Forceps | Leica Biosystems | 38DI18031 | |
| Gelrite | Research Products International Corp. | G35020-1000 | |
| Glycerol | ThermoFisher Scientific | 17904 | |
| Glycine | Sigma | 241261 | |
| Incubated Tabletop Orbital Shaker | ThermoFisher Scientific | SHKE420HP | |
| Indole-3-Acetic Acid (IAA) | Gold Biotechnology | I-110 | |
| Indole-3-Butyric Acid (IBA) | Gold Biotechnology | I-180 | |
| Kanamycin Monosulfate | Gold Biotechnology | K-120 | |
| Macrocentrifuge | ThermoFisher Scientific | 75007210 | |
| Magenta Boxes | ThermoFisher Scientific | 50255176 | |
| Micro Pipet Tips 1000 µL | Corning | 4140 | |
| Micro Pipet Tips 200 µL | Corning | 4138 | |
| Micro Pipette Tips 10 µL | Corning | 4135 | |
| Microcentrifuge | ThermoFisher Scientific | 75002410 | |
| Micropipettor 0.5-10 µL | Corning | 4071 | |
| Micropipettor 100-1000 µL | Corning | 4075 | |
| Micropipettor 20-200 µL | Corning | 4074 | |
| Micropipettor 2-20 µL | Corning | 4072 | |
| Murashige & Skooge Basal Medium with Vitamins | PhytoTech | M519 | |
| Murashige & Skooge Basal Salt Mixture | PhytoTech | M524 | |
| myo-Inositol | Gold Biotechnology | I-25 | |
| Nicotinic acid | Sigma | N0761-100g | |
| Parafilm (paraffin film) | ThermoFisher Scientific | S37440 | |
| Potassium Hydroxide (KOH) | Research Products International Corp. | P44000 | |
| Pyridoxine HCl | Sigma | P6280-10g | |
| Scalpel Blade Handle | Leica Biosystems | 38DI36419 | |
| Scalpel Blades | Leica Biosystems | 3802181 | |
| Sodium Chloride, Crystal (NaCl) | Mallinckrodt Chemicals | 7581-06 | |
| Sodium Hydroxide (NaOH) | Research Products International Corp. | S24000 | |
| Sodium Hypochlorite | Walmart | 23263068401 | |
| Soil- Bark Mix | Berger, USA | BM7 | |
| Square Pots (3.5 inches squared) | Greenhouse Megastore | CN-TRK-1835 | |
| Sucrose | Research Products International Corp. | S24060 | |
| Thermocycler | ThermoFisher Scientific | A24811 | |
| Thiamine HCl | Sigma | T4625-5G | |
| Timentin Ticarcillin/Clavulanate (15/1) (Timentin) | Gold Biotechnology | T-104 | |
| trans-Zeatin Riboside (ZR) | Gold Biotechnology | Z-100 | |
| Tryptone | Thermofisher Scientific | 211705 | |
| Wild Type Plantago lanceolata seeds | Outsidepride Seed Source, OR, USA | F1296 | Outsidepride.com |
| Yeast Extract Granulated | Research Products International Corp. | Y20025-1000 |
Riferimenti
- Koornneef, M., Meinke, D. The development of Arabidopsis as a model plant. The Plant Journal. 61 (6), 909-921 (2010).
- Bragg, J. N., Anderton, A., Nieu, R., Vogel, J. P. Brachypodium distachyon. Agrobacterium Protocols. , 17-33 (2015).
- Chang, C., Bowman, J. L., Meyerowitz, E. M. Field guide to plant model systems. Cell. 167 (2), 325-339 (2016).
- Müller, B., Grossniklaus, U. Model organisms-a historical perspective. Journal of Proteomics. 73 (11), 2054-2063 (2010).
- Ding, X., et al. Different fruit-specific promoters drive AtMYB12 expression to improve phenylpropanoid accumulation in tomato. Molecules. 27 (1), 317 (2022).
- Niedbała, G., Niazian, M., Sabbatini, P. Modeling agrobacterium-mediated gene transformation of tobacco (Nicotiana tabacum)-a model plant for gene transformation studies. Frontiers in Plant Science. 12, 695110 (2021).
- Kumari, D., Prasad, B., Dwivedi, P. . Genome Editing Platforms in Rice (Oryza sativa L.): Basic methodology and troubleshooting. , (2022).
- Zhang, B. Agrobacterium-mediated transformation of cotton. Transgenic Cotton. , 31-45 (2013).
- Tiwari, R., Singh, A. K., Rajam, M. V. Improved and reliable plant regeneration and Agrobacterium-mediated genetic transformation in soybean (Glycine max L). Journal of Crop Science and Biotechnology. , 1-10 (2022).
- Bakhsh, A. Development of efficient, reproducible and stable Agrobacterium-mediated genetic transformation of five potato cultivars. Food Technology and Biotechnology. 58 (1), 57-63 (2020).
- Bates, R., Craze, M., Wallington, E. J. Agrobacterium-mediated transformation of oilseed rape (Brassica napus). Current Protocols in Plant Biology. 2 (4), 287-298 (2017).
- Hopp, H. E., Spangenberg, G., Herrera-Estrella, L. Plant transformation. Frontiers in Plant Science. 13, 876671 (2022).
- Abdelmuhsin, A. A., Alghamdi, A. A., Ibrahim, N. A. Assessing the phenotypic and genotypic variations of Plantago ciliata in Ha'il region, Saudi Arabia. Entomology and Applied Science Letters. (1), 14-22 (2021).
- Coleman, N. Plantago Lanceolata. Botanical Bulletin. 1 (11), 45 (1876).
- Huang, J., et al. Tissue-specific transcriptomic profiling of Plantago major provides insights for the involvement of vasculature in phosphate deficiency responses. Molecular Genetics and Genomics. 294 (1), 159-175 (2019).
- Penczykowski, R. M., Sieg, R. D. Plantago spp. as models for studying the ecology and evolution of species interactions across environmental gradients. The American Naturalist. 198 (1), 158-176 (2021).
- Pommerrenig, B., et al. Common plantain. A collection of expressed sequence tags from vascular tissue and a simple and efficient transformation method. Plant Physiology. 142 (4), 1427-1441 (2006).
- Bergero, R., Levsen, N., Wolff, K., Charlesworth, D. Arms races with mitochondrial genome soft sweeps in a gynodioecious plant, Plantago lanceolata. Molecular Ecology. 28 (11), 2772-2785 (2019).
- Aalto, E. A., Koelewijn, H. P., Savolainen, O. Cytoplasmic male sterility contributes to hybrid incompatibility between subspecies of Arabidopsis lyrata. G3: Genes, Genomes, Genetics. 3 (10), 1727-1740 (2013).
- Bloch, K. D., Grossmann, B. Digestion of DNA with restriction endonucleases. Current Protocols in Molecular Biology. 3 (1), (1995).
- Du, C., et al. Prokaryotic expression, purification, physicochemical properties and antifungal activity analysis of phloem protein PP2-A1 from cucumber. International Journal of Biological Macromolecules. 194, 395-401 (2022).
- Deshmukh, S. 2. 2., Kulkarni, R., Bose, K. Transformation and protein expression. Textbook on Cloning, Expression and Purification of Recombinant Proteins. , 83-114 (2022).
- Bergkessel, M., Guthrie, C. Colony PCR. Methods in Enzymology. 529, 299-309 (2013).
- Broehan, G., Kroeger, T., Lorenzen, M., Merzendorfer, H. Functional analysis of the ATP-binding cassette (ABC) transporter gene family of Tribolium castaneum. BMC Genomics. 14, 6 (2013).
- Dong, Z., et al. Stable transformation of fluorescent proteins into Nosema bombycis by electroporation. Parasites & Vectors. 15 (1), 141 (2022).
- Li, S., et al. Optimization of Agrobacterium-mediated transformation in soybean. Frontiers in Plant Science. 8, 246 (2017).
- Manimaran, P., et al. Infection of early and young callus tissues of indica rice BPT 5204 enhances regeneration and transformation efficiency. Rice Science. 20 (6), 415-426 (2013).
- Wang, J., Nie, J., Pattanaik, S., Yuan, L. Efficient Agrobacterium-mediated transformation of Artemisia annua L. using young inflorescence. In Vitro Cellular & Developmental Biology-Plant. 52 (2), 204-211 (2016).
- Niazian, M., Belzile, F., Torkamaneh, D. CRISPR/Cas9 in planta hairy root transformation: a powerful platform for functional analysis of root traits in soybean. Plants. 11 (8), 1044 (2022).
- Geng, S., et al. An efficient root transformation system for CRISPR/Cas9-based analyses of shoot-root communication in cucurbit crops. Horticulture Research. 9, (2022).
- Xiao, Y., et al. Efficient Agrobacterium-mediated genetic transformation using cotyledons, hypocotyls and roots of 'Duli'(Pyrus betulifolia Bunge). Scientia Horticulturae. 296, 110906 (2022).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon