Method Article
Agrobacterium tumefaciens-Mediated Genetic Transformation of Narrowleaf Plantain
In This Article
Summary
בגלל היישום הרב-תכליתי שלו כמין מודל בתחומי מחקר שונים, יש צורך בארגז כלים לשינוי גנטי בפלנטיין צר עלים (Plantago lanceolata). כאן, באמצעות טרנספורמציה בתיווך Agrobacterium tumefaciens, מוצג פרוטוקול שמביא לקווים טרנסגניים יציבים עם יעילות טרנספורמציה של 20%.
Abstract
למינים בסוג Plantago מספר תכונות ייחודיות שהובילו להתאמתם כצמחי מודל בתחומי מחקר שונים. עם זאת, היעדר מערכת מניפולציה גנטית מונע חקירה מעמיקה של תפקוד הגנים, ומגביל את הרבגוניות של סוג זה כמודל. כאן, פרוטוקול טרנספורמציה מוצג עבור Plantago lanceolata, המין הנחקר ביותר Plantago. באמצעות טרנספורמציה בתיווך Agrobacterium tumefaciens, שורשים בני 3 שבועות של צמחי P. lanceolata שגדלו באופן אספטי היו נגועים בחיידקים, הודגרו במשך 2-3 ימים, ולאחר מכן הועברו למדיום השראת נבטה עם בחירת אנטיביוטיקה מתאימה. הנבטים יצאו בדרך כלל מהמדיום לאחר חודש, והשורשים התפתחו 1-4 שבועות לאחר העברת הנבטים למדיום השראת השורש. לאחר מכן התאקלמו הצמחים בסביבת קרקע ונבדקו לנוכחות טרנסגן באמצעות בדיקת כתב β-glucuronidase (GUS). יעילות הטרנספורמציה של השיטה הנוכחית היא ~20%, כאשר שני צמחים טרנסגניים מופיעים לכל 10 רקמות שורש שעברו טרנספורמציה. קביעת פרוטוקול טרנספורמציה לצמח צר עלים תקל על אימוץ צמח זה כמין מודל חדש בתחומים שונים.
Introduction
הרעיון של שימוש במיני מודל כדי לחקור היבטים רבים של ביולוגיה של צמחים הופיע עם השימוש הנרחב של Arabidopsis thaliana1. Arabidopsis נבחר בתחילה כי הוא חולק תכונות עם צמחים פורחים רבים אחרים ויש לו תכונות מרובות שהופכות אותו נוח ללמוד בסביבת מעבדה, כגון להיות קטן בעל מחזור דור קצר. הכמות הגדולה של מאמרי מחקר שפורסמו יחד איתו כנושא, יחד עם גודל הגנום הקטן שלו וקלות הטרנספורמציה הגנטית2, מאפשרים לו להתמיד כאורגניזם ניסיוני בשימוש נרחב. עם זאת, Arabidopsis יכול להיות מוגבל כמודל עבור מינים עם מאפיינים שונים או תכונות ייחודיות3. זה הניע את הפיתוח של מערכות מודל חדשות, כגון תירס (Zea mays), צמח חשוב לגנטיקה התפתחותית במונוקוטים4, ועגבנייה (Solanum lycopersicum), שהוא מודל חשוב למחקרים אבולוציוניים, התפתחות פירות, וייצור, והוא ייצוג טוב לגידולי ירקות5. שיטה לטרנספורמציה גנטית היא תנאי מוקדם כדי שמין צמח ישמש כאורגניזם מודל2. טרנספורמציה בתיווך גידולים אגרובקטריום היא כלי אמין בביולוגיה של צמחים; הוא שימש לשינוי כמה מיני מודל וגידולים עיקריים, כולל טבק (Nicotiana tabacum)6, אורז (Oryza sativa)7, כותנה (Gossypium hirsutum)8, סויה (Glycine max)9, תפוח אדמה (Solanum tuberosum)10, וקנולה (Brassica napus)11. מיני צמחים משתנים מאוד במידת ההצלחה שלהם להגיב לזיהום A. tumefaciens, ופרוטוקולי טרנספורמציה לעתים קרובות צריכים להיות מותאמים באופן אינדיבידואלי לכל מין 6,12.
הסוג Plantago כולל בסך הכל 256 מיני צמחים, הנפוצים ברחבי העולם13. למינים בסוג זה יש לעתים קרובות מאפיינים ייחודיים שהופכים אותם לנחשקים כמין מודל לחקר גנטיקה, אקולוגיה, פיזיולוגיה של עקה, מטבוליטים שניוניים, כימיה רפואית, אינטראקציות צמחים-מיקרובים, התפתחות צמחים ואבולוציה. Plantago lanceolata , המכונה גם צמח צר עלים או plantein ribwort, היה צמח פופולרי של עניין מאז המאה ה- 19, כאשר הוא שימש לראשונה כדי לתאר את תופעת העקרות הגברית14. כמו צמחים אחרים מסוגו, הוא שימש במחקרים בתחומי מחקר שונים. לאחרונה, הוא הוצע כמודל לביולוגיה של כלי הדם, שכן רקמת כלי הדם שלה ניתן לאסוף בקלות15. P. lanceolata הוא המין הנחקר ביותר בסוג Plantago; כתבה משנת 2021 דיווחה כי היו >1,400 פרסומים הכוללים או מתייחסים למין זה באותה עת16, ו-102 מאמרים נוספים פורסמו מתחילת 2022, על פי חיפוש PubMed שנערך ב-9בדצמבר 2022. הצמח הבא הנחקר ביותר בסוג, P. major, הוא הנושא של 414 מאמרים בלבד כאשר מחפשים על פי אותם קריטריונים באותו תאריך.
למרות העניין המחקרי ב- P. lanceolata, מחקרים, במיוחד על אפיון תפקוד גנים, מוגבלים לעתים קרובות על ידי היעדר ערכת כלים למניפולציה גנטית עבור המין. Pommerrienig et al. עשו מאמצים לפתח פרוטוקול טרנספורמציה עבור P. major באמצעות טכניקת טבילה פרחונית17. עם זאת, שיטה זו אינה יכולה להיות מיושמת על P. lanceolata בגלל העקרות הגברית האופיינית למין זה18,19. למיטב ידיעתנו, אין פרוטוקול קיים לטרנספורמציה של P. lanceolata.
מחקר זה מציג פרוטוקול פשוט עבור A. tumefaciens-mediated transformation of P. lanceolata. על ידי התמקדות ברקמות השורש, צמחים טרנסגניים שגדלו במלואם יכולים להיווצר תוך 3 חודשים מרגע הטרנספורמציה.
Protocol
הערה: שלבים 1.4-1.8, 2.3-2.5, 3.3-3.6, 4.1-4.6, 5.1-5.7 ו- 6.1-6.3 חייבים להתבצע בתנאים אספטיים, תוך שימוש במכסה מנוע נקי למניעת זיהום.
1. ריבוי חומר צמחי לצורך טרנספורמציה
- הניחו זרעי Plantago lanceolata מסוג בר (WT) הזמינים מסחרית (ראו טבלת חומרים) בצינור צנטריפוגה של 50 מ"ל עד לקו של 5 מ"ל, בהתאם למספר הצמחים הרצוי.
הערה: לחלופין, ניתן להשתמש בצינור מיקרוצנטריפוגה של 2 מ"ל כאשר יש צורך במספר קטן של זרעים, אך יש למלא אותו לנפח שאינו עולה על 0.1 מ"ל, מכיוון שזרעים רבים מדי יכולים להפחית את יעילות העיקור. - לטבול את הזרעים 75% אתנול במשך 60 שניות.
- השליכו את האתנול, ואז טבלו את הזרעים ב-20% נתרן היפוכלוריט (20% NaClO, 80% מים סטריליים) למשך 40 דקות, תוך היפוך עדין של הצינור כך שכל הזרעים יבואו במגע עם התמיסה.
הערה: תמיסת הנתרן היפוכלוריט חייבת להיות מיוצרת באופן טרי לקבלת תוצאות מיטביות. - תחת מכסה מנוע זרימה למינרית, להשליך את תמיסת hypochlorite נתרן, ולאחר מכן לשטוף את הזרעים עם מים מזוקקים (חמש פעמים). הוסיפו כמות קטנה של מים לזרעים לאחר השטיפה הסופית, מכיוון שזה יכול לעזור לתנועה של הצמחים על הצלחות.
- בעזרת מלקחיים מעוקרים, מעבירים את הזרעים לצלחות פטרי מוכנות מראש בגודל 95 מ"מ x 100 מ"מ עם מדיום MS מוצק (טבלה 1). פזרו את הזרעים באופן שווה על פני הצלחת, עם כ-1 ס"מ בין כל זרע כדי למנוע צפיפות יתר של השתילים המובטים (איור 1A).
- אטמו את הצלחות בשתי שכבות של סרט פרפין כדי למנוע זיהום, ולאחר מכן דגרו תחת אור גידול לבן קריר (ראו טבלת חומרים) בטמפרטורת החדר (22°C עם 50 μmol m-2 s-1, 12 שעות ימים). הזרעים נובטים בדרך כלל תוך 5-6 ימים.
- כאשר השתילים נובטים והם גדולים מספיק כדי להעביר אותם (איור 1B), בדרך כלל יומיים או שלושה לאחר הנביטה, השתמשו במלקחיים מעוקרים כדי להעביר את השתילים לקופסאות סטריליות עם מדיום טרשת נפוצה בנפח 50-100 מ"ל (טבלה 1). באופן אידיאלי, לשתול רק חמישה שתילים בכל ארגז כדי להשיג את השורשים באיכות הטובה ביותר.
- אטמו את הקופסאות בסרט כירורגי, ולאחר מכן אפשרו לצמחים לגדול תחת אור גידול לבן וקריר (ראו טבלת חומרים), באותם תנאים שהוזכרו בשלב 1.6. הצמחים צריכים להיות מוכנים לשינוי בעוד כ 3-4 שבועות, או כאשר השורשים העיקריים גדלו על 2 ס"מ אורך השורשים הרוחביים נראים לבנים.
הערה: מתכונים להכנה בינונית ומלאי ויטמינים כלולים בטבלה 1 ובטבלה 2.
2. בניית פלסמיד וטרנספורמציית E. Coli
הערה: הליך בניית הפלסמיד המדויק משתנה בהתאם לגן המעניין. בהליך זה, אנזימי ההגבלה HindIII ו-Sal II שימשו להחדרת מקדם AtPP2 בנפח 1.5 קילו-בתיםלתוך הפלסמיד הבינארי pBI101 (ראה טבלת חומרים) עם GUS, תוך שימוש בהליך השיבוט הסטנדרטי20. AtPP2 (חלבון פלואם 2) הוא גן המתבטא באופן ספציפי בפלואם21.
- שכפל את המקדם באמצעות זוגות פריימר 5'-AGTCAAGCTTCAAGTCCCTGTGGCTACTGAAC-3' (קדימה) ו- 5'-AGTCGTCGACAAACCAGTATGATGATTTTTTTTTG-3' (הפוך) מ - Arabidopsis. איור 2 מציג דיאגרמה של וקטור הפלסמיד הבינארי עם התוספת AtPP2:GUS .
- לאחר בניית פלסמיד, הפוך את הפלסמידים לתאים מוכשרים מסוג DH5a E. coli (ראה טבלת חומרים) בשיטת הלם חום22, ולאחר מכן דגר במשך שעה וחצי בטמפרטורה של 37°C עם טלטול (150 סל"ד).
- קח 150 μL מכל תרבית טרנספורמציה, צלחת על לוחות מדיה אגר LB (טבלה 1) עם הבחירה המתאימה (50 מ"ג / ליטר קנמיצין עבור הזן המשמש בפרוטוקול זה; ראה טבלת חומרים), ולאחר מכן לדגור על הצלחות במשך 16-24 שעות ב 37 ° C.
הערה: זן החיידקים המשמש במחקר זה הוא A. tumefaciens GV3101. - לאחר מכן, השתמש PCR מושבה כדי לסנן את המושבות עבור רקומביננטים חיוביים23.
הערה: בפרוטוקול זה, הפריימרים הבאים שימשו להגברת גן המטרה; 5'-ATGTTACGTCCTGTAGAAACCCCAA-3'(קדימה) ו- 5'-TCATTGTTTGCCTCCCTGCTGC-3' (הפוך).- הפעל את התגובה ב- thermocycler (ראה טבלת חומרים) עם תנאי מחזור של 3 דקות ב- 95 ° C, ואחריו 35 מחזורים של: 30 שניות ב- 95 ° C, 30 שניות ב- 55 ° C, 2 דקות ב- 72 ° C ושלב התארכות אחרון של 10 דקות ב- 72 ° C.
- חסן את המושבות החיוביות ב 6 מ"ל של מרק LB (טבלה 1) עם אנטיביוטיקה מתאימה (50 מ"ג / ליטר kanamycin) ולגדול ב 37 ° C לילה, ב 200-250 סל"ד.
- לאחר גידול לילה, לחלץ את פלסמידים מן החיידקים באמצעות הליכים סטנדרטיים24.
3. A. tumefaciens טרנספורמציה עם פלסמיד
- לאחר מיצוי פלסמיד, השתמש באלקטרופורציה כדי להפוך את הפלסמיד שונה לזן הרצוי של תאים מוכשרים. בהליך זה, A. tumefaciens זן GV3101 שימש. בצע שיטות סטנדרטיות עבור טכניקות electroporation25.
- לאחר electroporation, להשעות מחדש את התאים המוסמכים ב 1 מ"ל של מרק LB ולאחר מכן לדגור במשך 2-4 שעות ב 28 ° C ב 100 סל"ד.
- יש לאסוף את התאים באמצעות צנטריפוגה במהירות של 6,800 x גרם למשך 3 דקות במיקרו-צנטריפוגה שולחנית (ראו טבלת חומרים) בטמפרטורת החדר (22°C), ולאחר מכן לפזר 50-100 μL על צלחת אגר LB עם חומר בחירה מתאים (50 מ"ג/ליטר קנמיצין עבור הפלסמיד המשמש בפרוטוקול זה).
- לאחר שהתאים דגרו במשך יומיים ב 28 מעלות צלזיוס, לזהות מושבות חיוביות המכילות את הגן של עניין באמצעות PCR מושבה. בפרוטוקול זה, השתמש בפריימרים ובתנאים המוזכרים בשלב 2.4.
- לאחר מכן, השתמש במושבות החיוביות כדי לפזר צלחת מלאי עם מדיה אגר LB + בחירה. הצלחת ניתן לאחסן ב 4 ° C עד 1 חודש.
- לחלופין, לאחסון לטווח ארוך, לחסן מושבה חיובית עם נפח קטן של LB עם בחירה מתאימה. נערו את התרבית המחוסנת למשך הלילה ב-28°C ב-200 סל"ד, ולאחר מכן הכינו מלאי גליצרול (50% w/v גליצרול בתערובת של 50:50 חיידקים וגליצרול), שניתן לאחסן בטמפרטורה של -80°C למשך עד 10 שנים.
4. א. הכנת גידולים
- פסים A. tumefaciens המכילים את הפלסמיד הרצוי על לוחות LB מוצקים מוכנים 95 מ"מ x 100 מ"מ עם סוכן הבחירה המתאים. בפרוטוקול זה נעשה שימוש בזן החיידקי GV3101 עם תוספת הפלסמיד AtPP2:GUS , עם 50 מ"ג/ליטר קנמיצין שנוסף לבחירה.
- אטמו את הצלחות עם סרט פרפין, ואז דגרו בטמפרטורה של 28°C למשך עד 48 שעות, או עד שהחיידקים גדלים מספיק כדי לקטוף.
- השתמש בקצה פיפטה כדי לבחור מושבת חיידקים יומיים לפני הטרנספורמציה, וחסן אותה בצינור תחתון עגול 15 מ"ל המכיל 6 מ"ל של LB נוזלי עם בחירה מתאימה. נערו ב-200 סל"ד בשייקר שולחני של 28°C למשך הלילה, עד ש-OD600 יגיע ל-0.6-0.7.
הערה: ניתן לאחסן צלחות ואת החיסון החיידקי 6 מ"ל ב 4 ° C עד חודש אחד. - כאשר החיידקים מגיעים ל-OD 600 הנכון, השתמשו בפיפטה כדי להעביר את A. tumefaciens לבקבוק סטרילי המכיל100 מ"ל של LB נוזלי עם חומר בחירה. בדרך כלל, 200 μL של חיידקים לכל 100 מ"ל LB מתאים להתפשטות. יש לנער ב-200 סל"ד ב-28°C למשך הלילה, עד ש-OD600 מגיע ל-0.6-0.7.
- העבירו את החיידקים לצינורות צנטריפוגות סטריליות בנפח 50 מ"ל, ולצנטריפוגה בטמפרטורה של 2,200 xg למשך 10 דקות בטמפרטורת החדר (22°C) בצנטריפוגה שולחנית כדי לאסוף את החיידקים.
- השליכו את הסופרנאטנט בעזרת פיפטה. יש להשהות מחדש את כדורית החיידקים בתמיסת תרחיף נוזלי (SS) בטמפרטורת החדר (22°C) (טבלה 1) על-ידי פיפטינג, ולאחר מכן להוסיף עד 50 מ"ל SS ולהפוך מספר פעמים כדי לערבב. החיידק מוכן כעת לטרנספורמציה.
הערה: יש להכין את ה-SS הנוזלי באופן טרי, תוך שבוע מרגע הטרנספורמציה.
אזהרה: יש להשליך את כל החומר שבא במגע עם A. tumefaciens לפח פסולת מסוכן ביולוגית. שאריות נוזלים מתרביות חיידקים ניתן לעקר עם היפוכלוריט נתרן (אקונומיקה) בריכוז של 20% ומעלה.
5. טרנספורמציה של שורשי Plantago
- כאשר הצמחים מגיעים לשלב האידיאלי לשינוי צורה (שתילים בני 3 שבועות) (איור 1C), השתמשו במלקחיים סטריליים ובמספריים כדי להפריד את השורשים משאר הצמח (איור 3A). יש להשליך את חומר העלה והגבעול.
- מיד לאחר החיתוך, מעבירים את חתיכות השורש לקופסאות סטריליות המכילות מים סטריליים באמצעות מלקחיים סטריליים. שלב זה מאפשר לשורשים להישאר רוויים בזמן שכל הרקמה נאספת.
- כאשר כל השורשים נחתכים, יוצקים את מתלה A. tumefaciens/SS לתוך כלי פטרי חד פעמיים סטריליים בגודל 150 מ"מ x 15 מ"מ. העבירו את השורשים לתרבית A. tumefaciens וחסנו במשך 20 דקות לפחות (איור 3B).
- במהלך הדגירה, השתמש באזמל סטרילי עם להב חד כדי לחתוך את השורשים לשברים של 1 ס"מ, המפרידים את השורשים הראשוניים מהשורשים הרוחביים. בצעו חתכים דקים ורדודים על פני השטח של השורשים כדי לאפשר לחיידקים להדביק את הצמח.
הערה: אם מדובר במספר רב של צמחים, העבירו את חתיכות השורשים לתרבית החיידקים בקבוצות, כדי לוודא שכל השורשים שקועים במהלך החיסון. - לאחר הדגירה, השתמשו במלקחיים הסטריליים כדי להעביר את חתיכות השורש למגבות נייר סטריליות כדי להסיר עודפי חיידקים. הימנעו מייבוש השורשים במשך יותר מ-60 שניות, שכן הדבר עלול לגרום להתייבשות ולפגוע ברקמת השורש. באופן אידיאלי, ניתן לייבש 10-15 שורשים בו זמנית (איור 3C).
- העבירו את השורשים המיובשים לצלחות פטרי מוכנות בגודל 95 מ"מ על 15 מ"מ עם מצע מוצק של תרבית משותפת (טבלה 1), בסביבות 10-20 שורשים בכל צלחת, בהתאם לגודל השורשים (איור 3D).
- אטמו את הצלחות בשתי שכבות של סרט פלסטיק שקוף, ולאחר מכן כסו ברדיד אלומיניום. יש לדגור בטמפרטורת החדר (22°C) למשך 3 ימים. השלב הזה מספק זמן לחיידקים להדביק את השורשים ללא נוכחות של ברירה אנטיביוטית (איור 3E).
6. בחירה והתחדשות הצמח כולו
- לאחר הדגירה במדיה של תרבית משותפת, העבירו את חתיכות השורש לצלחות פטרי מוכנות בגודל 95 מ"מ x 15 מ"מ עם מדיה אינדוקציה של נבטה מוצקה (SIM) (טבלה 1) עם טימנטין (500 מ"ג/ליטר; ראו טבלת חומרים) ובחירת אנטיביוטיקה מתאימה. בפרוטוקול זה השתמשנו בקנמיצין (100 מ"ג/ליטר).
הערה: תחתית השורשים חייבת לבוא במגע מלא עם המדיום. שורשים שאינם נוגעים בפני השטח של התווך ארוכים מדי ויש לחתוך אותם כדי למנוע מהרקמה לברוח מהבחירה. - אטמו את הצלחות בשתי שכבות של סרט פלסטיק שקוף, ולאחר מכן גדלו תחת אור גידול למשך חודש אחד (ראו שלב 1.6 לתנאים מתאימים), או עד שהנבטים מתחילים לצאת.
הערה: בדרך כלל, ניתן לראות ראשי תיבות של יורים לאחר שבועיים של צמיחה, והנבטים נראים בדרך כלל לאחר חודש אחד. - כאשר אורכם של העציצים הוא 1.5-2.0 ס"מ (איור 1D), העבירו אותם לקופסאות סטריליות מוכנות עם מצע השראת שורשים מוצק (טבלה 1).
- לגדל את הצמחים תחת אור גידול (ראה שלב 1.6 לתנאים) במשך מספר שבועות, עד להיווצרות שורשים. שורשים בדרך כלל ניתן לראות לראשונה לאחר שבוע אחד.
הערה: מומלץ לאפשר לשורשים לצמוח במשך מספר שבועות לפני המעבר לקרקע, שכן צמחים עם מערכת שורשים גדולה יותר נוטים להיות בעלי שיעור הישרדות גבוה יותר בקרקע.
7. העברת קרקע
- כאשר מערכות השורשים נעשו גדולות מספיק כדי לעבור (איור 1E), בדרך כלל לאחר חודש אחד של צמיחה, העבירו את הצמחים ל-3.5 בעציצים מרובעים המכילים אדמה רב-תכליתית רטובה מראש (BM7). בפרוטוקול זה נעשה שימוש בתערובת קליפות BM7 (ראה טבלת חומרים).
- הסירו כל מדיום שנדבק לשורשים על ידי שטיפתם בעדינות במים.
הערה: ניתן לגדל את הצמחים לבגרות בחממה ב 800 עד 1400 פוטונים μmol m-2 s-2 באמצעות אורות לחץ נתרן גבוה של 600 W (ראה טבלת חומרים), או בתא גידול בטמפרטורת החדר (22 ° C) עם אורות לבנים קרים ב 50 μmol m-2 s-1, 12 שעות ימים.
- הסירו כל מדיום שנדבק לשורשים על ידי שטיפתם בעדינות במים.
- כסו את הצמחים בכיסוי פלסטיק לשתילה, ואז כסו אותם בשקית ניילון שקופה. שלב זה מאפשר לצמחים להישאר בסביבה לחה בזמן שהם מסתגלים לקרקע.
- לאחר כ-3-5 ימים, הסירו את שקית הניילון ולאחר מכן הסירו באיטיות את המכסה כדי לאפשר התאקלמות לסביבה החיצונית.
הערה: בהתאם לתקופה בשנה ולסביבה שאליה מועברים הצמחים, הזמן שהצמחים צריכים להסתגל יכול להשתנות. מומלץ לבדוק את הצמחים מדי יום ולהוסיף מים לעציצים לפי הצורך. - השקו את הצמחים באופן קבוע והוסיפו דשן לפי הצורך. צמחים יכולים גם להיות מועברים לעציצים גדולים יותר לצמיחה נוספת (איור 1F).
8. צביעה היסטוכימית β-glucuronidase (GUS)
- הכינו תמיסת צביעה β-glucuronidase (GUS), על פי פרוטוקוליםשפורסמו 15.
- כאשר ראשי התיבות של הנבטה הם באורך של כ-0.5-1 ס"מ, יש להסיר קצה קטן של עלה צעיר ומורחב במלואו (אורך של <5 מ"מ בדרך כלל מספיק) ולהעביר מיד ל-0.5-1 מ"ל של תמיסת צביעת GUS בצינור מיקרוצנטריפוגה של 1.5 או 2 מ"ל. הפתרון צריך לכסות באופן מלא את רקמת הצמח.
- מניחים את הצינורות הפתוחים במייבש ואקום ושואבים בטמפרטורה של 20-25 kPa למשך 5-10 דקות. בועות קטנות צריכות להיות גלויות בתמיסה במהלך הליך ואקום. זה מאפשר לפתרון להיכנס לתאי הצמח.
- אפשרו לאוויר להסתנן בחזרה למייבש הוואקום. סגרו את הצינורות ודגרו בטמפרטורה של 37°C למשך הלילה (12 שעות), או עד שהצבע הכחול נראה.
הערה: במחקר זה, פעילות GUS הייתה מקומית לפלואם, כלומר בצמחים שעברו טרנספורמציה חיובית, כתמים כחולים צריכים להיראות רק ברקמת הפלואם. צמחים ללא הטרנסגן אינם חווים כתמים (איור 4). - כדי לדמיין טוב יותר את הכתם, להעביר את הצמחים 100% אתנול כדי להסיר כלורופיל. כדי להגביר את יעילות תהליך הסרת הכלורופיל, יש לדגור על הצינורות בטמפרטורה של 60°C למשך 10 דקות.
הערה: ייתכן שיהיה צורך להחליף את האתנול מספר פעמים לפני הסרת כל הכלורופיל, בהתאם לגודל העלה המוכתם.
תוצאות
פרוטוקול פשוט מדווח כאן להשגת צמחי P. lanceolata טרנסגניים באמצעות טרנספורמציה בתיווך A. tumefaciens. הגן המדווח GUS (המקודד β-glucuronidase) הופך למונע על-ידי מקדם הביטוי של AtPP2, לשורשי P. lanceolata בני 3 שבועות באמצעות זן A. tumefaciens GV3101 (איור 2). מקדם ספציפי לפלואם נבחר מכיוון שהעניין העיקרי שלנו היה להקים מערכת לגנומיקה פונקציונלית של רקמות כלי הדם של צמחים, במיוחד פלואם. השיטה נבדקה על השורש, העלה ורקמת הפטוטרת בניסוי הראשוני. אף על פי שניתן היה לגרום ליבלות בכל סוגי הרקמות, רק רקמת השורש הפיקה ראשי תיבות של יורים (איור 5A) לאחר חודש אחד ב-SIM; העלה והפטוטרת הפכו חומים ומתו (איור 5B). זה הוביל למסקנה שרקמת השורש היא סוג הרקמה האופטימלי לשימוש בשיטת הטרנספורמציה. השורשים הודגרו בחיידקים מוכנים שהורחפו בתמיסת תרחיף (SS) (טבלה 1) למשך 20 דקות לפחות, ואז הודגרו בטמפרטורת החדר על לוחות SS מוצקים למשך עד 3 ימים בחושך (איור 3E). לאחר מכן הועברו השורשים למדיום האינדוקציה של הנבטה (SIM) ונשמרו תחת אור גידול, בתנאים המצוינים בפרוטוקול (שלב 1.6). איור 1 ואיור 3 מציגים תמונות מייצגות של כל שלב בפרוטוקול לצורך התייחסות.
איור 6 מראה את ההתקדמות של ראשי התיבות של הנבטים שיצאו מרקמה שעברה טרנספורמציה, מהיום הראשון שבו השורשים הונחו על ה-SIM (איור 6A) ועד שהנבטים היו מוכנים להשתרש (איור 6D). לאחר שבוע אחד, רקמת השורש יצרה יבלות (איור 6B), וניתן היה לראות את ההתחלה של ראשי התיבות של הירי (איור 6B1). הנבטים המשיכו להופיע במהלך שבועות 2 ו-3 (איור 6C), ולאחר 4 שבועות, הנבטים היו מוכנים להעברה למדיום השראת השורש (איור 6D).
זיהוי הצמחים הטרנסגניים המשוערים נעשה באמצעות הבדיקה ההיסטוכימית β-glucuronidase (GUS), באמצעות מקטעי עלים שנלקחו לאחר שהנבטים היו באורך של כ-0.5 ס"מ. צמחים טרנסגניים חיוביים הראו את דפוס הצביעה הצפוי ברקמה המקומית של פלואם, כפי שהודגם באיור 4. נבטים חיוביים המוכתמים ב-GUS הועברו למדיום השראת השורש, שבו הם פיתחו מערכות השתרשות חזקות לאחר 4 שבועות (איור 1E). צמחים מושרשים הועברו אז לאדמה. איור 4 מראה את התוצאה של צביעה בצמח צר עלים שעבר טרנספורמציה עם מקדם AtPP2 והגן β-glucuronidase (GUS), יחד עם סוג בר וצמח צר עלים שעברו טרנספורמציה עם מקדם AtPP2 , לשם השוואה. כל הצילומים שיצאו אושרו כטרנסגניים. יעילות הטרנספורמציה נקבעה בממוצע של 20%, עם כשני נבטים שהופיעו על כל 10 שורשים שעברו טרנספורמציה. צמחים טרנסגניים מאושרים הועברו לעציצים גדולים יותר וגודלו במשך 4-8 שבועות עד שהגיעו לשלב הבוגר (איור 1F).
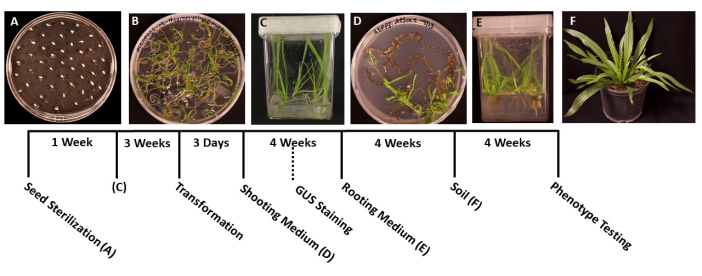
איור 1: ציר הזמן של טרנספורמציית Plantago lanceolata . תמונות מייצגות של כל שלב בפרוטוקול. (A) זרעים לא מונבטים מצופים על צלחת MS. (B) זרעים שנבטו לאחר שבוע, מוכנים להעברה לקופסאות מגנטה. (C) צמחים בקופסאות טרשת נפוצה לאחר 3 שבועות של צמיחה. השורשים ירוקים ובריאים, בשלב האידיאלי לטרנספורמציה. (D) צילומים במדיית אינדוקציה לצילום לאחר 4 שבועות מוכנים להעברה למדיום ההשתרשות. בשלב זה ניתן לבצע צביעה היסטוכימית β-glucuronidase (GUS), אם רלוונטי. (E) צמחים בקופסאות עם אמצעי השראת שורשים, שם נוצרו שורשים לאחר 4 שבועות של צמיחה. (F) צמחים טרנסגניים גדלים באורך מלא לאחר 4 שבועות של צמיחה באדמה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
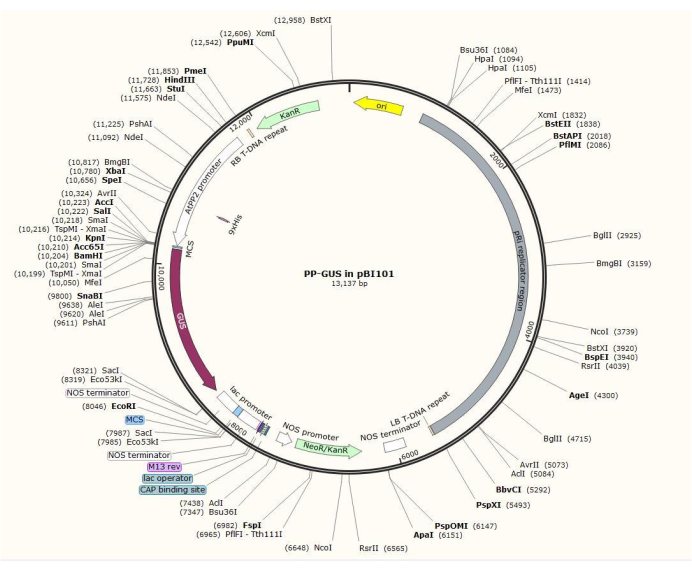
איור 2: דיאגרמה של פלסמיד וקטורי בינארי pBI101 + β-glucuronidase (GUS) עם המקדם הספציפי לפלואם שהוכנס AtPP2. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
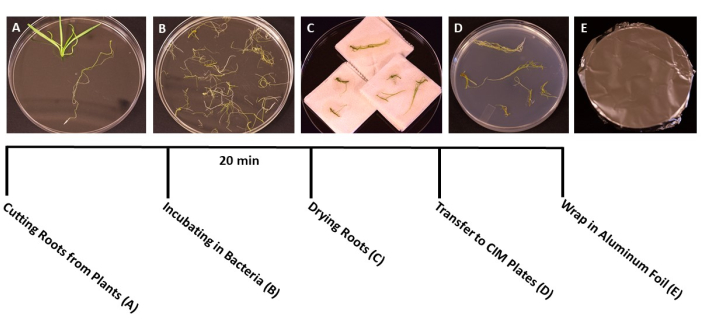
איור 3: שלבי טרנספורמציה. תמונות מייצגות של כל שלב בטרנספורמציה. (A) הפרדת שורשים מנבטים במהלך הטרנספורמציה. (B) השריית שורשים בתרחיף חיידקים/SS. (C) ייבוש שורשים על מגבות נייר לסילוק עודפי חיידקים. (D) שורשים מצופים במדיום של תרבות משותפת. (E) לוחות SS עטופים ברדיד אלומיניום. הצמחים הודגרו במשך 2-3 ימים לפני שהועברו למדיום הירי. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
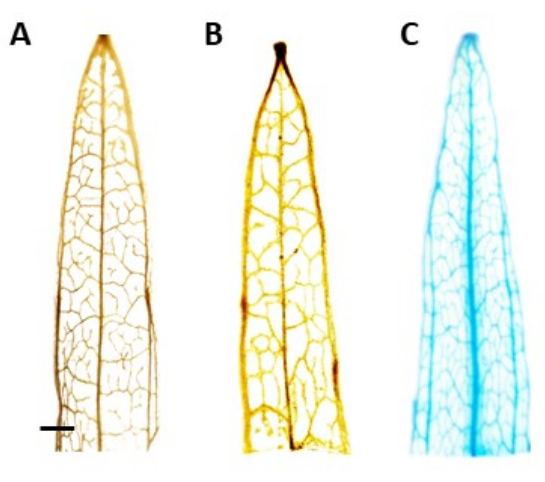
איור 4: צביעת GUS. תוצאות צביעה של β-glucuronidase (GUS) של מקטעי עלים צרים. (A) סוג פראי. (B) פלנטיין צר עלים שעבר טרנספורמציה עם הפלסמיד שמכיל את מקדם AtPP2 (וקטור ריק). (C) צמח צר עלים שעבר טרנספורמציה עם הפלסמיד שמכיל את מקדם AtPP2 ואת הגן β-glucuronidase (GUS). כל עלה הוכתם באמצעות פרוטוקול הצביעה ההיסטוכימי GUS, ולאחר מכן צולם במצלמה מיקרוסקופית. בתמונות (B) ו-(C) אין דפוס צביעה עקב היעדר הגן GUS. התמונה הימנית מראה דפוס כתמים כחול ברור בוורידים, המאשר כי הצמחים הם טרנסגניים. אורכו של המוט 1 מ"מ, כאשר אורכו של כל קטע עלה הוא כ-1 ס"מ. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
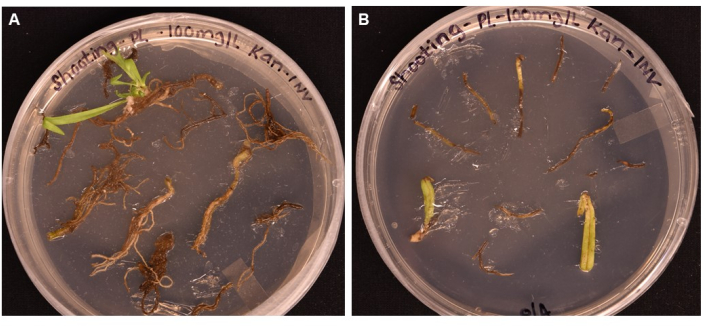
איור 5: השוואת יעילות הטרנספורמציה של סוגי רקמות שונים לאחר דגירה של > חודש על מדיית צילום . (A) רקמות שורש לאחר יותר מחודש אחד של גדילה. שורשים חוו יבלות מורחבות, וראשי תיבות של יורים צצו. יבלות שלא עברו טרנספורמציה החלו למות בתגובה לברירה אנטיביוטית. (B) רקמות עלים ופטוטרות לאחר יותר מחודש אחד של צמיחה. רקמות חוו התרחבות מסוימת של יבלות אך מתו במהרה בתגובה לאנטיביוטיקה. מאף אחת מהרקמות, לא יצאו נבטים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
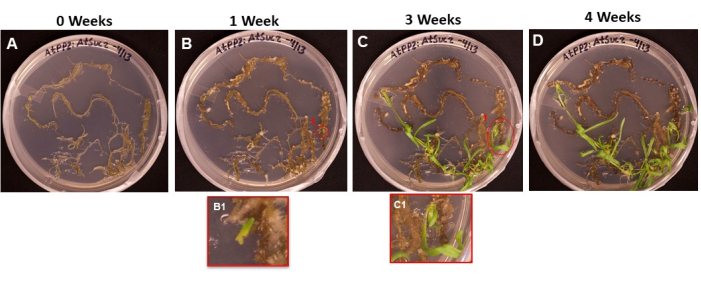
איור 6: הופעה של יבלות ויורה על רקמה שעברה טרנספורמציה. תמונות מייצגות של רקמות שהונחו על מדיום הירי לאחר אורכים שונים של דגירה. (A) רקמות שורש מיד לאחר הציפוי על מדיום הצילום. (B) רקמות שורש לאחר שבוע על מדיום צילום. ניתן להבחין בהתפשטות יבלות, ו-(B1) ראשי התיבות הראשונים של הירי החלו להופיע. (C) רקמות שורש לאחר 3 שבועות על מדיום צילום. ראשי תיבות נוספים של צילומים צצו. (ג1) הצילומים שיצאו מראשוני הירי B1. (D) רקמות שורש לאחר 4 שבועות של דגירה. רקמה שלא עברה טרנספורמציה החלה להפוך לשחורה/חומה ולמות, ונבטים מתפתחים ממשיכים לגדול. בשלב זה, יורה מוכנים לעבור למדיום ההשתרשות. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
טבלה 1: מתכונים להכנת מדיה. תיאור כיצד להכין מדיומים לטרנספורמציה. כמות הויטמינים שנוספו מחושבת על בסיס ריכוז תמיסת המלאי שצוין. ראו טבלה 2 להכנת תמיסת מלאי ויטמינים. עבור כל המדיומים, הוסף ריאגנטים ל- 900 מ"ל של H2O מזוקק כפול, pH לרמה שצוינה, ולאחר מכן הוסף מים לנפח סופי של 1,000 מ"ל. * = להוסיף לאחר עיקור. ** = pH עם 1 M KOH. = pH עם 1 M NaOH. אנא לחץ כאן כדי להוריד טבלה זו.
טבלה 2: מלאי ויטמינים למדיומים של Plantago . כל הוויטמינים חייבים להיות מסוננים, מעוקרים ומסומנים במדויק לפני האחסון. היכן שצוין, יש להמיס את האבקות תחילה ב-1 N NaOH, ולאחר מכן להשלים את הנפח הרצוי עם H2O מזוקק כפול. אנא לחץ כאן כדי להוריד טבלה זו.
Discussion
היעדר פרוטוקול טרנספורמציה לצמחים בסוג Plantago מגביל את השימוש בצמחים אלה כמודל, במיוחד כאשר חוקרים מעוניינים לחקור תפקודי גנים. P. lanceolata נבחר לפתח פרוטוקול טרנספורמציה גנטית מכיוון שהוא הצמח הנחקר ביותר בסוג16. הפרוטוקול שפותח ישמש ככל הנראה ככלי לקידום מחקרים נוספים הקשורים לביולוגיה של כלי הדם, אקולוגיה, אינטראקציות צמחים-חרקים ופיזיולוגיה של עקה אביוטית.
הפרוטוקול שהוצג מתאר בבירור צעדים המאפשרים למשתמש להשיג צמחים טרנסגניים. מלבד היכולת של P. lanceolata לשגשג בסביבת תרבית רקמות, גורמים רבים תרמו להצלחת שיטת הטרנספורמציה שלנו. ראשית, נצפתה החשיבות של שימוש ברקמת שורש צמח איכותית וסטרילית לצורך טרנספורמציה. לשורשים היו שיעורי השינוי הגבוהים ביותר כאשר הם נלקחו מצמחים בני 3-4 שבועות, ונראו ירוקים או לבנים בהירים. שורשים שנלקחו מקופסאות עם כל כמות של זיהום חיידקי או פטרייתי גרמו לעתים קרובות לתרביות ירי מזוהמות, ושורשים ישנים יותר שנראו חומים לא הביאו לשינוי מוצלח. רקמת שורש הייתה סוג הרקמה היעיל ביותר לטרנספורמציה בשיטה הנוכחית, שכן רקמת העלה ורקמת הפטוטרת לא הצליחו לפתח נבטים.
תצפית חשובה נוספת הייתה שהשיטה האופטימלית לאיסוף רקמת שורש לצורך טרנספורמציה היא הנחת חומר שורשים שזה עתה נחתך במים סטריליים. שלב זה איפשר למעשה לחומר השורש להישאר רווי לחות בזמן ששאר הרקמה נאספת, מכיוון שהשורשים נוטים להתייבש במהירות כאשר הם מוסרים ממיכלי הצמיחה שלהם. צעד זה גם סייע להגדיל את שיעור ההצלחה של הטרנספורמציה, מכיוון שהוא איפשר ליותר שורשים להיות מודגרים בחיידקים בו זמנית.
פרוטוקול זה יכול להשתנות על ידי הפחתת הזמן שבו רקמת השורש דוגרת במדיה co-culture ל 2 ימים. נצפה כי תקופת דגירה של 2 או 3 ימים מספיקה כדי לאפשר זיהום שתוצאתו ראשי תיבות יורה. עם זאת, זמני דגירה ארוכים יותר אינם מומלצים, שכן נצפתה כי היעדר מעכב אנטיביוטיקה בתקשורת גורם לעתים קרובות לצמיחת יתר של A. tumefaciens , אשר יכול להרוג את הרקמה המתעוררת.
מגבלה של מחקר זה היא היעדר נתונים זמינים על הביצועים של שיטות או מינים אחרים של A. tumefaciens בטרנספורמציה P. lanceolata להשוואה. למיטב ידיעתנו, פרוטוקול זה הוא חדשני. במהלך הניסויים הראשוניים נצפתה יעילות טרנספורמציה גבוהה עם A. tumefaciens GV3101, והתמקדנו בשכלול הטכניקה באמצעות זן זה במקום להתנסות בזנים אחרים. יעילות הטרנספורמציה שלנו של 20% היא גבוהה יחסית לטרנספורמציה של צמחים - שיטות קונבנציונליות רבות רואות כל דבר >1% כמוצלח26,27,28. עם זאת, שימוש בזן אחר של A. tumefaciens, כגון A. rhizogenes, הידוע בשימושו בשינוי שורשים במינים מרובים29,30,31, עשוי לגרום לשיעור הצלחה גבוה עוד יותר. יהיה צורך בניסויים נוספים כדי להעריך את ההשפעה של שימוש בזנים אחרים כדי לקדם יעילות טרנספורמציה מוגברת ב- P. lanceolata.
הטרנספורמציה המוצלחת של P. lanceolata תועיל ככל הנראה לתחומי לימוד רבים. יעילות הטרנספורמציה הגבוהה, והצמיחה המהירה של הצמח באמצעי תרביות רקמה, הופכים את P. lanceolata למועמד אפשרי למחקרי תפקודי גנים15.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
עבודה זו נתמכה על ידי הקרן הלאומית למדע (EDGE IOS-1923557 ל- C.Z. ו- Y.Z).
Materials
| Name | Company | Catalog Number | Comments |
| 14 mL Round Bottom TubeA4A2:A34 | ThermoFisher Scientific | 150268 | |
| 1-Naphthylacetic acid | Gold Biotechnology | N-780 | |
| 3M Micropore Surgical Paper Tape | ThermoFisher Scientific | 19-027761 | |
| 50 mL Centrifuge Tubes | Research Products International Corp. | 163227LC | |
| 600 Watt High Pressure Sodium Lights | Plantmax | PX-LU600 | |
| 6-Benzylaminopurine (6-BAP) | Gold Biotechnology | B-110 | |
| Aluminum Foil | ThermoFisher Scientific | 01-213-100 | |
| Bacto Agar | Thermofisher Scientific | 214010 | |
| Binary Plasmid pBI101 | Clontech, USA | 632522 | |
| Cool White Grow Light Sylvania LLC | Home Depot | 315952205 | |
| D-biotin | ThermoFisher Scientific | BP232-1 | |
| ddH2O | |||
| DH5a E. coli | Invitrogen, USA | 18258012 | |
| Disposable Petri Dishes, Sterile 150 x 16 mm | ThermoFisher Scientific | FB0875712 | |
| Disposable Petri Dishes, Sterile 95 x 15 mm | ThermoFisher Scientific | FB0875714G | |
| Dissecting Scissors | Leica Biosystems | 38DI12044 | |
| Ethanol 200 Proof | Decon Labs | 2705 | |
| Folic Acid | Fisher Scientific | BP2519-5 | |
| Forceps | Leica Biosystems | 38DI18031 | |
| Gelrite | Research Products International Corp. | G35020-1000 | |
| Glycerol | ThermoFisher Scientific | 17904 | |
| Glycine | Sigma | 241261 | |
| Incubated Tabletop Orbital Shaker | ThermoFisher Scientific | SHKE420HP | |
| Indole-3-Acetic Acid (IAA) | Gold Biotechnology | I-110 | |
| Indole-3-Butyric Acid (IBA) | Gold Biotechnology | I-180 | |
| Kanamycin Monosulfate | Gold Biotechnology | K-120 | |
| Macrocentrifuge | ThermoFisher Scientific | 75007210 | |
| Magenta Boxes | ThermoFisher Scientific | 50255176 | |
| Micro Pipet Tips 1000 µL | Corning | 4140 | |
| Micro Pipet Tips 200 µL | Corning | 4138 | |
| Micro Pipette Tips 10 µL | Corning | 4135 | |
| Microcentrifuge | ThermoFisher Scientific | 75002410 | |
| Micropipettor 0.5-10 µL | Corning | 4071 | |
| Micropipettor 100-1000 µL | Corning | 4075 | |
| Micropipettor 20-200 µL | Corning | 4074 | |
| Micropipettor 2-20 µL | Corning | 4072 | |
| Murashige & Skooge Basal Medium with Vitamins | PhytoTech | M519 | |
| Murashige & Skooge Basal Salt Mixture | PhytoTech | M524 | |
| myo-Inositol | Gold Biotechnology | I-25 | |
| Nicotinic acid | Sigma | N0761-100g | |
| Parafilm (paraffin film) | ThermoFisher Scientific | S37440 | |
| Potassium Hydroxide (KOH) | Research Products International Corp. | P44000 | |
| Pyridoxine HCl | Sigma | P6280-10g | |
| Scalpel Blade Handle | Leica Biosystems | 38DI36419 | |
| Scalpel Blades | Leica Biosystems | 3802181 | |
| Sodium Chloride, Crystal (NaCl) | Mallinckrodt Chemicals | 7581-06 | |
| Sodium Hydroxide (NaOH) | Research Products International Corp. | S24000 | |
| Sodium Hypochlorite | Walmart | 23263068401 | |
| Soil- Bark Mix | Berger, USA | BM7 | |
| Square Pots (3.5 inches squared) | Greenhouse Megastore | CN-TRK-1835 | |
| Sucrose | Research Products International Corp. | S24060 | |
| Thermocycler | ThermoFisher Scientific | A24811 | |
| Thiamine HCl | Sigma | T4625-5G | |
| Timentin Ticarcillin/Clavulanate (15/1) (Timentin) | Gold Biotechnology | T-104 | |
| trans-Zeatin Riboside (ZR) | Gold Biotechnology | Z-100 | |
| Tryptone | Thermofisher Scientific | 211705 | |
| Wild Type Plantago lanceolata seeds | Outsidepride Seed Source, OR, USA | F1296 | Outsidepride.com |
| Yeast Extract Granulated | Research Products International Corp. | Y20025-1000 |
References
- Koornneef, M., Meinke, D. The development of Arabidopsis as a model plant. The Plant Journal. 61 (6), 909-921 (2010).
- Bragg, J. N., Anderton, A., Nieu, R., Vogel, J. P. Brachypodium distachyon. Agrobacterium Protocols. , 17-33 (2015).
- Chang, C., Bowman, J. L., Meyerowitz, E. M. Field guide to plant model systems. Cell. 167 (2), 325-339 (2016).
- Müller, B., Grossniklaus, U. Model organisms-a historical perspective. Journal of Proteomics. 73 (11), 2054-2063 (2010).
- Ding, X., et al. Different fruit-specific promoters drive AtMYB12 expression to improve phenylpropanoid accumulation in tomato. Molecules. 27 (1), 317 (2022).
- Niedbała, G., Niazian, M., Sabbatini, P. Modeling agrobacterium-mediated gene transformation of tobacco (Nicotiana tabacum)-a model plant for gene transformation studies. Frontiers in Plant Science. 12, 695110 (2021).
- Kumari, D., Prasad, B., Dwivedi, P. . Genome Editing Platforms in Rice (Oryza sativa L.): Basic methodology and troubleshooting. , (2022).
- Zhang, B. Agrobacterium-mediated transformation of cotton. Transgenic Cotton. , 31-45 (2013).
- Tiwari, R., Singh, A. K., Rajam, M. V. Improved and reliable plant regeneration and Agrobacterium-mediated genetic transformation in soybean (Glycine max L). Journal of Crop Science and Biotechnology. , 1-10 (2022).
- Bakhsh, A. Development of efficient, reproducible and stable Agrobacterium-mediated genetic transformation of five potato cultivars. Food Technology and Biotechnology. 58 (1), 57-63 (2020).
- Bates, R., Craze, M., Wallington, E. J. Agrobacterium-mediated transformation of oilseed rape (Brassica napus). Current Protocols in Plant Biology. 2 (4), 287-298 (2017).
- Hopp, H. E., Spangenberg, G., Herrera-Estrella, L. Plant transformation. Frontiers in Plant Science. 13, 876671 (2022).
- Abdelmuhsin, A. A., Alghamdi, A. A., Ibrahim, N. A. Assessing the phenotypic and genotypic variations of Plantago ciliata in Ha'il region, Saudi Arabia. Entomology and Applied Science Letters. (1), 14-22 (2021).
- Coleman, N. Plantago Lanceolata. Botanical Bulletin. 1 (11), 45 (1876).
- Huang, J., et al. Tissue-specific transcriptomic profiling of Plantago major provides insights for the involvement of vasculature in phosphate deficiency responses. Molecular Genetics and Genomics. 294 (1), 159-175 (2019).
- Penczykowski, R. M., Sieg, R. D. Plantago spp. as models for studying the ecology and evolution of species interactions across environmental gradients. The American Naturalist. 198 (1), 158-176 (2021).
- Pommerrenig, B., et al. Common plantain. A collection of expressed sequence tags from vascular tissue and a simple and efficient transformation method. Plant Physiology. 142 (4), 1427-1441 (2006).
- Bergero, R., Levsen, N., Wolff, K., Charlesworth, D. Arms races with mitochondrial genome soft sweeps in a gynodioecious plant, Plantago lanceolata. Molecular Ecology. 28 (11), 2772-2785 (2019).
- Aalto, E. A., Koelewijn, H. P., Savolainen, O. Cytoplasmic male sterility contributes to hybrid incompatibility between subspecies of Arabidopsis lyrata. G3: Genes, Genomes, Genetics. 3 (10), 1727-1740 (2013).
- Bloch, K. D., Grossmann, B. Digestion of DNA with restriction endonucleases. Current Protocols in Molecular Biology. 3 (1), (1995).
- Du, C., et al. Prokaryotic expression, purification, physicochemical properties and antifungal activity analysis of phloem protein PP2-A1 from cucumber. International Journal of Biological Macromolecules. 194, 395-401 (2022).
- Deshmukh, S. 2. 2., Kulkarni, R., Bose, K. Transformation and protein expression. Textbook on Cloning, Expression and Purification of Recombinant Proteins. , 83-114 (2022).
- Bergkessel, M., Guthrie, C. Colony PCR. Methods in Enzymology. 529, 299-309 (2013).
- Broehan, G., Kroeger, T., Lorenzen, M., Merzendorfer, H. Functional analysis of the ATP-binding cassette (ABC) transporter gene family of Tribolium castaneum. BMC Genomics. 14, 6 (2013).
- Dong, Z., et al. Stable transformation of fluorescent proteins into Nosema bombycis by electroporation. Parasites & Vectors. 15 (1), 141 (2022).
- Li, S., et al. Optimization of Agrobacterium-mediated transformation in soybean. Frontiers in Plant Science. 8, 246 (2017).
- Manimaran, P., et al. Infection of early and young callus tissues of indica rice BPT 5204 enhances regeneration and transformation efficiency. Rice Science. 20 (6), 415-426 (2013).
- Wang, J., Nie, J., Pattanaik, S., Yuan, L. Efficient Agrobacterium-mediated transformation of Artemisia annua L. using young inflorescence. In Vitro Cellular & Developmental Biology-Plant. 52 (2), 204-211 (2016).
- Niazian, M., Belzile, F., Torkamaneh, D. CRISPR/Cas9 in planta hairy root transformation: a powerful platform for functional analysis of root traits in soybean. Plants. 11 (8), 1044 (2022).
- Geng, S., et al. An efficient root transformation system for CRISPR/Cas9-based analyses of shoot-root communication in cucurbit crops. Horticulture Research. 9, (2022).
- Xiao, Y., et al. Efficient Agrobacterium-mediated genetic transformation using cotyledons, hypocotyls and roots of 'Duli'(Pyrus betulifolia Bunge). Scientia Horticulturae. 296, 110906 (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved