Method Article
Agrobacterium tumefaciens-vermittelte genetische Transformation des Spitzwegerichs
In diesem Artikel
Zusammenfassung
Aufgrund seiner vielseitigen Anwendung als Modellart in verschiedenen Forschungsbereichen besteht ein Bedarf an einem genetischen Transformationswerkzeug für den Schmalblättrigen Wegerich (Plantago lanceolata). In dieser Arbeit wird unter Verwendung der Agrobacterium tumefaciens-vermittelten Transformation ein Protokoll vorgestellt, das zu stabilen transgenen Linien mit einer Transformationseffizienz von 20% führt.
Zusammenfassung
Arten der Gattung Plantago haben mehrere einzigartige Merkmale, die dazu geführt haben, dass sie als Modellpflanzen in verschiedenen Studienbereichen angepasst wurden. Das Fehlen eines genetischen Manipulationssystems verhindert jedoch eine eingehende Untersuchung der Genfunktion, was die Vielseitigkeit dieser Gattung als Modell einschränkt. In dieser Arbeit wird ein Transformationsprotokoll für Plantago lanceolata, die am häufigsten untersuchte Plantago-Art, vorgestellt. Mittels Agrobacterium tumefaciens-vermittelter Transformation wurden 3 Wochen alte Wurzeln aseptisch gewachsener P. lanceolata-Pflanzen mit Bakterien infiziert, 2-3 Tage inkubiert und dann in ein Sprossinduktionsmedium mit entsprechender Antibiotikaauswahl überführt. Die Triebe traten in der Regel nach 1 Monat aus dem Medium heraus, und die Wurzeln entwickelten sich 1-4 Wochen, nachdem die Triebe in das Wurzelinduktionsmedium übertragen wurden. Die Pflanzen wurden dann an eine Bodenumgebung gewöhnt und mit dem Reporter-Assay β-Glucuronidase (GUS) auf das Vorhandensein eines Transgens getestet. Die Transformationseffizienz der aktuellen Methode beträgt ~20%, wobei pro 10 transformiertes Wurzelgewebe zwei transgene Pflanzen entstehen. Die Etablierung eines Transformationsprotokolls für Spitzwegerich wird die Einführung dieser Pflanze als neue Modellart in verschiedenen Gebieten erleichtern.
Einleitung
Das Konzept, Modellarten zu verwenden, um mehrere Aspekte der Pflanzenbiologie zu untersuchen, entstand mit der weit verbreiteten Verwendung von Arabidopsis thaliana1. Arabidopsis wurde ursprünglich ausgewählt, weil sie Merkmale mit vielen anderen Blütenpflanzen teilt und mehrere Merkmale aufweist, die es bequem machen, sie in einer Laborumgebung zu untersuchen, wie z. B. sie ist klein und hat einen kurzen Generationszyklus. Die große Menge an Forschungsarbeiten, die mit ihm als Thema veröffentlicht wurden, zusammen mit seiner geringen Genomgröße und der Leichtigkeit der genetischen Transformation2, ermöglichen es ihm, als weit verbreiteter experimenteller Organismus zu bestehen. Arabidopsis kann jedoch als Modell für Arten mit unterschiedlichen Merkmalen oder einzigartigen Merkmalen eingeschränkt werden3. Dies hat zur Entwicklung neuer Modellsysteme geführt, wie z. B. Mais (Zea mays), eine wichtige Pflanze für die Entwicklungsgenetik bei Monokotyledonen4, und die Tomate (Solanum lycopersicum), die ein wichtiges Modell für Evolutionsstudien, Fruchtentwicklung und -produktion ist und eine gute Darstellung für Gemüsekulturendarstellt 5. Eine Methode zur genetischen Transformation ist Voraussetzung dafür, dass eine Pflanzenart als Modellorganismus dienenkann 2. Eine Agrobacterium tumefaciens-vermittelte Transformation ist ein zuverlässiges Werkzeug in der Pflanzenbiologie; Es wurde verwendet, um einige Modellarten und Hauptkulturen umzuwandeln, darunter Tabak (Nicotiana tabacum)6, Reis (Oryza sativa)7, Baumwolle (Gossypium hirsutum)8, Sojabohnen (Glycine max)9, Kartoffeln (Solanum tuberosum)10 und Raps (Brassica napus)11. Pflanzenarten reagieren sehr unterschiedlich auf eine Infektion mit A. tumefaciens, und die Transformationsprotokolle müssen oft individuell auf jede Art zugeschnitten werden 6,12.
Die Gattung Plantago umfasst insgesamt 256 Pflanzenarten, die weltweitweit verbreitet sind 13. Die Arten dieser Gattung haben oft einzigartige Eigenschaften, die sie als Modellarten für die Untersuchung von Genetik, Ökologie, Stressphysiologie, Sekundärmetaboliten, medizinischer Chemie, Pflanzen-Mikroben-Interaktionen, Pflanzenentwicklung und Evolution wünschenswert machen. Plantago lanceolata, auch Spitzwegerich genannt, ist seit dem 19. Jahrhundert eine beliebte Pflanze, als sie erstmals zur Beschreibung des Phänomens der männlichen Sterilität verwendet wurde14. Wie andere Pflanzen ihrer Gattung wurde sie in Studien in verschiedenen Forschungsbereichen verwendet. In jüngerer Zeit wurde es als Modell für die Gefäßbiologie vorgeschlagen, da sein Gefäßgewebe leicht entnommen werden kann15. P. lanceolata ist die am häufigsten untersuchte Art der Gattung Plantago; Ein Artikel aus dem Jahr 2021 berichtete, dass es zu diesem Zeitpunkt16 >1.400 Veröffentlichungen gab, die diese Art enthielten oder sich auf diese Art bezogen, und seit Anfang 2022 wurden weitere 102 Artikel veröffentlicht, wie aus einer am 9.Dezember 2022 durchgeführten PubMed-Suche hervorgeht. Die am zweithäufigsten untersuchte Pflanze der Gattung, P. major, ist Gegenstand von nur 414 Artikeln, wenn sie nach den gleichen Kriterien am selben Datum gesucht wird.
Trotz des Forschungsinteresses an P. lanceolata sind Studien, insbesondere zur Charakterisierung der Genfunktion, oft durch das Fehlen eines genetischen Manipulationswerkzeugs für die Art eingeschränkt. Pommerrienig et al. bemühten sich, ein Transformationsprotokoll für P. major unter Verwendung einer Flora-Dip-Technik zu entwickeln17. Diese Methode kann jedoch aufgrund der für diese Art charakteristischen männlichen Sterilität nicht auf P. lanceolata angewendet werden18,19. Unseres Wissens gibt es kein Protokoll für die Transformation von P. lanceolata.
In dieser Arbeit wird ein einfaches Protokoll für die A. tumefaciens-vermittelte Transformation von P. lanceolata vorgestellt. Durch die gezielte Ausrichtung auf Wurzelgewebe können ausgewachsene transgene Pflanzen innerhalb von 3 Monaten nach der Transformation erzeugt werden.
Protokoll
Anmerkungen: Die Schritte 1.4-1.8, 2.3-2.5, 3.3-3.6, 4.1-4.6, 5.1-5.7 und 6.1-6.3 müssen unter aseptischen Bedingungen unter Verwendung einer sauberen Haube durchgeführt werden, um eine Kontamination zu vermeiden.
1. Vermehrung von Pflanzenmaterial zur Umwandlung
- Setzen Sie kommerziell erhältliche Wildtyp-Samen (WT) von Plantago lanceolata (siehe Materialtabelle) in ein 50-ml-Zentrifugenröhrchen bis zur 5-ml-Linie, abhängig von der Anzahl der gewünschten Pflanzen.
HINWEIS: Alternativ kann ein 2-ml-Mikrozentrifugenröhrchen verwendet werden, wenn eine kleine Anzahl von Samen benötigt wird, aber es sollte auf ein Volumen von nicht mehr als 0,1 ml gefüllt werden, da zu viele Samen die Effizienz der Sterilisation verringern können. - Tauchen Sie die Samen 60 s lang in 75%iges Ethanol.
- Entsorgen Sie das Ethanol und tauchen Sie die Samen 40 Minuten lang in 20%igen Natriumhypochlorit (20% NaClO, 80% steriles Wasser) und drehen Sie das Röhrchen vorsichtig um, so dass alle Samen mit der Lösung in Kontakt kommen.
Anmerkungen: Die Natriumhypochloritlösung muss frisch hergestellt werden, um optimale Ergebnisse zu erzielen. - Entsorgen Sie die Natriumhypochloritlösung unter einer Laminar-Flow-Haube und waschen Sie die Samen dann mit destilliertem Wasser (fünfmal). Gib nach dem letzten Spülen eine kleine Menge Wasser zu den Samen, da dies die Bewegung der Pflanzen auf Tellern unterstützen kann.
- Übertragen Sie die Samen mit einer sterilisierten Pinzette auf vorbereitete 95 mm x 100 mm Petrischalen mit festem MS-Medium (Tabelle 1). Verteilen Sie die Samen gleichmäßig auf der Oberfläche des Tellers, mit einem Abstand von etwa 1 cm zwischen den einzelnen Samen, um ein Überfüllen der gekeimten Sämlinge zu verhindern (Abbildung 1A).
- Versiegeln Sie die Platten mit zwei Schichten Paraffinfilm, um eine Kontamination zu vermeiden, und inkubieren Sie sie dann unter einem kaltweißen Wachstumslicht (siehe Materialtabelle) bei Raumtemperatur (22 °C mit 50 μmol m-2 s-1, 12 h Tage). Die Samen keimen in der Regel innerhalb von 5-6 Tagen.
- Wenn die Sämlinge gekeimt sind und groß genug sind, um sie zu übertragen (Abbildung 1B), in der Regel 2 oder 3 Tage nach der Keimung, verwenden Sie eine sterilisierte Pinzette, um die Sämlinge mit den 50-100 ml MS-Medium in sterile Boxen zu überführen (Tabelle 1). Pflanzen Sie idealerweise nur fünf Sämlinge pro Kiste, um die besten Wurzeln zu erhalten.
- Verschließen Sie die Schachteln mit chirurgischem Klebeband und lassen Sie die Pflanzen dann unter einem kaltweißen Wachstumslicht wachsen (siehe Materialtabelle), unter den gleichen Bedingungen, die in Schritt 1.6 erwähnt wurden. Die Pflanzen sollten in etwa 3-4 Wochen bereit für die Transformation sein, oder wenn die Hauptwurzeln etwa 2 cm lang geworden sind und die Seitenwurzeln weiß erscheinen.
Anmerkungen: Mittlere Zubereitungsrezepte und Vitaminvorräte sind in Tabelle 1 und Tabelle 2 enthalten.
2. Plasmidkonstruktion und E. Coli-Transformation
HINWEIS: Das genaue Verfahren zur Plasmidkonstruktion variiert je nach interessiertem Gen. In diesem Verfahren wurden die Restriktionsenzyme HindIII und SalII verwendet, um den 1,5 kb AtPP2-Promotor mit GUS unter Verwendung des Standard-Klonierungsverfahrens20 in das binäre Plasmid pBI101 (siehe Materialtabelle) einzuschleusen. AtPP2 (Phloemprotein 2) ist ein Gen, das spezifisch im Phloem21 exprimiert wird.
- Klonieren Sie den Promotor mit den Primerpaaren 5'-AGTCAAGCTTCAAGTCCCTGTGGCTACTGAAC-3' (Vorwärts) und 5'-AGTCGTCGACAAACCAGTATGATGTATTTTTTTTG-3' (Rückwärts) aus Arabidopsis. Abbildung 2 zeigt ein Diagramm des binären Plasmidvektors mit dem AtPP2:GUS-Insert .
- Nach der Plasmidkonstruktion werden die Plasmide mit der Hitzeschockmethode22 in DH5a E. coli (siehe Materialtabelle) kompetente Zellen umgewandelt und anschließend 1,5 h bei 37 °C unter Schütteln (150 U/min) inkubiert.
- Von jeder Transformationskultur werden 150 μl entnommen, mit der entsprechenden Auswahl (50 mg/l Kanamycin für den in diesem Protokoll verwendeten Stamm; siehe Materialtabelle) auf LB-Agar-Medienplatten (Tabelle 1) plattiert und die Platten dann 16-24 h bei 37 °C inkubiert.
HINWEIS: Der in dieser Studie verwendete Bakterienstamm ist A. tumefaciens GV3101. - Als nächstes wird die Kolonie-PCR verwendet, um die Kolonien auf positive Rekombinanten zu untersuchen23.
HINWEIS: In diesem Protokoll wurden die folgenden Primer verwendet, um das Zielgen zu amplifizieren; 5'-ATGTTACGTCCTGTAGAAACCCCAA-3' (vorwärts) und 5'-TCATTGTTTGCCTCCTCCTGCTGC-3' (rückwärts).- Führen Sie die Reaktion in einem Thermocycler (siehe Materialtabelle) mit Zyklusbedingungen von 3 min bei 95 °C durch, gefolgt von 35 Zyklen von: 30 s bei 95 °C, 30 s bei 55 °C, 2 min bei 72 °C und einem abschließenden 10-minütigen Dehnungsschritt bei 72 °C.
- Die positiven Kolonien werden in 6 ml LB-Bouillon (Tabelle 1) mit dem entsprechenden Antibiotikum (50 mg/l Kanamycin) beimpft und über Nacht bei 37 °C bei 200-250 U/min gezüchtet.
- Nach dem Wachstum über Nacht werden die Plasmide mit Standardverfahren aus den Bakterien extrahiert24.
3. A . tumefaciens-Transformation mit Plasmid
- Nach der Plasmidextraktion wird das modifizierte Plasmid mittels Elektroporation in den gewünschten Stamm kompetenter Zellen umgewandelt. In diesem Verfahren wurde der A. tumefaciens-Stamm GV3101 verwendet. Befolgen Sie standardisierte Methoden für Elektroporationstechniken25.
- Nach der Elektroporation werden die kompetenten Zellen in 1 ml LB-Bouillon resuspendiert und anschließend für 2-4 h bei 28 °C bei 100 U/min inkubiert.
- Sammeln Sie die Zellen durch Zentrifugation bei 6.800 x g für 3 min in einer Tisch-Mikrozentrifuge (siehe Materialtabelle) bei Raumtemperatur (22 °C) und verteilen Sie dann 50-100 μl mit einem geeigneten Selektionsmittel (50 mg/l Kanamycin für das in diesem Protokoll verwendete Plasmid) auf einer LB-Agarplatte.
- Nachdem die Zellen 2 Tage bei 28 °C inkubiert haben, werden positive Kolonien, die das interessierende Gen enthalten, mit Hilfe der Kolonie-PCR identifiziert. Verwenden Sie in diesem Protokoll die in Schritt 2.4 genannten Primer und Bedingungen.
- Verwenden Sie als Nächstes die positiven Kolonien, um eine Vorratsplatte mit LB-Agarmedien + Auswahl zu streifen. Die Platte kann bei 4 °C bis zu 1 Monat gelagert werden.
- Alternativ kann für die Langzeitlagerung eine positive Kolonie mit einem kleinen Volumen LB mit entsprechender Selektion geimpft werden. Schütteln Sie die beimpfte Kultur über Nacht bei 28 °C bei 200 U/min und bereiten Sie dann eine Glycerinbrühe (50 % w/v Glycerin in einer 50:50-Mischung aus Bakterien und Glycerin) zu, die bei -80 °C bis zu 10 Jahre gelagert werden kann.
4. A . tumefaciens Präparat
- Streak A. tumefaciens mit dem gewünschten Plasmid auf präparierte 95 mm x 100 mm große feste LB-Platten mit dem entsprechenden Selektionsmittel. In diesem Protokoll wurde der Bakterienstamm GV3101 mit dem Plasmideinsatz AtPP2:GUS verwendet, wobei 50 mg/L Kanamycin für die Selektion hinzugefügt wurden.
- Versiegeln Sie die Platten mit Paraffinfolie und inkubieren Sie sie dann bei 28 °C für bis zu 48 Stunden oder bis die Bakterien groß genug sind, um sie zu pflücken.
- Verwenden Sie eine Pipettenspitze, um 2 Tage vor der Transformation eine Bakterienkolonie zu entnehmen, und beimpfen Sie sie in einem 15-ml-Röhrchen mit rundem Boden, das 6 ml flüssiges LB mit entsprechender Auswahl enthält. Bei 200 U/min in einem 28 °C heißen Tischschüttler über Nacht schütteln, bis OD600 0,6-0,7 erreicht.
HINWEIS: Die Platten und die 6-ml-Bakterienimpfung können bis zu 1 Monat bei 4 °C gelagert werden. - Wenn die Bakterien den richtigen OD 600 erreicht haben, verwenden Sie eine Pipette, um A. tumefaciens mit einem Selektionsmittel in einen sterilen Kolben mit100 ml flüssigem LB zu überführen. In der Regel sind 200 μl Bakterien pro 100 ml LB für die Vermehrung geeignet. Bei 200 U/min bei 28 °C über Nacht schütteln, bis OD600 0,6-0,7 erreicht.
- Übertragen Sie die Bakterien in sterile 50-ml-Zentrifugenröhrchen und zentrifugieren Sie sie 10 Minuten lang bei Raumtemperatur (22 °C) bei 2.200 x g in einer Tischzentrifuge, um die Bakterien aufzufangen.
- Entsorgen Sie den Überstand mit einer Pipette. Das Bakterienpellet wird in 5 ml flüssiger Suspensionslösung (SS) mit Raumtemperatur (22 °C) (Tabelle 1) durch Pipettieren resuspendiert, dann bis zu 50 ml SS hinzugefügt und mehrmals invertiert, um es zu mischen. Das Bakterium ist nun bereit für die Transformation.
Anmerkungen: Das flüssige SS muss innerhalb von 1 Woche nach der Umwandlung frisch zubereitet werden.
ACHTUNG: Sämtliches Material, das mit A. tumefaciens in Berührung kommt, muss in einer Mülltonne für biologische Abfälle entsorgt werden. Übrig gebliebene Flüssigkeiten aus Bakterienkulturen können mit Natriumhypochlorit (Bleichmittel) in einer Konzentration von 20 % oder mehr sterilisiert werden.
5. Transformation der Plantago-Wurzeln
- Wenn die Pflanzen das ideale Stadium für die Transformation erreicht haben (die Sämlinge sind 3 Wochen alt) (Abbildung 1C), verwenden Sie eine sterile Pinzette und eine Schere, um die Wurzeln vom Rest der Pflanze zu trennen (Abbildung 3A). Entsorgen Sie das Blatt- und Stängelmaterial.
- Übertragen Sie die Wurzelstücke unmittelbar nach dem Schneiden mit einer sterilen Pinzette in sterile Boxen mit sterilem Wasser. Dieser Schritt ermöglicht es den Wurzeln, hydratisiert zu bleiben, während das gesamte Gewebe gesammelt wird.
- Wenn alle Wurzeln abgeschnitten sind, gießen Sie die A. tumefaciens/SS-Suspension in sterile 150 mm x 15 mm große Einweg-Petrischale. Übertragen Sie die Wurzeln in die A . tumefaciens-Kultur und inokulieren Sie sie mindestens 20 Minuten lang (Abbildung 3B).
- Verwenden Sie während der Inkubation ein steriles Skalpell mit einer scharfen Klinge, um die Wurzeln in 1 cm große Fragmente zu schneiden und die Primärwurzeln von den Seitenwurzeln zu trennen. Machen Sie dünne, flache Schnitte auf der Oberfläche der Wurzeln, damit die Bakterien die Pflanze infizieren können.
Anmerkungen: Wenn Sie es mit einer großen Anzahl von Pflanzen zu tun haben, geben Sie die Wurzelstücke portionsweise in die Bakterienkultur, um sicherzustellen, dass alle Wurzeln während der Inokulation eingetaucht werden. - Verwenden Sie nach der Inkubation die sterile Pinzette, um die Wurzelstücke auf sterile Papiertücher zu übertragen, um überschüssige Bakterien zu entfernen. Vermeiden Sie es, die Wurzeln länger als 60 Sekunden auszutrocknen, da dies zu Austrocknung führen und das Wurzelgewebe schädigen kann. Im Idealfall können 10-15 Wurzeln gleichzeitig getrocknet werden (Abbildung 3C).
- Übertragen Sie die getrockneten Wurzeln in vorbereitete 95 mm x 15 mm Petrischalen mit festem Co-Kulturmedium (Tabelle 1), etwa 10-20 Wurzeln pro Platte, je nach Größe der Wurzeln (Abbildung 3D).
- Versiegeln Sie die Platten mit zwei Schichten transparenter Plastikfolie und decken Sie sie dann mit Aluminiumfolie ab. Bei Raumtemperatur (22 °C) 3 Tage inkubieren. Dieser Schritt gibt den Bakterien Zeit, die Wurzeln zu infizieren, ohne dass ein Antibiotikum ausgewählt wird (Abbildung 3E).
6. Selektion und Regeneration der gesamten Pflanze
- Nach der Inkubation in Co-Kulturmedien werden die Wurzelstücke in vorbereitete 95 mm x 15 mm Petrischalen mit festem Spross-Induktionsmedium (SIM) (Tabelle 1) mit Timentin (500 mg/l; siehe Materialtabelle) und geeigneter Antibiotikaauswahl überführt. In diesem Protokoll haben wir Kanamycin (100 mg/L) verwendet.
Anmerkungen: Die Unterseite der Wurzeln muss vollständig mit dem Medium in Kontakt kommen. Wurzeln, die die Oberfläche des Mediums nicht berühren, sind zu lang und müssen geschnitten werden, um zu verhindern, dass das Gewebe der Selektion entgeht. - Versiegeln Sie die Platten mit zwei Schichten transparenter Plastikfolie und wachsen Sie dann 1 Monat lang unter einer Wachstumslampe (siehe Schritt 1.6 für geeignete Bedingungen) oder bis die Triebe zu erscheinen beginnen.
Anmerkungen: In der Regel können die Initialen der Triebe nach 2 Wochen des Wachstums beobachtet werden, und die Triebe sind in der Regel nach 1 Monat sichtbar. - Wenn die Pflänzchen 1,5 bis 2,0 cm lang sind (Abbildung 1D), werden sie in vorbereitete sterile Boxen mit festem Wurzelinduktionsmedium umgefüllt (Tabelle 1).
- Züchten Sie die Pflanzen mehrere Wochen lang unter einer Wachstumslampe (siehe Schritt 1.6 für die Bedingungen), bis sich Wurzeln bilden. Wurzeln sind in der Regel erst nach 1 Woche zu sehen.
HINWEIS: Es wird empfohlen, die Wurzeln mehrere Wochen wachsen zu lassen, bevor sie in den Boden ziehen, da Pflanzen mit größeren Wurzelsystemen tendenziell eine höhere Überlebensrate im Boden haben.
7. Transfer des Bodens
- Wenn das Wurzelsystem groß genug geworden ist, um übertragen zu werden (Abbildung 1E), in der Regel nach 1 Monat des Wachstums, setzen Sie die Pflanzen in 3,5 in quadratische Töpfe mit vorgenässter Allzweckerde (BM7) um. In diesem Protokoll wurde BM7-Rindenmischung verwendet (siehe Materialtabelle).
- Entfernen Sie jegliches Medium, das an den Wurzeln haftet, indem Sie sie vorsichtig in Wasser waschen.
HINWEIS: Die Pflanzen können in einem Gewächshaus bei 800 bis 1400 μmol Photonen m-2 s-2 unter Verwendung von 600 W Natriumhochdrucklampen (siehe Materialtabelle) oder in einer Wachstumskammer bei Raumtemperatur (22 °C) mit kaltweißem Licht bei 50 μmol m-2 s-1, 12 h Tage, zur Reife gebracht werden.
- Entfernen Sie jegliches Medium, das an den Wurzeln haftet, indem Sie sie vorsichtig in Wasser waschen.
- Decken Sie die Pflanzen mit einer Plastikabdeckung ab und decken Sie sie dann mit einer durchsichtigen Plastiktüte ab. Dieser Schritt ermöglicht es den Pflanzen, in einer feuchten Umgebung zu bleiben, während sie sich an den Boden anpassen.
- Entfernen Sie nach ca. 3-5 Tagen die Plastiktüte und entfernen Sie dann langsam den Deckel, um sich an die äußere Umgebung zu gewöhnen.
HINWEIS: Abhängig von der Jahreszeit und der Umgebung, in die die Pflanzen gebracht werden, kann die Zeit, die die Pflanzen benötigen, um sich anzupassen, variieren. Es wird empfohlen, die Pflanzen täglich zu kontrollieren und bei Bedarf Wasser in die Töpfe zu geben. - Gießen Sie die Pflanzen regelmäßig und fügen Sie bei Bedarf Dünger hinzu. Die Pflanzen können auch in größere Töpfe umgepflanzt werden, um weiter zu wachsen (Abbildung 1F).
8. Histochemische Färbung der β-Glucuronidase (GUS)
- Herstellung β-Glucuronidase (GUS)-Färbelösung gemäß den veröffentlichten Protokollen15.
- Wenn die Initialen des Sprosses etwa 0,5-1 cm lang sind, entfernen Sie eine kleine Spitze eines jungen, vollständig expandierten Blattes (<5 mm Länge ist in der Regel ausreichend) und geben Sie sofort 0,5-1 ml GUS-Färbelösung in ein 1,5- oder 2-ml-Mikrozentrifugenröhrchen. Die Lösung sollte das Pflanzengewebe vollständig bedecken.
- Die geöffneten Röhrchen in einen Vakuumexsikkator geben und 5-10 min bei 20-25 kPa vakuumieren. Kleine Bläschen sollten während des Vakuumvorgangs in der Lösung sichtbar sein. Dadurch kann die Lösung in die Zellen der Pflanze gelangen.
- Lassen Sie die Luft zurück in den Vakuumexsikkator filtern. Schließen Sie die Röhrchen und inkubieren Sie sie bei 37 °C über Nacht (12 h) oder bis die blaue Farbe sichtbar ist.
ANMERKUNG: In dieser Studie war die GUS-Aktivität auf das Phloem lokalisiert, was bedeutet, dass bei positiv transformierten Pflanzen die blaue Färbung nur im Phloemgewebe sichtbar sein sollte. Bei Pflanzen ohne das Transgen kommt es nicht zu einer Färbung (Abbildung 4). - Um den Fleck besser sichtbar zu machen, stellen Sie die Pflanzen auf 100% Ethanol um, um Chlorophyll zu entfernen. Um die Effizienz des Chlorophyllentfernungsprozesses zu erhöhen, inkubieren Sie die Röhrchen 10 Minuten lang bei 60 °C.
Anmerkungen: Das Ethanol muss möglicherweise mehrmals gewechselt werden, bevor das gesamte Chlorophyll entfernt wird, abhängig von der Größe des Blattes, das gefärbt wird.
Ergebnisse
Hier wird ein einfaches Protokoll zur Gewinnung transgener P. lanceolata-Pflanzen unter Verwendung der A. tumefaciens-vermittelten Transformation beschrieben. Das Reportergen GUS (kodierend für β-Glucuronidase) wird durch den Phloem-exprimierten Promotor von AtPP2 durch den A. tumefaciens-Stamm GV3101 in 3 Wochen alte P. lanceolata-Wurzeln transformiert (Abbildung 2). Ein Phloem-spezifischer Promotor wurde gewählt, da unser Hauptinteresse darin bestand, ein System für die funktionelle Genomik von pflanzlichen Gefäßgeweben, insbesondere Phloem, zu etablieren. Die Methode wurde im Vorversuch am Wurzel-, Blatt- und Blattstielgewebe getestet. Obwohl Kallus in allen Gewebetypen induziert werden konnte, produzierte nur das Wurzelgewebe nach 1 Monat in SIM Sprossinitialen (Abbildung 5A); Das Blatt und der Blattstiel verfärbten sich braun und starben ab (Abbildung 5B). Dies führte zu der Schlussfolgerung, dass Wurzelgewebe der optimale Gewebetyp für den Einsatz in der Transformationsmethode ist. Die Wurzeln wurden in den präparierten Bakterien, die in Suspensionslösung (SS) resuspendiert wurden (Tabelle 1), für mindestens 20 min inkubiert und dann bei Raumtemperatur auf festen SS-Platten für bis zu 3 Tage im Dunkeln inkubiert (Abbildung 3E). Die Wurzeln wurden dann in das Sprossinduktionsmedium (SIM) übertragen und unter den im Protokoll angegebenen Bedingungen (Schritt 1.6) unter Wachstumslicht gehalten. Abbildung 1 und Abbildung 3 zeigen repräsentative Bilder der einzelnen Schritte des Protokolls als Referenz.
Abbildung 6 zeigt den Verlauf der Sprossinitialen, die aus transformiertem Gewebe hervorgehen, vom ersten Tag, an dem die Wurzeln auf die SIM gelegt wurden (Abbildung 6A), bis zu dem Zeitpunkt, an dem die Sprosse bereit waren, bewurzelt zu werden (Abbildung 6D). Nach 1 Woche bildete sich im Wurzelgewebe Kallus (Abbildung 6B), und die Anfänge der Sprossinitialen konnten beobachtet werden (Abbildung 6B1). In den Wochen 2 und 3 traten die Triebe weiter auf (Abbildung 6C), und nach 4 Wochen waren die Triebe bereit, in das Wurzelinduktionsmedium übertragen zu werden (Abbildung 6D).
Die Identifizierung der mutmaßlich transgenen Pflanzen erfolgte mit dem histochemischen Assay β-Glucuronidase (GUS) unter Verwendung von Blattsegmenten, die entnommen wurden, sobald die Triebe etwa 0,5 cm lang waren. Positive transgene Pflanzen zeigten das erwartete Färbemuster im Phloem-lokalisierten Gewebe, das in Abbildung 4 dargestellt ist. Positive GUS-gefärbte Triebe wurden in das Wurzelinduktionsmedium überführt, in dem sie nach 4 Wochen robuste Bewurzelungssysteme entwickelten (Abbildung 1E). Bewurzelte Pflanzen wurden dann in den Boden überführt. Abbildung 4 zeigt das Ergebnis der Färbung in einem schmalblättrigen Wegerich, der mit dem AtPP2-Promotor und dem β-Glucuronidase-Gen (GUS) transformiert wurde, sowie in einem Wildtyp- und einem schmalblättrigen Wegerich, die mit dem AtPP2-Promotor transformiert wurden. Alle Triebe, die auftauchten, wurden als transgen bestätigt. Die Transformationseffizienz wurde auf durchschnittlich 20 % festgelegt, wobei auf 10 transformierte Wurzeln etwa zwei Triebe kamen. Bestätigte transgene Pflanzen wurden in größere Töpfe umgepflanzt und 4-8 Wochen lang gezüchtet, bis sie das adulte Stadium erreichten (Abbildung 1F).
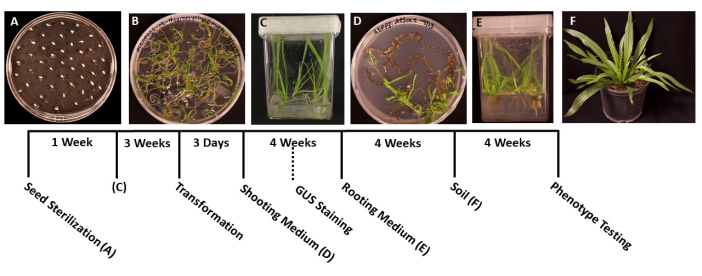
Abbildung 1: Zeitleiste der Transformation von Plantago lanceolata . Repräsentative Bilder jeder Phase des Protokolls. (A) Nicht gekeimte Samen, die auf einer MS-Platte plattiert sind. (B) Die Samen sind nach 1 Woche gekeimt und können in magentafarbene Schachteln umgefüllt werden. (C) Pflanzen in MS-Boxen nach 3 Wochen Wachstum. Die Wurzeln sind grün und gesund, im idealen Stadium für die Transformation. (D) Sprosse in Sprossinduktionsmedien sind nach 4 Wochen bereit, in das Bewurzelungsmedium überführt zu werden. In diesem Stadium kann gegebenenfalls eine histochemische Färbung der β-Glucuronidase (GUS) durchgeführt werden. (E) Pflanzen in Kisten mit Wurzelinduktionsmedien, bei denen sich nach 4 Wochen Wachstum Wurzeln gebildet haben. (F) Transgene Pflanzen werden nach 4 Wochen Wachstum im Boden auf volle Länge gezüchtet. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
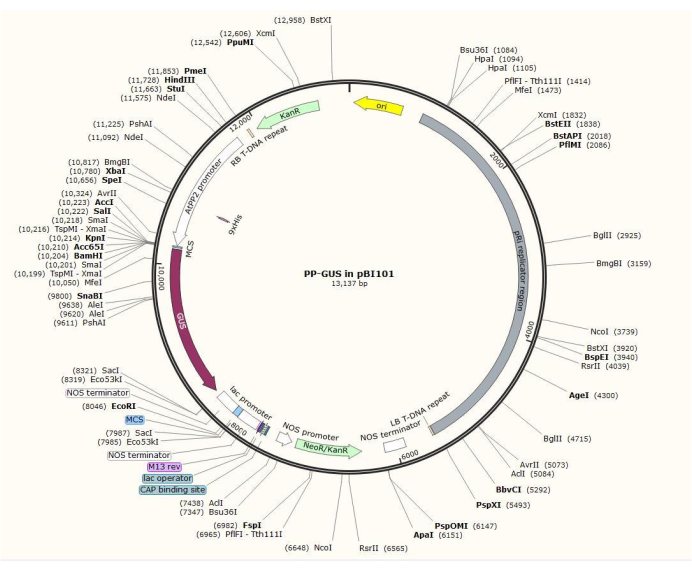
Abbildung 2: Schematische Darstellung des binären Vektorplasmids pBI101 + β-Glucuronidase (GUS) mit dem eingefügten phloemspezifischen Promotor AtPP2. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
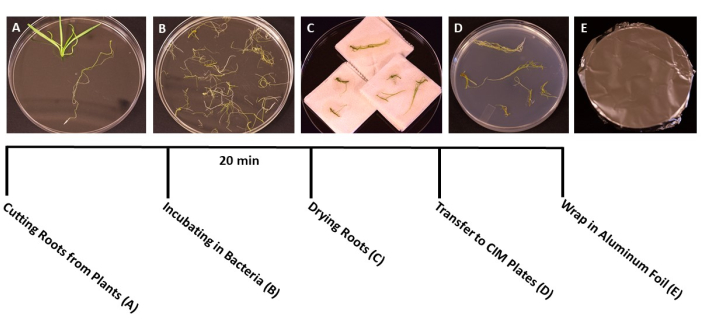
Abbildung 3: Schritte der Transformation. Repräsentative Bilder von jedem Schritt der Transformation. (A) Trennen von Wurzeln und Trieben während der Transformation. (B) Einweichen von Wurzeln in Bakterien/SS-Suspension. (C) Trocknen der Wurzeln auf Papiertüchern, um überschüssige Bakterien zu entfernen. (D) Wurzeln, die auf einem Co-Kulturmedium plattiert sind. (E) SS-Platten, die in Aluminiumfolie eingewickelt sind. Die Pflanzen wurden 2-3 Tage lang inkubiert, bevor sie in das Triebmedium überführt wurden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
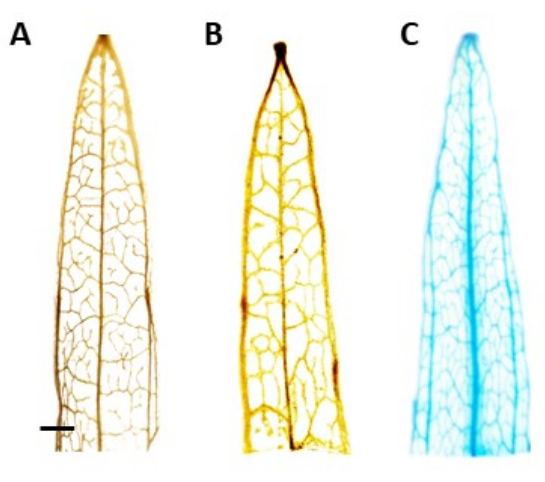
Abbildung 4: GUS-Färbung. β-Glucuronidase (GUS)-Färbeergebnisse von Blattsegmenten des Spitzwegerichs. (A) Wildtyp. (B) Schmalblättriger Wegerich, der mit dem Plasmid transformiert wurde, das den AtPP2-Promotor beherbergt (leerer Vektor). (C) Schmalblättriger Wegerich, der mit dem Plasmid transformiert wurde, das den AtPP2-Promotor und das β-Glucuronidase (GUS)-Gen beherbergt. Jedes Blatt wurde mit dem histochemischen Färbeprotokoll GUS gefärbt und dann mit einer mikroskopischen Kamera abgebildet. Die Bilder (B) und (C) zeigen aufgrund des Fehlens des GUS-Gens kein Färbemuster. Das rechte Bild zeigt ein deutliches blaues Färbemuster in den Adern, was bestätigt, dass die Pflanzen transgen sind. Der Balken stellt 1 mm dar, wobei jedes Blattsegment etwa 1 cm lang ist. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
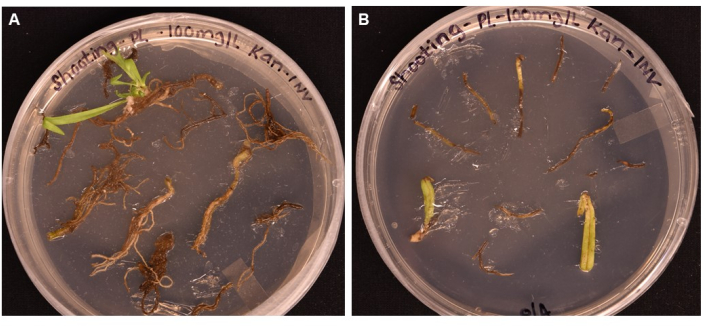
Abbildung 5: Vergleich der Transformationseffizienz verschiedener Gewebetypen nach >1 Monat Inkubation auf Shooting-Medien . (A) Wurzelgewebe nach mehr als 1 Monat Wachstum. Die Wurzeln haben eine ausgedehnte Hornhaut erfahren, und es sind Triebinitialen entstanden. Der nicht transformierte Kallus hat begonnen, als Reaktion auf die Antibiotikaauswahl abzusterben. (B) Blatt- und Blattstielgewebe nach mehr als 1 Monat Wachstum. Das Gewebe erfuhr eine gewisse Hornhautausdehnung, starb aber bald als Reaktion auf das Antibiotikum ab. Aus beiden Geweben sind keine Triebe hervorgegangen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
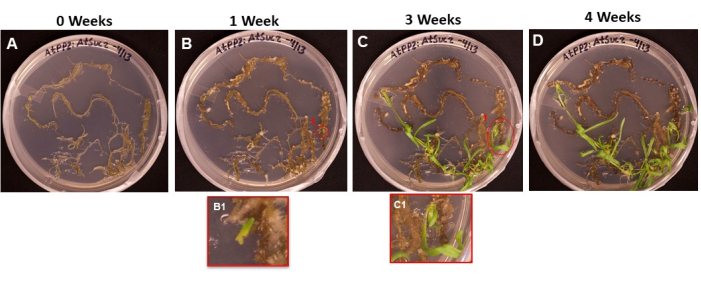
Abbildung 6: Entstehung von Kallus und Sprossen auf transformiertem Gewebe. Repräsentative Bilder von Geweben, die nach unterschiedlich langer Inkubationszeit auf Schießmedium gelegt wurden. (A) Wurzelgewebe direkt nach dem Aufplattieren auf das Schussmedium. (B) Wurzelgewebe nach 1 Woche auf Schussmedium. Die Ausdehnung der Hornhaut kann beobachtet werden, und (B1) die ersten Triebinitialen haben begonnen, sich zu zeigen. (C) Wurzelgewebe nach 3 Wochen auf Schießmedium. Weitere Shooting-Initialen sind aufgetaucht. (C1) Das Shooting, das aus dem anfänglichen B1-Shooting hervorgegangen ist. (D) Wurzelgewebe nach 4 Wochen Inkubation. Nicht transformiertes Gewebe hat begonnen, sich schwarz/braun zu verfärben und abzusterben, und die entstehenden Triebe wachsen weiter. In diesem Stadium sind die Triebe bereit, in das Bewurzelungsmedium gebracht zu werden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Tabelle 1: Rezepte für die Medienvorbereitung. Eine Beschreibung, wie man Medien auf die Transformation vorbereitet. Die Menge der zugesetzten Vitamine wird auf der Grundlage der angegebenen Stammlösungskonzentration berechnet. Siehe Tabelle 2 für die Herstellung der Vitaminvorratslösung. Geben Sie für alle Medien Reagenzien zu 900 ml doppelt destilliertemH2O, pH-Wert auf den angegebenen Wert und fügen Sie dann Wasser bis zu einem Endvolumen von 1.000 ml hinzu. * = nach der Sterilisation hinzufügen. ** = pH-Wert mit 1 M KOH. = pH mit 1 M NaOH. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Tabelle 2: Vitaminvorräte für Plantago-Nährböden . Alle Vitamine müssen vor der Lagerung filtersterilisiert und genau gekennzeichnet werden. Wo angegeben, lösen Sie die Pulver zuerst in 1 N NaOH auf und stellen Sie dann das gewünschte Volumen mit doppelt destilliertemH2Ozusammen. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Diskussion
Das Fehlen eines Transformationsprotokolls für Pflanzen der Gattung Plantago schränkt die Verwendung dieser Pflanzen als Modelle ein, insbesondere wenn Forscher an der Erforschung von Genfunktionen interessiert sind. P. lanceolata wurde ausgewählt, um ein genetisches Transformationsprotokoll zu entwickeln, da es die am häufigsten untersuchte Pflanze ihrer Gattung16 ist. Das entwickelte Protokoll wird wahrscheinlich als Werkzeug verwendet, um Studien im Zusammenhang mit Gefäßbiologie, Ökologie, Pflanzen-Insekten-Interaktionen und abiotischer Stressphysiologie weiter voranzutreiben.
Das vorgestellte Protokoll beschreibt klar die Schritte, die es einem Benutzer ermöglichen, transgene Pflanzen zu erhalten. Neben der Fähigkeit von P. lanceolata , in einer Gewebekulturumgebung zu gedeihen, trugen mehrere Faktoren zum Erfolg unserer Transformationsmethode bei. Zunächst wurde festgestellt, wie wichtig es ist, hochwertiges, steriles Pflanzenwurzelgewebe für die Transformation zu verwenden. Die Wurzeln hatten die höchsten Umwandlungsraten, wenn sie von 3-4 Wochen alten Pflanzen entnommen wurden und grün oder blassweiß erschienen. Wurzeln, die aus Kisten mit einer beliebigen Menge an bakterieller oder pilzlicher Kontamination entnommen wurden, führten oft zu kontaminierten Triebkulturen, und ältere Wurzeln, die braun aussahen, führten nicht zu einer erfolgreichen Transformation. Wurzelgewebe war mit der aktuellen Methode der effizienteste Gewebetyp für die Transformation, da Blatt- und Blattstielgewebe bei der Entwicklung von Trieben nicht erfolgreich waren.
Eine weitere wichtige Beobachtung war, dass die optimale Methode zur Entnahme von Wurzelgewebe für die Transformation darin bestand, frisch geschnittenes Wurzelmaterial in steriles Wasser zu legen. Dieser Schritt ermöglichte es effektiv, dass das Wurzelmaterial hydratisiert blieb, während der Rest des Gewebes gesammelt wurde, da Wurzeln dazu neigen, schnell auszutrocknen, wenn sie aus ihren Wachstumsbehältern entfernt werden. Dieser Schritt trug auch dazu bei, die Erfolgsquote der Transformation zu erhöhen, da mehr Wurzeln gleichzeitig in den Bakterien inkubiert werden konnten.
Dieses Protokoll könnte modifiziert werden, indem die Inkubationszeit des Wurzelgewebes in den Co-Kulturmedien auf 2 Tage verkürzt wird. Es wurde beobachtet, dass eine Inkubationszeit von 2 oder 3 Tagen ausreicht, um eine Infektion zu ermöglichen, die zu Sprossinitialen führt. Längere Inkubationszeiten werden jedoch nicht empfohlen, da beobachtet wurde, dass das Fehlen eines Antibiotika-Inhibitors im Medium häufig zu einer Überwucherung von A. tumefaciens führt, die das entstehende Gewebe abtöten kann.
Eine Einschränkung dieser Studie ist der Mangel an verfügbaren Daten über die Leistungsfähigkeit anderer Methoden oder Arten von A. tumefaciens bei der P. lanceolata-Transformation zum Vergleich. Unseres Wissens ist dieses Protokoll neuartig. Während der ersten Versuche wurde eine hohe Transformationseffizienz mit A. tumefaciens GV3101 festgestellt, und wir konzentrierten uns darauf, die Technik mit diesem Stamm zu verfeinern, anstatt mit anderen Stämmen zu experimentieren. Unsere Transformationseffizienz von 20 % ist für die Pflanzentransformation relativ hoch - viele konventionelle Methoden betrachten alles >1 % als erfolgreich26,27,28. Die Verwendung eines anderen Stammes von A. tumefaciens, wie z. B. A. rhizogenes, der für seine Verwendung bei der Wurzeltransformation bei mehreren Arten bekannt ist 29,30,31, kann jedoch zu einer noch höheren Erfolgsquote führen. Weitere Experimente wären erforderlich, um die Auswirkungen der Verwendung anderer Stämme zur Förderung einer erhöhten Transformationseffizienz bei P. lanceolata zu bewerten.
Die erfolgreiche Transformation von P. lanceolata wird wahrscheinlich vielen Forschungsbereichen zugute kommen. Die hohe Transformationseffizienz und das schnelle Wachstum der Pflanze in Gewebekulturmedien machen P. lanceolata zu einem geeigneten Kandidaten für Genfunktionsstudien15.
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Diese Arbeit wurde von der National Science Foundation unterstützt (EDGE IOS-1923557 an C.Z. und Y.Z.).
Materialien
| Name | Company | Catalog Number | Comments |
| 14 mL Round Bottom TubeA4A2:A34 | ThermoFisher Scientific | 150268 | |
| 1-Naphthylacetic acid | Gold Biotechnology | N-780 | |
| 3M Micropore Surgical Paper Tape | ThermoFisher Scientific | 19-027761 | |
| 50 mL Centrifuge Tubes | Research Products International Corp. | 163227LC | |
| 600 Watt High Pressure Sodium Lights | Plantmax | PX-LU600 | |
| 6-Benzylaminopurine (6-BAP) | Gold Biotechnology | B-110 | |
| Aluminum Foil | ThermoFisher Scientific | 01-213-100 | |
| Bacto Agar | Thermofisher Scientific | 214010 | |
| Binary Plasmid pBI101 | Clontech, USA | 632522 | |
| Cool White Grow Light Sylvania LLC | Home Depot | 315952205 | |
| D-biotin | ThermoFisher Scientific | BP232-1 | |
| ddH2O | |||
| DH5a E. coli | Invitrogen, USA | 18258012 | |
| Disposable Petri Dishes, Sterile 150 x 16 mm | ThermoFisher Scientific | FB0875712 | |
| Disposable Petri Dishes, Sterile 95 x 15 mm | ThermoFisher Scientific | FB0875714G | |
| Dissecting Scissors | Leica Biosystems | 38DI12044 | |
| Ethanol 200 Proof | Decon Labs | 2705 | |
| Folic Acid | Fisher Scientific | BP2519-5 | |
| Forceps | Leica Biosystems | 38DI18031 | |
| Gelrite | Research Products International Corp. | G35020-1000 | |
| Glycerol | ThermoFisher Scientific | 17904 | |
| Glycine | Sigma | 241261 | |
| Incubated Tabletop Orbital Shaker | ThermoFisher Scientific | SHKE420HP | |
| Indole-3-Acetic Acid (IAA) | Gold Biotechnology | I-110 | |
| Indole-3-Butyric Acid (IBA) | Gold Biotechnology | I-180 | |
| Kanamycin Monosulfate | Gold Biotechnology | K-120 | |
| Macrocentrifuge | ThermoFisher Scientific | 75007210 | |
| Magenta Boxes | ThermoFisher Scientific | 50255176 | |
| Micro Pipet Tips 1000 µL | Corning | 4140 | |
| Micro Pipet Tips 200 µL | Corning | 4138 | |
| Micro Pipette Tips 10 µL | Corning | 4135 | |
| Microcentrifuge | ThermoFisher Scientific | 75002410 | |
| Micropipettor 0.5-10 µL | Corning | 4071 | |
| Micropipettor 100-1000 µL | Corning | 4075 | |
| Micropipettor 20-200 µL | Corning | 4074 | |
| Micropipettor 2-20 µL | Corning | 4072 | |
| Murashige & Skooge Basal Medium with Vitamins | PhytoTech | M519 | |
| Murashige & Skooge Basal Salt Mixture | PhytoTech | M524 | |
| myo-Inositol | Gold Biotechnology | I-25 | |
| Nicotinic acid | Sigma | N0761-100g | |
| Parafilm (paraffin film) | ThermoFisher Scientific | S37440 | |
| Potassium Hydroxide (KOH) | Research Products International Corp. | P44000 | |
| Pyridoxine HCl | Sigma | P6280-10g | |
| Scalpel Blade Handle | Leica Biosystems | 38DI36419 | |
| Scalpel Blades | Leica Biosystems | 3802181 | |
| Sodium Chloride, Crystal (NaCl) | Mallinckrodt Chemicals | 7581-06 | |
| Sodium Hydroxide (NaOH) | Research Products International Corp. | S24000 | |
| Sodium Hypochlorite | Walmart | 23263068401 | |
| Soil- Bark Mix | Berger, USA | BM7 | |
| Square Pots (3.5 inches squared) | Greenhouse Megastore | CN-TRK-1835 | |
| Sucrose | Research Products International Corp. | S24060 | |
| Thermocycler | ThermoFisher Scientific | A24811 | |
| Thiamine HCl | Sigma | T4625-5G | |
| Timentin Ticarcillin/Clavulanate (15/1) (Timentin) | Gold Biotechnology | T-104 | |
| trans-Zeatin Riboside (ZR) | Gold Biotechnology | Z-100 | |
| Tryptone | Thermofisher Scientific | 211705 | |
| Wild Type Plantago lanceolata seeds | Outsidepride Seed Source, OR, USA | F1296 | Outsidepride.com |
| Yeast Extract Granulated | Research Products International Corp. | Y20025-1000 |
Referenzen
- Koornneef, M., Meinke, D. The development of Arabidopsis as a model plant. The Plant Journal. 61 (6), 909-921 (2010).
- Bragg, J. N., Anderton, A., Nieu, R., Vogel, J. P. Brachypodium distachyon. Agrobacterium Protocols. , 17-33 (2015).
- Chang, C., Bowman, J. L., Meyerowitz, E. M. Field guide to plant model systems. Cell. 167 (2), 325-339 (2016).
- Müller, B., Grossniklaus, U. Model organisms-a historical perspective. Journal of Proteomics. 73 (11), 2054-2063 (2010).
- Ding, X., et al. Different fruit-specific promoters drive AtMYB12 expression to improve phenylpropanoid accumulation in tomato. Molecules. 27 (1), 317 (2022).
- Niedbała, G., Niazian, M., Sabbatini, P. Modeling agrobacterium-mediated gene transformation of tobacco (Nicotiana tabacum)-a model plant for gene transformation studies. Frontiers in Plant Science. 12, 695110 (2021).
- Kumari, D., Prasad, B., Dwivedi, P. . Genome Editing Platforms in Rice (Oryza sativa L.): Basic methodology and troubleshooting. , (2022).
- Zhang, B. Agrobacterium-mediated transformation of cotton. Transgenic Cotton. , 31-45 (2013).
- Tiwari, R., Singh, A. K., Rajam, M. V. Improved and reliable plant regeneration and Agrobacterium-mediated genetic transformation in soybean (Glycine max L). Journal of Crop Science and Biotechnology. , 1-10 (2022).
- Bakhsh, A. Development of efficient, reproducible and stable Agrobacterium-mediated genetic transformation of five potato cultivars. Food Technology and Biotechnology. 58 (1), 57-63 (2020).
- Bates, R., Craze, M., Wallington, E. J. Agrobacterium-mediated transformation of oilseed rape (Brassica napus). Current Protocols in Plant Biology. 2 (4), 287-298 (2017).
- Hopp, H. E., Spangenberg, G., Herrera-Estrella, L. Plant transformation. Frontiers in Plant Science. 13, 876671 (2022).
- Abdelmuhsin, A. A., Alghamdi, A. A., Ibrahim, N. A. Assessing the phenotypic and genotypic variations of Plantago ciliata in Ha'il region, Saudi Arabia. Entomology and Applied Science Letters. (1), 14-22 (2021).
- Coleman, N. Plantago Lanceolata. Botanical Bulletin. 1 (11), 45 (1876).
- Huang, J., et al. Tissue-specific transcriptomic profiling of Plantago major provides insights for the involvement of vasculature in phosphate deficiency responses. Molecular Genetics and Genomics. 294 (1), 159-175 (2019).
- Penczykowski, R. M., Sieg, R. D. Plantago spp. as models for studying the ecology and evolution of species interactions across environmental gradients. The American Naturalist. 198 (1), 158-176 (2021).
- Pommerrenig, B., et al. Common plantain. A collection of expressed sequence tags from vascular tissue and a simple and efficient transformation method. Plant Physiology. 142 (4), 1427-1441 (2006).
- Bergero, R., Levsen, N., Wolff, K., Charlesworth, D. Arms races with mitochondrial genome soft sweeps in a gynodioecious plant, Plantago lanceolata. Molecular Ecology. 28 (11), 2772-2785 (2019).
- Aalto, E. A., Koelewijn, H. P., Savolainen, O. Cytoplasmic male sterility contributes to hybrid incompatibility between subspecies of Arabidopsis lyrata. G3: Genes, Genomes, Genetics. 3 (10), 1727-1740 (2013).
- Bloch, K. D., Grossmann, B. Digestion of DNA with restriction endonucleases. Current Protocols in Molecular Biology. 3 (1), (1995).
- Du, C., et al. Prokaryotic expression, purification, physicochemical properties and antifungal activity analysis of phloem protein PP2-A1 from cucumber. International Journal of Biological Macromolecules. 194, 395-401 (2022).
- Deshmukh, S. 2. 2., Kulkarni, R., Bose, K. Transformation and protein expression. Textbook on Cloning, Expression and Purification of Recombinant Proteins. , 83-114 (2022).
- Bergkessel, M., Guthrie, C. Colony PCR. Methods in Enzymology. 529, 299-309 (2013).
- Broehan, G., Kroeger, T., Lorenzen, M., Merzendorfer, H. Functional analysis of the ATP-binding cassette (ABC) transporter gene family of Tribolium castaneum. BMC Genomics. 14, 6 (2013).
- Dong, Z., et al. Stable transformation of fluorescent proteins into Nosema bombycis by electroporation. Parasites & Vectors. 15 (1), 141 (2022).
- Li, S., et al. Optimization of Agrobacterium-mediated transformation in soybean. Frontiers in Plant Science. 8, 246 (2017).
- Manimaran, P., et al. Infection of early and young callus tissues of indica rice BPT 5204 enhances regeneration and transformation efficiency. Rice Science. 20 (6), 415-426 (2013).
- Wang, J., Nie, J., Pattanaik, S., Yuan, L. Efficient Agrobacterium-mediated transformation of Artemisia annua L. using young inflorescence. In Vitro Cellular & Developmental Biology-Plant. 52 (2), 204-211 (2016).
- Niazian, M., Belzile, F., Torkamaneh, D. CRISPR/Cas9 in planta hairy root transformation: a powerful platform for functional analysis of root traits in soybean. Plants. 11 (8), 1044 (2022).
- Geng, S., et al. An efficient root transformation system for CRISPR/Cas9-based analyses of shoot-root communication in cucurbit crops. Horticulture Research. 9, (2022).
- Xiao, Y., et al. Efficient Agrobacterium-mediated genetic transformation using cotyledons, hypocotyls and roots of 'Duli'(Pyrus betulifolia Bunge). Scientia Horticulturae. 296, 110906 (2022).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten