Method Article
Transformation génétique médiée par Agrobacterium tumefaciens du plantain à feuilles étroites
Dans cet article
Résumé
En raison de son application polyvalente en tant qu’espèce modèle dans divers domaines d’étude, il existe un besoin pour une boîte à outils de transformation génétique chez le plantain à feuilles étroites (Plantago lanceolata). Ici, en utilisant la transformation médiée par Agrobacterium tumefaciens, un protocole est présenté qui aboutit à des lignées transgéniques stables avec une efficacité de transformation de 20%.
Résumé
Les espèces du genre Plantago ont plusieurs traits uniques qui les ont amenées à être adaptées comme plantes modèles dans divers domaines d’étude. Cependant, l’absence d’un système de manipulation génétique empêche une étude approfondie de la fonction des gènes, limitant la polyvalence de ce genre en tant que modèle. Ici, un protocole de transformation est présenté pour Plantago lanceolata, l’espèce de Plantago la plus couramment étudiée. En utilisant la transformation médiée par Agrobacterium tumefaciens, des racines de 3 semaines de plantes de P. lanceolata cultivées de manière aseptique ont été infectées par des bactéries, incubées pendant 2-3 jours, puis transférées dans un milieu d’induction de pousses avec une sélection d’antibiotiques appropriée. Les pousses ont généralement émergé du milieu après 1 mois et les racines se sont développées 1 à 4 semaines après le transfert des pousses dans le milieu d’induction racinaire. Les plantes ont ensuite été acclimatées à un environnement du sol et testées pour la présence d’un transgène à l’aide du test rapporteur β-glucuronidase (GUS). L’efficacité de transformation de la méthode actuelle est de ~20%, avec deux plantes transgéniques émergeant pour 10 tissus racinaires transformés. L’établissement d’un protocole de transformation du plantain à feuilles étroites facilitera l’adoption de cette plante comme nouvelle espèce modèle dans diverses régions.
Introduction
Le concept d’utilisation d’espèces modèles pour étudier de multiples aspects de la biologie végétale a émergé avec l’utilisation généralisée d’Arabidopsis thaliana1. Arabidopsis a été initialement choisi parce qu’il partage des caractéristiques avec de nombreuses autres plantes à fleurs et possède de multiples caractéristiques qui le rendent pratique à étudier dans un environnement de laboratoire, comme être petit et avoir un cycle de génération court. Le grand volume d’articles de recherche publiés avec lui en tant que sujet, ainsi que sa petite taille de génome et sa facilité de transformation génétique2, lui permettent de persister en tant qu’organisme expérimental largement utilisé. Cependant, Arabidopsis peut être limité en tant que modèle pour des espèces ayant des caractéristiques différentes ou des traits uniques3. Cela a incité le développement de nouveaux systèmes modèles, tels que le maïs (Zea mays), une plante importante pour la génétique du développement chez les monocotylédones4, et la tomate (Solanum lycopersicum), qui est un modèle important pour les études évolutives, le développement des fruits et la production, et est une bonne représentation pour les cultures légumières5. Une méthode de transformation génétique est une condition préalable pour qu’une espèce végétale serve d’organisme modèle2. Une transformation médiée par Agrobacterium tumefaciens est un outil fiable en biologie végétale; il a été utilisé pour transformer quelques espèces modèles et cultures majeures, notamment le tabac (Nicotiana tabacum)6, le riz (Oryza sativa)7, le coton (Gossypium hirsutum)8, le soja (Glycine max)9, la pomme de terre (Solanum tuberosum)10 et le canola (Brassica napus)11. Les espèces végétales sont très variables dans la façon dont elles répondent efficacement à l’infection à A. tumefaciens, et les protocoles de transformation doivent souvent être adaptés individuellement à chaque espèce 6,12.
Le genre Plantago comprend un total de 256 espèces de plantes, largement réparties dans le mondeentier 13. Les espèces de ce genre ont souvent des caractéristiques uniques qui les rendent souhaitables en tant qu’espèces modèles pour l’étude de la génétique, de l’écologie, de la physiologie du stress, des métabolites secondaires, de la chimie médicinale, des interactions plantes-microbes, du développement des plantes et de l’évolution. Plantago lanceolata , également appelé plantain, est une plante d’intérêt populaire depuis le 19èmesiècle , date à laquelle il a été utilisé pour la première fois pour décrire le phénomène de stérilité masculine14. Comme d’autres plantes de son genre, il a été utilisé dans des études dans divers domaines de recherche. Plus récemment, il a été proposé comme modèle pour la biologie vasculaire, car son tissu vasculaire peut être collecté facilement15. P. lanceolata est l’espèce la plus étudiée du genre Plantago. un article de 2021 indiquait qu’il y avait > 1 400 publications incluant ou relatives à cette espèce à ce moment-là,16, et 102 articles supplémentaires ont été publiés depuis le début de 2022, selon une recherche PubMed effectuée le 9décembre 2022. La deuxième plante la plus étudiée du genre, P. major, ne fait l’objet que de 414 articles lorsqu’elle est recherchée en utilisant les mêmes critères à la même date.
Malgré l’intérêt de la recherche pour P. lanceolata, les études, en particulier sur la caractérisation de la fonction des gènes, sont souvent limitées par l’absence d’une boîte à outils de manipulation génétique pour l’espèce. Pommerrienig et al. se sont efforcés d’élaborer un protocole de transformation pour P. major à l’aide d’une technique de trempage floral17. Cependant, cette méthode ne peut être appliquée à P. lanceolata en raison de la stérilité mâle caractéristique de cette espèce18,19. À notre connaissance, il n’existe pas de protocole pour la transformation de P. lanceolata.
Cette étude présente un protocole simple pour la transformation de P. lanceolata médiée par A. tumefaciens. En ciblant les tissus racinaires, des plantes transgéniques entièrement développées peuvent être générées dans les 3 mois suivant la transformation.
Protocole
NOTA: Les étapes 1.4-1.8, 2.3-2.5, 3.3-3.6, 4.1-4.6, 5.1-5.7 et 6.1-6.3 doivent être effectuées dans des conditions aseptiques, en utilisant une hotte propre pour éviter toute contamination.
1. Propagation du matériel végétal en vue de sa transformation
- Placer les graines de Plantago lanceolata de type sauvage (WT) disponibles dans le commerce (voir le tableau des matières) dans un tube à centrifuger de 50 ml jusqu’à la ligne de 5 ml, selon le nombre de plantes désirées.
REMARQUE : Un tube microcentrifuge de 2 mL peut également être utilisé lorsqu’un petit nombre de graines est nécessaire, mais il doit être rempli à un volume ne dépassant pas 0,1 mL, car trop de graines peut réduire l’efficacité de la stérilisation. - Plongez les graines dans de l’éthanol à 75% pendant 60 s.
- Jeter l’éthanol, puis immerger les graines dans de l’hypochlorite de sodium à 20% (20% de NaClO, 80% d’eau stérile) pendant 40 min, en retournant doucement le tube pour que toutes les graines entrent en contact avec la solution.
REMARQUE: La solution d’hypochlorite de sodium doit être fraîchement préparée pour des résultats optimaux. - Sous une hotte à flux laminaire, jeter la solution d’hypochlorite de sodium, puis laver les graines avec de l’eau distillée (cinq fois). Ajoutez un petit volume d’eau aux graines après le rinçage final, car cela peut aider à faciliter le mouvement des plantes sur les assiettes.
- À l’aide de pinces stérilisées, transférer les graines sur des boîtes de Petri de 95 mm x 100 mm préparées à l’avance avec un milieu solide de SEP (tableau 1). Répartir les graines uniformément sur la surface de la plaque, avec environ 1 cm entre chaque graine pour éviter le surpeuplement des plantules germées (figure 1A).
- Sceller les plaques avec deux couches de film de paraffine pour éviter la contamination, puis incuber sous une lampe de culture blanche froide (voir le tableau des matériaux) à température ambiante (22 °C avec 50 μmol m-2 s-1, 12 h jours). Les graines germent généralement dans les 5-6 jours.
- Lorsque les plantules ont germé et sont assez grosses pour être transférées (figure 1B), habituellement 2 ou 3 jours après la germination, utilisez des pinces stérilisées pour transférer les plantules dans des boîtes stériles contenant 50 à 100 ml de milieu de SP (tableau 1). Idéalement, plantez seulement cinq plants par boîte pour obtenir des racines de la meilleure qualité.
- Scellez les boîtes avec du ruban chirurgical, puis laissez les plantes pousser sous une lumière de culture blanche et froide (voir le tableau des matériaux), dans les mêmes conditions que celles mentionnées à l’étape 1.6. Les plantes devraient être prêtes pour la transformation dans environ 3-4 semaines, ou lorsque les racines principales ont atteint environ 2 cm de longueur et que les racines latérales apparaissent blanches.
REMARQUE : Les recettes de préparation moyenne et les stocks de vitamines sont inclus dans les tableaux 1 et 2.
2. Construction plasmidique et transformation d’E. Coli
REMARQUE: La procédure exacte de construction plasmidique varie en fonction du gène d’intérêt. Dans cette procédure, les enzymes de restriction HindIII et SalII ont été utilisées pour insérer le promoteur AtPP2 de 1,5 kb dans le plasmide binaire pBI101 (voir le tableau des matériaux) avec GUS, en utilisant la procédure de clonage standard20. AtPP2 (phloème protein 2) est un gène spécifiquement exprimé dans le phloème21.
- Cloner le promoteur en utilisant les paires d’amorces 5'-AGTCAAGCTTCAAGTCCCTGTGGCTACTGAAC-3' (avant) et 5'-AGTCGTCGACAAACCAGTATGATGTATTTATTTTTG-3' (revers) d’Arabidopsis. La figure 2 montre un diagramme du vecteur plasmidique binaire avec l’insert AtPP2:GUS .
- Après la construction plasmidique, transformer les plasmides en cellules compétentes DH5a E. coli (voir tableau des matériaux) en utilisant la méthode du choc thermique22, puis incuber pendant 1,5 h à 37 °C en agitant (150 tr/min).
- Prélever 150 μL de chaque culture de transformation, plaquer sur des plaques de milieu gélose LB (tableau 1) avec la sélection appropriée (50 mg/L de kanamycine pour la souche utilisée dans ce protocole; voir le tableau des matériaux), puis incuber les plaques pendant 16-24 h à 37 °C.
REMARQUE : La souche bactérienne utilisée dans cette étude est A. tumefaciens GV3101. - Ensuite, utilisez la PCR des colonies pour dépister les colonies pour les recombinants positifs23.
REMARQUE : Dans ce protocole, les amorces suivantes ont été utilisées pour amplifier le gène ciblé ; 5'-ATGTTACGTCCTGTAGAAACCCCAA-3'(avant) et 5'-TCATTGTTTGCCTCTGCTGC-3' (arrière).- Exécuter la réaction dans un thermocycleur (voir le tableau des matériaux) avec des conditions de cyclage de 3 min à 95 °C, suivies de 35 cycles de : 30 s à 95 °C, 30 s à 55 °C, 2 min à 72 °C et une dernière étape d’allongement de 10 min à 72 °C.
- Inoculer les colonies positives dans 6 mL de bouillon LB (tableau 1) avec l’antibiotique approprié (50 mg/L de kanamycine) et augmenter à 37 °C pendant la nuit, à 200-250 rpm.
- Après une croissance nocturne, extraire les plasmides des bactéries en utilisant les procédures standard24.
3. Transformation d’A. tumefaciens avec plasmide
- Après l’extraction plasmidique, utilisez l’électroporation pour transformer le plasmide modifié en la souche désirée de cellules compétentes. Dans cette procédure, la souche GV3101 de A. tumefaciens a été utilisée. Suivre des méthodes normalisées pour les techniques d’électroporation25.
- Après électroporation, remettre en suspension les cellules compétentes dans 1 mL de bouillon LB, puis incuber pendant 2-4 h à 28 °C à 100 rpm.
- Recueillir les cellules par centrifugation à 6 800 x g pendant 3 minutes dans une microcentrifugeuse de table (voir le tableau des matériaux) à température ambiante (22 °C), puis étaler 50 à 100 μL sur une plaque de gélose LB avec un agent de sélection approprié (50 mg/L de kanamycine pour le plasmide utilisé dans ce protocole).
- Après l’incubation des cellules pendant 2 jours à 28 °C, identifier les colonies positives contenant le gène d’intérêt grâce à l’utilisation de la PCR des colonies. Dans ce protocole, utilisez les amorces et les conditions mentionnées à l’étape 2.4.
- Ensuite, utilisez les colonies positives pour strier une plaque de stock avec LB agar media + selection. La plaque peut être conservée à 4 °C jusqu’à 1 mois.
- Alternativement, pour un stockage à long terme, inoculer une colonie positive avec un petit volume de LB avec une sélection appropriée. Agiter la culture inoculée pendant une nuit à 28 °C à 200 tr/min, puis préparer un stock de glycérol (50 % p/v de glycérol dans un mélange 50:50 de bactéries et de glycérol), qui peut être conservé à -80 °C jusqu’à 10 ans.
4. Préparation d’A. tumefaciens
- Stries A. tumefaciens contenant le plasmide désiré sur des plaques LB solides préparées de 95 mm x 100 mm avec l’agent de sélection approprié. Dans ce protocole, la souche bactérienne GV3101 avec l’insert plasmidique AtPP2:GUS a été utilisée, avec 50 mg/L de kanamycine ajoutée pour la sélection.
- Sceller les plaques avec un film de paraffine, puis incuber à 28 °C pendant 48 h ou jusqu’à ce que les bactéries deviennent suffisamment grosses pour être cueillies.
- Utilisez un embout de pipette pour prélever une colonie de bactéries 2 jours avant la transformation et inoculez-la dans un tube à fond rond de 15 ml contenant 6 ml de LB liquide avec une sélection appropriée. Agiter à 200 tr/min dans un agitateur de table à 28 °C pendant une nuit, jusqu’à ce que le diamètre de600 atteigne 0,6-0,7.
REMARQUE : Les plaques et l’inoculation bactérienne de 6 mL peuvent être conservées à 4 °C jusqu’à 1 mois. - Lorsque les bactéries atteignent la bonne DO 600, utiliser une pipette pour transférer A. tumefaciens dans une fiole stérile contenant100 mL de LB liquide avec un agent de sélection. En règle générale, 200 μL de bactéries par 100 mL de LB conviennent à la propagation. Agiter à 200 tr/min à 28 °C pendant une nuit, jusqu’à ce que le diamètre de600 atteigne 0,6-0,7.
- Transférer les bactéries dans des tubes à centrifuger stériles de 50 ml et centrifuger à 2 200 xg pendant 10 minutes à température ambiante (22 °C) dans une centrifugeuse de table pour recueillir les bactéries.
- Jeter le surnageant à l’aide d’une pipette. Remettez en suspension la pastille bactérienne dans 5 mL de solution de suspension liquide (SS) à température ambiante (22 °C) (tableau 1) par pipetage, puis ajoutez jusqu’à 50 mL de SS et retournez plusieurs fois pour mélanger. La bactérie est maintenant prête pour la transformation.
NOTE: Le SS liquide doit être préparé frais, dans la semaine 1 suivant la transformation.
MISE EN GARDE : Tout matériel qui entre en contact avec A. tumefaciens doit être jeté dans une poubelle à déchets présentant un risque biologique. Les restes liquides de cultures bactériennes peuvent être stérilisés avec de l’hypochlorite de sodium (eau de Javel) à une concentration de 20 % ou plus.
5. Transformation des racines de Plantago
- Lorsque les plantes atteignent le stade idéal de transformation (les semis ont 3 semaines) (figure 1C), utilisez des pinces et des ciseaux stériles pour séparer les racines du reste de la plante (figure 3A). Jeter la feuille et le matériau de la tige.
- Immédiatement après la coupe, transférer les morceaux de racines dans des boîtes stériles contenant de l’eau stérile à l’aide de pinces stériles. Cette étape permet aux racines de rester hydratées pendant que tous les tissus sont collectés.
- Lorsque toutes les racines sont coupées, verser la suspension A. tumefaciens/SS dans des boîtes de Petri jetables stériles de 150 mm x 15 mm. Transvaser les racines dans la culture A. tumefaciens et inoculer pendant au moins 20 minutes (figure 3B).
- Pendant l’incubation, utilisez un scalpel stérile avec une lame tranchante pour couper les racines en fragments de 1 cm, en séparant les racines primaires des racines latérales. Faites des coupes minces et peu profondes à la surface des racines pour permettre aux bactéries d’infecter la plante.
REMARQUE: Si vous avez affaire à un grand nombre de plantes, transférez les morceaux de racines dans la culture bactérienne par lots, pour vous assurer que toutes les racines sont immergées pendant l’inoculation. - Après l’incubation, utilisez les pinces stériles pour transférer les morceaux de racines dans des serviettes en papier stériles afin d’éliminer l’excès de bactéries. Évitez de sécher les racines pendant plus de 60 s, car cela peut provoquer une déshydratation et endommager le tissu racinaire. Idéalement, 10 à 15 racines peuvent être séchées simultanément (figure 3C).
- Transférer les racines séchées dans des boîtes de Petri préparées de 95 mm x 15 mm avec des milieux de coculture solides (tableau 1), environ 10 à 20 racines par assiette, selon la taille des racines (figure 3D).
- Scellez les plaques avec deux couches de film plastique transparent, puis recouvrez de papier d’aluminium. Incuber à température ambiante (22 °C) pendant 3 jours. Cette étape laisse le temps aux bactéries d’infecter les racines sans la présence d’une sélection d’antibiotiques (Figure 3E).
6. Sélection et régénération de plantes entières
- Après l’incubation dans des milieux de coculture, transférer les morceaux de racines dans des boîtes de Petri préparées de 95 mm x 15 mm avec des milieux d’induction de pousses solides (SIM) (tableau 1) avec de la timentine (500 mg/L; voir le tableau des matériaux) et une sélection appropriée d’antibiotiques. Dans ce protocole, nous avons utilisé la kanamycine (100 mg/L).
NOTE: Le bas des racines doit entrer en contact complet avec le milieu. Les racines qui ne touchent pas la surface du milieu sont trop longues et doivent être coupées pour éviter que le tissu n’échappe à la sélection. - Scellez les plaques avec deux couches de film plastique transparent, puis cultivez sous une lampe de culture pendant 1 mois (voir étape 1.6 pour les conditions appropriées), ou jusqu’à ce que les pousses commencent à émerger.
REMARQUE: En règle générale, les initiales des pousses peuvent être observées après 2 semaines de croissance, et les pousses sont généralement visibles après 1 mois. - Lorsque les plantules mesurent de 1,5 à 2,0 cm de long (figure 1D), transférez-les dans des boîtes stériles préparées avec un milieu d’induction racinaire solide (tableau 1).
- Cultivez les plantes sous une lumière de culture (voir l’étape 1.6 pour connaître les conditions) pendant plusieurs semaines, jusqu’à ce que les racines se forment. Les racines peuvent généralement être vues pour la première fois après 1 semaine.
REMARQUE: Il est recommandé de laisser pousser les racines pendant plusieurs semaines avant de se déplacer vers le sol, car les plantes ayant un système racinaire plus gros ont tendance à avoir un taux de survie plus élevé dans le sol.
7. Transfert de sol
- Lorsque les systèmes racinaires sont devenus assez gros pour être transférés (figure 1E), généralement après 1 mois de croissance, transférer les plantes dans 3,5 dans des pots carrés contenant de la terre tout usage pré-mouillée (BM7). Dans ce protocole, un mélange d’écorce BM7 a été utilisé (voir le tableau des matériaux).
- Enlevez tout milieu qui colle aux racines en les lavant doucement à l’eau.
NOTE: Les plantes peuvent être cultivées jusqu’à maturité dans une serre à 800 à 1400 μmol photons m-2 s-2 en utilisant des lampes à haute pression de sodium de 600 W (voir le tableau des matériaux), ou dans une chambre de croissance à température ambiante (22 ° C) avec des lumières blanches froides à 50 μmol m-2 s-1, 12 h jours.
- Enlevez tout milieu qui colle aux racines en les lavant doucement à l’eau.
- Couvrez les plantes avec un terreau en plastique, puis couvrez-les avec un sac en plastique transparent. Cette étape permet aux plantes de rester dans un environnement humide pendant qu’elles s’adaptent au sol.
- Après environ 3 à 5 jours, retirez le sac en plastique, puis retirez lentement le couvercle pour permettre l’acclimatation à l’environnement extérieur.
NOTE: Selon la période de l’année et l’environnement dans lequel les plantes sont transférées, le temps que les plantes doivent s’adapter peut varier. Il est recommandé de vérifier les plantes quotidiennement et d’ajouter de l’eau aux pots au besoin. - Arrosez les plantes régulièrement et ajoutez de l’engrais au besoin. Les plantes peuvent également être transférées dans des pots plus grands pour une croissance ultérieure (Figure 1F).
8. Coloration histochimique de la β-glucuronidase (GUS)
- Préparer la solution de coloration β-glucuronidase (GUS), conformément aux protocoles publiés15.
- Lorsque les initiales des pousses mesurent environ 0,5 à 1 cm de long, retirer une petite extrémité d’une jeune feuille complètement expansée (<5 mm de longueur est généralement suffisante) et transférer immédiatement dans 0,5 à 1 mL de solution de coloration GUS dans un tube microcentrifuge de 1,5 ou 2 mL. La solution doit couvrir entièrement le tissu végétal.
- Placer les tubes ouverts dans un dessiccateur à vide et vide à 20-25 kPa pendant 5-10 min. De petites bulles doivent être visibles dans la solution pendant la procédure de vide. Cela permet à la solution d’entrer dans les cellules de la plante.
- Laissez l’air filtrer à nouveau dans le dessiccateur sous vide. Fermer les tubes et incuber à 37 °C pendant une nuit (12 h), ou jusqu’à ce que la couleur bleue soit visible.
REMARQUE: Dans cette étude, l’activité GUS a été localisée au phloème, ce qui signifie que chez les plantes transformées positivement, la coloration bleue ne devrait être visible que dans le tissu du phloème. Les plantes sans transgène ne subissent pas de coloration (Figure 4). - Pour mieux visualiser la tache, transférez les plantes à 100% éthanol pour éliminer la chlorophylle. Pour augmenter l’efficacité du processus d’élimination de la chlorophylle, incuber les tubes à 60 °C pendant 10 min.
REMARQUE: L’éthanol peut devoir être changé plusieurs fois avant que toute la chlorophylle ne soit enlevée, selon la taille de la feuille colorée.
Résultats
Un protocole simple est rapporté ici pour obtenir des plantes transgéniques de P. lanceolata en utilisant une transformation médiée par A. tumefaciens. Le gène rapporteur GUS (codant β-glucuronidase) est transformé, entraîné par le promoteur exprimé par le phloème de l’AtPP2, en racines de P. lanceolata âgées de 3 semaines par la souche GV3101 d’A. tumefaciens (Figure 2). Un promoteur spécifique au phloème a été choisi parce que notre intérêt principal était d’établir un système pour la génomique fonctionnelle des tissus vasculaires végétaux, en particulier le phloème. La méthode a été testée sur les racines, les feuilles et les tissus pétiolaires dans l’expérience préliminaire. Bien que les callosités puissent être induites dans tous les types de tissus, seul le tissu racinaire produisait des initiales de pousses (figure 5A) après 1 mois dans la SIM; la feuille et le pétiole sont devenus bruns et sont morts (figure 5B). Cela a conduit à la conclusion que le tissu racinaire était le type de tissu optimal pour une utilisation dans la méthode de transformation. Les racines ont été incubées dans les bactéries préparées remises en suspension (SS) (tableau 1) pendant au moins 20 minutes, puis incubées à température ambiante sur des plaques de SS solides jusqu’à 3 jours dans l’obscurité (Figure 3E). Les racines ont ensuite été transférées dans le milieu d’induction des pousses (SIM) et conservées sous une lampe de culture, dans les conditions indiquées dans le protocole (étape 1.6). La figure 1 et la figure 3 montrent des images représentatives de chaque étape du protocole à titre de référence.
La figure 6 montre la progression des initiales des pousses émergeant du tissu transformé, depuis le premier jour où les racines ont été placées sur le SIM (figure 6A) jusqu’au moment où les pousses étaient prêtes à être enracinées (figure 6D). Après 1 semaine, le tissu racinaire a formé des callosités (Figure 6B) et les initiales des pousses ont pu être observées (Figure 6B1). Les pousses ont continué à émerger pendant les semaines 2 et 3 (figure 6C), et après 4 semaines, les pousses étaient prêtes à être transférées dans le milieu d’induction racinaire (figure 6D).
L’identification des plantes transgéniques présumées a été réalisée à l’aide du test histochimique de la β-glucuronidase (GUS), en utilisant des segments de feuilles prélevés une fois que les pousses mesuraient environ 0,5 cm de long. Les plantes transgéniques positives ont montré le schéma de coloration attendu dans le tissu localisé du phloème, démontré à la figure 4. Les pousses positives colorées GUS ont été transférées dans le milieu d’induction racinaire, dans lequel elles ont développé des systèmes racinaires robustes après 4 semaines (Figure 1E). Les plantes enracinées ont ensuite été transférées au sol. La figure 4 montre le résultat de la coloration chez un plantain à feuilles étroites transformé avec le promoteur AtPP2 et le gène β-glucuronidase (GUS), ainsi qu’un plantain de type sauvage et un plantain à feuilles étroites transformés avec le promoteur AtPP2 , à des fins de comparaison. Toutes les pousses qui ont émergé ont été confirmées comme transgéniques. L’efficacité de la transformation a été déterminée à une moyenne de 20 %, avec environ deux pousses émergeant pour 10 racines transformées. Les plantes transgéniques confirmées ont été transférées dans des pots plus grands et cultivées pendant 4 à 8 semaines jusqu’à ce qu’elles atteignent le stade adulte (figure 1F).
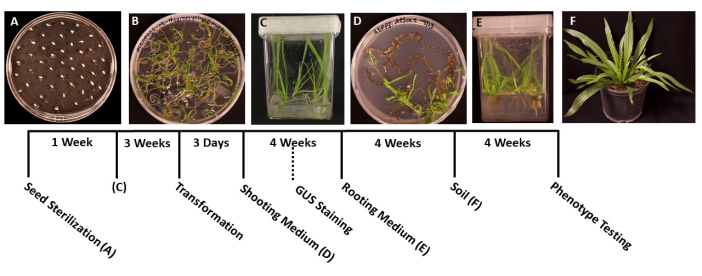
Figure 1 : Chronologie de la transformation de Plantago lanceolata. Images représentatives de chaque étape du protocole. (A) Graines non germées plaquées sur une plaque MS. (B) Graines germées après 1 semaine, prêtes à être transférées dans des boîtes magenta. (C) Plantes dans des boîtes MS après 3 semaines de croissance. Les racines sont vertes et saines, au stade idéal pour la transformation. (D) Les pousses dans le milieu d’induction des pousses après 4 semaines sont prêtes à être transférées dans le milieu d’enracinement. À ce stade, une coloration histochimique β-glucuronidase (GUS) peut être effectuée, le cas échéant. (E) Plantes dans des boîtes avec milieu d’induction racinaire, où les racines se sont formées après 4 semaines de croissance. (F) Les plantes transgéniques sont cultivées sur toute leur longueur après 4 semaines de croissance dans le sol. Veuillez cliquer ici pour voir une version agrandie de cette figure.
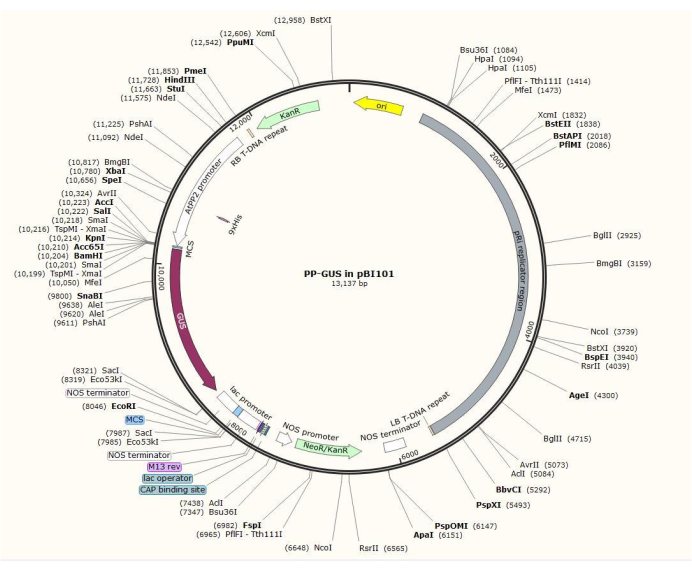
Figure 2 : Schéma du plasmide vectoriel binaire pBI101 + β-glucuronidase (GUS) avec le promoteur spécifique du phloème AtPP2 inséré. Veuillez cliquer ici pour voir une version agrandie de cette figure.
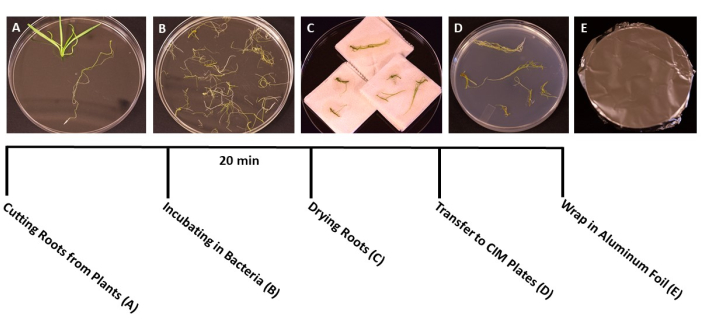
Figure 3 : Étapes de transformation. Des images représentatives de chaque étape de la transformation. (A) Séparer les racines des pousses pendant la transformation. (B) Trempage des racines dans une suspension bactérienne/SS. (C) Séchage des racines sur des serviettes en papier pour éliminer l’excès de bactéries. (D) Racines plaquées sur milieu de coculture. E) Plaques SS enveloppées dans du papier d’aluminium. Les plantes ont été incubées pendant 2-3 jours avant d’être transférées dans le milieu de prise de vue. Veuillez cliquer ici pour voir une version agrandie de cette figure.
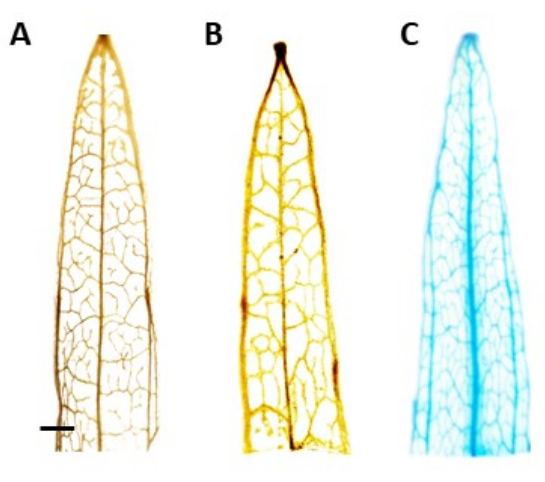
Figure 4 : Coloration par GUS. Résultats de la coloration par la β-glucuronidase (GUS) des segments de feuilles de plantain à feuilles étroites. (A) Type sauvage. (B) Plantain à feuilles étroites transformé avec le plasmide qui abrite le promoteur AtPP2 (vecteur vide). (C) Plantain à feuilles étroites transformé avec le plasmide qui abrite le promoteur AtPP2 et le gène β-glucuronidase (GUS). Chaque feuille a été colorée à l’aide du protocole de coloration histochimique GUS, puis imagée avec une caméra microscopique. Les images (B) et (C) ne montrent aucun motif de coloration en raison de l’absence du gène GUS. L’image de droite montre un motif de coloration bleu clair dans les veines, confirmant que les plantes sont transgéniques. La barre représente 1 mm, chaque segment de feuille mesurant environ 1 cm de longueur. Veuillez cliquer ici pour voir une version agrandie de cette figure.
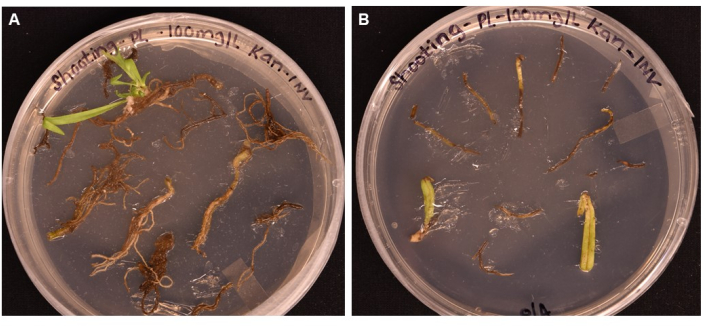
Figure 5 : Comparaison de l’efficacité de transformation de différents types de tissus après >1 mois d’incubation sur des milieux de prise de vue. (A) Tissus racinaires après plus de 1 mois de croissance. Les racines ont connu une hypertrophie et les initiales des pousses ont émergé. Les callosités non transformées ont commencé à mourir en réponse à la sélection d’antibiotiques. (B) Tissus foliaires et pétiolaires après plus de 1 mois de croissance. Les tissus ont connu une certaine expansion des callosités, mais sont rapidement morts en réponse à l’antibiotique. Aucune pousse n’a émergé de l’un ou l’autre tissu. Veuillez cliquer ici pour voir une version agrandie de cette figure.
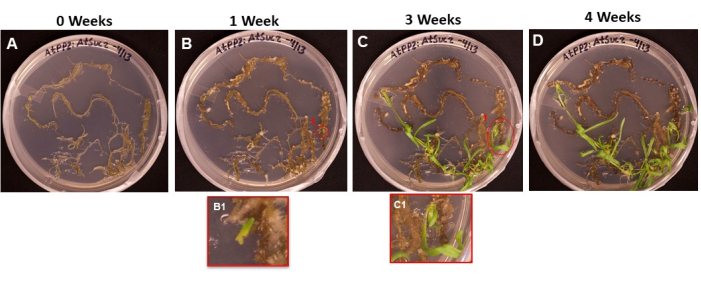
Figure 6 : Émergence de cals et de pousses sur les tissus transformés. Images représentatives de tissus placés sur un support de prise de vue après différentes durées d’incubation. (A) Tissus racinaires juste après avoir été plaqués sur le milieu de prise de vue. (B) Tissus racinaires après 1 semaine sur milieu de prise de vue. L’expansion des callosités peut être observée et (B1) les initiales des premières pousses ont commencé à émerger. (C) Tissus racinaires après 3 semaines sur milieu de prise de vue. D’autres initiales de tir ont émergé. (C1) La pousse qui a émergé de la prise de vue initiale B1. (D) Tissus racinaires après 4 semaines d’incubation. Les tissus non transformés ont commencé à devenir noirs/bruns et à mourir, et les pousses émergentes continuent de croître. À ce stade, les pousses sont prêtes à être déplacées vers le milieu d’enracinement. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Tableau 1 : Recettes de préparation des médias. Une description de la façon de préparer les médiums à la transformation. La quantité de vitamines ajoutée est calculée en fonction de la concentration indiquée de la solution mère. Voir le tableau 2 pour la préparation de la solution mère de vitamines. Pour tous les milieux, ajouter des réactifs à 900 mL deH2Obidistillé, pH au niveau indiqué, puis ajouter de l’eau jusqu’à un volume final de 1 000 mL. * = ajouter après stérilisation. ** = pH avec 1 M KOH. = pH avec 1 M NaOH. Veuillez cliquer ici pour télécharger ce tableau.
Tableau 2 : Stocks de vitamines pour les milieux Plantago . Toutes les vitamines doivent être stérilisées par filtre et étiquetées avec précision avant d’être stockées. Lorsque cela est indiqué, dissoudre d’abord les poudres dans 1 N NaOH, puis compléter le volume désiré avec duH2Obidistillé. Veuillez cliquer ici pour télécharger ce tableau.
Discussion
L’absence de protocole de transformation pour les plantes du genre Plantago limite l’utilisation de ces plantes comme modèles, en particulier lorsque les chercheurs s’intéressent à l’exploration des fonctions des gènes. P. lanceolata a été choisi pour développer un protocole de transformation génétique car c’est la plante la plus étudiée de son genre16. Le protocole qui a été élaboré sera probablement utilisé comme un outil pour faire avancer les études liées à la biologie vasculaire, à l’écologie, aux interactions plantes-insectes et à la physiologie du stress abiotique.
Le protocole présenté décrit clairement les étapes qui permettent à un utilisateur d’obtenir des plantes transgéniques. Outre la capacité de P. lanceolata à prospérer dans un environnement de culture tissulaire, de multiples facteurs ont contribué au succès de notre méthode de transformation. Tout d’abord, l’importance d’utiliser des tissus racinaires végétaux stériles de haute qualité pour la transformation a été observée. Les racines avaient les taux de transformation les plus élevés lorsqu’elles étaient prélevées sur des plantes âgées de 3 à 4 semaines et apparaissaient vertes ou blanc pâle. Les racines prélevées dans des boîtes présentant une contamination bactérienne ou fongique quelconque ont souvent entraîné la contamination des cultures de pousses, et les racines plus âgées qui semblaient brunes n’ont pas abouti à une transformation réussie. Le tissu racinaire était le type de tissu le plus efficace pour la transformation en utilisant la méthode actuelle, car les tissus foliaires et pétiolaires n’ont pas réussi à développer des pousses.
Une autre observation importante était que la méthode optimale pour prélever du tissu racinaire en vue de sa transformation consistait à placer le matériel racinaire fraîchement coupé dans de l’eau stérile. Cette étape a permis au matériel racinaire de rester hydraté pendant que le reste du tissu était recueilli, car les racines ont tendance à se dessécher rapidement lorsqu’elles sont retirées de leurs récipients de croissance. Cette étape a également permis d’augmenter le taux de réussite de la transformation, car elle a permis d’incuber plus de racines dans les bactéries en même temps.
Ce protocole pourrait être modifié en diminuant le temps d’incubation du tissu racinaire dans le milieu de co-culture à 2 jours. Il a été observé qu’une période d’incubation de 2 ou 3 jours est suffisante pour permettre une infection qui entraîne des initiales de pousse. Cependant, des temps d’incubation plus longs ne sont pas recommandés, car il a été observé que l’absence d’un inhibiteur antibiotique dans les milieux entraîne souvent une prolifération d’A. tumefaciens , ce qui peut tuer les tissus émergents.
Une limite de cette étude est le manque de données disponibles sur la performance d’autres méthodes ou espèces d’A. tumefaciens dans la transformation de P. lanceolata à des fins de comparaison. À notre connaissance, ce protocole est nouveau. Au cours des essais initiaux, une efficacité de transformation élevée a été notée avec A. tumefaciens GV3101, et nous nous sommes concentrés sur le raffinement de la technique en utilisant cette souche au lieu d’expérimenter avec d’autres souches. Notre efficacité de transformation de 20% est relativement élevée pour la transformation de l’usine - de nombreuses méthodes conventionnelles considèrent que tout >1% est un succès26,27,28. Cependant, l’utilisation d’une autre souche d’A. tumefaciens, telle que A. rhizogenes, connue pour son utilisation dans la transformation racinaire chez plusieurs espèces 29,30,31, peut entraîner un taux de réussite encore plus élevé. D’autres expériences seraient nécessaires pour évaluer l’impact de l’utilisation d’autres souches afin de promouvoir une efficacité accrue de transformation chez P. lanceolata.
La transformation réussie de P. lanceolata profitera probablement à de nombreux domaines d’études. L’efficacité de transformation élevée et la croissance rapide de la plante dans les milieux de culture tissulaire font de P. lanceolata un candidat réalisable pour les études de la fonction génique15.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce travail a été soutenu par la National Science Foundation (EDGE IOS-1923557 à C.Z. et Y.Z.).
matériels
| Name | Company | Catalog Number | Comments |
| 14 mL Round Bottom TubeA4A2:A34 | ThermoFisher Scientific | 150268 | |
| 1-Naphthylacetic acid | Gold Biotechnology | N-780 | |
| 3M Micropore Surgical Paper Tape | ThermoFisher Scientific | 19-027761 | |
| 50 mL Centrifuge Tubes | Research Products International Corp. | 163227LC | |
| 600 Watt High Pressure Sodium Lights | Plantmax | PX-LU600 | |
| 6-Benzylaminopurine (6-BAP) | Gold Biotechnology | B-110 | |
| Aluminum Foil | ThermoFisher Scientific | 01-213-100 | |
| Bacto Agar | Thermofisher Scientific | 214010 | |
| Binary Plasmid pBI101 | Clontech, USA | 632522 | |
| Cool White Grow Light Sylvania LLC | Home Depot | 315952205 | |
| D-biotin | ThermoFisher Scientific | BP232-1 | |
| ddH2O | |||
| DH5a E. coli | Invitrogen, USA | 18258012 | |
| Disposable Petri Dishes, Sterile 150 x 16 mm | ThermoFisher Scientific | FB0875712 | |
| Disposable Petri Dishes, Sterile 95 x 15 mm | ThermoFisher Scientific | FB0875714G | |
| Dissecting Scissors | Leica Biosystems | 38DI12044 | |
| Ethanol 200 Proof | Decon Labs | 2705 | |
| Folic Acid | Fisher Scientific | BP2519-5 | |
| Forceps | Leica Biosystems | 38DI18031 | |
| Gelrite | Research Products International Corp. | G35020-1000 | |
| Glycerol | ThermoFisher Scientific | 17904 | |
| Glycine | Sigma | 241261 | |
| Incubated Tabletop Orbital Shaker | ThermoFisher Scientific | SHKE420HP | |
| Indole-3-Acetic Acid (IAA) | Gold Biotechnology | I-110 | |
| Indole-3-Butyric Acid (IBA) | Gold Biotechnology | I-180 | |
| Kanamycin Monosulfate | Gold Biotechnology | K-120 | |
| Macrocentrifuge | ThermoFisher Scientific | 75007210 | |
| Magenta Boxes | ThermoFisher Scientific | 50255176 | |
| Micro Pipet Tips 1000 µL | Corning | 4140 | |
| Micro Pipet Tips 200 µL | Corning | 4138 | |
| Micro Pipette Tips 10 µL | Corning | 4135 | |
| Microcentrifuge | ThermoFisher Scientific | 75002410 | |
| Micropipettor 0.5-10 µL | Corning | 4071 | |
| Micropipettor 100-1000 µL | Corning | 4075 | |
| Micropipettor 20-200 µL | Corning | 4074 | |
| Micropipettor 2-20 µL | Corning | 4072 | |
| Murashige & Skooge Basal Medium with Vitamins | PhytoTech | M519 | |
| Murashige & Skooge Basal Salt Mixture | PhytoTech | M524 | |
| myo-Inositol | Gold Biotechnology | I-25 | |
| Nicotinic acid | Sigma | N0761-100g | |
| Parafilm (paraffin film) | ThermoFisher Scientific | S37440 | |
| Potassium Hydroxide (KOH) | Research Products International Corp. | P44000 | |
| Pyridoxine HCl | Sigma | P6280-10g | |
| Scalpel Blade Handle | Leica Biosystems | 38DI36419 | |
| Scalpel Blades | Leica Biosystems | 3802181 | |
| Sodium Chloride, Crystal (NaCl) | Mallinckrodt Chemicals | 7581-06 | |
| Sodium Hydroxide (NaOH) | Research Products International Corp. | S24000 | |
| Sodium Hypochlorite | Walmart | 23263068401 | |
| Soil- Bark Mix | Berger, USA | BM7 | |
| Square Pots (3.5 inches squared) | Greenhouse Megastore | CN-TRK-1835 | |
| Sucrose | Research Products International Corp. | S24060 | |
| Thermocycler | ThermoFisher Scientific | A24811 | |
| Thiamine HCl | Sigma | T4625-5G | |
| Timentin Ticarcillin/Clavulanate (15/1) (Timentin) | Gold Biotechnology | T-104 | |
| trans-Zeatin Riboside (ZR) | Gold Biotechnology | Z-100 | |
| Tryptone | Thermofisher Scientific | 211705 | |
| Wild Type Plantago lanceolata seeds | Outsidepride Seed Source, OR, USA | F1296 | Outsidepride.com |
| Yeast Extract Granulated | Research Products International Corp. | Y20025-1000 |
Références
- Koornneef, M., Meinke, D. The development of Arabidopsis as a model plant. The Plant Journal. 61 (6), 909-921 (2010).
- Bragg, J. N., Anderton, A., Nieu, R., Vogel, J. P. Brachypodium distachyon. Agrobacterium Protocols. , 17-33 (2015).
- Chang, C., Bowman, J. L., Meyerowitz, E. M. Field guide to plant model systems. Cell. 167 (2), 325-339 (2016).
- Müller, B., Grossniklaus, U. Model organisms-a historical perspective. Journal of Proteomics. 73 (11), 2054-2063 (2010).
- Ding, X., et al. Different fruit-specific promoters drive AtMYB12 expression to improve phenylpropanoid accumulation in tomato. Molecules. 27 (1), 317 (2022).
- Niedbała, G., Niazian, M., Sabbatini, P. Modeling agrobacterium-mediated gene transformation of tobacco (Nicotiana tabacum)-a model plant for gene transformation studies. Frontiers in Plant Science. 12, 695110 (2021).
- Kumari, D., Prasad, B., Dwivedi, P. . Genome Editing Platforms in Rice (Oryza sativa L.): Basic methodology and troubleshooting. , (2022).
- Zhang, B. Agrobacterium-mediated transformation of cotton. Transgenic Cotton. , 31-45 (2013).
- Tiwari, R., Singh, A. K., Rajam, M. V. Improved and reliable plant regeneration and Agrobacterium-mediated genetic transformation in soybean (Glycine max L). Journal of Crop Science and Biotechnology. , 1-10 (2022).
- Bakhsh, A. Development of efficient, reproducible and stable Agrobacterium-mediated genetic transformation of five potato cultivars. Food Technology and Biotechnology. 58 (1), 57-63 (2020).
- Bates, R., Craze, M., Wallington, E. J. Agrobacterium-mediated transformation of oilseed rape (Brassica napus). Current Protocols in Plant Biology. 2 (4), 287-298 (2017).
- Hopp, H. E., Spangenberg, G., Herrera-Estrella, L. Plant transformation. Frontiers in Plant Science. 13, 876671 (2022).
- Abdelmuhsin, A. A., Alghamdi, A. A., Ibrahim, N. A. Assessing the phenotypic and genotypic variations of Plantago ciliata in Ha'il region, Saudi Arabia. Entomology and Applied Science Letters. (1), 14-22 (2021).
- Coleman, N. Plantago Lanceolata. Botanical Bulletin. 1 (11), 45 (1876).
- Huang, J., et al. Tissue-specific transcriptomic profiling of Plantago major provides insights for the involvement of vasculature in phosphate deficiency responses. Molecular Genetics and Genomics. 294 (1), 159-175 (2019).
- Penczykowski, R. M., Sieg, R. D. Plantago spp. as models for studying the ecology and evolution of species interactions across environmental gradients. The American Naturalist. 198 (1), 158-176 (2021).
- Pommerrenig, B., et al. Common plantain. A collection of expressed sequence tags from vascular tissue and a simple and efficient transformation method. Plant Physiology. 142 (4), 1427-1441 (2006).
- Bergero, R., Levsen, N., Wolff, K., Charlesworth, D. Arms races with mitochondrial genome soft sweeps in a gynodioecious plant, Plantago lanceolata. Molecular Ecology. 28 (11), 2772-2785 (2019).
- Aalto, E. A., Koelewijn, H. P., Savolainen, O. Cytoplasmic male sterility contributes to hybrid incompatibility between subspecies of Arabidopsis lyrata. G3: Genes, Genomes, Genetics. 3 (10), 1727-1740 (2013).
- Bloch, K. D., Grossmann, B. Digestion of DNA with restriction endonucleases. Current Protocols in Molecular Biology. 3 (1), (1995).
- Du, C., et al. Prokaryotic expression, purification, physicochemical properties and antifungal activity analysis of phloem protein PP2-A1 from cucumber. International Journal of Biological Macromolecules. 194, 395-401 (2022).
- Deshmukh, S. 2. 2., Kulkarni, R., Bose, K. Transformation and protein expression. Textbook on Cloning, Expression and Purification of Recombinant Proteins. , 83-114 (2022).
- Bergkessel, M., Guthrie, C. Colony PCR. Methods in Enzymology. 529, 299-309 (2013).
- Broehan, G., Kroeger, T., Lorenzen, M., Merzendorfer, H. Functional analysis of the ATP-binding cassette (ABC) transporter gene family of Tribolium castaneum. BMC Genomics. 14, 6 (2013).
- Dong, Z., et al. Stable transformation of fluorescent proteins into Nosema bombycis by electroporation. Parasites & Vectors. 15 (1), 141 (2022).
- Li, S., et al. Optimization of Agrobacterium-mediated transformation in soybean. Frontiers in Plant Science. 8, 246 (2017).
- Manimaran, P., et al. Infection of early and young callus tissues of indica rice BPT 5204 enhances regeneration and transformation efficiency. Rice Science. 20 (6), 415-426 (2013).
- Wang, J., Nie, J., Pattanaik, S., Yuan, L. Efficient Agrobacterium-mediated transformation of Artemisia annua L. using young inflorescence. In Vitro Cellular & Developmental Biology-Plant. 52 (2), 204-211 (2016).
- Niazian, M., Belzile, F., Torkamaneh, D. CRISPR/Cas9 in planta hairy root transformation: a powerful platform for functional analysis of root traits in soybean. Plants. 11 (8), 1044 (2022).
- Geng, S., et al. An efficient root transformation system for CRISPR/Cas9-based analyses of shoot-root communication in cucurbit crops. Horticulture Research. 9, (2022).
- Xiao, Y., et al. Efficient Agrobacterium-mediated genetic transformation using cotyledons, hypocotyls and roots of 'Duli'(Pyrus betulifolia Bunge). Scientia Horticulturae. 296, 110906 (2022).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon