Method Article
Agrobacterium tumefaciens-Dar Yapraklı Muzun Aracılı Genetik Transformasyonu
Bu Makalede
Özet
Çeşitli çalışma alanlarında model bir tür olarak çok yönlü uygulaması nedeniyle, dar yapraklı muzda (Plantago lanceolata) genetik dönüşüm araç setine ihtiyaç vardır. Burada, Agrobacterium tumefaciens aracılı transformasyon kullanılarak,% 20'lik bir dönüşüm verimliliğine sahip stabil transgenik çizgilerle sonuçlanan bir protokol sunulmuştur.
Özet
Plantago cinsindeki türler, çeşitli çalışma alanlarında model bitkiler olarak adapte olmalarına yol açan birkaç benzersiz özelliğe sahiptir. Bununla birlikte, genetik bir manipülasyon sisteminin olmaması, gen fonksiyonunun derinlemesine araştırılmasını önler ve bu cinsin bir model olarak çok yönlülüğünü sınırlar. Burada, en çok çalışılan Plantago türü olan Plantago lanceolata için bir dönüşüm protokolü sunulmaktadır. Agrobacterium tumefaciens aracılı transformasyon kullanılarak, aseptik olarak yetiştirilen P. lanceolata bitkilerinin 3 haftalık kökleri bakterilerle enfekte edildi, 2-3 gün boyunca inkübe edildi ve daha sonra uygun antibiyotik seçimi ile bir sürgün indüksiyon ortamına transfer edildi. Sürgünler tipik olarak 1 ay sonra ortamdan ortaya çıktı ve sürgünler kök indüksiyon ortamına aktarıldıktan 1-4 hafta sonra kökler gelişti. Bitkiler daha sonra bir toprak ortamına alıştırıldı ve β-glukuronidaz (GUS) muhabir testi kullanılarak bir transgenin varlığı için test edildi. Mevcut yöntemin dönüşüm etkinliği ~% 20'dir ve dönüştürülen 10 kök doku başına iki transgenik bitki ortaya çıkar. Dar yapraklı muz için bir dönüşüm protokolü oluşturulması, bu bitkinin çeşitli alanlarda yeni bir model tür olarak benimsenmesini kolaylaştıracaktır.
Giriş
Bitki biyolojisinin birçok yönünü araştırmak için model türlerin kullanılması kavramı, Arabidopsis thaliana1'in yaygın kullanımı ile ortaya çıkmıştır. Arabidopsis başlangıçta seçildi çünkü diğer birçok çiçekli bitki ile özellikleri paylaşıyor ve küçük olmak ve kısa bir üretim döngüsüne sahip olmak gibi laboratuvar ortamında çalışmayı kolaylaştıran birçok özelliğe sahip. Bir konu olarak onunla birlikte yayınlanan çok sayıda araştırma makalesi, küçük genom boyutu ve genetik dönüşüm kolaylığı2 ile birlikte, yaygın olarak kullanılan deneysel bir organizma olarak varlığını sürdürmesini sağlar. Bununla birlikte, Arabidopsis, farklı özelliklere veya benzersiz özelliklere sahip türler için bir model olarak sınırlandırılabilir3. Bu, monokotlardagelişimsel genetik için önemli bir bitki olan mısır (Zea mays) 4 ve evrimsel çalışmalar, meyve gelişimi ve üretimi için önemli bir model olan domates (Solanum lycopersicum) gibi yeni model sistemlerin geliştirilmesine yol açmıştırve bitkisel ürünler için iyi bir temsil 5. Genetik dönüşüm için bir yöntem, bir bitki türünün model organizma olarak hizmet etmesi için bir ön koşuldur2. Agrobacterium tumefaciens aracılı bir dönüşüm, bitki biyolojisinde güvenilir bir araçtır; tütün (Nicotiana tabacum)6, pirinç (Oryza sativa)7, pamuk (Gossypium hirsutum)8, soya fasulyesi (Glycine max)9, patates (Solanum tuberosum)10 ve kanola (Brassica napus)11 dahil olmak üzere birkaç model türü ve başlıca mahsulleri dönüştürmek için kullanılmıştır. Bitki türleri, A. tumefaciens enfeksiyonuna ne kadar başarılı yanıt verdikleri konusunda oldukça değişkendir ve dönüşüm protokollerinin genellikle her bir türe göre ayrı ayrı uyarlanması gerekir 6,12.
Plantago cinsi, dünya çapında yaygın olarak dağıtılan toplam 256 bitki türünü içerir13. Bu cinsteki türler genellikle genetik, ekoloji, stres fizyolojisi, ikincil metabolitler, tıbbi kimya, bitki-mikrop etkileşimleri, bitki gelişimi ve evrimi incelemek için model türler olarak arzu edilmelerini sağlayan benzersiz özelliklere sahiptir. Dar yapraklı veya ribwort muz olarak da adlandırılan Plantago lanceolata, erkek kısırlığı fenomenini tanımlamak için ilk kez kullanıldığı 19. yüzyıldan beri ilgi çekici popüler bir bitki olmuştur14. Cinsinin diğer bitkileri gibi, çeşitli araştırma alanlarındaki çalışmalarda kullanılmıştır. Daha yakın zamanlarda, vasküler dokusu kolayca toplanabildiği için vasküler biyoloji için bir model olarak önerilmiştir15. P. lanceolata, Plantago cinsinde en çok çalışılan türdür; 2021 tarihli bir makalede, 9 Aralık 2022'de yapılan bir PubMed araştırmasına göre, o sırada bu tür dahil veya bu türle ilgili 1.400 yayın >16 ve 2022'nin başından bu yana 102 makale daha yayınlandığı bildirildi. Cinste en çok çalışılan bir sonraki bitki olan P. major, aynı tarihte aynı kriterler kullanılarak arandığında sadece 414 makalenin konusudur.
P. lanceolata'ya olan araştırma ilgisine rağmen, özellikle gen fonksiyon karakterizasyonu üzerine yapılan çalışmalar, türler için genetik bir manipülasyon araç setinin bulunmaması nedeniyle genellikle sınırlıdır. Pommerrienig ve ark., çiçek daldırma tekniğini kullanarak P. major için bir dönüşüm protokolü geliştirmek için çaba sarf etmişlerdir17. Ancak bu yöntem, bu türün18,19 erkek kısırlık özelliği nedeniyle P. lanceolata'ya uygulanamamaktadır. Bildiğimiz kadarıyla, P. lanceolata'nın dönüşümü için mevcut bir protokol yoktur.
Bu çalışma, P. lanceolata'nın A. tumefaciens aracılı dönüşümü için basit bir protokol sunmaktadır. Kök dokuları hedef alarak, dönüşümden sonraki 3 ay içinde tamamen büyümüş transgenik bitkiler üretilebilir.
Protokol
NOT: Adım 1.4-1.8, 2.3-2.5, 3.3-3.6, 4.1-4.6, 5.1-5.7 ve 6.1-6.3, kontaminasyonu önlemek için temiz bir başlık kullanılarak aseptik koşullarda gerçekleştirilmelidir.
1. Dönüşüm için bitki materyali yayılımı
- Ticari olarak temin edilebilen vahşi tip (WT) Plantago lanceolata tohumlarını ( bakınız Malzeme Tablosu), istenen bitki sayısına bağlı olarak 5 mL hattına kadar 50 mL'lik bir santrifüj tüpüne yerleştirin.
NOT: Alternatif olarak, az sayıda tohuma ihtiyaç duyulduğunda 2 mL'lik bir mikrosantrifüj tüpü kullanılabilir, ancak çok fazla tohum sterilizasyon verimliliğini azaltabileceğinden, 0,1 mL'den büyük olmayan bir hacme kadar doldurulmalıdır. - Tohumları 60 saniye boyunca% 75 etanol içine batırın.
- Etanolün atın, ardından tohumları 40 dakika boyunca% 20 sodyum hipoklorite (% 20 NaClO,% 80 steril su) batırın, tüpü yavaşça ters çevirin, böylece tüm tohumlar çözelti ile temas eder.
NOT: Sodyum hipoklorit çözeltisi, optimum sonuçlar için taze olarak yapılmalıdır. - Laminer bir akış başlığı altında, sodyum hipoklorit çözeltisini atın, ardından tohumları damıtılmış suyla yıkayın (beş kez). Son durulamadan sonra tohumlara az miktarda su ekleyin, çünkü bu, bitkilerin plakalara hareketine yardımcı olabilir.
- Sterilize forseps kullanarak, tohumları katı MS ortamı ile önceden hazırlanmış 95 mm x 100 mm Petri kaplarına aktarın (Tablo 1). Çimlenmiş fidelerin aşırı kalabalıklaşmasını önlemek için tohumları plakanın yüzeyine eşit olarak yayın, her tohum arasında yaklaşık 1 cm olacak şekilde yayın (Şekil 1A).
- Kirlenmeyi önlemek için plakaları iki kat parafin film ile kapatın, ardından oda sıcaklığında (50 μmol m-2 s-1, 12 saat gün ile 22 ° C) serin beyaz bir büyüme ışığı altında inkübe edin (Malzeme Tablosuna bakınız). Tohumlar tipik olarak 5-6 gün içinde çimlenir.
- Fideler çimlendiğinde ve aktarılacak kadar büyük olduğunda (Şekil 1B), tipik olarak çimlenmeden 2 veya 3 gün sonra, fideleri 50-100 mL MS ortamı ile steril kutulara aktarmak için sterilize edilmiş forseps kullanın (Tablo 1). İdeal olarak, en kaliteli kökleri elde etmek için kutu başına sadece beş fide dikin.
- Kutuları cerrahi bantla kapatın, ardından bitkilerin adım 1.6'da belirtilen aynı koşullarda serin beyaz bir büyüme ışığı altında büyümesine izin verin (bkz. Bitkiler yaklaşık 3-4 hafta içinde veya ana kökler yaklaşık 2 cm uzunluğunda büyüdüğünde ve yanal kökler beyaz göründüğünde dönüşüme hazır olmalıdır.
NOT: Orta hazırlık tarifleri ve vitamin stokları Tablo 1 ve Tablo 2'de yer almaktadır.
2. Plazmid yapımı ve E. Coli dönüşümü
NOT: Tam plazmid yapım prosedürü, ilgilenilen gene bağlı olarak değişir. Bu prosedürde, standart klonlama prosedürü20 kullanılarak, 1.5 kb AtPP2 promotörünü GUS101 ile ikili plazmid pBI101'e (bakınız Malzeme Tablosu) yerleştirmek için HindIII ve SalII kısıtlama enzimleri kullanılmıştır. AtPP2 (floem proteini 2), özellikle floem21'de eksprese edilen bir gendir.
- Arabidopsis'ten 5'-AGTCAAGCTTCAAGTCTGTGGCTACTGAAC-3' (İleri) ve 5'-AGTCGTCGACAAACCAGTATGATGTATTTATTTTTG-3' (Ters) astar çiftlerini kullanarak promotörü klonlayın. Şekil 2, AtPP2:GUS kesici ucu ile ikili plazmid vektörünün bir diyagramını göstermektedir.
- Plazmid yapımından sonra, ısı şoku yöntemi22'yi kullanarak plazmidleri DH5a E. coli (Malzeme Tablosuna bakınız) yetkin hücrelerine dönüştürün ve daha sonra çalkalayarak (150 rpm) 37 ° C'de 1,5 saat inkübe edin.
- Her dönüşüm kültüründen 150 μL alın, uygun seçimle (bu protokolde kullanılan suş için 50 mg / L kanamisin; bakınız Malzeme Tablosu) LB agar ortam plakalarına (Tablo 1) plaka alın ve ardından plakaları 37 ° C'de 16-24 saat boyunca inkübe edin.
NOT: Bu çalışmada kullanılan bakteri suşu A. tumefaciens GV3101'dir. - Daha sonra, kolonileri pozitif rekombinantlar için taramak için koloni PCR'sini kullanın23.
NOT: Bu protokolde, hedeflenen geni yükseltmek için aşağıdaki primerler kullanılmıştır; 5'-ATGTTACGTCCTGTAGAAACCCCAA-3' (İleri) ve 5'-TCATTGTTTGCCTCCCTGCTGC-3' (Ters).- Reaksiyonu 95 °C'de 3 dakikalık döngü koşullarıyla bir termosiklette ( Malzeme Tablosuna bakınız) çalıştırın, ardından 35 döngü izleyin: 95 ° C'de 30 s, 55 ° C'de 30 sn, 72 ° C'de 2 dakika ve 72 ° C'de son 10 dakikalık bir uzama adımı.
- Pozitif kolonileri 6 mL LB suyunda (Tablo 1) uygun antibiyotik (50 mg / L kanamisin) ile aşılayın ve gece boyunca 37 ° C'de, 200-250 rpm'de büyüyün.
- Bir gecede büyüdükten sonra, standart prosedürler24'ü kullanarak plazmidleri bakterilerden çıkarın.
3. A. plazmid ile tumefaciens dönüşümü
- Plazmid ekstraksiyonundan sonra, modifiye plazmidi istenen yetkin hücre suşuna dönüştürmek için elektroporasyon kullanın. Bu yordamda A. tumefaciens suşu GV3101 kullanıldı. Elektroporasyon teknikleri için standartlaştırılmış yöntemleri izleyin25.
- Elektroporasyondan sonra, yetkili hücreleri 1 mL LB suyunda yeniden askıya alın ve daha sonra 100 rpm'de 28 ° C'de 2-4 saat inkübe edin.
- Hücreleri, oda sıcaklığında (22 ° C) bir masa üstü mikrosantrifüjde (Malzeme Tablosuna bakınız) 3 dakika boyunca 6.800 x g'de santrifüjleme yoluyla toplayın, daha sonra uygun bir seçim maddesi (bu protokolde kullanılan plazmid için 50 mg / L kanamisin) ile bir LB agar plakasına 50-100 μL yayın.
- Hücreler 28 ° C'de 2 gün boyunca inkübe edildikten sonra, koloni PCR kullanarak ilgili geni içeren pozitif kolonileri tanımlayın. Bu protokolde, adım 2.4'te belirtilen primerleri ve koşulları kullanın.
- Daha sonra, LB agar media + selection ile bir stok plakasını çizmek için pozitif kolonileri kullanın. Plaka 4 °C'de 1 aya kadar saklanabilir.
- Alternatif olarak, uzun süreli depolama için, uygun seçim ile küçük bir LB hacmi ile pozitif bir koloni aşılayın. Aşılanmış kültürü gece boyunca 200 rpm'de 28 ° C'de çalkalayın, ardından -80 ° C'de 10 yıla kadar saklanabilen bir gliserol stoğu (50:50 bakteri ve gliserol karışımında% 50 w / v gliserol ile) hazırlayın.
4. A. tumefaciens preparatı
- Streak A. tumefaciens, uygun seçim maddesi ile hazırlanan 95 mm x 100 mm katı LB plakalar üzerine istenilen plazmidi içerir. Bu protokolde, plazmid eki AtPP2: GUS ile GV3101 bakteri suşu kullanıldı ve seçim için 50 mg / L kanamisin eklendi.
- Plakaları parafin filmle kapatın, ardından 28 ° C'de 48 saate kadar veya bakteriler toplanacak kadar büyüyene kadar inkübe edin.
- Dönüşümden 2 gün önce bir bakteri kolonisi seçmek için bir pipet ucu kullanın ve uygun seçimle 6 mL sıvı LB içeren 15 mL'lik yuvarlak tabanlı bir tüpe aşılayın. OD600 0,6-0,7'ye ulaşana kadar gece boyunca 28 °C'lik bir masa üstü çalkalayıcıda 200 rpm'de çalkalayın.
NOT: Plakalar ve 6 mL bakteri aşılaması 4 °C'de 1 aya kadar saklanabilir. - Bakteriler doğru OD 600'e ulaştığında, A. tumefaciens'i bir seçim maddesi ile100 mL sıvı LB içeren steril bir şişeye aktarmak için bir pipet kullanın. Tipik olarak, 100 mL LB başına 200 μL bakteri yayılma için uygundur. OD600 0,6-0,7'ye ulaşana kadar gece boyunca 28 ° C'de 200 rpm'de çalkalayın.
- Bakterileri 50 mL steril santrifüj tüplerine aktarın ve bakterileri toplamak için masa üstü santrifüjde oda sıcaklığında (22 ° C) 10 dakika boyunca 2.200 xg'de santrifüj yapın.
- Bir pipet kullanarak süpernatantı atın. Bakteriyel peleti pipetleme ile 5 mL oda sıcaklığında (22 °C) sıvı süspansiyon çözeltisinde (SS) (Tablo 1) tekrar askıya alın, ardından 50 mL'ye kadar SS ekleyin ve karıştırmak için birkaç kez ters çevirin. Bakteriler artık dönüşüm için hazırdır.
NOT: Sıvı SS, dönüşümden sonraki 1 hafta içinde taze olarak hazırlanmalıdır.
DİKKAT: A. tumefaciens ile temas eden tüm malzemelerin biyolojik tehlike atık kutusuna atılması gerekir. Bakteri kültürlerinden arta kalan sıvılar,% 20 veya daha yüksek bir konsantrasyonda sodyum hipoklorit (ağartıcı) ile sterilize edilebilir.
5. Plantago köklerinin dönüşümü
- Bitkiler dönüşüm için ideal aşamaya ulaştığında (fideler 3 haftalıktır) (Şekil 1C), kökleri bitkinin geri kalanından ayırmak için steril forseps ve makas kullanın (Şekil 3A). Yaprak ve gövde malzemesini atın.
- Kesimden hemen sonra, kök parçalarını steril forseps kullanarak steril su içeren steril kutulara aktarın. Bu adım, tüm dokular toplanırken köklerin sulu kalmasını sağlar.
- Tüm kökler kesildiğinde, A. tumefaciens/SS süspansiyonunu steril 150 mm x 15 mm tek kullanımlık Petri kaplarına dökün. Kökleri A. tumefaciens kültürüne aktarın ve en az 20 dakika boyunca aşılayın (Şekil 3B).
- Kuluçka sırasında, kökleri 1 cm'lik parçalara ayırmak için keskin bir bıçaklı steril bir neşter kullanın ve birincil kökleri yanal köklerden ayırın. Bakterilerin bitkiyi enfekte etmesine izin vermek için köklerin yüzeyinde ince, sığ kesimler yapın.
NOT: Çok sayıda bitki ile uğraşıyorsanız, aşılama sırasında tüm köklerin daldırıldığından emin olmak için kök parçalarını gruplar halinde bakteri kültürüne aktarın. - Kuluçkadan sonra, fazla bakterileri gidermek için kök parçalarını steril kağıt havlulara aktarmak için steril forseps kullanın. Kökleri 60 saniyeden fazla kurutmaktan kaçının, çünkü bu dehidrasyona neden olabilir ve kök dokusuna zarar verebilir. İdeal olarak, 10-15 kök aynı anda kurutulabilir (Şekil 3C).
- Kurutulmuş kökleri, köklerin büyüklüğüne bağlı olarak, katı ko-kültür ortamı (Tablo 1), plaka başına yaklaşık 10-20 kök ile hazırlanmış 95 mm x 15 mm Petri kaplarına aktarın (Şekil 3D).
- Plakaları iki kat şeffaf plastik film ile kapatın, ardından alüminyum folyo ile örtün. 3 gün boyunca oda sıcaklığında (22 ° C) inkübe edin. Bu adım, bakterilerin bir antibiyotik seçimi olmadan kökleri enfekte etmeleri için zaman sağlar (Şekil 3E).
6. Seçim ve tüm bitki yenilenmesi
- Ko-kültür ortamında inkübasyondan sonra, kök parçalarını Timentin (500 mg / L; bakınız Malzeme Tablosu) ve uygun antibiyotik seçimi ile katı sürgün indüksiyon ortamı (SIM) (Tablo 1) ile hazırlanmış 95 mm x 15 mm Petri kaplarına aktarın. Bu protokolde kanamisin (100 mg/L) kullandık.
NOT: Köklerin tabanı ortamla tam temas halinde olmalıdır. Ortamın yüzeyine temas etmeyen kökler çok uzundur ve dokunun seçimden kaçmasını önlemek için kesilmelidir. - Plakaları iki kat şeffaf plastik film ile kapatın, ardından 1 ay boyunca bir büyüme ışığı altında büyüyün (uygun koşullar için adım 1.6'ya bakın) veya sürgünler ortaya çıkmaya başlayana kadar.
NOT: Tipik olarak, sürgün baş harfleri 2 haftalık büyümeden sonra gözlemlenebilir ve sürgünler tipik olarak 1 ay sonra görülebilir. - Plantletler 1.5-2.0 cm uzunluğunda olduğunda (Şekil 1D), katı kök indüksiyon ortamı ile hazırlanmış steril kutulara aktarın (Tablo 1).
- Bitkileri, kökler oluşana kadar birkaç hafta boyunca bir büyüme ışığı altında (koşullar için adım 1.6'ya bakın) büyütün. Kökler tipik olarak ilk olarak 1 hafta sonra görülebilir.
NOT: Daha büyük kök sistemlerine sahip bitkiler toprakta daha yüksek bir hayatta kalma oranına sahip olma eğiliminde olduklarından, toprağa taşınmadan önce köklerin birkaç hafta büyümesine izin verilmesi önerilir.
7. Toprak transferi
- Kök sistemleri aktarılacak kadar büyüdüğünde (Şekil 1E), tipik olarak 1 aylık büyümeden sonra, bitkileri önceden ıslatılmış çok amaçlı toprak (BM7) içeren kare saksılarda 3.5'e aktarın. Bu protokolde BM7 kabuk karışımı kullanılmıştır (bakınız Malzeme Tablosu).
- Köklere yapışan herhangi bir ortamı suda nazikçe yıkayarak çıkarın.
NOT: Bitkiler, 600 W yüksek sodyum basınçlı ışıklar kullanılarak 800 ila 1400 μmol foton m-2 s-2'de bir serada veya 50 μmol m-2 s-1, 12 saat günde soğuk beyaz ışıklarla oda sıcaklığında (22 ° C) bir büyüme odasında olgunluğa kadar yetiştirilebilir.
- Köklere yapışan herhangi bir ortamı suda nazikçe yıkayarak çıkarın.
- Bitkileri plastik bir saksı örtüsüyle örtün, ardından şeffaf bir plastik torba ile örtün. Bu adım, bitkilerin toprağa adapte olurken nemli bir ortamda kalmalarını sağlar.
- Yaklaşık 3-5 gün sonra, plastik torbayı çıkarın, ardından dış ortama alışmaya izin vermek için kapağı yavaşça çıkarın.
NOT: Yılın zamanına ve bitkilerin transfer edildiği ortama bağlı olarak, bitkilerin uyum sağlaması gereken süre değişebilir. Bitkilerin günlük olarak kontrol edilmesi ve gerektiğinde saksılara su eklenmesi önerilir. - Bitkileri düzenli olarak sulayın ve gerektiğinde gübre ekleyin. Bitkiler ayrıca daha fazla büyüme için daha büyük saksılara aktarılabilir (Şekil 1F).
8. β-glukuronidaz (GUS) histokimyasal boyama
- Yayınlanan protokollere göre β-glukuronidaz (GUS) boyama çözeltisi hazırlayın15.
- Sürgün baş harfleri yaklaşık 0,5-1 cm uzunluğunda olduğunda, genç, tamamen genişlemiş bir yaprağın küçük bir ucunu çıkarın (<5 mm uzunluğunda genellikle yeterlidir) ve hemen 1,5 veya 2 mL'lik bir mikrosantrifüj tüpünde 0,5-1 mL GUS boyama çözeltisine aktarın. Çözelti bitki dokusunu tamamen örtmelidir.
- Açılan tüpleri bir vakum kurutucuya yerleştirin ve 5-10 dakika boyunca 20-25 kPa'da vakumlayın. Vakum prosedürü sırasında çözeltide küçük kabarcıklar görünmelidir. Bu, çözeltinin bitkinin hücrelerine girmesini sağlar.
- Havanın vakum kurutucuya geri filtrelenmesine izin verin. Tüpleri kapatın ve gece boyunca (12 saat) 37 ° C'de veya mavi renk görünene kadar inkübe edin.
NOT: Bu çalışmada, GUS aktivitesi floem lokalize edildi, yani pozitif olarak dönüştürülmüş bitkilerde mavi boyama sadece floem dokusunda görülebilmelidir. Transgeni olmayan bitkilerde lekelenme görülmez (Şekil 4). - Lekeyi daha iyi görselleştirmek için, klorofilin çıkarılması için bitkileri% 100 etanol'e aktarın. Klorofil giderme işleminin verimliliğini artırmak için, tüpleri 60 ° C'de 10 dakika boyunca inkübe edin.
NOT: Boyanan yaprağın boyutuna bağlı olarak, tüm klorofil çıkarılmadan önce etanolün birkaç kez değiştirilmesi gerekebilir.
Sonuçlar
Burada A. tumefaciens aracılı dönüşüm kullanılarak transgenik P. lanceolata bitkilerinin elde edilmesi için basit bir protokol bildirilmiştir. Muhabir gen GUS (β-glukuronidazı kodlayan), AtPP2'nin floem eksprese edici promotörü tarafından yönlendirilerek, A. tumefaciens suşu GV3101 yoluyla 3 haftalık P. lanceolata köklerine dönüştürülür (Şekil 2). Floem'e özgü bir promotör seçildi çünkü ana ilgi alanımız bitki vasküler dokularının, özellikle de floem'in fonksiyonel genomiği için bir sistem kurmaktı. Yöntem, ön deneyde kök, yaprak ve yaprak sapı dokusu üzerinde test edildi. Tüm doku tiplerinde nasır indüklenebilse de, SIM'de 1 ay sonra sadece kök doku sürgün baş harfleri (Şekil 5A); yaprak ve yaprak sapı kahverengiye döndü ve öldü (Şekil 5B). Bu, kök dokunun transformasyon yönteminde kullanılmak üzere en uygun doku tipi olduğu sonucuna varmıştır. Kökler, süspansiyon çözeltisinde (SS) (Tablo 1) en az 20 dakika boyunca yeniden askıya alınan hazırlanmış bakterilerde inkübe edildi, daha sonra karanlıkta 3 güne kadar katı SS plakaları üzerinde oda sıcaklığında inkübe edildi (Şekil 3E). Kökler daha sonra sürgün indüksiyon ortamına (SIM) aktarıldı ve protokolde belirtilen koşullarda (adım 1.6) bir büyüme ışığı altında tutuldu. Şekil 1 ve Şekil 3, referans için protokolün her adımının temsili görüntülerini göstermektedir.
Şekil 6, köklerin SIM üzerine yerleştirildiği ilk günden (Şekil 6A) sürgünlerin köklenmeye hazır olduğu zamana kadar (Şekil 6D) dönüştürülmüş dokudan ortaya çıkan sürgün baş harflerinin ilerlemesini göstermektedir. 1 hafta sonra kök dokusu nasır oluşturmuş (Şekil 6B) ve sürgün baş harflerinin başlangıcı gözlenmiştir (Şekil 6B1). Sürgünler 2. ve 3. haftalarda ortaya çıkmaya devam etti (Şekil 6C) ve 4 hafta sonra sürgünler kök indüksiyon ortamına aktarılmaya hazırdı (Şekil 6D).
Tahmini transgenik bitkilerin tanımlanması, sürgünler yaklaşık 0.5 cm uzunluğunda olduğunda alınan yaprak segmentleri kullanılarak β-glukuronidaz (GUS) histokimyasal testi kullanılarak gerçekleştirildi. Pozitif transgenik bitkiler, Şekil 4'te gösterilen floem lokalize dokuda beklenen boyama paternini gösterdi. Pozitif GUS boyalı sürgünler, 4 hafta sonra sağlam köklendirme sistemleri geliştirdikleri kök indüksiyon ortamına aktarıldı (Şekil 1E). Köklü bitkiler daha sonra toprağa aktarıldı. Şekil 4, AtPP2 promotörü ve β-glukuronidaz (GUS) geni ile dönüştürülmüş dar yapraklı bir muzda boyanmanın sonucunu, karşılaştırma için AtPP2 promotörü ile dönüştürülmüş vahşi tip ve dar yapraklı bir muz ile birlikte göstermektedir. Ortaya çıkan tüm sürgünler transgenik olarak doğrulandı. Dönüşüm verimliliğinin ortalama% 20 olduğu belirlendi ve dönüştürülen her 10 kök için yaklaşık iki sürgün ortaya çıktı. Doğrulanmış transgenik bitkiler daha büyük saksılara aktarıldı ve yetişkin aşamasına ulaşana kadar 4-8 hafta boyunca yetiştirildi (Şekil 1F).
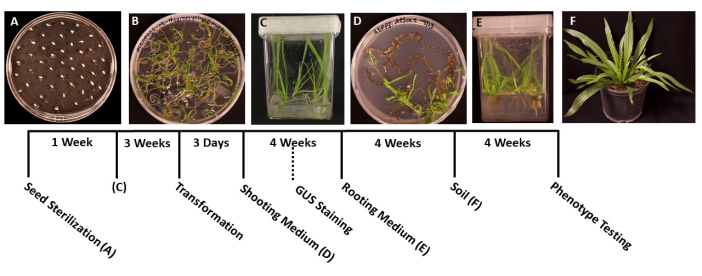
Resim 1: Plantago lanceolata dönüşümünün zaman çizelgesi. Protokolün her aşamasının temsili görüntüleri. (A) Bir MS plakası üzerine kaplanmış çimlenmemiş tohumlar. (B) 1 hafta sonra çimlenen, eflatun kutulara aktarılmaya hazır tohumlar. (C) 3 haftalık büyümeden sonra MS kutularındaki bitkiler. Kökler, dönüşüm için ideal aşamada yeşil ve sağlıklıdır. (D) 4 hafta sonra sürgün indüksiyon ortamındaki sürgünler köklendirme ortamına aktarılmaya hazırdır. Bu aşamada, varsa β-glukuronidaz (GUS) histokimyasal boyama yapılabilir. (E) Kök indüksiyon ortamına sahip kutularda, 4 haftalık büyümeden sonra köklerin oluştuğu bitkiler. (F) Transgenik bitkiler toprakta 4 haftalık büyümeden sonra tam uzunluğa kadar yetiştirilir. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
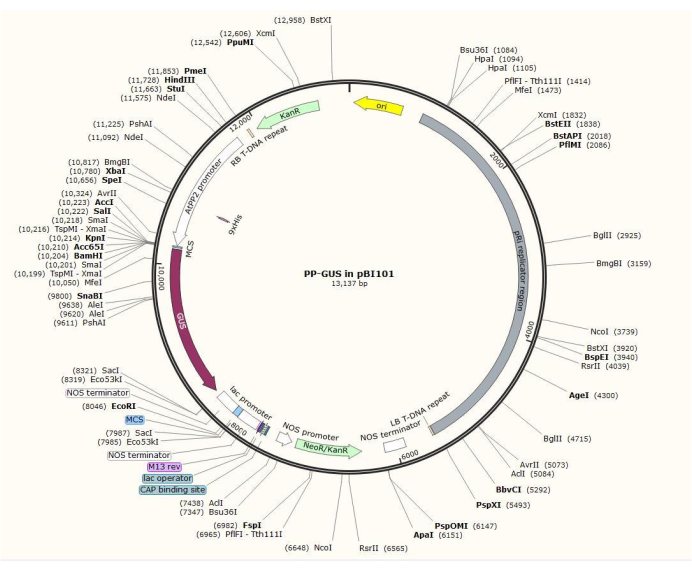
Şekil 2: Eklenen floem spesifik promotör AtPP2 ile ikili vektör plazmidi pBI101 + β-glukuronidaz (GUS) diyagramı. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
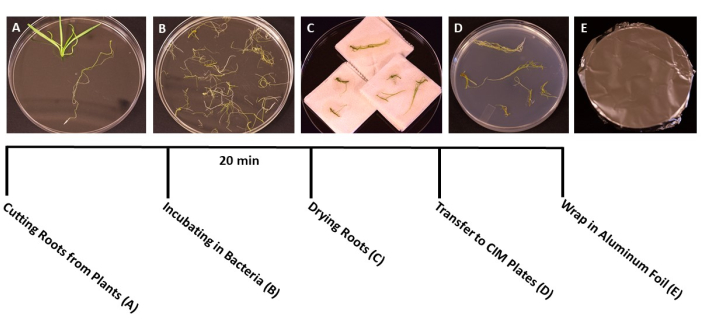
Şekil 3: Dönüşüm adımları. Dönüşümün her adımının temsili görüntüleri. (A) Dönüşüm sırasında kökleri sürgünlerden ayırmak. (B) Kökleri bakteri/SS süspansiyonuna batırmak. (C) Fazla bakterileri uzaklaştırmak için kağıt havlu üzerindeki köklerin kurutulması. (D) Ortak kültür ortamına kaplanmış kökler. (E) Alüminyum folyoya sarılı SS plakaları. Bitkiler çekim ortamına aktarılmadan önce 2-3 gün boyunca inkübe edildi. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
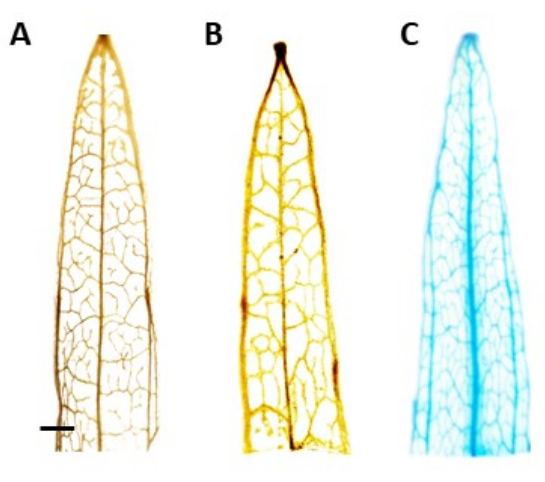
Resim 4: GUS-boyama. β-glukuronidaz (GUS) boyama sonuçları dar yapraklı muz yaprağı segmentleri. (A) Vahşi tip. (B) AtPP2 promotörünü (boş vektör) barındıran plazmid ile dönüştürülen dar yapraklı muz. (C) AtPP2 promotörünü ve β-glukuronidaz (GUS) genini barındıran plazmid ile dönüştürülen dar yapraklı muz. Her yaprak GUS histokimyasal boyama protokolü kullanılarak boyandı, daha sonra mikroskobik bir kamera ile görüntülendi. Görüntüler (B) ve (C), GUS geninin yokluğundan dolayı lekelenme paterni göstermez. Doğru görüntü, damarlarda bitkilerin transgenik olduğunu doğrulayan açık mavi bir lekelenme deseni göstermektedir. Çubuk 1 mm'yi temsil eder ve her yaprak segmenti yaklaşık 1 cm uzunluğundadır. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
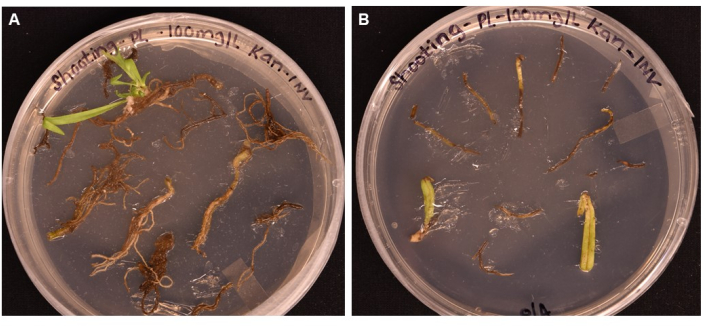
Şekil 5: Farklı doku tiplerinin >1 aylık inkübasyondan sonra çekim ortamlarında transformasyon etkinliğinin karşılaştırılması . (A) 1 aydan fazla büyümeden sonra kök dokular. Kökler genişlemiş nasır yaşadı ve atış baş harfleri ortaya çıktı. Dönüşmemiş nasır antibiyotik seçimine yanıt olarak ölmeye başlamıştır. (B) 1 aydan fazla büyümeden sonra yaprak ve yaprak sapı dokuları. Dokular bir miktar nasır genişlemesi yaşadı, ancak kısa süre sonra antibiyotiğe yanıt olarak öldü. Her iki dokudan da sürgün çıkmadı. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
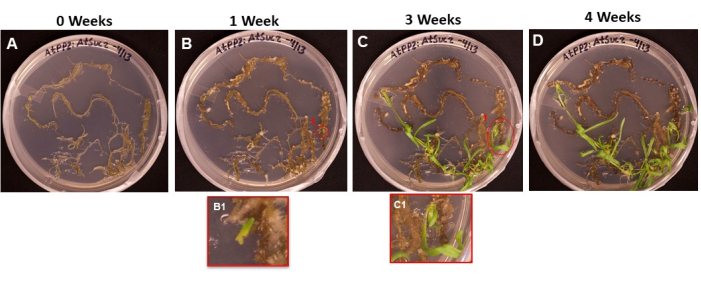
Şekil 6: Nasır ve transforme doku üzerindeki sürgünlerin ortaya çıkışı. Farklı inkübasyon uzunluklarından sonra çekim ortamına yerleştirilen dokuların temsili görüntüleri. (A) Kök dokular, çekim ortamına kaplandıktan hemen sonra. (B) Çekim ortamında 1 hafta sonra kök dokular. Nasır genişlemesi gözlemlenebilir ve (B1) ilk sürgün baş harfleri ortaya çıkmaya başlamıştır. (C) Çekim ortamında 3 hafta sonra kök dokuları. Daha fazla çekim baş harfi ortaya çıktı. (C1) B1 çekiminin başlangıcından ortaya çıkan çekim. (D) 4 haftalık inkübasyondan sonra kök dokuları. Dönüşmemiş doku siyah / kahverengiye dönmeye ve ölmeye başladı ve ortaya çıkan sürgünler büyümeye devam ediyor. Bu aşamada, sürgünler köklenme ortamına taşınmaya hazırdır. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
Tablo 1: Medya hazırlama tarifleri. Ortamların dönüşüm için nasıl hazırlanacağının açıklaması. Eklenen vitamin miktarı, belirtilen stok çözeltisi konsantrasyonuna göre hesaplanır. Vitamin stok çözeltisi hazırlığı için Tablo 2'ye bakınız. Tüm ortamlar için, 900 mL çift damıtılmışH2O'ya reaktifler, belirtilen seviyeye pH ekleyin ve ardından 1.000 mL'lik son hacme su ekleyin. * = sterilizasyondan sonra ekleyin. ** = 1 M KOH ile pH. = 1 M NaOH ile pH. Bu Tabloyu indirmek için lütfen tıklayınız.
Tablo 2: Plantago ortamları için vitamin stokları. Tüm vitaminler depolanmadan önce filtrelenmeli, sterilize edilmeli ve doğru şekilde etiketlenmelidir. Belirtildiği yerde, tozları önce 1 N NaOH'da çözün, daha sonra çift damıtılmışH2O ile istediğiniz hacmi oluşturun .
Tartışmalar
Plantago cinsindeki bitkiler için bir dönüşüm protokolünün olmaması, özellikle araştırmacılar gen fonksiyonlarını araştırmakla ilgilendiklerinde, bu bitkilerin model olarak kullanımını sınırlar. P. lanceolata, genetik bir dönüşüm protokolü geliştirmek için seçildi, çünkü16 cinsinin en çok çalışılan bitkisidir. Geliştirilen protokol muhtemelen vasküler biyoloji, ekoloji, bitki-böcek etkileşimleri ve abiyotik stres fizyolojisi ile ilgili çalışmaları ilerletmek için bir araç olarak kullanılacaktır.
Sunulan protokol, bir kullanıcının transgenik bitkiler elde etmesine izin veren adımları açıkça özetlemektedir. P. lanceolata'nın bir doku kültürü ortamında gelişme yeteneğinin yanı sıra, dönüşüm yöntemimizin başarısına birçok faktör katkıda bulunmuştur. İlk olarak, dönüşüm için yüksek kaliteli, steril bitki kök dokusunun kullanılmasının önemi gözlenmiştir. Kökler, 3-4 haftalık bitkilerden alındığında en yüksek dönüşüm oranlarına sahipti ve yeşil veya soluk beyaz görünüyordu. Herhangi bir miktarda bakteri veya mantar kontaminasyonu olan kutulardan alınan kökler genellikle kontamine çekim kültürlerine neden oldu ve kahverengi görünen eski kökler başarılı bir dönüşümle sonuçlanmadı. Kök dokusu, mevcut yöntem kullanılarak transformasyon için en etkili doku tipiydi, çünkü yaprak ve yaprak sapı dokusu sürgün geliştirmede başarısız oldu.
Bir diğer önemli gözlem, dönüşüm için kök dokusunu toplamak için en uygun yöntemin, taze kesilmiş kök materyalini steril suya yerleştirmek olduğuydu. Bu adım, dokunun geri kalanı toplanırken kök materyalinin hidratlı kalmasına etkili bir şekilde izin verdi, çünkü kökler büyüme kaplarından çıkarıldığında hızlı bir şekilde kuruma eğilimindedir. Bu adım aynı zamanda dönüşümün başarı oranını artırmaya yardımcı oldu, çünkü bir kerede bakterilerde daha fazla kökün inkübe edilmesine izin verdi.
Bu protokol, kök dokunun ko-kültür ortamında kuluçkaya yattığı süreyi 2 güne indirerek değiştirilebilir. 2 veya 3 günlük bir kuluçka süresinin, sürgün baş harfleriyle sonuçlanan enfeksiyona izin vermek için yeterli olduğu gözlenmiştir. Bununla birlikte, daha uzun inkübasyon süreleri önerilmez, çünkü medyada bir antibiyotik inhibitörünün yokluğunun sıklıkla ortaya çıkan dokuyu öldürebilen A. tumefaciens aşırı büyümesine neden olduğu gözlenmiştir.
Bu çalışmanın bir sınırlaması, karşılaştırma için P. lanceolata dönüşümünde diğer A. tumefaciens türlerinin performansı hakkında mevcut verilerin bulunmamasıdır. Bildiğimiz kadarıyla bu protokol yenidir. İlk denemeler sırasında, A. tumefaciens GV3101 ile yüksek bir dönüşüm verimliliği kaydedildi ve diğer suşlarla deney yapmak yerine bu suşu kullanarak tekniği rafine etmeye odaklandık. %20'lik dönüşüm verimliliğimiz bitki dönüşümü için nispeten yüksektir – birçok geleneksel yöntem, %1'lik herhangi bir şeyin başarılı olduğunu >26,27,28 olarak kabul eder. Bununla birlikte, birden fazla türde kök dönüşümünde kullanımı ile bilinen A. rhizogenes gibi başka bir A. tumefaciens suşu kullanılması 29,30,31, daha da yüksek bir başarı oranına neden olabilir. P. lanceolata'da artan dönüşüm verimliliğini teşvik etmek için diğer suşların kullanılmasının etkisini değerlendirmek için daha fazla deneye ihtiyaç duyulacaktır.
P. lanceolata'nın başarılı dönüşümü muhtemelen birçok çalışma alanına fayda sağlayacaktır. Yüksek transformasyon verimliliği ve bitkinin doku kültürü ortamındaki hızlı büyümesi, P. lanceolata'yı gen fonksiyonu çalışmaları için uygun bir aday haline getirmektedir15.
Açıklamalar
Yazarların açıklayacak hiçbir şeyi yok.
Teşekkürler
Bu çalışma Ulusal Bilim Vakfı (EDGE IOS-1923557'den C.Z. ve Y.Z.'ye) tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 14 mL Round Bottom TubeA4A2:A34 | ThermoFisher Scientific | 150268 | |
| 1-Naphthylacetic acid | Gold Biotechnology | N-780 | |
| 3M Micropore Surgical Paper Tape | ThermoFisher Scientific | 19-027761 | |
| 50 mL Centrifuge Tubes | Research Products International Corp. | 163227LC | |
| 600 Watt High Pressure Sodium Lights | Plantmax | PX-LU600 | |
| 6-Benzylaminopurine (6-BAP) | Gold Biotechnology | B-110 | |
| Aluminum Foil | ThermoFisher Scientific | 01-213-100 | |
| Bacto Agar | Thermofisher Scientific | 214010 | |
| Binary Plasmid pBI101 | Clontech, USA | 632522 | |
| Cool White Grow Light Sylvania LLC | Home Depot | 315952205 | |
| D-biotin | ThermoFisher Scientific | BP232-1 | |
| ddH2O | |||
| DH5a E. coli | Invitrogen, USA | 18258012 | |
| Disposable Petri Dishes, Sterile 150 x 16 mm | ThermoFisher Scientific | FB0875712 | |
| Disposable Petri Dishes, Sterile 95 x 15 mm | ThermoFisher Scientific | FB0875714G | |
| Dissecting Scissors | Leica Biosystems | 38DI12044 | |
| Ethanol 200 Proof | Decon Labs | 2705 | |
| Folic Acid | Fisher Scientific | BP2519-5 | |
| Forceps | Leica Biosystems | 38DI18031 | |
| Gelrite | Research Products International Corp. | G35020-1000 | |
| Glycerol | ThermoFisher Scientific | 17904 | |
| Glycine | Sigma | 241261 | |
| Incubated Tabletop Orbital Shaker | ThermoFisher Scientific | SHKE420HP | |
| Indole-3-Acetic Acid (IAA) | Gold Biotechnology | I-110 | |
| Indole-3-Butyric Acid (IBA) | Gold Biotechnology | I-180 | |
| Kanamycin Monosulfate | Gold Biotechnology | K-120 | |
| Macrocentrifuge | ThermoFisher Scientific | 75007210 | |
| Magenta Boxes | ThermoFisher Scientific | 50255176 | |
| Micro Pipet Tips 1000 µL | Corning | 4140 | |
| Micro Pipet Tips 200 µL | Corning | 4138 | |
| Micro Pipette Tips 10 µL | Corning | 4135 | |
| Microcentrifuge | ThermoFisher Scientific | 75002410 | |
| Micropipettor 0.5-10 µL | Corning | 4071 | |
| Micropipettor 100-1000 µL | Corning | 4075 | |
| Micropipettor 20-200 µL | Corning | 4074 | |
| Micropipettor 2-20 µL | Corning | 4072 | |
| Murashige & Skooge Basal Medium with Vitamins | PhytoTech | M519 | |
| Murashige & Skooge Basal Salt Mixture | PhytoTech | M524 | |
| myo-Inositol | Gold Biotechnology | I-25 | |
| Nicotinic acid | Sigma | N0761-100g | |
| Parafilm (paraffin film) | ThermoFisher Scientific | S37440 | |
| Potassium Hydroxide (KOH) | Research Products International Corp. | P44000 | |
| Pyridoxine HCl | Sigma | P6280-10g | |
| Scalpel Blade Handle | Leica Biosystems | 38DI36419 | |
| Scalpel Blades | Leica Biosystems | 3802181 | |
| Sodium Chloride, Crystal (NaCl) | Mallinckrodt Chemicals | 7581-06 | |
| Sodium Hydroxide (NaOH) | Research Products International Corp. | S24000 | |
| Sodium Hypochlorite | Walmart | 23263068401 | |
| Soil- Bark Mix | Berger, USA | BM7 | |
| Square Pots (3.5 inches squared) | Greenhouse Megastore | CN-TRK-1835 | |
| Sucrose | Research Products International Corp. | S24060 | |
| Thermocycler | ThermoFisher Scientific | A24811 | |
| Thiamine HCl | Sigma | T4625-5G | |
| Timentin Ticarcillin/Clavulanate (15/1) (Timentin) | Gold Biotechnology | T-104 | |
| trans-Zeatin Riboside (ZR) | Gold Biotechnology | Z-100 | |
| Tryptone | Thermofisher Scientific | 211705 | |
| Wild Type Plantago lanceolata seeds | Outsidepride Seed Source, OR, USA | F1296 | Outsidepride.com |
| Yeast Extract Granulated | Research Products International Corp. | Y20025-1000 |
Referanslar
- Koornneef, M., Meinke, D. The development of Arabidopsis as a model plant. The Plant Journal. 61 (6), 909-921 (2010).
- Bragg, J. N., Anderton, A., Nieu, R., Vogel, J. P. Brachypodium distachyon. Agrobacterium Protocols. , 17-33 (2015).
- Chang, C., Bowman, J. L., Meyerowitz, E. M. Field guide to plant model systems. Cell. 167 (2), 325-339 (2016).
- Müller, B., Grossniklaus, U. Model organisms-a historical perspective. Journal of Proteomics. 73 (11), 2054-2063 (2010).
- Ding, X., et al. Different fruit-specific promoters drive AtMYB12 expression to improve phenylpropanoid accumulation in tomato. Molecules. 27 (1), 317 (2022).
- Niedbała, G., Niazian, M., Sabbatini, P. Modeling agrobacterium-mediated gene transformation of tobacco (Nicotiana tabacum)-a model plant for gene transformation studies. Frontiers in Plant Science. 12, 695110 (2021).
- Kumari, D., Prasad, B., Dwivedi, P. . Genome Editing Platforms in Rice (Oryza sativa L.): Basic methodology and troubleshooting. , (2022).
- Zhang, B. Agrobacterium-mediated transformation of cotton. Transgenic Cotton. , 31-45 (2013).
- Tiwari, R., Singh, A. K., Rajam, M. V. Improved and reliable plant regeneration and Agrobacterium-mediated genetic transformation in soybean (Glycine max L). Journal of Crop Science and Biotechnology. , 1-10 (2022).
- Bakhsh, A. Development of efficient, reproducible and stable Agrobacterium-mediated genetic transformation of five potato cultivars. Food Technology and Biotechnology. 58 (1), 57-63 (2020).
- Bates, R., Craze, M., Wallington, E. J. Agrobacterium-mediated transformation of oilseed rape (Brassica napus). Current Protocols in Plant Biology. 2 (4), 287-298 (2017).
- Hopp, H. E., Spangenberg, G., Herrera-Estrella, L. Plant transformation. Frontiers in Plant Science. 13, 876671 (2022).
- Abdelmuhsin, A. A., Alghamdi, A. A., Ibrahim, N. A. Assessing the phenotypic and genotypic variations of Plantago ciliata in Ha'il region, Saudi Arabia. Entomology and Applied Science Letters. (1), 14-22 (2021).
- Coleman, N. Plantago Lanceolata. Botanical Bulletin. 1 (11), 45 (1876).
- Huang, J., et al. Tissue-specific transcriptomic profiling of Plantago major provides insights for the involvement of vasculature in phosphate deficiency responses. Molecular Genetics and Genomics. 294 (1), 159-175 (2019).
- Penczykowski, R. M., Sieg, R. D. Plantago spp. as models for studying the ecology and evolution of species interactions across environmental gradients. The American Naturalist. 198 (1), 158-176 (2021).
- Pommerrenig, B., et al. Common plantain. A collection of expressed sequence tags from vascular tissue and a simple and efficient transformation method. Plant Physiology. 142 (4), 1427-1441 (2006).
- Bergero, R., Levsen, N., Wolff, K., Charlesworth, D. Arms races with mitochondrial genome soft sweeps in a gynodioecious plant, Plantago lanceolata. Molecular Ecology. 28 (11), 2772-2785 (2019).
- Aalto, E. A., Koelewijn, H. P., Savolainen, O. Cytoplasmic male sterility contributes to hybrid incompatibility between subspecies of Arabidopsis lyrata. G3: Genes, Genomes, Genetics. 3 (10), 1727-1740 (2013).
- Bloch, K. D., Grossmann, B. Digestion of DNA with restriction endonucleases. Current Protocols in Molecular Biology. 3 (1), (1995).
- Du, C., et al. Prokaryotic expression, purification, physicochemical properties and antifungal activity analysis of phloem protein PP2-A1 from cucumber. International Journal of Biological Macromolecules. 194, 395-401 (2022).
- Deshmukh, S. 2. 2., Kulkarni, R., Bose, K. Transformation and protein expression. Textbook on Cloning, Expression and Purification of Recombinant Proteins. , 83-114 (2022).
- Bergkessel, M., Guthrie, C. Colony PCR. Methods in Enzymology. 529, 299-309 (2013).
- Broehan, G., Kroeger, T., Lorenzen, M., Merzendorfer, H. Functional analysis of the ATP-binding cassette (ABC) transporter gene family of Tribolium castaneum. BMC Genomics. 14, 6 (2013).
- Dong, Z., et al. Stable transformation of fluorescent proteins into Nosema bombycis by electroporation. Parasites & Vectors. 15 (1), 141 (2022).
- Li, S., et al. Optimization of Agrobacterium-mediated transformation in soybean. Frontiers in Plant Science. 8, 246 (2017).
- Manimaran, P., et al. Infection of early and young callus tissues of indica rice BPT 5204 enhances regeneration and transformation efficiency. Rice Science. 20 (6), 415-426 (2013).
- Wang, J., Nie, J., Pattanaik, S., Yuan, L. Efficient Agrobacterium-mediated transformation of Artemisia annua L. using young inflorescence. In Vitro Cellular & Developmental Biology-Plant. 52 (2), 204-211 (2016).
- Niazian, M., Belzile, F., Torkamaneh, D. CRISPR/Cas9 in planta hairy root transformation: a powerful platform for functional analysis of root traits in soybean. Plants. 11 (8), 1044 (2022).
- Geng, S., et al. An efficient root transformation system for CRISPR/Cas9-based analyses of shoot-root communication in cucurbit crops. Horticulture Research. 9, (2022).
- Xiao, Y., et al. Efficient Agrobacterium-mediated genetic transformation using cotyledons, hypocotyls and roots of 'Duli'(Pyrus betulifolia Bunge). Scientia Horticulturae. 296, 110906 (2022).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır