Method Article
Agrobacterium tumefaciens - опосредованная генетическая трансформация подорожника узколистного
В этой статье
Резюме
Из-за его универсального применения в качестве модельного вида в различных областях исследования существует необходимость в наборе инструментов генетической трансформации у подорожника узколистного (Plantago lanceolata). Здесь с использованием Agrobacterium tumefaciens-опосредованного превращения представлен протокол, в результате которого получаются стабильные трансгенные линии с эффективностью трансформации 20%.
Аннотация
Виды рода Plantago обладают несколькими уникальными чертами, которые привели к тому, что они были адаптированы в качестве модельных растений в различных областях исследования. Однако отсутствие системы генетических манипуляций препятствует углубленному исследованию функции генов, ограничивая универсальность этого рода в качестве модели. Здесь представлен протокол трансформации для Plantago lanceolata, наиболее часто изучаемого вида Plantago. С помощью Agrobacterium tumefaciens-опосредованной трансформации 3-недельные корни асептически выращенных растений P. lanceolata заражали бактериями, инкубировали в течение 2-3 дней, а затем переносили в среду для индукции побегов с соответствующим подбором антибиотика. Побеги обычно появлялись из среды через 1 месяц, а корни развивались через 1-4 недели после того, как побеги были перенесены в среду для индукции корней. Затем растения акклиматизировали в почвенной среде и проверяли на наличие трансгена с помощью репортерного анализа β-глюкуронидазы (GUS). Эффективность трансформации текущего метода составляет ~ 20%, при этом на 10 трансформированных тканей корня появляются два трансгенных растения. Создание протокола трансформации подорожника узколистного облегчит принятие этого растения в качестве нового модельного вида в различных районах.
Введение
Концепция использования модельных видов для исследования многочисленных аспектов биологии растений возникла с широким использованием Arabidopsis thaliana1. Арабидопсис был первоначально выбран потому, что он имеет общие черты со многими другими цветковыми растениями и имеет множество признаков, которые делают его удобным для изучения в лабораторных условиях, например, маленький размер и короткий цикл генерации. Большой объем исследовательских работ, опубликованных с ним в качестве субъекта, наряду с его небольшим размером генома и простотой генетической трансформации2, позволяют ему сохраняться в качестве широко используемого экспериментального организма. Тем не менее, Arabidopsis может быть ограничен в качестве модели для видов с различными характеристиками или уникальными признаками3. Это послужило толчком к разработке новых модельных систем, таких как кукуруза (Zea mays), важное растение для генетики развития у однодольныхрастений 4, и томат (Solanum lycopersicum), который является важной моделью для эволюционных исследований, развития плодов и производства и является хорошим представлением для овощных культур5. Метод генетической трансформации является предпосылкой для того, чтобы вид растений служил модельным организмом2. Трансформация, опосредованная Agrobacterium tumefaciens, является надежным инструментом в биологии растений; он был использован для преобразования нескольких модельных видов и основных сельскохозяйственных культур, включая табак (Nicotiana tabacum)6, рис (Oryza sativa)7, хлопок (Gossypium hirsutum)8, сою (Glycine max)9, картофель (Solanum tuberosum)10 и рапс (Brassica napus)11. Виды растений сильно различаются по тому, насколько успешно они реагируют на инфекцию A. tumefaciens, и протоколы трансформации часто должны быть индивидуально адаптированы к каждому виду 6,12.
Род Plantago включает в себя в общей сложности 256 видов растений, широко распространенных по всему миру13. Виды этого рода часто обладают уникальными характеристиками, которые делают их желательными в качестве модельных видов для изучения генетики, экологии, физиологии стресса, вторичных метаболитов, медицинской химии, взаимодействия растений и микробов, развития и эволюции растений. Подорожник ланцетный , также называемый узколистным или ребристым подорожником, был популярным растением, представляющим интерес с 19века , когда он был впервые использован для описания явления мужского бесплодия14. Как и другие растения этого рода, он использовался в исследованиях в различных областях исследований. Совсем недавно он был предложен в качестве модели для сосудистой биологии, так как его сосудистая ткань может быть легко собрана15. P. lanceolata является наиболее часто изучаемым видом рода Plantago; в статье 2021 года сообщалось, что в то время насчитывалось >1,1,400 публикаций, включающих или относящихся к этому виду16, и еще 102 статьи были опубликованы с начала 2022 года, согласно поиску PubMed, проведенному 9декабря 2022 года. Следующее наиболее изученное растение рода, P. major, является предметом только 414 статей при поиске с использованием тех же критериев в ту же дату.
Несмотря на исследовательский интерес к P. lanceolata, исследования, особенно по характеристике функций генов, часто ограничиваются отсутствием инструментария генетических манипуляций для вида. Pommerrienig et al. предприняли усилия по разработке протокола трансформации для P. major, используя технику цветочного погружения17. Однако этот метод не может быть применен к P. lanceolata из-за мужской стерильности, характерной для этого вида18,19. Насколько нам известно, не существует протокола трансформации P. lanceolata.
В этом исследовании представлен простой протокол для A. tumefaciens-опосредованной трансформации P. lanceolata. Воздействуя на корневые ткани, полностью выращенные трансгенные растения могут быть получены в течение 3 месяцев после трансформации.
протокол
ПРИМЕЧАНИЕ: Этапы 1.4-1.8, 2.3-2.5, 3.3-3.6, 4.1-4.6, 5.1-5.7 и 6.1-6.3 должны выполняться в асептических условиях, с использованием чистого колпака для предотвращения загрязнения.
1. Размножение растительного материала для трансформации
- Поместите коммерчески доступные семена подорожника ланцетного (WT) дикорастущего типа (см. Таблицу материалов) в центрифужную пробирку объемом 50 мл до линии 5 мл, в зависимости от желаемого количества растений.
ПРИМЕЧАНИЕ: В качестве альтернативы, микроцентрифужную пробирку объемом 2 мл можно использовать, когда требуется небольшое количество семян, но она должна быть заполнена до объема не более 0,1 мл, так как слишком большое количество семян может снизить эффективность стерилизации. - Погрузите семена в 75% этанол на 60 с.
- Выбросьте этанол, затем погрузите семена в 20% гипохлорит натрия (20% NaClO, 80% стерильная вода) на 40 мин, осторожно перевернув пробирку так, чтобы все семена соприкоснулись с раствором.
ПРИМЕЧАНИЕ: Раствор гипохлорита натрия должен быть свежеприготовленным для достижения оптимальных результатов. - Под ламинарным колпаком откажитесь от раствора гипохлорита натрия, затем промойте семена дистиллированной водой (пять раз). Добавьте небольшое количество воды к семенам после окончательного ополаскивания, так как это может помочь перемещению растений на тарелки.
- С помощью стерилизованных щипцов переложите семена на заранее подготовленные чашки Петри размером 95 мм х 100 мм с твердой средой MS (табл. 1). Равномерно распределите семена по поверхности тарелки, примерно по 1 см между каждым семенем, чтобы предотвратить переполнение проросшей рассады (рис. 1А).
- Запечатайте пластины двумя слоями парафиновой пленки, чтобы предотвратить загрязнение, затем инкубируйте под холодным белым светом для выращивания растений (см. Таблицу материалов) при комнатной температуре (22 ° C с 50 мкмоль м-2 с-1, 12 ч дней). Семена обычно прорастают в течение 5-6 дней.
- Когда проростки прорастут и станут достаточно большими для переноса (рис. 1B), обычно через 2 или 3 дня после прорастания, используйте стерилизованные щипцы для переноса проростков в стерильные ящики с 50-100 мл среды MS (таблица 1). В идеале сажайте всего пять саженцев в ящике, чтобы получить корни наилучшего качества.
- Заклейте ящики хирургической лентой, затем дайте растениям расти под холодным белым светом (см. Таблицу материалов) в тех же условиях, которые указаны в шаге 1.6. Растения должны быть готовы к трансформации примерно через 3-4 недели или когда основные корни вырастут примерно на 2 см в длину, а боковые корни станут белыми.
ПРИМЕЧАНИЕ: Рецепты среднего приготовления и витаминные запасы включены в таблицу 1 и таблицу 2.
2. Построение плазмиды и трансформация кишечной палочки
ПРИМЕЧАНИЕ: Точная процедура построения плазмиды варьируется в зависимости от интересующего гена. В этой процедуре рестрикционные ферменты HindIII и SalII использовали для вставки промотора AtPP2 размером 1,5 кб в бинарную плазмиду pBI101 (см. Таблицу материалов) с GUS, используя стандартную процедуруклонирования 20. AtPP2 (белок флоэмы 2) представляет собой ген, который специфически экспрессируется во флоэме21.
- Клонируйте промотор, используя пары праймеров 5'-AGTCAAGCTTCAAGTCCCTGTGGCTACTGAAC-3' (Вперед) и 5'-AGTCGTCGACAAACCAGTATGATGTATTTATTTTTG-3' (Обратный) из Arabidopsis. На рисунке 2 показана схема бинарного плазмидного вектора со вставкой AtPP2:GUS .
- После построения плазмиды трансформируют плазмиды в DH5a E. coli (см. Таблицу материалов) компетентными клетками, используя методтеплового шока 22, а затем инкубируют в течение 1,5 ч при 37 °C с встряхиванием (150 об/мин).
- Берут 150 мкл каждой культуры превращения, помещают на пластины с агаровыми средами LB (таблица 1) с соответствующим отбором (50 мг/л канамицина для штамма, используемого в этом протоколе; см. Таблицу материалов), а затем инкубируют планшеты в течение 16-24 ч при 37 °C.
ПРИМЕЧАНИЕ: Бактериальный штамм, используемый в этом исследовании , - A. tumefaciens GV3101. - Затем используйте колониальную ПЦР для скрининга колоний на наличие положительных рекомбинантов23.
ПРИМЕЧАНИЕ: В этом протоколе для амплификации гена-мишени использовались следующие праймеры; 5'-ATGTTACGTCCTGTAGAAACCCCAA-3'(вперед) и 5'-TCATTGTGTGCCTCCCTGCTGCC-3' (назад).- Запустите реакцию в термоциклере (см. Таблицу материалов) с условиями циклирования 3 мин при 95 °C, затем 35 циклов: 30 с при 95 °C, 30 с при 55 °C, 2 мин при 72 °C и заключительный 10-минутный этап удлинения при 72 °C.
- Инокулируйте положительные колонии в 6 мл бульона LB (таблица 1) соответствующим антибиотиком (50 мг / л канамицина) и выращивайте при 37 ° C в течение ночи при 200-250 об/мин.
- После ночного роста извлекают плазмиды из бактерий с помощью стандартных процедур24.
3. Трансформация A. tumefaciens с помощью плазмиды
- После экстракции плазмиды используйте электропорацию для превращения модифицированной плазмиды в желаемый штамм компетентных клеток. В этой процедуре использовался штамм A. tumefaciens GV3101. Следуйте стандартизированным методам электропорации25.
- После электропорации ресуспендируют компетентные клетки в 1 мл бульона LB, а затем инкубируют в течение 2-4 ч при 28 ° C при 100 об/мин.
- Соберите клетки путем центрифугирования в дозе 6 800 x g в течение 3 мин в настольной микроцентрифуге (см. Таблицу материалов) при комнатной температуре (22 ° C), затем распределите 50-100 мкл на агаровой пластине LB с соответствующим селекционным агентом (50 мг / л канамицина для плазмиды, используемой в этом протоколе).
- После инкубации клеток в течение 2 дней при 28 ° C идентифицируют положительные колонии, содержащие интересующий ген, с помощью колонии ПЦР. В этом протоколе используйте праймеры и условия, упомянутые в шаге 2.4.
- Затем используйте положительные колонии, чтобы прополосить бульонную пластину агаровой средой LB + выбор. Пластину можно хранить при температуре 4 °C до 1 месяца.
- В качестве альтернативы, для длительного хранения, инокулировать положительную колонию небольшим объемом LB с соответствующим отбором. Встряхните инокулированную культуру в течение ночи при 28 ° C при 200 об/мин, затем приготовьте глицериновый бульон (50% мас. / об. глицерина в смеси бактерий и глицерина 50:50), который можно хранить при -80 ° C до 10 лет.
4. Препарат A. tumefaciens
- Нанесите полосу A. tumefaciens, содержащую желаемую плазмиду, на подготовленные твердые пластины LB размером 95 мм x 100 мм с соответствующим селекционным агентом. В этом протоколе использовался бактериальный штамм GV3101 с плазмидной вставкой AtPP2:GUS с добавлением 50 мг/л канамицина для отбора.
- Запечатайте пластины парафиновой пленкой, затем инкубируйте при 28 °C до 48 часов или до тех пор, пока бактерии не станут достаточно большими, чтобы их можно было собирать.
- Используйте наконечник пипетки, чтобы собрать колонию бактерий за 2 дня до трансформации и инокулировать ее в пробирку с круглым дном объемом 15 мл, содержащую 6 мл жидкого LB с соответствующим отбором. Встряхните при 200 об/мин в настольном шейкере с температурой 28 °C на ночь, пока OD600 не достигнет 0,6-0,7.
ПРИМЕЧАНИЕ: Планшеты и бактериальную инокуляцию объемом 6 мл можно хранить при температуре 4 ° C до 1 месяца. - Когда бактерии достигнут правильного OD 600, используйте пипетку для переноса A. tumefaciens в стерильную колбу, содержащую100 мл жидкого LB с селекционным агентом. Как правило, для размножения подходит 200 мкл бактерий на 100 мл фунта. Встряхните при 200 об/мин при 28 °C в течение ночи, пока OD600 не достигнет 0,6-0,7.
- Перенесите бактерии в стерильные центрифужные пробирки объемом 50 мл и центрифугируйте при 2 200 xg в течение 10 минут при комнатной температуре (22 °C) в настольной центрифуге для сбора бактерий.
- Откажитесь от надосадочной жидкости с помощью пипетки. Ресуспендируют бактериальную гранулу в 5 мл жидкого раствора суспензии (SS) (SS) комнатной температуры (22 °C) (таблица 1) путем пипетирования, затем добавляют до 50 мл SS и несколько раз инвертируют для перемешивания. Теперь бактерии готовы к трансформации.
ПРИМЕЧАНИЕ: Жидкий SS должен быть приготовлен свежим, в течение 1 недели после преобразования.
ВНИМАНИЕ: Все материалы, вступающие в контакт с A. tumefaciens , необходимо выбрасывать в контейнер для биологически опасных отходов. Остатки жидкости из бактериальных культур можно стерилизовать гипохлоритом натрия (отбеливателем) в концентрации 20% или выше.
5. Трансформация корней подорожника
- Когда растения достигнут идеальной стадии трансформации (сеянцам 3 недели) (рис. 1В), используйте стерильные щипцы и ножницы, чтобы отделить корни от остальной части растения (рис. 3А). Выбросьте листовой и стеблевой материал.
- Сразу после срезания переложите кусочки корня в стерильные коробки со стерильной водой с помощью стерильных щипцов. Этот шаг позволяет корням оставаться увлажненными, пока вся ткань собирается.
- Когда все корни будут срезаны, вылейте суспензию A. tumefaciens/SS в стерильные одноразовые чашки Петри размером 150 мм x 15 мм. Перенесите корни в культуру A. tumefaciens и прививайте не менее 20 мин (рис. 3B).
- Во время инкубации стерильным скальпелем с острым лезвием разрезают корни на фрагменты по 1 см, отделяя первичные корни от боковых. Сделайте тонкие неглубокие надрезы на поверхности корней, чтобы бактерии могли заразить растение.
ПРИМЕЧАНИЕ: Если вы имеете дело с большим количеством растений, переносите кусочки корней в бактериальную культуру партиями, чтобы убедиться, что все корни погружены во время инокуляции. - После инкубации используйте стерильные щипцы, чтобы перенести кусочки корня на стерильные бумажные полотенца, чтобы удалить лишние бактерии. Избегайте сушки корней более 60 с, так как это может вызвать обезвоживание и повредить корневую ткань. В идеале одновременно можно сушить 10-15 корней (рис. 3В).
- Переложите высушенные корни в подготовленные чашки Петри размером 95 мм x 15 мм с твердыми средами для совместной культуры (таблица 1), примерно 10-20 корней на тарелку, в зависимости от размера корней (рис. 3D).
- Запечатайте пластины двумя слоями прозрачной полиэтиленовой пленки, затем накройте алюминиевой фольгой. Инкубировать при комнатной температуре (22 °C) в течение 3 дней. Этот шаг дает бактериям время для заражения корней без присутствия выбора антибиотика (рис. 3E).
6. Селекция и регенерация всего растения
- После инкубации в средах для совместного культивирования переложите кусочки корня в подготовленные чашки Петри размером 95 мм x 15 мм с индукционной средой для твердых побегов (SIM) (таблица 1) с тиментином (500 мг/л; см. Таблицу материалов) и соответствующим подбором антибиотиков. В этом протоколе мы использовали канамицин (100 мг/л).
ПРИМЕЧАНИЕ: Нижняя часть корней должна полностью соприкасаться со средой. Корни, которые не касаются поверхности среды, слишком длинные, и их необходимо обрезать, чтобы ткань не ускользнула от отбора. - Запечатайте пластины двумя слоями прозрачной полиэтиленовой пленки, затем выращивайте под растущим светом в течение 1 месяца (см. шаг 1.6 для соответствующих условий) или до тех пор, пока побеги не начнут появляться.
ПРИМЕЧАНИЕ: Как правило, инициалы побегов можно наблюдать через 2 недели роста, а побеги обычно видны через 1 месяц. - Когда проростки достигнут длины 1,5-2,0 см (рис. 1D), переложите их в подготовленные стерильные ящики с твердыми корневыми индукционными средами (табл. 1).
- Выращивайте растения при растущем свете (см. Шаг 1.6 для условий) в течение нескольких недель, пока не образуются корни. Корни обычно можно увидеть впервые через 1 неделю.
ПРИМЕЧАНИЕ: Рекомендуется дать корням расти в течение нескольких недель, прежде чем переходить в почву, так как растения с более крупной корневой системой, как правило, имеют более высокую выживаемость в почве.
7. Перенос грунта
- Когда корневая система станет достаточно большой для переноса (рис. 1E), обычно после 1 месяца роста, пересадите растения в 3,5 квадратных горшка с предварительно увлажненной универсальной почвой (BM7). В этом протоколе использовалась смесь коры BM7 (см. Таблицу материалов).
- Удалите любую среду, которая прилипает к корням, осторожно промойте их в воде.
ПРИМЕЧАНИЕ: Растения можно выращивать до зрелости в теплице при температуре от 800 до 1400 мкмоль фотонов м-2 с-2 с использованием ламп высокого давления натрия мощностью 600 Вт (см. Таблицу материалов) или в камере для выращивания при комнатной температуре (22 ° C) с холодным белым светом при 50 мкмоль м-2 с-1, 12 ч дней.
- Удалите любую среду, которая прилипает к корням, осторожно промойте их в воде.
- Накройте растения пластиковой крышкой горшка, затем накройте их прозрачным полиэтиленовым пакетом. Этот шаг позволяет растениям оставаться во влажной среде, поскольку они адаптируются к почве.
- Примерно через 3-5 дней снимите полиэтиленовый пакет, затем медленно снимите крышку, чтобы обеспечить акклиматизацию к внешней среде.
ПРИМЕЧАНИЕ: В зависимости от времени года и среды, в которую переносятся растения, время, необходимое растениям для адаптации, может варьироваться. Рекомендуется ежедневно проверять растения и добавлять воду в горшки по мере необходимости. - Регулярно поливайте растения и добавляйте удобрения по мере необходимости. Растения также можно пересадить в горшки большего размера для дальнейшего роста (рис. 1F).
8. Гистохимическое окрашивание β-глюкуронидазы (GUS)
- Приготовьте раствор для окрашивания β-глюкуронидазы (GUS) в соответствии с опубликованными протоколами15.
- Когда инициалы побега достигнут длины около 0,5-1 см, удалите небольшой кончик молодого, полностью развернутого листа (обычно достаточно <5 мм в длину) и немедленно перенесите в 0,5-1 мл раствора для окрашивания GUS в микроцентрифужной пробирке объемом 1,5 или 2 мл. Раствор должен полностью покрывать ткани растения.
- Поместите открытые пробирки в вакуумный эксикатор и вакуумируйте при 20-25 кПа в течение 5-10 мин. Во время вакуумной процедуры в растворе должны быть видны мелкие пузырьки. Это позволяет раствору проникать в клетки растения.
- Дайте воздуху отфильтроваться обратно в вакуумный эксикатор. Закройте пробирки и инкубируйте при температуре 37 °C в течение ночи (12 часов) или до тех пор, пока не станет виден синий цвет.
ПРИМЕЧАНИЕ: В этом исследовании активность GUS была локализована во флоэме, а это означает, что у положительно преобразованных растений синее окрашивание должно быть видно только в ткани флоэмы. Растения без трансгена не испытывают окрашивания (рис. 4). - Чтобы лучше визуализировать пятно, переведите растения на 100% этанол для удаления хлорофилла. Чтобы повысить эффективность процесса удаления хлорофилла, инкубируйте пробирки при 60 ° C в течение 10 мин.
ПРИМЕЧАНИЕ: Этанол, возможно, придется менять несколько раз, прежде чем весь хлорофилл будет удален, в зависимости от размера окрашиваемого листа.
Результаты
Здесь сообщается о простом протоколе получения трансгенных растений P. lanceolata с использованием A. tumefaciens-опосредованной трансформации. Репортерный ген GUS (кодирующий β-глюкуронидазу) трансформируется, движимый экспрессируемым флоэмой промотором AtPP2, в 3-недельные корни P. lanceolata через штамм A. tumefaciens GV3101 (рис. 2). Флоэм-специфический промотор был выбран потому, что наш основной интерес заключался в создании системы функциональной геномики сосудистых тканей растений, в частности флоэмы. Метод был протестирован на ткани корня, листа и черешка в предварительном эксперименте. Хотя мозоль может быть индуцирована во всех типах тканей, только корневая ткань продуцировала инициалы побегов (рис. 5A) через 1 месяц в SIM; лист и черешок побурели и отмерли (рис. 5Б). Это привело к выводу, что корневая ткань является оптимальным типом ткани для использования в методе трансформации. Корни инкубировали в подготовленных бактериях, ресуспендированных в суспензионном растворе (СС) (таблица 1) в течение не менее 20 мин, затем инкубировали при комнатной температуре на твердых пластинах СС до 3 дней в темноте (рис. 3E). Затем корни переносили в индукционную среду для побегов (SIM) и держали под растущим светом в условиях, указанных в протоколе (шаг 1.6). На рисунках 1 и 3 показаны репрезентативные изображения каждого шага протокола для справки.
На рисунке 6 показана прогрессия инициалов побегов, появляющихся из преобразованной ткани, с первого дня, когда корни были помещены на SIM (рис. 6A), до момента, когда побеги были готовы к укоренению (рис. 6D). Через 1 неделю в ткани корня образовалась каллус (рис. 6Б), и можно было наблюдать зачатки инициалов побегов (рис. 6В1). Всходы продолжали появляться в течение 2 и 3 недель (рис. 6C), а через 4 недели побеги были готовы к переносу в среду для индукции корней (рис. 6D).
Идентификация предполагаемых трансгенных растений проводилась с использованием гистохимического анализа β-глюкуронидазы (GUS) с использованием сегментов листьев, взятых после того, как побеги достигли длины около 0,5 см. Положительные трансгенные растения показали ожидаемую картину окрашивания в локализованной ткани флоэмы, показанную на рисунке 4. Побеги, окрашенные положительным GUS, были перенесены в среду для индукции корней, в которой через 4 недели у них развилась надежная корневая система (рис. 1E). Затем укоренившиеся растения переносили в почву. На рисунке 4 показан результат окрашивания в узколистном подорожнике, трансформированном промотором AtPP2 и геном β-глюкуронидазы (GUS), а также в подорожнике дикого типа и подорожнике узколистном, трансформированном промотором AtPP2 , для сравнения. Все появившиеся побеги были подтверждены как трансгенные. Было определено, что эффективность трансформации составляет в среднем 20%, при этом на каждые 10 преобразованных корней появляется примерно два побега. Подтвержденные трансгенные растения переносили в большие горшки и выращивали в течение 4-8 недель, пока они не достигли взрослой стадии (рис. 1F).
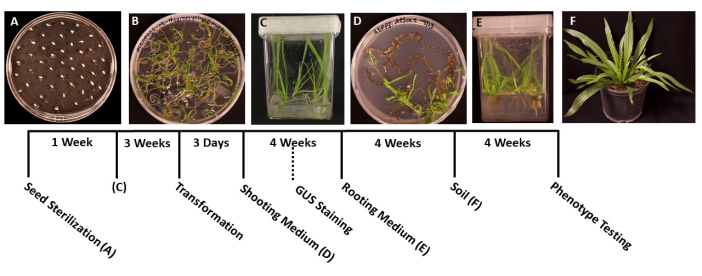
Рисунок 1: Хронология трансформации подорожника ланцетного . Репрезентативные изображения каждого этапа протокола. (А) Непроросшие семена, нанесенные на тарелку МС. (B) Семена, проросшие через 1 неделю, готовы к переносу в пурпурные коробочки. (C) Растения в коробках MS после 3 недель роста. Корни зеленые и здоровые, на идеальной стадии преображения. (D) Побеги в индукционных средах через 4 недели готовы к переносу в среду для укоренения. На этом этапе можно провести гистохимическое окрашивание β-глюкуронидазы (GUS), если это применимо. (E) Растения в ящиках с индукционными средами для корней, где корни образовались после 4 недель роста. (F) Трансгенные растения выращиваются до полной длины после 4 недель роста в почве. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
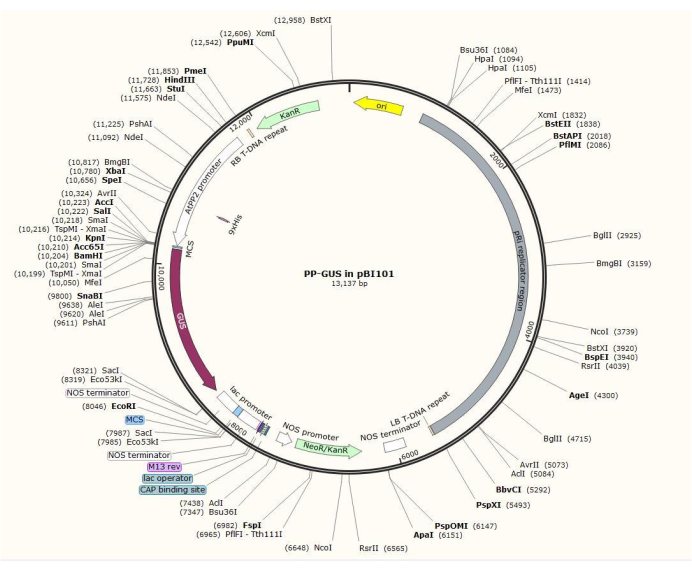
Рисунок 2: Диаграмма бинарной векторной плазмиды pBI101 + β-глюкуронидазы (GUS) со вставленным флоэм-специфическим промотором AtPP2. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
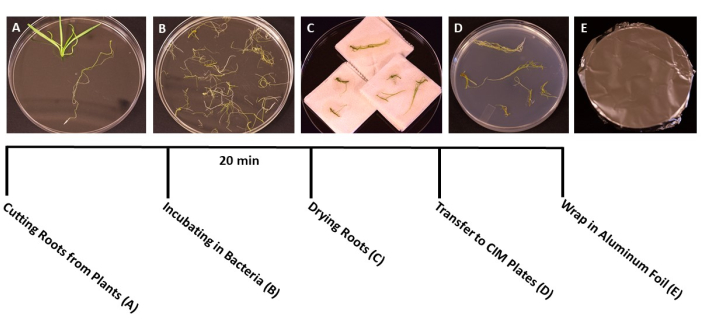
Рисунок 3: Этапы трансформации. Репрезентативные изображения каждого шага трансформации. (А) Отделение корней от побегов во время трансформации. (B) Замачивание корней в суспензии бактерий / SS. (C) Сушка корней на бумажных полотенцах для удаления лишних бактерий. (D) Корни, нанесенные на среду для совместной культуры. (E) Пластины SS, завернутые в алюминиевую фольгу. Растения инкубировали в течение 2-3 дней перед переносом на съемочную среду. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
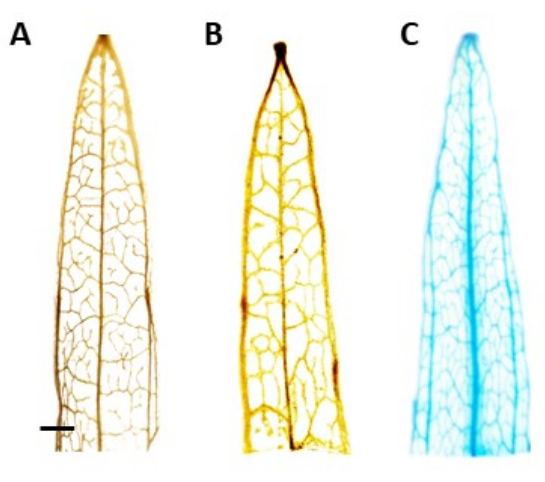
Рисунок 4: GUS-окрашивание. Результаты окрашивания β-глюкуронидазы (GUS ) сегментов листьев подорожника узколистного. (А) Дикий тип. (B) Узколистный подорожник, трансформированный плазмидой, которая содержит промотор AtPP2 (пустой вектор). (C) Подорожник узколистный, трансформированный плазмидой, содержащей промотор AtPP2 и ген β-глюкуронидазы (GUS). Каждый лист окрашивали с использованием протокола гистохимического окрашивания GUS, а затем визуализировали с помощью микроскопической камеры. Изображения (B) и (C) не показывают окрашивания из-за отсутствия гена GUS. На правом изображении видно четкое синее окрашивание в прожилках, подтверждающее, что растения являются трансгенными. Стержень представляет собой 1 мм, при этом каждый сегмент листа имеет длину около 1 см. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
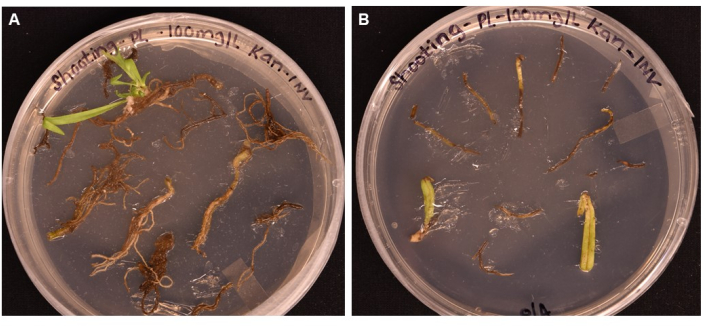
Рисунок 5: Сравнение эффективности трансформации различных типов тканей после инкубации >1 месяца на съемочных средах . (A) Корневые ткани после роста более 1 месяца. Корни испытали расширенную мозоль, и появились инициалы побегов. Нетрансформированная мозоль начала отмирать в ответ на подбор антибиотиков. (B) Ткани листьев и черешков после роста более 1 месяца. Ткани испытали некоторое расширение мозоли, но вскоре умерли в ответ на антибиотик. Ни из одной из тканей не появилось ни одного побега. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
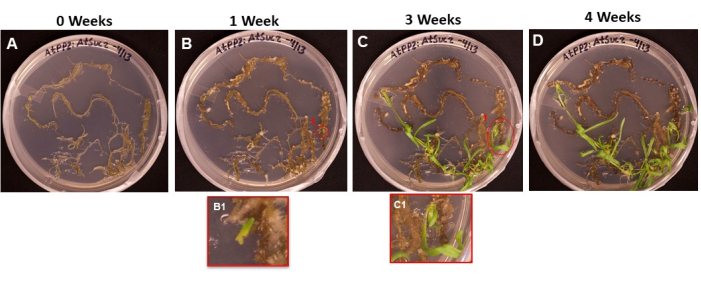
Рисунок 6: Появление мозоли и побегов на трансформированной ткани. Репрезентативные изображения тканей, помещенных на съемочную среду после разной продолжительности инкубации. (A) Корневые ткани сразу после нанесения на стреляющую среду. (Б) Корневые ткани через 1 неделю на съемочной среде. Можно наблюдать расширение костной костли, и (B1) начали появляться первые инициалы побега. (С) Корневые ткани через 3 недели на съемочной среде. Появилось больше инициалов съемки. (С1) Побег, возникший из начального выстрела B1. (D) Ткани корня после 4 недель инкубации. Нетрансформированные ткани начали становиться черными/коричневыми и отмирать, а появляющиеся побеги продолжают расти. На этом этапе побеги готовы к перемещению в среду для укоренения. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Таблица 1: Рецепты приготовления среды. Описание того, как подготовить медиумы к трансформации. Количество добавляемых витаминов рассчитывается исходя из указанной концентрации исходного раствора. В таблице 2 приведено приготовление раствора витаминного сырья. Для всех сред добавьте реагенты в 900 мл двойной дистилляции H2O, pH до указанного уровня, а затем добавьте воду до конечного объема 1000 мл. * = добавить после стерилизации. ** = рН с 1 М КОН. = рН с 1 М NaOH. Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
Таблица 2: Запасы витаминов для сред Plantago . Все витамины перед хранением должны быть отфильтрованы, стерилизованы и точно маркированы. Там, где указано, сначала растворите порошки в 1 N NaOH, затем заполните желаемый объем двойной дистиллированной H2O. Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
Обсуждение
Отсутствие протокола трансформации для растений рода Plantago ограничивает использование этих растений в качестве моделей, особенно когда исследователи заинтересованы в изучении функций генов. P. lanceolata был выбран для разработки протокола генетической трансформации, потому что он является наиболее часто изучаемым растением своего рода16. Разработанный протокол, вероятно, будет использоваться в качестве инструмента для дальнейшего продвижения исследований, связанных с сосудистой биологией, экологией, взаимодействием растений и насекомых и физиологией абиотического стресса.
В представленном протоколе четко изложены шаги, которые позволяют пользователю получить трансгенные растения. Помимо способности P. lanceolata процветать в среде культивирования тканей, успех нашего метода трансформации способствовал множеству факторов. Во-первых, была отмечена важность использования высококачественной, стерильной ткани корня растений для трансформации. Корни имели самые высокие скорости трансформации, когда они были взяты из 3-4-недельных растений, и казались зелеными или бледно-белыми. Корни, взятые из ящиков с любым количеством бактериального или грибкового загрязнения, часто приводили к заражению побеговых культур, а старые корни, которые казались коричневыми, не приводили к успешной трансформации. Корневая ткань была наиболее эффективным типом ткани для трансформации с использованием современного метода, так как ткань листа и черешка не была успешной при развитии побегов.
Еще одно важное наблюдение заключалось в том, что оптимальным методом сбора корневой ткани для трансформации было помещение свежесрезанного корневого материала в стерильную воду. Этот этап эффективно позволял корневому материалу оставаться гидратированным, в то время как оставшаяся часть ткани была собрана, поскольку корни имеют тенденцию быстро высыхать при удалении из контейнеров для роста. Этот шаг также помог увеличить вероятность успеха трансформации, потому что он позволил одновременно инкубировать больше корней в бактериях.
Этот протокол может быть изменен путем уменьшения времени инкубации корневой ткани в среде совместного культивирования до 2 дней. Было отмечено, что 2-3-дневный инкубационный период достаточен для того, чтобы допустить заражение, которое приводит к инициалам побегов. Однако более длительное время инкубации не рекомендуется, поскольку было замечено, что отсутствие ингибитора антибиотика в среде часто приводит к чрезмерному росту A. tumefaciens , который может убить формирующуюся ткань.
Ограничением этого исследования является отсутствие доступных данных о производительности других методов или видов A. tumefaciens в трансформации P. lanceolata для сравнения. Насколько нам известно, этот протокол является новым. Во время первоначальных испытаний была отмечена высокая эффективность трансформации с A. tumefaciens GV3101, и мы сосредоточились на совершенствовании методики с использованием этого штамма вместо экспериментов с другими штаммами. Наша эффективность трансформации в 20% относительно высока для трансформации растений - многие традиционные методы считают успешным все, что >1% 26,27,28. Однако использование другого штамма A. tumefaciens, такого как A. rhizogenes, известного своим использованием в трансформации корней у нескольких видов 29,30,31, может привести к еще более высокому уровню успеха. Потребуются дальнейшие эксперименты для оценки влияния использования других штаммов на повышение эффективности трансформации P. lanceolata.
Успешная трансформация P. lanceolata , вероятно, принесет пользу многим областям исследования. Высокая эффективность трансформации и быстрый рост растения в средах для культивирования тканей делают P. lanceolata возможным кандидатом для изучения функции генов15.
Раскрытие информации
Авторам раскрывать нечего.
Благодарности
Эта работа была поддержана Национальным научным фондом (EDGE IOS-1923557 для C.Z. и Y.Z.).
Материалы
| Name | Company | Catalog Number | Comments |
| 14 mL Round Bottom TubeA4A2:A34 | ThermoFisher Scientific | 150268 | |
| 1-Naphthylacetic acid | Gold Biotechnology | N-780 | |
| 3M Micropore Surgical Paper Tape | ThermoFisher Scientific | 19-027761 | |
| 50 mL Centrifuge Tubes | Research Products International Corp. | 163227LC | |
| 600 Watt High Pressure Sodium Lights | Plantmax | PX-LU600 | |
| 6-Benzylaminopurine (6-BAP) | Gold Biotechnology | B-110 | |
| Aluminum Foil | ThermoFisher Scientific | 01-213-100 | |
| Bacto Agar | Thermofisher Scientific | 214010 | |
| Binary Plasmid pBI101 | Clontech, USA | 632522 | |
| Cool White Grow Light Sylvania LLC | Home Depot | 315952205 | |
| D-biotin | ThermoFisher Scientific | BP232-1 | |
| ddH2O | |||
| DH5a E. coli | Invitrogen, USA | 18258012 | |
| Disposable Petri Dishes, Sterile 150 x 16 mm | ThermoFisher Scientific | FB0875712 | |
| Disposable Petri Dishes, Sterile 95 x 15 mm | ThermoFisher Scientific | FB0875714G | |
| Dissecting Scissors | Leica Biosystems | 38DI12044 | |
| Ethanol 200 Proof | Decon Labs | 2705 | |
| Folic Acid | Fisher Scientific | BP2519-5 | |
| Forceps | Leica Biosystems | 38DI18031 | |
| Gelrite | Research Products International Corp. | G35020-1000 | |
| Glycerol | ThermoFisher Scientific | 17904 | |
| Glycine | Sigma | 241261 | |
| Incubated Tabletop Orbital Shaker | ThermoFisher Scientific | SHKE420HP | |
| Indole-3-Acetic Acid (IAA) | Gold Biotechnology | I-110 | |
| Indole-3-Butyric Acid (IBA) | Gold Biotechnology | I-180 | |
| Kanamycin Monosulfate | Gold Biotechnology | K-120 | |
| Macrocentrifuge | ThermoFisher Scientific | 75007210 | |
| Magenta Boxes | ThermoFisher Scientific | 50255176 | |
| Micro Pipet Tips 1000 µL | Corning | 4140 | |
| Micro Pipet Tips 200 µL | Corning | 4138 | |
| Micro Pipette Tips 10 µL | Corning | 4135 | |
| Microcentrifuge | ThermoFisher Scientific | 75002410 | |
| Micropipettor 0.5-10 µL | Corning | 4071 | |
| Micropipettor 100-1000 µL | Corning | 4075 | |
| Micropipettor 20-200 µL | Corning | 4074 | |
| Micropipettor 2-20 µL | Corning | 4072 | |
| Murashige & Skooge Basal Medium with Vitamins | PhytoTech | M519 | |
| Murashige & Skooge Basal Salt Mixture | PhytoTech | M524 | |
| myo-Inositol | Gold Biotechnology | I-25 | |
| Nicotinic acid | Sigma | N0761-100g | |
| Parafilm (paraffin film) | ThermoFisher Scientific | S37440 | |
| Potassium Hydroxide (KOH) | Research Products International Corp. | P44000 | |
| Pyridoxine HCl | Sigma | P6280-10g | |
| Scalpel Blade Handle | Leica Biosystems | 38DI36419 | |
| Scalpel Blades | Leica Biosystems | 3802181 | |
| Sodium Chloride, Crystal (NaCl) | Mallinckrodt Chemicals | 7581-06 | |
| Sodium Hydroxide (NaOH) | Research Products International Corp. | S24000 | |
| Sodium Hypochlorite | Walmart | 23263068401 | |
| Soil- Bark Mix | Berger, USA | BM7 | |
| Square Pots (3.5 inches squared) | Greenhouse Megastore | CN-TRK-1835 | |
| Sucrose | Research Products International Corp. | S24060 | |
| Thermocycler | ThermoFisher Scientific | A24811 | |
| Thiamine HCl | Sigma | T4625-5G | |
| Timentin Ticarcillin/Clavulanate (15/1) (Timentin) | Gold Biotechnology | T-104 | |
| trans-Zeatin Riboside (ZR) | Gold Biotechnology | Z-100 | |
| Tryptone | Thermofisher Scientific | 211705 | |
| Wild Type Plantago lanceolata seeds | Outsidepride Seed Source, OR, USA | F1296 | Outsidepride.com |
| Yeast Extract Granulated | Research Products International Corp. | Y20025-1000 |
Ссылки
- Koornneef, M., Meinke, D. The development of Arabidopsis as a model plant. The Plant Journal. 61 (6), 909-921 (2010).
- Bragg, J. N., Anderton, A., Nieu, R., Vogel, J. P. Brachypodium distachyon. Agrobacterium Protocols. , 17-33 (2015).
- Chang, C., Bowman, J. L., Meyerowitz, E. M. Field guide to plant model systems. Cell. 167 (2), 325-339 (2016).
- Müller, B., Grossniklaus, U. Model organisms-a historical perspective. Journal of Proteomics. 73 (11), 2054-2063 (2010).
- Ding, X., et al. Different fruit-specific promoters drive AtMYB12 expression to improve phenylpropanoid accumulation in tomato. Molecules. 27 (1), 317 (2022).
- Niedbała, G., Niazian, M., Sabbatini, P. Modeling agrobacterium-mediated gene transformation of tobacco (Nicotiana tabacum)-a model plant for gene transformation studies. Frontiers in Plant Science. 12, 695110 (2021).
- Kumari, D., Prasad, B., Dwivedi, P. . Genome Editing Platforms in Rice (Oryza sativa L.): Basic methodology and troubleshooting. , (2022).
- Zhang, B. Agrobacterium-mediated transformation of cotton. Transgenic Cotton. , 31-45 (2013).
- Tiwari, R., Singh, A. K., Rajam, M. V. Improved and reliable plant regeneration and Agrobacterium-mediated genetic transformation in soybean (Glycine max L). Journal of Crop Science and Biotechnology. , 1-10 (2022).
- Bakhsh, A. Development of efficient, reproducible and stable Agrobacterium-mediated genetic transformation of five potato cultivars. Food Technology and Biotechnology. 58 (1), 57-63 (2020).
- Bates, R., Craze, M., Wallington, E. J. Agrobacterium-mediated transformation of oilseed rape (Brassica napus). Current Protocols in Plant Biology. 2 (4), 287-298 (2017).
- Hopp, H. E., Spangenberg, G., Herrera-Estrella, L. Plant transformation. Frontiers in Plant Science. 13, 876671 (2022).
- Abdelmuhsin, A. A., Alghamdi, A. A., Ibrahim, N. A. Assessing the phenotypic and genotypic variations of Plantago ciliata in Ha'il region, Saudi Arabia. Entomology and Applied Science Letters. (1), 14-22 (2021).
- Coleman, N. Plantago Lanceolata. Botanical Bulletin. 1 (11), 45 (1876).
- Huang, J., et al. Tissue-specific transcriptomic profiling of Plantago major provides insights for the involvement of vasculature in phosphate deficiency responses. Molecular Genetics and Genomics. 294 (1), 159-175 (2019).
- Penczykowski, R. M., Sieg, R. D. Plantago spp. as models for studying the ecology and evolution of species interactions across environmental gradients. The American Naturalist. 198 (1), 158-176 (2021).
- Pommerrenig, B., et al. Common plantain. A collection of expressed sequence tags from vascular tissue and a simple and efficient transformation method. Plant Physiology. 142 (4), 1427-1441 (2006).
- Bergero, R., Levsen, N., Wolff, K., Charlesworth, D. Arms races with mitochondrial genome soft sweeps in a gynodioecious plant, Plantago lanceolata. Molecular Ecology. 28 (11), 2772-2785 (2019).
- Aalto, E. A., Koelewijn, H. P., Savolainen, O. Cytoplasmic male sterility contributes to hybrid incompatibility between subspecies of Arabidopsis lyrata. G3: Genes, Genomes, Genetics. 3 (10), 1727-1740 (2013).
- Bloch, K. D., Grossmann, B. Digestion of DNA with restriction endonucleases. Current Protocols in Molecular Biology. 3 (1), (1995).
- Du, C., et al. Prokaryotic expression, purification, physicochemical properties and antifungal activity analysis of phloem protein PP2-A1 from cucumber. International Journal of Biological Macromolecules. 194, 395-401 (2022).
- Deshmukh, S. 2. 2., Kulkarni, R., Bose, K. Transformation and protein expression. Textbook on Cloning, Expression and Purification of Recombinant Proteins. , 83-114 (2022).
- Bergkessel, M., Guthrie, C. Colony PCR. Methods in Enzymology. 529, 299-309 (2013).
- Broehan, G., Kroeger, T., Lorenzen, M., Merzendorfer, H. Functional analysis of the ATP-binding cassette (ABC) transporter gene family of Tribolium castaneum. BMC Genomics. 14, 6 (2013).
- Dong, Z., et al. Stable transformation of fluorescent proteins into Nosema bombycis by electroporation. Parasites & Vectors. 15 (1), 141 (2022).
- Li, S., et al. Optimization of Agrobacterium-mediated transformation in soybean. Frontiers in Plant Science. 8, 246 (2017).
- Manimaran, P., et al. Infection of early and young callus tissues of indica rice BPT 5204 enhances regeneration and transformation efficiency. Rice Science. 20 (6), 415-426 (2013).
- Wang, J., Nie, J., Pattanaik, S., Yuan, L. Efficient Agrobacterium-mediated transformation of Artemisia annua L. using young inflorescence. In Vitro Cellular & Developmental Biology-Plant. 52 (2), 204-211 (2016).
- Niazian, M., Belzile, F., Torkamaneh, D. CRISPR/Cas9 in planta hairy root transformation: a powerful platform for functional analysis of root traits in soybean. Plants. 11 (8), 1044 (2022).
- Geng, S., et al. An efficient root transformation system for CRISPR/Cas9-based analyses of shoot-root communication in cucurbit crops. Horticulture Research. 9, (2022).
- Xiao, Y., et al. Efficient Agrobacterium-mediated genetic transformation using cotyledons, hypocotyls and roots of 'Duli'(Pyrus betulifolia Bunge). Scientia Horticulturae. 296, 110906 (2022).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены