Method Article
Agrobacterium tumefaciens - 좁은 잎 질경이의 매개 유전자 변형
요약
다양한 연구 분야에서 모델 종으로 다용도로 적용되기 때문에 좁은 잎 질경이 (Plantago lanceolata)의 유전자 변형 툴킷이 필요합니다. 여기에서 Agrobacterium tumefaciens 매개 형질전환을 사용하여 형질전환 효율이 20%인 안정적인 형질전환 계통을 생성하는 프로토콜이 제시됩니다.
초록
Plantago 속의 종은 다양한 연구 분야에서 모델 식물로 채택 된 몇 가지 독특한 특성을 가지고 있습니다. 그러나 유전자 조작 시스템의 부족은 유전자 기능에 대한 심층 조사를 방해하여 모델로서의 이 속의 다양성을 제한합니다. 여기에서는 가장 일반적으로 연구되는 Plantago 종인 Plantago lanceolata에 대한 형질 전환 프로토콜이 제시됩니다. 아그로박테리움 투메파시엔스 매개 형질전환을 사용하여 무균적으로 자란 P. lanceolata 식물의 3주령 뿌리를 박테리아에 감염시키고 2-3일 동안 배양한 다음 적절한 항생제 선택과 함께 싹 유도 배지로 옮겼습니다. 새싹은 일반적으로 1개월 후에 배지에서 나오고 뿌리는 새싹이 뿌리 유도 배지로 옮겨진 후 1-4주 후에 발달합니다. 그런 다음 식물을 토양 환경에 적응시키고 β-글루쿠로니다아제(GUS) 리포터 분석을 사용하여 이식유전자의 존재 여부를 테스트했습니다. 현재 방법의 형질전환 효율은 ~20%이며, 형질전환된 뿌리 조직 10개당 2개의 형질전환 식물이 출현합니다. 협엽 질경이에 대한 형질 전환 프로토콜을 수립하면 이 식물을 다양한 영역에서 새로운 모델 종으로 채택하는 것을 촉진할 것입니다.
서문
식물 생물학의 여러 측면을 조사하기 위해 모델 종을 사용한다는 개념은 Arabidopsis thaliana1의 광범위한 사용과 함께 나타났습니다. 애기장대는 다른 많은 꽃 피는 식물과 특징을 공유하고 작고 짧은 생성 주기와 같이 실험실 환경에서 연구하기 편리한 여러 특성을 가지고 있기 때문에 처음에 선택되었습니다. 게놈 크기가 작고 유전자 변형이 용이한 것과 함께 주제로 발표된 많은 양의 연구 논문2은 널리 사용되는 실험 유기체로 지속될 수 있게 한다. 그러나, 애기장대는 다른 특성이나 독특한 형질을 가진 종에 대한 모델로 제한될 수 있다3. 이로 인해 외떡잎식물4의 발달유전학에 중요한 식물인 옥수수(Zea mays)와 진화 연구, 과일 발달 및 생산에 중요한 모델인 토마토(Solanum lycopersicum)와 같은 새로운 모델 시스템의 개발이 촉진되었으며, 채소 작물5의 좋은 대표가된다. 유전자 변형을 위한 방법은 식물종이 모델유기체 역할을 하기 위한 전제 조건이다2. Agrobacterium tumefaciens 매개 형질전환은 식물 생물학에서 신뢰할 수 있는 도구입니다. 담배 (Nicotiana tabacum) 6, 쌀 (Oryza sativa) 7, 목화 (Gossypium hirsutum) 8, 콩 (Glycine max) 9, 감자 (Solanum tuberosum) 10 및 카놀라 (Brassica napus) 11. 식물 종은 A. tumefaciens 감염에 얼마나 성공적으로 반응하는지에 따라 매우 다양하며, 형질전환 프로토콜은 종종 각 종에 개별적으로 맞춰져야 합니다 6,12.
Plantago 속은 전 세계적으로 널리 분포하는 총 256 종의 식물 종을 포함합니다13. 이 속의 종은 종종 유전학, 생태학, 스트레스 생리학, 2차 대사 산물, 의약 화학, 식물-미생물 상호 작용, 식물 발달 및 진화를 연구하기 위한 모델 종으로 바람직한 고유한 특성을 가지고 있습니다. Narrowleaf 또는 ribwort 질경이라고도 불리는 질경이 란쾨라타(Plantago lanceolata)는 수컷의 불임 현상을 묘사하는 데 처음 사용된 19세기 이래로 인기 있는 식물이었다14. 그 속의 다른 식물과 마찬가지로 다양한 연구 분야의 연구에 사용되었습니다. 보다 최근에는, 혈관 조직을 쉽게 채취할 수 있기 때문에 혈관 생물학의 모델로 제안되었다15. P. lanceolata는 Plantago 속에서 가장 일반적으로 연구되는 종입니다. 2021년 기사에 따르면 2022년 12월 9일에 수행된 PubMed 검색에 따르면 당시 이 종을 포함하거나 관련된 출판물이1,400개 >16개 있었고 2022년 초부터 102개의 기사가 추가로 출판되었다고 보고했습니다. 속(genus)에서 다음으로 가장 많이 연구된 식물인 P. major는 같은 날짜에 동일한 기준을 사용하여 검색했을 때 414개의 기사의 주제입니다.
P. lanceolata에 대한 연구 관심에도 불구하고, 특히 유전자 기능 특성화에 대한 연구는 종종 종에 대한 유전자 조작 툴킷의 부족으로 인해 제한됩니다. Pommerrienig et al. 꽃 딥 기법17을 사용하여 P. major에 대한 형질전환 프로토콜을 개발하기 위해 노력했습니다. 그러나 이 방법은 이 종의 수컷 불임 특성 때문에 P. lanceolata에 적용할 수 없습니다18,19. 우리가 아는 한, P. lanceolata의 변형에 대한 기존 프로토콜은 없습니다.
이 연구는 P. lanceolata의 A. tumefaciens 매개 형질전환에 대한 간단한 프로토콜을 제시합니다. 뿌리 조직을 표적으로 삼음으로써 완전히 자란 형질전환 식물을 형질전환 후 3개월 이내에 생성할 수 있습니다.
프로토콜
알림: 1.4-1.8, 2.3-2.5, 3.3-3.6, 4.1-4.6, 5.1-5.7 및 6.1-6.3단계는 오염을 방지하기 위해 깨끗한 후드를 사용하여 무균 상태에서 수행해야 합니다.
1. 변형을 위한 식물 재료 번식
- 시중에서 판매되는 야생형(WT) 질경이 란쾡 이 종자( 재료 표 참조)를 원하는 식물 수에 따라 최대 5mL 라인까지 50mL 원심분리기 튜브에 넣습니다.
알림: 또는 적은 수의 종자가 필요할 때 2mL 미세 원심분리기 튜브를 사용할 수 있지만 종자가 너무 많으면 멸균 효율이 떨어질 수 있으므로 0.1mL 이하의 부피로 채워야 합니다. - 씨앗을 75 % 에탄올에 60 초 동안 담그십시오.
- 에탄올을 버린 다음 씨앗을 20 % 차아 염소산 나트륨 (20 % NaClO, 80 % 멸균 수)에 40 분 동안 담그고 튜브를 부드럽게 뒤집어 모든 씨앗이 용액과 접촉하도록합니다.
알림: 차아염소산나트륨 용액은 최적의 결과를 위해 새로 만들어야 합니다. - 층류 후드 아래에서 차아염소산나트륨 용액을 버린 다음 씨앗을 증류수(5회)로 씻습니다. 최종 헹굼 후 씨앗에 소량의 물을 추가하면 식물이 접시로 이동하는 데 도움이 될 수 있습니다.
- 멸균된 집게를 사용하여 씨앗을 고체 MS 배지가 있는 미리 준비된 95mm x 100mm 페트리 접시에 옮깁니다(표 1). 발아 된 묘목의 과밀을 방지하기 위해 각 씨앗 사이에 약 1cm의 간격을 두고 접시 표면에 씨앗을 고르게 뿌립니다(그림 1A).
- 오염을 방지하기 위해 플레이트를 두 층의 파라핀 필름으로 밀봉한 다음 실온(22°C, 50μmol m-2s-1, 12시간)에서 차가운 백색 성장 조명(재료 표 참조) 아래에서 배양합니다. 씨앗은 일반적으로 5-6일 이내에 발아합니다.
- 묘목이 발아하고 옮길 수 있을 만큼 충분히 커지면(그림 1B), 일반적으로 발아 후 2-3일이 지나면 멸균된 집게를 사용하여 묘목을 50-100mL의 MS 배지와 함께 멸균 상자에 옮깁니다(표 1). 이상적으로는 최고 품질의 뿌리를 얻기 위해 상자 당 5 개의 묘목 만 심습니다.
- 수술용 테이프로 상자를 밀봉한 다음 1.6단계에서 언급한 것과 동일한 조건에서 식물이 서늘한 흰색 성장 조명 아래에서 자랄 수 있도록 합니다( 재료 표 참조). 식물은 약 3-4 주 안에 또는 주 뿌리의 길이가 약 2cm 자라고 측면 뿌리가 흰색으로 보일 때 변형 될 준비가되어 있어야합니다.
참고: 중간 준비 레시피와 비타민 스톡은 표 1 과 표 2에 포함되어 있습니다.
2. 플라스미드 구축 및 대장균 형질전환
참고: 정확한 플라스미드 구성 절차는 관심 유전자에 따라 다릅니다. 이 절차에서, 제한 효소 HindIII 및 SalII를 사용하여 표준 클로닝 절차20을 사용하여 GUS와 함께 이진 플라스미드 pBI101 (재료 표 참조)에 1.5kb AtPP2 프로모터를 삽입했습니다. AtPP2(체관 단백질 2)는 체관21에서 특이적으로 발현되는 유전자입니다.
- 애기장대에서 프라이머 쌍 5'-AGTCAAGCTTCAAGTCCCTGTGGCTACTGAAC-3'(정방향) 및 5'-AGTCGTCGACAAACCAGTATGATGTATTTATTTG-3'(역방향)을 사용하여 프로모터를 복제합니다. 그림 2는 AtPP2:GUS 삽입물이 있는 이진 플라스미드 벡터의 다이어그램을 보여줍니다.
- 플라스미드 구축 후, 플라스미드를 열 충격 방법22를 사용하여 DH5a 대장균(재료 표 참조)을 적격 세포로 형질전환시킨 다음, 진탕(150 rpm)하면서 37°C에서 1.5시간 동안 인큐베이션한다.
- 각 형질전환 배양액 150μL를 LB 한천 배지 플레이트(표 1)에 적절한 선택(이 프로토콜에 사용된 균주에 대한 50mg/L 카나마이신, 재료 표 참조)한 다음 플레이트를 37°C에서 16-24시간 동안 배양합니다.
참고: 이 연구에 사용된 박테리아 균주는 A. tumefaciens GV3101입니다. - 다음으로, 콜로니 PCR을 사용하여 콜로니에서 양성 재조합체를 스크리닝한다23.
참고: 이 프로토콜에서는 표적 유전자를 증폭하기 위해 다음 프라이머를 사용했습니다. 5'-ATGTTACGTCCTGTAGAAACCCCAA-3'(정방향) 및 5'-TCATTGTTTGCCTCCCTGCTGC-3'(후진).- 95°C에서 3분의 사이클링 조건으로 열순환기( 재료 표 참조)에서 반응을 실행한 후 95°C에서 30초, 55°C에서 30초, 72°C에서 2분, 72°C에서 최종 10분 신장 단계의 35회 사이클을 수행합니다.
- 6mL의 LB 액체배지(표 1)에 양성 콜로니를 적절한 항생제(50mg/L 카나마이신)로 접종하고 37°C에서 하룻밤 동안 200-250rpm으로 성장시킵니다.
- 하룻밤 성장 후, 표준 절차24를 사용하여 박테리아로부터 플라스미드를 추출한다.
3. A. 플라 스미드를 이용한 형질전환
- 플라스미드 추출 후, 전기천공법을 사용하여 변형된 플라스미드를 원하는 적격 세포 균주로 변형시킵니다. 본 과정에서는 A. tumefaciens 균주 GV3101을 사용하였다. 전기천공 기법에 대한 표준화된 방법을 따른다25.
- 전기천공 후, 컴피턴트 세포를 LB 브로스 1mL에 재현탁한 다음, 28°C에서 100rpm으로 2-4시간 동안 인큐베이션한다.
- 실온(22°C)의 탁상용 미세원심분리기(재료 표 참조)에서 6,800 x g에서 3분 동안 원심분리를 통해 세포를 수집한 다음 적절한 선별제(이 프로토콜에 사용된 플라스미드의 경우 50mg/L 카나마이신)와 함께 LB 한천 플레이트에 50-100μL를 뿌립니다.
- 세포를 28°C에서 2일 동안 배양한 후, 콜로니 PCR을 사용하여 관심 유전자를 함유하는 양성 콜로니를 확인한다. 이 프로토콜에서는 2.4 단계에서 언급 된 프라이머 및 조건을 사용하십시오.
- 다음으로, 양성 콜로니를 사용하여 LB 한천 배지 + 선택으로 스톡 플레이트를 줄무늬로 만듭니다. 플레이트는 4°C에서 최대 1개월 동안 보관할 수 있습니다.
- 또는 장기 보관을 위해 적절한 선택으로 소량의 LB로 양성 콜로니를 접종하십시오. 접종된 배양물을 28°C에서 200rpm으로 밤새 흔들어 준 다음 최대 10년 동안 -80°C에서 보관할 수 있는 글리세롤 스톡(박테리아와 글리세롤의 50:50 혼합에서 50% w/v 글리세롤)을 준비합니다.
4. A. tumefaciens 준비
- 적절한 선택제와 함께 준비된 95mm x 100mm 고체 LB 플레이트에 원하는 플라스미드를 포함하는 줄무늬 A. tumefaciens . 이 프로토콜에서는 플라스미드 삽입물 AtPP2:GUS 가 있는 박테리아 균주 GV3101을 사용했으며 선택을 위해 50mg/L 카나마이신을 추가했습니다.
- 플레이트를 파라핀 필름으로 밀봉한 다음 28°C에서 최대 48시간 동안 또는 박테리아가 선택할 수 있을 만큼 커질 때까지 배양합니다.
- 형질전환 2일 전에 피펫 팁을 사용하여 박테리아 집락을 선택하고 적절한 선택으로 6mL의 액체 LB가 들어 있는 15mL 둥근 바닥 튜브에 접종합니다. OD600 이 0.6-0.7에 도달할 때까지 28°C 탁상용 셰이커에서 밤새 200rpm으로 흔들어줍니다.
알림: 플레이트와 6mL 박테리아 접종물은 4°C에서 최대 1개월 동안 보관할 수 있습니다. - 박테리아가 올바른 OD600에 도달하면 피펫을 사용하여 A. tumefaciens 를 선별제와 함께 100mL의 액체 LB가 들어 있는 멸균 플라스크에 옮깁니다. 일반적으로 100mLLB당 200μL의 박테리아가 번식에 적합합니다. OD600 이 0.6-0.7에 도달할 때까지 28°C에서 밤새 200rpm으로 흔들어 줍니다.
- 박테리아를 50mL 멸균 원심분리기 튜브로 옮기고 탁상용 원심분리기에서 실온(22°C)에서 10분 동안 2,200 x g 로 원심분리하여 박테리아를 수집합니다.
- 피펫을 사용하여 상청액을 버립니다. 박테리아 펠릿을 피펫팅으로 실온(22°C) 액체 현탁액 용액(SS) 5mL(표 1)에 재현탁한 다음 최대 50mL의 SS를 추가하고 여러 번 뒤집어 혼합합니다. 박테리아는 이제 변형될 준비가 되었습니다.
알림: 액체 SS는 변형 후 1주일 이내에 신선하게 준비해야 합니다.
주의 : A. tumefaciens 와 접촉하는 모든 물질은 생물학적 위험 쓰레기통에 버려야 합니다. 박테리아 배양에서 남은 액체는 차아염소산나트륨(표백제)으로 20% 이상의 농도로 멸균할 수 있습니다.
5. 질경이 뿌리의 변형
- 식물이 형질전환을 위한 이상적인 단계(묘목은 3주령)에 도달하면(그림 1C) 멸균 집게와 가위를 사용하여 식물의 나머지 부분과 뿌리를 분리합니다(그림 3A). 잎과 줄기 재료를 버리십시오.
- 절단 직후, 멸균 집게를 사용하여 멸균 된 물이 들어있는 멸균 상자에 뿌리 조각을 옮깁니다. 이 단계를 통해 모든 조직이 수집되는 동안 뿌리가 수분을 유지할 수 있습니다.
- 모든 뿌리가 절단되면 A. tumefaciens/SS 현탁액을 멸균된 150mm x 15mm 일회용 페트리 접시에 붓습니다. 뿌리를 A. tumefaciens 배양액으로 옮기고 최소 20분 동안 접종합니다(그림 3B).
- 부화하는 동안 날카로운 칼날이 달린 멸균 메스를 사용하여 뿌리를 1cm 조각으로 자르고 1 차 뿌리를 측면 뿌리에서 분리합니다. 박테리아가 식물을 감염시킬 수 있도록 뿌리 표면을 얇고 얕게 자릅니다.
참고: 많은 수의 식물을 다루는 경우 뿌리 조각을 일괄적으로 박테리아 배양에 옮겨 접종하는 동안 모든 뿌리가 잠기도록 합니다. - 배양 후 멸균 겸자를 사용하여 뿌리 조각을 멸균 종이 타월로 옮겨 과도한 박테리아를 제거합니다. 탈수를 일으키고 뿌리 조직을 손상시킬 수 있으므로 60초 이상 뿌리를 건조시키지 마십시오. 이상적으로는 10-15 개의 뿌리를 동시에 건조시킬 수 있습니다 (그림 3C).
- 건조된 뿌리를 고체 공동 배양 배지(표 1)를 사용하여 준비된 95mm x 15mm 페트리 접시에 옮기고, 뿌리의 크기에 따라 플레이트당 약 10-20개의 뿌리를 만듭니다(그림 3D).
- 투명 플라스틱 필름의 두 층으로 플레이트를 밀봉 한 다음 알루미늄 호일로 덮습니다. 실온(22°C)에서 3일 동안 배양한다. 이 단계는 박테리아가 항생제 선택 없이 뿌리를 감염시킬 수 있는 시간을 제공합니다(그림 3E).
6. 선택 및 전체 식물 재생
- 공동 배양 배지에서 배양한 후 뿌리 조각을 Timentin(500mg/L, 재료 표 참조)과 함께 고체 싹 유도 배지(SIM)(표 1)와 함께 준비된 95mm x 15mm 페트리 접시에 옮기고 적절한 항생제를 선택합니다. 이 프로토콜에서는 카나마이신(100mg/L)을 사용했습니다.
알림: 뿌리의 바닥은 배지와 완전히 접촉해야 합니다. 배지 표면에 닿지 않는 뿌리는 너무 길기 때문에 조직이 선택을 벗어나지 않도록 잘라야 합니다. - 두 겹의 투명 플라스틱 필름으로 판을 밀봉한 다음 1개월 동안(적절한 조건은 1.6단계 참조) 또는 새싹이 나오기 시작할 때까지 자라는 빛 아래에서 자랍니다.
참고: 일반적으로 싹 이니셜은 성장 2주 후에 관찰할 수 있으며 싹은 일반적으로 1개월 후에 볼 수 있습니다. - 묘목의 길이가 1.5-2.0cm일 때(그림 1D), 단단한 뿌리 유도 매체가 있는 준비된 멸균 상자에 옮깁니다(표 1).
- 뿌리가 형성 될 때까지 몇 주 동안 성장 조명 아래에서 식물을 재배하십시오 (조건은 1.6 단계 참조). 뿌리는 일반적으로 1주일 후에 처음 볼 수 있습니다.
알림: 뿌리 시스템이 더 큰 식물은 토양에서 생존율이 더 높은 경향이 있으므로 토양으로 이동하기 전에 뿌리가 몇 주 동안 자라도록 하는 것이 좋습니다.
7. 토양 이송
- 뿌리 시스템이 옮길 수 있을 만큼 커지면(그림 1E), 일반적으로 성장 1개월 후, 식물을 미리 습윤된 다목적 토양(BM7)이 들어 있는 정사각형 화분에 3.5로 옮깁니다. 이 프로토콜에서, BM7 껍질 믹스를 사용하였다 ( 재료 표 참조).
- 뿌리에 달라붙는 배지는 물로 부드럽게 씻어 제거합니다.
참고: 식물은 600W 고나트륨 압력 조명(재료 표 참조)을 사용하여 800 내지 1400 μmol 광자 m-2 s-2의 온실에서 성숙할 수 있거나, 실온(22 °C)의 성장 챔버에서 50 μmol m-2 s-1, 12 h 일의 차가운 백색광을 사용하여 성장할 수 있습니다.
- 뿌리에 달라붙는 배지는 물로 부드럽게 씻어 제거합니다.
- 플라스틱 화분 덮개로 식물을 덮은 다음 투명한 비닐 봉지로 덮으십시오. 이 단계를 통해 식물은 토양에 적응할 때 습한 환경에 머물 수 있습니다.
- 약 3-5일 후 비닐봉지를 제거한 후 뚜껑을 천천히 제거하여 외부 환경에 적응합니다.
알림: 연중 시기와 식물이 옮겨지는 환경에 따라 식물이 적응해야 하는 시간이 다를 수 있습니다. 매일 식물을 확인하고 필요에 따라 화분에 물을 추가하는 것이 좋습니다. - 식물에 정기적으로 물을주고 필요에 따라 비료를 추가하십시오. 식물은 또한 추가 성장을 위해 더 큰 화분으로 옮길 수 있습니다 (그림 1F).
8. β-글루쿠로니다아제(GUS) 조직화학적 염색
- 공개된 프로토콜15에 따라 β-글루쿠로니다아제(GUS) 염색 용액을 준비합니다.
- 싹의 이니셜 길이가 약 0.5-1cm이면 완전히 확장된 어린 잎의 작은 끝(일반적으로 길이가 <5mm이면 충분함)을 제거하고 즉시 1.5 또는 2mL 미세 원심분리기 튜브에 있는 0.5-1mL의 GUS 염색 용액으로 옮깁니다. 용액은 식물 조직을 완전히 덮어야합니다.
- 열린 튜브를 진공 데시케이터에 넣고 20-25kPa에서 5-10분 동안 진공 청소기로 청소합니다. 진공 절차 중에 용액에 작은 기포가 보일 수 있어야합니다. 이렇게하면 용액이 식물의 세포에 들어갈 수 있습니다.
- 공기가 진공 건조기로 다시 여과되도록 합니다. 튜브를 닫고 37°C에서 하룻밤(12시간) 또는 파란색이 보일 때까지 배양합니다.
참고: 이 연구에서 GUS 활성은 체관부에 국한되었으며, 이는 양성으로 형질전환된 식물에서 청색 염색이 체관 조직에서만 볼 수 있어야 함을 의미합니다. 이식유전자가 없는 식물은 염색을 경험하지 않습니다(그림 4). - 얼룩을 더 잘 시각화하려면 식물을 100 % 에탄올로 옮겨 엽록소를 제거하십시오. 엽록소 제거 공정의 효율을 높이려면 튜브를 60°C에서 10분 동안 배양합니다.
알림: 염색되는 잎의 크기에 따라 모든 엽록소가 제거되기 전에 에탄올을 여러 번 교체해야 할 수도 있습니다.
결과
A. tumefaciens 매개 형질전환을 사용하여 형질전환 P. lanceolata 식물을 얻기 위한 간단한 프로토콜이 여기에 보고되었습니다. 리포터 유전자 GUS(β-글루쿠로니다아제를 암호화함)는 AtPP2의 체관부 발현 프로모터에 의해 구동되어 A. tumefaciens 균주 GV3101을 통해 3주령의 P. lanceolata 뿌리로 형질전환됩니다(그림 2). 체관 특이적 프로모터가 선택되었는데, 그 이유는 우리의 주요 관심사가 식물 혈관 조직, 특히 체관부의 기능적 유전체학을 위한 시스템을 확립하는 것이었기 때문입니다. 상기 방법은 예비실험에서 뿌리, 잎, 잎자루 조직에 대해 시험하였다. 굳은살은 모든 조직 유형에서 유도될 수 있지만 SIM에서 1개월 후에 뿌리 조직만이 싹 이니셜(그림 5A)을 생성했습니다. 잎과 잎자루는 갈색으로 변하여 죽었습니다(그림 5B). 이것은 뿌리 조직이 형질전환 방법에 사용하기에 최적의 조직 유형이라는 결론으로 이어졌습니다. 뿌리를 현탁액 용액(SS)에 재현탁된 준비된 박테리아(표 1)에서 최소 20분 동안 배양한 다음, 실온에서 암실에서 최대 3일 동안 고체 SS 플레이트에서 배양했습니다(그림 3E). 그런 다음 뿌리를 싹 유도 배지(SIM)로 옮기고 프로토콜(단계 1.6)에 표시된 조건에서 성장광 하에 보관했습니다. 그림 1과 그림 3은 참조를 위해 프로토콜의 각 단계를 대표하는 이미지를 보여줍니다.
도 6은 뿌리가 SIM에 놓인 첫날(도 6A)부터 새싹이 뿌리를 내릴 준비가 되었을 때(도 6D)까지 형질전환된 조직으로부터 나오는 새싹 이니셜의 진행을 보여준다. 1주일 후, 뿌리 조직은 캘러스를 형성했고(그림 6B), 싹 이니셜의 시작을 관찰할 수 있었습니다(그림 6B1). 새싹은 2주와 3주 동안 계속 나타났고(그림 6C), 4주 후에는 새싹이 뿌리 유도 배지로 옮겨질 준비가 되었습니다(그림 6D).
추정되는 형질전환 식물의 식별은 β-글루쿠로니다아제(GUS) 조직화학적 분석을 사용하여 수행되었으며, 싹의 길이가 약 0.5cm가 되면 잎 세그먼트를 채취했습니다. 양성 형질전환 식물은 체관부 조직에서 예상되는 염색 패턴을 보여주었으며, 이는 도 4에서 입증되었다. 양성 GUS 염색 새싹은 뿌리 유도 배지로 옮겨져 4주 후에 강력한 발근 시스템을 개발했습니다(그림 1E). 그런 다음 뿌리를 내린 식물을 토양으로 옮겼습니다. 도 4 는 AtPP2 프로모터β로 형질전환된 내로우리프 질경이와 AtPP2 프로모터로 형질전환된 야생형 및 네로우리프 질경이와 함께 AtPP2 프로모터로 형질전환된 내로우리프 질경이에서 염색한 결과를 나타낸 것이다. 출현 한 모든 싹은 형질 전환으로 확인되었습니다. 형질전환 효율은 평균 20%로 결정되었으며, 형질전환된 뿌리 10개당 약 2개의 새싹이 나왔다. 확인된 형질전환 식물을 더 큰 화분으로 옮기고 성충 단계에 도달할 때까지 4-8주 동안 성장시켰습니다(그림 1F).
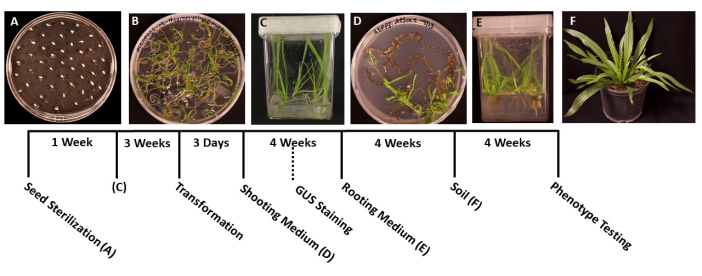
그림 1: 질경이 천(Plantago lanceolata ) 변형의 타임라인. 프로토콜의 각 단계를 대표하는 이미지입니다. (A) MS 플레이트에 도금된 발아되지 않은 종자. (B) 씨앗은 1 주일 후에 발아하여 마젠타 색 상자로 옮길 준비가되었습니다. (C) 성장 3주 후 MS 상자에 있는 식물. 뿌리는 녹색이고 건강하며 변형에 이상적인 단계에 있습니다. (D) 4주 후 슛 유도 배지의 슛은 발근 배지로 옮겨질 준비가 됩니다. 이 단계에서 해당되는 경우 β-글루쿠로니다아제(GUS) 조직화학적 염색을 수행할 수 있습니다. (E) 성장 4주 후에 뿌리가 형성된 뿌리 유도 매체가 있는 상자에 담긴 식물. (F) 형질전환 식물은 토양에서 4주 동안 성장한 후 전체 길이로 자랍니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
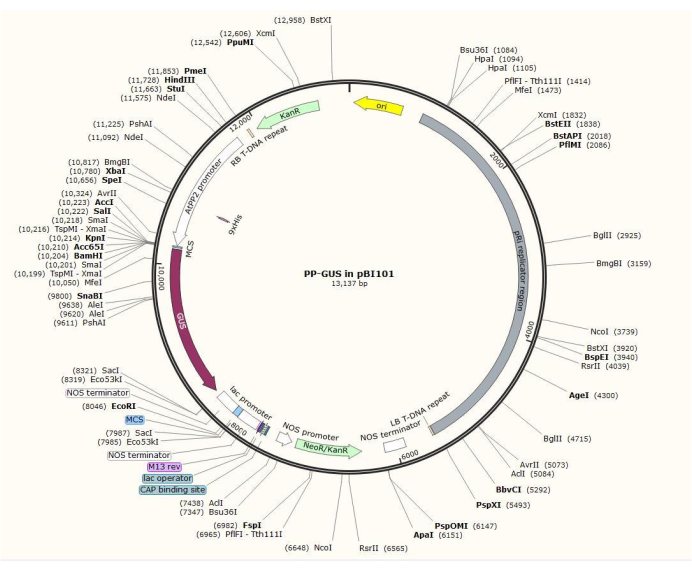
그림 2: 체관 특이적 프로모터 AtPP2가 삽입된 이진 벡터 플라스미드 pBI101 + β-글루쿠로니다아제(GUS)의 다이어그램. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
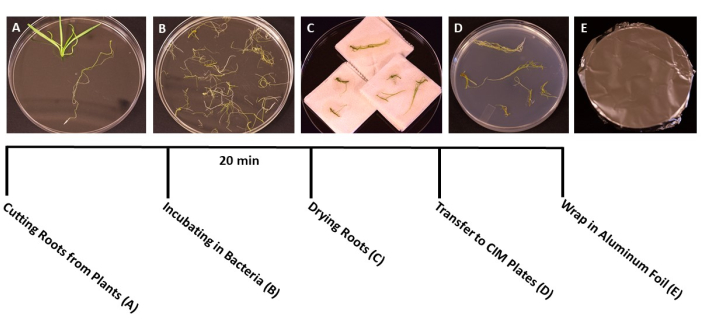
그림 3: 변환 단계 각 변환 단계의 대표 이미지입니다. (A) 형질전환 중 새싹에서 뿌리를 분리합니다. (B) 박테리아/SS 현탁액에 뿌리를 담그기. (C) 과도한 박테리아를 제거하기 위해 종이 타월에 뿌리를 건조시킵니다. (D) 공동 배양 배지에 도말된 뿌리. (E) 알루미늄 호일로 싸인 SS 플레이트. 식물을 촬영 매체로 옮기기 전에 2-3일 동안 배양했습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
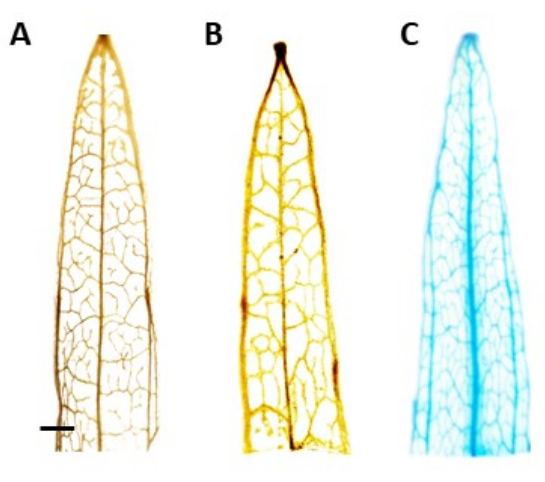
그림 4: GUS 염색. 좁은 잎 질경이 잎 세그먼트의 β-글루쿠로니다아제(GUS) 염색 결과. (A) 야생형. (B) AtPP2 프로모터를 보유하는 플라스미드로 형질전환된 좁은 잎 질경이(빈 벡터). (C) AtPP2 프로모터 및 β-글루쿠로니다아제(GUS) 유전자를 보유하는 플라스미드로 형질전환된 좁은 잎 질경이. 각 잎은 GUS 조직화학적 염색 프로토콜을 사용하여 염색한 다음 현미경 카메라로 이미지화했습니다. 이미지 (B) 및 (C)는 GUS 유전자의 부재로 인한 염색 패턴을 나타내지 않습니다. 오른쪽 이미지는 정맥의 맑은 파란색 염색 패턴을 보여 식물이 형질 전환임을 확인합니다. 막대는 1mm를 나타내며 각 잎 부분의 길이는 약 1cm입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
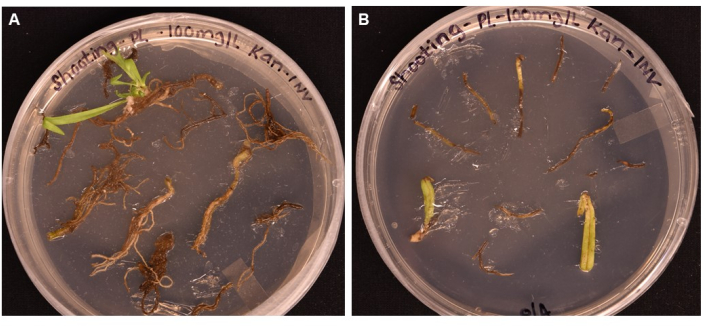
그림 5: 촬영 배지에서 >1개월 배양 후 다양한 조직 유형의 형질전환 효율 비교 . (A) 성장 1개월 이상 후의 뿌리 조직. 뿌리는 확장 된 굳은 살을 경험했으며 싹 이니셜이 나타났습니다. 형질전환되지 않은 굳은살은 항생제 선택에 반응하여 죽기 시작했습니다. (B) 성장 1개월 이상 경과 후의 잎과 잎자루 조직. 조직은 약간의 굳은 살 확장을 경험했지만 항생제에 대한 반응으로 곧 사망했습니다. 어느 조직에서도 싹이 나오지 않았습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
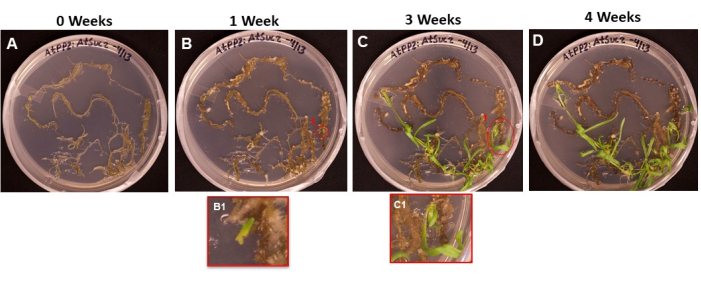
그림 6 : 변형 된 조직에 굳은 살과 싹의 출현. 서로 다른 길이의 배양 후 촬영 배지에 놓인 조직의 대표 이미지. (A) 촬영 매체에 도금된 직후의 뿌리 조직. (B) 촬영 매체에서 1주일 후 치근 조직. 굳은살의 확장이 관찰될 수 있으며, (B1) 첫 번째 싹의 이니셜이 나타나기 시작했다. (C) 촬영 매체에서 3주 후 치근 조직. 더 많은 촬영 이니셜이 등장했습니다. (씨1) B1 이니셜 촬영에서 나온 촬영. (D) 배양 4주 후의 뿌리 조직. 변형되지 않은 조직은 검은색/갈색으로 변하기 시작하여 죽기 시작했으며 새로 나오는 새싹이 계속 자랍니다. 이 단계에서 싹을 뿌리 매체로 옮길 준비가되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
표 1: 배지 준비 레시피. 변환을 위해 매체를 준비하는 방법에 대한 설명입니다. 첨가되는 비타민의 양은 표시된 원액 농도를 기준으로 계산됩니다. 비타민 원액 준비에 대해서는 표 2 를 참조하십시오. 모든 배지에 대해 시약을 900mL의 이중 증류된H2O, pH를 표시된 수준으로 첨가한 다음 최종 부피 1,000mL에 물을 첨가합니다. * = 멸균 후 추가. ** = 1 M KOH의 pH. = 1M NaOH의 pH. 이 표를 다운로드하려면 여기를 클릭하십시오.
표 2: 질경이 배지용 비타민 재고. 모든 비타민은 보관 전에 필터 멸균 및 라벨을 정확하게 부착해야 합니다. 표시된 경우 분말을 먼저 1N NaOH에 용해시킨 다음 이중 증류된 H2O로 원하는 부피를 구성합니다 . 이 표를 다운로드하려면 여기를 클릭하십시오.
토론
Plantago 속의 식물에 대한 형질 전환 프로토콜의 부족은 특히 연구자가 유전자 기능을 탐구하는 데 관심이 있을 때 이러한 식물을 모델로 사용하는 것을 제한합니다. P. lanceolata는속 16에서 가장 일반적으로 연구되는 식물이기 때문에 유전자 변형 프로토콜을 개발하기 위해 선택되었습니다. 개발된 프로토콜은 혈관 생물학, 생태학, 식물-곤충 상호 작용 및 비생물적 스트레스 생리학과 관련된 연구를 더욱 발전시키는 도구로 사용될 것입니다.
제시된 프로토콜은 사용자가 형질전환 식물을 얻을 수 있도록 하는 단계를 명확하게 설명합니다. 조직 배양 환경에서 번성하는 P. lanceolata 의 능력 외에도 여러 요인이 우리 형질전환 방법의 성공에 기여했습니다. 첫째, 형질전환을 위해 고품질의 멸균 식물 뿌리 조직을 사용하는 것의 중요성이 관찰되었습니다. 뿌리는 3-4주 된 식물에서 채취했을 때 가장 높은 변형률을 보였으며 녹색 또는 옅은 흰색으로 나타났습니다. 박테리아 또는 곰팡이 오염이 어느 정도 있는 상자에서 채취한 뿌리는 종종 오염된 사격 배양을 초래했으며 갈색으로 보이는 오래된 뿌리는 성공적인 변형을 초래하지 않았습니다. 뿌리 조직은 잎과 잎자루 조직이 새싹을 발달시키는 데 실패했기 때문에 현재의 방법을 사용하여 변형에 가장 효율적인 조직 유형이었습니다.
또 다른 중요한 관찰은 형질전환을 위해 뿌리 조직을 수집하는 최적의 방법은 갓 자른 뿌리 재료를 멸균수에 넣는 것이라는 것입니다. 이 단계는 뿌리가 성장 용기에서 제거될 때 빨리 마르는 경향이 있기 때문에 조직의 나머지 부분이 수집되는 동안 뿌리 재료가 수분을 유지하는 것을 효과적으로 허용했습니다. 이 단계는 또한 한 번에 더 많은 뿌리가 박테리아에서 배양될 수 있게 해주었기 때문에 형질전환의 성공률을 높이는 데 도움이 되었습니다.
이 프로토콜은 뿌리 조직이 공동 배양 배지에서 배양하는 시간을 2일로 줄임으로써 수정할 수 있습니다. 2일 또는 3일의 잠복기가 감염을 허용하기에 충분하여 싹 이니셜을 초래하는 것으로 관찰되었습니다. 그러나 배지에 항생제 억제제가 없으면 종종 A. tumefaciens 과증식이 발생하여 신생 조직을 죽일 수 있다는 것이 관찰되었기 때문에 더 긴 배양 시간은 권장되지 않습니다.
이 연구의 한계는 비교를 위해 P. lanceolata 형질전환에서 A. tumefaciens의 다른 방법 또는 종의 성능에 대한 사용 가능한 데이터가 부족하다는 것입니다. 우리가 아는 한, 이 프로토콜은 참신합니다. 초기 시험에서 A. tumefaciens GV3101에서 높은 형질전환 효율이 나타났으며, 다른 균주를 실험하는 대신 이 균주를 사용하여 기술을 개선하는 데 중점을 두었습니다. 20 %의 변형 효율은 플랜트 변형에 대해 상대적으로 높습니다 - 많은 기존 방법은 > 1 %를 성공으로 간주합니다26,27,28. 그러나여러 종의 뿌리 형질전환에 사용되는 것으로 알려진 A. rhizogenes와 같은 A. tumefaciens의 다른 균주를 사용하면 훨씬 더 높은 성공률을 얻을 수 있습니다. P. lanceolata 의 형질전환 효율 증가를 촉진하기 위해 다른 균주를 사용하는 것의 영향을 평가하기 위해서는 추가 실험이 필요할 것입니다.
P. lanceolata의 성공적인 변형은 많은 연구 분야에 도움이 될 것입니다. 높은 형질전환 효율과 조직 배양 배지에서 식물의 빠른 성장은 P. lanceolata를 유전자 기능 연구를 위한 실현 가능한 후보로 만든다15.
공개
저자는 공개 할 것이 없습니다.
감사의 말
이 연구는 국립 과학 재단 (EDGE IOS-1923557 to C.Z. and Y.Z.)의 지원을 받았다.
자료
| Name | Company | Catalog Number | Comments |
| 14 mL Round Bottom TubeA4A2:A34 | ThermoFisher Scientific | 150268 | |
| 1-Naphthylacetic acid | Gold Biotechnology | N-780 | |
| 3M Micropore Surgical Paper Tape | ThermoFisher Scientific | 19-027761 | |
| 50 mL Centrifuge Tubes | Research Products International Corp. | 163227LC | |
| 600 Watt High Pressure Sodium Lights | Plantmax | PX-LU600 | |
| 6-Benzylaminopurine (6-BAP) | Gold Biotechnology | B-110 | |
| Aluminum Foil | ThermoFisher Scientific | 01-213-100 | |
| Bacto Agar | Thermofisher Scientific | 214010 | |
| Binary Plasmid pBI101 | Clontech, USA | 632522 | |
| Cool White Grow Light Sylvania LLC | Home Depot | 315952205 | |
| D-biotin | ThermoFisher Scientific | BP232-1 | |
| ddH2O | |||
| DH5a E. coli | Invitrogen, USA | 18258012 | |
| Disposable Petri Dishes, Sterile 150 x 16 mm | ThermoFisher Scientific | FB0875712 | |
| Disposable Petri Dishes, Sterile 95 x 15 mm | ThermoFisher Scientific | FB0875714G | |
| Dissecting Scissors | Leica Biosystems | 38DI12044 | |
| Ethanol 200 Proof | Decon Labs | 2705 | |
| Folic Acid | Fisher Scientific | BP2519-5 | |
| Forceps | Leica Biosystems | 38DI18031 | |
| Gelrite | Research Products International Corp. | G35020-1000 | |
| Glycerol | ThermoFisher Scientific | 17904 | |
| Glycine | Sigma | 241261 | |
| Incubated Tabletop Orbital Shaker | ThermoFisher Scientific | SHKE420HP | |
| Indole-3-Acetic Acid (IAA) | Gold Biotechnology | I-110 | |
| Indole-3-Butyric Acid (IBA) | Gold Biotechnology | I-180 | |
| Kanamycin Monosulfate | Gold Biotechnology | K-120 | |
| Macrocentrifuge | ThermoFisher Scientific | 75007210 | |
| Magenta Boxes | ThermoFisher Scientific | 50255176 | |
| Micro Pipet Tips 1000 µL | Corning | 4140 | |
| Micro Pipet Tips 200 µL | Corning | 4138 | |
| Micro Pipette Tips 10 µL | Corning | 4135 | |
| Microcentrifuge | ThermoFisher Scientific | 75002410 | |
| Micropipettor 0.5-10 µL | Corning | 4071 | |
| Micropipettor 100-1000 µL | Corning | 4075 | |
| Micropipettor 20-200 µL | Corning | 4074 | |
| Micropipettor 2-20 µL | Corning | 4072 | |
| Murashige & Skooge Basal Medium with Vitamins | PhytoTech | M519 | |
| Murashige & Skooge Basal Salt Mixture | PhytoTech | M524 | |
| myo-Inositol | Gold Biotechnology | I-25 | |
| Nicotinic acid | Sigma | N0761-100g | |
| Parafilm (paraffin film) | ThermoFisher Scientific | S37440 | |
| Potassium Hydroxide (KOH) | Research Products International Corp. | P44000 | |
| Pyridoxine HCl | Sigma | P6280-10g | |
| Scalpel Blade Handle | Leica Biosystems | 38DI36419 | |
| Scalpel Blades | Leica Biosystems | 3802181 | |
| Sodium Chloride, Crystal (NaCl) | Mallinckrodt Chemicals | 7581-06 | |
| Sodium Hydroxide (NaOH) | Research Products International Corp. | S24000 | |
| Sodium Hypochlorite | Walmart | 23263068401 | |
| Soil- Bark Mix | Berger, USA | BM7 | |
| Square Pots (3.5 inches squared) | Greenhouse Megastore | CN-TRK-1835 | |
| Sucrose | Research Products International Corp. | S24060 | |
| Thermocycler | ThermoFisher Scientific | A24811 | |
| Thiamine HCl | Sigma | T4625-5G | |
| Timentin Ticarcillin/Clavulanate (15/1) (Timentin) | Gold Biotechnology | T-104 | |
| trans-Zeatin Riboside (ZR) | Gold Biotechnology | Z-100 | |
| Tryptone | Thermofisher Scientific | 211705 | |
| Wild Type Plantago lanceolata seeds | Outsidepride Seed Source, OR, USA | F1296 | Outsidepride.com |
| Yeast Extract Granulated | Research Products International Corp. | Y20025-1000 |
참고문헌
- Koornneef, M., Meinke, D. The development of Arabidopsis as a model plant. The Plant Journal. 61 (6), 909-921 (2010).
- Bragg, J. N., Anderton, A., Nieu, R., Vogel, J. P. Brachypodium distachyon. Agrobacterium Protocols. , 17-33 (2015).
- Chang, C., Bowman, J. L., Meyerowitz, E. M. Field guide to plant model systems. Cell. 167 (2), 325-339 (2016).
- Müller, B., Grossniklaus, U. Model organisms-a historical perspective. Journal of Proteomics. 73 (11), 2054-2063 (2010).
- Ding, X., et al. Different fruit-specific promoters drive AtMYB12 expression to improve phenylpropanoid accumulation in tomato. Molecules. 27 (1), 317 (2022).
- Niedbała, G., Niazian, M., Sabbatini, P. Modeling agrobacterium-mediated gene transformation of tobacco (Nicotiana tabacum)-a model plant for gene transformation studies. Frontiers in Plant Science. 12, 695110 (2021).
- Kumari, D., Prasad, B., Dwivedi, P. . Genome Editing Platforms in Rice (Oryza sativa L.): Basic methodology and troubleshooting. , (2022).
- Zhang, B. Agrobacterium-mediated transformation of cotton. Transgenic Cotton. , 31-45 (2013).
- Tiwari, R., Singh, A. K., Rajam, M. V. Improved and reliable plant regeneration and Agrobacterium-mediated genetic transformation in soybean (Glycine max L). Journal of Crop Science and Biotechnology. , 1-10 (2022).
- Bakhsh, A. Development of efficient, reproducible and stable Agrobacterium-mediated genetic transformation of five potato cultivars. Food Technology and Biotechnology. 58 (1), 57-63 (2020).
- Bates, R., Craze, M., Wallington, E. J. Agrobacterium-mediated transformation of oilseed rape (Brassica napus). Current Protocols in Plant Biology. 2 (4), 287-298 (2017).
- Hopp, H. E., Spangenberg, G., Herrera-Estrella, L. Plant transformation. Frontiers in Plant Science. 13, 876671 (2022).
- Abdelmuhsin, A. A., Alghamdi, A. A., Ibrahim, N. A. Assessing the phenotypic and genotypic variations of Plantago ciliata in Ha'il region, Saudi Arabia. Entomology and Applied Science Letters. (1), 14-22 (2021).
- Coleman, N. Plantago Lanceolata. Botanical Bulletin. 1 (11), 45 (1876).
- Huang, J., et al. Tissue-specific transcriptomic profiling of Plantago major provides insights for the involvement of vasculature in phosphate deficiency responses. Molecular Genetics and Genomics. 294 (1), 159-175 (2019).
- Penczykowski, R. M., Sieg, R. D. Plantago spp. as models for studying the ecology and evolution of species interactions across environmental gradients. The American Naturalist. 198 (1), 158-176 (2021).
- Pommerrenig, B., et al. Common plantain. A collection of expressed sequence tags from vascular tissue and a simple and efficient transformation method. Plant Physiology. 142 (4), 1427-1441 (2006).
- Bergero, R., Levsen, N., Wolff, K., Charlesworth, D. Arms races with mitochondrial genome soft sweeps in a gynodioecious plant, Plantago lanceolata. Molecular Ecology. 28 (11), 2772-2785 (2019).
- Aalto, E. A., Koelewijn, H. P., Savolainen, O. Cytoplasmic male sterility contributes to hybrid incompatibility between subspecies of Arabidopsis lyrata. G3: Genes, Genomes, Genetics. 3 (10), 1727-1740 (2013).
- Bloch, K. D., Grossmann, B. Digestion of DNA with restriction endonucleases. Current Protocols in Molecular Biology. 3 (1), (1995).
- Du, C., et al. Prokaryotic expression, purification, physicochemical properties and antifungal activity analysis of phloem protein PP2-A1 from cucumber. International Journal of Biological Macromolecules. 194, 395-401 (2022).
- Deshmukh, S. 2. 2., Kulkarni, R., Bose, K. Transformation and protein expression. Textbook on Cloning, Expression and Purification of Recombinant Proteins. , 83-114 (2022).
- Bergkessel, M., Guthrie, C. Colony PCR. Methods in Enzymology. 529, 299-309 (2013).
- Broehan, G., Kroeger, T., Lorenzen, M., Merzendorfer, H. Functional analysis of the ATP-binding cassette (ABC) transporter gene family of Tribolium castaneum. BMC Genomics. 14, 6 (2013).
- Dong, Z., et al. Stable transformation of fluorescent proteins into Nosema bombycis by electroporation. Parasites & Vectors. 15 (1), 141 (2022).
- Li, S., et al. Optimization of Agrobacterium-mediated transformation in soybean. Frontiers in Plant Science. 8, 246 (2017).
- Manimaran, P., et al. Infection of early and young callus tissues of indica rice BPT 5204 enhances regeneration and transformation efficiency. Rice Science. 20 (6), 415-426 (2013).
- Wang, J., Nie, J., Pattanaik, S., Yuan, L. Efficient Agrobacterium-mediated transformation of Artemisia annua L. using young inflorescence. In Vitro Cellular & Developmental Biology-Plant. 52 (2), 204-211 (2016).
- Niazian, M., Belzile, F., Torkamaneh, D. CRISPR/Cas9 in planta hairy root transformation: a powerful platform for functional analysis of root traits in soybean. Plants. 11 (8), 1044 (2022).
- Geng, S., et al. An efficient root transformation system for CRISPR/Cas9-based analyses of shoot-root communication in cucurbit crops. Horticulture Research. 9, (2022).
- Xiao, Y., et al. Efficient Agrobacterium-mediated genetic transformation using cotyledons, hypocotyls and roots of 'Duli'(Pyrus betulifolia Bunge). Scientia Horticulturae. 296, 110906 (2022).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유