Method Article
アグロバクテリウム・ツメファシエンスを介したナローリーフオオバコの遺伝子形質転換
要約
様々な研究分野でのモデル種としての汎用性が高いため、オオバコ(Plantago lanceolata)の遺伝子形質転換ツールキットが必要です。 ここでは、 アグロバクテリウム・ツメファシエンス媒介形質転換を用いて、形質転換効率20%の安定したトランスジェニック株をもたらすプロトコールを提示する。
要約
プランタゴ属の種にはいくつかのユニークな形質があり、さまざまな研究分野でモデル植物として適応されています。しかし、遺伝子操作システムの欠如は、遺伝子機能の詳細な調査を妨げ、モデルとしてのこの属の多様性を制限します。ここでは、最も一般的に研究されているオオバコ種であるプランタゴランセオラータの形質転換プロトコルが提示されています。 アグロバクテリウム・ツメファシエンス媒介形質転換を用いて、無菌的に増殖したP. lanceolata植物の3週齢の根を細菌に感染させ、2〜3日間インキュベートした後、適切な抗生物質選択を伴うシュート誘導培地に移した。シュートは通常、1か月後に培地から出現し、シュートが根誘導培地に移されてから1〜4週間後に根が発達しました。次に、植物を土壌環境に順応させ、β-グルクロニダーゼ(GUS)レポーターアッセイを使用して導入遺伝子の存在を試験しました。現在の方法の形質転換効率は~20%で、根組織10個あたり2つのトランスジェニック植物が形質転換されます。オオバコの形質転換プロトコルを確立することで、様々な分野での新たなモデル種としての採用が促進されます。
概要
モデル種を使用して植物生物学の複数の側面を調査するという概念は、シロイヌナズナ1の広範な使用とともに出現しました。シロイヌナズナは、他の多くの顕花植物と特徴を共有し、小型で世代サイクルが短いなど、実験室環境での研究に便利な複数の特性を持っているため、最初に選択されました。それを主題として発表された大量の研究論文は、その小さなゲノムサイズと遺伝子形質転換の容易さ2とともに、広く使用されている実験生物として存続することを可能にします。しかし、シロイヌナズナは、異なる特性や独特の形質を持つ種のモデルとして限定することができます3。これにより、単子葉植物の発生遺伝学にとって重要な植物であるトウモロコシ(Zea mays)4や、進化研究、果実の発育、生産の重要なモデルであり、野菜作物の優れた表現であるトマト(Solanum lycopersicum)などの新しいモデルシステムの開発が促進されました5。遺伝子形質転換の方法は、植物種がモデル生物として機能するための前提条件です2。 アグロバクテリウム・ツメファシエンスを介した形質転換は、植物生物学における信頼できるツールです。タバコ(Nicotiana tabacum)6、イネ(Oryza sativa)7、綿花(Gossypium hirsutum)8、大豆(Glycine max)9、ジャガイモ(Solanum tuberosum)10、キャノーラ(Brassica napus)11など、いくつかのモデル種や主要作物の形質転換に使用されています。 植物種は、A. tumefaciens感染にどれだけうまく反応するかにおいて非常に多様であり、形質転換プロトコルはしばしば種ごとに個別に調整する必要があります6,12。
プランタゴ属には合計256の植物種が含まれており、世界中に広く分布しています13。この属の種は、遺伝学、生態学、ストレス生理学、二次代謝産物、医薬品化学、植物と微生物の相互作用、植物の発生、進化を研究するためのモデル種として望ましい独特の特徴を持っていることがよくあります。ナローリーフまたはリブワートオオバコとも呼ばれるプランタゴランセオラータは、男性の不妊の現象を説明するために最初に使用された19世紀以来、人気のある興味深い植物でした14。その属の他の植物と同様に、それは様々な研究分野の研究に使用されてきました。最近では、血管組織を簡単に採取できるため、血管生物学のモデルとして提案されています15。P.ランセオラータは、プランタゴ属で最も一般的に研究されている種です。2021年の記事では、2022年12月9日に実施されたPubMed検索によると、当時この種を含む、または関連する>1,400の出版物があり16、2022年の初めからさらに102の記事が公開されていると報告されています。属の次に研究されている植物であるP. majorは、同じ日に同じ基準を使用して検索した場合、わずか414の記事の対象です。
P. lanceolataの研究関心にもかかわらず、特に遺伝子機能の特性評価に関する研究は、この種の遺伝子操作ツールキットの欠如によってしばしば制限されています。Pommerrienigらは、フローラルディップ法を用いてP.メジャーの形質転換プロトコルを開発するために努力した17。しかし、この方法は、この種の雄性不稔性の特徴のためにP. lanceolataには適用できない18,19。私たちの知る限り、P.ランセオラータの形質転換のための既存のプロトコルはありません。
この研究は、A.ツメファシエンスを介したP.ランセオラータの形質転換のための簡単なプロトコルを提示します。根組織を標的とすることにより、形質転換から3ヶ月以内に完全に成長したトランスジェニック植物を生成することができる。
プロトコル
注意: 手順1.4-1.8、2.3-2.5、3.3-3.6、4.1-4.6、5.1-5.7、および6.1-6.3は、汚染を防ぐために清潔なフードを使用して、無菌状態で実行する必要があります。
1. 形質転換のための植物材料増殖
- 市販の野生型(WT)オオ バコランセオラータ 種子( 材料の表を参照)を、希望する植物の数に応じて、50 mLラインまで50 mL遠沈管に入れます。
注:または、少数の種子が必要な場合は2 mLの微量遠心チューブを使用できますが、種子が多すぎると滅菌の効率が低下する可能性があるため、0.1 mL以下の容量に充填する必要があります。 - 種子を75%エタノールに60秒間浸します。
- エタノールを廃棄し、種子を20%次亜塩素酸ナトリウム(20%NaClO、80%滅菌水)に40分間浸し、すべての種子が溶液と接触するようにチューブを静かに反転させます。
注意: 次亜塩素酸ナトリウム溶液は、最適な結果を得るために新たに作成する必要があります。 - 層流フードの下で、次亜塩素酸ナトリウム溶液を捨て、次に種子を蒸留水で洗います(5回)。最後のすすぎの後、種子に少量の水を追加します, これはプレートへの植物の移動を助けるのに役立ちます.
- 滅菌した鉗子を使用して、種子を固体MS培地で事前に準備された95 mm x 100 mmのペトリ皿に移します(表1)。発芽した苗の過密を防ぐために、各種子の間に約1 cmの間隔で、プレートの表面全体に種子を均等に広げます(図1A)。
- 汚染を防ぐために2層のパラフィンフィルムでプレートを密封し、室温(22°C、50 μmol m-2 s-1、12時間)で冷白色のグローライト(材料の表を参照)の下でインキュベートします。種子は通常5〜6日以内に発芽します。
- 苗が発芽し、移すのに十分な大きさになったら(図1B)、通常は発芽後2〜3日で、滅菌した鉗子を使用して、50〜100 mLのMS培地を入れた滅菌箱に苗を移します(表1)。理想的には、最高品質の根を得るために箱ごとに5本の苗だけを植えます。
- 箱をサージカルテープで密封し、次に、ステップ1.6で説明したのと同じ条件で、涼しい白いグローライトの下で植物を成長させます( 材料の表を参照)。植物は約3〜4週間で、または主根の長さが約2 cm成長し、側根が白く見えるときに形質転換の準備ができているはずです。
注:培地調製レシピとビタミンストックは 、表1 と 表2に含まれています。
2. プラスミド構築と 大腸菌 形質転換
注:正確なプラスミド構築手順は、目的の遺伝子によって異なります。この手順では、制限酵素HindIIIおよびSalIIを使用して、標準的なクローニング手順20を使用して、1.5kbのAtPP2プロモーターをGUSと共にバイナリプラスミドpBI101(材料表を参照)に挿入しました。AtPP2(師部タンパク質2)は、師部21に特異的に発現する遺伝子である。
- シロイヌナズナ由来のプライマーペア5'-AGTCAAGCTTCAAGTCCGTGGCTACTGAAC-3'(フォワード)および5'-AGTCGTCGACAAACCAACCATGATATTATTTTTG-3'(リバース)を用いてプロモーターをクローニングする。図2は、AtPP2:GUSインサートを有するバイナリプラスミドベクターのダイアグラムを示す。
- プラスミド構築後、ヒートショック法22を用いてプラスミドをDH5a E.coliコンピテントセル(材料の表を参照されたい)に形質転換し、次いで振とう(150rpm)しながら37°Cで1.5時間インキュベートする。
- 各形質転換培養液150 μLを取り、適切な選択(このプロトコルで使用される菌株に対して50 mg/Lカナマイシン;材料の表を参照)でLB寒天培地プレート(表1)にプレートし、プレートを37°Cで16〜24時間インキュベートします。
注:この研究で使用された細菌株は A.ツメファシエンス GV3101です。 - 次に、コロニーPCRを用いて、陽性組換え体23についてコロニーをスクリーニングする。
注:このプロトコルでは、以下のプライマーを使用して標的遺伝子を増幅しました。5'-ATGTTACGTCCTTAGAGAAACCCCAA-3'(フォワード)および5'-TCATTGTTTGCCTCCTGCTGC-3'(リバース)。- サーモサイクラー( 材料表を参照)で95°Cで3分間のサイクル条件で反応を実行し、続いて95°Cで30秒、55°Cで30秒、72°Cで2分、および72°Cで最後の10分間の伸長ステップを35サイクル行います。
- 陽性コロニーを6 mLのLBブロス(表1)に適切な抗生物質(50 mg / Lカナマイシン)を接種し、37°Cで200〜250 rpmで一晩増殖させます。
- 一晩増殖した後、標準的な手順24を用いて細菌からプラスミドを抽出する。
3. A.プラスミドによるツメファシエンス の形質転換
- プラスミド抽出後、エレクトロポレーションを使用して、修飾プラスミドを目的のコンピテントセル株に形質転換します。この手順では、 A.ツメファシエンス 株GV3101を使用した。エレクトロポレーション技術の標準化された方法に従う25。
- エレクトロポレーション後、コンピテントセルを1 mLのLBブロスに再懸濁し、28°C、100 rpmで2〜4時間インキュベートします。
- 室温(22°C)の卓上マイクロ遠心分離機(材料の表を参照)で6,800 x gで3分間遠心分離して細胞を収集し、適切な選択剤(このプロトコルで使用されるプラスミドには50 mg / Lカナマイシン)を含むLB寒天プレートに50〜100 μLを広げます。
- 細胞を28°Cで2日間インキュベートした後、コロニーPCRを使用して目的の遺伝子を含む陽性コロニーを同定する。このプロトコルでは、ステップ2.4に記載されているプライマーと条件を使用します。
- 次に、ポジティブコロニーを使用して、LB寒天培地+選択でストックプレートをストリークします。プレートは4°Cで最大1ヶ月間保存できます。
- あるいは、長期保存のために、適切な選択で少量のLBを陽性コロニーに接種する。接種培養液を28°C、200rpmで一晩振とうし、-80°Cで最大10年間保存できるグリセロールストック(細菌とグリセロールの50:50混合物中の50%w/vグリセロール)を調製します。
4. A.ツメファシエンス の準備
- 目的のプラスミドを含むストリーク A.ツメファシエンスを 、適切な選択剤を使用して準備した95 mm x 100 mmの固体LBプレート上に配置します。このプロトコルでは、プラスミドインサート AtPP2:GUS を有する細菌株GV3101を使用し、50 mg/Lのカナマイシンを選択して追加しました。
- プレートをパラフィンフィルムで密封し、28°Cで最大48時間、またはバクテリアがピッキングするのに十分な大きさになるまでインキュベートします。
- 形質転換の2日前にピペットチップを使用して細菌コロニーを選び、適切な選択で6 mLの液体LBを含む15 mLの丸底チューブに接種します。OD 200が0.6〜0.7に達するまで、28 °Cの卓上シェーカーで200rpmで一晩振とうします。
注:プレートと6 mLの細菌接種は、4°Cで最大1か月間保存できます。 - 細菌が正しいOD 600に達したら、ピペットを使用して、選択剤を含む100 mLの液体LBを含む滅菌フラスコに A.ツメファシエンス を移します。通常、100 mL LBあたり200 μLの細菌が増殖に適しています。OD 200が0.6〜0.7に達するまで、28°Cで200rpm で一晩振とうします。
- 菌を50 mL滅菌遠心チューブに移し、卓上遠心分離機で室温(22°C)で2,200 xg で10分間遠心分離し、菌を回収します。
- ピペットを使用して上清を捨てる。ピペッティングにより細菌ペレットを5 mLの室温(22°C)液体懸濁溶液(SS)(表1)に再懸濁し、次に最大50 mLのSSを加え、数回反転させて混合します。これで、バクテリアは形質転換の準備が整いました。
注:液体SSは、形質転換から1週間以内に新たに調製する必要があります。
注意: A. tumefaciensと 接触するすべての材料は、バイオハザード廃棄物箱に廃棄する必要があります。細菌培養液の残り液は、次亜塩素酸ナトリウム(漂白剤)で20%以上の濃度で殺菌することができます。
5. オ オバコ の根の形質転換
- 植物が形質転換の理想的な段階(苗は3週齢)に達したら(図1C)、滅菌鉗子とはさみを使用して根を植物の他の部分から分離します(図3A)。葉と茎の材料を捨てます。
- 切断直後に、滅菌鉗子を使用して滅菌水の入った滅菌箱に根片を移します。このステップにより、すべての組織が収集されている間、根は水分補給されたままになります。
- すべての根が切断されたら、 A.ツメファシエンス/ SS懸濁液を滅菌済みの150 mm x 15 mmの使い捨てペトリ皿に注ぎます。根を A.ツメファシエンス 培養物に移し、少なくとも20分間接種します(図3B)。
- インキュベーション中に、鋭利な刃の付いた滅菌メスを使用して根を1 cmの断片に切り、一次根を側根から分離します。根の表面に薄くて浅い切り込みを入れて、バクテリアが植物に感染できるようにします。
注:多数の植物を扱う場合は、接種中にすべての根が浸るように、根片をバッチで細菌培養物に移します。 - インキュベーション後、滅菌鉗子を使用して根片を滅菌ペーパータオルに移し、余分な細菌を除去します。根を60秒以上乾燥させると、脱水症状を引き起こし、根の組織が損傷する可能性があるため、避けてください。理想的には、10〜15本の根を同時に乾燥させることができます(図3C)。
- 乾燥した根を、根のサイズに応じて、プレートあたり約10〜20本の根で、固体共培養培地(表1)で準備した95 mm x 15 mmのペトリ皿に移します(図3D)。
- プレートを2層の透明プラスチックフィルムで密封し、アルミホイルで覆います。室温(22°C)で3日間インキュベートします。このステップは、抗生物質の選択なしに細菌が根に感染する時間を提供します(図3E)。
6.選択と植物全体の再生
- 共培養培地でインキュベートした後、根片を、固体シュート誘導培地(SIM)(表1)とタイメンチン(500 mg / L; 材料の表を参照)と適切な抗生物質の選択を含む準備された95 mm x 15 mmのペトリ皿に移します。このプロトコルでは、カナマイシン(100 mg / L)を使用しました。
注意: 根の底は培地と完全に接触している必要があります。培地の表面に触れない根は長すぎるため、組織が選択から逃れるのを防ぐために切断する必要があります。 - プレートを2層の透明なプラスチックフィルムで密封し、次にグローライトの下で1か月間(適切な条件についてはステップ1.6を参照)、または芽が出始めるまで成長します。
注:通常、シュートのイニシャルは成長の2週間後に観察でき、シュートは通常1か月後に見えます。 - 小植物の長さが1.5〜2.0 cmになったら(図1D)、固体根誘導培地で準備した滅菌箱に移します(表1)。
- グローライトの下で植物を育てます (条件についてはステップ1.6を参照) 数週間, 根が形成されるまで.根は通常1週間後に最初に見ることができます。
注:根系が大きい植物は土壌での生存率が高くなる傾向があるため、土壌に移動する前に根を数週間成長させることをお勧めします。
7.土壌移動
- 根系が移動できるほど大きくなったら(図1E)、通常は1か月の成長後、事前に濡れた万能土壌(BM7)を含む四角い鉢に植物を3.5に移します。このプロトコルでは、BM7樹皮ミックスが使用されました( 材料の表を参照)。
- 根に付着している培地を水でやさしく洗って取り除きます。
注:植物は、600 Wの高ナトリウム圧ライト(材料の表を参照)を使用して800〜1400 μmol光子m-2 s-2の温室で、または室温(22°C)の成長チャンバーで50 μmol m-2 s-1の冷たい白色光で、12時間日間成熟させることができます。
- 根に付着している培地を水でやさしく洗って取り除きます。
- 植物をプラスチック製の培養土カバーで覆い、次に透明なビニール袋で覆います。このステップにより、植物は土壌に適応するため、湿った環境にとどまることができます。
- 約3〜5日後、ビニール袋を取り外し、蓋をゆっくりと取り外して、外部環境に順応させます。
注意: 一年の時期と植物が移される環境に応じて、植物が適応する必要がある時間は異なる場合があります。毎日植物をチェックし、必要に応じて鉢に水を加えることをお勧めします。 - 定期的に植物に水をやり、必要に応じて肥料を加えます。植物は、さらなる成長のためにより大きな鉢に移すこともできます(図1F)。
8.β-グルクロニダーゼ(GUS)組織化学染色
- 公開されているプロトコル15に従って、β-グルクロニダーゼ(GUS)染色溶液を調製します。
- シュートのイニシャルの長さが約0.5〜1 cmになったら、完全に拡張した若い葉の小さな先端を取り除き(通常は長さ<5 mmで十分です)、すぐに1.5または2 mLの微量遠心チューブ内の0.5〜1 mLのGUS染色液に移します。溶液は植物組織を完全に覆うべきです。
- 開いたチューブを真空デシケーターに入れ、20〜25 kPaで5〜10分間真空にします。真空手順中に溶液中に小さな気泡が見えるはずです。これにより、溶液が植物の細胞に入ることができます。
- 空気をろ過して真空デシケーターに戻します。チューブを閉じ、37°Cで一晩(12時間)、または青色が見えるまでインキュベートします。
注:この研究では、GUS活性は師部に局在しており、正に形質転換された植物では、青色の染色は師部組織でのみ見えるはずです。導入遺伝子を持たない植物は染色を受けません(図4)。 - 汚れをよりよく視覚化するには、植物を100%エタノールに移してクロロフィルを取り除きます。クロロフィル除去プロセスの効率を高めるには、チューブを60°Cで10分間インキュベートします。
注:染色される葉のサイズによっては、すべてのクロロフィルを除去する前にエタノールを数回交換する必要がある場合があります。
結果
ここでは、A. tumefaciens媒介形質転換を用いてトランスジェニックP. lanceolata植物を得るための簡単なプロトコルを報告する。レポーター遺伝子GUS(β-グルクロニダーゼをコード)は、師部発現プロモーターであるAtPP2によって駆動され、A.ツメファシエンス株GV3101を介して3週齢のP.ランセオラータの根に形質転換されます(図2)。師部特異的プロモーターが選ばれたのは、植物血管組織、特に師部の機能ゲノミクスシステムを確立することに主な関心があったためです。この方法は、予備実験で根、葉、および葉柄組織でテストされました。カルスはすべての組織タイプで誘発される可能性がありますが、根の組織のみがSIMで1か月後にシュートイニシャル(図5A)を産生しました。葉と葉柄は茶色に変わり、死にました(図5B)。これは、根組織が形質転換法で使用するのに最適な組織タイプであるという結論につながりました。根を懸濁液(SS)に再懸濁した調製した細菌中で最低20分間インキュベートし(表1)、次に固体SSプレート上で室温で暗所で最大3日間インキュベートした(図3E)。次に、根をシュート誘導培地(SIM)に移し、プロトコルに示された条件でグローライトの下に保ちました(ステップ1.6)。図1および図3は、参考のためにプロトコルの各ステップの代表的な画像を示す。
図6は、根がSIM上に置かれた最初の日(図6A)から苗条が発根する準備ができたとき(図6D)までの、形質転換組織から出現する苗条のイニシャルの進行を示す。1週間後、根組織はカルスを形成し(図6B)、シュートイニシャルの始まりが観察されました(図6B1)。シュートは2週目と3週目の間も出現し続け(図6C)、4週間後、シュートは根誘導培地に移す準備ができていました(図6D)。
推定トランスジェニック植物の同定は、β-グルクロニダーゼ(GUS)組織化学的アッセイを使用して、芽の長さが約0.5 cmになった後に採取された葉のセグメントを使用して行われました。陽性トランスジェニック植物は、師部局在組織において予想される染色パターンを示し、図4に実証された。陽性のGUS染色苗条を根誘導培地に移し、4週間後に堅牢な発根系を発達させた(図1E)。その後、発根した植物を土壌に移しました。図4は、比較のために、AtPP2プロモーターとβグルクロニダーゼ(GUS)遺伝子で形質転換したナローリーフオオバコと、AtPP2プロモーターで形質転換した野生型とナローリーフオオバコで染色した結果を示しています。出現したすべての新芽はトランスジェニックであることが確認されました。形質転換効率は平均20%と決定され、形質転換された根10本ごとに約2つのシュートが出現した。確認されたトランスジェニック植物は、より大きな鉢に移され、成虫期に達するまで4〜8週間成長しました(図1F)。
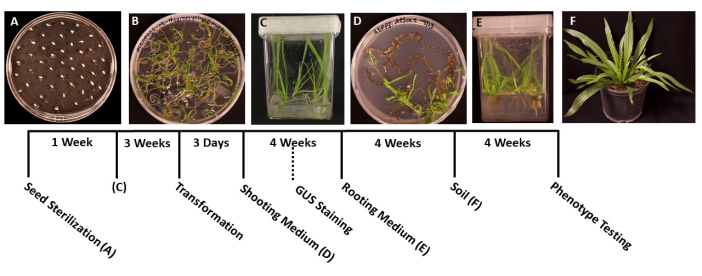
図1:オオバコランセオラータ変換のタイムライン。プロトコルの各段階の代表的な画像。(A)MSプレートに播種した未発芽種子。(B)種子は1週間後に発芽し、マゼンタの箱に移す準備ができました。(C)3週間の成長後のMSボックス内の植物。根は緑色で健康的で、形質転換に理想的な段階にあります。(D)4週間後のシュート誘導培地中のシュートは、発根培地に移す準備ができています。この段階で、該当する場合、β-グルクロニダーゼ(GUS)組織化学的染色を行うことができます。(E)根誘導培地が入った箱に入った植物で、4週間の成長後に根が形成された。(F)トランスジェニック植物は、土壌中で4週間成長した後、全長まで成長する。この図の拡大版を表示するには、ここをクリックしてください。
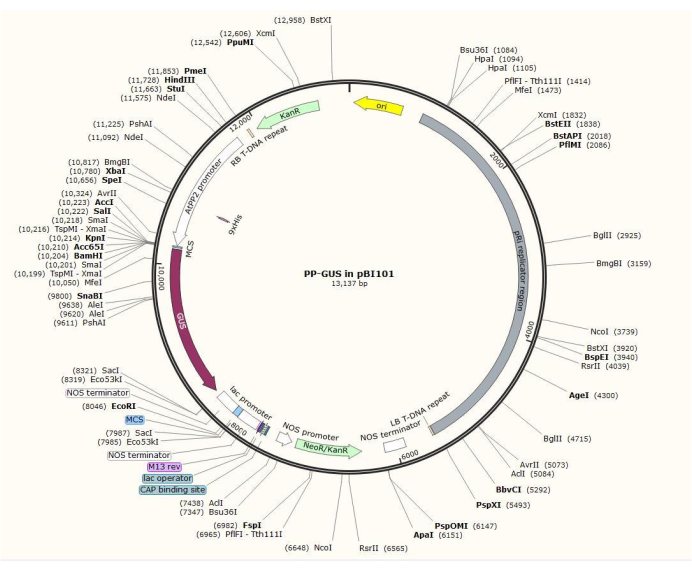
図2:師部特異的プロ モーターAtPP2を挿入したバイナリベクタープラスミドpBI101+β-グルクロニダーゼ(GUS)の図。 この図の拡大版を表示するには、ここをクリックしてください。
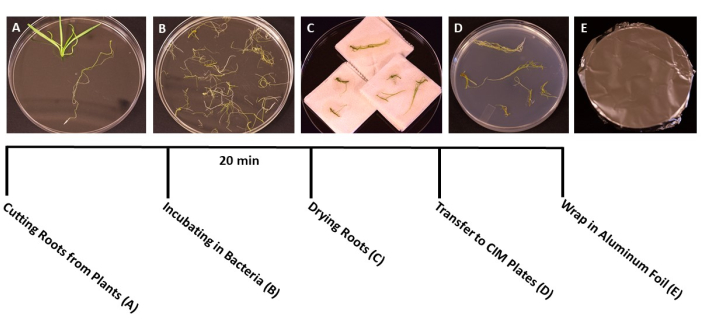
図3:変換の手順。 変換の各ステップの代表的な画像。(A)形質転換中に苗条から根を分離する。(B)根を細菌/ SS懸濁液に浸します。(C)ペーパータオルで根を乾かして、余分なバクテリアを取り除きます。(D)共培養培地に播種した根。(E)SSプレートをアルミホイルで包んだもの。植物を2〜3日間インキュベートした後、撮影培地に移した。 この図の拡大版を表示するには、ここをクリックしてください。
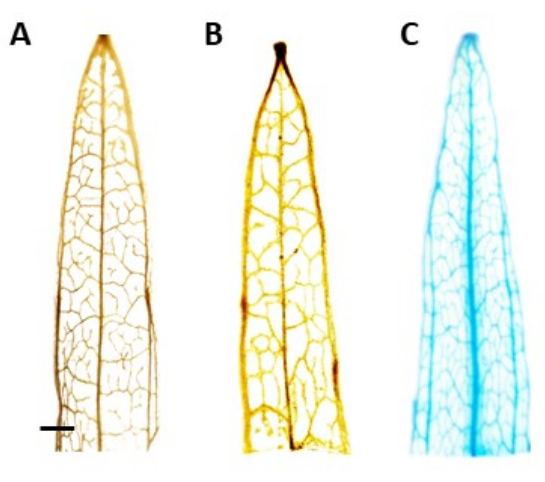
図4:GUS染色 。 β-グルクロニダーゼ(GUS)染色結果 狭葉オオバコ葉セグメントの。(A)野生型。(B) AtPP2 プロモーターを保持するプラスミド(空のベクター)で形質転換されたナローリーフオオバコ。(C) AtPP2 プロモーターとβ-グルクロニダーゼ(GUS)遺伝子を保持するプラスミドで形質転換されたナローリーフオオバコ。各葉をGUS組織化学染色プロトコルを用いて染色し、次いで顕微鏡カメラで画像化した。画像(B)および(C)は、GUS遺伝子の不在による染色パターンを示していません。右の画像は、静脈の明確な青色の染色パターンを示しており、植物が遺伝子組み換えであることを確認しています。バーは1 mmを表し、各葉のセグメントの長さは約1 cmです。 この図の拡大版を表示するには、ここをクリックしてください。
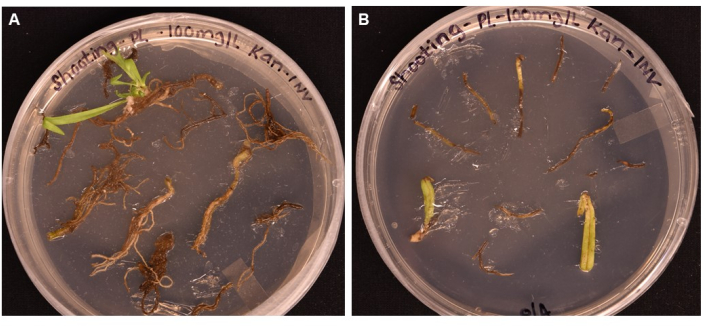
図5:撮影培地上で>1ヶ月インキュベートした後の異なる組織タイプの形質転換効率の比較 。 (A)1ヶ月以上の成長後の根組織。根は拡大したカルスを経験し、シュートのイニシャルが出現しました。形質転換されていないカルスは、抗生物質の選択に応答して死に始めています。(B)1ヶ月以上の成長後の葉および葉柄組織。組織はカルスの拡大を経験しましたが、抗生物質に反応してすぐに死亡しました。どちらの組織からも苗条は出なかった。 この図の拡大版を表示するには、ここをクリックしてください。
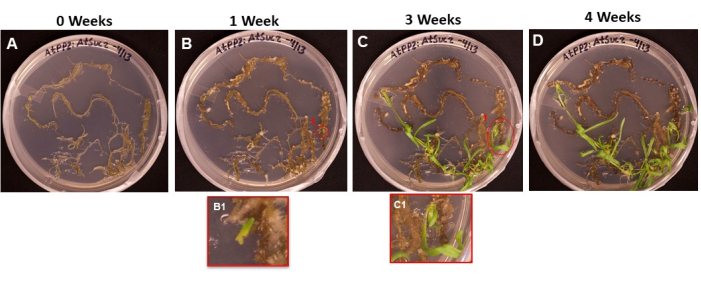
図6:形質転換組織上のカルスとシュートの出現。 異なる長さのインキュベーション後に撮影培地上に置かれた組織の代表的な画像。(A)撮影媒体に播種した直後の根組織。(B)撮影培地で1週間後の根組織。カルスの拡張が見られ、(B1)最初のシュートのイニシャルが出現し始めています。(C)撮影培地で3週間後の根組織。より多くのシュートイニシャルが登場しました。(C1)B1シュートのイニシャルから出てきたシュート。(D)4週間のインキュベーション後の根組織。形質転換されていない組織は黒/茶色に変わって死に始め、そして出現する新芽は成長し続けています。この段階で、芽は発根培地に移動する準備ができています。 この図の拡大版を表示するには、ここをクリックしてください。
表1:培地調製レシピ。 変換のために媒体を準備する方法の説明。添加されるビタミンの量は、示された原液濃度に基づいて計算されます。ビタミンストック溶液の調製については 表2 を参照してください。すべての培地について、900 mLの二重蒸留H2Oに試薬を加え、pHを指示されたレベルまで加え、次に最終容量1,000 mLまで水を加えます。* =滅菌後に追加します。** = 1 M KOHのpH。= 1 M NaOHによるpH。 この表をダウンロードするには、ここをクリックしてください。
表2: プランタゴ 培地のビタミンストック。 すべてのビタミンは、保管前にフィルター滅菌し、正確にラベルを付ける必要があります。示されている場合は、最初に粉末を1 N NaOHに溶解し、次に二重蒸留H2Oで目的の容量を構成します。 この表をダウンロードするには、ここをクリックしてください。
ディスカッション
プランタゴ属の植物の形質転換プロトコルの欠如は、特に研究者が遺伝子機能の探索に関心がある場合、モデルとしてのこれらの植物の使用を制限します。P. lanceolataは、その属の中で最も一般的に研究されている植物であるため、遺伝子形質転換プロトコルを開発するために選ばれました16。開発されたプロトコルは、血管生物学、生態学、植物と昆虫の相互作用、および非生物的ストレス生理学に関連する研究をさらに進めるためのツールとして使用される可能性があります。
提示されたプロトコルは、ユーザーがトランスジェニック植物を得ることを可能にするステップを明確に概説している。 P. lanceolata が組織培養環境で繁殖する能力に加えて、複数の要因が私たちの形質転換法の成功に貢献しました。第一に、形質転換のために高品質で無菌の植物根組織を使用することの重要性が観察された。根は、3〜4週齢の植物から採取したときに最も高い形質転換率を示し、緑色または淡白色に見えました。細菌や真菌の汚染がある程度の箱から採取された根は、しばしば汚染された射撃培養をもたらし、茶色に見える古い根は成功した形質転換をもたらさなかった。根組織は、葉と葉柄の組織が芽の発育に失敗したため、現在の方法を使用した形質転換に最も効率的な組織タイプでした。
もう一つの重要な観察は、形質転換のために根組織を収集するための最適な方法は、切りたての根の材料を滅菌水に入れることであるということでした。このステップにより、根は成長容器から取り出されるとすぐに乾く傾向があるため、残りの組織が収集されている間、根の材料は効果的に水和したままになります。このステップはまた、一度により多くの根を細菌内でインキュベートすることを可能にしたため、形質転換の成功率を高めるのに役立ちました。
このプロトコルは、根組織が共培養培地でインキュベートする時間を2日に短縮することで変更できます。シュートイニシャルをもたらす感染を可能にするには、2〜3日の潜伏期間で十分であることが観察されました。しかし、培地中に抗生物質阻害剤が存在しないと、 A. tumefaciensが 異常増殖し、出現組織を殺す可能性があることが観察されているため、より長いインキュベーション時間は推奨されません。
この研究の限界は、比較のためのP.ランセオラータ形質転換におけるA.ツメファシエンスの他の方法または種の性能に関する利用可能なデータの欠如です。私たちの知る限り、このプロトコルは斬新です。最初の試験では、A. tumefaciens GV3101で高い形質転換効率が認められ、他の菌株で実験するのではなく、この菌株を使用して技術を改良することに焦点を当てました。20%の形質転換効率は植物の形質転換にとって比較的高く、多くの従来の方法では>1%が成功すると考えています26,27,28。ただし、複数の種29,30,31で根の形質転換に使用することで知られているA.リゾゲネスなどのA.ツメファシエンスの別の株を使用すると、さらに高い成功率が得られる可能性があります。P. lanceolataの形質転換効率の向上を促進するために他の菌株を使用することの影響を評価するには、さらなる実験が必要です。
P. lanceolataの変換の成功は、多くの研究分野に利益をもたらす可能性があります。高い形質転換効率と組織培養培地での植物の急速な成長により、P. lanceolataは遺伝子機能研究の実行可能な候補となっています15。
開示事項
著者は開示するものは何もありません。
謝辞
この研究は、国立科学財団(EDGE IOS-1923557からC.Z.およびY.Z.)の支援を受けました。
資料
| Name | Company | Catalog Number | Comments |
| 14 mL Round Bottom TubeA4A2:A34 | ThermoFisher Scientific | 150268 | |
| 1-Naphthylacetic acid | Gold Biotechnology | N-780 | |
| 3M Micropore Surgical Paper Tape | ThermoFisher Scientific | 19-027761 | |
| 50 mL Centrifuge Tubes | Research Products International Corp. | 163227LC | |
| 600 Watt High Pressure Sodium Lights | Plantmax | PX-LU600 | |
| 6-Benzylaminopurine (6-BAP) | Gold Biotechnology | B-110 | |
| Aluminum Foil | ThermoFisher Scientific | 01-213-100 | |
| Bacto Agar | Thermofisher Scientific | 214010 | |
| Binary Plasmid pBI101 | Clontech, USA | 632522 | |
| Cool White Grow Light Sylvania LLC | Home Depot | 315952205 | |
| D-biotin | ThermoFisher Scientific | BP232-1 | |
| ddH2O | |||
| DH5a E. coli | Invitrogen, USA | 18258012 | |
| Disposable Petri Dishes, Sterile 150 x 16 mm | ThermoFisher Scientific | FB0875712 | |
| Disposable Petri Dishes, Sterile 95 x 15 mm | ThermoFisher Scientific | FB0875714G | |
| Dissecting Scissors | Leica Biosystems | 38DI12044 | |
| Ethanol 200 Proof | Decon Labs | 2705 | |
| Folic Acid | Fisher Scientific | BP2519-5 | |
| Forceps | Leica Biosystems | 38DI18031 | |
| Gelrite | Research Products International Corp. | G35020-1000 | |
| Glycerol | ThermoFisher Scientific | 17904 | |
| Glycine | Sigma | 241261 | |
| Incubated Tabletop Orbital Shaker | ThermoFisher Scientific | SHKE420HP | |
| Indole-3-Acetic Acid (IAA) | Gold Biotechnology | I-110 | |
| Indole-3-Butyric Acid (IBA) | Gold Biotechnology | I-180 | |
| Kanamycin Monosulfate | Gold Biotechnology | K-120 | |
| Macrocentrifuge | ThermoFisher Scientific | 75007210 | |
| Magenta Boxes | ThermoFisher Scientific | 50255176 | |
| Micro Pipet Tips 1000 µL | Corning | 4140 | |
| Micro Pipet Tips 200 µL | Corning | 4138 | |
| Micro Pipette Tips 10 µL | Corning | 4135 | |
| Microcentrifuge | ThermoFisher Scientific | 75002410 | |
| Micropipettor 0.5-10 µL | Corning | 4071 | |
| Micropipettor 100-1000 µL | Corning | 4075 | |
| Micropipettor 20-200 µL | Corning | 4074 | |
| Micropipettor 2-20 µL | Corning | 4072 | |
| Murashige & Skooge Basal Medium with Vitamins | PhytoTech | M519 | |
| Murashige & Skooge Basal Salt Mixture | PhytoTech | M524 | |
| myo-Inositol | Gold Biotechnology | I-25 | |
| Nicotinic acid | Sigma | N0761-100g | |
| Parafilm (paraffin film) | ThermoFisher Scientific | S37440 | |
| Potassium Hydroxide (KOH) | Research Products International Corp. | P44000 | |
| Pyridoxine HCl | Sigma | P6280-10g | |
| Scalpel Blade Handle | Leica Biosystems | 38DI36419 | |
| Scalpel Blades | Leica Biosystems | 3802181 | |
| Sodium Chloride, Crystal (NaCl) | Mallinckrodt Chemicals | 7581-06 | |
| Sodium Hydroxide (NaOH) | Research Products International Corp. | S24000 | |
| Sodium Hypochlorite | Walmart | 23263068401 | |
| Soil- Bark Mix | Berger, USA | BM7 | |
| Square Pots (3.5 inches squared) | Greenhouse Megastore | CN-TRK-1835 | |
| Sucrose | Research Products International Corp. | S24060 | |
| Thermocycler | ThermoFisher Scientific | A24811 | |
| Thiamine HCl | Sigma | T4625-5G | |
| Timentin Ticarcillin/Clavulanate (15/1) (Timentin) | Gold Biotechnology | T-104 | |
| trans-Zeatin Riboside (ZR) | Gold Biotechnology | Z-100 | |
| Tryptone | Thermofisher Scientific | 211705 | |
| Wild Type Plantago lanceolata seeds | Outsidepride Seed Source, OR, USA | F1296 | Outsidepride.com |
| Yeast Extract Granulated | Research Products International Corp. | Y20025-1000 |
参考文献
- Koornneef, M., Meinke, D. The development of Arabidopsis as a model plant. The Plant Journal. 61 (6), 909-921 (2010).
- Bragg, J. N., Anderton, A., Nieu, R., Vogel, J. P. Brachypodium distachyon. Agrobacterium Protocols. , 17-33 (2015).
- Chang, C., Bowman, J. L., Meyerowitz, E. M. Field guide to plant model systems. Cell. 167 (2), 325-339 (2016).
- Müller, B., Grossniklaus, U. Model organisms-a historical perspective. Journal of Proteomics. 73 (11), 2054-2063 (2010).
- Ding, X., et al. Different fruit-specific promoters drive AtMYB12 expression to improve phenylpropanoid accumulation in tomato. Molecules. 27 (1), 317 (2022).
- Niedbała, G., Niazian, M., Sabbatini, P. Modeling agrobacterium-mediated gene transformation of tobacco (Nicotiana tabacum)-a model plant for gene transformation studies. Frontiers in Plant Science. 12, 695110 (2021).
- Kumari, D., Prasad, B., Dwivedi, P. . Genome Editing Platforms in Rice (Oryza sativa L.): Basic methodology and troubleshooting. , (2022).
- Zhang, B. Agrobacterium-mediated transformation of cotton. Transgenic Cotton. , 31-45 (2013).
- Tiwari, R., Singh, A. K., Rajam, M. V. Improved and reliable plant regeneration and Agrobacterium-mediated genetic transformation in soybean (Glycine max L). Journal of Crop Science and Biotechnology. , 1-10 (2022).
- Bakhsh, A. Development of efficient, reproducible and stable Agrobacterium-mediated genetic transformation of five potato cultivars. Food Technology and Biotechnology. 58 (1), 57-63 (2020).
- Bates, R., Craze, M., Wallington, E. J. Agrobacterium-mediated transformation of oilseed rape (Brassica napus). Current Protocols in Plant Biology. 2 (4), 287-298 (2017).
- Hopp, H. E., Spangenberg, G., Herrera-Estrella, L. Plant transformation. Frontiers in Plant Science. 13, 876671 (2022).
- Abdelmuhsin, A. A., Alghamdi, A. A., Ibrahim, N. A. Assessing the phenotypic and genotypic variations of Plantago ciliata in Ha'il region, Saudi Arabia. Entomology and Applied Science Letters. (1), 14-22 (2021).
- Coleman, N. Plantago Lanceolata. Botanical Bulletin. 1 (11), 45 (1876).
- Huang, J., et al. Tissue-specific transcriptomic profiling of Plantago major provides insights for the involvement of vasculature in phosphate deficiency responses. Molecular Genetics and Genomics. 294 (1), 159-175 (2019).
- Penczykowski, R. M., Sieg, R. D. Plantago spp. as models for studying the ecology and evolution of species interactions across environmental gradients. The American Naturalist. 198 (1), 158-176 (2021).
- Pommerrenig, B., et al. Common plantain. A collection of expressed sequence tags from vascular tissue and a simple and efficient transformation method. Plant Physiology. 142 (4), 1427-1441 (2006).
- Bergero, R., Levsen, N., Wolff, K., Charlesworth, D. Arms races with mitochondrial genome soft sweeps in a gynodioecious plant, Plantago lanceolata. Molecular Ecology. 28 (11), 2772-2785 (2019).
- Aalto, E. A., Koelewijn, H. P., Savolainen, O. Cytoplasmic male sterility contributes to hybrid incompatibility between subspecies of Arabidopsis lyrata. G3: Genes, Genomes, Genetics. 3 (10), 1727-1740 (2013).
- Bloch, K. D., Grossmann, B. Digestion of DNA with restriction endonucleases. Current Protocols in Molecular Biology. 3 (1), (1995).
- Du, C., et al. Prokaryotic expression, purification, physicochemical properties and antifungal activity analysis of phloem protein PP2-A1 from cucumber. International Journal of Biological Macromolecules. 194, 395-401 (2022).
- Deshmukh, S. 2. 2., Kulkarni, R., Bose, K. Transformation and protein expression. Textbook on Cloning, Expression and Purification of Recombinant Proteins. , 83-114 (2022).
- Bergkessel, M., Guthrie, C. Colony PCR. Methods in Enzymology. 529, 299-309 (2013).
- Broehan, G., Kroeger, T., Lorenzen, M., Merzendorfer, H. Functional analysis of the ATP-binding cassette (ABC) transporter gene family of Tribolium castaneum. BMC Genomics. 14, 6 (2013).
- Dong, Z., et al. Stable transformation of fluorescent proteins into Nosema bombycis by electroporation. Parasites & Vectors. 15 (1), 141 (2022).
- Li, S., et al. Optimization of Agrobacterium-mediated transformation in soybean. Frontiers in Plant Science. 8, 246 (2017).
- Manimaran, P., et al. Infection of early and young callus tissues of indica rice BPT 5204 enhances regeneration and transformation efficiency. Rice Science. 20 (6), 415-426 (2013).
- Wang, J., Nie, J., Pattanaik, S., Yuan, L. Efficient Agrobacterium-mediated transformation of Artemisia annua L. using young inflorescence. In Vitro Cellular & Developmental Biology-Plant. 52 (2), 204-211 (2016).
- Niazian, M., Belzile, F., Torkamaneh, D. CRISPR/Cas9 in planta hairy root transformation: a powerful platform for functional analysis of root traits in soybean. Plants. 11 (8), 1044 (2022).
- Geng, S., et al. An efficient root transformation system for CRISPR/Cas9-based analyses of shoot-root communication in cucurbit crops. Horticulture Research. 9, (2022).
- Xiao, Y., et al. Efficient Agrobacterium-mediated genetic transformation using cotyledons, hypocotyls and roots of 'Duli'(Pyrus betulifolia Bunge). Scientia Horticulturae. 296, 110906 (2022).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved