Method Article
Transformação Genética Mediada por Agrobacterium tumefaciens de Plátano de Folha Estreita
Neste Artigo
Resumo
Devido à sua versátil aplicação como espécie-modelo em vários campos de estudo, há a necessidade de um kit de ferramentas de transformação genética em banana-da-terra (Plantago lanceolata) de folha estreita. Aqui, utilizando a transformação mediada por Agrobacterium tumefaciens, é apresentado um protocolo que resulta em linhagens transgênicas estáveis com eficiência de transformação de 20%.
Resumo
As espécies do gênero Plantago têm várias características únicas que as levaram a serem adaptadas como plantas-modelo em vários campos de estudo. No entanto, a falta de um sistema de manipulação genética impede a investigação aprofundada da função gênica, limitando a versatilidade deste gênero como modelo. Aqui, um protocolo de transformação é apresentado para Plantago lanceolata, a espécie de Plantago mais comumente estudada. Usando a transformação mediada por Agrobacterium tumefaciens, raízes de plantas de P. lanceolata cultivadas assepticamente com 3 semanas de idade foram infectadas com bactérias, incubadas por 2-3 dias e, em seguida, transferidas para um meio de indução da parte aérea com seleção antibiótica apropriada. Os brotos tipicamente emergiram do meio após 1 mês, e as raízes se desenvolveram 1-4 semanas após a transferência dos brotos para o meio de indução radicular. As plantas foram então aclimatadas ao ambiente de solo e testadas quanto à presença de um transgene usando o ensaio repórter de β-glucuronidase (GUS). A eficiência de transformação do método atual é de ~20%, com duas plantas transgênicas emergindo a cada 10 tecidos radiculares transformados. O estabelecimento de um protocolo de transformação para a banana-da-terra facilitará a adoção desta planta como uma nova espécie modelo em várias áreas.
Introdução
O conceito de usar espécies-modelo para investigar múltiplos aspectos da biologia vegetal surgiu com o amplo uso de Arabidopsis thaliana1. Arabidopsis foi inicialmente escolhida porque compartilha características com muitas outras plantas com flores e tem várias características que tornam conveniente estudar em um ambiente de laboratório, como ser pequeno e ter um ciclo de geração curto. O grande volume de trabalhos de pesquisa publicados com ele como sujeito, juntamente com seu pequeno tamanho do genoma e facilidade de transformação genética2, permitem que ele persista como um organismo experimental amplamente utilizado. No entanto, Arabidopsis pode ser limitado como modelo para espécies com características diferentes ou características únicas3. Isso tem motivado o desenvolvimento de novos sistemas-modelo, como o milho (Zea mays), uma planta importante para a genética do desenvolvimento em monocotiledôneas4, e o tomateiro (Solanum lycopersicum), que é um importante modelo para estudos evolutivos, desenvolvimento e produção de frutos, e é uma boa representação para hortaliças5. Um método de transformação genética é um pré-requisito para que uma espécie vegetal sirva como organismo modelo2. Uma transformação mediada por Agrobacterium tumefaciens é uma ferramenta confiável em biologia vegetal; tem sido utilizada para transformar algumas espécies-modelo e culturas importantes, incluindo tabaco (Nicotiana tabacum)6, arroz (Oryza sativa)7, algodão (Gossypium hirsutum)8, soja (Glycine max)9, batata (Solanum tuberosum)10 e canola (Brassica napus)11. As espécies vegetais são altamente variáveis quanto ao sucesso com que respondem à infecção por A. tumefaciens e os protocolos de transformação muitas vezes precisam ser adaptados individualmente a cada espécie 6,12.
O gênero Plantago inclui um total de 256 espécies vegetais, amplamente distribuídas em todo omundo13. As espécies deste gênero frequentemente têm características únicas que as tornam desejáveis como espécies-modelo para o estudo da genética, ecologia, fisiologia do estresse, metabólitos secundários, química medicinal, interações planta-micróbio, desenvolvimento e evolução vegetal. Plantago lanceolata , também chamada de banana de folha estreita ou erva-de-ribúscula, tem sido uma planta popular de interesse desdeo século 19, quando foi usada pela primeira vez para descrever o fenômeno da esterilidade masculina14. Como outras plantas de seu gênero, tem sido usado em estudos em vários campos de pesquisa. Mais recentemente, tem sido proposta como modelo para a biologia vascular, uma vez que seu tecido vascular pode ser facilmentecoletado15. P. lanceolata é a espécie mais comumente estudada no gênero Plantago; um artigo de 2021 relatou que havia > 1.400 publicações incluindo ou relacionadas a esta espécie naquele momento16, e mais 102 artigos foram publicados desde o início de 2022, de acordo com uma pesquisa no PubMed realizada em 9 de dezembrode 2022. A segunda planta mais estudada do gênero, P. major, é objeto de apenas 414 artigos quando pesquisada usando os mesmos critérios na mesma data.
Apesar do interesse de pesquisa em P. lanceolata, os estudos, especialmente sobre a caracterização da função gênica, são frequentemente limitados pela falta de um kit de ferramentas de manipulação genética para a espécie. Pommerrienig e col. fizeram esforços para desenvolver um protocolo de transformação para P. major usando uma técnica de imersão floral17. Entretanto, este método não pode ser aplicado a P. lanceolata devido à esterilidade masculina característica desta espécie18,19. Até onde sabemos, não existe um protocolo para a transformação de P. lanceolata.
Este estudo apresenta um protocolo simples para a transformação mediada por A. tumefaciens de P. lanceolata. Ao atingir os tecidos radiculares, plantas transgênicas totalmente cultivadas podem ser geradas dentro de 3 meses após a transformação.
Protocolo
NOTA: As etapas 1.4-1.8, 2.3-2.5, 3.3-3.6, 4.1-4.6, 5.1-5.7 e 6.1-6.3 devem ser executadas em condições assépticas, usando uma coifa limpa para evitar contaminação.
1. Propagação de material vegetal para transformação
- Coloque sementes de Plantago lanceolata do tipo selvagem (WT) comercialmente disponíveis (ver Tabela de Materiais) em um tubo de centrífuga de 50 mL até a linha de 5 mL, dependendo do número de plantas desejadas.
NOTA: Alternativamente, um tubo de microcentrífuga de 2 mL pode ser usado quando um pequeno número de sementes é necessário, mas deve ser preenchido para um volume não superior a 0,1 mL, pois muitas sementes podem reduzir a eficiência da esterilização. - Imergir as sementes em etanol 75% por 60 s.
- Descarte o etanol e, em seguida, mergulhe as sementes em hipoclorito de sódio a 20% (NaClO 20%, água estéril a 80%) por 40 min, invertendo suavemente o tubo para que todas as sementes entrem em contato com a solução.
NOTA: A solução de hipoclorito de sódio deve ser feita na hora para obter os melhores resultados. - Sob uma capela de fluxo laminar, descarte a solução de hipoclorito de sódio e, em seguida, lave as sementes com água destilada (cinco vezes). Adicione um pequeno volume de água às sementes após o enxágue final, pois isso pode ajudar a auxiliar o movimento das plantas em placas.
- Com pinça esterilizada, transferir as sementes para placas de Petri de 95 mm x 100 mm, pré-preparadas, com meio MS sólido (Tabela 1). Espalhe as sementes uniformemente pela superfície da placa, com aproximadamente 1 cm entre cada semente para evitar superlotação das plântulas germinadas (Figura 1A).
- Selar as placas com duas camadas de filme de parafina para evitar contaminação, em seguida, incubar sob uma luz de crescimento branca fria (ver Tabela de Materiais) à temperatura ambiente (22 °C com 50 μmol m-2 s-1, 12 h dias). As sementes normalmente germinam dentro de 5-6 dias.
- Quando as plântulas germinarem e forem grandes o suficiente para transferência (Figura 1B), tipicamente 2 ou 3 dias após a germinação, utilizar pinça esterilizada para transferir as plântulas para caixas estéreis com 50-100 mL de meio MS (Tabela 1). O ideal é plantar apenas cinco mudas por caixa para obter raízes de melhor qualidade.
- Selar as caixas com fita cirúrgica e, em seguida, permitir que as plantas cresçam sob uma luz de crescimento branca fria (ver Tabela de Materiais), nas mesmas condições mencionadas no passo 1.6. As plantas devem estar prontas para a transformação em cerca de 3-4 semanas, ou quando as raízes principais cresceram cerca de 2 cm de comprimento e as raízes laterais parecem brancas.
NOTA: As receitas de preparo médio e os estoques vitamínicos estão incluídos na Tabela 1 e na Tabela 2.
2. Construção de plasmídeos e transformação de E. Coli
NOTA: O procedimento exato de construção do plasmídeo varia dependendo do gene de interesse. Neste procedimento, as enzimas de restrição Hind III e SalII foram utilizadas para inserir o promotor AtPP2 de 1,5 kb no plasmídeo binário pBI101 (ver Tabela de Materiais) com GUS, utilizando o procedimento padrão declonagem20. AtPP2 (phloem protein 2) é um gene que é especificamente expresso no floema21.
- Clone o promotor usando os pares de primers 5'-AGTCAAGCTTCAAGTCCCTGTGGCTACTGAAC-3' (Forward) e 5'-AGTCGTCGACACAAACCAGTATGATGTATTTATTTTTG-3' (Reverse) de Arabidopsis. A Figura 2 mostra um diagrama do vetor plasmidial binário com a inserção AtPP2:GUS .
- Após a construção do plasmídeo, transformar os plasmídeos em células competentes DH5a E. coli (ver Tabela de Materiais) usando o método de choque térmico22 e, em seguida, incubar por 1,5 h a 37 °C com agitação (150 rpm).
- Tomar 150 μL de cada cultura de transformação, colocar a placa em placas de meio de ágar LB (Tabela 1) com a seleção apropriada (50 mg/L de canamicina para a cepa usada neste protocolo; ver Tabela de Materiais) e, em seguida, incubar as placas por 16-24 h a 37 °C.
NOTA: A cepa bacteriana utilizada neste estudo é A. tumefaciens GV3101. - Em seguida, utilizar a PCR de colônias para rastrear as colônias em busca de recombinantes positivos23.
NOTA: Neste protocolo, os seguintes primers foram usados para amplificar o gene alvo; 5'-ATGTTACGTCCTGTAGAAACCCCAA-3'(Forward) e 5'-TCATTGTTTGCCTCCCTGCTGC-3' (Reverse).- Executar a reação em um termociclador (ver Tabela de Materiais) com condições de ciclagem de 3 min a 95 °C, seguido por 35 ciclos de: 30 s a 95 °C, 30 s a 55 °C, 2 min a 72 °C e uma etapa final de alongamento de 10 min a 72 °C.
- Inocular as colônias positivas em 6 mL de caldo LB (Tabela 1) com antibiótico apropriado (50 mg/L de canamicina) e crescer a 37 °C durante a noite, a 200-250 rpm.
- Após o crescimento durante a noite, extrair os plasmídeos das bactérias usando procedimentos padrão24.
3. Transformação de A. tumefaciens com plasmídeo
- Após a extração do plasmídeo, utilizar a eletroporação para transformar o plasmídeo modificado na linhagem desejada de células competentes. Neste procedimento, utilizou-se A. tumefaciens cepa GV3101. Seguir métodos padronizados para técnicas de eletroporação25.
- Após a eletroporação, ressuspender as células competentes em 1 mL de caldo LB e, em seguida, incubar por 2-4 h a 28 °C a 100 rpm.
- Recolher as células através de centrifugação a 6.800 x g durante 3 minutos numa microcentrífuga de mesa (ver Tabela de Materiais) à temperatura ambiente (22 °C) e, em seguida, espalhar 50-100 μL numa placa de ágar LB com um agente de selecção apropriado (50 mg/L de canamicina para o plasmídeo utilizado neste protocolo).
- Após as células terem incubado por 2 dias a 28 °C, identificar colônias positivas contendo o gene de interesse através do uso de PCR de colônias. Neste protocolo, utilizar os primers e condições mencionados no passo 2.4.
- Em seguida, use as colônias positivas para listar uma placa de estoque com meio de ágar LB + seleção. A placa pode ser armazenada a 4 °C por até 1 mês.
- Alternativamente, para armazenamento a longo prazo, inocular uma colônia positiva com um pequeno volume de LB com seleção apropriada. Agitar a cultura inoculada durante a noite a 28 °C a 200 rpm e, em seguida, preparar um estoque de glicerol (50% p/v de glicerol em uma mistura de 50:50 de bactérias e glicerol), que pode ser armazenado a -80 °C por até 10 anos.
4. Preparação de A. tumefaciens
- Streak A. tumefaciens contendo o plasmídeo desejado em placas LB sólidas preparadas de 95 mm x 100 mm com o agente de seleção apropriado. Neste protocolo, foi utilizada a cepa bacteriana GV3101 com inserção plasmidial AtPP2:GUS , com 50 mg/L de canamicina adicionada para a seleção.
- Sele as placas com filme de parafina, em seguida, incubar a 28 °C por até 48 h, ou até que a bactéria cresça grande o suficiente para pegar.
- Use uma ponta de pipeta para escolher uma colônia de bactérias 2 dias antes da transformação e inocular-a em um tubo de fundo redondo de 15 mL contendo 6 mL de LB líquido com seleção apropriada. Agite a 200 rpm em um agitador de mesa de 28 °C durante a noite, até que o OD600 atinja 0,6-0,7.
NOTA: As placas e a inoculação bacteriana de 6 mL podem ser armazenadas a 4 °C por até 1 mês. - Quando as bactérias atingirem o OD 600 correto, utilizar uma pipeta para transferir A. tumefaciens para um frasco estéril contendo100 mL de LB líquido com um agente de seleção. Normalmente, 200 μL de bactérias por 100 mL de LB são apropriados para propagação. Agitar a 200 rpm a 28 °C durante a noite, até que OD600 atinja 0,6-0,7.
- Transferir as bactérias para tubos de centrífuga estéreis de 50 mL e centrifugar a 2.200 xg por 10 min à temperatura ambiente (22 °C) em uma centrífuga de mesa para coletar as bactérias.
- Descarte o sobrenadante usando uma pipeta. Ressuspender o pellet bacteriano em 5 mL de solução líquida de suspensão (SS) à temperatura ambiente (22 °C) (Tabela 1) por pipetagem, adicionar até 50 mL de SF e inverter várias vezes para misturar. A bactéria está agora pronta para a transformação.
OBS: O SS líquido deve ser preparado na hora, dentro de 1 semana após a transformação.
CUIDADO: Todo material que entra em contato com A. tumefaciens precisa ser descartado em uma lixeira de risco biológico. Sobras de culturas bacterianas podem ser esterilizadas com hipoclorito de sódio (água sanitária) em concentração igual ou superior a 20%.
5. Transformação das raízes de Plantago
- Quando as plantas atingirem o estágio ideal para transformação (as plântulas têm 3 semanas de idade) (Figura 1C), utilizar pinça e tesoura estéreis para separar as raízes do restante da planta (Figura 3A). Descarte o material da folha e do caule.
- Imediatamente após o corte, transfira os pedaços de raiz para caixas estéreis contendo água estéril usando pinças estéreis. Esta etapa permite que as raízes se mantenham hidratadas enquanto todo o tecido é coletado.
- Quando todas as raízes estiverem cortadas, despeje a suspensão de A. tumefaciens/SS em placas de Petri descartáveis estéreis de 150 mm x 15 mm. Transferir as raízes para a cultura de A. tumefaciens e inocular por pelo menos 20 min (Figura 3B).
- Durante a incubação, utilizar bisturi estéril com lâmina afiada para cortar as raízes em fragmentos de 1 cm, separando as raízes primárias das raízes laterais. Faça cortes finos e rasos na superfície das raízes para permitir que as bactérias infectem a planta.
NOTA: Se lidar com um grande número de plantas, transfira os pedaços de raiz para a cultura bacteriana em lotes, para garantir que todas as raízes estejam imersas durante a inoculação. - Após a incubação, use a pinça estéril para transferir os pedaços de raiz para toalhas de papel estéreis para remover o excesso de bactérias. Evite secar as raízes por mais de 60 s, pois isso pode causar desidratação e danificar o tecido radicular. Idealmente, 10-15 raízes podem ser secas simultaneamente (Figura 3C).
- Transfira as raízes secas para placas de Petri preparadas de 95 mm x 15 mm com meios sólidos de co-cultivo (Tabela 1), em torno de 10-20 raízes por placa, dependendo do tamanho das raízes (Figura 3D).
- Sele as placas com duas camadas de filme plástico transparente e, em seguida, cubra com papel alumínio. Incubar à temperatura ambiente (22 °C) durante 3 dias. Essa etapa dá tempo para que as bactérias infectem as raízes sem a presença de uma seleção de antibióticos (Figura 3E).
6. Seleção e regeneração de toda a planta
- Após incubação em meio de co-cultura, transferir as peças de raiz para placas de Petri preparadas de 95 mm x 15 mm com meio sólido de indução da parte aérea (SIM) (Tabela 1) com Timentin (500 mg/L; ver Tabela de Materiais) e seleção adequada de antibióticos. Nesse protocolo, utilizou-se canamicina (100 mg/L).
OBS: O fundo das raízes deve entrar em completo contato com o meio. As raízes que não tocam a superfície do meio são muito longas e devem ser cortadas para evitar que o tecido escape da seleção. - Sele as placas com duas camadas de filme plástico transparente e, em seguida, cresça sob uma luz de crescimento durante 1 mês (ver passo 1.6 para condições adequadas), ou até que os brotos comecem a emergir.
NOTA: Normalmente, as iniciais do broto podem ser observadas após 2 semanas de crescimento, e os brotos são tipicamente visíveis após 1 mês. - Quando as plântulas tiverem de 1,5 a 2,0 cm de comprimento (Figura 1D), transferi-las para caixas estéreis preparadas com meio sólido de indução radicular (Tabela 1).
- Cultivar as plantas sob uma luz de crescimento (ver passo 1.6 para condições) durante várias semanas, até que as raízes se formem. As raízes normalmente podem ser vistas pela primeira vez após 1 semana.
NOTA: Recomenda-se permitir que as raízes cresçam por várias semanas antes de se moverem para o solo, pois plantas com sistemas radiculares maiores tendem a ter uma taxa de sobrevivência maior no solo.
7. Transferência de solo
- Quando os sistemas radiculares tiverem se tornado grandes o suficiente para serem transferidos (Figura 1E), tipicamente após 1 mês de crescimento, transfira as plantas para 3,5 em vasos quadrados contendo solo pré-molhado para todos os fins (BM7). Neste protocolo, foi utilizada a mistura de cascas de BM7 (ver Tabela de Materiais).
- Retire qualquer meio que grude nas raízes, lavando-as suavemente em água.
NOTA: As plantas podem ser cultivadas até a maturidade em casa de vegetação a 800 a 1400 μmol fótons m-2 s-2 usando luzes de alta pressão de sódio de 600 W (ver Tabela de Materiais), ou em uma câmara de crescimento à temperatura ambiente (22 °C) com luzes brancas frias a 50 μmol m-2 s-1, 12 h dias.
- Retire qualquer meio que grude nas raízes, lavando-as suavemente em água.
- Cubra as plantas com uma tampa plástica de vaso e, em seguida, cubra-as com um saco plástico transparente. Essa etapa permite que as plantas permaneçam em um ambiente úmido à medida que se adaptam ao solo.
- Após cerca de 3-5 dias, remova o saco plástico e, em seguida, remova lentamente a tampa para permitir a aclimatação ao ambiente externo.
OBS: Dependendo da época do ano e do ambiente para o qual as plantas são transferidas, o tempo que as plantas precisam se adaptar pode variar. Recomenda-se verificar as plantas diariamente e adicionar água aos vasos, conforme necessário. - Regue as plantas regularmente e adicione fertilizante conforme necessário. As plantas também podem ser transferidas para vasos maiores para posterior crescimento (Figura 1F).
8. Coloração histoquímica da β-glucuronidase (GUS)
- Preparar solução corante de β-glucuronidase (GUS), de acordo com protocolos publicados15.
- Quando as iniciais da parte aérea tiverem cerca de 0,5-1 cm de comprimento, remova uma pequena ponta de uma folha jovem e totalmente expandida (<5 mm de comprimento geralmente é suficiente) e transfira imediatamente para 0,5-1 mL de solução corante de GUS em um tubo de microcentrífuga de 1,5 ou 2 mL. A solução deve cobrir totalmente o tecido vegetal.
- Coloque os tubos abertos em um exsicador a vácuo e vácuo a 20-25 kPa por 5-10 min. Pequenas bolhas devem ser visíveis na solução durante o procedimento de vácuo. Isso permite que a solução entre nas células da planta.
- Deixe o ar filtrar de volta para o dessecador a vácuo. Feche os tubos e incube a 37 °C durante a noite (12 h), ou até que a cor azul seja visível.
NOTA: Neste estudo, a atividade do GUS foi localizada no floema, o que significa que em plantas positivamente transformadas, a coloração azul deve ser visível apenas no tecido do floema. Plantas sem o transgene não apresentam coloração (Figura 4). - Para melhor visualização da mancha, transfira as plantas para etanol 100% para remover a clorofila. Para aumentar a eficiência do processo de remoção de clorofila, incubar os tubos a 60 °C por 10 min.
NOTA: O etanol pode precisar ser trocado várias vezes antes de toda a clorofila ser removida, dependendo do tamanho da folha que está sendo manchada.
Resultados
Um protocolo simples é relatado aqui para a obtenção de plantas transgênicas de P. lanceolata usando transformação mediada por A. tumefaciens. O gene repórter GUS (que codifica a β-glucuronidase) é transformado, impulsionado pelo promotor floema expresso de AtPP2, em raízes de P. lanceolata com 3 semanas de idade através da cepa GV3101 de A. tumefaciens (Figura 2). Um promotor floema-específico foi escolhido porque nosso principal interesse era estabelecer um sistema para a genômica funcional de tecidos vasculares de plantas, particularmente floema. O método foi testado no tecido da raiz, folha e pecíolo no experimento preliminar. Embora o calo pudesse ser induzido em todos os tipos de tecido, apenas o tecido radicular produziu iniciais da parte aérea (Figura 5A) após 1 mês no SIM; a folha e o pecíolo ficaram marrons e morreram (Figura 5B). Isso levou à conclusão de que o tecido radicular era o tipo de tecido ideal para uso no método de transformação. As raízes foram incubadas nas bactérias preparadas ressuspensas em solução de suspensão (SS) (Tabela 1) por um período mínimo de 20 min, em seguida incubadas à temperatura ambiente em placas sólidas de SS por até 3 dias no escuro (Figura 3E). As raízes foram então transferidas para o meio de indução da parte aérea (SIM) e mantidas sob luz de crescimento, nas condições indicadas no protocolo (etapa 1.6). A Figura 1 e a Figura 3 mostram imagens representativas de cada etapa do protocolo para referência.
A Figura 6 mostra a progressão das iniciais dos brotos que emergem do tecido transformado, desde o primeiro dia em que as raízes foram colocadas no SIM (Figura 6A) até quando os brotos estavam prontos para serem enraizados (Figura 6D). Após 1 semana, o tecido radicular formou-se calo (Figura 6B), observando-se o início das iniciais dos cautes (Figura 6B1). Os brotos continuaram a emergir durante as semanas 2 e 3 (Figura 6C) e, após 4 semanas, os brotos estavam prontos para serem transferidos para o meio de indução radicular (Figura 6D).
A identificação das plantas putativas transgênicas foi realizada por meio do ensaio histoquímico de β-glucuronidase (GUS), utilizando-se segmentos foliares retirados quando a parte aérea tinha cerca de 0,5 cm de comprimento. Plantas transgênicas positivas apresentaram o padrão de coloração esperado no tecido localizado do floema, demonstrado na Figura 4. A parte aérea positiva corada pelo GUS foi transferida para o meio de indução radicular, no qual desenvolveram sistemas robustos de enraizamento após 4 semanas (Figura 1E). As plantas enraizadas foram então transferidas para o solo. A Figura 4 mostra o resultado da coloração em uma banana de folha estreita transformada com o promotor AtPP2 e o gene da β-glucuronidase (GUS), juntamente com uma banana-da-terra selvagem e uma banana-da-terra transformada com o promotor AtPP2 , para comparação. Todos os brotos que emergiram foram confirmados como transgênicos. A eficiência de transformação foi determinada em média de 20%, com aproximadamente dois brotos emergindo para cada 10 raízes transformadas. As plantas transgênicas confirmadas foram transferidas para vasos maiores e cultivadas por 4-8 semanas até atingirem a fase adulta (Figura 1F).
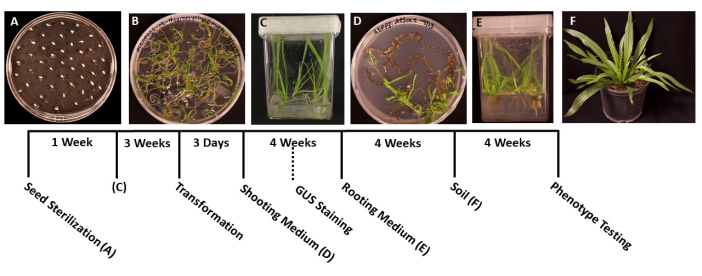
Figura 1: Linha do tempo da transformação de Plantago lanceolata . Imagens representativas de cada etapa do protocolo. (A) Sementes não germinadas plaqueadas em placa MS. (B) As sementes germinaram após 1 semana, prontas para serem transferidas para caixas magenta. (C) Plantas em caixas de MS após 3 semanas de crescimento. As raízes são verdes e saudáveis, no estágio ideal para a transformação. (D) Os brotos em meio de indução da parte aérea após 4 semanas estão prontos para serem transferidos para o meio de enraizamento. Nesta fase, a coloração histoquímica da β-glucuronidase (GUS) pode ser realizada, se aplicável. (E) Plantas em caixas com meio de indução radicular, onde as raízes se formaram após 4 semanas de crescimento. (F) As plantas transgênicas são cultivadas em toda a extensão após 4 semanas de crescimento no solo. Clique aqui para ver uma versão maior desta figura.
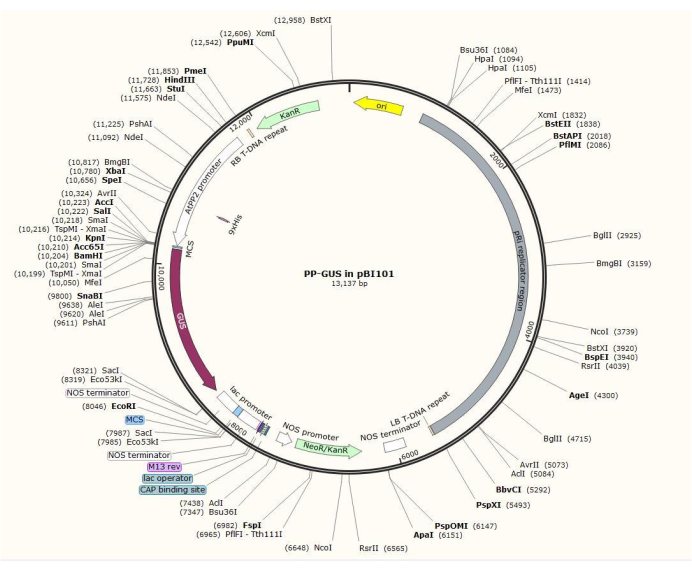
Figura 2: Diagrama do plasmídeo vetorial binário pBI101 + β-glucuronidase (GUS) com o promotor floema-específico AtPP2 inserido. Clique aqui para ver uma versão maior desta figura.
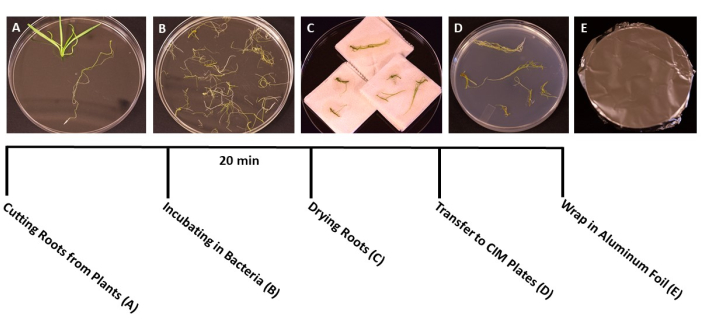
Figura 3: Etapas da transformação. Imagens representativas de cada etapa da transformação. (A) Separar raízes de brotos durante a transformação. (B) Embeber raízes em suspensão de bactérias/SS. (C) Secar as raízes em papel toalha para remover o excesso de bactérias. (D) Raízes banhadas em meio de co-cultura. (E) Placas de SS envoltas em papel alumínio. As plantas foram incubadas por 2-3 dias antes de serem transferidas para o meio de disparo. Clique aqui para ver uma versão maior desta figura.
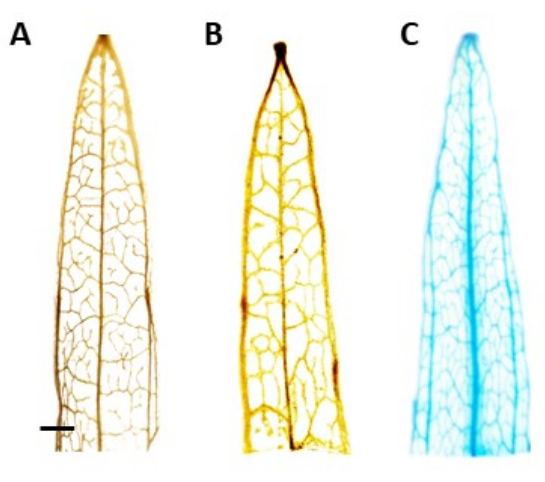
Figura 4: Coloração por GUS. Resultados da coloração pela β-glucuronidase (GUS) de segmentos foliares estreitos de bananeira. (A) Tipo selvagem. (B) Plátano de folha estreita transformado com o plasmídeo que abriga o promotor AtPP2 (vetor vazio). (C) Plátano de folha estreita transformado com o plasmídeo que abriga o promotor AtPP2 e o gene da β-glucuronidase (GUS). Cada folha foi corada pelo protocolo de coloração histoquímica por GUS e, em seguida, obtida a imagem com uma câmera microscópica. As imagens (B) e (C) não mostram padrão de coloração devido à ausência do gene GUS. A imagem à direita mostra um padrão de coloração azul claro nas nervuras, confirmando que as plantas são transgênicas. A barra representa 1 mm, com cada segmento de folha medindo aproximadamente 1 cm de comprimento. Clique aqui para ver uma versão maior desta figura.
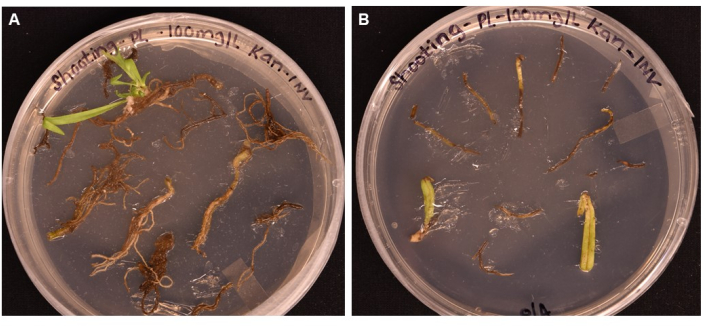
Figura 5: Comparação da eficiência de transformação de diferentes tipos de tecidos após >1 mês de incubação em meios de filmagem . (A) Tecidos radiculares após mais de 1 mês de crescimento. As raízes experimentaram calos expandidos, e as iniciais dos brotos surgiram. Calos não transformados começaram a morrer em resposta à seleção de antibióticos. (B) Tecidos foliares e pecíolos após mais de 1 mês de crescimento. Os tecidos experimentaram alguma expansão do calo, mas logo morreram em resposta ao antibiótico. Nenhum broto emergiu de nenhum dos tecidos. Clique aqui para ver uma versão maior desta figura.
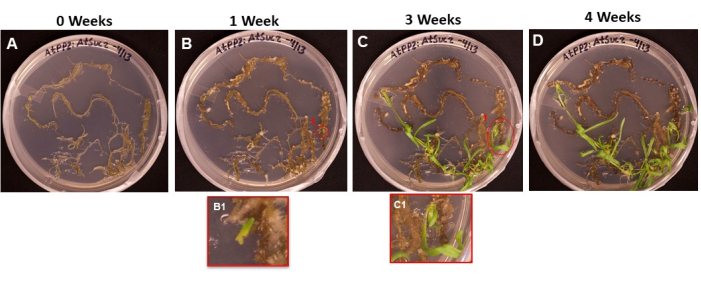
Figura 6: Emergência de calos e brotos em tecido transformado. Imagens representativas de tecidos colocados em meio de disparo após diferentes comprimentos de incubação. (A) Tecidos radiculares logo após serem plaqueados no meio de disparo. (B) Tecidos radiculares após 1 semana em meio de disparo. Observa-se expansão do calo e (B1) começam a surgir as primeiras iniciais dos brotos. (C) Tecidos radiculares após 3 semanas em meio de disparo. Mais iniciais de tiro surgiram. (C1) O tiro que emergiu do tiro B1 inicial. (D) Tecidos radiculares após 4 semanas de incubação. O tecido não transformado começou a ficar preto/marrom e morrer, e os brotos emergentes continuam a crescer. Nesta fase, os brotos estão prontos para serem movidos para o meio de enraizamento. Clique aqui para ver uma versão maior desta figura.
Tabela 1: Receitas de preparação de mídia. Uma descrição de como preparar os médiuns para a transformação. A quantidade de vitaminas adicionada é calculada com base na concentração da solução-mãe indicada. Consulte a Tabela 2 para a preparação da solução estoque de vitaminas. Para todos os meios, adicionar reagentes a 900 mL de H2O bidestilado, pH até o nível indicado, e adicionar água a um volume final de 1.000 mL. * = adicionar após a esterilização. ** = pH com 1 M KOH. = pH com NaOH 1 M. Clique aqui para baixar esta tabela.
Tabela 2: Estoques vitamínicos para os meios de Plantago . Todas as vitaminas devem ser esterilizadas por filtro e rotuladas com precisão antes do armazenamento. Quando indicado, dissolva os pós primeiro em 1 N NaOH, depois componha o volume desejado com H2O bidestilado Clique aqui para baixar esta Tabela.
Discussão
A falta de um protocolo de transformação para plantas do gênero Plantago limita o uso dessas plantas como modelos, particularmente quando os pesquisadores estão interessados em explorar as funções gênicas. P. lanceolata foi escolhida para desenvolver um protocolo de transformação genética por ser a planta mais comumente estudada de seugênero16. O protocolo que foi desenvolvido provavelmente será usado como uma ferramenta para avançar em estudos relacionados à biologia vascular, ecologia, interações planta-inseto e fisiologia do estresse abiótico.
O protocolo apresentado delineia claramente as etapas que permitem ao usuário obter plantas transgênicas. Além da capacidade de P. lanceolata prosperar em ambiente de cultura de tecidos, múltiplos fatores contribuíram para o sucesso do nosso método de transformação. Primeiramente, observou-se a importância do uso de tecido radicular vegetal estéril e de alta qualidade para a transformação. As raízes tiveram as maiores taxas de transformação quando foram retiradas de plantas com 3-4 semanas de idade, e apareceram verdes ou brancas pálidas. Raízes retiradas de caixas com qualquer quantidade de contaminação bacteriana ou fúngica muitas vezes resultavam em culturas de brotos contaminadas, e raízes mais velhas que pareciam marrons não resultavam em transformação bem-sucedida. O tecido radicular foi o tipo de tecido mais eficiente para transformação pelo método atual, uma vez que o tecido foliar e pecíolo não obteve sucesso no desenvolvimento da parte aérea.
Outra observação importante foi que o método ideal para coletar tecido radicular para transformação era colocar material radicular recém-cortado em água estéril. Essa etapa permitiu efetivamente que o material radicular permanecesse hidratado enquanto o restante do tecido era coletado, pois as raízes tendem a secar rapidamente ao serem removidas de seus recipientes de crescimento. Essa etapa também ajudou a aumentar a taxa de sucesso da transformação, pois permitiu que mais raízes fossem incubadas nas bactérias de uma só vez.
Este protocolo poderia ser modificado diminuindo para 2 dias o tempo de incubação do tecido radicular no meio de co-cultura. Observou-se que um período de incubação de 2 ou 3 dias é suficiente para permitir infecção que resulte em iniciais de brotos. No entanto, tempos de incubação mais longos não são recomendados, uma vez que foi observado que a ausência de um inibidor antibiótico na mídia frequentemente resulta em crescimento excessivo de A. tumefaciens, o que pode matar o tecido emergente.
Uma limitação deste estudo é a falta de dados disponíveis sobre o desempenho de outros métodos ou espécies de A. tumefaciens na transformação de P. lanceolata para comparação. Até onde sabemos, esse protocolo é novo. Durante os ensaios iniciais, uma alta eficiência de transformação foi observada com A. tumefaciens GV3101, e nós nos concentramos em refinar a técnica usando esta cepa em vez de experimentar com outras cepas. Nossa eficiência de transformação de 20% é relativamente alta para a transformação de plantas - muitos métodos convencionais consideram qualquer coisa >1% como bem sucedida26,27,28. Entretanto, a utilização de outra cepa de A. tumefaciens, como A. rhizogenes, conhecida por seu uso na transformação radicular em múltiplas espécies29,30,31, pode resultar em uma taxa de sucesso ainda maior. Mais experimentos seriam necessários para avaliar o impacto do uso de outras linhagens para promover maior eficiência de transformação em P. lanceolata.
A transformação bem-sucedida de P. lanceolata provavelmente beneficiará muitos campos de estudo. A alta eficiência de transformação e o rápido crescimento da planta em meios de cultura de tecidos tornam P. lanceolata uma candidata viável para estudos de função gênica15.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Este trabalho foi apoiado pela National Science Foundation (EDGE IOS-1923557 to C.Z. and Y.Z.).
Materiais
| Name | Company | Catalog Number | Comments |
| 14 mL Round Bottom TubeA4A2:A34 | ThermoFisher Scientific | 150268 | |
| 1-Naphthylacetic acid | Gold Biotechnology | N-780 | |
| 3M Micropore Surgical Paper Tape | ThermoFisher Scientific | 19-027761 | |
| 50 mL Centrifuge Tubes | Research Products International Corp. | 163227LC | |
| 600 Watt High Pressure Sodium Lights | Plantmax | PX-LU600 | |
| 6-Benzylaminopurine (6-BAP) | Gold Biotechnology | B-110 | |
| Aluminum Foil | ThermoFisher Scientific | 01-213-100 | |
| Bacto Agar | Thermofisher Scientific | 214010 | |
| Binary Plasmid pBI101 | Clontech, USA | 632522 | |
| Cool White Grow Light Sylvania LLC | Home Depot | 315952205 | |
| D-biotin | ThermoFisher Scientific | BP232-1 | |
| ddH2O | |||
| DH5a E. coli | Invitrogen, USA | 18258012 | |
| Disposable Petri Dishes, Sterile 150 x 16 mm | ThermoFisher Scientific | FB0875712 | |
| Disposable Petri Dishes, Sterile 95 x 15 mm | ThermoFisher Scientific | FB0875714G | |
| Dissecting Scissors | Leica Biosystems | 38DI12044 | |
| Ethanol 200 Proof | Decon Labs | 2705 | |
| Folic Acid | Fisher Scientific | BP2519-5 | |
| Forceps | Leica Biosystems | 38DI18031 | |
| Gelrite | Research Products International Corp. | G35020-1000 | |
| Glycerol | ThermoFisher Scientific | 17904 | |
| Glycine | Sigma | 241261 | |
| Incubated Tabletop Orbital Shaker | ThermoFisher Scientific | SHKE420HP | |
| Indole-3-Acetic Acid (IAA) | Gold Biotechnology | I-110 | |
| Indole-3-Butyric Acid (IBA) | Gold Biotechnology | I-180 | |
| Kanamycin Monosulfate | Gold Biotechnology | K-120 | |
| Macrocentrifuge | ThermoFisher Scientific | 75007210 | |
| Magenta Boxes | ThermoFisher Scientific | 50255176 | |
| Micro Pipet Tips 1000 µL | Corning | 4140 | |
| Micro Pipet Tips 200 µL | Corning | 4138 | |
| Micro Pipette Tips 10 µL | Corning | 4135 | |
| Microcentrifuge | ThermoFisher Scientific | 75002410 | |
| Micropipettor 0.5-10 µL | Corning | 4071 | |
| Micropipettor 100-1000 µL | Corning | 4075 | |
| Micropipettor 20-200 µL | Corning | 4074 | |
| Micropipettor 2-20 µL | Corning | 4072 | |
| Murashige & Skooge Basal Medium with Vitamins | PhytoTech | M519 | |
| Murashige & Skooge Basal Salt Mixture | PhytoTech | M524 | |
| myo-Inositol | Gold Biotechnology | I-25 | |
| Nicotinic acid | Sigma | N0761-100g | |
| Parafilm (paraffin film) | ThermoFisher Scientific | S37440 | |
| Potassium Hydroxide (KOH) | Research Products International Corp. | P44000 | |
| Pyridoxine HCl | Sigma | P6280-10g | |
| Scalpel Blade Handle | Leica Biosystems | 38DI36419 | |
| Scalpel Blades | Leica Biosystems | 3802181 | |
| Sodium Chloride, Crystal (NaCl) | Mallinckrodt Chemicals | 7581-06 | |
| Sodium Hydroxide (NaOH) | Research Products International Corp. | S24000 | |
| Sodium Hypochlorite | Walmart | 23263068401 | |
| Soil- Bark Mix | Berger, USA | BM7 | |
| Square Pots (3.5 inches squared) | Greenhouse Megastore | CN-TRK-1835 | |
| Sucrose | Research Products International Corp. | S24060 | |
| Thermocycler | ThermoFisher Scientific | A24811 | |
| Thiamine HCl | Sigma | T4625-5G | |
| Timentin Ticarcillin/Clavulanate (15/1) (Timentin) | Gold Biotechnology | T-104 | |
| trans-Zeatin Riboside (ZR) | Gold Biotechnology | Z-100 | |
| Tryptone | Thermofisher Scientific | 211705 | |
| Wild Type Plantago lanceolata seeds | Outsidepride Seed Source, OR, USA | F1296 | Outsidepride.com |
| Yeast Extract Granulated | Research Products International Corp. | Y20025-1000 |
Referências
- Koornneef, M., Meinke, D. The development of Arabidopsis as a model plant. The Plant Journal. 61 (6), 909-921 (2010).
- Bragg, J. N., Anderton, A., Nieu, R., Vogel, J. P. Brachypodium distachyon. Agrobacterium Protocols. , 17-33 (2015).
- Chang, C., Bowman, J. L., Meyerowitz, E. M. Field guide to plant model systems. Cell. 167 (2), 325-339 (2016).
- Müller, B., Grossniklaus, U. Model organisms-a historical perspective. Journal of Proteomics. 73 (11), 2054-2063 (2010).
- Ding, X., et al. Different fruit-specific promoters drive AtMYB12 expression to improve phenylpropanoid accumulation in tomato. Molecules. 27 (1), 317 (2022).
- Niedbała, G., Niazian, M., Sabbatini, P. Modeling agrobacterium-mediated gene transformation of tobacco (Nicotiana tabacum)-a model plant for gene transformation studies. Frontiers in Plant Science. 12, 695110 (2021).
- Kumari, D., Prasad, B., Dwivedi, P. . Genome Editing Platforms in Rice (Oryza sativa L.): Basic methodology and troubleshooting. , (2022).
- Zhang, B. Agrobacterium-mediated transformation of cotton. Transgenic Cotton. , 31-45 (2013).
- Tiwari, R., Singh, A. K., Rajam, M. V. Improved and reliable plant regeneration and Agrobacterium-mediated genetic transformation in soybean (Glycine max L). Journal of Crop Science and Biotechnology. , 1-10 (2022).
- Bakhsh, A. Development of efficient, reproducible and stable Agrobacterium-mediated genetic transformation of five potato cultivars. Food Technology and Biotechnology. 58 (1), 57-63 (2020).
- Bates, R., Craze, M., Wallington, E. J. Agrobacterium-mediated transformation of oilseed rape (Brassica napus). Current Protocols in Plant Biology. 2 (4), 287-298 (2017).
- Hopp, H. E., Spangenberg, G., Herrera-Estrella, L. Plant transformation. Frontiers in Plant Science. 13, 876671 (2022).
- Abdelmuhsin, A. A., Alghamdi, A. A., Ibrahim, N. A. Assessing the phenotypic and genotypic variations of Plantago ciliata in Ha'il region, Saudi Arabia. Entomology and Applied Science Letters. (1), 14-22 (2021).
- Coleman, N. Plantago Lanceolata. Botanical Bulletin. 1 (11), 45 (1876).
- Huang, J., et al. Tissue-specific transcriptomic profiling of Plantago major provides insights for the involvement of vasculature in phosphate deficiency responses. Molecular Genetics and Genomics. 294 (1), 159-175 (2019).
- Penczykowski, R. M., Sieg, R. D. Plantago spp. as models for studying the ecology and evolution of species interactions across environmental gradients. The American Naturalist. 198 (1), 158-176 (2021).
- Pommerrenig, B., et al. Common plantain. A collection of expressed sequence tags from vascular tissue and a simple and efficient transformation method. Plant Physiology. 142 (4), 1427-1441 (2006).
- Bergero, R., Levsen, N., Wolff, K., Charlesworth, D. Arms races with mitochondrial genome soft sweeps in a gynodioecious plant, Plantago lanceolata. Molecular Ecology. 28 (11), 2772-2785 (2019).
- Aalto, E. A., Koelewijn, H. P., Savolainen, O. Cytoplasmic male sterility contributes to hybrid incompatibility between subspecies of Arabidopsis lyrata. G3: Genes, Genomes, Genetics. 3 (10), 1727-1740 (2013).
- Bloch, K. D., Grossmann, B. Digestion of DNA with restriction endonucleases. Current Protocols in Molecular Biology. 3 (1), (1995).
- Du, C., et al. Prokaryotic expression, purification, physicochemical properties and antifungal activity analysis of phloem protein PP2-A1 from cucumber. International Journal of Biological Macromolecules. 194, 395-401 (2022).
- Deshmukh, S. 2. 2., Kulkarni, R., Bose, K. Transformation and protein expression. Textbook on Cloning, Expression and Purification of Recombinant Proteins. , 83-114 (2022).
- Bergkessel, M., Guthrie, C. Colony PCR. Methods in Enzymology. 529, 299-309 (2013).
- Broehan, G., Kroeger, T., Lorenzen, M., Merzendorfer, H. Functional analysis of the ATP-binding cassette (ABC) transporter gene family of Tribolium castaneum. BMC Genomics. 14, 6 (2013).
- Dong, Z., et al. Stable transformation of fluorescent proteins into Nosema bombycis by electroporation. Parasites & Vectors. 15 (1), 141 (2022).
- Li, S., et al. Optimization of Agrobacterium-mediated transformation in soybean. Frontiers in Plant Science. 8, 246 (2017).
- Manimaran, P., et al. Infection of early and young callus tissues of indica rice BPT 5204 enhances regeneration and transformation efficiency. Rice Science. 20 (6), 415-426 (2013).
- Wang, J., Nie, J., Pattanaik, S., Yuan, L. Efficient Agrobacterium-mediated transformation of Artemisia annua L. using young inflorescence. In Vitro Cellular & Developmental Biology-Plant. 52 (2), 204-211 (2016).
- Niazian, M., Belzile, F., Torkamaneh, D. CRISPR/Cas9 in planta hairy root transformation: a powerful platform for functional analysis of root traits in soybean. Plants. 11 (8), 1044 (2022).
- Geng, S., et al. An efficient root transformation system for CRISPR/Cas9-based analyses of shoot-root communication in cucurbit crops. Horticulture Research. 9, (2022).
- Xiao, Y., et al. Efficient Agrobacterium-mediated genetic transformation using cotyledons, hypocotyls and roots of 'Duli'(Pyrus betulifolia Bunge). Scientia Horticulturae. 296, 110906 (2022).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados