A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
قياس معدل تحلل الدهون في الأنسجة الدهنية خارج الجسم الحي والخلايا preadipocytes الأولية متمايزة في المختبر
In This Article
Summary
تحلل الدهون الثلاثية في الخلايا الشحمية هو عملية التمثيل الغذائي الهامة التي تؤدي إلى تحرير الأحماض الدهنية الحرة والجلسرين. هنا ، نقدم بروتوكولا مفصلا لقياس تحلل الدهون القاعدي والمحفز في الخلايا الشحمية والأنسجة الدهنية خارج الجسم الحي من الفئران.
Abstract
تخزن الخلايا الشحمية الطاقة في شكل دهون ثلاثية في قطرات الدهون. يمكن تعبئة هذه الطاقة عن طريق تحلل الدهون ، حيث يتم شق السلاسل الجانبية للأحماض الدهنية بالتتابع من العمود الفقري للجلسرين ، مما يؤدي إلى إطلاق الأحماض الدهنية الحرة والجلسرين. نظرا لانخفاض تعبير كيناز الجلسرين في الخلايا الشحمية البيضاء ، فإن معدلات إعادة امتصاص الجلسرين لا تكاد تذكر ، في حين أن إعادة امتصاص الأحماض الدهنية تمليها قدرة ربط الأحماض الدهنية لمكونات الوسائط مثل الألبومين. يمكن قياس كل من إطلاق الجلسرين والأحماض الدهنية في الوسائط عن طريق المقايسات اللونية لتحديد معدل تحلل الدهون. من خلال قياس هذه العوامل في نقاط زمنية متعددة ، يمكن للمرء تحديد المعدل الخطي لتحلل الدهون بثقة عالية. هنا ، نقدم بروتوكولا مفصلا لقياس تحلل الدهون في الخلايا الشحمية المتمايزة في المختبر والأنسجة الدهنية خارج الجسم الحي من الفئران. يمكن أيضا تحسين هذا البروتوكول لخطوط خلايا preadipocyte الأخرى أو الأنسجة الدهنية من الكائنات الحية الأخرى. تتم مناقشة الاعتبارات ومعلمات التحسين. تم تصميم هذا البروتوكول ليكون مفيدا في تحديد ومقارنة معدل تحلل الدهون الشحمية بين نماذج الفئران والعلاجات.
Introduction
يتم تخزين العناصر الغذائية الزائدة في الأنسجة الدهنية البيضاء في شكل الدهون الثلاثية في قلب الدهون المحايدة لقطرات الدهون. يتم تعبئة مخازن الدهون الثلاثية عن طريق تحلل الدهون ، وهي عملية يتم من خلالها شق السلاسل الجانبية للأحماض الدهنية بالتتابع بواسطة ليباز الأنسجة الدهنية الثلاثية (ATGL) ، والليباز الحساس للهرمونات (HSL) ، والليباز أحادي الجليسريد (MGL) ، مما يؤدي إلى إطلاق الأحماض الدهنية الحرة (FFAs) والعمود الفقري للجلسرين 1,2. يتم تنشيط تحلل الدهون عن طريق إشارات الكاتيكولامين في الأنسجة الدهنية. تطلق المحطات العصبية الودية محليا الكاتيكولامينات ، التي ترتبط بمستقبلات β الأدرينالية على غشاء البلازما الشحمية. عند ربط الرباط ، تعمل مستقبلات البروتين G المقترنة (GPCRs) على تنشيط سيكلاز الأدينيل عبر Gαs. يؤدي التنشيط اللاحق لبروتين كيناز A (PKA) بواسطة cAMP إلى زيادة تنظيم كل من ATGL و HSL. تتسبب فسفرة perilipin-1 بواسطة PKA في تفكك ABHD5 (المعروف أيضا باسم CGI-58) ، والذي يربط وينشط ATGL3. PKA يفسفر مباشرة HSL ، وتعزيز انتقاله من السيتوسول إلى قطرة الدهون ، حيث التفاعل مع perilipin-1 المفسفر يعزز نشاط الليباز4،5،6،7. لا يبدو أن الليباز الثالث المتورط في تحلل الدهون ، MGL ، يتم تنظيمه بواسطة إشارات الكاتيكولامين8. الأهم من ذلك ، يتم التوسط في تخليق الدهون الثلاثية في الخلايا الشحمية عن طريق مسار تخليق الدهون الجلسرين ، والذي لا ينطوي على تكوين أحادي الجليسريد كوسيط. بدلا من ذلك ، تحفز ترانسفيراز أسيل الجلسرين -3 فوسفات تكوين حمض الليسوفوسفاتيديك ، والذي يتم دمجه مع أسيل دهني آخر لتشكيل حمض الفوسفاتيديك ، ثم يتم إيزوميره إلى ثنائي الجليسريد قبل التوليف النهائي للدهون الثلاثية (الشكل 1)9،10،11.

الشكل 1: مسارات تخليق تحلل الدهون وشحوم الجليسرول. أعلى: مسار تحلل الدهون. الإنزيمات الموضحة باللون الأحمر: ليباز الأنسجة الدهنية الثلاثية (ATGL) ، الليباز الحساس للهرمونات (HSL) ، والليباز أحادي الجليسريد (MGL). أسفل: مسار تخليق الدهون الجلسرين. الإنزيمات الموضحة باللون الأخضر: ديجليسريد أسيلترانسفيراز (DGAT) ، فوسفاتيز حمض الفوسفاتيديك (PAP) ، حمض الليسوفوسفاتيديك أسيلترانسفيراز (LPAT ، المعروف أيضا باسم LPAATs) ، والجلسرين -3-فوسفات أسيلترانسفيراز (GPAT). الدهون: الدهون الثلاثية (TG) ، ثنائي الجليسريد (DG) ، أحادي الجليسريد (MG) ، الأحماض الدهنية الحرة (FFA) ، الأسيل الدهني CoA (FA-CoA) ، حمض الليسوفوسفاتيديك (LPA) ، وحمض الفوسفاتيديك (PA). المستقلبات الأخرى: الفوسفات غير العضوي (Pi) والجلسرين 3-فوسفات (G3P). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الأدينوزين خارج الخلية هو منظم مهم آخر لتحلل الدهون ، يعمل من خلال GPCRs المقترنة ب Gs و Gi للتأثير على نشاط أدينيل سيكلاز. مستقبلات الأدينوزين السائدة في الخلايا الشحمية ، ADORA1 ، تمنع سيكلاز الأدينيل ، وبالتالي تحلل الدهون من خلال تنشيط Gi12. يتم التعبير عن ADORA2A عند مستويات أقل ، وفي المقام الأول في الخلايا الشحمية البنية ، وينشط تحلل الدهون عبر إشارات Gs 13. يؤثر ADORA1 على كل من تحلل الدهون القاعدي والاستجابة للمنبهات الأدرينالية. يمكن التحكم في تأثير الأدينوزين على تحلل الدهون عن طريق إضافة أدينوزين دياميناز لتحييد الأدينوزين ، بالإضافة إلى ناهض فينيل إيزوبروبيل أدينوزين الخاص ب ADORA114,15. يمكن أن يؤثر التنشيط الهرموني ل GPCRs المقترنة ب Gq أيضا على تحلل الدهون عن طريق تنشيط الفوسفوليباز C وبروتين كيناز C16،17،18،19. تؤثر الإشارات الالتهابية أيضا على معدلات تحلل الدهون. يزيد تنشيط TLR4 بواسطة LPS (والسموم الداخلية الأخرى) من معدل تحلل الدهون عن طريق تنشيط ERK ، الذي يفسفر perilipin-1 و HSL20. ينشط TNF-α أيضا تحلل الدهون عبر تنشيط ERK و NF-κB ، بالإضافة إلى تقليل التنظيم النسخي ل phosphodiesterase PDE-3B و CIDEC21،22،23. ارتبط IL-6 أيضا بزيادة تحلل الدهون في الخلايا الشحمية ، خاصة في الأنسجة الدهنية المساريقية ، التي يؤثر إطلاقها FFA على التنكس الدهني الكبدي وتكوين الجلوكوز24،25،26.
يتم قمع تحلل الدهون أثناء حالة التغذية بواسطة الأنسولين. AKT يفسفر وينشط PDE-3B لقمع إشارات cAMP ومنع تنشيط PKA27. الأنسولين أيضا يقلل من النسخ ينظم ATGL28. تعزز السمنة مقاومة الكاتيكولامين من خلال مجموعة متنوعة من الآليات ، بما في ذلك خفض تنظيم مستقبلات β الأدرينالية في الخلايا الشحمية29،30،31،32،33. تعبر الخلايا الشحمية عن المستقبلات β الأدرينالية الثلاثة (β-1 و β-2 و β-3). بينما يتم التعبير عن المستقبلات الأدرينالية β-1 و β-2 في كل مكان ، يتم التعبير عن مستقبلات الأدرينالية β-3 في الغالب في الخلايا الشحمية في الفئران34,35. يتم تحفيز تعبير Adrb3 بواسطة C / EBPα أثناء تكوين الدهون36. يتم التعبير عن مستقبلات الأدرينالية β-3 بشكل كبير في الخلايا الشحمية الناضجة. تنشيط مستقبلات β-1 و β-2 الأدرينالية محدود ذاتيا بسبب تثبيط التغذية المرتدة بواسطة β-arrestin37. يتم تثبيط التغذية المرتدة للمستقبلات الأدرينالية β-3 بواسطة مسارات إشارات أخرى ، مما يقلل من تعبير Adrb3 33،38،39.
يمكن استخدام العديد من المركبات لتنشيط تحلل الدهون في الخلايا الشحمية. الكاتيكولامينات هي المنشطات الفسيولوجية الرئيسية لتحلل الدهون. يقوم النورإبينفرين (أو النورادرينالين) والإبينفرين (أو الأدرينالين) بتنشيط جميع مستقبلات β الأدرينالية الثلاثة40. يؤثر النورإبينفرين والإبينفرين أيضا على تحلل الدهون عن طريق تنشيط إشارات مستقبلات α الأدرينالية41. تشمل ناهضات مستقبلات β الأدرينالية شائعة الاستخدام الأيزوبروتيرينول ، وهو ناهض غير انتقائي لمستقبلات β الأدرينالية ، ومنبهات مستقبلات الأدرينالية β-3 CL-316,243 و mirabegron42. بالنظر إلى أن الخلايا الشحمية تعبر في الغالب عن مستقبلات الأدرينالية β-3 ، فإننا نستخدم CL-316,243 كمثال هنا. كما أن خصوصيته للمستقبلات الأدرينالية β-3 تجعله منشطا محددا نسبيا لإشارات الكاتيكولامين الشحمية ، والتي يمكن استخدامها أيضا بأمان في الجسم الحي. لاحظ أن التركيز الشائع الاستخدام البالغ 10 ميكرومتر CL-316,243 في زراعة الخلايا هو أوامر من حيث الحجم أعلى من جرعة ~ 0.1 ميكرومتر المطلوبة لتحقيق أقصى استجابة33. يتجاوز Forskolin مستقبلات الأدرينالية ، وينشط مباشرة سيكلاز adenylyl وإشارات تحلل الدهون النهائية. هناك العديد من المنشطات ، وكذلك مثبطات تحلل الدهون. عند اختيار مركب لتحفيز تحلل الدهون ، يجب مراعاة خصوصية المستقبلات ومسارات إشارات المصب بعناية في التصميم التجريبي.
يعد معدل تحلل الدهون في الأنسجة الدهنية البيضاء عاملا استقلابيا مهما يؤثر على تحمل البرد وتوافر المغذيات أثناء الصيام أو ممارسةالرياضة 43،44،45،46. الغرض من هذا البروتوكول هو قياس معدل تحلل الدهون في الخلايا الشحمية والأنسجة الدهنية ، مما يسهل فهم استقلاب الخلايا الشحمية وكيف يمكن أن يؤثر على النمط الظاهري الأيضي لنماذج الفئران المختلفة. لتحديد معدل تحلل الدهون ، نقيس مظهر المنتجات المحللة للدهون في الوسائط (مثل FFAs والجلسرين). تعتمد الطريقة على إطلاق منتجات تحلل الدهون من الخلايا الشحمية إلى الوسائط. نظرا لأن الخلايا الشحمية البيضاء تعبر عن مستويات منخفضة من كيناز الجلسرين ، فإن معدلات امتصاص الجلسرين منخفضة47. على العكس من ذلك ، ينبغي أيضا النظر في إنتاج FFAs والجلسرين عن طريق مسارات التمثيل الغذائي بخلاف تحلل الدهون. يبدو أن الخلايا الشحمية تعبر عن الفوسفاتيز مع نشاط ضد فوسفات الجلسرين -3 ، مما يتيح إنتاج الجلسرين من الجلسرين -3 فوسفات المشتق من الجلوكوز48،49،50. تحلل السكر هو مصدر للجلسرين -3 فوسفات المستخدم لإعادة أسترة FFA في الخلايا الشحمية البيضاء. عندما تكون مستويات الجلوكوز محدودة ، يتطلب تكوين الجليسرون مصادر 3 كربون أخرى ، مثل اللاكتات والبيروفات51. إن توجيه FFAs الصادر عن تحلل الدهون داخل الخلية ومصيرها الأيضي غير مفهوم بشكل جيد ؛ يجب تحويل FFAs المنبعثة عن تحلل الدهون إلى أسيل CoA دهني ، قبل إعادة أسترة أو الخضوع للأكسدة β. يبدو أن FFAs التي يطلقها تحلل الدهون من المحتمل أن تخرج من الخلية قبل أن يتم أخذها مرة أخرى وتحويلها إلى أسيل دهني CoA 52،53،54،55،56،57،58،59،60،61،62. يمكن عزل FFAs خارج الخلية بواسطة الألبومين. الأهم من ذلك ، من المعروف أن FFAs طويلة السلسلة تمنع تحلل الدهون إذا لم يتم عزلها بواسطة الألبومين63،64،65،66،67. وبالتالي ، فإن تحسين قدرة التخزين المؤقت FFA للوسائط أثناء مقايسة تحلل الدهون أمر بالغ الأهمية. يشبه الإجراء الموصوف هنا الطرق المنشورة سابقا لقياس معدل تحلل الدهون في الخلايا الشحمية والأنسجة الدهنية خارج الجسم الحي من الفئران والبشر15،68،69،70،71. يختلف هذا البروتوكول من خلال استخدام أخذ العينات التسلسلية. من خلال إجراء أخذ العينات التسلسلية ، يمكننا التحقق داخليا من أن تحلل الدهون يتم قياسه في الطور الخطي واستخدام قياسات متعددة لحساب معدل تحلل الدهون ، وبالتالي تقليل خطأ القياس لزيادة الثقة في القيمة النهائية المحسوبة. عيب أخذ العينات التسلسلية هو أن الفحص يتطلب المزيد من الوقت والكواشف. ومع ذلك ، فإن الإطار الزمني الأطول يقلل من تأثير خطأ القياس على الخطأ المعياري لتقديرات المعدل. بالإضافة إلى ذلك ، يقيس هذا البروتوكول كلا من FFA وإطلاق الجلسرين ، ويأخذ في الاعتبار نسبة FFA: إطلاق الجلسرين بهدف تحقيق نسبة 3: 1 ، كما هو متوقع من تحلل الدهون الكامل وإطلاق المنتجات المحللة للدهون في الوسائط72.
Protocol
تمت الموافقة على استخدام جميع الحيوانات من قبل اللجنة المؤسسية لرعاية واستخدام الحيوانات (IACUC) في كلية طب وايل كورنيل بجامعة كورنيل.
1. إعداد المخازن المؤقتة ولوحات التجميع
- اصنع 5٪ من ألبومين مصل الأبقار (BSA) عن طريق إذابة 5 جم من BSA في 100 مل من وسط النسر المعدل من Dulbecco (DMEM) بدون الفينول الأحمر. حرك BSA برفق ليذوب (الاهتزاز يؤدي إلى نتائج عكسية). بمجرد إذابة BSA بالكامل ، قم بتعقيم الوسائط بمرشح 0.2 ميكرومتر. قم بتخزين وسائط BSA في درجة حرارة 4 درجة مئوية لمدة تصل إلى 1 شهر.
- جعل تركيزات العمل من وسائط التحكم والتحفيز. وسائط التحكم: وسائط BSA بنسبة 5٪ مع التحكم في السيارة. وسائط التحفيز: وسائط BSA بنسبة 5٪ مع 0.5 ميكرومتر CL-316,243. اصنع وسائط تحفيز جديدة لكل تجربة.
- قم بتسخين الوسائط لاستخدامها حتى 37 درجة مئوية. قم بتسمية لوحة 96 بئرا لجمع الوسائط.
2. إعداد عينة
- إجراء زراعة الخلايا كما هو موضح أدناه. قم بجميع أعمال الخلية في غطاء دخان معقم لتقليل التلوث الخارجي.
- عزل وتمييز الخلايا الأولية preadipocytes ، كما هو الحال في73,74.
- صفيحة الخلايا الأولية الأولية بكثافة عالية ، مثل 1 × 105 خلايا / بئر في صفيحة 24 بئرا في 1 مل / وسط استزراع جيد (15٪ مصل بقري جنيني (FBS) و 1x بنسلين-ستربتومايسين-جلوتامين في DMEM / F12).
- بعد أن تصل الخلايا إلى التقاء 100٪ ، تمايز مع 5 ميكرومتر ديكساميثازون ، 0.5 مللي متر 3-إيزوبوتيل -1-ميثيل زانثين ، 1 ميكروغرام / مل أنسولين ، و 1 ميكرومتر ثيازوليدينيديون (TZD) في وسط الثقافة لمدة 3 أيام. بعد ذلك ، قم بالتغيير إلى وسائط الاستزراع باستخدام 1 ميكروغرام / مل من الأنسولين لمدة 3 أيام على الأقل لتنمو قطرات الدهون. استخدم 1 مل / بئر من الوسائط في لوحة 24 بئرا.
- تغيير وسط الاستزراع (1 مل / بئر) مع الأنسولين كل 2 أو 3 أيام. يمكن الحفاظ على الخلايا في وسائل الإعلام مع الأنسولين لمدة تصل إلى 2 أسابيع. استخدم فقط الثقافات التي تزيد فيها معدلات التمايز عن 90٪ وتكون متشابهة عبر المجموعات لهذا الفحص ، حيث يمكن إساءة تفسير التمايز المنخفض على أنه انخفاض في معدل تحلل الدهون.
- استزراع الخلايا في وسائط خالية من الأنسولين لمدة 24 ساعة قبل قياس تحلل الدهون.
ملاحظة: يحافظ الأنسولين الموجود في الوسائط على قطرات الدهون ، ولكنه يمنع أيضا تحلل الدهون. الحضانة بدون الأنسولين لمدة 24 ساعة تسمح بالتنشيط الكامل للدهون دون فقدان حجم قطرات الدهون. في بعض الأنظمة ، قد يحتاج وقت المزرعة بدون الأنسولين إلى تقصير أو تمديد.
- اغسل الخلايا باستخدام DPBS مرة واحدة لإزالة المصل المتبقي من وسائط الاستزراع.
ملاحظة: لا يشمل هذا البروتوكول تجويع المصل ، والذي يمكن أن ينشط تحلل الدهون. يمكن استخدام تجويع المصل وفقا لتقدير الباحث.
- عزل وتمييز الخلايا الأولية preadipocytes ، كما هو الحال في73,74.
- أداء ثقافة خارج الجسم الحي كما هو موضح أدناه.
- قم بإعداد صفيحة من 6 آبار ، مع بئر واحد لكل نسيج يتم جمعه من كل فأر. ضع 4 مل من DMEM بدرجة حرارة الغرفة في كل بئر لاستخدامها.
ملاحظة: BSA في وسائط المجموعة ليست ضرورية. - قم بإعداد لوحة من 48 بئرا لمقايسة تحلل الدهون ، مع بئر واحد لكل نسخة مكررة. ضع 400 ميكرولتر من DMEM بدرجة حرارة الغرفة في كل بئر لاستخدامها. استخدم اثنين إلى أربعة عناصر تحكم واثنين إلى أربعة آبار محفزة لكل نسيج لكل فأر.
- القتل الرحيم للفأر عن طريق خلع عنق الرحم تحت التخدير ، مع طريقة ثانوية مثل استرواح الصدر الثنائي. هنا ، استخدمنا فأرة C57BL / 6J تبلغ من العمر 32 جراما ، تبلغ من العمر 7 أشهر ، تتغذى على نظام غذائي عالي الدهون بنسبة 45٪ لمدة 4 أشهر.
ملاحظة: يمكن أيضا استخدام هذا البروتوكول للذكور ، بالإضافة إلى السلالات الأخرى والوجبات الغذائية والأعمار. - رش بالإيثانول بنسبة 70٪ واستخدم المقص لعمل شق جانبي صغير (~ 1 سم) في وسط جلد البطن ، واسحب الجلد بعيدا عن طريق الضغط على أي من الجانبين بالإبهام والسبابة وقم بطي جلد أسفل البطن للكشف عن المستودعات الخلفية تحت الجلد. حدد موقع العقدة الليمفاوية الأربية وأزلها وقم بتشريح الأنسجة الدهنية الأربية مباشرة خلف العقدة الليمفاوية الأربية باستخدام الملقط.
- لجمع الأنسجة الدهنية للغدد التناسلية ، قم بعمل شق جانبي وعمودي في الصفاق للوصول إلى التجويف البريتوني. امسك وسادة الدهون في الغدد التناسلية بملاقط واقطعها على طول الرحم (أو البربخ للذكور) لإزالة الأنسجة الدهنية للغدد التناسلية. ضع المستودعات المجمعة في طبق من 6 آبار.
- أخرج المنديل من البئر ، وضعه على حصيرة سيليكون ، وقطع إلى قطع من 5 إلى 7 ملغ بالمقص.
- قم بوزن 25 إلى 30 مجم (خمس أو ست قطع) لكل فحص جيد وضعه في لوحة فحص 48 بئرا. امسح المنديل على منشفة نظيفة قبل وزنها لإزالة أي وسائط. قم بوزن قارب الوزن بعد إزالة الأنسجة وسجل وزن أي بقايا متبقية. امسح قارب الوزن نظيفا بين العينات وأعد تنظيفه إذا لزم الأمر. استخدم قارب وزن جديد لكل منديل.
- بمجرد وزن جميع عينات الأنسجة ، ضع لوحة فحص 48 بئرا في حاضنة 37 درجة مئوية ، 10٪ CO2 لمدة 15 دقيقة.
- قم بإعداد صفيحة من 6 آبار ، مع بئر واحد لكل نسيج يتم جمعه من كل فأر. ضع 4 مل من DMEM بدرجة حرارة الغرفة في كل بئر لاستخدامها.
3. مقايسة تحلل الدهون
- أداء جمع الوسائط. القيام بنقل الوسائط وجمع العينات لاحقا في غطاء دخان معقم لتقليل التلوث المحتمل من المصادر الخارجية.
- عند t = 0 ، قم بإزالة الوسائط وإضافة 400 ميكرولتر لكل بئر من وسائط التحكم أو التحفيز ، ووضع فحص اللوحة في حاضنة CO2 37 درجة مئوية ، 10٪. لزراعة الأنسجة خارج الجسم الحي ، قم بإزالة الوسائط بعناية باستخدام ماصة ؛ لا ينبغي أبدا استخدام الشفط.
ملاحظة: بدلا من ذلك ، قم بإعداد لوحة ثانية مع وسائط التحكم والتحفيز ، ونقل الأنسجة. - عند t = 1 و 2 و 3 و 4 ساعات ، اجمع 200 ميكرولتر من الوسائط ، واستبدلها ب 200 ميكرولتر من وسائط التحكم أو التحفيز المناسبة ، وأعد لوحة الفحص إلى الحاضنة. قم بتخزين لوحة التجميع في درجة حرارة 4 درجات مئوية. لتحديد سعة التخزين المؤقت FFA لوسائط BSA ، استخدم مجموعة إضافية عند 24 ساعة.
ملاحظة: يمكن إيقاف التجارب هنا ، ويمكن تخزين الوسائط المجمعة عند -20 درجة مئوية.
- عند t = 0 ، قم بإزالة الوسائط وإضافة 400 ميكرولتر لكل بئر من وسائط التحكم أو التحفيز ، ووضع فحص اللوحة في حاضنة CO2 37 درجة مئوية ، 10٪. لزراعة الأنسجة خارج الجسم الحي ، قم بإزالة الوسائط بعناية باستخدام ماصة ؛ لا ينبغي أبدا استخدام الشفط.
4. مقايسة القياس اللوني FFA
- قم بتسخين الكواشف إلى درجة حرارة الغرفة وقم بإذابة زجاجة واحدة من الكاشف الملون A بزجاجة واحدة من المذيب A ، وزجاجة واحدة من الكاشف الملون B مع زجاجة واحدة من المذيب B. من تاريخ إعادة التكوين ، من الأفضل استخدام هذه الكواشف في غضون 1 أسبوع. تجاهل 1 شهر بعد إعادة التكوين.
- ذوبان وخلط العينات.
- إنشاء منحنى قياسي FFA. الحل القياسي هو 1 مللي مول. استخدم الحجم التالي مع الكواشف للمنحنى القياسي: 25 ميكرولتر ، 20 ميكرولتر ، 15 ميكرولتر ، 10 ميكرولتر ، 10 ميكرولتر (تخفيف 1: 2) ، 10 ميكرولتر (تخفيف 1: 4) ، 10 ميكرولتر (تخفيف 1: 8) ، و 10 ميكرولتر ماء لأقصى نطاق. بالنسبة لمستويات FFA المنخفضة ، قد يكون معيار 10 ميكرولتر من 1 mM و 0.8 mM و 0.6 mM و 0.4 mM و 0.2 mM و 0.1 mM و 0.05 mM أكثر قابلية للتطبيق.
- معايير وعينات ماصة في لوحة فحص 96 بئرا. حجم العينة الموصى به هو 10 ميكرولتر. قم بتضمين ثلاثة آبار بنفس حجم وسائط BSA مثل عينات تصحيح الخلفية.
ملاحظة: إذا كانت تركيزات العينة تقع خارج نطاق المنحنى القياسي ، كرر الفحص ، واضبط حجم العينة إلى 2-25 ميكرولتر. - أضف 150 ميكرولتر من الكاشف A إلى كل بئر واخلطها. تجنب توليد الفقاعات. فرقع أي فقاعات بإبرة قياس دقيقة. احتضان لوحة الفحص على حرارة 37 درجة مئوية لمدة 5 دقائق.
- اقرأ امتصاص اللوحة عند 550 نانومتر ومرجع 660 نانومتر (القراءة أ).
- أضف 75 ميكرولتر من الكاشف B إلى كل بئر واخلطها. تجنب توليد الفقاعات. فرقع أي فقاعات بإبرة قياس دقيقة. احتضان لوحة الفحص على حرارة 37 درجة مئوية لمدة 5 دقائق.
- اقرأ امتصاص اللوحة مرة أخرى عند 550 نانومتر ومرجع 660 نانومتر (القراءة ب).
5. مقايسة الجلسرين اللوني
- أعد تكوين كاشف الجلسرين الحر ب 36 مل من الماء عالي النقاء وتأقلم مع درجة حرارة الغرفة. من الأفضل استخدام هذه الكواشف في غضون أسابيع قليلة. تجاهل 2 أشهر بعد إعادة التكوين.
- ذوبان وخلط العينات.
- قم بإنشاء منحنى قياسي للجلسرين عن طريق عمل تخفيف تسلسلي من سبع نقاط ، 2 أضعاف من محلول الجلسرين القياسي وفراغ مائي.
ملاحظة: المنحنى القياسي خطي نسبيا يصل إلى 25 ميكرولتر من 2.8 مللي متر من الجلسرين ، ولكنه ليس خطيا بتركيزات أعلى. - ماصة 25 ميكرولتر لكل من المعايير والعينات في لوحة فحص 96 بئرا. قم بتضمين ثلاثة آبار مع وسائط BSA لتصحيح الخلفية.
- أضف 175 ميكرولتر من كاشف الجلسرين الحر إلى كل بئر واخلطها. تجنب توليد الفقاعات. فرقع أي فقاعات بإبرة قياس دقيقة. احتضان لوحة الفحص على حرارة 37 درجة مئوية لمدة 5 دقائق.
- اقرأ امتصاص اللوحة عند 540 نانومتر.
6. حساب معدل تحلل الدهون
- ابدأ بقيم الكثافة الضوئية (OD). بالنسبة للجلسرين ، استخدم قيم A540 OD مباشرة. احسب OD لمقايسة FFA وفقا للصيغة التالية:
OD = (القراءة ب: أ 550 - أ 660) - (القراءة أ: أ550 - أ 660) - استخدم المنحنى القياسي لحساب مستويات FFA والجلسرين في العينات التي تم جمعها. ارسم قيم OD القياسية على المحور ص ، وعلى المحور السيني ، استخدم التركيزات القياسية بالنسبة لحجم العينة (أي أن تركيز الآبار مع 20 ميكرولتر من معيار 1 mM FFA على لوحة بها عينات 10 ميكرولتر يساوي 2 mM). ملاءمة خط اتجاه خطي:
ص = م س + ب - افحص بصريا المنحنى القياسي وقم بإزالة أي نقاط خارج النطاق الخطي للفحص. احسب تركيزات العينة باستخدام المعادلة:
تركيز العينة: س = (OD - ب) ÷ م - ضبط وإعادة فحص العينات التي تقع خارج نطاق الفحص الخطي. للحصول على تركيز العينة النهائي ، اطرح تركيز آبار الخلفية التي تحتوي على وسائط BSA فقط من تركيز العينات.
- احسب مولات FFA والجلسرين التي تنتجها كل عينة في كل نقطة زمنية ، وفقا للصيغة:
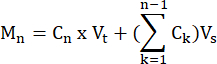
حيث C n = التركيز في الوقت t = n ؛ Vt = الحجم الكلي في البئر ؛ Vs = حجم جمع العينات ؛ و M n = مولات منتجة في الوقت t = n (عندما تكون التركيزات في mM والأحجام في mL ، يكون الناتج μMol).
على سبيل المثال ، في نقاط زمنية مختلفة:
م 1 = ج1 × فولتر
م 4 = ج4 × فولتر + (ج1 + ج2+ ج3) فولتثانية
أو
م 4 =ج 4 × فولتر + ج3 × فولت ثانية + ج2 × فولتثانية + ج1 × فولتثانية - تطبيع وزن الأنسجة بالقسمة على وزن الأنسجة لكل عينة بالجرام للحصول على وحدات ميكرومول / جم. بالنسبة للخلايا المستزرعة ، يتم تقديم القيم على شكل ميكرومول / بئر. تأكد من أن رقم الخلية وكفاءة التمايز قابلة للمقارنة من بئر إلى بئر.
ملاحظة: الاختلافات في كفاءة الانتشار أو التمايز ستعقد تفسير النتائج وتتطلب طريقة أخرى للتطبيع (على سبيل المثال، التطبيع مع البروتين؛ انظر المناقشة). - احسب ميل الميكرومول / جم المنتج (المحور الصادي) مقابل الوقت (المحور السيني) لكل عينة على حدة.
- في جدول البيانات ، يمكن القيام بذلك باستخدام الدالة = SLOPE (known_ys,known_xs). في خلية جديدة ، اكتب "= SLOPE" (ثم استخدم المؤشر لتمييز قيم عينة الجلسرين أو FFA بالميكرومول / جم ، ثم لتمييز قيم الوقت المقابلة).
- تحقق من خطية البيانات. قيم R2 هي طريقة سريعة لتحديد خطية العينات. في جدول البيانات ، يمكن القيام بذلك باستخدام الدالة = RSQ (known_ys,known_xs) ، بنفس الطريقة الموضحة في الخطوة 6.7.1 ، ولكن الإدخال الأولي هو = RSQ. تأكد من أن قيم R2 > 0.98 ؛ تشير القيم المنخفضة إلى الانحراف عن الخطية. يمكن أن ينتج هذا عن خطأ في القياس / أخذ العينات أو فقدان الخطية.
- هناك طريقة أخرى لاختبار الخطية وهي إجراء انحدار خطي لكل عينة ورسم البقايا. في برنامج التحليل الإحصائي ، قم بإنشاء جدول XY بقيمة Y واحدة لكل نقطة زمنية. حدد تحليل > الانحدار الخطي البسيط وحدد المربع الخاص بالمؤامرة المتبقية قبل الضغط على موافق. ستظهر المؤامرة المتبقية كرسم بياني جديد.
- استخدم FFA ومعدل إنتاج الجلسرين (أي المنحدر [(μmol / g / h]) لكل عينة كنقطة بيانات فردية لإجراء التحليل الإحصائي ، ورسم القيم إذا تمت مقارنة ظروف تحلل الدهون المختلفة. إذا تمت مقارنة معدلات تحلل الدهون عبر الأنماط الجينية ، فاستخدم عينتين أو ثلاث عينات لكل كتكرارات تقنية ، واستخدم المتوسط لنقطة بيانات واحدة لكل ، بحيث يكون حجم العينة مساويا لعدد الحيوانات.
النتائج
قمنا بقياس معدل تحلل الدهون القاعدي والمحفز للخلايا الشحمية المتمايزة في المختبر. تم تمييز الخلايا preadipocytes الأولية من الأنسجة الدهنية البيضاء الأربية إلى الخلايا الشحمية عن طريق علاج الخلايا المتقاربة مع 5 ميكرومتر ديكساميثازون ، 0.5 mM IBMX ، 1 ميكروغرام / مل الأنسولين ، و 1 ميكرومتر تروغ...
Discussion
هنا ، نقدم بروتوكولا أساسيا لقياس معدل تحلل الدهون في الخلايا الشحمية والأنسجة الدهنية خارج الجسم الحي . لتحديد تحلل الدهون ، من المهم قياس معدل تحلل الدهون في المرحلة الخطية. نحن نستخدم تقنية أخذ العينات التسلسلية ، حيث يتم جمع جزء كبير من الوسائط واستبدالها بوسائط جديدة على فترات م?...
Disclosures
ليس لدى المؤلفين ما يكشفون عنه.
Acknowledgements
تم دعم هذا العمل من قبل المعاهد الوطنية الأمريكية للصحة منحة R01DK126944 إلى SMR
Materials
| Name | Company | Catalog Number | Comments |
| 24-Well tissue culture treated plate | Corning Inc | 3527 | Must be tissue culture treated for adipocyte differntiation |
| 48-Well flat bottom plate with lid | Corning Inc | 353078 | Can be tissue culture treated |
| 6-Well flat bottom plate with lid | Corning Inc | 353046 | Can be tissue culture treated |
| 96-Well PCR Plate | USA sceintific | 1402-9100 | Any conical 0.2 mL PCR plate will be convenient |
| Bovine Serum Albumin | Sigma Aldrich | A9418 | FFA free BSA such as A8806, is also commonly used. The BSA should not have detectable FFA, also lot to lot variations in BSA can impact the observed rate of lipolysis |
| CL-316,243 | Sigma Aldrich | C5976 | CAS #: 138908-40-4 availaible from other suppliers |
| CO2 incubator | PHCBI | MCO-170AICUVH | CO2 should ideally be set to 10% for adipose tissue, however 5% CO2 will also work |
| DMEM, low glucose, no phenol red | Thermofischer | 11054020 | Any phenol red free media should work, DMEM/F12, RPMI, but should contain volatile buffering capacity, i.e. biocarbonate |
| FFA-free Bovine serum albumin | Equitech-Bio, Inc, | BAH66 | |
| Free Glycerol Reagent | Sigma Aldrich | F6428 | |
| Glycerol Standard Solution | Sigma Aldrich | G7793 | This can also be made by diluting glycerol to the desired concentration |
| HR Series NEFA Standard Solution | Fujifilm | 276-76491 | |
| HR Series NEFA-HR (2) Color Reagent A | Fujifilm | 999-34691 | |
| HR Series NEFA-HR (2) Color Reagent B | Fujifilm | 991-34891 | |
| HR Series NEFA-HR (2) Solvent A | Fujifilm | 995-34791 | |
| HR Series NEFA-HR (2) Solvent B | Fujifilm | 993-35191 | |
| Microbiological Incubator | Fischer Scientific | S28668 | Any incubator at 37C can be used |
| Nunc MicroWell 96-Well Plates | Thermo Scientific | 269620 | Any optically clear, flat bottom 96-well plate works |
| Silicone Laboratory Benchtop Mat | VWR | 76045-300 | Glass plate can also be used. Absorbant surfaces are not recommended |
| Spectrophotometer/Microplate Reader | Molecular devices | SpectraMax i3x | Any plate reader that can read at 540, 550 and 660 mm will work |
| V Bovine serum albumin | Sigma-Aldrich | 810531 | |
| WypAll X70 Wipers | Kimberly-Clark | 41200 | Any high quality paper towel will work |
References
- Vaughan, M., Berger, J. E., Steinberg, D. Hormone-sensitive lipase and monoglyceride lipase activities in adipose tissue. The Journal of Biological Chemistry. 239, 401-409 (1964).
- Zimmermann, R., et al. Fat mobilization in adipose tissue is promoted by adipose triglyceride lipase. Science. 306 (5700), 1383-1386 (2004).
- Lass, A., et al. Adipose triglyceride lipase-mediated lipolysis of cellular fat stores is activated by CGI-58 and defective in Chanarin-Dorfman syndrome. Cell Metabolism. 3 (5), 309-319 (2006).
- Stralfors, P., Bjorgell, P., Belfrage, P. Hormonal regulation of hormone-sensitive lipase in intact adipocytes: identification of phosphorylated sites and effects on the phosphorylation by lipolytic hormones and insulin. Proceedings of the National Academy of Sciences. 81 (11), 3317-3321 (1984).
- Miyoshi, H., et al. Perilipin promotes hormone-sensitive lipase-mediated adipocyte lipolysis via phosphorylation-dependent and -independent mechanisms. The Journal of Biological Chemistry. 281 (23), 15837-15844 (2006).
- Sztalryd, C., et al. Perilipin A is essential for the translocation of hormone-sensitive lipase during lipolytic activation. The Journal of Cell Biology. 161 (6), 1093-1103 (2003).
- Lafontan, M., Langin, D. Lipolysis and lipid mobilization in human adipose tissue. Progress in Lipid Research. 48 (5), 275-297 (2009).
- Grabner, G. F., Xie, H., Schweiger, M., Zechner, R. Lipolysis: cellular mechanisms for lipid mobilization from fat stores. Nature Metabolism. 3 (11), 1445-1465 (2021).
- Weiss, S. B., Kennedy, E. P., Kiyasu, J. Y. The enzymatic synthesis of triglycerides. The Journal of Biological Chemistry. 235, 40-44 (1960).
- Kennedy, E. P. Biosynthesis of complex lipids. Federation Proceedings. 20, 934-940 (1961).
- Wendel, A. A., Lewin, T. M., Coleman, R. A. Glycerol-3-phosphate acyltransferases: rate limiting enzymes of triacylglycerol biosynthesis. Biochimica et Biophysica Acta. 1791 (6), 501-506 (2009).
- Johansson, S. M., Lindgren, E., Yang, J. N., Herling, A. W., Fredholm, B. B. Adenosine A1 receptors regulate lipolysis and lipogenesis in mouse adipose tissue-interactions with insulin. European Journal of Pharmacology. 597 (1-3), 92-101 (2008).
- Gnad, T., et al. Adenosine activates brown adipose tissue and recruits beige adipocytes via A2A receptors. Nature. 516 (7531), 395-399 (2014).
- Fried, S. K., et al. Resistance to the antilipolytic effect of insulin in adipocytes of African-American compared to Caucasian postmenopausal women. Journal of Lipid Research. 51 (5), 1193-1200 (2010).
- Lee, M. J., Fried, S. K. Optimal protocol for the differentiation and metabolic analysis of human adipose stromal cells. Methods in Enzymology. 538, 49-65 (2014).
- Fricke, K., Heitland, A., Maronde, E. Cooperative activation of lipolysis by protein kinase A and protein kinase C pathways in 3T3-L1 adipocytes. Endocrinology. 145 (11), 4940-4947 (2004).
- Bergan, H. E., Kittilson, J. D., Sheridan, M. A. PKC and ERK mediate GH-stimulated lipolysis. Journal of Molecular Endocrinology. 51 (2), 213-224 (2013).
- Schmitz-Peiffer, C. The tail wagging the dog--regulation of lipid metabolism by protein kinase C. The FEBS Journal. 280 (21), 5371-5383 (2013).
- Carmen, G. Y., Victor, S. M. Signalling mechanisms regulating lipolysis. Cellular Signalling. 18 (4), 401-408 (2006).
- Zu, L., et al. Bacterial endotoxin stimulates adipose lipolysis via toll-like receptor 4 and extracellular signal-regulated kinase pathway. The Journal of Biological Chemistry. 284 (9), 5915-5926 (2009).
- Zhang, H. H., Halbleib, M., Ahmad, F., Manganiello, V. C., Greenberg, A. S. Tumor necrosis factor-alpha stimulates lipolysis in differentiated human adipocytes through activation of extracellular signal-related kinase and elevation of intracellular cAMP. Diabetes. 51 (10), 2929-2935 (2002).
- Tan, X., et al. TNF-α downregulates CIDEC via MEK/ERK pathway in human adipocytes. Obesity. 24 (5), 1070-1080 (2016).
- Laurencikiene, J., et al. NF-kappaB is important for TNF-alpha-induced lipolysis in human adipocytes. Journal of Lipid Research. 48 (5), 1069-1077 (2007).
- van Hall, G., et al. Interleukin-6 stimulates lipolysis and fat oxidation in humans. The Journal of Clinical Endocrinology and Metabolism. 88 (7), 3005-3010 (2003).
- Wueest, S., et al. Mesenteric fat lipolysis mediates obesity-associated hepatic steatosis and insulin resistance. Diabetes. 65 (1), 140-148 (2016).
- Trujillo, M. E., et al. Interleukin-6 regulates human adipose tissue lipid metabolism and leptin production in vitro. The Journal of Clinical Endocrinology and Metabolism. 89 (11), 5577-5582 (2004).
- Kitamura, T., et al. Insulin-induced phosphorylation and activation of cyclic nucleotide phosphodiesterase 3B by the serine-threonine kinase Akt. Molecular and Cellular Biology. 19 (9), 6286-6296 (1999).
- Chakrabarti, P., et al. Insulin inhibits lipolysis in adipocytes via the evolutionarily conserved mTORC1-Egr1-ATGL-mediated pathway. Molecular and Cellular Biology. 33 (18), 3659-3666 (2013).
- Collins, S., Daniel, K. W., Petro, A. E., Surwit, R. S. Strain-specific response to beta 3-adrenergic receptor agonist treatment of diet-induced obesity in mice. Endocrinology. 138 (1), 405-413 (1997).
- Surwit, R. S., Dixon, T. M., Petro, A. E., Daniel, K. W., Collins, S. Diazoxide restores beta3-adrenergic receptor function in diet-induced obesity and diabetes. Endocrinology. 141 (10), 3630-3637 (2000).
- Gettys, T. W., et al. Age-dependent changes in beta-adrenergic receptor subtypes and adenylyl cyclase activation in adipocytes from Fischer 344 rats. Endocrinology. 136 (5), 2022-2032 (1995).
- Mowers, J., et al. Inflammation produces catecholamine resistance in obesity via activation of PDE3B by the protein kinases IKKε and TBK1. eLife. 2, e01119 (2013).
- Valentine, J. M., et al. β3-Adrenergic receptor downregulation leads to adipocyte catecholamine resistance in obesity. The Journal of Clinical Investigation. 132 (2), e153357 (2022).
- Collins, S., et al. Impaired expression and functional activity of the beta 3- and beta 1-adrenergic receptors in adipose tissue of congenitally obese (C57BL/6J ob/ob) mice. Molecular Endocrinology. 8 (4), 518-527 (1994).
- Collins, S., Surwit, R. S. The beta-adrenergic receptors and the control of adipose tissue metabolism and thermogenesis. Recent Progress in Hormone Research. 56, 309-328 (2001).
- Dixon, T. M., Daniel, K. W., Farmer, S. R., Collins, S. CCAAT/enhancer-binding protein alpha is required for transcription of the beta 3-adrenergic receptor gene during adipogenesis. The Journal of Biological Chemistry. 276 (1), 722-728 (2001).
- Lohse, M. J., Benovic, J. L., Codina, J., Caron, M. G., Lefkowitz, R. J. beta-Arrestin: a protein that regulates beta-adrenergic receptor function. Science. 248 (4962), 1547-1550 (1990).
- Nantel, F., et al. The human beta 3-adrenergic receptor is resistant to short term agonist-promoted desensitization. Molecular Pharmacology. 43 (4), 548-555 (1993).
- Liggett, S. B., Freedman, N. J., Schwinn, D. A., Lefkowitz, R. J. Structural basis for receptor subtype-specific regulation revealed by a chimeric beta 3/beta 2-adrenergic receptor. Proceedings of the National Academy of Sciences. 90 (8), 3665-3669 (1993).
- Baker, J. G. The selectivity of beta-adrenoceptor agonists at human beta1-, beta2- and beta3-adrenoceptors. British Journal of Pharmacology. 160 (5), 1048-1061 (2010).
- Lafontan, M. Inhibition of epinephrine-induced lipolysis in isolated white adipocytes of aging rabbits by increased alpha-adrenergic responsiveness. Journal of Lipid Research. 20 (2), 208-216 (1979).
- Baker, J. G. The selectivity of beta-adrenoceptor antagonists at the human beta1, beta2 and beta3 adrenoceptors. British Journal of Pharmacology. 144 (3), 317-322 (2005).
- Jensen, M. D., Nielsen, S. Insulin dose response analysis of free fatty acid kinetics. Metabolism. 56 (1), 68-76 (2007).
- Jensen, M. D., Haymond, M. W., Gerich, J. E., Cryer, P. E., Miles, J. M. Lipolysis during fasting. Decreased suppression by insulin and increased stimulation by epinephrine. The Journal of Clinical Investigation. 79 (1), 207-213 (1987).
- Heckmann, B. L., et al. Defective adipose lipolysis and altered global energy metabolism in mice with adipose overexpression of the lipolytic inhibitor G0/G1 switch gene 2 (G0S2). The Journal of Biological Chemistry. 289 (4), 1905-1916 (2014).
- Shin, H., et al. Lipolysis in brown adipocytes is not essential for cold-induced thermogenesis in mice. Cell Metabolism. 26 (5), 764.e5-777.e5 (2017).
- Treble, D. H., Mayer, J. Glycerolkinase activity in white adipose tissue of obese-hyperglycaemic mice. Nature. 200, 363-364 (1963).
- Possik, E., et al. New mammalian glycerol-3-phosphate phosphatase: role in beta-cell, liver and adipocyte metabolism. Frontiers in Endocrinology. 12, 706607 (2021).
- Romero Mdel, M., Sabater, D., Fernandez-Lopez, J. A., Remesar, X., Alemany, M. Glycerol production from glucose and fructose by 3T3-L1 cells: a mechanism of adipocyte defense from excess substrate. PLoS One. 10 (10), e0139502 (2015).
- Mugabo, Y., et al. Identification of a mammalian glycerol-3-phosphate phosphatase: Role in metabolism and signaling in pancreatic beta-cells and hepatocytes. Proceedings of the National Academy of Sciences. 113 (4), E430-E439 (2016).
- Hanson, R. W., Reshef, L. Glyceroneogenesis revisited. Biochimie. 85 (12), 1199-1205 (2003).
- Vaughan, M. The production and release of glycerol by adipose tissue incubated in vitro. The Journal of Biological Chemistry. 237, 3354-3358 (1962).
- Jensen, M. D., Ekberg, K., Landau, B. R. Lipid metabolism during fasting. American Journal of Physiology-Endocrinology and Metabolism. 281 (4), E789-E793 (2001).
- Ballard, F. J., Hanson, R. W., Leveille, G. A. Phosphoenolpyruvate carboxykinase and the synthesis of glyceride-glycerol from pyruvate in adipose tissue. The Journal of Biological Chemistry. 242 (11), 2746-2750 (1967).
- Reshef, L., Hanson, R. W., Ballard, F. J. A possible physiological role for glyceroneogenesis in rat adipose tissue. The Journal of Biological Chemistry. 245 (22), 5979-5984 (1970).
- Gorin, E., Tal-Or, Z., Shafrir, E. Glyceroneogenesis in adipose tissue of fasted, diabetic and triamcinolone treated rats. European Journal of Biochemistry. 8 (3), 370-375 (1969).
- Elia, M., Zed, C., Neale, G., Livesey, G. The energy cost of triglyceride-fatty acid recycling in nonobese subjects after an overnight fast and four days of starvation. Metabolism. 36 (3), 251-255 (1987).
- Reshef, L., et al. Glyceroneogenesis and the triglyceride/fatty acid cycle. Journal of Biological Chemistry. 278 (33), 30413-30416 (2003).
- Edens, N. K., Leibel, R. L., Hirsch, J. Mechanism of free fatty acid re-esterification in human adipocytes in vitro. Journal of Lipid Research. 31 (8), 1423-1431 (1990).
- Vaughan, M., Steinberg, D. Effect of hormones on lipolysis and esterification of free fatty acids during incubation of adipose tissue in vitro. Journal of Lipid Research. 4, 193-199 (1963).
- Brooks, B., Arch, J. R., Newsholme, E. A. Effects of hormones on the rate of the triacylglycerol/fatty acid substrate cycle in adipocytes and epididymal fat pads. Federation of European Biochemical Societies Letters. 146 (2), 327-330 (1982).
- Bjorntorp, P., Karlsson, M., Hovden, A. Quantitative aspects of lipolysis and reesterification in human adipose tissue in vitro. Acta Medica Scandinavica. 185 (1-2), 89-97 (1969).
- Angel, A., Desai, K., Halperin, M. L. Free fatty acid and ATP levels in adipocytes during lipolysis. Metabolism. 20 (1), 87-99 (1971).
- Husted, A. S., et al. Autocrine negative feedback regulation of lipolysis through sensing of NEFAs by FFAR4/GPR120 in WAT. Molecular Metabolism. 42, 101103 (2020).
- Fain, J. N., Shepherd, R. E. Free fatty acids as feedback regulators of adenylate cyclase and cyclic 3':5'-AMP accumulation in rat fat cells. The Journal of Biological Chemistry. 250 (16), 6586-6592 (1975).
- Burns, T. W., Langley, P. E., Terry, B. E., Robinson, G. A. The role of free fatty acids in the regulation of lipolysis by human adipose tissue cells. Metabolism. 27 (12), 1755-1762 (1978).
- Kalderon, B., et al. Suppression of adipose lipolysis by long-chain fatty acid analogs. Journal of Lipid Research. 53 (5), 868-878 (2012).
- Schweiger, M., et al. Measurement of lipolysis. Methods in Enzymology. 538, 171-193 (2014).
- Decaunes, P., Bouloumie, A., Ryden, M., Galitzky, J. Ex vivo analysis of lipolysis in human subcutaneous adipose tissue explants. Bio-Protocol. 8 (3), e2711 (2018).
- Roy, D., Myers, J. M., Tedeschi, A. Protocol for assessing ex vivo lipolysis of murine adipose tissue. STAR Protocols. 3 (3), 101518 (2022).
- Baskaran, P., Thyagarajan, B. Measurement of basal and forskolin-stimulated lipolysis in inguinal adipose fat pads. Journal of Visualized Experiments. 125 (125), 55625 (2017).
- Reilly, S. M., et al. Catecholamines suppress fatty acid re-esterification and increase oxidation in white adipocytes via STAT3. Nature Metabolism. 2 (7), 620-634 (2020).
- Liu, L., et al. Isolation of mouse stromal vascular cells for monolayer culture. Methods in Molecular Biology. 1566, 9-16 (2017).
- DeLuca, J. H., Reilly, S. M. . Methods in Molecular Biology. , (2023).
- Richard, G., Vernon, R. A. C. New Perspectives in Adipose Tissue. Butterworth-Heinemann. , (1985).
- Brito, M. N., Botion, L. M., Brito, N. A., Kettelhut, I. C., Migliorini, R. H. Lipolysis and glycerokinase activity in brown adipose tissue of rat fed a high protein, carbohydrate-free diet. Hormone and Metabolic Research. 26 (1), 51-52 (1994).
- Bertin, R. Glycerokinase activity and lipolysis regulation in brown adipose tissue of cold acclimated rats. Biochimie. 58 (4), 431-434 (1976).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved