Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Medición de la tasa de lipólisis en tejido adiposo murino ex vivo y preadipocitos primarios diferenciados in vitro
En este artículo
Resumen
La lipólisis de triglicéridos en los adipocitos es un proceso metabólico importante que resulta en la liberación de ácidos grasos libres y glicerol. Aquí, proporcionamos un protocolo detallado para medir la lipólisis basal y estimulada en adipocitos y tejido adiposo ex vivo de ratones.
Resumen
Los adipocitos almacenan energía en forma de triglicéridos en gotas de lípidos. Esta energía se puede movilizar a través de la lipólisis, donde las cadenas laterales de ácidos grasos se escinden secuencialmente de la columna vertebral de glicerol, lo que resulta en la liberación de ácidos grasos libres y glicerol. Debido a la baja expresión de glicerol quinasa en los adipocitos blancos, las tasas de recaptación de glicerol son insignificantes, mientras que la recaptación de ácidos grasos está dictada por la capacidad de unión de ácidos grasos de componentes de medios como la albúmina. Tanto el glicerol como la liberación de ácidos grasos en los medios se pueden cuantificar mediante ensayos colorimétricos para determinar la tasa lipolítica. Al medir estos factores en múltiples puntos de tiempo, se puede determinar la tasa lineal de lipólisis con alta confianza. Aquí, proporcionamos un protocolo detallado para la medición de la lipólisis en adipocitos diferenciados in vitro y tejido adiposo ex vivo de ratones. Este protocolo también puede optimizarse para otras líneas celulares de preadipocitos o tejido adiposo de otros organismos; Se discuten las consideraciones y los parámetros de optimización. Este protocolo está diseñado para ser útil en la determinación y comparación de la tasa de lipólisis de adipocitos entre modelos de ratón y tratamientos.
Introducción
El exceso de nutrientes se almacena en el tejido adiposo blanco en forma de triglicéridos en el núcleo lipídico neutro de las gotas de lípidos. Las reservas de triglicéridos se movilizan a través de la lipólisis, un proceso por el cual las cadenas laterales de ácidos grasos son escindidas secuencialmente por la lipasa de triglicéridos del tejido adiposo (ATGL), la lipasa sensible a las hormonas (HSL) y la lipasa monoglicérida (MGL), lo que resulta en la liberación de ácidos grasos libres (AGL) y la columna vertebral de glicerol 1,2. La lipólisis se activa por la señalización de catecolaminas en el tejido adiposo. Las terminales nerviosas simpáticas liberan localmente catecolaminas, que se unen a los receptores β-adrenérgicos en la membrana plasmática de los adipocitos. Tras la unión del ligando, estos receptores acoplados a proteínas G (GPCR) activan la adenilil ciclasa a través de Gαs. La activación posterior de la proteína quinasa A (PKA) por cAMP da como resultado la regulación positiva tanto de ATGL como de HSL. La fosforilación de la perilipina-1 por PKA provoca la disociación de ABHD5 (también conocido como CGI-58), que se une y coactiva ATGL3. PKA fosforila directamente HSL, promoviendo su translocación del citosol a la gota lipídica, donde la interacción con la perilipina-1 fosforilada promueve aún más su actividad lipasa 4,5,6,7. La tercera lipasa involucrada en la lipólisis, MGL, no parece estar regulada por la señalización de catecolaminas8. Es importante destacar que la síntesis de triglicéridos en los adipocitos está mediada por la vía de síntesis de lípidos de glicerol, que no implica la formación de monoglicéridos como intermediario; en cambio, las glicerol-3-fosfato aciltransferasas catalizan la formación de ácido lisofosfatídico, que se combina con otro acil-CoA graso para formar ácido fosfatídico, y luego se isomeriza a diglicéridos antes de la síntesis final de triglicéridos (Figura 1)9,10,11.

Figura 1: Vías de síntesis de lípidos de lipólisis y lipíleo de lipcerol. Arriba: vía lipolítica; enzimas mostradas en rojo: triglicéridos del tejido adiposo lipasa (ATGL), lipasa sensible a hormonas (HSL) y monoglicéridos lipasa (MGL). Abajo: vía de síntesis de lípidos de glicerol; enzimas mostradas en verde: diglicérido aciltransferasa (DGAT), fosfatasa de ácido fosfatídico (PAP), ácido lisofosfatídico aciltransferasa (LPAT, también conocida como LPAAT) y glicerol-3-fosfato aciltransferasa (GPAT). Lípidos: triglicéridos (TG), diglicéridos (DG), monoglicéridos (MG), ácidos grasos libres (FFA), acil-CoA grasos (FA-CoA), ácido lisofosfatídico (LPA) y ácido fosfatídico (PA). Otros metabolitos: fosfato inorgánico (Pi) y glicerol 3-fosfato (G3P). Haga clic aquí para ver una versión más grande de esta figura.
La adenosina extracelular es otro regulador importante de la lipólisis, que trabaja a través de GPCR acoplados a Gs y Gi para afectar la actividad de la adenilciclasa. El receptor de adenosina predominante en los adipocitos, ADORA1, inhibe la adenilil ciclasa y, por lo tanto, la lipólisis a través de la activación de Gi12. Expresado en niveles más bajos, y principalmente en adipocitos marrones, ADORA2A activa la lipólisis a través de la señalización Gs 13. ADORA1 afecta tanto a la lipólisis basal como a la respuesta a los agonistas adrenérgicos. El efecto de la adenosina sobre la lipólisis se puede controlar mediante la adición de adenosina desaminasa para neutralizar la adenosina, así como el agonista específico de ADORA1 fenilisopropiladenosina14,15. La activación hormonal de los GPCR acoplados a Gq también puede afectar la lipólisis a través de la activación de la fosfolipasa C y la proteína quinasa C16,17,18,19. Las señales inflamatorias también afectan las tasas lipolíticas. La activación de TLR4 por LPS (y otras endotoxinas) aumenta la tasa lipolítica al activar ERK, que fosforila perilipin-1 y HSL20. El TNF-α también activa la lipólisis a través de la activación de ERK y NF-κB, así como la regulación transcripcional a la baja de la fosfodiesterasa PDE-3B y CIDEC21,22,23. La IL-6 también se ha asociado con un aumento de la lipólisis de los adipocitos, especialmente en el tejido adiposo mesentérico, cuya liberación de AGF afecta la esteatosis hepática y la gluconeogénesis24,25,26.
La lipólisis es suprimida durante el estado alimentado por la insulina. AKT fosforila y activa PDE-3B para suprimir la señalización de cAMP y prevenir la activación de PKA27. La insulina también regula transcripcionalmente a la baja ATGL28. La obesidad promueve la resistencia a las catecolaminas a través de una variedad de mecanismos, incluyendo la regulación a la baja de los receptores β-adrenérgicos en los adipocitos 29,30,31,32,33. Los adipocitos expresan los tres receptores β-adrenérgicos (β-1, β-2 y β-3). Mientras que los receptores adrenérgicos β-1 y β-2 se expresan ubicuamente, el receptor adrenérgico β-3 se expresa predominantemente en los adipocitos en ratones34,35. La expresión de Adrb3 es inducida por C/EBPα durante la adipogénesis36. El receptor adrenérgico β-3 está altamente expresado en adipocitos maduros. La activación de los receptores adrenérgicos β-1 y β-2 es autolimitada debido a la inhibición de la retroalimentación por β-arrestina37. La inhibición por retroalimentación del receptor adrenérgico β-3 está mediada por otras vías de señalización, que reducen la expresión de Adrb3 33,38,39.
Se pueden utilizar numerosos compuestos para activar la lipólisis de los adipocitos. Las catecolaminas son los principales activadores fisiológicos de la lipólisis. La norepinefrina (o noradrenalina) y la epinefrina (o adrenalina) activan los tres receptores β-adrenérgicos40. La norepinefrina y la epinefrina también afectan la lipólisis a través de la activación de la señalización del receptor α-adrenérgico41. Los agonistas de los receptores β-adrenérgicos comúnmente utilizados incluyen isoproterenol, que es un agonista no selectivo del receptor β-adrenérgico, y los agonistas del receptor adrenérgico β-3 CL-316,243 y mirabegron42. Dado que los adipocitos expresan predominantemente el receptor adrenérgico β-3, utilizamos CL-316,243 como ejemplo aquí. Su especificidad para el receptor adrenérgico β-3 también lo convierte en un activador relativamente específico de la señalización de catecolaminas de adipocitos, que también se puede usar de manera segura in vivo. Tenga en cuenta que la concentración comúnmente utilizada de 10 μM CL-316,243 en cultivo celular es órdenes de magnitud mayor que la dosis de ~ 0.1 μM requerida para lograr una respuesta máxima33. La forskoline evita el receptor adrenérgico, activando directamente la adenilil ciclasa y la señalización lipolítica aguas abajo. Hay muchos más activadores, así como supresores de la lipólisis. Al seleccionar un compuesto para estimular la lipólisis, la especificidad del receptor y las vías de señalización aguas abajo deben considerarse cuidadosamente dentro del diseño experimental.
La tasa de lipólisis en el tejido adiposo blanco es un factor metabólico importante que afecta la tolerancia al frío y la disponibilidad de nutrientes durante el ayuno o el ejercicio43,44,45,46. El propósito de este protocolo es medir la tasa de lipólisis en adipocitos y tejido adiposo, lo que facilitará la comprensión del metabolismo de los adipocitos y cómo puede afectar el fenotipo metabólico de varios modelos murinos. Para cuantificar la tasa lipolítica, medimos la aparición de productos lipolíticos en los medios (es decir, AGL y glicerol). El método se basa en la liberación de productos lipolíticos del adipocito en los medios. Dado que los adipocitos blancos expresan niveles bajos de glicerol quinasa, las tasas de recaptación de glicerol son bajas47. Por el contrario, también se debe considerar la producción de AGL y glicerol por vías metabólicas distintas de la lipólisis. Los adipocitos parecen expresar una fosfatasa con actividad contra el fosfato de glicerol-3, lo que permite la producción de glicerol a partir de glicerol-3-fosfato derivado de la glucosa48,49,50. La glucólisis es una fuente de glicerol-3-fosfato utilizada para la reesterificación de FFA en adipocitos blancos. Cuando los niveles de glucosa son limitados, la gliceroneogénesis requiere otras fuentes de 3 carbonos, como lactato y piruvato51. La canalización de AGL liberados por lipólisis dentro de la célula y su destino metabólico es poco conocida; Los AGL liberados por lipólisis deben convertirse en acil-CoA graso, antes de ser reesterificados o sometidos a β-oxidación. Parece que los AGL liberados por lipólisis probablemente salen de la célula antes de ser tomados de nuevo y convertidos en acil-CoA graso 52,53,54,55,56,57,58,59,60,61,62 . Los AGF pueden ser secuestrados fuera de la célula por la albúmina. Es importante destacar que se sabe que los AGF de cadena larga inhiben la lipólisis si no son secuestrados por la albúmina 63,64,65,66,67. Por lo tanto, es fundamental optimizar la capacidad de amortiguación de FFA de los medios durante el ensayo de lipólisis. El procedimiento descrito aquí es similar a los métodos publicados anteriormente para medir la tasa lipolítica en adipocitos y tejido adiposo ex vivo de ratones y humanos 15,68,69,70,71. Este protocolo difiere por el uso de muestreo en serie; Al realizar un muestreo en serie, podemos validar internamente que la lipólisis se mide en la fase lineal y utilizar múltiples mediciones para calcular la tasa de lipólisis, reduciendo así el error de medición para aumentar la confianza en el valor final calculado. El inconveniente del muestreo en serie es que el ensayo requiere más tiempo y reactivos; Sin embargo, el plazo más largo reduce el impacto del error de medición en el error estándar de las estimaciones de la tasa. Además, este protocolo mide tanto la liberación de FFA como la de glicerol, y considera la relación de liberación de FFA:glicerol con el objetivo de lograr una relación de 3:1, como se esperaría de la lipólisis completa y la liberación de productos lipolíticos en los medios72.
Protocolo
El uso de todos los animales fue aprobado por el Comité Institucional de Cuidado y Uso de Animales (IACUC) en Weill Cornell Medical College de la Universidad de Cornell.
1. Preparación de tampones y placas de recogida
- Producir albúmina sérica bovina (BSA) al 5% disolviendo 5 g de BSA en 100 ml de medio de Eagle modificado de Dulbecco (DMEM) sin rojo fenol. Revuelva suavemente el BSA para que se disuelva (agitar es contraproducente). Una vez que el BSA esté completamente disuelto, esterilice el medio con filtro con un filtro de 0,2 μm. Conserve el soporte BSA a 4 °C durante un máximo de 1 mes.
- Realizar concentraciones de trabajo de medios de control y estimulación. Medios de control: 5% de medios BSA con control del vehículo. Medios de estimulación: 5% de medios BSA con 0,5 μM CL-316,243. Haga nuevos medios de estimulación para cada experimento.
- Calentar el soporte a utilizar a 37 °C. Etiquete una placa de 96 pocillos para la recolección de medios.
2. Preparación de la muestra
- Realice el cultivo celular como se describe a continuación. Realice todo el trabajo de celda en una campana de humos estéril para minimizar la contaminación externa.
- Aislar y diferenciar preadipocitos primarios, como en73,74.
- Preadipocitos primarios en placa a una alta densidad, como 1 x 105 células/pocillo en una placa de 24 pocillos en medios de cultivo de 1 ml/pocillo (15% de suero bovino fetal (FBS) y 1x penicilina-estreptomicina-glutamina en DMEM/F12).
- Después de que las células alcancen el 100% de confluencia, diferenciar con 5 μM dexametasona, 0,5 mM 3-isobutil-1-metilxantina, 1 μg/ml de insulina y 1 μM tiazolidindiona (TZD) en medios de cultivo durante 3 días. Luego, cambie a medios de cultivo con insulina de 1 μg / ml durante al menos 3 días para cultivar gotas de lípidos. Use 1 ml/pocillo de medio en la placa de 24 pocillos.
- Cambiar los medios de cultivo (1 ml/pocillo) con insulina cada 2 o 3 días. Las células se pueden mantener en medios con insulina hasta por 2 semanas. Utilice solo cultivos en los que las tasas de diferenciación sean superiores al 90% y sean similares en todos los grupos para este ensayo, ya que la diferenciación reducida podría malinterpretarse como una reducción en la tasa lipolítica.
- Cultivar las células en medios libres de insulina durante 24 h antes de medir la lipólisis.
NOTA: La insulina en los medios mantiene las gotas de lípidos, pero también inhibe la lipólisis. La incubación sin insulina durante 24 h permite la activación lipolítica completa sin pérdida del volumen de gotas de lípidos. En algunos sistemas, el tiempo de cultivo sin insulina puede necesitar ser acortado o extendido.
- Lave las células con DPBS una vez para eliminar el suero residual de los medios de cultivo.
NOTA: Este protocolo no incluye la inanición sérica, que puede activar la lipólisis. La inanición de suero puede emplearse a discreción del investigador.
- Aislar y diferenciar preadipocitos primarios, como en73,74.
- Realizar un cultivo ex vivo como se describe a continuación.
- Prepare una placa de 6 pocillos, con un pocillo para cada tejido que se recogerá de cada ratón. Coloque 4 ml de DMEM a temperatura ambiente en cada pocillo que se vaya a utilizar.
NOTA: BSA en los medios de recolección no es necesario. - Prepare una placa de 48 pocillos para el ensayo de lipólisis, con un pocillo para cada réplica. Coloque 400 μL de DMEM a temperatura ambiente en cada pocillo que se vaya a utilizar. Use de dos a cuatro pocillos de control y de dos a cuatro estimulados por tejido por ratón.
- Eutanasia al ratón por luxación cervical bajo anestesia, con un método secundario como el neumotórax bilateral. Aquí, utilizamos un ratón hembra C57BL / 6J de 32 g y 7 meses de edad, alimentado con una dieta alta en grasas al 45% durante 4 meses.
NOTA: Este protocolo también se puede usar para hombres, así como para otras cepas, dietas y edades. - Rocíe con etanol al 70% y use tijeras para hacer una pequeña incisión lateral (~ 1 cm) en el centro de la piel abdominal, separe la piel pellizcando cualquiera de los lados con el pulgar y el índice y doble la piel abdominal inferior para revelar los depósitos subcutáneos posteriores. Localice y extirpe el ganglio linfático inguinal y disección roma el tejido adiposo inguinal inmediatamente posterior al ganglio linfático inguinal con fórceps.
- Para recoger el tejido adiposo gonadal, realice una incisión lateral y una vertical en el peritoneo para acceder a la cavidad peritoneal. Sostenga la almohadilla de grasa gonadal con pinzas y corte a lo largo del útero (o epidídimo para los hombres) para eliminar el tejido adiposo gonadal. Coloque los depósitos recolectados en una placa de 6 pocillos.
- Retire el tejido del pozo, colóquelo en una estera de silicona y córtelo en trozos de 5 a 7 mg con tijeras.
- Pesar de 25 a 30 mg (cinco o seis trozos) para cada pocillo de ensayo y colocarlo en una placa de ensayo de 48 pocillos. Seque el pañuelo en una toalla limpia antes de pesarlo para eliminar cualquier medio. Pese el bote de pesas después de retirar el tejido y registre el peso de cualquier residuo que quede. Limpie el bote de pesas entre muestras y vuelva a tarlo si es necesario. Use un bote de pesas nuevo para cada tejido.
- Una vez que se hayan pesado todas las muestras de tejido, coloque la placa de ensayo de 48 pocillos en una incubadora deCO2 al 10% a 37 °C durante 15 min.
- Prepare una placa de 6 pocillos, con un pocillo para cada tejido que se recogerá de cada ratón. Coloque 4 ml de DMEM a temperatura ambiente en cada pocillo que se vaya a utilizar.
3. Ensayo de lipólisis
- Realizar la recopilación de medios. Realice la transferencia de los medios y la posterior recolección de muestras en una campana extractora estéril para minimizar la posible contaminación de fuentes externas.
- A t = 0, retirar el medio y añadir 400 μL por pocillo de medio de control o estimulación, y colocar el ensayo de la placa en una incubadora deCO2 al 10% a 37 °C. Para el cultivo de tejido ex vivo , retire con cuidado los medios con una pipeta; Nunca se debe usar succión.
NOTA: Alternativamente, prepare una segunda placa con medios de control y estimulación, y transfiera los tejidos. - A t = 1, 2, 3 y 4 h, recoger 200 μL de medios, sustituir por 200 μL de los medios de control o estimulación apropiados y devolver la placa de ensayo a la incubadora. Conservar la placa de recogida a 4 °C. Para determinar la capacidad de almacenamiento en búfer FFA de los medios BSA, utilice una colección adicional a las 24 h.
NOTA: Los experimentos se pueden detener aquí, y los medios recopilados se pueden almacenar a -20 ° C.
- A t = 0, retirar el medio y añadir 400 μL por pocillo de medio de control o estimulación, y colocar el ensayo de la placa en una incubadora deCO2 al 10% a 37 °C. Para el cultivo de tejido ex vivo , retire con cuidado los medios con una pipeta; Nunca se debe usar succión.
4. Ensayo colorimétrico FFA
- Caliente los reactivos a temperatura ambiente y disuelva una botella de reactivo de color A con una botella de disolvente A y una botella de reactivo de color B con una botella de disolvente B. A partir de la fecha de reconstitución, estos reactivos se utilizan mejor dentro de 1 semana. Desechar 1 mes después de la reconstitución.
- Descongelar y mezclar las muestras.
- Cree una curva estándar FFA. La solución estándar es de 1 mM. Utilice el siguiente volumen con los reactivos para la curva estándar: 25 μL, 20 μL, 15 μL, 10 μL, 10 μL (dilución 1:2), 10 μL (dilución 1:4), 10 μL (dilución 1:8) y 10 μL de agua para el rango máximo. Para niveles bajos de FFA, 10 μL de 1 mM, 0.8 mM, 0.6 mM, 0.4 mM, 0.2 mM, 0.1 mM y 0.05 mM estándar pueden ser más aplicables.
- Pipetear patrones y muestras en una placa de ensayo de 96 pocillos. El volumen de muestra recomendado es de 10 μL. Incluya tres pocillos con el mismo volumen de medios BSA que las muestras para la corrección de fondo.
NOTA: Si las concentraciones de la muestra quedan fuera del rango de la curva estándar, repita el ensayo, ajustando el volumen de la muestra a 2-25 μL. - Añadir 150 μL de reactivo A a cada pocillo y mezclar. Evita generar burbujas. Haga estallar cualquier burbuja con una aguja de calibre fino. Incubar la placa de ensayo a 37 °C durante 5 min.
- Lea la absorbancia de la placa a 550 nm y 660 nm de referencia (Lectura A).
- Añadir 75 μL de reactivo B a cada pocillo y mezclar. Evita generar burbujas. Haga estallar cualquier burbuja con una aguja de calibre fino. Incubar la placa de ensayo a 37 °C durante 5 min.
- Lea de nuevo la absorbancia de la placa a 550 nm y 660 nm de referencia (lectura B).
5. Ensayo colorimétrico de glicerol
- Reconstituir el reactivo de glicerol libre con 36 mL de agua ultrapura y aclimatarlo a temperatura ambiente. Estos reactivos se utilizan mejor en unas pocas semanas. Desechar 2 meses después de la reconstitución.
- Descongelar y mezclar las muestras.
- Cree una curva estándar de glicerol haciendo una dilución en serie de siete puntos y 2 veces de la solución estándar de glicerol y un espacio en blanco.
NOTA: La curva estándar es relativamente lineal hasta 25 μL de glicerol de 2,8 mM, pero no lineal a concentraciones más altas. - Pipetear 25 μL cada uno de los ejemplares estándar y muestras en la placa de ensayo de 96 pocillos. Incluya tres pozos con los medios BSA para la corrección de fondo.
- Agregue 175 μL de reactivo de glicerol libre a cada pocillo y mezcle. Evita generar burbujas. Haga estallar cualquier burbuja con una aguja de calibre fino. Incubar la placa de ensayo a 37 °C durante 5 min.
- Lea la absorbancia de la placa a 540 nm.
6. Cálculo de la tasa lipolítica
- Comience con los valores de densidad óptica (OD). Para el glicerol, utilice directamente los valores de A540 OD. Calcule el OD del ensayo FFA de acuerdo con la siguiente fórmula:
OD = (Lectura B: A 550 - A 660) - (Lectura A: A550 - A660) - Utilice la curva estándar para calcular los niveles de FFA y glicerol en las muestras recogidas. Trazar los valores estándar de OD en el eje y, y en el eje x, utilizar concentraciones estándar relativas al volumen de la muestra (es decir, la concentración de los pocillos con 20 μL de 1 mM FFA estándar en una placa con muestras de 10 μL es igual a 2 mM). Ajuste a una línea de tendencia lineal:
y = mx + b - Inspeccione visualmente la curva estándar y elimine cualquier punto fuera del rango lineal del ensayo. Calcule las concentraciones de muestra usando la ecuación:
Concentración de la muestra: x = (OD - b) ÷ m - Ajustar y volver a ensayar las muestras que caen fuera del rango de ensayo lineal. Para obtener la concentración final de la muestra, reste la concentración de los pocillos de fondo que contienen solo medios BSA de la concentración de las muestras.
- Calcule los moles de FFA y glicerol producidos por cada muestra en cada punto de tiempo, de acuerdo con la fórmula:
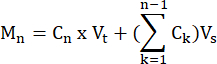
donde C n = concentración en el tiempo t = n; Vt = volumen total en el pozo; Vs = volumen de recogida de muestras; y M n = moles producidos en el tiempo t = n (cuando las concentraciones están en mM y los volúmenes están en mL, la salida es μMol).
Por ejemplo, en varios puntos temporales:
M 1 = C1 × Vt
M 4 = C4 × Vt + (C1 + C2+ C3)Vs
o
M 4 = C4 × Vt + C3 × V s + C2 × V s + C1 ×V s - Normalizar el peso del tejido dividiendo por el peso del tejido para cada muestra en gramos para obtener unidades de μmol/g. Para las células cultivadas, los valores se presentan como μmol/pocillo. Asegúrese de que el número de células y la eficiencia de diferenciación sean comparables de un pozo a otro.
NOTA: Las diferencias en la eficiencia de proliferación o diferenciación complicarán la interpretación de los resultados y requerirán otro método de normalización (por ejemplo, normalización a proteína; ver discusión). - Calcule la pendiente del μmol/g producido (eje y) frente al tiempo (eje x) para cada muestra individualmente.
- En una hoja de cálculo, esto se puede hacer usando la función =SLOPE(known_ys,known_xs). En una celda nueva, escriba "=SLOPE" (luego use el cursor para resaltar los valores de glicerol o FFA de la muestra en μmol / g, luego para resaltar los valores de tiempo correspondientes).
- Verifique la linealidad de los datos. Los valores de R2 son una forma rápida de determinar la linealidad de las muestras. En una hoja de cálculo, esto se puede hacer usando la función =RSQ(known_ys,known_xs), de la misma manera que se describe en el paso 6.7.1, pero la entrada inicial es =RSQ. Asegúrese de que los valores de R2 sean > 0,98; Los valores más bajos indican una desviación de la linealidad. Esto puede ser el resultado de un error de medición/muestreo o pérdida de linealidad.
- Otra forma de probar la linealidad es realizar una regresión lineal para cada muestra y trazar los residuos. En un software de análisis estadístico, genere una tabla XY con un solo valor Y para cada punto de tiempo. Seleccione Analizar > Regresión lineal simple y seleccione la casilla Gráfica residual antes de pulsar OK. La gráfica residual aparecerá como un nuevo gráfico.
- Utilice la tasa de producción de FFA y glicerol (es decir, pendiente [(μmol / g / h]) para cada muestra como un punto de datos individual para realizar análisis estadísticos y trazar valores si se comparan diferentes condiciones lipolíticas. Si se comparan las tasas lipolíticas entre genotipos, use dos o tres muestras por animal como réplicas técnicas y use el promedio para un punto de datos por animal, de modo que el tamaño de la muestra sea igual al número de animales.
Resultados
Medimos la tasa lipolítica basal y estimulada de adipocitos diferenciados in vitro. Los preadipocitos primarios del tejido adiposo blanco inguinal se diferenciaron en adipocitos mediante el tratamiento de células confluentes con 5 μM de dexametasona, 0,5 mM IBMX, 1 μg/ml de insulina y 1 μM de troglitazona durante 4 días, seguido de un tratamiento adicional de 3 días con 1 μg/ml de insulina. Las células se incubaron en medios sin insulina durante 24 h antes del ensayo de lipólisis. En el momento = 0h, l...
Discusión
Aquí, proporcionamos un protocolo básico para medir la tasa de lipólisis en adipocitos y tejido adiposo ex vivo . Para cuantificar la lipólisis, es importante medir la tasa lipolítica en la fase lineal. Utilizamos una técnica de muestreo en serie, donde se recolecta una gran fracción de los medios y se reemplaza con medios frescos a intervalos regulares. Este método semiconservador permite la adición de BSA fresco con capacidad de amortiguación FFA y retrasa la inhibición de la retroalimentación, ext...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue apoyado por la subvención R01DK126944 de los Institutos Nacionales de Salud de los Estados Unidos a S.M.R.
Materiales
| Name | Company | Catalog Number | Comments |
| 24-Well tissue culture treated plate | Corning Inc | 3527 | Must be tissue culture treated for adipocyte differntiation |
| 48-Well flat bottom plate with lid | Corning Inc | 353078 | Can be tissue culture treated |
| 6-Well flat bottom plate with lid | Corning Inc | 353046 | Can be tissue culture treated |
| 96-Well PCR Plate | USA sceintific | 1402-9100 | Any conical 0.2 mL PCR plate will be convenient |
| Bovine Serum Albumin | Sigma Aldrich | A9418 | FFA free BSA such as A8806, is also commonly used. The BSA should not have detectable FFA, also lot to lot variations in BSA can impact the observed rate of lipolysis |
| CL-316,243 | Sigma Aldrich | C5976 | CAS #: 138908-40-4 availaible from other suppliers |
| CO2 incubator | PHCBI | MCO-170AICUVH | CO2 should ideally be set to 10% for adipose tissue, however 5% CO2 will also work |
| DMEM, low glucose, no phenol red | Thermofischer | 11054020 | Any phenol red free media should work, DMEM/F12, RPMI, but should contain volatile buffering capacity, i.e. biocarbonate |
| FFA-free Bovine serum albumin | Equitech-Bio, Inc, | BAH66 | |
| Free Glycerol Reagent | Sigma Aldrich | F6428 | |
| Glycerol Standard Solution | Sigma Aldrich | G7793 | This can also be made by diluting glycerol to the desired concentration |
| HR Series NEFA Standard Solution | Fujifilm | 276-76491 | |
| HR Series NEFA-HR (2) Color Reagent A | Fujifilm | 999-34691 | |
| HR Series NEFA-HR (2) Color Reagent B | Fujifilm | 991-34891 | |
| HR Series NEFA-HR (2) Solvent A | Fujifilm | 995-34791 | |
| HR Series NEFA-HR (2) Solvent B | Fujifilm | 993-35191 | |
| Microbiological Incubator | Fischer Scientific | S28668 | Any incubator at 37C can be used |
| Nunc MicroWell 96-Well Plates | Thermo Scientific | 269620 | Any optically clear, flat bottom 96-well plate works |
| Silicone Laboratory Benchtop Mat | VWR | 76045-300 | Glass plate can also be used. Absorbant surfaces are not recommended |
| Spectrophotometer/Microplate Reader | Molecular devices | SpectraMax i3x | Any plate reader that can read at 540, 550 and 660 mm will work |
| V Bovine serum albumin | Sigma-Aldrich | 810531 | |
| WypAll X70 Wipers | Kimberly-Clark | 41200 | Any high quality paper towel will work |
Referencias
- Vaughan, M., Berger, J. E., Steinberg, D. Hormone-sensitive lipase and monoglyceride lipase activities in adipose tissue. The Journal of Biological Chemistry. 239, 401-409 (1964).
- Zimmermann, R., et al. Fat mobilization in adipose tissue is promoted by adipose triglyceride lipase. Science. 306 (5700), 1383-1386 (2004).
- Lass, A., et al. Adipose triglyceride lipase-mediated lipolysis of cellular fat stores is activated by CGI-58 and defective in Chanarin-Dorfman syndrome. Cell Metabolism. 3 (5), 309-319 (2006).
- Stralfors, P., Bjorgell, P., Belfrage, P. Hormonal regulation of hormone-sensitive lipase in intact adipocytes: identification of phosphorylated sites and effects on the phosphorylation by lipolytic hormones and insulin. Proceedings of the National Academy of Sciences. 81 (11), 3317-3321 (1984).
- Miyoshi, H., et al. Perilipin promotes hormone-sensitive lipase-mediated adipocyte lipolysis via phosphorylation-dependent and -independent mechanisms. The Journal of Biological Chemistry. 281 (23), 15837-15844 (2006).
- Sztalryd, C., et al. Perilipin A is essential for the translocation of hormone-sensitive lipase during lipolytic activation. The Journal of Cell Biology. 161 (6), 1093-1103 (2003).
- Lafontan, M., Langin, D. Lipolysis and lipid mobilization in human adipose tissue. Progress in Lipid Research. 48 (5), 275-297 (2009).
- Grabner, G. F., Xie, H., Schweiger, M., Zechner, R. Lipolysis: cellular mechanisms for lipid mobilization from fat stores. Nature Metabolism. 3 (11), 1445-1465 (2021).
- Weiss, S. B., Kennedy, E. P., Kiyasu, J. Y. The enzymatic synthesis of triglycerides. The Journal of Biological Chemistry. 235, 40-44 (1960).
- Kennedy, E. P. Biosynthesis of complex lipids. Federation Proceedings. 20, 934-940 (1961).
- Wendel, A. A., Lewin, T. M., Coleman, R. A. Glycerol-3-phosphate acyltransferases: rate limiting enzymes of triacylglycerol biosynthesis. Biochimica et Biophysica Acta. 1791 (6), 501-506 (2009).
- Johansson, S. M., Lindgren, E., Yang, J. N., Herling, A. W., Fredholm, B. B. Adenosine A1 receptors regulate lipolysis and lipogenesis in mouse adipose tissue-interactions with insulin. European Journal of Pharmacology. 597 (1-3), 92-101 (2008).
- Gnad, T., et al. Adenosine activates brown adipose tissue and recruits beige adipocytes via A2A receptors. Nature. 516 (7531), 395-399 (2014).
- Fried, S. K., et al. Resistance to the antilipolytic effect of insulin in adipocytes of African-American compared to Caucasian postmenopausal women. Journal of Lipid Research. 51 (5), 1193-1200 (2010).
- Lee, M. J., Fried, S. K. Optimal protocol for the differentiation and metabolic analysis of human adipose stromal cells. Methods in Enzymology. 538, 49-65 (2014).
- Fricke, K., Heitland, A., Maronde, E. Cooperative activation of lipolysis by protein kinase A and protein kinase C pathways in 3T3-L1 adipocytes. Endocrinology. 145 (11), 4940-4947 (2004).
- Bergan, H. E., Kittilson, J. D., Sheridan, M. A. PKC and ERK mediate GH-stimulated lipolysis. Journal of Molecular Endocrinology. 51 (2), 213-224 (2013).
- Schmitz-Peiffer, C. The tail wagging the dog--regulation of lipid metabolism by protein kinase C. The FEBS Journal. 280 (21), 5371-5383 (2013).
- Carmen, G. Y., Victor, S. M. Signalling mechanisms regulating lipolysis. Cellular Signalling. 18 (4), 401-408 (2006).
- Zu, L., et al. Bacterial endotoxin stimulates adipose lipolysis via toll-like receptor 4 and extracellular signal-regulated kinase pathway. The Journal of Biological Chemistry. 284 (9), 5915-5926 (2009).
- Zhang, H. H., Halbleib, M., Ahmad, F., Manganiello, V. C., Greenberg, A. S. Tumor necrosis factor-alpha stimulates lipolysis in differentiated human adipocytes through activation of extracellular signal-related kinase and elevation of intracellular cAMP. Diabetes. 51 (10), 2929-2935 (2002).
- Tan, X., et al. TNF-α downregulates CIDEC via MEK/ERK pathway in human adipocytes. Obesity. 24 (5), 1070-1080 (2016).
- Laurencikiene, J., et al. NF-kappaB is important for TNF-alpha-induced lipolysis in human adipocytes. Journal of Lipid Research. 48 (5), 1069-1077 (2007).
- van Hall, G., et al. Interleukin-6 stimulates lipolysis and fat oxidation in humans. The Journal of Clinical Endocrinology and Metabolism. 88 (7), 3005-3010 (2003).
- Wueest, S., et al. Mesenteric fat lipolysis mediates obesity-associated hepatic steatosis and insulin resistance. Diabetes. 65 (1), 140-148 (2016).
- Trujillo, M. E., et al. Interleukin-6 regulates human adipose tissue lipid metabolism and leptin production in vitro. The Journal of Clinical Endocrinology and Metabolism. 89 (11), 5577-5582 (2004).
- Kitamura, T., et al. Insulin-induced phosphorylation and activation of cyclic nucleotide phosphodiesterase 3B by the serine-threonine kinase Akt. Molecular and Cellular Biology. 19 (9), 6286-6296 (1999).
- Chakrabarti, P., et al. Insulin inhibits lipolysis in adipocytes via the evolutionarily conserved mTORC1-Egr1-ATGL-mediated pathway. Molecular and Cellular Biology. 33 (18), 3659-3666 (2013).
- Collins, S., Daniel, K. W., Petro, A. E., Surwit, R. S. Strain-specific response to beta 3-adrenergic receptor agonist treatment of diet-induced obesity in mice. Endocrinology. 138 (1), 405-413 (1997).
- Surwit, R. S., Dixon, T. M., Petro, A. E., Daniel, K. W., Collins, S. Diazoxide restores beta3-adrenergic receptor function in diet-induced obesity and diabetes. Endocrinology. 141 (10), 3630-3637 (2000).
- Gettys, T. W., et al. Age-dependent changes in beta-adrenergic receptor subtypes and adenylyl cyclase activation in adipocytes from Fischer 344 rats. Endocrinology. 136 (5), 2022-2032 (1995).
- Mowers, J., et al. Inflammation produces catecholamine resistance in obesity via activation of PDE3B by the protein kinases IKKε and TBK1. eLife. 2, e01119 (2013).
- Valentine, J. M., et al. β3-Adrenergic receptor downregulation leads to adipocyte catecholamine resistance in obesity. The Journal of Clinical Investigation. 132 (2), e153357 (2022).
- Collins, S., et al. Impaired expression and functional activity of the beta 3- and beta 1-adrenergic receptors in adipose tissue of congenitally obese (C57BL/6J ob/ob) mice. Molecular Endocrinology. 8 (4), 518-527 (1994).
- Collins, S., Surwit, R. S. The beta-adrenergic receptors and the control of adipose tissue metabolism and thermogenesis. Recent Progress in Hormone Research. 56, 309-328 (2001).
- Dixon, T. M., Daniel, K. W., Farmer, S. R., Collins, S. CCAAT/enhancer-binding protein alpha is required for transcription of the beta 3-adrenergic receptor gene during adipogenesis. The Journal of Biological Chemistry. 276 (1), 722-728 (2001).
- Lohse, M. J., Benovic, J. L., Codina, J., Caron, M. G., Lefkowitz, R. J. beta-Arrestin: a protein that regulates beta-adrenergic receptor function. Science. 248 (4962), 1547-1550 (1990).
- Nantel, F., et al. The human beta 3-adrenergic receptor is resistant to short term agonist-promoted desensitization. Molecular Pharmacology. 43 (4), 548-555 (1993).
- Liggett, S. B., Freedman, N. J., Schwinn, D. A., Lefkowitz, R. J. Structural basis for receptor subtype-specific regulation revealed by a chimeric beta 3/beta 2-adrenergic receptor. Proceedings of the National Academy of Sciences. 90 (8), 3665-3669 (1993).
- Baker, J. G. The selectivity of beta-adrenoceptor agonists at human beta1-, beta2- and beta3-adrenoceptors. British Journal of Pharmacology. 160 (5), 1048-1061 (2010).
- Lafontan, M. Inhibition of epinephrine-induced lipolysis in isolated white adipocytes of aging rabbits by increased alpha-adrenergic responsiveness. Journal of Lipid Research. 20 (2), 208-216 (1979).
- Baker, J. G. The selectivity of beta-adrenoceptor antagonists at the human beta1, beta2 and beta3 adrenoceptors. British Journal of Pharmacology. 144 (3), 317-322 (2005).
- Jensen, M. D., Nielsen, S. Insulin dose response analysis of free fatty acid kinetics. Metabolism. 56 (1), 68-76 (2007).
- Jensen, M. D., Haymond, M. W., Gerich, J. E., Cryer, P. E., Miles, J. M. Lipolysis during fasting. Decreased suppression by insulin and increased stimulation by epinephrine. The Journal of Clinical Investigation. 79 (1), 207-213 (1987).
- Heckmann, B. L., et al. Defective adipose lipolysis and altered global energy metabolism in mice with adipose overexpression of the lipolytic inhibitor G0/G1 switch gene 2 (G0S2). The Journal of Biological Chemistry. 289 (4), 1905-1916 (2014).
- Shin, H., et al. Lipolysis in brown adipocytes is not essential for cold-induced thermogenesis in mice. Cell Metabolism. 26 (5), 764.e5-777.e5 (2017).
- Treble, D. H., Mayer, J. Glycerolkinase activity in white adipose tissue of obese-hyperglycaemic mice. Nature. 200, 363-364 (1963).
- Possik, E., et al. New mammalian glycerol-3-phosphate phosphatase: role in beta-cell, liver and adipocyte metabolism. Frontiers in Endocrinology. 12, 706607 (2021).
- Romero Mdel, M., Sabater, D., Fernandez-Lopez, J. A., Remesar, X., Alemany, M. Glycerol production from glucose and fructose by 3T3-L1 cells: a mechanism of adipocyte defense from excess substrate. PLoS One. 10 (10), e0139502 (2015).
- Mugabo, Y., et al. Identification of a mammalian glycerol-3-phosphate phosphatase: Role in metabolism and signaling in pancreatic beta-cells and hepatocytes. Proceedings of the National Academy of Sciences. 113 (4), E430-E439 (2016).
- Hanson, R. W., Reshef, L. Glyceroneogenesis revisited. Biochimie. 85 (12), 1199-1205 (2003).
- Vaughan, M. The production and release of glycerol by adipose tissue incubated in vitro. The Journal of Biological Chemistry. 237, 3354-3358 (1962).
- Jensen, M. D., Ekberg, K., Landau, B. R. Lipid metabolism during fasting. American Journal of Physiology-Endocrinology and Metabolism. 281 (4), E789-E793 (2001).
- Ballard, F. J., Hanson, R. W., Leveille, G. A. Phosphoenolpyruvate carboxykinase and the synthesis of glyceride-glycerol from pyruvate in adipose tissue. The Journal of Biological Chemistry. 242 (11), 2746-2750 (1967).
- Reshef, L., Hanson, R. W., Ballard, F. J. A possible physiological role for glyceroneogenesis in rat adipose tissue. The Journal of Biological Chemistry. 245 (22), 5979-5984 (1970).
- Gorin, E., Tal-Or, Z., Shafrir, E. Glyceroneogenesis in adipose tissue of fasted, diabetic and triamcinolone treated rats. European Journal of Biochemistry. 8 (3), 370-375 (1969).
- Elia, M., Zed, C., Neale, G., Livesey, G. The energy cost of triglyceride-fatty acid recycling in nonobese subjects after an overnight fast and four days of starvation. Metabolism. 36 (3), 251-255 (1987).
- Reshef, L., et al. Glyceroneogenesis and the triglyceride/fatty acid cycle. Journal of Biological Chemistry. 278 (33), 30413-30416 (2003).
- Edens, N. K., Leibel, R. L., Hirsch, J. Mechanism of free fatty acid re-esterification in human adipocytes in vitro. Journal of Lipid Research. 31 (8), 1423-1431 (1990).
- Vaughan, M., Steinberg, D. Effect of hormones on lipolysis and esterification of free fatty acids during incubation of adipose tissue in vitro. Journal of Lipid Research. 4, 193-199 (1963).
- Brooks, B., Arch, J. R., Newsholme, E. A. Effects of hormones on the rate of the triacylglycerol/fatty acid substrate cycle in adipocytes and epididymal fat pads. Federation of European Biochemical Societies Letters. 146 (2), 327-330 (1982).
- Bjorntorp, P., Karlsson, M., Hovden, A. Quantitative aspects of lipolysis and reesterification in human adipose tissue in vitro. Acta Medica Scandinavica. 185 (1-2), 89-97 (1969).
- Angel, A., Desai, K., Halperin, M. L. Free fatty acid and ATP levels in adipocytes during lipolysis. Metabolism. 20 (1), 87-99 (1971).
- Husted, A. S., et al. Autocrine negative feedback regulation of lipolysis through sensing of NEFAs by FFAR4/GPR120 in WAT. Molecular Metabolism. 42, 101103 (2020).
- Fain, J. N., Shepherd, R. E. Free fatty acids as feedback regulators of adenylate cyclase and cyclic 3':5'-AMP accumulation in rat fat cells. The Journal of Biological Chemistry. 250 (16), 6586-6592 (1975).
- Burns, T. W., Langley, P. E., Terry, B. E., Robinson, G. A. The role of free fatty acids in the regulation of lipolysis by human adipose tissue cells. Metabolism. 27 (12), 1755-1762 (1978).
- Kalderon, B., et al. Suppression of adipose lipolysis by long-chain fatty acid analogs. Journal of Lipid Research. 53 (5), 868-878 (2012).
- Schweiger, M., et al. Measurement of lipolysis. Methods in Enzymology. 538, 171-193 (2014).
- Decaunes, P., Bouloumie, A., Ryden, M., Galitzky, J. Ex vivo analysis of lipolysis in human subcutaneous adipose tissue explants. Bio-Protocol. 8 (3), e2711 (2018).
- Roy, D., Myers, J. M., Tedeschi, A. Protocol for assessing ex vivo lipolysis of murine adipose tissue. STAR Protocols. 3 (3), 101518 (2022).
- Baskaran, P., Thyagarajan, B. Measurement of basal and forskolin-stimulated lipolysis in inguinal adipose fat pads. Journal of Visualized Experiments. 125 (125), 55625 (2017).
- Reilly, S. M., et al. Catecholamines suppress fatty acid re-esterification and increase oxidation in white adipocytes via STAT3. Nature Metabolism. 2 (7), 620-634 (2020).
- Liu, L., et al. Isolation of mouse stromal vascular cells for monolayer culture. Methods in Molecular Biology. 1566, 9-16 (2017).
- DeLuca, J. H., Reilly, S. M. . Methods in Molecular Biology. , (2023).
- Richard, G., Vernon, R. A. C. New Perspectives in Adipose Tissue. Butterworth-Heinemann. , (1985).
- Brito, M. N., Botion, L. M., Brito, N. A., Kettelhut, I. C., Migliorini, R. H. Lipolysis and glycerokinase activity in brown adipose tissue of rat fed a high protein, carbohydrate-free diet. Hormone and Metabolic Research. 26 (1), 51-52 (1994).
- Bertin, R. Glycerokinase activity and lipolysis regulation in brown adipose tissue of cold acclimated rats. Biochimie. 58 (4), 431-434 (1976).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados