Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Измерение скорости липолиза в мышиной жировой ткани ex vivo и первичных преадипоцитах, дифференцированных in vitro
В этой статье
Резюме
Триглицеридный липолиз в адипоцитах является важным метаболическим процессом, приводящим к высвобождению свободных жирных кислот и глицерина. Здесь мы приводим подробный протокол измерения базального и стимулированного липолиза в адипоцитах и жировой ткани ex vivo у мышей.
Аннотация
Адипоциты хранят энергию в виде триглицеридов в липидных каплях. Эта энергия может быть мобилизована посредством липолиза, где боковые цепи жирных кислот последовательно отщепляются от основной цепи глицерина, что приводит к высвобождению свободных жирных кислот и глицерина. Из-за низкой экспрессии глицеринкиназы в белых адипоцитах скорость обратного захвата глицерина незначительна, в то время как обратный захват жирных кислот продиктован способностью связывания жирных кислот компонентов среды, таких как альбумин. Высвобождение глицерина и жирных кислот в среду может быть количественно определено с помощью колориметрических анализов для определения скорости липолитики. Измеряя эти факторы в несколько временных точек, можно с высокой достоверностью определить линейную скорость липолиза. Здесь мы приводим подробный протокол измерения липолиза в дифференцированных адипоцитах in vitro и жировой ткани ex vivo у мышей. Этот протокол также может быть оптимизирован для других клеточных линий преадипоцитов или жировой ткани других организмов; Обсуждаются соображения и параметры оптимизации. Этот протокол предназначен для определения и сравнения скорости липолиза адипоцитов между мышиными моделями и методами лечения.
Введение
Избыток питательных веществ хранится в белой жировой ткани в виде триглицеридов в нейтральном липидном ядре липидных капель. Запасы триглицеридов мобилизуются посредством липолиза, процесса, при котором боковые цепи жирных кислот последовательно расщепляются триглицеридлипазой жировой ткани (ATGL), гормоночувствительной липазой (HSL) и моноглицеридлипазой (MGL), что приводит к высвобождению свободных жирных кислот (FFA) и глицериновой цепи 1,2. Липолиз активируется передачей сигналов катехоламинов в жировой ткани. Симпатические нервные окончания локально высвобождают катехоламины, которые связываются с β-адренорецепторами на плазматической мембране адипоцитов. При связывании лиганда эти рецепторы, связанные с G-белком (GPCR), активируют аденилатциклазу через Gαs. Последующая активация протеинкиназы А (PKA) цАМФ приводит к усилению регуляции как ATGL, так и HSL. Фосфорилирование перилипина-1 PKA вызывает диссоциацию ABHD5 (также известного как CGI-58), который связывает и коактивирует ATGL3. PKA непосредственно фосфорилирует HSL, способствуя его транслокации из цитозоля в липидную каплю, где взаимодействие с фосфорилированным перилипином-1 дополнительно способствует его липазной активности 4,5,6,7. Третья липаза, участвующая в липолизе, MGL, по-видимому, не регулируется передачей сигналов катехоламинов8. Важно отметить, что синтез триглицеридов в адипоцитах опосредован путем синтеза липидов глицерина, который не включает образование моноглицеридов в качестве промежуточного продукта; вместо этого глицерин-3-фосфатацилтрансферазы катализируют образование лизофосфатидной кислоты, которая соединяется с другим жирным ацил-КоА с образованием фосфатидной кислоты, а затем изомеризуется до диглицеридов до окончательного синтеза триглицеридов (рис. 1)9,10,11.

Рисунок 1: Пути синтеза липидов липолиза и глицерина. Вверху: Липолитический путь; ферменты, показанные красным цветом: триглицеридлипаза жировой ткани (ATGL), гормоночувствительная липаза (HSL) и моноглицеридлипаза (MGL). Внизу: путь синтеза липидов глицерина; ферменты, показанные зеленым цветом: диглицеридацилтрансфераза (DGAT), фосфатидная кислая фосфатаза (PAP), лизофосфатидная кислота ацилтрансфераза (LPAT, также известная как LPAAT) и глицерин-3-фосфат-ацилтрансфераза (GPAT). Липиды: триглицериды (ТГ), диглицериды (ДГ), моноглицериды (МГ), свободные жирные кислоты (СЖК), жирные ацил-КоА (ФА-КоА), лизофосфатидная кислота (ЛПА) и фосфатидная кислота (ПА). Другие метаболиты: неорганический фосфат (Pi) и глицерин-3-фосфат (G3P). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Внеклеточный аденозин является еще одним важным регулятором липолиза, работаячерез Gs- и G-i-связанные GPCR, чтобы влиять на активность аденилциклазы. Преобладающий аденозиновый рецептор в адипоцитах, ADORA1, ингибирует аденилатциклазу и, таким образом, липолиз посредством активации Gi12. Экспрессируемый на более низких уровнях и в основном в коричневых адипоцитах, ADORA2A активирует липолиз через передачусигналов G s 13. ADORA1 влияет как на базальный липолиз, так и на реакцию на адренергические агонисты. Влияние аденозина на липолиз можно контролировать, добавляя аденозиндезаминазу для нейтрализации аденозина, а также ADORA1-специфический агонист фенилизопропиладенозин14,15. Гормональная активация Gq-связанных GPCR также может влиять на липолиз через активацию фосфолипазы С и протеинкиназы С16,17,18,19. Воспалительные сигналы также влияют на липолитические показатели. Активация TLR4 ЛПС (и другими эндотоксинами) увеличивает липолитическую скорость за счет активации ERK, который фосфорилирует перилипин-1 и HSL20. TNF-α также активирует липолиз посредством активации ERK и NF-κB, а также транскрипционного подавления фосфодиэстеразы PDE-3B и CIDEC21,22,23. IL-6 также был связан с повышенным липолизом адипоцитов, особенно в брыжеечной жировой ткани, высвобождение FFA которой влияет на стеатоз печени и глюконеогенез24,25,26.
Липолиз подавляется во время вскормленного состояния инсулином. AKT фосфорилирует и активирует PDE-3B для подавления передачи сигналов цАМФ и предотвращения активации PKA27. Инсулин также транскрипционно подавляет ATGL28. Ожирение способствует резистентности к катехоламинам с помощью различных механизмов, включая подавление β-адренорецепторов в адипоцитах 29,30,31,32,33. Адипоциты экспрессируют все три β-адренорецептора (β-1, β-2 и β-3). В то время как адренорецепторы β-1 и β-2 экспрессируются повсеместно, адренорецептор β-3 преимущественно экспрессируется в адипоцитах у мышей34,35. Экспрессия Adrb3 индуцируется C/EBPα во время адипогенеза36. Адренорецептор β-3 высоко экспрессируется в зрелых адипоцитах. Активация адренорецепторов β-1 и β-2 является самоограничивающейся из-за ингибирования обратной связи β-аррестином37. Ингибирование с обратной связью адренергического рецептора β-3 опосредовано другими сигнальными путями, которые снижают экспрессию Adrb3 33,38,39.
Многочисленные соединения могут быть использованы для активации липолиза адипоцитов. Катехоламины являются основными физиологическими активаторами липолиза. Норадреналин (или норадреналин) и адреналин (или адреналин) активируют все три β-адренорецептора40. Норадреналин и адреналин также влияют на липолиз посредством активации передачисигналов 41 α-адренергического рецептора. Обычно используемые агонисты β-адренорецепторов включают изопротеренол, который является неселективным агонистом β-адренорецепторов, и агонисты адренорецепторов β-3 CL-316,243 и мирабегрон42. Учитывая, что адипоциты преимущественно экспрессируют адренергический рецептор β-3, мы используем CL-316,243 в качестве примера. Его специфичность для адренорецептора β-3 также делает его относительно специфическим активатором передачи сигналов катехоламинов адипоцитов, который также можно безопасно использовать in vivo. Обратите внимание, что обычно используемая концентрация 10 мкМ CL-316,243 в культуре клеток на порядки выше, чем доза ~0,1 мкМ, необходимая для достижения максимального ответа33. Форсколин обходит адренергический рецептор, непосредственно активируя аденилатциклазу и последующую липолитическую сигнализацию. Существует еще много активаторов, а также супрессоров липолиза. При выборе соединения для стимуляции липолиза в рамках экспериментального дизайна следует тщательно учитывать специфичность рецептора и последующие сигнальные пути.
Скорость липолиза в белой жировой ткани является важным метаболическим фактором, влияющим на переносимость холода и доступность питательных веществ во время голодания или физических упражнений43,44,45,46. Целью этого протокола является измерение скорости липолиза в адипоцитах и жировой ткани, что облегчит понимание метаболизма адипоцитов и того, как он может влиять на метаболический фенотип различных мышиных моделей. Чтобы количественно оценить скорость липолитики, мы измеряем появление липолитических продуктов в средах (т.е. СЖК и глицерина). Метод основан на высвобождении липолитических продуктов из адипоцита в среду. Поскольку белые адипоциты экспрессируют низкие уровни глицеринкиназы, показатели обратного захвата глицерина низкие47. И наоборот, следует также учитывать выработку СЖК и глицерина метаболическими путями, отличными от липолиза. Адипоциты, по-видимому, экспрессируют фосфатазу с активностью против фосфата глицерина-3, что позволяет производить глицерин из глицерин-3-фосфата, полученного из глюкозы48,49,50. Гликолиз является источником глицерин-3-фосфата, используемого для повторной этерификации FFA в белых адипоцитах. Когда уровни глюкозы ограничены, глиценеогенез требует других 3-углеродных источников, таких как лактат и пируват51. Канализация FFA, высвобождаемых липолизом внутри клетки, и их метаболическая судьба плохо изучены; FFA, высвобождаемые липолизом, должны быть преобразованы в жирный ацил-КоА, прежде чем подвергаться повторной этерифицированности или β-окислению. Похоже, что СЖК, высвобождаемые липолизом, скорее всего, выходят из клетки, прежде чем возвращаться обратно и превращаться в жирный ацил-КоА 52,53,54,55,56,57,58,59,60,61,62 . СЖК могут быть изолированы вне клетки альбумином. Важно отметить, что длинноцепочечные FFA, как известно, ингибируют липолиз с обратной связью, если они не секвестрированы альбумином 63,64,65,66,67. Таким образом, оптимизация буферной емкости среды FFA во время анализа липолиза имеет решающее значение. Описанная здесь процедура аналогична ранее опубликованным методам измерения скорости липолитиков в адипоцитах и жировой ткани ex vivo у мышей и людей 15,68,69,70,71. Этот протокол отличается использованием последовательной выборки; Выполняя последовательный отбор проб, мы можем внутренне подтвердить, что липолиз измеряется в линейной фазе, и использовать несколько измерений для расчета скорости липолиза, тем самым уменьшая погрешность измерения и повышая достоверность конечного расчетного значения. Недостатком серийного отбора проб является то, что анализ требует больше времени и реагентов; Однако более длительный срок снижает влияние погрешности измерения на стандартную погрешность оценок ставки. Кроме того, в этом протоколе измеряется высвобождение как СЖК, так и глицерина и рассматривается соотношение высвобождения СЖК и глицерина с целью достижения соотношения 3:1, как и следовало ожидать от полного липолиза и высвобождения липолитических продуктов в среду72.
протокол
Использование всех животных было одобрено Институциональным комитетом по уходу за животными и их использованию (IACUC) в Медицинском колледже Вейля Корнелла Корнельского университета.
1. Подготовка буферов и сборных пластин
- Сделайте 5% бычий сывороточный альбумин (BSA), растворив 5 г BSA в 100 мл модифицированной среды Dulbecco Eagle's Medium (DMEM) без фенольного красного. Аккуратно перемешайте BSA до растворения (встряхивание контрпродуктивно). Как только BSA полностью растворится, фильтруйте фильтр и стерилизуйте фильтр с помощью фильтра 0,2 мкм. Храните носитель BSA при температуре 4 °C до 1 месяца.
- Сделайте рабочие концентрации контрольных и стимулирующих сред. Управляющая среда: 5% среды BSA с управлением транспортным средством. Среда стимуляции: 5% среды BSA с 0,5 мкМ CL-316,243. Для каждого эксперимента приготовьте свежие среды для стимуляции.
- Нагрейте используемый носитель до 37 °C. Наклейте этикетку на 96-луночную пластину для сбора носителей.
2. Пробоподготовка
- Выполните культивирование клеток, как описано ниже. Выполняйте все работы с ячейками в стерильном вытяжном шкафу, чтобы свести к минимуму внешнее загрязнение.
- Выделяют и дифференцируют первичные преадипоциты, как в73,74.
- Пластинчатые первичные преадипоциты с высокой плотностью, такие как 1 x 105 клеток / лунка в 24-луночном планшете в 1 мл / лунка культуральная среда (15% фетальной бычьей сыворотки (FBS) и 1x пенициллин-стрептомицин-глутамин в DMEM / F12).
- После того, как клетки достигнут 100% слияния, дифференцируют с 5 мкМ дексаметазоном, 0,5 мМ 3-изобутил-1-метилксантином, 1 мкг/мл инсулина и 1 мкМ тиазолидиндионом (TZD) в питательных средах в течение 3 дней. Затем перейдите на питательную среду с инсулином 1 мкг / мл в течение не менее 3 дней, чтобы вырастить липидные капли. Используйте 1 мл/лунку среды в 24-луночной пластине.
- Меняйте питательные среды (1 мл/лунка) инсулином каждые 2 или 3 дня. Клетки могут поддерживаться в среде с инсулином до 2 недель. Для этого анализа используйте только культуры, в которых показатели дифференцировки превышают 90% и одинаковы в разных группах, так как снижение дифференцировки может быть неверно истолковано как снижение скорости липолитики.
- Культивируют клетки в безинсулиновых средах в течение 24 ч перед измерением липолиза.
ПРИМЕЧАНИЕ: Инсулин в среде поддерживает липидные капли, но также ингибирует липолиз. Инкубация без инсулина в течение 24 ч позволяет провести полную липолитическую активацию без потери объема липидных капель. В некоторых системах может потребоваться сокращение или продление времени культивирования без инсулина.
- Промойте клетки DPBS один раз, чтобы удалить остатки сыворотки из питательной среды.
ПРИМЕЧАНИЕ: Этот протокол не включает сывороточное голодание, которое может активировать липолиз. Сывороточное голодание может быть использовано по усмотрению исследователя.
- Выделяют и дифференцируют первичные преадипоциты, как в73,74.
- Выполните культуру ex vivo, как описано ниже.
- Подготовьте 6-луночную тарелку с одной лункой для каждой ткани, которая будет собрана у каждой мыши. Поместите 4 мл DMEM комнатной температуры в каждую лунку, которая будет использоваться.
ПРИМЕЧАНИЕ: BSA в средствах сбора не требуется. - Подготовьте 48-луночную пластину для анализа липолиза, по одной лунке для каждой реплики. Поместите 400 мкл ДМЭМ комнатной температуры в каждую лунку, которая будет использоваться. Используйте две-четыре контрольных и две-четыре стимулированных лунки на ткань на мышь.
- Усыпить мышь вывихом шейки матки под наркозом, вторичным методом, таким как двусторонний пневмоторакс. Здесь мы использовали 32-граммовую 7-месячную самку мыши C57BL / 6J, которую кормили 45% диетой с высоким содержанием жиров в течение 4 месяцев.
ПРИМЕЧАНИЕ: Этот протокол также может быть использован для мужчин, а также для других штаммов, диет и возрастов. - Сбрызните 70% этанолом и с помощью ножниц сделайте небольшой (~ 1 см) боковой разрез в центре кожи живота, раздвиньте кожу, ущипнув обе стороны большим и указательным пальцами, и сложите нижнюю часть живота, чтобы обнажить задние подкожные депо. Найдите и удалите паховый лимфатический узел и затупите паховую жировую ткань непосредственно позади пахового лимфатического узла с помощью щипцов.
- Чтобы собрать гонадную жировую ткань, сделайте боковой и вертикальный разрез в брюшине, чтобы получить доступ к брюшной полости. Держите жировую подушку гонад пинцетом и разрежьте вдоль матки (или придатка яичка для мужчин), чтобы удалить жировую ткань гонады. Поместите собранные склады в 6-луночную тарелку.
- Снимите салфетку с лунки, положите на силиконовый коврик и нарежьте ножницами на кусочки по 5-7 мг.
- Взвесьте от 25 до 30 мг (пять или шесть кусков) для каждой пробирной лунки и поместите в пробирную пластину на 48 лунок. Промокните салфетку на чистом полотенце перед взвешиванием, чтобы удалить все носители. Взвесьте весовую лодку после удаления ткани и запишите вес любых оставшихся остатков. Протрите весовую лодку между образцами и при необходимости снова тарируйте. Используйте новую весовую лодку для каждой ткани.
- После того, как все образцы тканей будут взвешены, поместите 48-луночную тестовую пластину в инкубатор с 37 °C, 10% CO2 на 15 минут.
- Подготовьте 6-луночную тарелку с одной лункой для каждой ткани, которая будет собрана у каждой мыши. Поместите 4 мл DMEM комнатной температуры в каждую лунку, которая будет использоваться.
3. Анализ на липолиз
- Выполните сбор мультимедиа. Проведите перенос среды и последующий отбор проб в стерильный вытяжной шкаф, чтобы свести к минимуму потенциальное загрязнение из внешних источников.
- При t = 0 удалите среду и добавьте 400 мкл на лунку контрольной или стимулирующей среды, а затем поместите планшет для анализа в инкубатор с 37 °C и 10% CO2 . Для культивирования тканей ex vivo осторожно удалите среду с помощью пипетки; Ни в коем случае нельзя использовать всасывание.
ПРИМЕЧАНИЕ: В качестве альтернативы подготовьте вторую пластину со средой для контроля и стимуляции и перенесите ткани. - При t = 1, 2, 3 и 4 ч соберите 200 мкл среды, замените ее 200 мкл соответствующей контрольной или стимулирующей среды и верните пробирную пластину в инкубатор. Храните сборную пластину при температуре 4 °C. Чтобы определить буферную емкость среды BSA FFA, используйте дополнительный сбор через 24 часа.
ПРИМЕЧАНИЕ: На этом эксперименты можно остановить, а собранные носители можно хранить при -20 °C.
- При t = 0 удалите среду и добавьте 400 мкл на лунку контрольной или стимулирующей среды, а затем поместите планшет для анализа в инкубатор с 37 °C и 10% CO2 . Для культивирования тканей ex vivo осторожно удалите среду с помощью пипетки; Ни в коем случае нельзя использовать всасывание.
4. Колориметрический анализ FFA
- Нагрейте реагенты до комнатной температуры и растворите один флакон цветного реагента А с одним флаконом растворителя А, а один флакон с цветным реагентом В с одним флаконом растворителя В. С момента восстановления эти реагенты лучше всего использовать в течение 1 недели. Выбросить через 1 месяц после восстановления.
- Разморозьте и перемешайте образцы.
- Создайте стандартную кривую FFA. Стандартный раствор составляет 1 мМ. Используйте следующий объем с реагентами для стандартной кривой: 25 мкл, 20 мкл, 15 мкл, 10 мкл, 10 мкл (разведение 1:2), 10 мкл (разбавление 1:4), 10 мкл (разбавление 1:8) и 10 мкл воды для максимального диапазона. Для низких уровней FFA могут быть более применимыми 10 мкл стандарта 1 мМ, 0,8 мМ, 0,6 мМ, 0,4 мМ, 0,2 мМ, 0,1 мМ и 0,05 мМ.
- Стандарты пипетки и образцы в 96-луночную пробирную пластину. Рекомендуемый объем образца составляет 10 мкл. Включите три лунки с тем же объемом среды BSA, что и образцы для коррекции фона.
ПРИМЕЧАНИЕ: Если концентрации в пробе выходят за пределы диапазона стандартной кривой, повторите анализ, отрегулировав объем образца до 2-25 мкл. - Добавьте по 150 мкл реагента А в каждую лунку и перемешайте. Избегайте образования пузырей. Лопните любые пузырьки тонкой иглой. Инкубируйте пробирную пластину при 37 °C в течение 5 минут.
- Считайте коэффициент поглощения пластины при 550 нм и 660 нм эталона (чтение A).
- Добавьте 75 мкл реагента B в каждую лунку и перемешайте. Избегайте образования пузырей. Лопните любые пузырьки тонкой иглой. Инкубируйте пробирную пластину при 37 °C в течение 5 минут.
- Еще раз считайте коэффициент поглощения пластины при 550 нм и 660 нм (чтение B).
5. Колориметрический анализ глицерина
- Восстановите свободный глицериновый реагент 36 мл сверхчистой воды и акклиматизируйте до комнатной температуры. Эти реагенты лучше всего использовать в течение нескольких недель. Выбросить через 2 месяца после восстановления.
- Разморозьте и перемешайте образцы.
- Создайте стандартную кривую глицерина, сделав семиточечное, 2-кратное последовательное разведение стандартного раствора глицерина и пустую воду.
ПРИМЕЧАНИЕ: Стандартная кривая является относительно линейной до 25 мкл глицерина 2,8 мМ, но не линейной при более высоких концентрациях. - Пипетка по 25 мкл каждого стандарта и образцов в 96-луночную пробирную пластину. Включите три лунки со средой BSA для коррекции фона.
- Добавьте в каждую лунку по 175 мкл свободного глицеринового реагента и перемешайте. Избегайте образования пузырей. Лопните любые пузырьки тонкой иглой. Инкубируйте пробирную пластину при 37 °C в течение 5 минут.
- Считайте поглощение пластины на длине волны 540 нм.
6. Расчет липолитического курса
- Начните со значений оптической плотности (OD). Для глицерина используйте значения ODA 540 напрямую. Рассчитайте OD анализа FFA по следующей формуле:
OD = (Чтение B: A 550 - A 660) - (Чтение A: A550 - A660) - Используйте стандартную кривую для расчета уровней СЖК и глицерина в собранных образцах. Нанесите стандартные значения OD на ось y, а на ось x используйте стандартные концентрации относительно объема образца (т. е. концентрация лунок с 20 мкл стандарта FFA 1 мМ на пластине с образцами 10 мкл равна 2 мМ). Подгонка линейной линии тренда:
y = mx + b - Визуально осмотрите стандартную кривую и удалите все точки за пределами линейного диапазона анализа. Рассчитайте концентрацию пробы, используя уравнение:
Концентрация образца: x = (OD - b) ÷ м - Корректируйте и повторно анализируйте образцы, выходящие за пределы линейного диапазона анализа. Чтобы получить окончательную концентрацию пробы, вычтите из концентрации проб концентрацию фоновых скважин, содержащих только среду BSA.
- Рассчитайте моли FFA и глицерина, продуцируемые каждым образцом в каждый момент времени, по формуле:
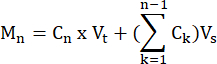
где C n = концентрация в момент времени t = n; Vt = общий объем в скважине; Vs = объем отбора проб; и M n = моли, образующиеся в момент времени t = n (когда концентрации указаны в мМ, а объемы - в мл, на выходе получается мкмоль).
Например, в разные моменты времени:
M 1 = C1 × Vt
М 4 = С4 × В t + (С1 + С 2+ С3)В с
или
М 4 = С4 × Вт + С3 × Вс + С2 × В с + С1 ×В с - Нормализуйте массу ткани путем деления на массу ткани для каждого образца в граммах, чтобы получить единицы мкмоль/г. Для культивируемых клеток значения представлены в мкмоль/лунка. Убедитесь, что количество клеток и эффективность дифференцировки сопоставимы от скважины к скважине.
ПРИМЕЧАНИЕ: Различия в эффективности пролиферации или дифференцировки усложнят интерпретацию результатов и потребуют другого метода нормализации (например, нормализации до белка; см. обсуждение). - Рассчитайте наклон полученного мкмоль/г (ось y) в зависимости от времени (ось x) для каждого образца в отдельности.
- В электронной таблице это можно сделать с помощью функции =SLOPE(known_ys,known_xs). В новой ячейке введите «=НАКЛОН» (затем с помощью курсора выделите образцы значений глицерина или FFA в мкмоль/г, а затем выделите соответствующие значения времени).
- Проверьте линейность данных. Значения R2 являются быстрым способом определения линейности образцов. В электронной таблице это можно сделать с помощью функции =RSQ(known_ys,known_xs) так же, как описано в шаге 6.7.1, но начальные входные данные =RSQ. Убедитесь, что значения R2 > 0,98; Меньшие значения указывают на отклонение от линейности. Это может быть результатом ошибки измерения/выборки или потери линейности.
- Другой способ проверить линейность — выполнить линейную регрессию для каждого образца и построить график остатков. В программном обеспечении для статистического анализа создайте таблицу XY с одним значением Y для каждого момента времени. Выберите «Анализ» > «Простая линейная регрессия» и установите флажок « Остаточный график », прежде чем нажать кнопку «ОК». Остаточный график появится в виде нового графика.
- Используйте скорость производства FFA и глицерина (т. е. наклон [(мкмоль/г/ч]) для каждого образца в качестве отдельной точки данных для выполнения статистического анализа и построения графика значений, если сравниваются различные липолитические условия. Если липолитические показатели сравниваются между генотипами, используйте два или три образца на животное в качестве технических реплик и используйте среднее значение для одной точки данных на животное, чтобы размер выборки был равен количеству животных.
Результаты
Мы измерили базальную и стимулированную липолитическую скорость дифференцированных адипоцитов in vitro. Первичные преадипоциты из паховой белой жировой ткани дифференцировали в адипоциты путем обработки сливающихся клеток 5 мкМ дексаметазоном, 0,5 мМ IBMX, 1 мкг/мл инсулина и 1 мкМ трог?...
Обсуждение
Здесь мы приводим базовый протокол для измерения скорости липолиза в адипоцитах и жировой ткани ex vivo . Для количественной оценки липолиза важно измерить скорость липолитики в линейной фазе. Мы используем метод серийного отбора проб, при котором большая часть среды собирается и за?...
Раскрытие информации
Авторам раскрывать нечего.
Благодарности
Эта работа была поддержана грантом Национального института здравоохранения США R01DK126944 для S.M.R.
Материалы
| Name | Company | Catalog Number | Comments |
| 24-Well tissue culture treated plate | Corning Inc | 3527 | Must be tissue culture treated for adipocyte differntiation |
| 48-Well flat bottom plate with lid | Corning Inc | 353078 | Can be tissue culture treated |
| 6-Well flat bottom plate with lid | Corning Inc | 353046 | Can be tissue culture treated |
| 96-Well PCR Plate | USA sceintific | 1402-9100 | Any conical 0.2 mL PCR plate will be convenient |
| Bovine Serum Albumin | Sigma Aldrich | A9418 | FFA free BSA such as A8806, is also commonly used. The BSA should not have detectable FFA, also lot to lot variations in BSA can impact the observed rate of lipolysis |
| CL-316,243 | Sigma Aldrich | C5976 | CAS #: 138908-40-4 availaible from other suppliers |
| CO2 incubator | PHCBI | MCO-170AICUVH | CO2 should ideally be set to 10% for adipose tissue, however 5% CO2 will also work |
| DMEM, low glucose, no phenol red | Thermofischer | 11054020 | Any phenol red free media should work, DMEM/F12, RPMI, but should contain volatile buffering capacity, i.e. biocarbonate |
| FFA-free Bovine serum albumin | Equitech-Bio, Inc, | BAH66 | |
| Free Glycerol Reagent | Sigma Aldrich | F6428 | |
| Glycerol Standard Solution | Sigma Aldrich | G7793 | This can also be made by diluting glycerol to the desired concentration |
| HR Series NEFA Standard Solution | Fujifilm | 276-76491 | |
| HR Series NEFA-HR (2) Color Reagent A | Fujifilm | 999-34691 | |
| HR Series NEFA-HR (2) Color Reagent B | Fujifilm | 991-34891 | |
| HR Series NEFA-HR (2) Solvent A | Fujifilm | 995-34791 | |
| HR Series NEFA-HR (2) Solvent B | Fujifilm | 993-35191 | |
| Microbiological Incubator | Fischer Scientific | S28668 | Any incubator at 37C can be used |
| Nunc MicroWell 96-Well Plates | Thermo Scientific | 269620 | Any optically clear, flat bottom 96-well plate works |
| Silicone Laboratory Benchtop Mat | VWR | 76045-300 | Glass plate can also be used. Absorbant surfaces are not recommended |
| Spectrophotometer/Microplate Reader | Molecular devices | SpectraMax i3x | Any plate reader that can read at 540, 550 and 660 mm will work |
| V Bovine serum albumin | Sigma-Aldrich | 810531 | |
| WypAll X70 Wipers | Kimberly-Clark | 41200 | Any high quality paper towel will work |
Ссылки
- Vaughan, M., Berger, J. E., Steinberg, D. Hormone-sensitive lipase and monoglyceride lipase activities in adipose tissue. The Journal of Biological Chemistry. 239, 401-409 (1964).
- Zimmermann, R., et al. Fat mobilization in adipose tissue is promoted by adipose triglyceride lipase. Science. 306 (5700), 1383-1386 (2004).
- Lass, A., et al. Adipose triglyceride lipase-mediated lipolysis of cellular fat stores is activated by CGI-58 and defective in Chanarin-Dorfman syndrome. Cell Metabolism. 3 (5), 309-319 (2006).
- Stralfors, P., Bjorgell, P., Belfrage, P. Hormonal regulation of hormone-sensitive lipase in intact adipocytes: identification of phosphorylated sites and effects on the phosphorylation by lipolytic hormones and insulin. Proceedings of the National Academy of Sciences. 81 (11), 3317-3321 (1984).
- Miyoshi, H., et al. Perilipin promotes hormone-sensitive lipase-mediated adipocyte lipolysis via phosphorylation-dependent and -independent mechanisms. The Journal of Biological Chemistry. 281 (23), 15837-15844 (2006).
- Sztalryd, C., et al. Perilipin A is essential for the translocation of hormone-sensitive lipase during lipolytic activation. The Journal of Cell Biology. 161 (6), 1093-1103 (2003).
- Lafontan, M., Langin, D. Lipolysis and lipid mobilization in human adipose tissue. Progress in Lipid Research. 48 (5), 275-297 (2009).
- Grabner, G. F., Xie, H., Schweiger, M., Zechner, R. Lipolysis: cellular mechanisms for lipid mobilization from fat stores. Nature Metabolism. 3 (11), 1445-1465 (2021).
- Weiss, S. B., Kennedy, E. P., Kiyasu, J. Y. The enzymatic synthesis of triglycerides. The Journal of Biological Chemistry. 235, 40-44 (1960).
- Kennedy, E. P. Biosynthesis of complex lipids. Federation Proceedings. 20, 934-940 (1961).
- Wendel, A. A., Lewin, T. M., Coleman, R. A. Glycerol-3-phosphate acyltransferases: rate limiting enzymes of triacylglycerol biosynthesis. Biochimica et Biophysica Acta. 1791 (6), 501-506 (2009).
- Johansson, S. M., Lindgren, E., Yang, J. N., Herling, A. W., Fredholm, B. B. Adenosine A1 receptors regulate lipolysis and lipogenesis in mouse adipose tissue-interactions with insulin. European Journal of Pharmacology. 597 (1-3), 92-101 (2008).
- Gnad, T., et al. Adenosine activates brown adipose tissue and recruits beige adipocytes via A2A receptors. Nature. 516 (7531), 395-399 (2014).
- Fried, S. K., et al. Resistance to the antilipolytic effect of insulin in adipocytes of African-American compared to Caucasian postmenopausal women. Journal of Lipid Research. 51 (5), 1193-1200 (2010).
- Lee, M. J., Fried, S. K. Optimal protocol for the differentiation and metabolic analysis of human adipose stromal cells. Methods in Enzymology. 538, 49-65 (2014).
- Fricke, K., Heitland, A., Maronde, E. Cooperative activation of lipolysis by protein kinase A and protein kinase C pathways in 3T3-L1 adipocytes. Endocrinology. 145 (11), 4940-4947 (2004).
- Bergan, H. E., Kittilson, J. D., Sheridan, M. A. PKC and ERK mediate GH-stimulated lipolysis. Journal of Molecular Endocrinology. 51 (2), 213-224 (2013).
- Schmitz-Peiffer, C. The tail wagging the dog--regulation of lipid metabolism by protein kinase C. The FEBS Journal. 280 (21), 5371-5383 (2013).
- Carmen, G. Y., Victor, S. M. Signalling mechanisms regulating lipolysis. Cellular Signalling. 18 (4), 401-408 (2006).
- Zu, L., et al. Bacterial endotoxin stimulates adipose lipolysis via toll-like receptor 4 and extracellular signal-regulated kinase pathway. The Journal of Biological Chemistry. 284 (9), 5915-5926 (2009).
- Zhang, H. H., Halbleib, M., Ahmad, F., Manganiello, V. C., Greenberg, A. S. Tumor necrosis factor-alpha stimulates lipolysis in differentiated human adipocytes through activation of extracellular signal-related kinase and elevation of intracellular cAMP. Diabetes. 51 (10), 2929-2935 (2002).
- Tan, X., et al. TNF-α downregulates CIDEC via MEK/ERK pathway in human adipocytes. Obesity. 24 (5), 1070-1080 (2016).
- Laurencikiene, J., et al. NF-kappaB is important for TNF-alpha-induced lipolysis in human adipocytes. Journal of Lipid Research. 48 (5), 1069-1077 (2007).
- van Hall, G., et al. Interleukin-6 stimulates lipolysis and fat oxidation in humans. The Journal of Clinical Endocrinology and Metabolism. 88 (7), 3005-3010 (2003).
- Wueest, S., et al. Mesenteric fat lipolysis mediates obesity-associated hepatic steatosis and insulin resistance. Diabetes. 65 (1), 140-148 (2016).
- Trujillo, M. E., et al. Interleukin-6 regulates human adipose tissue lipid metabolism and leptin production in vitro. The Journal of Clinical Endocrinology and Metabolism. 89 (11), 5577-5582 (2004).
- Kitamura, T., et al. Insulin-induced phosphorylation and activation of cyclic nucleotide phosphodiesterase 3B by the serine-threonine kinase Akt. Molecular and Cellular Biology. 19 (9), 6286-6296 (1999).
- Chakrabarti, P., et al. Insulin inhibits lipolysis in adipocytes via the evolutionarily conserved mTORC1-Egr1-ATGL-mediated pathway. Molecular and Cellular Biology. 33 (18), 3659-3666 (2013).
- Collins, S., Daniel, K. W., Petro, A. E., Surwit, R. S. Strain-specific response to beta 3-adrenergic receptor agonist treatment of diet-induced obesity in mice. Endocrinology. 138 (1), 405-413 (1997).
- Surwit, R. S., Dixon, T. M., Petro, A. E., Daniel, K. W., Collins, S. Diazoxide restores beta3-adrenergic receptor function in diet-induced obesity and diabetes. Endocrinology. 141 (10), 3630-3637 (2000).
- Gettys, T. W., et al. Age-dependent changes in beta-adrenergic receptor subtypes and adenylyl cyclase activation in adipocytes from Fischer 344 rats. Endocrinology. 136 (5), 2022-2032 (1995).
- Mowers, J., et al. Inflammation produces catecholamine resistance in obesity via activation of PDE3B by the protein kinases IKKε and TBK1. eLife. 2, e01119 (2013).
- Valentine, J. M., et al. β3-Adrenergic receptor downregulation leads to adipocyte catecholamine resistance in obesity. The Journal of Clinical Investigation. 132 (2), e153357 (2022).
- Collins, S., et al. Impaired expression and functional activity of the beta 3- and beta 1-adrenergic receptors in adipose tissue of congenitally obese (C57BL/6J ob/ob) mice. Molecular Endocrinology. 8 (4), 518-527 (1994).
- Collins, S., Surwit, R. S. The beta-adrenergic receptors and the control of adipose tissue metabolism and thermogenesis. Recent Progress in Hormone Research. 56, 309-328 (2001).
- Dixon, T. M., Daniel, K. W., Farmer, S. R., Collins, S. CCAAT/enhancer-binding protein alpha is required for transcription of the beta 3-adrenergic receptor gene during adipogenesis. The Journal of Biological Chemistry. 276 (1), 722-728 (2001).
- Lohse, M. J., Benovic, J. L., Codina, J., Caron, M. G., Lefkowitz, R. J. beta-Arrestin: a protein that regulates beta-adrenergic receptor function. Science. 248 (4962), 1547-1550 (1990).
- Nantel, F., et al. The human beta 3-adrenergic receptor is resistant to short term agonist-promoted desensitization. Molecular Pharmacology. 43 (4), 548-555 (1993).
- Liggett, S. B., Freedman, N. J., Schwinn, D. A., Lefkowitz, R. J. Structural basis for receptor subtype-specific regulation revealed by a chimeric beta 3/beta 2-adrenergic receptor. Proceedings of the National Academy of Sciences. 90 (8), 3665-3669 (1993).
- Baker, J. G. The selectivity of beta-adrenoceptor agonists at human beta1-, beta2- and beta3-adrenoceptors. British Journal of Pharmacology. 160 (5), 1048-1061 (2010).
- Lafontan, M. Inhibition of epinephrine-induced lipolysis in isolated white adipocytes of aging rabbits by increased alpha-adrenergic responsiveness. Journal of Lipid Research. 20 (2), 208-216 (1979).
- Baker, J. G. The selectivity of beta-adrenoceptor antagonists at the human beta1, beta2 and beta3 adrenoceptors. British Journal of Pharmacology. 144 (3), 317-322 (2005).
- Jensen, M. D., Nielsen, S. Insulin dose response analysis of free fatty acid kinetics. Metabolism. 56 (1), 68-76 (2007).
- Jensen, M. D., Haymond, M. W., Gerich, J. E., Cryer, P. E., Miles, J. M. Lipolysis during fasting. Decreased suppression by insulin and increased stimulation by epinephrine. The Journal of Clinical Investigation. 79 (1), 207-213 (1987).
- Heckmann, B. L., et al. Defective adipose lipolysis and altered global energy metabolism in mice with adipose overexpression of the lipolytic inhibitor G0/G1 switch gene 2 (G0S2). The Journal of Biological Chemistry. 289 (4), 1905-1916 (2014).
- Shin, H., et al. Lipolysis in brown adipocytes is not essential for cold-induced thermogenesis in mice. Cell Metabolism. 26 (5), 764.e5-777.e5 (2017).
- Treble, D. H., Mayer, J. Glycerolkinase activity in white adipose tissue of obese-hyperglycaemic mice. Nature. 200, 363-364 (1963).
- Possik, E., et al. New mammalian glycerol-3-phosphate phosphatase: role in beta-cell, liver and adipocyte metabolism. Frontiers in Endocrinology. 12, 706607 (2021).
- Romero Mdel, M., Sabater, D., Fernandez-Lopez, J. A., Remesar, X., Alemany, M. Glycerol production from glucose and fructose by 3T3-L1 cells: a mechanism of adipocyte defense from excess substrate. PLoS One. 10 (10), e0139502 (2015).
- Mugabo, Y., et al. Identification of a mammalian glycerol-3-phosphate phosphatase: Role in metabolism and signaling in pancreatic beta-cells and hepatocytes. Proceedings of the National Academy of Sciences. 113 (4), E430-E439 (2016).
- Hanson, R. W., Reshef, L. Glyceroneogenesis revisited. Biochimie. 85 (12), 1199-1205 (2003).
- Vaughan, M. The production and release of glycerol by adipose tissue incubated in vitro. The Journal of Biological Chemistry. 237, 3354-3358 (1962).
- Jensen, M. D., Ekberg, K., Landau, B. R. Lipid metabolism during fasting. American Journal of Physiology-Endocrinology and Metabolism. 281 (4), E789-E793 (2001).
- Ballard, F. J., Hanson, R. W., Leveille, G. A. Phosphoenolpyruvate carboxykinase and the synthesis of glyceride-glycerol from pyruvate in adipose tissue. The Journal of Biological Chemistry. 242 (11), 2746-2750 (1967).
- Reshef, L., Hanson, R. W., Ballard, F. J. A possible physiological role for glyceroneogenesis in rat adipose tissue. The Journal of Biological Chemistry. 245 (22), 5979-5984 (1970).
- Gorin, E., Tal-Or, Z., Shafrir, E. Glyceroneogenesis in adipose tissue of fasted, diabetic and triamcinolone treated rats. European Journal of Biochemistry. 8 (3), 370-375 (1969).
- Elia, M., Zed, C., Neale, G., Livesey, G. The energy cost of triglyceride-fatty acid recycling in nonobese subjects after an overnight fast and four days of starvation. Metabolism. 36 (3), 251-255 (1987).
- Reshef, L., et al. Glyceroneogenesis and the triglyceride/fatty acid cycle. Journal of Biological Chemistry. 278 (33), 30413-30416 (2003).
- Edens, N. K., Leibel, R. L., Hirsch, J. Mechanism of free fatty acid re-esterification in human adipocytes in vitro. Journal of Lipid Research. 31 (8), 1423-1431 (1990).
- Vaughan, M., Steinberg, D. Effect of hormones on lipolysis and esterification of free fatty acids during incubation of adipose tissue in vitro. Journal of Lipid Research. 4, 193-199 (1963).
- Brooks, B., Arch, J. R., Newsholme, E. A. Effects of hormones on the rate of the triacylglycerol/fatty acid substrate cycle in adipocytes and epididymal fat pads. Federation of European Biochemical Societies Letters. 146 (2), 327-330 (1982).
- Bjorntorp, P., Karlsson, M., Hovden, A. Quantitative aspects of lipolysis and reesterification in human adipose tissue in vitro. Acta Medica Scandinavica. 185 (1-2), 89-97 (1969).
- Angel, A., Desai, K., Halperin, M. L. Free fatty acid and ATP levels in adipocytes during lipolysis. Metabolism. 20 (1), 87-99 (1971).
- Husted, A. S., et al. Autocrine negative feedback regulation of lipolysis through sensing of NEFAs by FFAR4/GPR120 in WAT. Molecular Metabolism. 42, 101103 (2020).
- Fain, J. N., Shepherd, R. E. Free fatty acids as feedback regulators of adenylate cyclase and cyclic 3':5'-AMP accumulation in rat fat cells. The Journal of Biological Chemistry. 250 (16), 6586-6592 (1975).
- Burns, T. W., Langley, P. E., Terry, B. E., Robinson, G. A. The role of free fatty acids in the regulation of lipolysis by human adipose tissue cells. Metabolism. 27 (12), 1755-1762 (1978).
- Kalderon, B., et al. Suppression of adipose lipolysis by long-chain fatty acid analogs. Journal of Lipid Research. 53 (5), 868-878 (2012).
- Schweiger, M., et al. Measurement of lipolysis. Methods in Enzymology. 538, 171-193 (2014).
- Decaunes, P., Bouloumie, A., Ryden, M., Galitzky, J. Ex vivo analysis of lipolysis in human subcutaneous adipose tissue explants. Bio-Protocol. 8 (3), e2711 (2018).
- Roy, D., Myers, J. M., Tedeschi, A. Protocol for assessing ex vivo lipolysis of murine adipose tissue. STAR Protocols. 3 (3), 101518 (2022).
- Baskaran, P., Thyagarajan, B. Measurement of basal and forskolin-stimulated lipolysis in inguinal adipose fat pads. Journal of Visualized Experiments. 125 (125), 55625 (2017).
- Reilly, S. M., et al. Catecholamines suppress fatty acid re-esterification and increase oxidation in white adipocytes via STAT3. Nature Metabolism. 2 (7), 620-634 (2020).
- Liu, L., et al. Isolation of mouse stromal vascular cells for monolayer culture. Methods in Molecular Biology. 1566, 9-16 (2017).
- DeLuca, J. H., Reilly, S. M. . Methods in Molecular Biology. , (2023).
- Richard, G., Vernon, R. A. C. New Perspectives in Adipose Tissue. Butterworth-Heinemann. , (1985).
- Brito, M. N., Botion, L. M., Brito, N. A., Kettelhut, I. C., Migliorini, R. H. Lipolysis and glycerokinase activity in brown adipose tissue of rat fed a high protein, carbohydrate-free diet. Hormone and Metabolic Research. 26 (1), 51-52 (1994).
- Bertin, R. Glycerokinase activity and lipolysis regulation in brown adipose tissue of cold acclimated rats. Biochimie. 58 (4), 431-434 (1976).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены