このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
in vitroで分化したマウス脂肪組織および初代前駆脂肪細胞における脂肪分解の速度の測定
要約
脂肪細胞におけるトリグリセリド脂肪分解は、遊離脂肪酸およびグリセロールの遊離をもたらす重要な代謝プロセスである。ここでは、マウスの脂肪細胞および ex vivo 脂肪組織における基礎脂肪分解および刺激脂肪分解を測定するための詳細なプロトコルを提供します。
要約
脂肪細胞は脂肪滴中にトリグリセリドの形でエネルギーを蓄えます。このエネルギーは脂肪分解 を介して 動員することができ、そこでは脂肪酸側鎖がグリセロール骨格から順次切断され、遊離脂肪酸およびグリセロールの放出をもたらす。白色脂肪細胞におけるグリセロールキナーゼの発現が低いため、グリセロールの再取り込み速度はごくわずかですが、脂肪酸の再取り込みはアルブミンなどの培地成分の脂肪酸結合能力によって決まります。培地へのグリセロールおよび脂肪酸放出の両方を比色アッセイによって定量し、脂肪分解率を決定することができる。これらの因子を複数の時点で測定することにより、脂肪分解の線形速度を高い信頼性で決定できます。ここでは、マウス由来の in vitro 分化脂肪細胞および ex vivo 脂肪組織における脂肪分解の測定のための詳細なプロトコルを提供します。このプロトコルは、他の脂肪前駆細胞株または他の生物由来の脂肪組織に対しても最適化され得る。考慮事項と最適化パラメーターについて説明します。このプロトコルは、マウスモデルと治療の間の脂肪細胞脂肪分解の速度を決定および比較するのに役立つように設計されています。
概要
過剰な栄養素は、脂肪滴の中性脂質コア中のトリグリセリドの形で白色脂肪組織に貯蔵される。トリグリセリド貯蔵は、脂肪組織トリグリセリドリパーゼ(ATGL)、ホルモン感受性リパーゼ(HSL)、およびモノグリセリドリパーゼ(MGL)によって脂肪酸側鎖が順次切断され、遊離脂肪酸(FFA)およびグリセロール骨格が放出されるプロセスである脂肪分解を介して動員される1,2。脂肪分解は、脂肪組織のカテコールアミンシグナル伝達によって活性化されます。交感神経終末はカテコールアミンを局所的に放出し、カテコールアミンは脂肪細胞原形質膜上のβアドレナリン作動性受容体に結合する。リガンドが結合すると、これらのGタンパク質共役受容体(GPCR)はGαsを介してアデニリルシクラーゼを活性化します。その後のcAMPによるプロテインキナーゼA(PKA)の活性化は、ATGLおよびHSLの両方のアップレギュレーションをもたらす。PKAによるペリリピン-1のリン酸化は、ATGL3に結合して共活性化するABHD5(CGI-58としても知られる)の解離を引き起こす。PKAはHSLを直接リン酸化し、細胞質ゾルから脂肪滴への転座を促進し、リン酸化ペリリピン-1との相互作用によりリパーゼ活性がさらに促進されます4,5,6,7。脂肪分解に関与する3番目のリパーゼであるMGLは、カテコールアミンシグナル伝達によって調節されていないようです8。重要なことに、脂肪細胞におけるトリグリセリド合成は、中間体としてのモノグリセリドの形成を伴わないグリセロール脂質合成経路によって媒介される。代わりに、グリセロール-3-リン酸アシルトランスフェラーゼはリゾホスファチジン酸の形成を触媒し、リゾホスファチジン酸は別の脂肪酸アシルCoAと結合してホスファチジン酸を形成し、トリグリセリドの最終合成前にジグリセリドに異性化します(図1)9,10,11。

図1:脂肪分解とグリセロール脂質合成経路。 上:脂肪分解経路;赤で示されている酵素:脂肪組織トリグリセリドリドリパーゼ(ATGL)、ホルモン感受性リパーゼ(HSL)、およびモノグリセリドリパーゼ(MGL)。下:グリセロール脂質合成経路;緑色で示されている酵素:ジグリセリドアシルトランスフェラーゼ(DGAT)、ホスファチジン酸ホスファターゼ(PAP)、リゾホスファチジン酸アシルトランスフェラーゼ(LPAT、LPAATとしても知られています)、およびグリセロール-3-リン酸アシルトランスフェラーゼ(GPAT)。脂質:トリグリセリド(TG)、ジグリセリド(DG)、モノグリセリド(MG)、遊離脂肪酸(FFA)、脂肪酸アシルCoA(FA-CoA)、リゾホスファチジン酸(LPA)、およびホスファチジン酸(PA)。他の代謝産物:無機リン酸(Pi)およびグリセロール3-リン酸(G3P)。 この図の拡大版を表示するには、ここをクリックしてください。
細胞外アデノシンは脂肪分解のもう一つの重要な調節因子であり、GsおよびGi結合GPCRを介してアデニルシクラーゼ活性に影響を与えます。脂肪細胞における優勢なアデノシン受容体であるADORA1は、アデニリルシクラーゼを阻害し、したがってGi12の活性化を介して脂肪分解を阻害します。ADORA2Aは、より低いレベルで、主に褐色脂肪細胞で発現し、Gsシグナル伝達を介して脂肪分解を活性化します13。ADORA1は、基礎脂肪分解とアドレナリン作動薬に対する反応の両方に影響を与えます。.脂肪分解に対するアデノシンの効果は、アデノシンを中和するためのアデノシンデアミナーゼ、ならびにADORA1特異的アゴニストフェニルイソプロピルアデノシン14,15を添加することによって制御することができる。Gq結合GPCRのホルモン活性化は、ホスホリパーゼCおよびプロテインキナーゼC 16,17,18,19の活性化を介して脂肪分解にも影響を及ぼし得る。炎症シグナルも脂肪分解率に影響を与えます。LPS(および他のエンドトキシン)によるTLR4活性化は、ペリリピン-1およびHSL20をリン酸化するERKを活性化することにより、脂肪分解率を増加させる。TNF-αはまた、ERKおよびNF-κB活性化、ならびにホスホジエステラーゼPDE-3BおよびCIDEC21,22,23の転写ダウンレギュレーションを介して脂肪分解を活性化します。IL-6はまた、特に腸間膜脂肪組織における脂肪細胞脂肪分解の増加と関連しており、そのFFA放出は肝脂肪症および糖新生に影響を及ぼす24,25,26。
脂肪分解は、インスリンによって摂食状態の間に抑制される。AKTはPDE-3Bをリン酸化して活性化し、cAMPシグナル伝達を抑制し、PKA活性化を阻止します27。インスリンはまた、ATGL28を転写的にダウンレギュレートします。肥満は、脂肪細胞におけるβ-アドレナリン作動性受容体のダウンレギュレーションを含む様々なメカニズムを通じてカテコールアミン耐性を促進する29,30,31,32,33。脂肪細胞は、3つのβアドレナリン作動性受容体(β-1、β-2、およびβ-3)すべてを発現します。β-1およびβ-2アドレナリン受容体が遍在的に発現しているのに対し、β-3アドレナリン受容体は主にマウスの脂肪細胞で発現している34,35。Adrb3の発現は、脂肪生成中にC / EBPαによって誘導されます36。β-3アドレナリン受容体は成熟脂肪細胞で高度に発現しています。β-1およびβ-2アドレナリン作動性受容体の活性化は、β-アレスチン37によるフィードバック阻害による自己制限である。β-3アドレナリン作動性受容体のフィードバック阻害は、Adrb3発現を減少させる他のシグナル伝達経路によって媒介される33、38、39。
脂肪細胞の脂肪分解を活性化するために多数の化合物を使用することができる。カテコールアミンは、脂肪分解の主要な生理活性物質です。ノルエピネフリン(またはノルアドレナリン)およびエピネフリン(またはアドレナリン)は、3つのβアドレナリン受容体すべてを活性化する40。ノルエピネフリンおよびエピネフリンはまた、α-アドレナリン作動性受容体シグナル伝達 の活性化を介して 脂肪分解に影響を及ぼす41。一般的に使用されるβ-アドレナリン受容体アゴニストには、非選択的β-アドレナリン受容体アゴニストであるイソプロテレノール、ならびにβ-3アドレナリン受容体アゴニストCL-316,243およびミラベグロン42が含まれる。脂肪細胞が主にβ-3アドレナリン受容体を発現していることを考えると、ここでは例としてCL-316,243を使用します。β-3アドレナリン受容体に対するその特異性はまた、それを脂肪細胞カテコールアミンシグナル伝達の比較的特異的な活性化因子にし、それはまた、 in vivoで安全に使用することができる。細胞培養で一般的に使用される10 μM CL-316,243の濃度は、最大応答を達成するために必要な~0.1 μMの用量よりも桁違いに高いことに注意してください33。フォルスコリンはアドレナリン作動性受容体をバイパスし、アデニリルシクラーゼと下流の脂肪分解シグナル伝達を直接活性化します。脂肪分解の抑制剤と同様に、より多くの活性化剤があります。脂肪分解を刺激する化合物を選択する際には、受容体特異性と下流のシグナル伝達経路を実験デザイン内で慎重に検討する必要があります。
白色脂肪組織における脂肪分解の速度は、絶食または運動中の耐寒性と栄養素の利用可能性に影響を与える重要な代謝因子です43,44,45,46。このプロトコルの目的は、脂肪細胞と脂肪組織における脂肪分解の速度を測定することであり、脂肪細胞の代謝と、それがさまざまなマウスモデルの代謝表現型にどのように影響するかの理解を容易にします。脂肪分解率を定量化するために、培地中の脂肪分解生成物(すなわち、FFAおよびグリセロール)の出現を測定する。この方法は、脂肪細胞から培地への脂肪分解産物の放出に依存する。白色脂肪細胞は低レベルのグリセロールキナーゼを発現するので、グリセロール再取り込み率は低い47。逆に、脂肪分解以外の代謝経路によるFFAとグリセロールの生成も考慮する必要があります。脂肪細胞は、グリセロール-3リン酸に対する活性を有するホスファターゼを発現するようであり、グルコース48,49,50に由来するグリセロール-3-リン酸からのグリセロールの産生を可能にする。解糖系は、白色脂肪細胞のFFA再エステル化に使用されるグリセロール-3-リン酸の供給源です。グルコースレベルが制限されている場合、血糖新生には乳酸やピルビン酸などの他の3炭素源が必要です51。細胞内の脂肪分解によって放出されるFFAのチャネリングとその代謝運命はよくわかっていません。脂肪分解によって放出されたFFAは、再エステル化またはβ酸化を受ける前に、脂肪アシルCoAに変換する必要があります。脂肪分解によって放出されたFFAは、取り戻されて脂肪アシルCoAに変換される前に細胞から出る可能性が高いようです52,53,54,55,56,57,58,59,60,61,62 .FFAはアルブミンによって細胞外に隔離することができます。重要なことに、長鎖FFAは、アルブミン63,64,65,66,67によって隔離されていない場合、脂肪分解をフィードバック阻害することが知られています。したがって、脂肪分解アッセイ中の培地のFFA緩衝能を最適化することは極めて重要である。ここで説明する手順は、マウスおよびヒト由来の脂肪細胞およびex vivo脂肪組織における脂肪分解率を測定するために以前に公開された方法と同様である15、68、69、70、71。このプロトコルは、シリアルサンプリングの使用によって異なります。シリアルサンプリングを行うことで、脂肪分解が線形相で測定されていることを内部で検証し、複数の測定を利用して脂肪分解の速度を計算することで、測定誤差を減らし、最終的な計算値の信頼性を高めることができます。シリアルサンプリングの欠点は、アッセイにより多くの時間と試薬が必要になることです。ただし、時間枠が長いほど、レートの推定値の標準誤差に対する測定誤差の影響が減少します。さらに、このプロトコルは、FFAとグリセロールの両方の放出を測定し、完全な脂肪分解および培地72への脂肪分解生成物の放出から予想されるように、3:1の比率を達成することを目標にFFA:グリセロール放出の比率を考慮します。
プロトコル
すべての動物の使用は、コーネル大学のワイルコーネル医科大学の施設動物管理および使用委員会(IACUC)によって承認されました。
1. バッファーおよび回収プレートの調製
- フェノールレッドを含まないダルベッコ改変イーグル培地(DMEM)100 mLに5 gのBSAを溶解して、5%ウシ血清アルブミン(BSA)を作ります。BSAを静かにかき混ぜて溶解します(振とうは逆効果です)。BSAが完全に溶解したら、0.2 μmのフィルターで培地をフィルター滅菌します。BSA培地を4°Cで最長1ヶ月間保管します。
- 制御および刺激媒体の作業濃度を作ります。制御メディア:車両制御付き5%BSAメディア。刺激媒体:0.5 μM CL-316,243を含む5%BSA媒体。実験ごとに新鮮な刺激培地を作ります。
- 使用するメディアを37°Cに温めます。 培地収集用に96ウェルプレートにラベルを付けます。
2. サンプル調製
- 以下のように細胞培養を行う。外部汚染を最小限に抑えるために、滅菌ヒュームフード内のすべてのセル作業を行います。
- 73,74のように、初代前駆脂肪細胞を単離して分化させる。
- 初代脂肪前駆細胞を高密度でプレート化します(1 mL/ウェル培地(15%ウシ胎児血清(FBS)およびDMEM/F12中の1xペニシリン-ストレプトマイシン-グルタミン)の24ウェルプレートに1 x 105 細胞/ウェルなど)。
- 細胞が100%コンフルエントになったら、培養培地中で5 μMデキサメタゾン、0.5 mM 3-イソブチル-1-メチルキサンチン、1 μg/mLインスリン、および1 μMチアゾリジンジオン(TZD)で3日間分化させます。その後、1 μg/mLのインスリンを含む培地に少なくとも3日間交換して、脂肪滴を増殖させます。24ウェルプレートに1 mL/ウェルの培地を使用します。
- 培養培地(1 ml /ウェル)を2〜3日ごとにインスリンで交換します。細胞はインスリンを含む培地中で最大2週間維持することができる。分化率の低下は脂肪分解率の低下と誤解される可能性があるため、このアッセイでは分化率が90%を超え、グループ間で類似している培養のみを使用してください。
- 脂肪分解を測定する前に、インスリンフリー培地で細胞を24時間培養します。
注:培地中のインスリンは脂肪滴を維持しますが、脂肪分解も阻害します。インスリンなしで24時間インキュベーションすると、脂肪滴量を失うことなく完全な脂肪分解活性化が可能になります。一部のシステムでは、インスリンなしの培養時間を短縮または延長する必要がある場合があります。
- 細胞をDPBSで一度洗浄し、培地から残留血清を除去します。
注:このプロトコルには、脂肪分解を活性化する可能性のある血清飢餓は含まれていません。血清飢餓は、研究者の裁量で使用することができます。
- 73,74のように、初代前駆脂肪細胞を単離して分化させる。
- 下記のように 生体外 培養を行う。
- 各マウスから採取する組織ごとに1ウェルずつ、6ウェルプレートを準備します。使用する各ウェルに4 mLの室温DMEMを入れます。
注: 収集メディア内の BSA は必要ありません。 - 脂肪分解アッセイ用の48ウェルプレートを準備し、複製ごとに1ウェルを用意します。使用する各ウェルに400 μLの室温DMEMを入れます。マウス1匹あたり組織あたり2〜4個のコントロールウェルと2〜4個の刺激ウェルを使用します。
- マウスを麻酔下で頸部脱臼によって、両側気胸などの二次的な方法で安楽死させる。ここでは、32 gの生後7か月の雌C57BL / 6Jマウスを使用し、45%の高脂肪食を4か月間与えました。
注:このプロトコルは、男性だけでなく、他の株、食事、年齢にも使用できます。 - 70%エタノールをスプレーし、ハサミで腹部の皮膚中央を横方向に小さく(~1cm)切開し、親指と人差し指で両側をつまんで皮膚を引き離し、下腹部の皮膚を折りたたんで後皮下デポを露出させます。鼠径リンパ節を見つけて除去し、鉗子を使用して鼠径リンパ節のすぐ後方の鼠径脂肪組織を鈍く解剖します。
- 性腺脂肪組織を収集するには、腹膜を横方向および垂直方向に切開して腹膜腔にアクセスします。性腺脂肪パッドをピンセットで持ち、子宮(または男性の場合は精巣上体)に沿って切断して性腺脂肪組織を取り除きます。収集したデポを6ウェルプレートに入れます。
- ウェルからティッシュを取り出し、シリコンマットの上に置き、ハサミで5〜7mgの塊に切ります。
- アッセイウェルごとに25〜30 mg(5つまたは6つのチャンク)を計量し、48ウェルアッセイプレートに入れます。計量する前に、清潔なタオルでティッシュを拭き取ってメディアを取り除きます。組織を除去した後、重量ボートの重量を量り、残った残留物の重量を記録します。サンプル間でウェイトボートをきれいに拭き、必要に応じて風袋引きします。組織ごとに新しいウェイトボートを使用してください。
- すべての組織サンプルを秤量したら、48ウェルアッセイプレートを37°C、10%CO2 インキュベーターに15分間入れます。
- 各マウスから採取する組織ごとに1ウェルずつ、6ウェルプレートを準備します。使用する各ウェルに4 mLの室温DMEMを入れます。
3. 脂肪分解アッセイ
- メディアの収集を実行します。培地の移送とその後のサンプル収集を滅菌ヒュームフードで行い、外部ソースからの潜在的な汚染を最小限に抑えます。
- t = 0で、培地を除去し、コントロールまたは刺激培地のウェルあたり400 μLを添加し、アッセイプレートを37°C、10%CO2 インキュベーターに入れます。 ex vivo 組織培養の場合は、ピペットを使用して培地を慎重に除去します。吸引は絶対に使用しないでください。
注:または、制御および刺激媒体を備えた2番目のプレートを準備し、組織を移します。 - t = 1、2、3、および4時間で、200 μLの培地を収集し、200 μLの適切なコントロールまたは刺激培地と交換し、アッセイプレートをインキュベーターに戻します。回収プレートは4°Cで保管してください。 BSA メディアの FFA バッファリング容量を判別するには、24 時間後に追加のコレクションを使用します。
注:実験はここで停止でき、収集した培地は-20°Cで保存できます。
- t = 0で、培地を除去し、コントロールまたは刺激培地のウェルあたり400 μLを添加し、アッセイプレートを37°C、10%CO2 インキュベーターに入れます。 ex vivo 組織培養の場合は、ピペットを使用して培地を慎重に除去します。吸引は絶対に使用しないでください。
4. FFA比色アッセイ
- 試薬を室温に温め、カラー試薬A1本を溶剤A1本、カラー試薬Bボトル1本を溶剤Bボトル1本に溶解します。再構成日から、これらの試薬は1週間以内に使用するのが最適です。再構成後1ヶ月で廃棄する。
- サンプルを解凍して混合します。
- 遊離曲線を作成します。標準溶液は1mMです。最大範囲では、試薬に25 μL、20 μL、15 μL、10 μL、10 μL(1:2希釈)、10 μL(1:4希釈)、10 μL(1:8希釈)、および10 μLの水を使用します。FFAレベルが低い場合は、1 mM、0.8 mM、0.6 mM、0.4 mM、0.2 mM、0.1 mM、および0.05 mMの標準10 μLがより適用できる場合があります。
- ピペット標準物質とサンプルを96ウェルアッセイプレートに入れます。推奨サンプル量は10 μLです。 バックグラウンド補正用のサンプルと同じ量のBSA培地を含む3つのウェルを含めます。
注:サンプル濃度が標準曲線の範囲外にある場合は、サンプル量を2〜25μLに調整してアッセイを繰り返します。 - 150 μLの試薬Aを各ウェルに加え、混合します。気泡の発生を避けてください。細かいゲージの針で泡をポップします。アッセイプレートを37°Cで5分間インキュベートします。
- 550 nmおよび660 nmの基準でのプレートの吸光度を読み取ります(読み取りA)。
- 75 μLの試薬Bを各ウェルに加え、混合します。気泡の発生を避けてください。細かいゲージの針で泡をポップします。アッセイプレートを37°Cで5分間インキュベートします。
- 550 nmおよび660 nmの基準でプレートの吸光度を再度読み取ります(読み取り値B)。
5.グリセロール比色アッセイ
- 遊離グリセロール試薬を36mLの超純水で再構成し、室温に順応させます。これらの試薬は数週間以内に使用するのが最適です。再構成後2ヶ月で廃棄する。
- サンプルを解凍して混合します。
- グリセロール標準溶液と水ブランクの7点、2倍段階希釈を行うことにより、グリセロール標準曲線を作成します。
注:標準曲線は、2.8 mMグリセロールの25 μLまでは比較的直線的ですが、高濃度では線形ではありません。 - 標準およびサンプルのそれぞれ25 μLを96ウェルアッセイプレートにピペットで入れます。バックグラウンド補正のためにBSA培地に3つのウェルを含めます。
- 175 μLの遊離グリセロール試薬を各ウェルに加え、混合します。気泡の発生を避けてください。細かいゲージの針で泡をポップします。アッセイプレートを37°Cで5分間インキュベートします。
- 540 nmでのプレートの吸光度を読み取ります。
6. 脂肪分解率の計算
- 光学濃度(OD)値から始めます。グリセロールの場合、A540 OD値を直接使用します。以下の式に従ってFFAアッセイのODを計算します。
OD = (読み取り値 B: A 550 - A 660) - (読み取り値 A: A550 - A660) - 検量線を使用して、収集されたサンプルのFFAおよびグリセロールレベルを計算します。標準OD値をy軸にプロットし、x軸にはサンプル量に対する標準濃度を使用します(つまり、10 μLサンプルのプレート上の20 μLの1 mM FFA標準を含むウェルの濃度は2 mMに等しくなります)。線形近似曲線を当てはめる:
y = mx + b - 検量線を目視検査し、アッセイの直線範囲外の点を取り除きます。次の式を使用してサンプル濃度を計算します。
サンプル濃度: x = (外径 - b) ÷ m - 線形アッセイ範囲外のサンプルを調整して再アッセイします。最終サンプル濃度を取得するには、サンプルの濃度からBSA培地のみを含むバックグラウンドウェルの濃度を差し引きます。
- 次の式に従って、各時点で各サンプルによって生成されたFFAとグリセロールのモルを計算します。
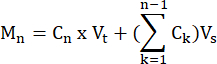
ここで、C n =時間t = nにおける濃度。Vt =ウェル内の総体積。Vs =サンプル収集量。Mn=時間t = nで生成されたモル(濃度がmMで容量がmLの場合、出力はμMolです)。
たとえば、さまざまな時点で:
M 1 = C1 × Vt
m 4 = C4 × Vt + (C1 + C2+ C3)Vs
又は
M 4 = C4 × Vt + C3 × V s + C2 × V s + C1 ×V s - 各サンプルの組織重量をグラム単位で割って組織重量に正規化し、μmol/gの単位を取得します。培養細胞の場合、値はμmol/ウェルとして提示されます。細胞数と分化効率がウェルからウェルに匹敵することを確認してください。
注:増殖または分化効率の違いは結果の解釈を複雑にし、別の正規化方法を必要とします(例:タンパク質への正規化;議論を参照)。 - 各サンプルについて、生成されたμmol/g(y軸)と時間(x軸)の傾きを個別に計算します。
- スプレッドシートでは、これは =SLOPE(known_ys,known_xs) 関数を使用して実行できます。新しいセルに「= SLOPE」と入力します(次に、カーソルを使用してサンプルグリセロールまたはFFA値をμmol / gで強調表示してから、対応する時間値を強調表示します)。
- データの線形性を確認します。R2 値は、サンプルの線形性を決定するための迅速な方法です。スプレッドシートでは、これは手順 6.7.1 で説明したのと同じ方法で =RSQ(known_ys,known_xs) 関数を使用して実行できますが、最初の入力は =RSQ です。R2 値が 0.98 >ていることを確認します。値が小さいほど、線形性からの偏差を示します。これは、測定/サンプリング誤差または直線性の損失に起因する可能性があります。
- 線形性を検定する別の方法は、各サンプルに対して線形回帰を実行し、残差をプロットすることです。統計解析ソフトウェアで、各時点の単一のY値を持つXYテーブルを生成します。単純線形回帰分析を選択し>OKをクリックする前に残差プロットのボックスを選択します。残差プロットが新しいグラフとして表示されます。
- 各サンプルのFFAとグリセロールの生成速度(つまり、傾き[(μmol / g / h]))を個々のデータポイントとして使用して統計分析を実行し、異なる脂肪分解条件が比較されている場合は値をプロットします。脂肪分解率が遺伝子型間で比較されている場合は、技術的な反復として動物ごとに2つまたは3つのサンプルを使用し、サンプルサイズが動物の数と等しくなるように、動物ごとに1つのデータポイントの平均を使用します。
結果
in vitro分化脂肪細胞の基礎脂肪分解率および刺激脂肪分解率を測定した。鼠径部白色脂肪組織由来の初代前駆脂肪細胞を、5 μMデキサメタゾン、0.5 mM IBMX、1 μg/mLインスリン、および1 μMトログリタゾンで4日間処理し、さらに1 μg/mLインスリンで3日間処理することにより脂肪細胞に分化させた。細胞を、脂肪分解アッセイの前にインスリンを含まない培地中で24時間インキュベートした。...
ディスカッション
ここでは、脂肪細胞およびex vivo脂肪組織における脂肪分解の速度を測定するための基本的なプロトコルを提供します。脂肪分解を定量化するためには、線形相における脂肪分解率を測定することが重要です。シリアルサンプリング技術を使用しており、メディアの大部分が収集され、定期的に新しいメディアに置き換えられます。この半保存的方法は、FFA緩衝能を有する新鮮なBSAの添...
開示事項
著者は開示するものは何もありません。
謝辞
この研究は、米国国立衛生研究所の助成金R01DK126944によってS.M.R.に支援されました。
資料
| Name | Company | Catalog Number | Comments |
| 24-Well tissue culture treated plate | Corning Inc | 3527 | Must be tissue culture treated for adipocyte differntiation |
| 48-Well flat bottom plate with lid | Corning Inc | 353078 | Can be tissue culture treated |
| 6-Well flat bottom plate with lid | Corning Inc | 353046 | Can be tissue culture treated |
| 96-Well PCR Plate | USA sceintific | 1402-9100 | Any conical 0.2 mL PCR plate will be convenient |
| Bovine Serum Albumin | Sigma Aldrich | A9418 | FFA free BSA such as A8806, is also commonly used. The BSA should not have detectable FFA, also lot to lot variations in BSA can impact the observed rate of lipolysis |
| CL-316,243 | Sigma Aldrich | C5976 | CAS #: 138908-40-4 availaible from other suppliers |
| CO2 incubator | PHCBI | MCO-170AICUVH | CO2 should ideally be set to 10% for adipose tissue, however 5% CO2 will also work |
| DMEM, low glucose, no phenol red | Thermofischer | 11054020 | Any phenol red free media should work, DMEM/F12, RPMI, but should contain volatile buffering capacity, i.e. biocarbonate |
| FFA-free Bovine serum albumin | Equitech-Bio, Inc, | BAH66 | |
| Free Glycerol Reagent | Sigma Aldrich | F6428 | |
| Glycerol Standard Solution | Sigma Aldrich | G7793 | This can also be made by diluting glycerol to the desired concentration |
| HR Series NEFA Standard Solution | Fujifilm | 276-76491 | |
| HR Series NEFA-HR (2) Color Reagent A | Fujifilm | 999-34691 | |
| HR Series NEFA-HR (2) Color Reagent B | Fujifilm | 991-34891 | |
| HR Series NEFA-HR (2) Solvent A | Fujifilm | 995-34791 | |
| HR Series NEFA-HR (2) Solvent B | Fujifilm | 993-35191 | |
| Microbiological Incubator | Fischer Scientific | S28668 | Any incubator at 37C can be used |
| Nunc MicroWell 96-Well Plates | Thermo Scientific | 269620 | Any optically clear, flat bottom 96-well plate works |
| Silicone Laboratory Benchtop Mat | VWR | 76045-300 | Glass plate can also be used. Absorbant surfaces are not recommended |
| Spectrophotometer/Microplate Reader | Molecular devices | SpectraMax i3x | Any plate reader that can read at 540, 550 and 660 mm will work |
| V Bovine serum albumin | Sigma-Aldrich | 810531 | |
| WypAll X70 Wipers | Kimberly-Clark | 41200 | Any high quality paper towel will work |
参考文献
- Vaughan, M., Berger, J. E., Steinberg, D. Hormone-sensitive lipase and monoglyceride lipase activities in adipose tissue. The Journal of Biological Chemistry. 239, 401-409 (1964).
- Zimmermann, R., et al. Fat mobilization in adipose tissue is promoted by adipose triglyceride lipase. Science. 306 (5700), 1383-1386 (2004).
- Lass, A., et al. Adipose triglyceride lipase-mediated lipolysis of cellular fat stores is activated by CGI-58 and defective in Chanarin-Dorfman syndrome. Cell Metabolism. 3 (5), 309-319 (2006).
- Stralfors, P., Bjorgell, P., Belfrage, P. Hormonal regulation of hormone-sensitive lipase in intact adipocytes: identification of phosphorylated sites and effects on the phosphorylation by lipolytic hormones and insulin. Proceedings of the National Academy of Sciences. 81 (11), 3317-3321 (1984).
- Miyoshi, H., et al. Perilipin promotes hormone-sensitive lipase-mediated adipocyte lipolysis via phosphorylation-dependent and -independent mechanisms. The Journal of Biological Chemistry. 281 (23), 15837-15844 (2006).
- Sztalryd, C., et al. Perilipin A is essential for the translocation of hormone-sensitive lipase during lipolytic activation. The Journal of Cell Biology. 161 (6), 1093-1103 (2003).
- Lafontan, M., Langin, D. Lipolysis and lipid mobilization in human adipose tissue. Progress in Lipid Research. 48 (5), 275-297 (2009).
- Grabner, G. F., Xie, H., Schweiger, M., Zechner, R. Lipolysis: cellular mechanisms for lipid mobilization from fat stores. Nature Metabolism. 3 (11), 1445-1465 (2021).
- Weiss, S. B., Kennedy, E. P., Kiyasu, J. Y. The enzymatic synthesis of triglycerides. The Journal of Biological Chemistry. 235, 40-44 (1960).
- Kennedy, E. P. Biosynthesis of complex lipids. Federation Proceedings. 20, 934-940 (1961).
- Wendel, A. A., Lewin, T. M., Coleman, R. A. Glycerol-3-phosphate acyltransferases: rate limiting enzymes of triacylglycerol biosynthesis. Biochimica et Biophysica Acta. 1791 (6), 501-506 (2009).
- Johansson, S. M., Lindgren, E., Yang, J. N., Herling, A. W., Fredholm, B. B. Adenosine A1 receptors regulate lipolysis and lipogenesis in mouse adipose tissue-interactions with insulin. European Journal of Pharmacology. 597 (1-3), 92-101 (2008).
- Gnad, T., et al. Adenosine activates brown adipose tissue and recruits beige adipocytes via A2A receptors. Nature. 516 (7531), 395-399 (2014).
- Fried, S. K., et al. Resistance to the antilipolytic effect of insulin in adipocytes of African-American compared to Caucasian postmenopausal women. Journal of Lipid Research. 51 (5), 1193-1200 (2010).
- Lee, M. J., Fried, S. K. Optimal protocol for the differentiation and metabolic analysis of human adipose stromal cells. Methods in Enzymology. 538, 49-65 (2014).
- Fricke, K., Heitland, A., Maronde, E. Cooperative activation of lipolysis by protein kinase A and protein kinase C pathways in 3T3-L1 adipocytes. Endocrinology. 145 (11), 4940-4947 (2004).
- Bergan, H. E., Kittilson, J. D., Sheridan, M. A. PKC and ERK mediate GH-stimulated lipolysis. Journal of Molecular Endocrinology. 51 (2), 213-224 (2013).
- Schmitz-Peiffer, C. The tail wagging the dog--regulation of lipid metabolism by protein kinase C. The FEBS Journal. 280 (21), 5371-5383 (2013).
- Carmen, G. Y., Victor, S. M. Signalling mechanisms regulating lipolysis. Cellular Signalling. 18 (4), 401-408 (2006).
- Zu, L., et al. Bacterial endotoxin stimulates adipose lipolysis via toll-like receptor 4 and extracellular signal-regulated kinase pathway. The Journal of Biological Chemistry. 284 (9), 5915-5926 (2009).
- Zhang, H. H., Halbleib, M., Ahmad, F., Manganiello, V. C., Greenberg, A. S. Tumor necrosis factor-alpha stimulates lipolysis in differentiated human adipocytes through activation of extracellular signal-related kinase and elevation of intracellular cAMP. Diabetes. 51 (10), 2929-2935 (2002).
- Tan, X., et al. TNF-α downregulates CIDEC via MEK/ERK pathway in human adipocytes. Obesity. 24 (5), 1070-1080 (2016).
- Laurencikiene, J., et al. NF-kappaB is important for TNF-alpha-induced lipolysis in human adipocytes. Journal of Lipid Research. 48 (5), 1069-1077 (2007).
- van Hall, G., et al. Interleukin-6 stimulates lipolysis and fat oxidation in humans. The Journal of Clinical Endocrinology and Metabolism. 88 (7), 3005-3010 (2003).
- Wueest, S., et al. Mesenteric fat lipolysis mediates obesity-associated hepatic steatosis and insulin resistance. Diabetes. 65 (1), 140-148 (2016).
- Trujillo, M. E., et al. Interleukin-6 regulates human adipose tissue lipid metabolism and leptin production in vitro. The Journal of Clinical Endocrinology and Metabolism. 89 (11), 5577-5582 (2004).
- Kitamura, T., et al. Insulin-induced phosphorylation and activation of cyclic nucleotide phosphodiesterase 3B by the serine-threonine kinase Akt. Molecular and Cellular Biology. 19 (9), 6286-6296 (1999).
- Chakrabarti, P., et al. Insulin inhibits lipolysis in adipocytes via the evolutionarily conserved mTORC1-Egr1-ATGL-mediated pathway. Molecular and Cellular Biology. 33 (18), 3659-3666 (2013).
- Collins, S., Daniel, K. W., Petro, A. E., Surwit, R. S. Strain-specific response to beta 3-adrenergic receptor agonist treatment of diet-induced obesity in mice. Endocrinology. 138 (1), 405-413 (1997).
- Surwit, R. S., Dixon, T. M., Petro, A. E., Daniel, K. W., Collins, S. Diazoxide restores beta3-adrenergic receptor function in diet-induced obesity and diabetes. Endocrinology. 141 (10), 3630-3637 (2000).
- Gettys, T. W., et al. Age-dependent changes in beta-adrenergic receptor subtypes and adenylyl cyclase activation in adipocytes from Fischer 344 rats. Endocrinology. 136 (5), 2022-2032 (1995).
- Mowers, J., et al. Inflammation produces catecholamine resistance in obesity via activation of PDE3B by the protein kinases IKKε and TBK1. eLife. 2, e01119 (2013).
- Valentine, J. M., et al. β3-Adrenergic receptor downregulation leads to adipocyte catecholamine resistance in obesity. The Journal of Clinical Investigation. 132 (2), e153357 (2022).
- Collins, S., et al. Impaired expression and functional activity of the beta 3- and beta 1-adrenergic receptors in adipose tissue of congenitally obese (C57BL/6J ob/ob) mice. Molecular Endocrinology. 8 (4), 518-527 (1994).
- Collins, S., Surwit, R. S. The beta-adrenergic receptors and the control of adipose tissue metabolism and thermogenesis. Recent Progress in Hormone Research. 56, 309-328 (2001).
- Dixon, T. M., Daniel, K. W., Farmer, S. R., Collins, S. CCAAT/enhancer-binding protein alpha is required for transcription of the beta 3-adrenergic receptor gene during adipogenesis. The Journal of Biological Chemistry. 276 (1), 722-728 (2001).
- Lohse, M. J., Benovic, J. L., Codina, J., Caron, M. G., Lefkowitz, R. J. beta-Arrestin: a protein that regulates beta-adrenergic receptor function. Science. 248 (4962), 1547-1550 (1990).
- Nantel, F., et al. The human beta 3-adrenergic receptor is resistant to short term agonist-promoted desensitization. Molecular Pharmacology. 43 (4), 548-555 (1993).
- Liggett, S. B., Freedman, N. J., Schwinn, D. A., Lefkowitz, R. J. Structural basis for receptor subtype-specific regulation revealed by a chimeric beta 3/beta 2-adrenergic receptor. Proceedings of the National Academy of Sciences. 90 (8), 3665-3669 (1993).
- Baker, J. G. The selectivity of beta-adrenoceptor agonists at human beta1-, beta2- and beta3-adrenoceptors. British Journal of Pharmacology. 160 (5), 1048-1061 (2010).
- Lafontan, M. Inhibition of epinephrine-induced lipolysis in isolated white adipocytes of aging rabbits by increased alpha-adrenergic responsiveness. Journal of Lipid Research. 20 (2), 208-216 (1979).
- Baker, J. G. The selectivity of beta-adrenoceptor antagonists at the human beta1, beta2 and beta3 adrenoceptors. British Journal of Pharmacology. 144 (3), 317-322 (2005).
- Jensen, M. D., Nielsen, S. Insulin dose response analysis of free fatty acid kinetics. Metabolism. 56 (1), 68-76 (2007).
- Jensen, M. D., Haymond, M. W., Gerich, J. E., Cryer, P. E., Miles, J. M. Lipolysis during fasting. Decreased suppression by insulin and increased stimulation by epinephrine. The Journal of Clinical Investigation. 79 (1), 207-213 (1987).
- Heckmann, B. L., et al. Defective adipose lipolysis and altered global energy metabolism in mice with adipose overexpression of the lipolytic inhibitor G0/G1 switch gene 2 (G0S2). The Journal of Biological Chemistry. 289 (4), 1905-1916 (2014).
- Shin, H., et al. Lipolysis in brown adipocytes is not essential for cold-induced thermogenesis in mice. Cell Metabolism. 26 (5), 764.e5-777.e5 (2017).
- Treble, D. H., Mayer, J. Glycerolkinase activity in white adipose tissue of obese-hyperglycaemic mice. Nature. 200, 363-364 (1963).
- Possik, E., et al. New mammalian glycerol-3-phosphate phosphatase: role in beta-cell, liver and adipocyte metabolism. Frontiers in Endocrinology. 12, 706607 (2021).
- Romero Mdel, M., Sabater, D., Fernandez-Lopez, J. A., Remesar, X., Alemany, M. Glycerol production from glucose and fructose by 3T3-L1 cells: a mechanism of adipocyte defense from excess substrate. PLoS One. 10 (10), e0139502 (2015).
- Mugabo, Y., et al. Identification of a mammalian glycerol-3-phosphate phosphatase: Role in metabolism and signaling in pancreatic beta-cells and hepatocytes. Proceedings of the National Academy of Sciences. 113 (4), E430-E439 (2016).
- Hanson, R. W., Reshef, L. Glyceroneogenesis revisited. Biochimie. 85 (12), 1199-1205 (2003).
- Vaughan, M. The production and release of glycerol by adipose tissue incubated in vitro. The Journal of Biological Chemistry. 237, 3354-3358 (1962).
- Jensen, M. D., Ekberg, K., Landau, B. R. Lipid metabolism during fasting. American Journal of Physiology-Endocrinology and Metabolism. 281 (4), E789-E793 (2001).
- Ballard, F. J., Hanson, R. W., Leveille, G. A. Phosphoenolpyruvate carboxykinase and the synthesis of glyceride-glycerol from pyruvate in adipose tissue. The Journal of Biological Chemistry. 242 (11), 2746-2750 (1967).
- Reshef, L., Hanson, R. W., Ballard, F. J. A possible physiological role for glyceroneogenesis in rat adipose tissue. The Journal of Biological Chemistry. 245 (22), 5979-5984 (1970).
- Gorin, E., Tal-Or, Z., Shafrir, E. Glyceroneogenesis in adipose tissue of fasted, diabetic and triamcinolone treated rats. European Journal of Biochemistry. 8 (3), 370-375 (1969).
- Elia, M., Zed, C., Neale, G., Livesey, G. The energy cost of triglyceride-fatty acid recycling in nonobese subjects after an overnight fast and four days of starvation. Metabolism. 36 (3), 251-255 (1987).
- Reshef, L., et al. Glyceroneogenesis and the triglyceride/fatty acid cycle. Journal of Biological Chemistry. 278 (33), 30413-30416 (2003).
- Edens, N. K., Leibel, R. L., Hirsch, J. Mechanism of free fatty acid re-esterification in human adipocytes in vitro. Journal of Lipid Research. 31 (8), 1423-1431 (1990).
- Vaughan, M., Steinberg, D. Effect of hormones on lipolysis and esterification of free fatty acids during incubation of adipose tissue in vitro. Journal of Lipid Research. 4, 193-199 (1963).
- Brooks, B., Arch, J. R., Newsholme, E. A. Effects of hormones on the rate of the triacylglycerol/fatty acid substrate cycle in adipocytes and epididymal fat pads. Federation of European Biochemical Societies Letters. 146 (2), 327-330 (1982).
- Bjorntorp, P., Karlsson, M., Hovden, A. Quantitative aspects of lipolysis and reesterification in human adipose tissue in vitro. Acta Medica Scandinavica. 185 (1-2), 89-97 (1969).
- Angel, A., Desai, K., Halperin, M. L. Free fatty acid and ATP levels in adipocytes during lipolysis. Metabolism. 20 (1), 87-99 (1971).
- Husted, A. S., et al. Autocrine negative feedback regulation of lipolysis through sensing of NEFAs by FFAR4/GPR120 in WAT. Molecular Metabolism. 42, 101103 (2020).
- Fain, J. N., Shepherd, R. E. Free fatty acids as feedback regulators of adenylate cyclase and cyclic 3':5'-AMP accumulation in rat fat cells. The Journal of Biological Chemistry. 250 (16), 6586-6592 (1975).
- Burns, T. W., Langley, P. E., Terry, B. E., Robinson, G. A. The role of free fatty acids in the regulation of lipolysis by human adipose tissue cells. Metabolism. 27 (12), 1755-1762 (1978).
- Kalderon, B., et al. Suppression of adipose lipolysis by long-chain fatty acid analogs. Journal of Lipid Research. 53 (5), 868-878 (2012).
- Schweiger, M., et al. Measurement of lipolysis. Methods in Enzymology. 538, 171-193 (2014).
- Decaunes, P., Bouloumie, A., Ryden, M., Galitzky, J. Ex vivo analysis of lipolysis in human subcutaneous adipose tissue explants. Bio-Protocol. 8 (3), e2711 (2018).
- Roy, D., Myers, J. M., Tedeschi, A. Protocol for assessing ex vivo lipolysis of murine adipose tissue. STAR Protocols. 3 (3), 101518 (2022).
- Baskaran, P., Thyagarajan, B. Measurement of basal and forskolin-stimulated lipolysis in inguinal adipose fat pads. Journal of Visualized Experiments. 125 (125), 55625 (2017).
- Reilly, S. M., et al. Catecholamines suppress fatty acid re-esterification and increase oxidation in white adipocytes via STAT3. Nature Metabolism. 2 (7), 620-634 (2020).
- Liu, L., et al. Isolation of mouse stromal vascular cells for monolayer culture. Methods in Molecular Biology. 1566, 9-16 (2017).
- DeLuca, J. H., Reilly, S. M. . Methods in Molecular Biology. , (2023).
- Richard, G., Vernon, R. A. C. New Perspectives in Adipose Tissue. Butterworth-Heinemann. , (1985).
- Brito, M. N., Botion, L. M., Brito, N. A., Kettelhut, I. C., Migliorini, R. H. Lipolysis and glycerokinase activity in brown adipose tissue of rat fed a high protein, carbohydrate-free diet. Hormone and Metabolic Research. 26 (1), 51-52 (1994).
- Bertin, R. Glycerokinase activity and lipolysis regulation in brown adipose tissue of cold acclimated rats. Biochimie. 58 (4), 431-434 (1976).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved