JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
생체 외 쥐 지방 조직 및 in vitro에서 분화된 1차 지방전구세포에서 지방분해 속도 측정
요약
지방 세포에서 트리글리세라이드 지방 분해는 유리 지방산과 글리세롤의 유리를 초래하는 중요한 대사 과정입니다. 여기에서 우리는 생쥐의 지방 세포 및 생체 외 지방 조직에서 기저 및 자극 지방 분해를 측정하기 위한 자세한 프로토콜을 제공합니다.
초록
지방 세포는 지질 방울에 트리글리세리드 형태로 에너지를 저장합니다. 이 에너지는 지방산 측쇄가 글리세롤 골격에서 순차적으로 절단되어 유리 지방산과 글리세롤이 방출되는 지방 분해를 통해 동원될 수 있습니다. 백색 지방세포에서 글리세롤 키나아제의 낮은 발현으로 인해, 글리세롤 재흡수율은 무시할 수 있는 반면, 지방산 재흡수율은 알부민과 같은 배지 성분의 지방산 결합 능력에 의해 결정된다. 글리세롤과 배지로의 지방산 방출은 모두 지방 분해 속도를 결정하기 위해 비색 분석으로 정량화할 수 있습니다. 여러 시점에서 이러한 요인을 측정함으로써 높은 신뢰도로 지방 분해의 선형 속도를 결정할 수 있습니다. 여기에서 우리는 마우스의 시험 관 내 분화된 지방 세포 및 생체 외 지방 조직에서 지방 분해를 측정하기 위한 자세한 프로토콜을 제공합니다. 이 프로토콜은 또한 다른 지방전구세포 세포주 또는 다른 유기체의 지방 조직에 대해 최적화될 수 있습니다. 고려 사항 및 최적화 매개변수에 대해 설명합니다. 이 프로토콜은 마우스 모델과 치료 사이의 지방 세포 지방 분해 속도를 결정하고 비교하는 데 유용하도록 설계되었습니다.
서문
과잉 영양소는 지질 방울의 중성 지질 코어에서 트리글리세리드 형태로 백색 지방 조직에 저장됩니다. 트리글리세리드 저장은 지방 분해를 통해 동원되며, 지방 조직 트리글리세리드 리파아제(ATGL), 호르몬 민감성 리파아제(HSL) 및 모노글리세리드 리파아제(MGL)에 의해 지방산 측쇄가 순차적으로 절단되어 유리 지방산(FFA)과 글리세롤 골격 1,2. 지방 분해는 지방 조직에서 카테콜아민 신호 전달에 의해 활성화됩니다. 교감 신경 말단은 지방 세포 원형질막의 β-아드레날린 수용체에 결합하는 카테콜아민을 국소적으로 방출합니다. 리간드 결합 시, 이러한 G-단백질 결합 수용체(GPCR)는 Gαs를 통해 아데닐릴 시클라제를 활성화합니다. cAMP에 의한 단백질 키나아제 A (PKA)의 후속 활성화는 ATGL 및 HSL 모두의 상향 조절을 초래한다. PKA에 의한 페리핀-1의 인산화는 ATGL3에 결합하고 공동 활성화하는 ABHD5(CGI-58이라고도 함)의 해리를 유발합니다. PKA는 HSL을 직접 인산화하여 세포질에서 지질 방울로의 전좌를 촉진하며, 여기서 인산화된 페리핀-1과의 상호작용은 리파아제 활성을 더욱 촉진합니다 4,5,6,7. 지방분해에 관여하는 세 번째 리파아제인 MGL은 카테콜아민 신호전달에 의해 조절되지 않는 것으로 보인다8. 중요하게도, 지방 세포에서의 트리글리세리드 합성은 글리세롤 지질 합성 경로에 의해 매개되며, 이는 중간체로서 모노글리세리드의 형성을 포함하지 않습니다. 대신, 글리세롤-3-포스페이트 아실 트랜스퍼라제는 리소포스파티드산의 형성을 촉매하며, 이는 다른 지방 아실-CoA와 결합하여 포스파티드산을 형성한 다음 트리글리세리드의 최종 합성 전에 디글리세리드로 이성질화됩니다(그림 1)9,10,11.

그림 1: 지방 분해 및 글리세롤 지질 합성 경로. 상단: 지질 경로; 빨간색으로 표시된 효소: 지방 조직 트리글리세리드 리파아제(ATGL), 호르몬 민감성 리파아제(HSL) 및 모노글리세리드 리파아제(MGL). 바닥: 글리세롤 지질 합성 경로; 녹색으로 표시된 효소: 디글리세리드 아실트랜스퍼라제(DGAT), 포스파티드산 포스파타제(PAP), 리소포스파티드산 아실트랜스퍼라제(LPAT, LPAAT라고도 함) 및 글리세롤-3-포스페이트 아실트랜스퍼라제(GPAT). 지질: 트리글리세리드(TG), 디글리세리드(DG), 모노글리세리드(MG), 유리 지방산(FFA), 지방 아실-CoA(FA-CoA), 리소포스파티드산(LPA) 및 포스파티드산(PA). 기타 대사 산물 : 무기 인산염 (Pi) 및 글리세롤 3- 인산염 (G3P). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
세포외 아데노신은 지방 분해의 또 다른 중요한 조절자이며, Gs- 및 Gi 결합 GPCR을 통해 작용하여 아데닐 시클라제 활성에 영향을 미칩니다. 지방세포에서 우세한 아데노신 수용체인 ADORA1은 아데닐릴 시클라제를 억제하고, 따라서 Gi12의 활성화를 통해 지방 분해를 억제한다. 낮은 수준에서, 주로 갈색 지방세포에서 발현되는 ADORA2A는 Gs 신호전달13을 통해 지방분해를 활성화한다. ADORA1은 기저 지방 분해와 아드레날린 작용제에 대한 반응 모두에 영향을 미칩니다. 지방 분해에 대한 아데노신의 효과는 아데노신을 중화시키기 위해 아데노신 데아미나제와 ADORA1 특이적 작용제인 페닐이소프로필아데노신14,15를 첨가하여 조절할 수 있습니다. Gq-결합 GPCR의 호르몬 활성화는 또한 포스포리파제 C 및 단백질 키나아제 C16,17,18,19의 활성화를 통해 지방 분해에 영향을 미칠 수 있습니다. 염증 신호는 또한 지방 분해 속도에 영향을 미칩니다. LPS(및 기타 내독소)에 의한 TLR4 활성화는 페리핀-1 및 HSL20을 인산화하는 ERK를 활성화하여 지방 분해율을 증가시킵니다. TNF-α는 또한 ERK 및 NF-κB 활성화뿐만 아니라 포스포디에스테라제 PDE-3B 및 CIDEC21,22,23의 전사 하향 조절을 통해 지방 분해를 활성화합니다. IL-6는 또한 특히 장간막 지방 조직에서 증가된 지방세포 지방 분해와 관련이 있으며, 그의 FFA 방출은 간 지방증 및 포도당 생성에 영향을 미친다24,25,26.
지방 분해는 인슐린에 의해 섭식 상태 동안 억제됩니다. AKT는 PDE-3B를 인산화하고 활성화시켜 cAMP 신호전달을 억제하고 PKA 활성화를 방지한다27. 인슐린은 또한 전사적으로 ATGL28을 하향 조절합니다. 비만은 지방 세포에서 β-아드레날린 수용체의 하향 조절을 포함하여 다양한 메커니즘을 통해 카테콜아민 내성을 촉진합니다 29,30,31,32,33. 지방 세포는 세 가지 β-아드레날린 수용체(β-1, β-2 및 β-3)를 모두 발현합니다. β-1 및 β-2 아드레날린 수용체가 유비쿼터스하게 발현되는 반면, β-3 아드레날린 수용체는 마우스34,35의 지방 세포에서 우세하게 발현됩니다. Adrb3 발현은 지방 생성 동안 C/EBPα에 의해 유도됩니다36. β-3 아드레날린 수용체는 성숙한 지방 세포에서 고도로 발현됩니다. β-1 및 β-2 아드레날린 수용체의 활성화는 β-arrestin37에 의한 피드백 억제로 인해 자가 제한적입니다. β-3 아드레날린 수용체의 피드백 억제는 Adrb3 발현을 감소시키는 다른 신호 전달 경로에 의해 매개됩니다33,38,39.
지방 세포 지방 분해를 활성화하기 위해 수많은 화합물을 사용할 수 있습니다. 카테콜아민은 지방 분해의 주요 생리학적 활성제입니다. 노르에피네프린(노르아드레날린)과 에피네프린(또는 아드레날린)은 세 가지 β-아드레날린 수용체를 모두 활성화시킨다40. 노르에피네프린과 에피네프린은 또한 α-아드레날린 수용체 신호 전달의 활성화 를 통해 지방 분해에 영향을 미칩니다41. 통상적으로 사용되는 β-아드레날린 수용체 작용제는 비선택적 β-아드레날린 수용체 작용제인 이소프로테레놀, 및 β-3 아드레날린 수용체 작용제 CL-316,243 및 미라베그론42를 포함한다. 지방 세포가 주로 β-3 아드레날린 수용체를 발현한다는 점을 감안할 때 여기서는 CL-316,243을 예로 사용합니다. β-3 아드레날린 수용체에 대한 특이성은 또한 생체 내에서도 안전하게 사용할 수 있는 지방 세포 카테콜아민 신호 전달의 비교적 특이적인 활성화제입니다. 세포 배양에서 일반적으로 사용되는 10 μM CL-316,243 농도는 최대 반응33을 달성하는 데 필요한 ~0.1 μM 용량보다 훨씬 더 높다는 점에 유의하십시오. 포스콜린은 아드레날린 수용체를 우회하여 아데닐릴 시클라제와 다운스트림 지방 분해 신호를 직접 활성화합니다. 지방 분해의 억제 인자뿐만 아니라 더 많은 활성제가 있습니다. 지방 분해를 자극하는 화합물을 선택할 때 수용체 특이성과 다운스트림 신호 전달 경로를 실험 설계 내에서 신중하게 고려해야 합니다.
백색 지방 조직의 지방 분해 속도는 단식 또는 운동 중 내한성 및 영양소 가용성에 영향을 미치는 중요한 대사 인자입니다43,44,45,46. 이 프로토콜의 목적은 지방 세포 및 지방 조직의 지방 분해 속도를 측정하는 것이며, 이는 지방 세포 대사에 대한 이해와 다양한 쥐 모델의 대사 표현형에 어떤 영향을 미칠 수 있는지에 대한 이해를 용이하게 합니다. 지방 분해 비율을 정량화하기 위해 우리는 배지(즉, FFA 및 글리세롤)에서 지방 분해 제품의 모양을 측정합니다. 이 방법은 지방 세포에서 배지로 지방 분해 생성물의 방출에 의존합니다. 백색 지방세포는 낮은 수준의 글리세롤 키나아제를 발현하기 때문에 글리세롤 재흡수율은 낮다(47). 반대로, 지방 분해 이외의 대사 경로에 의한 FFA 및 글리세롤의 생산도 고려해야 합니다. 지방세포는 글리세롤-3 포스페이트에 대해 활성을 갖는 포스파타제를 발현하는 것으로 보이며, 글루코스48,49,50으로부터 유래된 글리세롤-3-포스페이트로부터 글리세롤의 생산을 가능하게 한다. 해당과정은 백색 지방세포에서 FFA 재에스테르화에 사용되는 글리세롤-3-포스페이트의 공급원입니다. 포도당 수치가 제한되면 글리세로신생성에는 젖산 및 피루브산51과 같은 다른 3-탄소원이 필요합니다. 세포 내 지방 분해에 의해 방출되는 FFA의 채널링과 그 대사 운명은 잘 알려져 있지 않습니다. 지방 분해에 의해 방출된 FFA는 재에스테르화되거나 β산화되기 전에 지방 아실-CoA로 전환되어야 합니다. 지방 분해에 의해 방출된 FFA는 다시 흡수되어 지방 아실-CoA 52,53,54,55,56,57,58,59,60,61,62로 전환되기 전에 세포를 빠져나갈 가능성이 있는 것으로 보입니다. FFA는 알부민에 의해 세포 외부로 격리될 수 있습니다. 중요하게도, 장쇄 FFA는 알부민 63,64,65,66,67에 의해 격리되지 않는 경우 피드백 억제 지방 분해를 억제하는 것으로 알려져 있습니다. 따라서 지방 분해 분석 동안 배지의 FFA 완충 용량을 최적화하는 것이 중요합니다. 여기에 기술된 절차는 마우스 및 인간 15,68,69,70,71로부터의 지방세포 및 생체외 지방 조직에서의 지방 분해율을 측정하기 위해 이전에 발표된 방법과 유사하다. 이 프로토콜은 직렬 샘플링을 사용하여 다릅니다. 직렬 샘플링을 수행함으로써 지방 분해가 선형 위상으로 측정되고 있음을 내부적으로 검증하고 여러 측정을 활용하여 지방 분해 속도를 계산함으로써 측정 오류를 줄여 최종 계산된 값에 대한 신뢰도를 높일 수 있습니다. 연속 샘플링의 단점은 분석에 더 많은 시간과 시약이 필요하다는 것입니다. 그러나 기간이 길수록 측정 오차가 비율 추정치의 표준 오차에 미치는 영향이 줄어듭니다. 부가적으로, 이 프로토콜은 FFA 및 글리세롤 방출 둘 다를 측정하고, 완전한 지방분해 및 배지 내로의 지방분해 생성물의 방출로부터 예상될 수 있는 바와 같이, 3:1 비율을 달성하는 것을 목표로 FFA:글리세롤 방출의 비율을 고려한다(72).
프로토콜
모든 동물의 사용은 코넬 대학교 웨일 코넬 의과 대학의 기관 동물 관리 및 사용위원회 (IACUC)에 의해 승인되었습니다.
1. 완충액 및 수집 플레이트의 준비
- 페놀 레드가 없는 Dulbecco's modified Eagle's medium(DMEM) 100mL에 BSA 5g을 용해시켜 5% 소혈청알부민(BSA)을 만듭니다. BSA를 부드럽게 저어 용해시킵니다(흔들면 비생산적입니다). BSA가 완전히 용해되면 0.2μm 필터로 매체를 필터 멸균합니다. BSA 배지를 4°C에서 최대 1개월 동안 보관합니다.
- 제어 및 자극 매체의 작동 농도를 확인하십시오. 제어 매체: 차량 제어 기능이 있는 5% BSA 매체. 자극 매체: 0.5μM CL-316,243을 사용한 5% BSA 매체. 각 실험에 대해 새로운 자극 매체를 만드십시오.
- 사용할 미디어를 37°C로 가온합니다. 배지 수집을 위해 96웰 플레이트에 라벨을 붙입니다.
2. 시료 전처리
- 아래에 설명된 대로 세포 배양을 수행합니다. 외부 오염을 최소화하기 위해 멸균 흄 후드에서 모든 셀 작업을 수행합니다.
- 73,74에서와 같이 1차 지방전구세포를 분리하고 분화합니다.
- 1mL/웰 배양 배지(DMEM/F12의 15% 소 태아 혈청(FBS) 및 1x 페니실린-스트렙토마이신-글루타민)의 24웰 플레이트에서 1 x 105 세포/웰과 같은 고밀도의 1차 지방전구세포 플레이트.
- 세포가 100% 밀도에 도달한 후 5μM 덱사메타손, 0.5mM 3-이소부틸-1-메틸크산틴, 1μg/mL 인슐린 및 1μM 티아졸리딘디온(TZD)으로 3일 동안 배양 배지에서 분화합니다. 그런 다음 최소 3일 동안 1μg/mL 인슐린으로 배양 배지로 변경하여 지질 방울을 성장시킵니다. 24웰 플레이트에 1mL/웰의 배지를 사용합니다.
- 배양 배지(1ml/웰)를 2-3일마다 인슐린으로 교체합니다. 세포는 최대 2주 동안 인슐린과 함께 배지에서 유지될 수 있습니다. 분화율이 90% 이상이고 이 분석에는 분화율이 감소하면 지방 분해율의 감소로 잘못 해석될 수 있으므로 그룹 간에 유사한 배양물만 사용하십시오.
- 지방 분해를 측정하기 전에 인슐린 없는 배지에서 24시간 동안 세포를 배양합니다.
참고: 배지의 인슐린은 지질 방울을 유지하지만 지방 분해도 억제합니다. 24시간 동안 인슐린 없이 배양하면 지질 액적 부피의 손실 없이 완전한 지방 분해 활성화가 가능합니다. 일부 시스템에서는 인슐린이 없는 배양 시간을 단축하거나 연장해야 할 수 있습니다.
- 세포를 DPBS로 한번 세척하여 배양 배지로부터 잔류 혈청을 제거한다.
참고: 이 프로토콜에는 지방 분해를 활성화할 수 있는 혈청 기아가 포함되지 않습니다. 혈청 기아는 연구자의 재량에 따라 사용될 수 있습니다.
- 73,74에서와 같이 1차 지방전구세포를 분리하고 분화합니다.
- 아래에 설명된 대로 생체 외 배양을 수행합니다.
- 각 마우스에서 채취 할 각 조직에 대해 하나의 웰을 갖는 6 웰 플레이트를 준비한다. 사용할 각 웰에 4mL의 실온 DMEM을 넣습니다.
참고: 수집 매체의 BSA는 필요하지 않습니다. - 지방 분해 분석을 위해 48웰 플레이트를 준비하고, 각 복제물에 대해 하나의 웰을 사용합니다. 사용할 각 웰에 400μL의 실온 DMEM을 넣습니다. 마우스당 조직당 2-4개의 대조군과 2-4개의 자극된 웰을 사용합니다.
- 마취 하에 자궁경부 탈구로 마우스를 안락사시키고, 양측 기흉과 같은 2차 방법을 사용합니다. 여기에서는 32g, 7개월 된 암컷 C57BL/6J 마우스를 사용하여 4개월 동안 45% 고지방 식단을 먹였습니다.
참고: 이 프로토콜은 남성뿐만 아니라 다른 균주, 식단 및 연령에도 사용할 수 있습니다. - 70% 에탄올을 뿌리고 가위로 복부 피부 중앙에 작은(~1cm) 측면 절개를 하고 엄지와 집게손가락으로 양쪽을 꼬집어 피부를 떼어내고 하복부 피부를 접어 후방 피하 저장소를 드러냅니다. 사타구니 림프절을 찾아 제거하고 겸자를 사용하여 사타구니 림프절 바로 뒤쪽에 있는 사타구니 지방 조직을 무뚝뚝하게 해부합니다.
- 생식선 지방 조직을 수집하려면 복막에 측면 및 수직 절개를하여 복강에 접근하십시오. 족집게로 생식선 지방 패드를 잡고 자궁 (또는 남성의 경우 부고환)을 따라 잘라 생식선 지방 조직을 제거합니다. 수집된 저장소를 6웰 플레이트에 넣습니다.
- 우물에서 티슈를 꺼내 실리콘 매트 위에 놓고 가위로 5-7mg 덩어리로 자릅니다.
- 각 분석 웰에 대해 25-30mg(5개 또는 6개 덩어리)의 무게를 측정하고 48웰 분석 플레이트에 넣습니다. 무게를 측정하기 전에 깨끗한 수건에 티슈를 닦아내어 배지를 제거합니다. 조직을 제거한 후 웨이트 보트의 무게를 측정하고 남은 잔류물의 무게를 기록합니다. 샘플 사이에 웨이트 보트를 깨끗하게 닦고 필요한 경우 다시 용기를 냅니다. 각 조직에 새 웨이트 보트를 사용하십시오.
- 일단 모든 조직 샘플의 칭량이 이루어지면, 48-웰 분석 플레이트를 37°C, 10%CO2 인큐베이터에 15분 동안 둔다.
- 각 마우스에서 채취 할 각 조직에 대해 하나의 웰을 갖는 6 웰 플레이트를 준비한다. 사용할 각 웰에 4mL의 실온 DMEM을 넣습니다.
3. 지방 분해 분석
- 미디어 수집을 수행합니다. 매체를 이송하고 멸균 흄 후드에서 후속 시료 수집을 수행하여 외부 소스의 잠재적인 오염을 최소화합니다.
- t=0에서, 배지를 제거하고, 대조군 또는 자극 배지의 웰 당 400 μL를 추가하고, 플레이트를 37°C, 10%CO2 인큐베이터에 넣어 분석한다. 생체 외 조직 배양의 경우 피펫을 사용하여 배지를 조심스럽게 제거합니다. 흡입은 절대 사용해서는 안 됩니다.
알림: 또는 대조군 및 자극 매체가 있는 두 번째 플레이트를 준비하고 조직을 옮깁니다. - t = 1, 2, 3 및 4h에서 200μL의 배지를 수집하고 200μL의 적절한 대조군 또는 자극 배지로 교체한 후 분석 플레이트를 인큐베이터로 되돌립니다. 수집 플레이트를 4°C에서 보관하십시오. BSA 미디어의 FFA 버퍼링 용량을 확인하려면 24시간에 추가 수집을 사용합니다.
참고: 여기에서 실험을 중지할 수 있으며 수집된 배지를 -20°C에서 보관할 수 있습니다.
- t=0에서, 배지를 제거하고, 대조군 또는 자극 배지의 웰 당 400 μL를 추가하고, 플레이트를 37°C, 10%CO2 인큐베이터에 넣어 분석한다. 생체 외 조직 배양의 경우 피펫을 사용하여 배지를 조심스럽게 제거합니다. 흡입은 절대 사용해서는 안 됩니다.
4. FFA 비색 분석
- 시약을 실온으로 데우고 색 시약 A 1 병을 용매 A 1 병과 용해시키고, 색 시약 B 1 병을 용매 B 1 병과 용해시킨다. 재구성일로부터 이러한 시약은 1주일 이내에 사용하는 것이 가장 좋습니다. 재구성 후 1 개월 후에 폐기하십시오.
- 샘플을 해동하고 혼합하십시오.
- FFA 표준 곡선을 작성합니다. 표준 용액은 1mM입니다. 표준 곡선의 시약과 함께 25 μL, 20 μL, 15 μL, 10 μL, 10 μL (1:2 희석), 10 μL (1:4 희석), 10 μL (1:8 희석) 및 10 μL 물을 사용합니다. 낮은 FFA 수준의 경우 10μL의 1mM, 0.8mM, 0.6mM, 0.4mM, 0.2mM, 0.1mM 및 0.05mM 표준이 더 적합할 수 있습니다.
- 표준물질과 샘플을 96웰 분석 플레이트에 피펫팅합니다. 권장 샘플 부피는 10μL입니다. 배경 보정을 위해 샘플과 동일한 부피의 BSA 배지를 가진 3개의 웰을 포함합니다.
알림: 만약 ample 농도가 표준 곡선의 범위를 벗어나면 분석을 반복하여 s를 조정하십시오.ample 부피를 2-25μL로 조정합니다. - 각 웰에 150μL의 시약 A를 넣고 혼합합니다. 거품을 생성하지 마십시오. 미세한 게이지 바늘로 거품을 터뜨립니다. 분석 플레이트를 37°C에서 5분 동안 인큐베이션합니다.
- 550 nm 및 660 nm 기준에서 플레이트의 흡광도를 판독합니다(판독값 A).
- 75 μL의 시약 B를 각 웰에 첨가하고 혼합한다. 거품을 생성하지 마십시오. 미세한 게이지 바늘로 거품을 터뜨립니다. 분석 플레이트를 37°C에서 5분 동안 인큐베이션합니다.
- 플레이트의 흡광도를 550 nm 및 660 nm 기준에서 다시 판독한다(판독값 B).
5. 글리세롤 비색 분석
- 유리 글리세롤 시약을 초순수 36mL로 재구성하고 실온에 순응시킨다. 이 시약은 몇 주 이내에 사용하는 것이 가장 좋습니다. 재구성 후 2 개월 후에 폐기하십시오.
- 샘플을 해동하고 혼합하십시오.
- 글리세롤 표준용액을 7점, 2배 연속 희석하고 블랭크를 사용하여 글리세롤 표준물질 곡선을 만듭니다.
참고: 표준 곡선은 2.8mM 글리세롤의 최대 25μL까지 비교적 선형이지만 더 높은 농도에서는 선형이 아닙니다. - 표준물질과 시료 각각 25 μL를 96-웰 분석 플레이트에 넣었다. 배경 보정을 위해 BSA 미디어에 3개의 웰을 포함합니다.
- 175 μL의 유리 글리세롤 시약을 각 웰에 넣고 혼합합니다. 거품을 생성하지 마십시오. 미세한 게이지 바늘로 거품을 터뜨립니다. 분석 플레이트를 37°C에서 5분 동안 인큐베이션합니다.
- 540nm에서 플레이트의 흡광도를 읽습니다.
6. 지방 분해 비율의 계산
- 광학 밀도(OD) 값으로 시작합니다. 글리세롤의 경우A 540 OD 값을 직접 사용하십시오. 다음 공식에 따라 FFA 분석의 OD를 계산합니다.
OD = (판독값 B: A 550 - A 660) - (판독값 A: A550 - A660) - 표준 곡선을 사용하여 수집된 샘플의 FFA 및 글리세롤 수준을 계산합니다. y축에 표준 OD 값을 표시하고 x축에 표준 농도를 사용하여 샘플 부피를 사용합니다(즉, 10μL 샘플이 있는 플레이트에 1mM FFA 표준물 20μL이 있는 웰의 농도는 2mM과 같습니다). 선형 추세선 맞추기:
y = mx + b - 표준 곡선을 육안으로 검사하고 분석의 선형 범위를 벗어난 점을 제거합니다. 다음 방정식을 사용하여 시료 농도를 계산합니다.
시료 농도 : x = (OD - b) ÷ m - 선형 분석 범위를 벗어나는 샘플을 조정하고 다시 분석합니다. 최종 샘플 농도를 얻으려면 샘플의 농도에서 BSA 미디어만 포함된 백그라운드 웰의 농도를 뺍니다.
- 공식에 따라 각 시점에서 각 샘플에 의해 생성된 FFA와 글리세롤의 몰을 계산합니다.
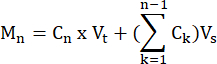
여기서 Cn = 시간 t=n에서의 농도; Vt = 우물 내의 총 부피; Vs = 샘플 수집 부피; 및 M n = 시간 t = n에서 생성된 몰(농도가 mM 단위이고 부피가 mL 단위일 때 출력은 μMol임).
예를 들어, 다양한 시점에서 다음을 수행합니다.
미디엄 1 =C1 ×Vt
M4 =C4 ×Pt+(C1 +C2+C3)Vs
또는
M4 =C4 ×Pt+C3× Vs +C2× Vs +C1×Vs - 각 샘플의 조직 중량을 그램 단위로 나누어 조직 중량을 정규화하여 μmol/g 단위를 구합니다. 배양된 세포의 경우 값은 μmol/well로 표시됩니다. 세포 수와 분화 효율이 우물에서 우물로 비교할 수 있는지 확인하십시오.
참고: 증식 또는 분화 효율의 차이는 결과의 해석을 복잡하게 만들고 다른 정규화 방법(예: 단백질로의 정규화, 토론 참조)이 필요합니다. - 각 샘플에 대해 생성된 μmol/g(y축) 대 시간(x축)의 기울기를 개별적으로 계산합니다.
- 스프레드시트에서는 =SLOPE(known_ys,known_xs) 함수를 사용하여 이 작업을 수행할 수 있습니다. 새 셀에 "=SLOPE"를 입력합니다(그런 다음 커서를 사용하여 샘플 글리세롤 또는 FFA 값(μmol/g)을 강조 표시한 다음 해당 시간 값을 강조 표시).
- 데이터의 선형성을 확인합니다. R2 값은 샘플의 선형성을 결정하는 빠른 방법입니다. 스프레드시트에서 6.7.1단계에서 설명한 것과 동일한 방식으로 =RSQ(known_ys,known_xs) 함수를 사용하여 이 작업을 수행할 수 있지만 초기 입력은 =RSQ입니다. R2 값이 0.98 >인지 확인하십시오. 값이 낮을수록 선형성에서 벗어난 것을 나타냅니다. 이는 측정/샘플링 오류 또는 선형성 손실로 인해 발생할 수 있습니다.
- 선형성을 테스트하는 또 다른 방법은 각 표본에 대해 선형 회귀를 수행하고 잔차를 플로팅하는 것입니다. 통계 분석 소프트웨어에서 각 시점에 대해 단일 Y 값을 갖는 XY 테이블을 생성합니다. 분석 > 단순 선형 회귀를 선택하고 확인을 누르기 전에 잔차 그림 상자를 선택합니다. 잔차 그림이 새 그래프로 나타납니다.
- 각 샘플에 대한 FFA 및 글리세롤 생성 속도(즉, 기울기[(μmol/g/h])를 개별 데이터 포인트로 사용하여 통계 분석을 수행하고 다른 지방 분해 조건을 비교하는 경우 값을 표시합니다. 유전자형에 걸쳐 지방 분해 비율을 비교하는 경우 동물당 2개 또는 3개의 샘플을 기술 복제로 사용하고 동물당 하나의 데이터 포인트에 대한 평균을 사용하여 샘플 크기가 동물 수와 같도록 합니다.
결과
우리는 시험관 내 분화된 지방세포의 기저 및 자극 지방 분해 속도를 측정했습니다. 사타구니 백색 지방 조직의 1차 지방전구세포는 4일 동안 5μM 덱사메타손, 0.5mM IBMX, 1μg/mL 인슐린 및 1μM 트로글리타존으로 융합 세포를 처리한 후 1μg/mL 인슐린으로 추가 3일 처리하여 지방세포로 분화되었습니다. 세포는 지방 분해 분석 전에 24시간 동안 인슐린 없이 배지에서 배양되었습니다. 시간 = 0h에서...
토론
여기에서는 지방 세포 및 생체 외 지방 조직에서 지방 분해 속도를 측정하기 위한 기본 프로토콜을 제공합니다. 지방 분해를 정량화하려면 선형 상에서 지방 분해 속도를 측정하는 것이 중요합니다. 우리는 많은 양의 매체를 수집하여 정기적으로 새로운 매체로 교체하는 직렬 샘플링 기술을 사용합니다. 이 반보존적 방법은 FFA 완충 용량을 가진 신선한 BSA의 추가를 허용하고 피드백 억제를...
공개
저자는 공개 할 것이 없습니다.
감사의 말
이 작업은 미국 국립 보건원 (National Institutes of Health)이 S.M.R.에 R01DK126944를 부여하여 지원했습니다.
자료
| Name | Company | Catalog Number | Comments |
| 24-Well tissue culture treated plate | Corning Inc | 3527 | Must be tissue culture treated for adipocyte differntiation |
| 48-Well flat bottom plate with lid | Corning Inc | 353078 | Can be tissue culture treated |
| 6-Well flat bottom plate with lid | Corning Inc | 353046 | Can be tissue culture treated |
| 96-Well PCR Plate | USA sceintific | 1402-9100 | Any conical 0.2 mL PCR plate will be convenient |
| Bovine Serum Albumin | Sigma Aldrich | A9418 | FFA free BSA such as A8806, is also commonly used. The BSA should not have detectable FFA, also lot to lot variations in BSA can impact the observed rate of lipolysis |
| CL-316,243 | Sigma Aldrich | C5976 | CAS #: 138908-40-4 availaible from other suppliers |
| CO2 incubator | PHCBI | MCO-170AICUVH | CO2 should ideally be set to 10% for adipose tissue, however 5% CO2 will also work |
| DMEM, low glucose, no phenol red | Thermofischer | 11054020 | Any phenol red free media should work, DMEM/F12, RPMI, but should contain volatile buffering capacity, i.e. biocarbonate |
| FFA-free Bovine serum albumin | Equitech-Bio, Inc, | BAH66 | |
| Free Glycerol Reagent | Sigma Aldrich | F6428 | |
| Glycerol Standard Solution | Sigma Aldrich | G7793 | This can also be made by diluting glycerol to the desired concentration |
| HR Series NEFA Standard Solution | Fujifilm | 276-76491 | |
| HR Series NEFA-HR (2) Color Reagent A | Fujifilm | 999-34691 | |
| HR Series NEFA-HR (2) Color Reagent B | Fujifilm | 991-34891 | |
| HR Series NEFA-HR (2) Solvent A | Fujifilm | 995-34791 | |
| HR Series NEFA-HR (2) Solvent B | Fujifilm | 993-35191 | |
| Microbiological Incubator | Fischer Scientific | S28668 | Any incubator at 37C can be used |
| Nunc MicroWell 96-Well Plates | Thermo Scientific | 269620 | Any optically clear, flat bottom 96-well plate works |
| Silicone Laboratory Benchtop Mat | VWR | 76045-300 | Glass plate can also be used. Absorbant surfaces are not recommended |
| Spectrophotometer/Microplate Reader | Molecular devices | SpectraMax i3x | Any plate reader that can read at 540, 550 and 660 mm will work |
| V Bovine serum albumin | Sigma-Aldrich | 810531 | |
| WypAll X70 Wipers | Kimberly-Clark | 41200 | Any high quality paper towel will work |
참고문헌
- Vaughan, M., Berger, J. E., Steinberg, D. Hormone-sensitive lipase and monoglyceride lipase activities in adipose tissue. The Journal of Biological Chemistry. 239, 401-409 (1964).
- Zimmermann, R., et al. Fat mobilization in adipose tissue is promoted by adipose triglyceride lipase. Science. 306 (5700), 1383-1386 (2004).
- Lass, A., et al. Adipose triglyceride lipase-mediated lipolysis of cellular fat stores is activated by CGI-58 and defective in Chanarin-Dorfman syndrome. Cell Metabolism. 3 (5), 309-319 (2006).
- Stralfors, P., Bjorgell, P., Belfrage, P. Hormonal regulation of hormone-sensitive lipase in intact adipocytes: identification of phosphorylated sites and effects on the phosphorylation by lipolytic hormones and insulin. Proceedings of the National Academy of Sciences. 81 (11), 3317-3321 (1984).
- Miyoshi, H., et al. Perilipin promotes hormone-sensitive lipase-mediated adipocyte lipolysis via phosphorylation-dependent and -independent mechanisms. The Journal of Biological Chemistry. 281 (23), 15837-15844 (2006).
- Sztalryd, C., et al. Perilipin A is essential for the translocation of hormone-sensitive lipase during lipolytic activation. The Journal of Cell Biology. 161 (6), 1093-1103 (2003).
- Lafontan, M., Langin, D. Lipolysis and lipid mobilization in human adipose tissue. Progress in Lipid Research. 48 (5), 275-297 (2009).
- Grabner, G. F., Xie, H., Schweiger, M., Zechner, R. Lipolysis: cellular mechanisms for lipid mobilization from fat stores. Nature Metabolism. 3 (11), 1445-1465 (2021).
- Weiss, S. B., Kennedy, E. P., Kiyasu, J. Y. The enzymatic synthesis of triglycerides. The Journal of Biological Chemistry. 235, 40-44 (1960).
- Kennedy, E. P. Biosynthesis of complex lipids. Federation Proceedings. 20, 934-940 (1961).
- Wendel, A. A., Lewin, T. M., Coleman, R. A. Glycerol-3-phosphate acyltransferases: rate limiting enzymes of triacylglycerol biosynthesis. Biochimica et Biophysica Acta. 1791 (6), 501-506 (2009).
- Johansson, S. M., Lindgren, E., Yang, J. N., Herling, A. W., Fredholm, B. B. Adenosine A1 receptors regulate lipolysis and lipogenesis in mouse adipose tissue-interactions with insulin. European Journal of Pharmacology. 597 (1-3), 92-101 (2008).
- Gnad, T., et al. Adenosine activates brown adipose tissue and recruits beige adipocytes via A2A receptors. Nature. 516 (7531), 395-399 (2014).
- Fried, S. K., et al. Resistance to the antilipolytic effect of insulin in adipocytes of African-American compared to Caucasian postmenopausal women. Journal of Lipid Research. 51 (5), 1193-1200 (2010).
- Lee, M. J., Fried, S. K. Optimal protocol for the differentiation and metabolic analysis of human adipose stromal cells. Methods in Enzymology. 538, 49-65 (2014).
- Fricke, K., Heitland, A., Maronde, E. Cooperative activation of lipolysis by protein kinase A and protein kinase C pathways in 3T3-L1 adipocytes. Endocrinology. 145 (11), 4940-4947 (2004).
- Bergan, H. E., Kittilson, J. D., Sheridan, M. A. PKC and ERK mediate GH-stimulated lipolysis. Journal of Molecular Endocrinology. 51 (2), 213-224 (2013).
- Schmitz-Peiffer, C. The tail wagging the dog--regulation of lipid metabolism by protein kinase C. The FEBS Journal. 280 (21), 5371-5383 (2013).
- Carmen, G. Y., Victor, S. M. Signalling mechanisms regulating lipolysis. Cellular Signalling. 18 (4), 401-408 (2006).
- Zu, L., et al. Bacterial endotoxin stimulates adipose lipolysis via toll-like receptor 4 and extracellular signal-regulated kinase pathway. The Journal of Biological Chemistry. 284 (9), 5915-5926 (2009).
- Zhang, H. H., Halbleib, M., Ahmad, F., Manganiello, V. C., Greenberg, A. S. Tumor necrosis factor-alpha stimulates lipolysis in differentiated human adipocytes through activation of extracellular signal-related kinase and elevation of intracellular cAMP. Diabetes. 51 (10), 2929-2935 (2002).
- Tan, X., et al. TNF-α downregulates CIDEC via MEK/ERK pathway in human adipocytes. Obesity. 24 (5), 1070-1080 (2016).
- Laurencikiene, J., et al. NF-kappaB is important for TNF-alpha-induced lipolysis in human adipocytes. Journal of Lipid Research. 48 (5), 1069-1077 (2007).
- van Hall, G., et al. Interleukin-6 stimulates lipolysis and fat oxidation in humans. The Journal of Clinical Endocrinology and Metabolism. 88 (7), 3005-3010 (2003).
- Wueest, S., et al. Mesenteric fat lipolysis mediates obesity-associated hepatic steatosis and insulin resistance. Diabetes. 65 (1), 140-148 (2016).
- Trujillo, M. E., et al. Interleukin-6 regulates human adipose tissue lipid metabolism and leptin production in vitro. The Journal of Clinical Endocrinology and Metabolism. 89 (11), 5577-5582 (2004).
- Kitamura, T., et al. Insulin-induced phosphorylation and activation of cyclic nucleotide phosphodiesterase 3B by the serine-threonine kinase Akt. Molecular and Cellular Biology. 19 (9), 6286-6296 (1999).
- Chakrabarti, P., et al. Insulin inhibits lipolysis in adipocytes via the evolutionarily conserved mTORC1-Egr1-ATGL-mediated pathway. Molecular and Cellular Biology. 33 (18), 3659-3666 (2013).
- Collins, S., Daniel, K. W., Petro, A. E., Surwit, R. S. Strain-specific response to beta 3-adrenergic receptor agonist treatment of diet-induced obesity in mice. Endocrinology. 138 (1), 405-413 (1997).
- Surwit, R. S., Dixon, T. M., Petro, A. E., Daniel, K. W., Collins, S. Diazoxide restores beta3-adrenergic receptor function in diet-induced obesity and diabetes. Endocrinology. 141 (10), 3630-3637 (2000).
- Gettys, T. W., et al. Age-dependent changes in beta-adrenergic receptor subtypes and adenylyl cyclase activation in adipocytes from Fischer 344 rats. Endocrinology. 136 (5), 2022-2032 (1995).
- Mowers, J., et al. Inflammation produces catecholamine resistance in obesity via activation of PDE3B by the protein kinases IKKε and TBK1. eLife. 2, e01119 (2013).
- Valentine, J. M., et al. β3-Adrenergic receptor downregulation leads to adipocyte catecholamine resistance in obesity. The Journal of Clinical Investigation. 132 (2), e153357 (2022).
- Collins, S., et al. Impaired expression and functional activity of the beta 3- and beta 1-adrenergic receptors in adipose tissue of congenitally obese (C57BL/6J ob/ob) mice. Molecular Endocrinology. 8 (4), 518-527 (1994).
- Collins, S., Surwit, R. S. The beta-adrenergic receptors and the control of adipose tissue metabolism and thermogenesis. Recent Progress in Hormone Research. 56, 309-328 (2001).
- Dixon, T. M., Daniel, K. W., Farmer, S. R., Collins, S. CCAAT/enhancer-binding protein alpha is required for transcription of the beta 3-adrenergic receptor gene during adipogenesis. The Journal of Biological Chemistry. 276 (1), 722-728 (2001).
- Lohse, M. J., Benovic, J. L., Codina, J., Caron, M. G., Lefkowitz, R. J. beta-Arrestin: a protein that regulates beta-adrenergic receptor function. Science. 248 (4962), 1547-1550 (1990).
- Nantel, F., et al. The human beta 3-adrenergic receptor is resistant to short term agonist-promoted desensitization. Molecular Pharmacology. 43 (4), 548-555 (1993).
- Liggett, S. B., Freedman, N. J., Schwinn, D. A., Lefkowitz, R. J. Structural basis for receptor subtype-specific regulation revealed by a chimeric beta 3/beta 2-adrenergic receptor. Proceedings of the National Academy of Sciences. 90 (8), 3665-3669 (1993).
- Baker, J. G. The selectivity of beta-adrenoceptor agonists at human beta1-, beta2- and beta3-adrenoceptors. British Journal of Pharmacology. 160 (5), 1048-1061 (2010).
- Lafontan, M. Inhibition of epinephrine-induced lipolysis in isolated white adipocytes of aging rabbits by increased alpha-adrenergic responsiveness. Journal of Lipid Research. 20 (2), 208-216 (1979).
- Baker, J. G. The selectivity of beta-adrenoceptor antagonists at the human beta1, beta2 and beta3 adrenoceptors. British Journal of Pharmacology. 144 (3), 317-322 (2005).
- Jensen, M. D., Nielsen, S. Insulin dose response analysis of free fatty acid kinetics. Metabolism. 56 (1), 68-76 (2007).
- Jensen, M. D., Haymond, M. W., Gerich, J. E., Cryer, P. E., Miles, J. M. Lipolysis during fasting. Decreased suppression by insulin and increased stimulation by epinephrine. The Journal of Clinical Investigation. 79 (1), 207-213 (1987).
- Heckmann, B. L., et al. Defective adipose lipolysis and altered global energy metabolism in mice with adipose overexpression of the lipolytic inhibitor G0/G1 switch gene 2 (G0S2). The Journal of Biological Chemistry. 289 (4), 1905-1916 (2014).
- Shin, H., et al. Lipolysis in brown adipocytes is not essential for cold-induced thermogenesis in mice. Cell Metabolism. 26 (5), 764.e5-777.e5 (2017).
- Treble, D. H., Mayer, J. Glycerolkinase activity in white adipose tissue of obese-hyperglycaemic mice. Nature. 200, 363-364 (1963).
- Possik, E., et al. New mammalian glycerol-3-phosphate phosphatase: role in beta-cell, liver and adipocyte metabolism. Frontiers in Endocrinology. 12, 706607 (2021).
- Romero Mdel, M., Sabater, D., Fernandez-Lopez, J. A., Remesar, X., Alemany, M. Glycerol production from glucose and fructose by 3T3-L1 cells: a mechanism of adipocyte defense from excess substrate. PLoS One. 10 (10), e0139502 (2015).
- Mugabo, Y., et al. Identification of a mammalian glycerol-3-phosphate phosphatase: Role in metabolism and signaling in pancreatic beta-cells and hepatocytes. Proceedings of the National Academy of Sciences. 113 (4), E430-E439 (2016).
- Hanson, R. W., Reshef, L. Glyceroneogenesis revisited. Biochimie. 85 (12), 1199-1205 (2003).
- Vaughan, M. The production and release of glycerol by adipose tissue incubated in vitro. The Journal of Biological Chemistry. 237, 3354-3358 (1962).
- Jensen, M. D., Ekberg, K., Landau, B. R. Lipid metabolism during fasting. American Journal of Physiology-Endocrinology and Metabolism. 281 (4), E789-E793 (2001).
- Ballard, F. J., Hanson, R. W., Leveille, G. A. Phosphoenolpyruvate carboxykinase and the synthesis of glyceride-glycerol from pyruvate in adipose tissue. The Journal of Biological Chemistry. 242 (11), 2746-2750 (1967).
- Reshef, L., Hanson, R. W., Ballard, F. J. A possible physiological role for glyceroneogenesis in rat adipose tissue. The Journal of Biological Chemistry. 245 (22), 5979-5984 (1970).
- Gorin, E., Tal-Or, Z., Shafrir, E. Glyceroneogenesis in adipose tissue of fasted, diabetic and triamcinolone treated rats. European Journal of Biochemistry. 8 (3), 370-375 (1969).
- Elia, M., Zed, C., Neale, G., Livesey, G. The energy cost of triglyceride-fatty acid recycling in nonobese subjects after an overnight fast and four days of starvation. Metabolism. 36 (3), 251-255 (1987).
- Reshef, L., et al. Glyceroneogenesis and the triglyceride/fatty acid cycle. Journal of Biological Chemistry. 278 (33), 30413-30416 (2003).
- Edens, N. K., Leibel, R. L., Hirsch, J. Mechanism of free fatty acid re-esterification in human adipocytes in vitro. Journal of Lipid Research. 31 (8), 1423-1431 (1990).
- Vaughan, M., Steinberg, D. Effect of hormones on lipolysis and esterification of free fatty acids during incubation of adipose tissue in vitro. Journal of Lipid Research. 4, 193-199 (1963).
- Brooks, B., Arch, J. R., Newsholme, E. A. Effects of hormones on the rate of the triacylglycerol/fatty acid substrate cycle in adipocytes and epididymal fat pads. Federation of European Biochemical Societies Letters. 146 (2), 327-330 (1982).
- Bjorntorp, P., Karlsson, M., Hovden, A. Quantitative aspects of lipolysis and reesterification in human adipose tissue in vitro. Acta Medica Scandinavica. 185 (1-2), 89-97 (1969).
- Angel, A., Desai, K., Halperin, M. L. Free fatty acid and ATP levels in adipocytes during lipolysis. Metabolism. 20 (1), 87-99 (1971).
- Husted, A. S., et al. Autocrine negative feedback regulation of lipolysis through sensing of NEFAs by FFAR4/GPR120 in WAT. Molecular Metabolism. 42, 101103 (2020).
- Fain, J. N., Shepherd, R. E. Free fatty acids as feedback regulators of adenylate cyclase and cyclic 3':5'-AMP accumulation in rat fat cells. The Journal of Biological Chemistry. 250 (16), 6586-6592 (1975).
- Burns, T. W., Langley, P. E., Terry, B. E., Robinson, G. A. The role of free fatty acids in the regulation of lipolysis by human adipose tissue cells. Metabolism. 27 (12), 1755-1762 (1978).
- Kalderon, B., et al. Suppression of adipose lipolysis by long-chain fatty acid analogs. Journal of Lipid Research. 53 (5), 868-878 (2012).
- Schweiger, M., et al. Measurement of lipolysis. Methods in Enzymology. 538, 171-193 (2014).
- Decaunes, P., Bouloumie, A., Ryden, M., Galitzky, J. Ex vivo analysis of lipolysis in human subcutaneous adipose tissue explants. Bio-Protocol. 8 (3), e2711 (2018).
- Roy, D., Myers, J. M., Tedeschi, A. Protocol for assessing ex vivo lipolysis of murine adipose tissue. STAR Protocols. 3 (3), 101518 (2022).
- Baskaran, P., Thyagarajan, B. Measurement of basal and forskolin-stimulated lipolysis in inguinal adipose fat pads. Journal of Visualized Experiments. 125 (125), 55625 (2017).
- Reilly, S. M., et al. Catecholamines suppress fatty acid re-esterification and increase oxidation in white adipocytes via STAT3. Nature Metabolism. 2 (7), 620-634 (2020).
- Liu, L., et al. Isolation of mouse stromal vascular cells for monolayer culture. Methods in Molecular Biology. 1566, 9-16 (2017).
- DeLuca, J. H., Reilly, S. M. . Methods in Molecular Biology. , (2023).
- Richard, G., Vernon, R. A. C. New Perspectives in Adipose Tissue. Butterworth-Heinemann. , (1985).
- Brito, M. N., Botion, L. M., Brito, N. A., Kettelhut, I. C., Migliorini, R. H. Lipolysis and glycerokinase activity in brown adipose tissue of rat fed a high protein, carbohydrate-free diet. Hormone and Metabolic Research. 26 (1), 51-52 (1994).
- Bertin, R. Glycerokinase activity and lipolysis regulation in brown adipose tissue of cold acclimated rats. Biochimie. 58 (4), 431-434 (1976).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유