É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Mensuração da Taxa de Lipólise em Tecido Adiposo Murino Ex Vivo e Pré-adipócitos Primários Diferenciados In Vitro
Neste Artigo
Resumo
A lipólise de triglicerídeos em adipócitos é um importante processo metabólico que resulta na liberação de ácidos graxos livres e glicerol. Aqui, fornecemos um protocolo detalhado para medir a lipólise basal e estimulada em adipócitos e tecido adiposo ex vivo de camundongos.
Resumo
Os adipócitos armazenam energia na forma de triglicerídeos em gotículas lipídicas. Essa energia pode ser mobilizada via lipólise, onde as cadeias laterais dos ácidos graxos são sequencialmente clivadas da espinha dorsal do glicerol, resultando na liberação de ácidos graxos livres e glicerol. Devido à baixa expressão de glicerol quinase em adipócitos brancos, as taxas de recaptação de glicerol são desprezíveis, enquanto a recaptação de ácidos graxos é ditada pela capacidade de ligação de ácidos graxos de componentes do meio, como a albumina. Tanto a liberação de glicerol quanto de ácidos graxos em meios pode ser quantificada por ensaios colorimétricos para determinar a taxa lipolítica. Medindo esses fatores em vários momentos, pode-se determinar a taxa linear de lipólise com alta confiança. Aqui, fornecemos um protocolo detalhado para a mensuração da lipólise em adipócitos diferenciados in vitro e tecido adiposo ex vivo de camundongos. Este protocolo também pode ser otimizado para outras linhagens celulares de pré-adipócitos ou tecido adiposo de outros organismos; considerações e parâmetros de otimização são discutidos. Este protocolo foi projetado para ser útil na determinação e comparação da taxa de lipólise de adipócitos entre modelos e tratamentos em camundongos.
Introdução
Os nutrientes em excesso são armazenados no tecido adiposo branco na forma de triglicerídeos no núcleo lipídico neutro das gotículas lipídicas. Os estoques de triglicérides são mobilizados via lipólise, processo pelo qual as cadeias laterais de ácidos graxos são sequencialmente clivadas por lipase triglicérides do tecido adiposo (ATGL), lipase hormônio-sensível (HSL) e lipase monoglicerídica (MGL), resultando na liberação de ácidos graxos livres (AGL) e da espinha dorsal do glicerol 1,2. A lipólise é ativada pela sinalização de catecolaminas no tecido adiposo. Os terminais nervosos simpáticos liberam localmente catecolaminas, que se ligam aos receptores β-adrenérgicos na membrana plasmática dos adipócitos. Após a ligação do ligante, esses receptores acoplados à proteína G (GPCRs) ativam a adenilil ciclase via Gαs. A ativação subsequente da proteína quinase A (PKA) pelo AMPc resulta na regulação positiva tanto da ATGL quanto da HSL. A fosforilação da perilipina-1 pela PKA causa a dissociação da ABHD5 (também conhecida como CGI-58), que se liga e coativa a ATGL3. O PKA fosforila diretamente a HSL, promovendo sua translocação do citosol para a gota lipídica, onde a interação com a perilipina-1 fosforilada promove ainda mais sua atividade lipase 4,5,6,7. A terceira lipase envolvida na lipólise, a MGL, parece não ser regulada pela sinalização das catecolaminas8. É importante ressaltar que a síntese de triglicérides em adipócitos é mediada pela via de síntese lipídica do glicerol, que não envolve a formação de monoglicerídeos como intermediário; em vez disso, as glicerol-3-fosfato acilo transferases catalisam a formação de ácido lisofosfatídico, que é combinado com outro acil-CoA graxo para formar ácido fosfatídico e, em seguida, isomerizado em diglicerídeos antes da síntese final de triglicérides (Figura 1)9,10,11.

Figura 1: Vias de lipólise e síntese lipídica do glicerol. Topo: Via lipolítica; enzimas mostradas em vermelho: lipase triglicerídica do tecido adiposo (ATGL), lipase sensível ao hormônio (HSL) e lipase monoglicerídica (MGL). Fundo: via de síntese lipídica do glicerol; enzimas mostradas em verde: diglicerídeos aciltransferase (DGAT), fosfatase do ácido fosfatídico (PAP), ácido lisofosfatídico aciltransferase (LPAT, também conhecido como LPAATs) e glicerol-3-fosfato aciltransferase (GPAT). Lipídios: triglicerídeos (TG), diglicerídeos (DG), monoglicerídeos (MG), ácidos graxos livres (AGL), acil-CoA graxo (FA-CoA), ácido lisofosfatídico (LPA) e ácido fosfatídico (AP). Outros metabólitos: fosfato inorgânico (Pi) e glicerol 3-fosfato (G3P). Clique aqui para ver uma versão maior desta figura.
A adenosina extracelular é outro importante regulador da lipólise, atuando através de GPCRs acoplados a Gs e Gi para impactar a atividade da adenil ciclase. O receptor de adenosina predominante nos adipócitos, ADORA1, inibe a adenilil ciclase e, assim, a lipólise através da ativação de Gi12. Expressa em níveis mais baixos, e principalmente em adipócitos marrons, a ADORA2A ativa a lipólise via sinalizaçãode G s 13. ADORA1 afeta tanto a lipólise basal quanto a resposta aos agonistas adrenérgicos. O efeito da adenosina na lipólise pode ser controlado pela adição de adenosina desaminase para neutralizar a adenosina, assim como o agonista específico ADORA1 fenilisopropiladenosina14,15. A ativação hormonal de GPCRs acopladas a Gq também pode afetar a lipólise via ativação da fosfolipase C e da proteína quinase C16,17,18,19. Sinais inflamatórios também afetam as taxas lipolíticas. A ativação de TLR4 pelo LPS (e outras endotoxinas) aumenta a taxa lipolítica pela ativação da ERK, que fosforila perilipina-1 e HSL20. O TNF-α também ativa a lipólise via ativação de ERK e NF-κB, bem como downregulation transcricional da fosfodiesterase PDE-3B e CIDEC21,22,23. A IL-6 também tem sido associada ao aumento da lipólise dos adipócitos, especialmente no tecido adiposo mesentérico, cuja liberação de AGL afeta a esteatose hepática e a gliconeogênese24,25,26.
A lipólise é suprimida durante o estado alimentado pela insulina. AKT fosforila e ativa PDE-3B para suprimir a sinalização de AMPc e impedir a ativação de PKA27. A insulina também diminui transcricionalmente a ATGL28. A obesidade promove resistência às catecolaminas através de uma variedade de mecanismos, incluindo a diminuição da regulação dos receptores β-adrenérgicos nos adipócitos 29,30,31,32,33. Os adipócitos expressam os três receptores β-adrenérgicos (β-1, β-2 e β-3). Enquanto os receptores adrenérgicos β-1 e β-2 são expressos de forma ubíqua, o receptor adrenérgico β-3 é predominantemente expresso em adipócitos de camundongos34,35. A expressão de Adrb3 é induzida por C/EBPα durante a adipogênese36. O receptor adrenérgico β-3 é altamente expresso em adipócitos maduros. A ativação dos receptores adrenérgicos β-1 e β-2 é autolimitada devido à inibição por feedback pela β-arrestina37. A inibição por feedback do receptor adrenérgico β-3 é mediada por outras vias de sinalização, que reduzema expressão de Adrb33,38,39.
Numerosos compostos podem ser usados para ativar a lipólise dos adipócitos. As catecolaminas são os principais ativadores fisiológicos da lipólise. A noradrenalina (ou noradrenalina) e a epinefrina (ou adrenalina) ativam os três receptores β-adrenérgicos40. A noradrenalina e a adrenalina também afetam a lipólise via ativação da sinalização dos receptores α-adrenérgicos41. Os agonistas dos receptores β-adrenérgicos comumente usados incluem o isoproterenol, que é um agonista não seletivo dos receptores β-adrenérgicos, e os agonistas dos receptores adrenérgicos β-3 CL-316,243 e mirabegron42. Como os adipócitos expressam predominantemente o receptor adrenérgico β-3, utilizamos a CL-316,243 como exemplo. Sua especificidade para o receptor adrenérgico β-3 também o torna um ativador relativamente específico da sinalização de catecolaminas de adipócitos, que também pode ser usado com segurança in vivo. Note-se que a concentração comumente usada de 10 μM CL-316,243 em cultura celular é ordens de magnitude maior do que a dose de ~0,1 μM necessária para atingir uma resposta máxima33. Forskolin contorna o receptor adrenérgico, ativando diretamente adenilil ciclase e sinalização lipolítica a jusante. Existem muito mais ativadores, bem como supressores de lipólise. Ao selecionar um composto para estimular a lipólise, a especificidade do receptor e as vias de sinalização a jusante devem ser cuidadosamente consideradas dentro do planejamento experimental.
A taxa de lipólise no tecido adiposo branco é um importante fator metabólico que afeta a tolerância ao frio e a disponibilidade de nutrientes durante o jejum ou exercício43,44,45,46. O objetivo deste protocolo é medir a taxa de lipólise em adipócitos e tecido adiposo, o que facilitará o entendimento do metabolismo dos adipócitos e como ele pode afetar o fenótipo metabólico de vários modelos murinos. Para quantificar a taxa lipolítica, medimos a aparência dos produtos lipolíticos na mídia (i.e., AGL e glicerol). O método baseia-se na liberação de produtos lipolíticos do adipócito para o meio. Como os adipócitos brancos expressam baixos níveis de glicerol quinase, as taxas de recaptação do glicerol são baixas47. Por outro lado, a produção de AGL e glicerol por outras vias metabólicas que não a lipólise também deve ser considerada. Os adipócitos parecem expressar uma fosfatase com atividade contra o glicerol-3 fosfato, possibilitando a produção de glicerol a partir do glicerol-3-fosfato derivado da glicose48,49,50. A glicólise é uma fonte de glicerol-3-fosfato usado para reesterificação de AGL em adipócitos brancos. Quando os níveis de glicose são limitados, a gliceroneogênese requer outras fontes de carbono 3, como lactato e piruvato51. A canalização dos AGL liberados pela lipólise dentro da célula e seu destino metabólico é pouco compreendido; Os AGL liberados pela lipólise devem ser convertidos em acil-CoA graxo, antes de serem reesterificados ou submetidos à β-oxidação. Parece que os AGL liberados pela lipólise provavelmente saem da célula antes de serem retomados e convertidos em acil-CoA gorduroso 52,53,54,55,56,57,58,59,60,61,62 . Os AGL podem ser sequestrados fora da célula pela albumina. É importante ressaltar que os AGL de cadeia longa são conhecidos por inibir a lipólise se não forem sequestrados pela albumina 63,64,65,66,67. Assim, a otimização da capacidade tampão dos AGL do meio durante o ensaio de lipólise é fundamental. O procedimento aqui descrito é semelhante aos métodos publicados anteriormente para medir a taxa lipolítica em adipócitos e tecido adiposo ex vivo de camundongos e humanos 15,68,69,70,71. Esse protocolo difere pelo uso de amostragem seriada; Ao realizar amostragens seriadas, podemos validar internamente que a lipólise está sendo medida na fase linear e utilizar múltiplas medidas para calcular a taxa de lipólise, reduzindo assim o erro de medição para aumentar a confiança no valor final calculado. A desvantagem da amostragem seriada é que o ensaio requer mais tempo e reagentes; no entanto, o prazo mais longo reduz o impacto do erro de medição no erro padrão das estimativas da taxa. Além disso, esse protocolo mede tanto a liberação de AGL quanto a de glicerol e considera a relação AGL:liberação de glicerol com o objetivo de atingir uma relação de 3:1, como seria esperado a partir da lipólise completa e liberação de produtos lipolíticos na mídia72.
Protocolo
O uso de todos os animais foi aprovado pelo Institutional Animal Care and Use Committee (IACUC) do Weill Cornell Medical College da Cornell University.
1. Preparação de tampões e placas coletoras
- Produzir albumina de soro bovino (BSA) a 5% dissolvendo 5 g de BSA em 100 mL de meio de Eagle modificado de Dulbecco (DMEM) sem vermelho de fenol. Mexa suavemente o BSA para dissolver (agitar é contraproducente). Uma vez que a BSA esteja totalmente dissolvida, filtre-esterilize o meio com um filtro de 0,2 μm. Conservar o suporte BSA a 4 °C durante um período máximo de 1 mês.
- Fazer concentrações de trabalho de meios de controle e estimulação. Meios de controle: 5% de mídia BSA com controle veicular. Meio de estimulação: meio BSA 5% com CL-316,243 μM 0,5 μM. Faça novos meios de estimulação para cada experimento.
- Aquecer o meio a ser utilizado a 37 °C. Rotule uma placa de 96 poços para coleta de mídia.
2. Preparo da amostra
- Realizar cultura celular conforme descrito abaixo. Realize todo o trabalho celular em uma capela de fumaça estéril para minimizar a contaminação externa.
- Isolar e diferenciar pré-adipócitos primários, como em73,74.
- Pré-adipócitos primários em placa de alta densidade, como 1 x 105 células/poço em placa de 24 poços em meio de cultura de 1 mL/poço (15% de soro fetal bovino (SFB) e 1x penicilina-estreptomicina-glutamina em DMEM/F12).
- Após as células atingirem 100% de confluência, diferenciar com 5 μM de dexametasona, 0,5 mM de 3-isobutil-1-metilxantina, 1 μg/mL de insulina e 1 μM de tiazolidinediona (TZD) em meios de cultura por 3 dias. Em seguida, mude para o meio de cultura com 1 μg/mL de insulina por pelo menos 3 dias para crescer gotículas lipídicas. Utilizar 1 mL/poço de meio na placa de 24 poços.
- Troque o meio de cultura (1 ml/poço) com insulina a cada 2 ou 3 dias. As células podem ser mantidas em meio com insulina por até 2 semanas. Use apenas culturas em que as taxas de diferenciação são superiores a 90% e são semelhantes entre os grupos para este ensaio, pois a diferenciação reduzida pode ser mal interpretada como uma redução na taxa lipolítica.
- Cultivar as células em meio livre de insulina por 24 h antes da dosagem da lipólise.
NOTA: A insulina na mídia mantém as gotículas lipídicas, mas também inibe a lipólise. A incubação sem insulina por 24 h permite a ativação lipolítica completa sem perda do volume lipídico das gotículas. Em alguns sistemas, o tempo de cultura sem insulina pode precisar ser encurtado ou prolongado.
- Lavar as células com DPBS uma vez para remover o soro residual dos meios de cultura.
NOTA: Este protocolo não inclui a inanição de soro, que pode ativar a lipólise. A inanição de soro pode ser empregada a critério do pesquisador.
- Isolar e diferenciar pré-adipócitos primários, como em73,74.
- Realizar cultura ex vivo conforme descrito abaixo.
- Prepare uma placa de 6 poços, com um poço para cada tecido a ser coletado de cada camundongo. Colocar 4 mL de DMEM à temperatura ambiente em cada poço a ser utilizado.
NOTA: BSA na mídia de coleta não é necessário. - Preparar uma placa de 48 poços para o ensaio de lipólise, com um orifício para cada repetição. Colocar 400 μL de DMEM à temperatura ambiente em cada poço a ser utilizado. Utilizar dois a quatro poços controle e dois a quatro poços estimulados por tecido por camundongo.
- Eutanásia do camundongo por luxação cervical sob anestesia, com um método secundário como pneumotórax bilateral. Utilizou-se um camundongo fêmea C57BL/6J, com 32 g de 7 meses de idade, alimentado com dieta hiperlipídica a 45% por 4 meses.
NOTA: Este protocolo também pode ser usado para o sexo masculino, bem como outras cepas, dietas e idades. - Borrifar com etanol a 70% e usar tesoura para fazer uma pequena incisão lateral (~ 1 cm) no centro da pele abdominal, afastar a pele apertando cada lado com polegar e indicador e dobrar a pele abdominal inferior para revelar os depósitos subcutâneos posteriores. Localizar e remover o linfonodo inguinal e dissecar o tecido adiposo inguinal imediatamente posterior ao linfonodo inguinal usando pinças.
- Para coletar o tecido adiposo gonadal, fazer uma incisão lateral e uma vertical no peritônio para acessar a cavidade peritoneal. Segure o coxim gorduroso gonadal com uma pinça e corte ao longo do útero (ou epidídimo para os machos) para remover o tecido adiposo gonadal. Coloque os depósitos coletados em um prato de 6 poços.
- Retire bem o tecido, coloque em um tapete de silicone e corte em pedaços de 5 a 7 mg com tesoura.
- Pesar 25 a 30 mg (cinco ou seis pedaços) para cada ensaio bem e colocar em uma placa de ensaio de 48 poços. Coloque o tecido em uma toalha limpa antes de pesar para remover qualquer meio. Pesar o barco de peso após a remoção do tecido e registrar o peso de qualquer resíduo deixado para trás. Limpe o barco de peso entre as amostras e re-tar, se necessário. Use um novo barco de peso para cada tecido.
- Depois de pesadas todas as amostras de tecido, colocar a placa de ensaio de 48 poços em uma incubadora de 37 °C e 10% de CO2 por 15 minutos.
- Prepare uma placa de 6 poços, com um poço para cada tecido a ser coletado de cada camundongo. Colocar 4 mL de DMEM à temperatura ambiente em cada poço a ser utilizado.
3. Ensaio de lipólise
- Executar coleta de mídia. Realizar a transferência do meio e posterior coleta de amostras em um exaustor de fumaça estéril para minimizar a contaminação potencial de fontes externas.
- Em t = 0, remova o meio e adicione 400 μL por poço de controle ou meio de estimulação e coloque a placa em uma incubadora de 37 °C e 10% de CO2 . Para cultura de tecidos ex vivo , remover cuidadosamente o meio usando uma pipeta; A sucção nunca deve ser usada.
NOTA: Alternativamente, prepare uma segunda placa com meios de controle e estimulação, e transfira os tecidos. - Em t = 1, 2, 3 e 4 h, coletar 200 μL de meio, substituir por 200 μL do meio de controle ou estimulação apropriado e retornar a placa de ensaio à incubadora. Conservar a placa de recolha a 4 °C. Para determinar a capacidade de tamponamento FFA da mídia BSA, use uma coleta adicional em 24 h.
NOTA: Os experimentos podem ser interrompidos aqui, e o meio coletado pode ser armazenado a -20 °C.
- Em t = 0, remova o meio e adicione 400 μL por poço de controle ou meio de estimulação e coloque a placa em uma incubadora de 37 °C e 10% de CO2 . Para cultura de tecidos ex vivo , remover cuidadosamente o meio usando uma pipeta; A sucção nunca deve ser usada.
4. Ensaio colorimétrico de AGL
- Aqueça os reagentes à temperatura ambiente e dissolva um frasco de reagente de cor A com um frasco de solvente A e um frasco de reagente de cor B com um frasco de solvente B. A partir da data de reconstituição, esses reagentes são melhor utilizados dentro de 1 semana. Descarte 1 mês após a reconstituição.
- Descongele e misture as amostras.
- Crie uma curva padrão FFA. A solução padrão é de 1 mM. Use o seguinte volume com os reagentes para a curva padrão: 25 μL, 20 μL, 15 μL, 10 μL, 10 μL (diluição 1:2), 10 μL (diluição 1:4), 10 μL (diluição 1:8) e 10 μL de água para a faixa máxima. Para baixos níveis de AGL, 10 μL de 1 mM, 0,8 mM, 0,6 mM, 0,4 mM, 0,2 mM, 0,1 mM e 0,05 mM podem ser mais aplicáveis.
- Pipetar padrões e amostras em uma placa de ensaio de 96 poços. O volume de amostra recomendado é de 10 μL. Inclua três poços com o mesmo volume de meio BSA que as amostras para correção de fundo.
NOTA: Se as concentrações da amostra se situarem fora do intervalo da curva padrão, repetir o ensaio, ajustando o volume da amostra para 2-25 μL. - Adicionar 150 μL de reagente A a cada poço e misturar. Evite gerar bolhas. Estoure quaisquer bolhas com uma agulha de calibre fino. Incubar a placa de ensaio a 37 °C durante 5 min.
- Leia a absorbância da placa a 550 nm e 660 nm de referência (Leitura A).
- Adicionar 75 μL de reagente B a cada poço e misturar. Evite gerar bolhas. Estoure quaisquer bolhas com uma agulha de calibre fino. Incubar a placa de ensaio a 37 °C durante 5 min.
- Leia novamente a absorbância da placa a 550 nm e 660 nm de referência (Leitura B).
5. Ensaio colorimétrico de glicerol
- Reconstituir o reagente glicerol livre com 36 mL de água ultrapura e aclimatar-se à temperatura ambiente. Esses reagentes são melhor usados dentro de algumas semanas. Descarte 2 meses após a reconstituição.
- Descongele e misture as amostras.
- Crie uma curva padrão de glicerol fazendo uma diluição em série de sete pontos e 2 vezes da solução padrão de glicerol e um branco de água.
NOTA: A curva padrão é relativamente linear até 25 μL de glicerol 2,8 mM, mas não linear em concentrações mais elevadas. - Pipetar 25 μL cada um do padrão e amostras para a placa de ensaio de 96 poços. Inclua três poços com a mídia BSA para correção de fundo.
- Adicionar 175 μL de reagente de glicerol livre a cada poço e misturar. Evite gerar bolhas. Estoure quaisquer bolhas com uma agulha de calibre fino. Incubar a placa de ensaio a 37 °C durante 5 min.
- Leia a absorbância da placa a 540 nm.
6. Cálculo da taxa lipolítica
- Comece com valores de densidade óptica (OD). Para glicerol, use A540 OD valores diretamente. Calcular o DO do ensaio de AGL de acordo com a seguinte fórmula:
OD = (Leitura B: A 550 - A 660) - (Leitura A: A550 - A660) - Utilizar a curva padrão para calcular os níveis de AGL e glicerol nas amostras coletadas. Plotar os valores padrão OD no eixo y e, no eixo x, usar concentrações padrão em relação ao volume da amostra (ou seja, a concentração dos poços com 20 μL do padrão FFA 1 mM em uma placa com amostras de 10 μL é igual a 2 mM). Ajuste uma linha de tendência linear:
y = mx + b - Inspecione visualmente a curva padrão e remova quaisquer pontos fora da faixa linear do ensaio. Calcule as concentrações das amostras utilizando a equação:
Concentração da amostra: x = (OD - b) ÷ m - Ajustar e reensaiar amostras que estejam fora do intervalo de ensaio linear. Para obter a concentração final da amostra, subtraia a concentração dos poços de fundo contendo apenas meios BSA da concentração das amostras.
- Calcular os moles de AGL e glicerol produzidos por cada amostra em cada ponto de tempo, de acordo com a fórmula:
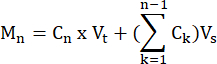
onde C n = concentração no tempo t = n; Vt = volume total no poço; Vs = volume de coleta da amostra; e M, n = moles produzidos no tempo t = n (quando as concentrações estão em mM e os volumes estão em mL, o débito é μMol).
Por exemplo, em vários momentos:
M 1 = C1 × Vt
M 4 = C4 × Vt + (C1 + C2+ C3)Vs
ou
M 4 = C4 × Vt + C3 × V s + C2 × V s + C1 ×V s - Normalizar para o peso do tecido dividindo pelo peso do tecido para cada amostra em gramas para obter unidades de μmol/g. Para células cultivadas, os valores são apresentados como μmol/poço. Certifique-se de que o número de células e a eficiência da diferenciação sejam comparáveis de poço para poço.
NOTA: Diferenças na eficiência de proliferação ou diferenciação complicarão a interpretação dos resultados e exigirão outro método de normalização (por exemplo, normalização para proteína; ver discussão). - Calcular a inclinação do μmol/g produzido (eixo y) versus o tempo (eixo x) para cada amostra individualmente.
- Em uma planilha, isso pode ser feito usando a função =SLOPE(known_ys,known_xs). Em uma nova célula, digite "=SLOPE" (em seguida, use o cursor para realçar os valores de glicerol ou FFA da amostra em μmol/g e, em seguida, para realçar os valores de tempo correspondentes).
- Verifique a linearidade dos dados. Os valores de R2 são uma maneira rápida de determinar a linearidade das amostras. Em uma planilha, isso pode ser feito usando a função =RSQ(known_ys,known_xs), da mesma maneira descrita na etapa 6.7.1, mas a entrada inicial é =RSQ. Certifique-se de que os valores de R2 estejam > 0,98; valores mais baixos indicam desvio da linearidade. Isso pode resultar de um erro de medição/amostragem ou perda de linearidade.
- Outra forma de testar a linearidade é realizar uma regressão linear para cada amostra e plotar os resíduos. Em um software de análise estatística, gere uma tabela XY com um único valor Y para cada ponto de tempo. Selecione Analisar > regressão linear simples e selecione a caixa para Gráfico residual antes de pressionar OK. O gráfico residual aparecerá como um novo gráfico.
- Use o FFA e a taxa de produção de glicerol (ou seja, inclinação [(μmol/g/h]) para cada amostra como um ponto de dados individual para realizar análise estatística e plotar valores se diferentes condições lipolíticas estiverem sendo comparadas. Se as taxas lipolíticas estiverem sendo comparadas entre genótipos, use duas ou três amostras por animal como réplicas técnicas e use a média para um ponto de dados por animal, de modo que o tamanho da amostra seja igual ao número de animais.
Resultados
Medimos a taxa lipolítica basal e estimulada de adipócitos diferenciados in vitro. Os pré-adipócitos primários do tecido adiposo branco inguinal foram diferenciados em adipócitos pelo tratamento de células confluentes com 5 μM de dexametasona, 0,5 mM de IBMX, 1 μg/mL de insulina e 1 μM de troglitazona por 4 dias, seguidos por um tratamento adicional de 3 dias com 1 μg/mL de insulina. As células foram incubadas em meio sem insulina por 24 h antes do ensaio de lipólise. No tempo = 0h, as células fora...
Discussão
Aqui, fornecemos um protocolo básico para medir a taxa de lipólise em adipócitos e tecido adiposo ex vivo . Para quantificar a lipólise, é importante medir a taxa lipolítica na fase linear. Usamos uma técnica de amostragem seriada, onde uma grande fração de meios é coletada e substituída por meios frescos em intervalos regulares. Este método semiconservador permite a adição de BSA fresco com capacidade tamponante de AGL e retarda a inibição do feedback, estendendo a duração da lipólise linear....
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Este trabalho foi apoiado pelo US National Institutes of Health grant R01DK126944 para S.M.R.
Materiais
| Name | Company | Catalog Number | Comments |
| 24-Well tissue culture treated plate | Corning Inc | 3527 | Must be tissue culture treated for adipocyte differntiation |
| 48-Well flat bottom plate with lid | Corning Inc | 353078 | Can be tissue culture treated |
| 6-Well flat bottom plate with lid | Corning Inc | 353046 | Can be tissue culture treated |
| 96-Well PCR Plate | USA sceintific | 1402-9100 | Any conical 0.2 mL PCR plate will be convenient |
| Bovine Serum Albumin | Sigma Aldrich | A9418 | FFA free BSA such as A8806, is also commonly used. The BSA should not have detectable FFA, also lot to lot variations in BSA can impact the observed rate of lipolysis |
| CL-316,243 | Sigma Aldrich | C5976 | CAS #: 138908-40-4 availaible from other suppliers |
| CO2 incubator | PHCBI | MCO-170AICUVH | CO2 should ideally be set to 10% for adipose tissue, however 5% CO2 will also work |
| DMEM, low glucose, no phenol red | Thermofischer | 11054020 | Any phenol red free media should work, DMEM/F12, RPMI, but should contain volatile buffering capacity, i.e. biocarbonate |
| FFA-free Bovine serum albumin | Equitech-Bio, Inc, | BAH66 | |
| Free Glycerol Reagent | Sigma Aldrich | F6428 | |
| Glycerol Standard Solution | Sigma Aldrich | G7793 | This can also be made by diluting glycerol to the desired concentration |
| HR Series NEFA Standard Solution | Fujifilm | 276-76491 | |
| HR Series NEFA-HR (2) Color Reagent A | Fujifilm | 999-34691 | |
| HR Series NEFA-HR (2) Color Reagent B | Fujifilm | 991-34891 | |
| HR Series NEFA-HR (2) Solvent A | Fujifilm | 995-34791 | |
| HR Series NEFA-HR (2) Solvent B | Fujifilm | 993-35191 | |
| Microbiological Incubator | Fischer Scientific | S28668 | Any incubator at 37C can be used |
| Nunc MicroWell 96-Well Plates | Thermo Scientific | 269620 | Any optically clear, flat bottom 96-well plate works |
| Silicone Laboratory Benchtop Mat | VWR | 76045-300 | Glass plate can also be used. Absorbant surfaces are not recommended |
| Spectrophotometer/Microplate Reader | Molecular devices | SpectraMax i3x | Any plate reader that can read at 540, 550 and 660 mm will work |
| V Bovine serum albumin | Sigma-Aldrich | 810531 | |
| WypAll X70 Wipers | Kimberly-Clark | 41200 | Any high quality paper towel will work |
Referências
- Vaughan, M., Berger, J. E., Steinberg, D. Hormone-sensitive lipase and monoglyceride lipase activities in adipose tissue. The Journal of Biological Chemistry. 239, 401-409 (1964).
- Zimmermann, R., et al. Fat mobilization in adipose tissue is promoted by adipose triglyceride lipase. Science. 306 (5700), 1383-1386 (2004).
- Lass, A., et al. Adipose triglyceride lipase-mediated lipolysis of cellular fat stores is activated by CGI-58 and defective in Chanarin-Dorfman syndrome. Cell Metabolism. 3 (5), 309-319 (2006).
- Stralfors, P., Bjorgell, P., Belfrage, P. Hormonal regulation of hormone-sensitive lipase in intact adipocytes: identification of phosphorylated sites and effects on the phosphorylation by lipolytic hormones and insulin. Proceedings of the National Academy of Sciences. 81 (11), 3317-3321 (1984).
- Miyoshi, H., et al. Perilipin promotes hormone-sensitive lipase-mediated adipocyte lipolysis via phosphorylation-dependent and -independent mechanisms. The Journal of Biological Chemistry. 281 (23), 15837-15844 (2006).
- Sztalryd, C., et al. Perilipin A is essential for the translocation of hormone-sensitive lipase during lipolytic activation. The Journal of Cell Biology. 161 (6), 1093-1103 (2003).
- Lafontan, M., Langin, D. Lipolysis and lipid mobilization in human adipose tissue. Progress in Lipid Research. 48 (5), 275-297 (2009).
- Grabner, G. F., Xie, H., Schweiger, M., Zechner, R. Lipolysis: cellular mechanisms for lipid mobilization from fat stores. Nature Metabolism. 3 (11), 1445-1465 (2021).
- Weiss, S. B., Kennedy, E. P., Kiyasu, J. Y. The enzymatic synthesis of triglycerides. The Journal of Biological Chemistry. 235, 40-44 (1960).
- Kennedy, E. P. Biosynthesis of complex lipids. Federation Proceedings. 20, 934-940 (1961).
- Wendel, A. A., Lewin, T. M., Coleman, R. A. Glycerol-3-phosphate acyltransferases: rate limiting enzymes of triacylglycerol biosynthesis. Biochimica et Biophysica Acta. 1791 (6), 501-506 (2009).
- Johansson, S. M., Lindgren, E., Yang, J. N., Herling, A. W., Fredholm, B. B. Adenosine A1 receptors regulate lipolysis and lipogenesis in mouse adipose tissue-interactions with insulin. European Journal of Pharmacology. 597 (1-3), 92-101 (2008).
- Gnad, T., et al. Adenosine activates brown adipose tissue and recruits beige adipocytes via A2A receptors. Nature. 516 (7531), 395-399 (2014).
- Fried, S. K., et al. Resistance to the antilipolytic effect of insulin in adipocytes of African-American compared to Caucasian postmenopausal women. Journal of Lipid Research. 51 (5), 1193-1200 (2010).
- Lee, M. J., Fried, S. K. Optimal protocol for the differentiation and metabolic analysis of human adipose stromal cells. Methods in Enzymology. 538, 49-65 (2014).
- Fricke, K., Heitland, A., Maronde, E. Cooperative activation of lipolysis by protein kinase A and protein kinase C pathways in 3T3-L1 adipocytes. Endocrinology. 145 (11), 4940-4947 (2004).
- Bergan, H. E., Kittilson, J. D., Sheridan, M. A. PKC and ERK mediate GH-stimulated lipolysis. Journal of Molecular Endocrinology. 51 (2), 213-224 (2013).
- Schmitz-Peiffer, C. The tail wagging the dog--regulation of lipid metabolism by protein kinase C. The FEBS Journal. 280 (21), 5371-5383 (2013).
- Carmen, G. Y., Victor, S. M. Signalling mechanisms regulating lipolysis. Cellular Signalling. 18 (4), 401-408 (2006).
- Zu, L., et al. Bacterial endotoxin stimulates adipose lipolysis via toll-like receptor 4 and extracellular signal-regulated kinase pathway. The Journal of Biological Chemistry. 284 (9), 5915-5926 (2009).
- Zhang, H. H., Halbleib, M., Ahmad, F., Manganiello, V. C., Greenberg, A. S. Tumor necrosis factor-alpha stimulates lipolysis in differentiated human adipocytes through activation of extracellular signal-related kinase and elevation of intracellular cAMP. Diabetes. 51 (10), 2929-2935 (2002).
- Tan, X., et al. TNF-α downregulates CIDEC via MEK/ERK pathway in human adipocytes. Obesity. 24 (5), 1070-1080 (2016).
- Laurencikiene, J., et al. NF-kappaB is important for TNF-alpha-induced lipolysis in human adipocytes. Journal of Lipid Research. 48 (5), 1069-1077 (2007).
- van Hall, G., et al. Interleukin-6 stimulates lipolysis and fat oxidation in humans. The Journal of Clinical Endocrinology and Metabolism. 88 (7), 3005-3010 (2003).
- Wueest, S., et al. Mesenteric fat lipolysis mediates obesity-associated hepatic steatosis and insulin resistance. Diabetes. 65 (1), 140-148 (2016).
- Trujillo, M. E., et al. Interleukin-6 regulates human adipose tissue lipid metabolism and leptin production in vitro. The Journal of Clinical Endocrinology and Metabolism. 89 (11), 5577-5582 (2004).
- Kitamura, T., et al. Insulin-induced phosphorylation and activation of cyclic nucleotide phosphodiesterase 3B by the serine-threonine kinase Akt. Molecular and Cellular Biology. 19 (9), 6286-6296 (1999).
- Chakrabarti, P., et al. Insulin inhibits lipolysis in adipocytes via the evolutionarily conserved mTORC1-Egr1-ATGL-mediated pathway. Molecular and Cellular Biology. 33 (18), 3659-3666 (2013).
- Collins, S., Daniel, K. W., Petro, A. E., Surwit, R. S. Strain-specific response to beta 3-adrenergic receptor agonist treatment of diet-induced obesity in mice. Endocrinology. 138 (1), 405-413 (1997).
- Surwit, R. S., Dixon, T. M., Petro, A. E., Daniel, K. W., Collins, S. Diazoxide restores beta3-adrenergic receptor function in diet-induced obesity and diabetes. Endocrinology. 141 (10), 3630-3637 (2000).
- Gettys, T. W., et al. Age-dependent changes in beta-adrenergic receptor subtypes and adenylyl cyclase activation in adipocytes from Fischer 344 rats. Endocrinology. 136 (5), 2022-2032 (1995).
- Mowers, J., et al. Inflammation produces catecholamine resistance in obesity via activation of PDE3B by the protein kinases IKKε and TBK1. eLife. 2, e01119 (2013).
- Valentine, J. M., et al. β3-Adrenergic receptor downregulation leads to adipocyte catecholamine resistance in obesity. The Journal of Clinical Investigation. 132 (2), e153357 (2022).
- Collins, S., et al. Impaired expression and functional activity of the beta 3- and beta 1-adrenergic receptors in adipose tissue of congenitally obese (C57BL/6J ob/ob) mice. Molecular Endocrinology. 8 (4), 518-527 (1994).
- Collins, S., Surwit, R. S. The beta-adrenergic receptors and the control of adipose tissue metabolism and thermogenesis. Recent Progress in Hormone Research. 56, 309-328 (2001).
- Dixon, T. M., Daniel, K. W., Farmer, S. R., Collins, S. CCAAT/enhancer-binding protein alpha is required for transcription of the beta 3-adrenergic receptor gene during adipogenesis. The Journal of Biological Chemistry. 276 (1), 722-728 (2001).
- Lohse, M. J., Benovic, J. L., Codina, J., Caron, M. G., Lefkowitz, R. J. beta-Arrestin: a protein that regulates beta-adrenergic receptor function. Science. 248 (4962), 1547-1550 (1990).
- Nantel, F., et al. The human beta 3-adrenergic receptor is resistant to short term agonist-promoted desensitization. Molecular Pharmacology. 43 (4), 548-555 (1993).
- Liggett, S. B., Freedman, N. J., Schwinn, D. A., Lefkowitz, R. J. Structural basis for receptor subtype-specific regulation revealed by a chimeric beta 3/beta 2-adrenergic receptor. Proceedings of the National Academy of Sciences. 90 (8), 3665-3669 (1993).
- Baker, J. G. The selectivity of beta-adrenoceptor agonists at human beta1-, beta2- and beta3-adrenoceptors. British Journal of Pharmacology. 160 (5), 1048-1061 (2010).
- Lafontan, M. Inhibition of epinephrine-induced lipolysis in isolated white adipocytes of aging rabbits by increased alpha-adrenergic responsiveness. Journal of Lipid Research. 20 (2), 208-216 (1979).
- Baker, J. G. The selectivity of beta-adrenoceptor antagonists at the human beta1, beta2 and beta3 adrenoceptors. British Journal of Pharmacology. 144 (3), 317-322 (2005).
- Jensen, M. D., Nielsen, S. Insulin dose response analysis of free fatty acid kinetics. Metabolism. 56 (1), 68-76 (2007).
- Jensen, M. D., Haymond, M. W., Gerich, J. E., Cryer, P. E., Miles, J. M. Lipolysis during fasting. Decreased suppression by insulin and increased stimulation by epinephrine. The Journal of Clinical Investigation. 79 (1), 207-213 (1987).
- Heckmann, B. L., et al. Defective adipose lipolysis and altered global energy metabolism in mice with adipose overexpression of the lipolytic inhibitor G0/G1 switch gene 2 (G0S2). The Journal of Biological Chemistry. 289 (4), 1905-1916 (2014).
- Shin, H., et al. Lipolysis in brown adipocytes is not essential for cold-induced thermogenesis in mice. Cell Metabolism. 26 (5), 764.e5-777.e5 (2017).
- Treble, D. H., Mayer, J. Glycerolkinase activity in white adipose tissue of obese-hyperglycaemic mice. Nature. 200, 363-364 (1963).
- Possik, E., et al. New mammalian glycerol-3-phosphate phosphatase: role in beta-cell, liver and adipocyte metabolism. Frontiers in Endocrinology. 12, 706607 (2021).
- Romero Mdel, M., Sabater, D., Fernandez-Lopez, J. A., Remesar, X., Alemany, M. Glycerol production from glucose and fructose by 3T3-L1 cells: a mechanism of adipocyte defense from excess substrate. PLoS One. 10 (10), e0139502 (2015).
- Mugabo, Y., et al. Identification of a mammalian glycerol-3-phosphate phosphatase: Role in metabolism and signaling in pancreatic beta-cells and hepatocytes. Proceedings of the National Academy of Sciences. 113 (4), E430-E439 (2016).
- Hanson, R. W., Reshef, L. Glyceroneogenesis revisited. Biochimie. 85 (12), 1199-1205 (2003).
- Vaughan, M. The production and release of glycerol by adipose tissue incubated in vitro. The Journal of Biological Chemistry. 237, 3354-3358 (1962).
- Jensen, M. D., Ekberg, K., Landau, B. R. Lipid metabolism during fasting. American Journal of Physiology-Endocrinology and Metabolism. 281 (4), E789-E793 (2001).
- Ballard, F. J., Hanson, R. W., Leveille, G. A. Phosphoenolpyruvate carboxykinase and the synthesis of glyceride-glycerol from pyruvate in adipose tissue. The Journal of Biological Chemistry. 242 (11), 2746-2750 (1967).
- Reshef, L., Hanson, R. W., Ballard, F. J. A possible physiological role for glyceroneogenesis in rat adipose tissue. The Journal of Biological Chemistry. 245 (22), 5979-5984 (1970).
- Gorin, E., Tal-Or, Z., Shafrir, E. Glyceroneogenesis in adipose tissue of fasted, diabetic and triamcinolone treated rats. European Journal of Biochemistry. 8 (3), 370-375 (1969).
- Elia, M., Zed, C., Neale, G., Livesey, G. The energy cost of triglyceride-fatty acid recycling in nonobese subjects after an overnight fast and four days of starvation. Metabolism. 36 (3), 251-255 (1987).
- Reshef, L., et al. Glyceroneogenesis and the triglyceride/fatty acid cycle. Journal of Biological Chemistry. 278 (33), 30413-30416 (2003).
- Edens, N. K., Leibel, R. L., Hirsch, J. Mechanism of free fatty acid re-esterification in human adipocytes in vitro. Journal of Lipid Research. 31 (8), 1423-1431 (1990).
- Vaughan, M., Steinberg, D. Effect of hormones on lipolysis and esterification of free fatty acids during incubation of adipose tissue in vitro. Journal of Lipid Research. 4, 193-199 (1963).
- Brooks, B., Arch, J. R., Newsholme, E. A. Effects of hormones on the rate of the triacylglycerol/fatty acid substrate cycle in adipocytes and epididymal fat pads. Federation of European Biochemical Societies Letters. 146 (2), 327-330 (1982).
- Bjorntorp, P., Karlsson, M., Hovden, A. Quantitative aspects of lipolysis and reesterification in human adipose tissue in vitro. Acta Medica Scandinavica. 185 (1-2), 89-97 (1969).
- Angel, A., Desai, K., Halperin, M. L. Free fatty acid and ATP levels in adipocytes during lipolysis. Metabolism. 20 (1), 87-99 (1971).
- Husted, A. S., et al. Autocrine negative feedback regulation of lipolysis through sensing of NEFAs by FFAR4/GPR120 in WAT. Molecular Metabolism. 42, 101103 (2020).
- Fain, J. N., Shepherd, R. E. Free fatty acids as feedback regulators of adenylate cyclase and cyclic 3':5'-AMP accumulation in rat fat cells. The Journal of Biological Chemistry. 250 (16), 6586-6592 (1975).
- Burns, T. W., Langley, P. E., Terry, B. E., Robinson, G. A. The role of free fatty acids in the regulation of lipolysis by human adipose tissue cells. Metabolism. 27 (12), 1755-1762 (1978).
- Kalderon, B., et al. Suppression of adipose lipolysis by long-chain fatty acid analogs. Journal of Lipid Research. 53 (5), 868-878 (2012).
- Schweiger, M., et al. Measurement of lipolysis. Methods in Enzymology. 538, 171-193 (2014).
- Decaunes, P., Bouloumie, A., Ryden, M., Galitzky, J. Ex vivo analysis of lipolysis in human subcutaneous adipose tissue explants. Bio-Protocol. 8 (3), e2711 (2018).
- Roy, D., Myers, J. M., Tedeschi, A. Protocol for assessing ex vivo lipolysis of murine adipose tissue. STAR Protocols. 3 (3), 101518 (2022).
- Baskaran, P., Thyagarajan, B. Measurement of basal and forskolin-stimulated lipolysis in inguinal adipose fat pads. Journal of Visualized Experiments. 125 (125), 55625 (2017).
- Reilly, S. M., et al. Catecholamines suppress fatty acid re-esterification and increase oxidation in white adipocytes via STAT3. Nature Metabolism. 2 (7), 620-634 (2020).
- Liu, L., et al. Isolation of mouse stromal vascular cells for monolayer culture. Methods in Molecular Biology. 1566, 9-16 (2017).
- DeLuca, J. H., Reilly, S. M. . Methods in Molecular Biology. , (2023).
- Richard, G., Vernon, R. A. C. New Perspectives in Adipose Tissue. Butterworth-Heinemann. , (1985).
- Brito, M. N., Botion, L. M., Brito, N. A., Kettelhut, I. C., Migliorini, R. H. Lipolysis and glycerokinase activity in brown adipose tissue of rat fed a high protein, carbohydrate-free diet. Hormone and Metabolic Research. 26 (1), 51-52 (1994).
- Bertin, R. Glycerokinase activity and lipolysis regulation in brown adipose tissue of cold acclimated rats. Biochimie. 58 (4), 431-434 (1976).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados