A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
مجموعة من تقنيات الفحص للحصول على نظرة عامة سريعة على وظيفة العدلات
In This Article
Summary
يتميز هذا البروتوكول بمجموعة من المقايسات الوظيفية للعدلات لاستخدامها كطريقة فحص لتغطية الوظائف من مسارات الإشارات المختلفة. يتضمن البروتوكول تقييما أوليا وبسيطا لصلاحية الخلية ، والنقاء ، وإنتاج أنواع الأكسجين التفاعلية ، والهجرة في الوقت الفعلي ، والبلعمة ، واقتراح أولي لمصائد العدلات خارج الخلية.
Abstract
تعرف العدلات بأنها واحدة من خطوط الدفاع الأولى في الاستجابة المناعية الفطرية ويمكن أن تؤدي العديد من الوظائف الخلوية الخاصة ، مثل الانجذاب الكيميائي ، والهجرة العكسية ، والبلعمة ، وتحلل الإنزيمات السامة للخلايا والمستقلبات ، وإطلاق الحمض النووي كمصائد خارج الخلية للعدلات (NETs). لا تقوم العدلات بتنظيم الإشارات بإحكام فحسب ، بل تشارك أيضا في تنظيم المكونات الأخرى للجهاز المناعي. نظرا لأن العدلات الطازجة متباينة بشكل نهائي وقصيرة العمر ومتغيرة للغاية بين الأفراد ، فمن المهم تحقيق أقصى استفادة من العينات التي تم جمعها. غالبا ما يحتاج الباحثون إلى إجراء فحوصات الفحص لتقييم نظرة عامة على العديد من وظائف العدلات التي قد تتأثر بظروف معينة قيد التقييم. تم تطوير مجموعة من الاختبارات بعد عملية عزل واحدة للعدلات ذات الكثافة الطبيعية لتلبية هذه الحاجة ، سعيا لتحقيق التوازن بين السرعة والشمولية والتكلفة والدقة. يمكن استخدام النتائج لتبرير وتوجيه دراسات المتابعة المتعمقة. يمكن تنفيذ هذا الإجراء في متوسط وقت 4 ساعات ويتضمن تقييم صلاحية الخلية ، وإنتاج أنواع الأكسجين التفاعلية (ROS) ، والهجرة في الوقت الفعلي ، والبلعمة من الخميرة على الشرائح الزجاجية ، وترك خلايا كافية لنهج أكثر تفصيلا مثل دراسات omics. علاوة على ذلك ، يتضمن الإجراء طريقة لمراقبة اقتراح أولي للشبكات بسهولة بعد تلطيخ بانوبتيكي سريع لوحظ بواسطة المجهر الضوئي ، مع عدم وجود علامات محددة ، وإن كانت كافية للإشارة إلى ما إذا كان من المفيد بذل المزيد من الجهود بهذه الطريقة. يجمع تنوع الوظائف التي تم اختبارها بين النقاط المشتركة بين الاختبارات ، مما يقلل من وقت التحليل والنفقات. تم تسمية الإجراء باسم NeutroFun Screen ، وعلى الرغم من وجود قيود ، إلا أنه يوازن بين العوامل المذكورة أعلاه. علاوة على ذلك ، فإن الهدف من هذا العمل ليس مجموعة اختبار محددة ، بل هو مبدأ توجيهي يمكن تعديله بسهولة وفقا لموارد ومتطلبات كل مختبر.
Introduction
العدلات هي الخلايا المناعية الفطرية الأكثر وفرة في دم الإنسان ومن المعروف أنها تلعب دورا رئيسيا في العدوى والالتهابات ، كونها أول المستجيبين الذين يصلون إلى موقع تلف الأنسجة1. في السنوات الأخيرة ، كان هناك اعتراف متزايد بالدور الحاسم الذي تلعبه العدلات في مجموعة متنوعة من الأمراض وفي دعم التوازن2. لا تقوم العدلات بتنظيم الإشارات بإحكام فحسب ، بل تشارك أيضا في تنظيم المكونات الأخرى للجهاز المناعي3،4،5. لذلك ، فإن التحقيق في العدلات والعديد من وظائفها الخلوية غير العادية ، مثل الانجذاب الكيميائي ، والهجرة العكسية6 ، والبلعمة7 ، والانفجار التنفسي8 ، وإطلاق مصائد العدلات خارج الخلية (NETs) 7 ، أمر حتمي في العديد من سياقات البحث حيث يكون من الضروري تقييم التغيرات الوظيفية أو المورفولوجية أو الجزيئية المحتملة التي تسببها ظروف محددة قيد التحليل.
العدلات المعزولة حديثا متباينة بشكل نهائي ، وقصيرة العمر ، وديناميكية للغاية ، ويمكن تنشيطهابسهولة 9. ومع ذلك ، لم يتم بعد تحقيق طريقة تخزين فعالة لا تؤثر على استجابات العدلات ، مما يجعل من الصعب إجراء فحوصات متعددة يجب أن تكون دون انقطاع. علاوة على ذلك ، قد لا تكون التحليلات الوظيفية الموصوفةسابقا 10،11 ، بناء على المقايسات التي تتطلب قياس الخلايا و / أو تلطيخ الفلورسنت ، خيارا قابلا للتطبيق عند الحاجة إلى تقييم واسع وأولي للعدلات.
لمعالجة هذه المشكلات ، يصف هذا البروتوكول مجموعة من الاختبارات التي يمكن إجراؤها بعد عملية عزل واحدة ، بما في ذلك تقييم صلاحية الخلية ، وإنتاج أنواع الأكسجين التفاعلية (ROS) ، والهجرة في الوقت الفعلي ، والبلعمة في Saccharomyces cerevisiae ، والتي يمكن استخدام نتائجها لتبرير دراسات المتابعة المتعمقة. تم تصميم هذا الإجراء ، المسمى NeutroFun Screen ، ليشمل أنشطة المستجيب الرئيسية ، باستثناء التحبب ، ويمكن إكماله في متوسط وقت قدره 4 ساعات ، بما في ذلك 1 ساعة من التنشيط. بالإضافة إلى ذلك ، يمكن استخدام الخلايا المتبقية لنهج أكثر تفصيلا مثل دراسات omics. تكمن ميزة هذه الطريقة في توازنها بين السرعة والشمولية والتكلفة والدقة.
وعلاوة على ذلك، هناك طريقة للمراقبة بسهولة لاقتراح أولي بشأن شبكات شبكية، دون علامات محددة، ولكنها تكفي لبيان ما إذا كان من المفيد بذل مزيد من الجهود في هذا الاتجاه. يهدف تنوع الوظائف التي تم اختبارها إلى الجمع بين النقاط المشتركة بين الاختبارات ، مما يقلل من وقت التحليل والنفقات. الهدف الرئيسي من هذه الطريقة هو توفير تحليل وظيفي متوازن فيما يتعلق بالسرعة والشمولية والتكلفة والدقة التي تسمح بإلقاء نظرة عامة على استجابة العدلات ، مما يجعلها خطوة أولية مفيدة في التحقيق في آثار المحفزات الجديدة على العدلات ذات الكثافة الطبيعية.
Protocol
اتبعت جميع التجارب بدقة المبادئ التوجيهية الأخلاقية التي وضعها مجلس المراجعة المؤسسية في جامعة برازيليا (العملية 13364819.0.0000.5558) ، وتم تحديد العينات بواسطة الرموز لضمان عدم الكشف عن هوية المانح. تم الحصول على الخلايا من متبرعين ذكور أصحاء طبيعيين تتراوح أعمارهم بين 18 و 35 عاما ، والذين وقعوا على الموافقة المستنيرة واستوفوا معايير الأهلية التالية: غير المدخنين / vapers ، ولا توجد حالات صحية مزمنة ، ولا يوجد تاريخ من الحالات الالتهابية في آخر 14 يوما.
1. جمع الدم
- ضع 0.3 مل من 5000 وحدة دولية / مل من الهيبارين (انظر جدول المواد) في حقنة معقمة سعة 20 مل لتهقيمها.
- ضع عاصبة وريدية حوالي 4 بوصات فوق موقع البزل وحدد الوريد المرفقي أو الرأسي المتوسط لبزل الوريد.
ملاحظة: تأكد من أن إجمالي وقت العاصبة لا يتجاوز 1 دقيقة. - تنظيف موقع ثقب مع الكحول 70 ٪ وإجراء بزل الوريد.
- اقلب المحقنة برفق ثلاث أو أربع مرات بعد جمع الدم لخلط الدم والهيبارين بشكل صحيح.
2. عزل العدلات
ملاحظة: يتم عزل الكريات البيض متعددة الأشكال النووية (PMNs) من خلال الطرد المركزي المتدرج الكثافة يليه تحلل منخفض التوتر لخلايا الدم الحمراء المتبقية (RBC) ، كما هو موضح سابقا11 مع بعض التغييرات. هذه الطريقة ليست إلزامية لإجراء فحوصات الفحص ، ويمكن استبدالها طالما أن الطريقة المختارة تؤدي إلى صلاحية >97٪ ، أو تحضير أو تنشيط <3٪ من PMNs ، وتنتج خلايا كافية لجميع المقايسات والنسخ المتماثلة والظروف. يعد تنفيذ هذه الخطوات في ظل ظروف معقمة واستخدام محاليل خالية من السموم الداخلية أمرا إلزاميا لتجنب تنشيط الخلية.
- اصنع تخفيفات 12 مل من وسائط فصل 60٪ و 70٪ (متوفرة تجاريا ؛ انظر جدول المواد) في أنابيب مخروطية سعة 50 مل.
- قم بإعداد التدرج من الأسفل إلى الأعلى بإضافة 4 مل في وقت التخفيف بنسبة 60٪ على التخفيف بنسبة 70٪ ، باستخدام ماصة 5 مل. افعل ذلك برفق لمنع خلط الواجهة.
- ضع طبقة 12 مل من الدم الهيبارين بعناية فوق تدرج الكثافة. أجهزة الطرد المركزي عند 200 × جم لمدة 15 دقيقة في درجة حرارة الغرفة.
ملاحظة: من هذه الخطوة فصاعدا ، حتى تنشيط PMN ، يجب حفظ جميع الكواشف والأنابيب المستخدمة في مبرد مملوء بالثلج. - تخلص من طبقة الخلايا البلازمية / أحادية النواة ، ثم انقل الطبقة برفق فوق حبيبات كرات الدم الحمراء إلى أنبوبين مخروطيين سعة 15 مل مع حوالي 7.5 مل في كل منهما. قم بتكوين حجم الأنبوب باستخدام محلول الملح المتوازن من هانك (HBSS ؛ انظر جدول المواد).
- أجهزة الطرد المركزي عند 300 × جم لمدة 5 دقائق عند 19 درجة مئوية.
- اغسل بيليه الخلية باستخدام HBSS.
- تخلص من المادة الطافية عن طريق صب الأنبوب وإعادة تعليق الحبيبات برفق في 7 مل من HBSS.
- جهاز طرد مركزي عند 300 × جم لمدة 5 دقائق عند 19 درجة مئوية لإزالة جميع وسائط الفصل.
- أداء تحلل منخفض التوتر من كرات الدم الحمراء المتبقية.
- تخلص من المادة الطافية وادمج الكريات في أنبوب واحد.
- أعد تعليق حبيبات RBC / PMN في 3 مل من H2O المعقم وأضف 3 مل من HBSS (2x) في غضون 25 ثانية لاستعادة الأسمولية. ثم ، أجهزة الطرد المركزي عند 300 × جم لمدة 5 دقائق عند 19 درجة مئوية.
- كرر الخطوتين 2.8.1 و2.8.2 للحصول على حبيبات بيضاء خالية من كريات الدم الحمراء.
ملاحظة: يجب إزالة المادة الطافية في أسرع وقت ممكن لتقليل ملامسة العدلات لمنتجات انهيار كرات الدم الحمراء. بدلا من ذلك ، يمكن استبدال التحلل الثاني منخفض التوتر عن طريق تعليق طبقة كرات الدم الحمراء المتبقية برفق وإزالة كل المواد الطافية ، حيث أن كرات الدم الحمراء المتبقية سوف تترسب فوق حبيبات PMN.
- تخلص من المادة الطافية عن طريق سكب الأنبوب ، وأعد تعليق PMNs برفق في المخزن المؤقت المتبقي ، وانقلها إلى أنبوب دقيق بارد مثلج.
ملاحظة: تأكد من إضافة تعليق توضيحي إلى وحدة التخزين أثناء نقل الخلايا المعاد تعليقها باستخدام ماصة دقيقة. - انقل 3 × 1 ميكرولتر من معلق الخلية إلى شريحة زجاجية نظيفة (ثلاثة آبار سعة كل منها 1 ميكرولتر) وصبغها ببانوبتيك سريع (انظر جدول المواد) لتقييم التشكل والنقاء12.
- للتلوين باستخدام بانوبتيك سريع ، اغمر الشريحة خمس مرات في المثبت الشامل رقم 1 ، وست مرات في eosin رقم 2 ، ومرتين في الهيماتوكسيلين رقم 3 ، مع كل غمر يدوم 1 ثانية.
- اغسل الشريحة الزجاجية برفق بالماء المقطر.
- السماح لاستنزاف والهواء الجاف.
- راقب تحت المجهر وعد 300 خلية عشوائية في كل بئر ، وبالتالي تمييز العدلات عن الخلايا المحببة الأخرى.
- نقل 1 ميكرولتر من تعليق الخلية إلى 49 ميكرولتر من 0.2٪ صبغة تريبانالزرقاء 13 وعد الخلايا باستخدام غرفة نيوباور ، والتمييز بين الخلايا الميتة والقابلة للحياة.
- اضبط تركيز الخلية على 6,667 خلية / ميكرولتر باستخدام محلول من 50٪ بلازما ذاتية و 50٪ HBSS مكملة بالكالسيوم والمغنيسيوم. قسم 6667 خلية / ميكرولتر بالتساوي بين الأنابيب الدقيقة المقابلة للظروف المراد اختبارها ، بما في ذلك التحكم السلبي.
ملاحظة: يمكن استخدام أي تركيز خلية مشابه للعدلات المنتشرة في الكائن الحي النموذجي ، ولكن من المهم استخدام نفس تركيز الخلية في جميع التجارب من أجل التكاثر.
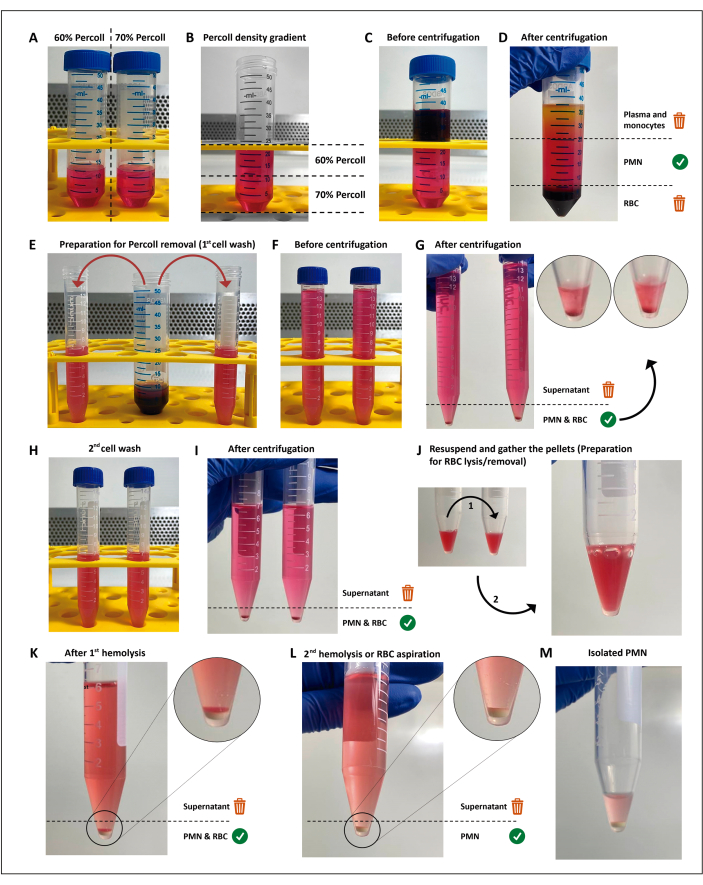
الشكل 1: بروتوكول عزل العدلات. يتم تكديس تركيزين من وسط الفصل (percoll) (A) (B) ، ثم يتم وضع طبقات الدم فوق تدرج الفصل (C). بعد الطرد المركزي ، يكون PMN في الطبقة المركزية (D) ، والتي تنقسم إلى أنبوبين سعة 15 مل (E). يتم غسل تعليق الخلية مرتين في HBSS والطرد المركزي (G-I) لإزالة الوسائط ، ثم يتم إعادة الخلايا ، ويتم تقديم كرات الدم الحمراء المتبقية إلى جولتين من تحلل منخفض التوتر (J-M). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
3. التحضير لتنشيط العدلات
- في الأنابيب الدقيقة سعة 1.5 مل ، قم بإعداد نظام تنشيط لكل حالة بحيث يكون تركيز الخلية النهائي 6600 خلية / ميكرولتر. على سبيل المثال ، لاختبار تأثيرات 100 نانومتر fMLP (N-formyl-methionyl-leucyl-phenylalanine ؛ انظر جدول المواد) ، أضف 5 ميكرولتر من 10 ميكرومتر fMLP إلى 495 ميكرولتر من 6,667 خلية / ميكرولتر معلق. بالنسبة للتحكم السلبي (غير المحفز) ، أضف HBSS الذي يحتوي على Ca2+ و Mg2+.
ملاحظة: لإثبات هذه المنهجية ، تم استخدام التركيزات النهائية التالية للمحفزات: 100 نانومتر fMLP ، 16 ميكرومتر من fallaxin ، ببتيد مضاد للميكروباتطبيعي 14 ، و 100 نانومتر PMA (phorbol 12-myristate 13-acetate) (انظر جدول المواد). - احتضان في 37 درجة مئوية دون دوران.
ملاحظة: يتم أخذ جميع الحصصات للمقايسات الوظيفية من تعليق الخلية هذا ، ويشار إليه فيما يلي باسم نظام التنشيط.
4. مقايسة كلوريد النيتروتيترازوليوم الأزرق (NBT) لتقييم إنتاج أنواع الأكسجين التفاعلية
- إعداد حل عمل NBT: لكل حالة تجريبية ، قم بإعداد حل عمل NBT (انظر جدول المواد) من 6 mM باستخدام الخطوات التالية:
- قم بإذابة 0.0005 جم من NBT في 10 ميكرولتر من ثنائي ميثيل سلفوكسيد (DMSO) والدوامة لمدة 15 دقيقة على الأقل.
- أضف 90 ميكرولتر من HBSS Ca2 + Mg2+ ودوامة تصل إلى دقيقتين.
ملاحظة: يجب تنفيذ جميع الخطوات التي تتضمن NBT في الظلام.
- قم بإجراء اختبار شرائح NBT.
- بعد 20 دقيقة من تنشيط الخلية ، امزج تعليق الخلية برفق وانقل بعناية 2 ميكرولتر من PMN إلى شريحة زجاجية نظيفة. احتضان لمدة 20 دقيقة في غرفة رطبة على حرارة 37 درجة مئوية.
ملاحظة: لا تنشر تعليق الخلية كثيرا على الشريحة ؛ وإلا فقد يجف قبل الحضانة. - أضف 1 ميكرولتر من محلول عمل NBT فوق الخلايا واحتضانها لمدة 20 دقيقة محمية من الضوء.
- تجفيف الشريحة بالهواء الساخن وإصلاحه مع قطرة من الميثانول في كل بئر لمدة 1 دقيقة. بقعة مع 0.03٪ سافرانين (انظر جدول المواد) لمدة 1 دقيقة.
- اغسل الشريحة الزجاجية برفق بالماء المقطر.
- اترك الشريحة تجف في الهواء وراقبها تحت المجهر.
- عد 100 خلية عشوائية في كل بئر ، مع التمييز بين العدلات مع وبدون رواسب الفورمازان.
- بعد 20 دقيقة من تنشيط الخلية ، امزج تعليق الخلية برفق وانقل بعناية 2 ميكرولتر من PMN إلى شريحة زجاجية نظيفة. احتضان لمدة 20 دقيقة في غرفة رطبة على حرارة 37 درجة مئوية.
- إجراء مقايسة قياس الطيف الضوئي NBT.
- بعد 40 دقيقة من تنشيط الخلية ، امزج تعليق الخلية برفق وانقل 90 ميكرولتر من PMNs من نظام التنشيط إلى أنبوب دقيق نظيف. ثم أضف بعناية 20 ميكرولتر من محلول 6 mM NBT. احتضان في الظلام لمدة 20 دقيقة عند 37 درجة مئوية.
- أضف 100 ميكرولتر من 10٪ كبريتات دوديسيل الصوديوم (SDS ؛ انظر جدول المواد) والدوامة.
- Sonicate باستخدام tip-sonicator بسعة 60 ٪ ، خمس دورات من 15 ثانية لكل منها مع فترات 15 ثانية. جهاز طرد مركزي عند 12000 × جرام لمدة 5 دقائق.
- انقل 60 ميكرولتر من المادة الطافية إلى صفيحة 96 بئرا صافية القاع وقم بقياس امتصاص منتج الفورمازان عند 570 نانومتر.
5. مقايسة البلعمة
- قم بإعداد معلق 33000 خميرة / ميكرولتر لكل حالة ، كما هو موضح أدناه:
- أضف ما يقرب من 0.75 مجم من الخميرة الجافة (Saccharomyces cerevisiae ؛ انظر جدول المواد) إلى 200 ميكرولتر من HBSS Ca2 + Mg2+ واحتضانها في خلاط حراري عند 100 درجة مئوية مع 500 دورة في الدقيقة لمدة 15 دقيقة على الأقل.
- تجانس الخليط عن طريق الدوامة ونقل 5 ميكرولتر من تعليق الخميرة إلى 45 ميكرولتر من صبغة تريبان الزرقاء 0.2٪. عد الخمائر باستخدام غرفة نيوباور.
- اضبط تركيز المعلق الأولي على 33000 خلية خميرة / ميكرولتر باستخدام HBSS Ca2 + Mg2+. الحفاظ على تعليق على الجليد حتى الاستخدام.
- بعد 20 دقيقة من تنشيط الخلية ، امزج تعليق الخلية برفق وانقل 5 ميكرولتر من نظام التنشيط إلى 5 ميكرولتر من 33000 خميرة / ميكرولتر معلق Saccharomyces cerevisiae في أنبوب دقيق معقم جديد.
ملاحظة: نسبة العدلات إلى الخميرة هي 1: 5 (PMN: الخميرة). - انقل على الفور 6 ميكرولتر من تعليق PMN / الخميرة إلى ثلاثة آبار من شريحة زجاجية نظيفة (2 ميكرولتر لكل منها) واحتضان الشريحة في غرفة مرطبة لمدة 40 دقيقة.
ملاحظة: لا تنشر تعليق الخلية كثيرا على الشريحة ؛ خلاف ذلك ، قد يجف قبل الحضانة. - جفف الشريحة تحت الهواء الساخن وصمة عار باستخدام بانوبتيك سريع ، كما هو موضح في الخطوة 2.9 أعلاه.
ملاحظة: الخطوة الثالثة من تلطيخ بانوبتيك سريع أمر بالغ الأهمية للتحليل المجهري للشريحة. يمكن أن يؤدي تلطيخ الشريحة لمدة ≥3 ثوان في هذه الخطوة إلى جعلها غير صالحة للتحليل ، حيث سيكون من الصعب التمييز بين الخميرة والفصوص النووية العدلة. - راقب الشرائح تحت المجهر ، عد 100 عدلة عشوائية لكل بئر والتمييز بين PMNs الإيجابية والسلبية للبلعمة.
ملاحظة: يشير جسيم خميرة واحد على الأقل داخل الغشاء الخلوي PMN أو في اتصال مباشر معه إلى وجود PMN إيجابي للبلعمة. إذا كنت مهتما بنسبة الخميرة / العدلات ، فاحسب عدد جزيئات الخميرة المبتلعة أيضا.
6. الفحص الكيميائي PMN في الوقت الحقيقي
ملاحظة: يتم إجراء اختبار الترحيل بشكل مشابه للبروتوكول الموضح سابقا15 ، مع التعديلات التالية:
- قم بإعداد التدرج الكيميائي عن طريق إضافة 160 ميكرولتر من الجاذب الكيميائي (على سبيل المثال ، fMLP أو IL-8 أو C5 أو LTB4 ؛ انظر جدول المواد) إلى الغرفة السفلية للوحة محلل الخلايا في الوقت الحقيقي (RTCA) القائمة على المعاوقة. بالنسبة للضوابط السلبية والفراغات ، أضف 160 ميكرولتر من HBSS Ca2 + Mg2+.
- نعلق الغرفة العلوية وإضافة 25 ميكرولتر من HBSS Ca2 + Mg2+. احتضان في درجة حرارة الغرفة لمدة 1 ساعة على الأقل لتشكيل التدرج الكيميائي.
- بعد 60 دقيقة من تنشيط الخلية ، امزج تعليق الخلية برفق وضع 60 ميكرولتر من تعليق الخلية في الغرفة العلوية. أضف 60 ميكرولتر من HBSS Ca2 + Mg2+ إلى الفراغ.
- ضع لوحة RTCA وبرمج برنامج RTCA لقياس مؤشر الخلية (CI) كل 60 ثانية لمدة 2 ساعة.
ملاحظة: يمكن غسل لوحات RTCA لإعادة استخدامها كما هو موضح سابقا16. باختصار ، اغسل غرف RTCA والأقطاب الكهربائية بمحلول ملحي من الفوسفات (PBS) ثلاث مرات ، ثم بمياه فائقة النقاء من النوع الأول مرتين. احتضان الحجرة السفلية والعلوية بنسبة 0.25٪ تربسين 0.53 مللي متر حمض الإيثيلين ديامينيترايتيك (EDTA) لمدة 40 دقيقة. تغسل بالماء النقي ثلاث مرات.
7. صافي مقايسة موحية
- بعد 10 دقائق من تنشيط الخلية ، امزج تعليق الخلية برفق وانقل 4 ميكرولتر من PMNs من كل نظام تنشيط قيد التقييم ، مقسما إلى بئرين من شريحة زجاجية نظيفة. احتضان في غرفة رطبة على حرارة 37 درجة مئوية لمدة 30 دقيقة.
- أضف 1 ميكرولتر من DNAse I إلى أحد الآبار واحتضانها لمدة 20 دقيقة عند 37 درجة مئوية (في غرفة رطبة).
- قم بتجفيف الشريحة والبقع باستخدام بانوبتيك سريع ، كما هو موضح سابقا في الخطوة 2.9 من قسم "عزل العدلات".
- تقييم الشرائح تحت المجهر.
ملاحظة: ابحث عن أي إشارة إلى إصدار NET ، تتميز بوجود هياكل تشبه الويب. بمجرد تحديده ، تأكد مما إذا كان علاج DNA I قادرا على إزالة مثل هذه الهياكل. يشير هذا الفحص إلى تكوين NET ، حيث يلزم إجراء اختبارات إضافية لتأكيد وجودها.
النتائج
استوفت طريقة العزل القائمة على الكثافة المستخدمة في هذه الدراسة (الشكل 1) معايير التجارب المقترحة. تضمنت معلمات العدلات التي تم الحصول عليها من هذه الطريقة الصلاحية ≥98٪ ، والنقاء ≥94٪ ، وإنتاجية الخلية ≥1.5 × 107 ، مع عدم وجود تنشيط يمكن اكتشافه بواسطة اختبارات الفحص. خ?...
Discussion
العدلات هي خلايا ديناميكية للغاية وسريعة الاستجابة وقصيرة العمر ولا يمكن حفظها بالتبريدحتى الآن 19 ، مما يجعل التحقيقات في بيولوجيتها صعبة. لذلك ، من الضروري اتباع خطوات دقيقة للحصول على العدلات القابلة للحياة والمخصبة والراحة11,20. استخدمت هذه ...
Disclosures
يعلن أصحاب البلاغ عدم وجود تضارب في المصالح.
Acknowledgements
يعترف المؤلفون بوكالات التمويل التالية: FAPDF و CNPq و CAPES و UnB و FINEP و FINATEC.
Materials
| Name | Company | Catalog Number | Comments |
| CIM-Plate 16 | Agilent | 5665825001 | |
| CLARIOstar Plate Reader | BMG LABTECH | US Patent Number 9,733,124 Product details: MARS Data Analysis Software | |
| Dimethyl sulfoxide | Dinâmica | 1582 | |
| DNAse I | Sigma - Aldrich | DN 25 | |
| Ethylenediaminetetraacetic acid disodium salt dihydrate | Sigma - Aldrich | E5134 | |
| Fast panoptic stain | Laborclin | 620529 | |
| Glass slide | Exacta | 7102 | |
| Hank’s Balanced Salt Solution with calcium, with magnesium, without phenol red. | Sigma - Aldrich | 55037C | |
| Hank’s Balanced Salt Solution without calcium chloride, magnesium sulfate and sodium bicarbonate. | Sigma - Aldrich | H4641 | |
| Heparin | Blau | 7896014655229 | |
| Laminar flow cabinet | Veco | VLFS-12 | |
| Microscope | Zeiss | 415501-0101-002 | Product details: Primostar 1 |
| Mixing Block | BIOER | MB-102 | |
| Neubauer improved bright-lined | New Optik | 1110000 | |
| N-formyl-methionyl-leucyl-phenylalanine | Sigma - Aldrich | F3506 | |
| Nitroblue tetrazolium | Neon | CAS 298-83-9 | |
| Percoll | Cytiva | 17089101 | separation media |
| Phorbol 12-myristate 13-acetate | Sigma - Aldrich | P8139 | |
| Phosphate buffered saline tablet | Sigma - Aldrich | P4417 | |
| ROTOFIX 32 A | Hettich | 1206 | |
| Saccharomyces cerevisiae | Fleischmann | ||
| Safranin | Sigma - Aldrich | 50240 | |
| Sodium dodecyl sulfate | Cytiva | 17-1313-01 | |
| Sonicator | Qsonica | Q125 | |
| Trypan blue solution | Vetec | C.I. 23850 | |
| Vortex Genie 2 | Scientific Industries, Inc. | 0K-0500-902 | |
| xCELLigence Real-Time Cell Analysis (RTCA) DP (dual purpose) | Agilent | 380601050 | Product details: RTCA system composed of detection hardware, cell plates and software |
References
- Nauseef, W. M., Borregaard, N. Neutrophils at work. Nature Immunology. 15 (7), 602-611 (2014).
- Groeneweg, L., Hidalgo, A. Emerging roles of infiltrating granulocytes and monocytes in homeostasis. Cellular and Molecular Life Sciences. 77 (19), 3823-3830 (2020).
- Rosales, C., Lowell, C. A., Schnoor, M., Uribe-Querol, E. Neutrophils: their role in innate and adaptive immunity 2017. Journal of Immunology Research. 2017, 9748345 (2017).
- Castro, M., et al. Proteome analysis of resting human neutrophils. Protein & Peptide Letters. 13 (5), 481-487 (2006).
- Li, Y., et al. The regulatory roles of neutrophils in adaptive immunity. Cell Communication and Signaling. 17, 147 (2019).
- de Oliveira, S., Rosowski, E. E., Huttenlocher, A. Neutrophil migration in infection and wound repair: going forward in reverse. Nature Reviews Immunology. 16 (6), 378-391 (2016).
- Burn, G. L., Foti, A., Marsman, G., Patel, D. F., Zychlinsky, A. The neutrophil. Immunity. 54 (7), 1377-1391 (2021).
- El-Benna, J., et al. Priming of the neutrophil respiratory burst: role in host defense and inflammation. Immunological Reviews. 273 (1), 180-193 (2016).
- Castro, M. S., Cilli, E. M., Fontes, W. Combinatorial synthesis and directed evolution applied to the production of alpha-helix forming antimicrobial peptides analogues. Current Protein & Peptide Science. 7 (6), 473-478 (2006).
- Mihaila, A. C., et al. Transcriptional profiling and functional analysis of N1/N2 neutrophils reveal an immunomodulatory effect of S100A9-blockade on the pro-inflammatory N1 subpopulation. Frontiers in Immunology. 12, 708770 (2021).
- Kuhns, D. B., Priel, D. A. L., Chu, J., Zarember, K. A. Isolation and functional analysis of human neutrophils. Current Protocols in Immunology. 111 (1), 7-23 (2015).
- Paulíková, E., Kociková, A., Sabol, M. Modification of a panoptic method of staining isolated cells. Bratislavske Lekarske Listy. 94 (12), 638-640 (1993).
- Strober, W. Trypan blue exclusion test of cell viability. Current Protocols in Immunology. 111 (1), 1-3 (2015).
- Libério, M. S., et al. Anti-proliferative and cytotoxic activity of pentadactylin isolated from Leptodactylus labyrinthicus on melanoma cells. Amino Acids. 40 (1), 51-59 (2011).
- Cano, P. M., Vargas, A., Lavoie, J. P. A real-time assay for neutrophil chemotaxis. BioTechniques. 60 (5), 245-251 (2016).
- Stefanowicz-Hajduk, J., Adamska, A., Bartoszewski, R., Ochocka, J. R. Reuse of E-plate cell sensor arrays in the xCELLigence Real-Time Cell Analyzer. BioTechniques. 61 (3), 117-122 (2016).
- Björkstén, B., Nyström, K., Lindqvist, B. The nitroblue tetrazolium (NBT) test in endemic benign (epidemic) nephropathy. Acta Medica Scandinavica. 199 (1-6), 147-150 (1976).
- Aquino, E., et al. Proteomic analysis of neutrophil priming by PAF. Protein & Peptide Letters. 23 (2), 142-151 (2016).
- Blanter, M., Gouwy, M., Struyf, S. Studying neutrophil function in vitro: cell models and environmental factors. Journal of Inflammation Research. 14, 141-162 (2021).
- Hsu, A. Y., Peng, Z., Luo, H., Loison, F. Isolation of human neutrophils from whole blood and buffy coats. Journal of Visualized Experiments. (175), e62837 (2021).
- Moghadam, Z. M., Henneke, P., Kolter, J. From flies to men: ROS and the NADPH oxidase in phagocytes. Frontiers in Cell and Developmental Biology. 9, 628991 (2021).
- Pattan, S. S., Bhat, K. G., Pattar, G. D., Kuntagi, M. Comparison of three different techniques for isolation of neutrophils from blood and their utility in performing nitroblue tetrazolium test. International Journal of Basic and Applied Physiology. 8 (1), 41 (2019).
- Gooty, J. R., Shashirekha, A., Guntakala, V. R., Palaparthi, R. Estimation of phagocytic activity of polymorphonuclear leukocytes in chronic and aggressive periodontitis patients with nitroblue tetrazolium test. Journal of Indian Society of Periodontology. 23 (4), 316 (2019).
- Langer, S., et al. Clinical and laboratory profiles of 17 cases of chronic granulomatous disease in north India. Indian Journal of Hematology and Blood Transfusion. 37 (1), 45-51 (2021).
- Oualha, R., et al. Infection of human neutrophils with Leishmania infantum or Leishmania major strains triggers activation and differential cytokines release. Frontiers in Cellular and Infection Microbiology. 9, 153 (2019).
- Zilinskas, J., Zekonis, J., Zekonis, G., Valantiejiene, A., Periokaite, R. The reduction of nitroblue tetrazolium by total blood in periodontitis patients and the aged. Stomatologijal. 9 (4), 105-108 (2007).
- Benov, L. Improved formazan dissolution for bacterial MTT assay. Microbiology Spectrum. 9 (3), e01637 (2021).
- Chen, Y., Junger, W. G. Measurement of oxidative burst in neutrophils. Methods in Molecular Biology. 844, 115-124 (2012).
- Richardson, M. P., Ayliffe, M. J., Helbert, M., Davies, E. G. A simple flow cytometry assay using dihydrorhodamine for the measurement of the neutrophil respiratory burst in whole blood: comparison with the quantitative nitrobluetetrazolium test. Journal of Immunological Methods. 219 (1-2), 187-193 (1998).
- Jancinová, V., et al. The combined luminol/isoluminol chemiluminescence method for differentiating between extracellular and intracellular oxidant production by neutrophils. Redox Report. 11 (3), 110-116 (2006).
- Nosál, R., et al. Pharmacological intervention with oxidative burst in human neutrophils. Interdisciplinary Toxicology. 10 (2), 56-60 (2017).
- Mol, S., et al. Efficient neutrophil activation requires two simultaneous activating stimuli. International Journal of Molecular Sciences. 22 (18), 10106 (2021).
- Schneider, L., et al. Flow cytometry evaluation of CD14/CD16 monocyte subpopulations in systemic sclerosis patients: a cross sectional controlled study. Advances in Rheumatology. 61 (1), 27 (2021).
- Akin, E., Pelen, N. N., Tiryaki, I. U., Yalcin, F. Parameter identification for gompertz and logistic dynamic equations. PLoS One. 15 (4), e0230582 (2020).
- Guy, J. B., et al. Evaluation of the cell invasion and migration process: A comparison of the video microscope-based scratch wound assay and the boyden chamber assay. Journal of Visualized Experiments. (129), e56337 (2017).
- Brinkmann, V., et al. Neutrophil extracellular traps kill bacteria. Science. 303 (5663), 1532-1535 (2004).
- de Bont, C. M., Koopman, W. J. H., Boelens, W. C., Pruijn, G. J. M. Stimulus-dependent chromatin dynamics, citrullination, calcium signalling and ROS production during NET formation. Biochimica et Biophysica Acta. Molecular Cell Research. 1865, 1621-1629 (2018).
- Masuda, S., et al. Measurement of NET formation in vitro and in vivo by flow cytometry. Cytometry Part A. 91 (8), 822-829 (2017).
- Zharkova, O., et al. A flow cytometry-based assay for high-throughput detection and quantification of neutrophil extracellular traps in mixed cell populations. Cytometry Part A. 95 (3), 268-278 (2019).
- Hosseinnejad, A., et al. DNase I functional microgels for neutrophil extracellular trap disruption. Biomaterials Science. 10 (1), 85-99 (2022).
- Chrysanthopoulou, A., et al. Neutrophil extracellular traps promote differentiation and function of fibroblasts. The Journal of Pathology. 233 (3), 294-307 (2014).
- Tong, M., Abrahams, V. M. Visualization and quantification of neutrophil extracellular traps. Methods in Molecular Biology. 2255, 87-95 (2021).
- Santana, C. J. C., et al. Biological properties of a novel multifunctional host defense peptide from the skin secretion of the chaco tree frog, boana raniceps. Biomolecules. 10 (5), 790 (2020).
- Murphy, M. P., et al. Guidelines for measuring reactive oxygen species and oxidative damage in cells and in vivo. Nature Metabolism. 4 (6), 651-662 (2022).
- Boero, E., et al. Use of flow cytometry to evaluate phagocytosis of staphylococcus aureus by human neutrophils. Frontiers in Immunology. 12, 635825 (2021).
- Karsten, C. B., et al. A versatile high-throughput assay to characterize antibody-mediated neutrophil phagocytosis. Journal of Immunological Methods. 471, 46-56 (2019).
- Smirnov, A., Solga, M. D., Lannigan, J., Criss, A. K. Using imaging flow cytometry to quantify neutrophil phagocytosis. Methods in Molecular Biology. 2087, 127-140 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved