このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
好中球機能の概要を把握するための一連のスクリーニング技術
要約
このプロトコルは異なったシグナリング細道からの機能をカバーするスクリーニング方法として使用されるべき一組の好中球の機能試金を特色にする。プロトコルは好中球の細胞外トラップの細胞生存率、純度、活性酸素種の生産、実時間移動、食作用および予備の提案の初期および簡単な評価を含んでいる。
要約
好中球は、自然免疫応答における防御の最前線の1つとして知られており、走化性、逆遊走、食作用、細胞傷害性酵素および代謝産物の脱顆粒、好中球細胞外トラップ(NET)としてのDNAの放出など、多くの特定の細胞機能を実行することができます。好中球は、それ自体が厳密に制御されたシグナル伝達を持っているだけでなく、免疫系の他の構成要素の制御にも関与しています。新鮮な好中球は末期分化型で、寿命が短く、個人差が大きいため、採取したサンプルを最大限に活用することが重要です。研究者は、評価中の特定の条件によって影響を受ける可能性のある多くの好中球機能の概要を評価するために、スクリーニングアッセイを実施する必要があることがよくあります。このニーズに対応するために、正常密度好中球の単一の単離プロセスに続く一連のテストが開発され、速度、包括性、コスト、および精度のバランスが模索されました。この結果は、詳細な追跡調査の推論と指針として使用できます。この手順は平均4時間で実施でき、スライドガラス上での細胞生存率、活性酸素種(ROS)産生、リアルタイム移動、酵母の食作用の評価が含まれ、オミクス研究などのより詳細なアプローチに十分な細胞を残します。さらに、この手順には、光学顕微鏡で観察された高速パノプティック染色後のNETの予備的な提案を簡単に観察する方法が含まれていますが、特定のマーカーはありませんが、その方法でさらに努力する価値があるかどうかを示すのに十分です。テストする機能の多様性は、テスト間の共通点を組み合わせ、分析時間とコストを削減します。この手順はNeutroFun Screenと名付けられ、制限はありますが、前述の要素のバランスが取れています。さらに、この作業の目的は、明確なテストセットではなく、各ラボのリソースと要求に合わせて簡単に調整できるガイドラインです。
概要
好中球は、ヒトの血液中に最も多く存在する自然免疫細胞であり、感染や炎症に大きな役割を果たすことが知られており、組織損傷部位に最初に到達する応答者です1。近年、好中球がさまざまな疾患において、また恒常性維持(ホメオスタシス)を支える重要な役割を担っているという認識が高まっています2。好中球は、それ自体が厳密に制御されたシグナル伝達を持っているだけでなく、免疫系の他の構成要素の調節にも関与しています3,4,5。したがって、好中球と、走化性、逆遊走6、食作用7、呼吸バースト8、好中球細胞外トラップ(NET)7の放出など、好中球とその多くの異常な細胞機能を調べることは、分析中の特定の条件によって引き起こされる潜在的な好中球の機能的、形態学的、または分子的変化を評価する必要がある多くの研究状況で不可欠です。
単離されたばかりの好中球は、末端分化型で、寿命が短く、動的で、活性化しやすい9。しかし、好中球の応答に影響を与えない効率的な保存法はまだ達成されておらず、中断のない複数のアッセイを行うことは困難です。さらに、サイトメトリーおよび/または蛍光染色を必要とするアッセイに基づく、以前に記載された機能解析10,11は、好中球の広範かつ初期評価が必要な場合には実行可能な選択肢ではないかもしれない。
これらの問題に対処するために、このプロトコルでは、細胞生存率、活性酸素種(ROS)産生、リアルタイム移動、 出芽酵母の食作用の評価など、単一の分離プロセスに続いて実施できる一連のテストを記述しており、その結果を使用して詳細なフォローアップ研究を推論することができます。NeutroFun Screenと名付けられたこの手順は、脱顆粒を除く主要なエフェクター活動を網羅するように設計されており、1時間の活性化を含む平均4時間で完了することができます。さらに、残りの細胞は、オミクス研究などのより詳細なアプローチに使用できます。この方法の利点は、速度、包括性、コスト、および精度のバランスにあります。
さらに、NETの予備的な提案を、特定のマーカーなしで簡単に観察する方法がありますが、その方向でのさらなる努力が価値があるかどうかを示すのに十分です。テストされる機能の多様性は、テスト間の共通点を組み合わせることを目的としており、分析時間とコストを削減します。この方法の主な目的は、好中球の応答の概要を可能にする速度、包括性、コスト、および精度に関するバランスの取れた機能分析を提供することであり、正常密度好中球に対する新しい刺激の影響を調査する際の有用な最初のステップになります。
プロトコル
すべての実験は、ブラジリア大学の治験審査委員会(プロセス13364819.0.0000.5558)によって設定された倫理ガイドラインに厳密に従い、サンプルはドナーの匿名性を確保するためのコードによって識別されました。細胞は、インフォームドコンセントに署名し、次の適格基準を満たした18〜35歳の正常な健康な男性ドナーから取得されました:非喫煙者/ベイパー、慢性的な健康状態なし、および過去14日間の炎症状態の病歴なし。
1.採血
- 0.3 mL の 5,000 IU/mL ヘパリン( 材料表を参照)を滅菌 20 mL シリンジに無菌的に入れてヘパリン化します。
- 穿刺部位の上に約4インチの静脈止血帯を適用し、静脈穿刺用の正中肘静脈または橈側静脈を特定します。
注意: 止血帯の合計時間が1分を超えないようにしてください。 - 穿刺部位を70%アルコールで洗浄し、静脈穿刺を行います。
- 血液を採取した後、シリンジを3〜4回静かに反転させて、血液とヘパリンを適切に混合します。.
2. 好中球の単離
注:多形核白血球(PMN)は、密度勾配遠心分離とそれに続く残りの赤血球(RBC)の低張溶解によって単離されます。この分析法は、スクリーニングアッセイの実施に必須ではなく、選択した分析法が生存率>97%、PMNのプライミングまたは活性化が<3%となり、すべてのアッセイ、反復、および条件に十分な細胞が得られれば、置き換えることができます。これらのステップを無菌条件下で実施し、エンドトキシンフリー溶液を使用することは、細胞の活性化を避けるために必須です。
- 60%および70%の分離培地(市販品、 材料表を参照)を12 mLに希釈して、50 mLのコニカルチューブに入れます。
- 5 mL ピペットを使用して、60% 希釈と 70% 希釈で一度に 4 mL を添加し、下から上にグラジエントを調製します。インターフェイスが混ざらないように、これを静かに行ってください。
- 密度勾配の上に12 mLのヘパリン処理血液を慎重に重ねます。室温で200 x g で15分間遠心分離します。
注:このステップ以降、PMNが活性化されるまで、使用するすべての試薬とチューブは、氷で満たされたクーラーボックスに保管する必要があります。 - 血漿/単核球層を廃棄し、赤血球ペレットの上の層を、それぞれ約7.5 mLの入った2本の15 mLコニカルチューブに静かに移します。ハンクの平衡塩溶液(HBSS、 材料表を参照)でチューブ容量を構成します。
- 19°Cで5分間、300 x g で遠心分離します。
- 細胞ペレットをHBSSで洗浄します。
- チューブを注ぐことで上清を廃棄し、ペレットを7 mLのHBSSに静かに再懸濁します。
- 19°Cで300 x g で5分間遠心分離し、すべての分離媒体を除去します。
- 残りの赤血球の低張溶解を実行します。
- 上澄みを捨て、ペレットを1本のチューブに入れます。
- RBC/PMNペレットを3 mLの滅菌H2Oに再懸濁し、25秒以内に3 mLのHBSS(2x)を加えて浸透圧を回復させます。その後、19°Cで5分間、300 x g で遠心分離します。
- 手順2.8.1と2.8.2を繰り返して、赤血球を含まない白色のペレットを作ります。
注:好中球と赤血球分解生成物との接触を最小限に抑えるために、上清をできるだけ早く除去する必要があります。あるいは、2回目の低張溶解は、残りのRBCがPMNペレットの上に沈殿するため、残留RBC層を静かに再懸濁し、すべての上清を除去することによって置き換えることができます。
- チューブを注ぐことで上清を廃棄し、残りのバッファーにPMNを静かに再懸濁し、氷冷したマイクロチューブに移します。
注:再懸濁した細胞をマイクロピペットで移す際は、必ずボリュームに注釈を付けてください。 - 3 x 1 μLの細胞懸濁液を清潔なスライドガラス(各1 μLのウェル3つ)に移し、形態および純度評価のために高速パノプティック( 材料表を参照)で染色します12。
- 高速パノプティックで染色するには、スライドをパノプティック固定液 n° 1 に 5 回、エオシン n° 2 に 6 回、ヘマトキシリン n° 3 に 2 回浸漬し、各浸漬を 1 秒間持続させます。
- スライドガラスを蒸留水でやさしく洗います。
- 水気を切り、風乾させます。
- 顕微鏡で観察し、各ウェルで300個のランダムな細胞を数え、好中球を他の顆粒球と区別します。
- 細胞懸濁液1 μLを49 μLの0.2%トリパンブルー色素13に移し、ノイバウアーチャンバーを使用して細胞をカウントし、死細胞と生細胞を区別します。
- 50%自家血漿と50%HBSSの溶液にカルシウムとマグネシウムを添加して、細胞濃度を6,667細胞/μLに調整します。6,667細胞/μLの懸濁液を、ネガティブコントロールを含む試験条件に対応するマイクロチューブに均等に分配します。
注:モデル生物の循環好中球に類似した細胞濃度を使用できますが、再現性のためにすべての実験で同じ細胞濃度を使用することが重要です。
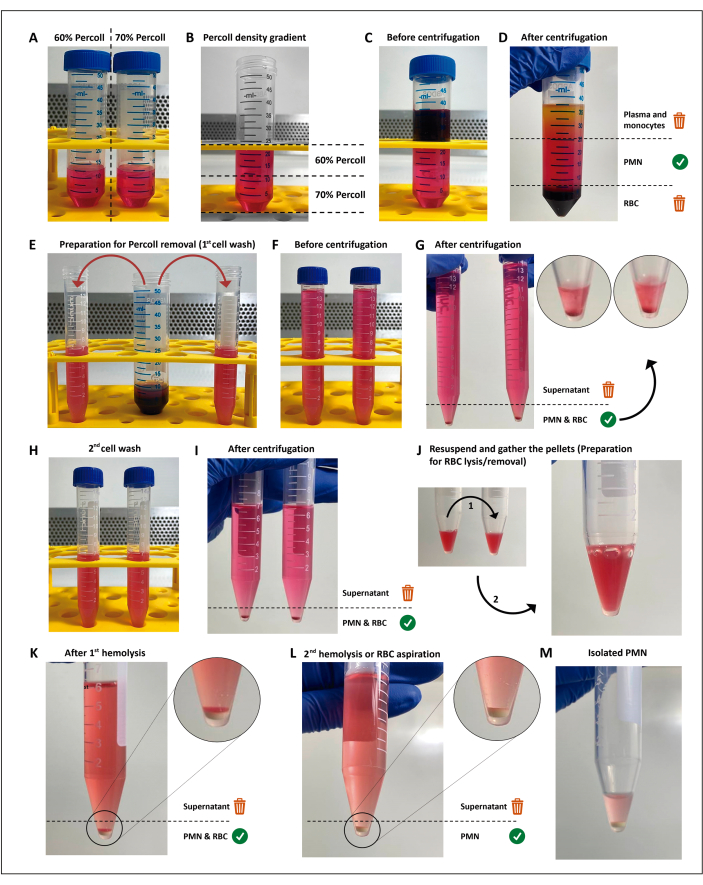
図1:好中球分離プロトコル。2 つの濃度の分離培地(パーコール)(A)をスタックし(B)、次に分離グラジエントの上に血液を層状にします(C)。遠心分離後、PMNは中央層(D)にあり、2つの15 mLチューブ(E)に分割されます。細胞懸濁液をHBSSで2回洗浄し、遠心分離(G-I)して培地を除去し、次に細胞を再懸濁し、残ったRBCを2回の低張溶解(J-M)にかけます。この図の拡大版をご覧になるには、ここをクリックしてください。
3. 好中球活性化の準備
- 1.5 mLのマイクロチューブに、最終的な細胞濃度が6,600細胞/μLになるように、各条件の活性化系を調製します。例えば、100 nM fMLP(N-ホルミル-メチオニル-ロイシル-フェニルアラニン、 材料表を参照)の効果を試験するには、6,667 cells/μL 懸濁液の 495 μL に 5 μL の 10 μM fMLP を加えます。ネガティブ(非刺激)コントロールには、Ca2+ とMg2+を含むHBSSを添加します。
注:この方法論を実証するために、100 nM fMLP、16 μM のファラキシン、天然に存在する抗菌ペプチド14、および 100 nM PMA(ホルボール 12-ミリスチン酸 13-アセテート)の刺激の最終濃度を使用しました( 材料表を参照)。 - 回転せずに37°Cでインキュベートします。
注:機能アッセイ用のすべてのアリコートは、この細胞懸濁液(以下、活性化システムと呼びます)から採取されます。
4. ROS産生評価のためのニトロテトラゾリウム青色塩化物(NBT)アッセイ
- NBT作動溶液の調製:各実験条件について、以下のステップを用いて6 mMのNBT( 材料表を参照)作動溶液を調製します。
- 0.0005 g の NBT を 10 μL のジメチルスルホキシド(DMSO)に溶解し、少なくとも 15 分間ボルテックスします。
- 90 μL の HBSS Ca2+Mg2+ を加え、最大 2 分間ボルテックスします。
注意: NBTに関連するすべての手順は、暗闇の中で実行する必要があります。
- NBTスライドテストを実行します。
- 細胞活性化の20分後、細胞懸濁液を穏やかに混合し、2 μLのPMNを清潔なスライドガラスに慎重に移します。37°Cの加湿チャンバーで20分間インキュベートします。
注:細胞懸濁液をスライド上に広げすぎないでください。そうしないと、インキュベーション前に乾燥する可能性があります。 - 細胞上に1μLのNBTワーキング溶液を加え、光から保護してさらに20分間インキュベートします。
- スライドを熱風で乾燥させ、各ウェルにメタノールを一滴垂らして1分間固定します。0.03%サフラニン( 材料表参照)で1分間染色します。
- スライドガラスを蒸留水でやさしく洗います。
- スライドを風乾させ、顕微鏡で観察します。
- 各ウェルで100個のランダムな細胞を数え、ホルマザン沈着物の有無にかかわらず好中球を分化します。
- 細胞活性化の20分後、細胞懸濁液を穏やかに混合し、2 μLのPMNを清潔なスライドガラスに慎重に移します。37°Cの加湿チャンバーで20分間インキュベートします。
- NBT分光光度法アッセイを実施します。
- 細胞活性化を40分間行った後、細胞懸濁液を穏やかに混合し、活性化系から90 μLのPMNを清潔なマイクロチューブに移します。次に、20 μL の 6 mM NBT 溶液を慎重に添加します。暗所で37°Cで20分間インキュベートします。
- 100 μL の 10% ドデシル硫酸ナトリウム (SDS、 材料表を参照) を加え、ボルテックスします。
- 60%の振幅でチップソニケーターを使用して、それぞれ15秒間隔で15秒の5サイクルを超音波処理します。12,000 x g で5分間遠心分離します。
- 上清 60 μL を底が透明な 96 ウェルプレートに移し、570 nm でのホルマザン生成物の吸光度を測定します。
5. 食作用アッセイ
- 以下に説明するように、各条件について33,000酵母/μL懸濁液を調製します。
- 約0.75 mgの乾燥酵母 (出芽酵母、 材料表参照)を200 μLのHBSS Ca2+Mg2+ に加え、100°C、500rpmのサーモミキサーで少なくとも15分間インキュベートします。
- ボルテックスにより混合物をホモジナイズし、酵母懸濁液5 μLを0.2%トリパンブルー色素45 μLに移します。ノイバウアーチャンバーを使用して酵母をカウントします。
- HBSS Ca2+Mg2+を用いて、初期懸濁液の濃度を33,000酵母細胞/μLに調整します。使用するまで懸濁液を氷上に保管してください。
- 細胞活性化の20分後、細胞懸濁液を穏やかに混合し、活性化系5 μLを33,000酵母/μL出 芽 酵母懸濁液5 μLに移し、新しい滅菌マイクロチューブに入れます。
注:好中球と酵母の比率は1:5(PMN:酵母)です。 - 直ちに6 μLのPMN/酵母懸濁液を清潔なスライドガラスの3つのウェル(各2 μL)に移し、加湿チャンバー内で40分間インキュベートします。
注:細胞懸濁液をスライド上に広げすぎないでください。そうしないと、インキュベーション前に乾燥する可能性があります。 - スライドを熱風で乾燥させ、上記のステップ2.9で説明したように、高速パノプティックで染色します。
注:高速パノプティック染色の第3ステップは、スライドの顕微鏡分析に不可欠です。このステップでスライドを≥3秒間染色すると、酵母と好中球核ローブの鑑別が困難になるため、分析に適さなくなる可能性があります。 - スライドを顕微鏡で観察し、各ウェルの100個のランダムな好中球を数え、食作用の陽性と陰性のPMNを区別します。
注:PMN細胞膜内またはPMN細胞膜と直接接触している少なくとも1つの酵母粒子は、食作用に対してPMN陽性であることを示します。酵母/好中球比に興味がある場合は、飲み込まれた酵母粒子の数も数えます。
6. リアルタイムPMN走化性アッセイ
注:移行アッセイは、previoulsy15に記載されているプロトコルと同様に、次の適応で実行されます。
- 160 μL の走化性グラジエント(fMLP、IL-8、C5、LTB4 など、材料 表を参照)をインピーダンスベースリアルタイムセルアナライザー(RTCA)プレートの下チャンバーに添加して、走化性グラジエントを調製します。ネガティブコントロールおよびブランクには、160 μL の HBSS Ca2+Mg2+ を添加します。
- 上部チャンバーを取り付け、25 μL の HBSS Ca2+Mg2+ を添加します。室温で少なくとも1時間インキュベートして、走化性グラジエントを形成します。
- 細胞活性化の60分後、細胞懸濁液を静かに混合し、60 μLの細胞懸濁液を上部チャンバーに入れます。60 μLのHBSSCa2+Mg2+ をブランクに加えます。
- RTCAプレートをセットし、60秒ごとに2時間セルインデックス(CI)を測定するようにRTCAソフトウェアをプログラムします。
注意: RTCAプレートは、前述のように洗浄して再利用できます16。要約すると、RTCAチャンバーと電極をリン酸塩ブファー生理食塩水(PBS)で3回洗浄し、次にタイプI超純水で2回洗浄します。下部チャンバーと上部チャンバーを0.25%トリプシン、0.53 mMエチレンジアミン四酢酸(EDTA)で40分間インキュベートします。超純水で3回洗います。
7. NET暗示アッセイ
- 細胞活性化の10分後、細胞懸濁液を静かに混合し、評価中の各活性化システムから4 μLのPMNを移し、2つのウェルに分けて清浄なスライドガラスに移します。加湿チャンバー内で37°Cで30分間インキュベートします。
- ウェルの1つに1 μLのDNAse Iを加え、37°C(ウェットチャンバー内)で20分間インキュベートします。
- スライドを乾燥させ、「好中球の単離」セクションのステップ2.9で前述したように、高速パノプティックで染色します。
- スライドを顕微鏡で評価します。
注 : Web のような構造の存在を特徴とする NET リリースの兆候を探します。同定されたら、DNAse I処理がそのような構造を除去できるかどうかを確認します。このアッセイは、NETの存在を確認するために追加のテストが必要であるため、NET形成を示唆しています。
結果
この研究で使用した密度ベースの分離法(図1)は、提案された実験の基準を満たしていました。この方法から得られた好中球パラメータには、生存率≥98%、純度≥94%、および細胞収量≥1.5 x 107が含まれていましたが、スクリーニングテストでは検出可能な活性化はありませんでした。PMNの単離における2つの関連するステップは、抗凝固療法と赤血球除去です。抗?...
ディスカッション
好中球は非常に動的で応答性の高い細胞であり、寿命が短く、まだ凍結保存できないため19、その生物学の調査は困難です。したがって、生存可能で濃縮された安静中の好中球を得るためには、慎重な手順に従うことが不可欠です11,20。この研究では、穏やかで最小限の操作と、活性化ステップまでの低温の使用に重点を置いた密?...
開示事項
著者らは、利益相反がないことを宣言します。
謝辞
著者らは、FAPDF、CNPq、CAPES、UnB、FINEP、およびFINATECの助成機関に謝意を表します。
資料
| Name | Company | Catalog Number | Comments |
| CIM-Plate 16 | Agilent | 5665825001 | |
| CLARIOstar Plate Reader | BMG LABTECH | US Patent Number 9,733,124 Product details: MARS Data Analysis Software | |
| Dimethyl sulfoxide | Dinâmica | 1582 | |
| DNAse I | Sigma - Aldrich | DN 25 | |
| Ethylenediaminetetraacetic acid disodium salt dihydrate | Sigma - Aldrich | E5134 | |
| Fast panoptic stain | Laborclin | 620529 | |
| Glass slide | Exacta | 7102 | |
| Hank’s Balanced Salt Solution with calcium, with magnesium, without phenol red. | Sigma - Aldrich | 55037C | |
| Hank’s Balanced Salt Solution without calcium chloride, magnesium sulfate and sodium bicarbonate. | Sigma - Aldrich | H4641 | |
| Heparin | Blau | 7896014655229 | |
| Laminar flow cabinet | Veco | VLFS-12 | |
| Microscope | Zeiss | 415501-0101-002 | Product details: Primostar 1 |
| Mixing Block | BIOER | MB-102 | |
| Neubauer improved bright-lined | New Optik | 1110000 | |
| N-formyl-methionyl-leucyl-phenylalanine | Sigma - Aldrich | F3506 | |
| Nitroblue tetrazolium | Neon | CAS 298-83-9 | |
| Percoll | Cytiva | 17089101 | separation media |
| Phorbol 12-myristate 13-acetate | Sigma - Aldrich | P8139 | |
| Phosphate buffered saline tablet | Sigma - Aldrich | P4417 | |
| ROTOFIX 32 A | Hettich | 1206 | |
| Saccharomyces cerevisiae | Fleischmann | ||
| Safranin | Sigma - Aldrich | 50240 | |
| Sodium dodecyl sulfate | Cytiva | 17-1313-01 | |
| Sonicator | Qsonica | Q125 | |
| Trypan blue solution | Vetec | C.I. 23850 | |
| Vortex Genie 2 | Scientific Industries, Inc. | 0K-0500-902 | |
| xCELLigence Real-Time Cell Analysis (RTCA) DP (dual purpose) | Agilent | 380601050 | Product details: RTCA system composed of detection hardware, cell plates and software |
参考文献
- Nauseef, W. M., Borregaard, N. Neutrophils at work. Nature Immunology. 15 (7), 602-611 (2014).
- Groeneweg, L., Hidalgo, A. Emerging roles of infiltrating granulocytes and monocytes in homeostasis. Cellular and Molecular Life Sciences. 77 (19), 3823-3830 (2020).
- Rosales, C., Lowell, C. A., Schnoor, M., Uribe-Querol, E. Neutrophils: their role in innate and adaptive immunity 2017. Journal of Immunology Research. 2017, 9748345 (2017).
- Castro, M., et al. Proteome analysis of resting human neutrophils. Protein & Peptide Letters. 13 (5), 481-487 (2006).
- Li, Y., et al. The regulatory roles of neutrophils in adaptive immunity. Cell Communication and Signaling. 17, 147 (2019).
- de Oliveira, S., Rosowski, E. E., Huttenlocher, A. Neutrophil migration in infection and wound repair: going forward in reverse. Nature Reviews Immunology. 16 (6), 378-391 (2016).
- Burn, G. L., Foti, A., Marsman, G., Patel, D. F., Zychlinsky, A. The neutrophil. Immunity. 54 (7), 1377-1391 (2021).
- El-Benna, J., et al. Priming of the neutrophil respiratory burst: role in host defense and inflammation. Immunological Reviews. 273 (1), 180-193 (2016).
- Castro, M. S., Cilli, E. M., Fontes, W. Combinatorial synthesis and directed evolution applied to the production of alpha-helix forming antimicrobial peptides analogues. Current Protein & Peptide Science. 7 (6), 473-478 (2006).
- Mihaila, A. C., et al. Transcriptional profiling and functional analysis of N1/N2 neutrophils reveal an immunomodulatory effect of S100A9-blockade on the pro-inflammatory N1 subpopulation. Frontiers in Immunology. 12, 708770 (2021).
- Kuhns, D. B., Priel, D. A. L., Chu, J., Zarember, K. A. Isolation and functional analysis of human neutrophils. Current Protocols in Immunology. 111 (1), 7-23 (2015).
- Paulíková, E., Kociková, A., Sabol, M. Modification of a panoptic method of staining isolated cells. Bratislavske Lekarske Listy. 94 (12), 638-640 (1993).
- Strober, W. Trypan blue exclusion test of cell viability. Current Protocols in Immunology. 111 (1), 1-3 (2015).
- Libério, M. S., et al. Anti-proliferative and cytotoxic activity of pentadactylin isolated from Leptodactylus labyrinthicus on melanoma cells. Amino Acids. 40 (1), 51-59 (2011).
- Cano, P. M., Vargas, A., Lavoie, J. P. A real-time assay for neutrophil chemotaxis. BioTechniques. 60 (5), 245-251 (2016).
- Stefanowicz-Hajduk, J., Adamska, A., Bartoszewski, R., Ochocka, J. R. Reuse of E-plate cell sensor arrays in the xCELLigence Real-Time Cell Analyzer. BioTechniques. 61 (3), 117-122 (2016).
- Björkstén, B., Nyström, K., Lindqvist, B. The nitroblue tetrazolium (NBT) test in endemic benign (epidemic) nephropathy. Acta Medica Scandinavica. 199 (1-6), 147-150 (1976).
- Aquino, E., et al. Proteomic analysis of neutrophil priming by PAF. Protein & Peptide Letters. 23 (2), 142-151 (2016).
- Blanter, M., Gouwy, M., Struyf, S. Studying neutrophil function in vitro: cell models and environmental factors. Journal of Inflammation Research. 14, 141-162 (2021).
- Hsu, A. Y., Peng, Z., Luo, H., Loison, F. Isolation of human neutrophils from whole blood and buffy coats. Journal of Visualized Experiments. (175), e62837 (2021).
- Moghadam, Z. M., Henneke, P., Kolter, J. From flies to men: ROS and the NADPH oxidase in phagocytes. Frontiers in Cell and Developmental Biology. 9, 628991 (2021).
- Pattan, S. S., Bhat, K. G., Pattar, G. D., Kuntagi, M. Comparison of three different techniques for isolation of neutrophils from blood and their utility in performing nitroblue tetrazolium test. International Journal of Basic and Applied Physiology. 8 (1), 41 (2019).
- Gooty, J. R., Shashirekha, A., Guntakala, V. R., Palaparthi, R. Estimation of phagocytic activity of polymorphonuclear leukocytes in chronic and aggressive periodontitis patients with nitroblue tetrazolium test. Journal of Indian Society of Periodontology. 23 (4), 316 (2019).
- Langer, S., et al. Clinical and laboratory profiles of 17 cases of chronic granulomatous disease in north India. Indian Journal of Hematology and Blood Transfusion. 37 (1), 45-51 (2021).
- Oualha, R., et al. Infection of human neutrophils with Leishmania infantum or Leishmania major strains triggers activation and differential cytokines release. Frontiers in Cellular and Infection Microbiology. 9, 153 (2019).
- Zilinskas, J., Zekonis, J., Zekonis, G., Valantiejiene, A., Periokaite, R. The reduction of nitroblue tetrazolium by total blood in periodontitis patients and the aged. Stomatologijal. 9 (4), 105-108 (2007).
- Benov, L. Improved formazan dissolution for bacterial MTT assay. Microbiology Spectrum. 9 (3), e01637 (2021).
- Chen, Y., Junger, W. G. Measurement of oxidative burst in neutrophils. Methods in Molecular Biology. 844, 115-124 (2012).
- Richardson, M. P., Ayliffe, M. J., Helbert, M., Davies, E. G. A simple flow cytometry assay using dihydrorhodamine for the measurement of the neutrophil respiratory burst in whole blood: comparison with the quantitative nitrobluetetrazolium test. Journal of Immunological Methods. 219 (1-2), 187-193 (1998).
- Jancinová, V., et al. The combined luminol/isoluminol chemiluminescence method for differentiating between extracellular and intracellular oxidant production by neutrophils. Redox Report. 11 (3), 110-116 (2006).
- Nosál, R., et al. Pharmacological intervention with oxidative burst in human neutrophils. Interdisciplinary Toxicology. 10 (2), 56-60 (2017).
- Mol, S., et al. Efficient neutrophil activation requires two simultaneous activating stimuli. International Journal of Molecular Sciences. 22 (18), 10106 (2021).
- Schneider, L., et al. Flow cytometry evaluation of CD14/CD16 monocyte subpopulations in systemic sclerosis patients: a cross sectional controlled study. Advances in Rheumatology. 61 (1), 27 (2021).
- Akin, E., Pelen, N. N., Tiryaki, I. U., Yalcin, F. Parameter identification for gompertz and logistic dynamic equations. PLoS One. 15 (4), e0230582 (2020).
- Guy, J. B., et al. Evaluation of the cell invasion and migration process: A comparison of the video microscope-based scratch wound assay and the boyden chamber assay. Journal of Visualized Experiments. (129), e56337 (2017).
- Brinkmann, V., et al. Neutrophil extracellular traps kill bacteria. Science. 303 (5663), 1532-1535 (2004).
- de Bont, C. M., Koopman, W. J. H., Boelens, W. C., Pruijn, G. J. M. Stimulus-dependent chromatin dynamics, citrullination, calcium signalling and ROS production during NET formation. Biochimica et Biophysica Acta. Molecular Cell Research. 1865, 1621-1629 (2018).
- Masuda, S., et al. Measurement of NET formation in vitro and in vivo by flow cytometry. Cytometry Part A. 91 (8), 822-829 (2017).
- Zharkova, O., et al. A flow cytometry-based assay for high-throughput detection and quantification of neutrophil extracellular traps in mixed cell populations. Cytometry Part A. 95 (3), 268-278 (2019).
- Hosseinnejad, A., et al. DNase I functional microgels for neutrophil extracellular trap disruption. Biomaterials Science. 10 (1), 85-99 (2022).
- Chrysanthopoulou, A., et al. Neutrophil extracellular traps promote differentiation and function of fibroblasts. The Journal of Pathology. 233 (3), 294-307 (2014).
- Tong, M., Abrahams, V. M. Visualization and quantification of neutrophil extracellular traps. Methods in Molecular Biology. 2255, 87-95 (2021).
- Santana, C. J. C., et al. Biological properties of a novel multifunctional host defense peptide from the skin secretion of the chaco tree frog, boana raniceps. Biomolecules. 10 (5), 790 (2020).
- Murphy, M. P., et al. Guidelines for measuring reactive oxygen species and oxidative damage in cells and in vivo. Nature Metabolism. 4 (6), 651-662 (2022).
- Boero, E., et al. Use of flow cytometry to evaluate phagocytosis of staphylococcus aureus by human neutrophils. Frontiers in Immunology. 12, 635825 (2021).
- Karsten, C. B., et al. A versatile high-throughput assay to characterize antibody-mediated neutrophil phagocytosis. Journal of Immunological Methods. 471, 46-56 (2019).
- Smirnov, A., Solga, M. D., Lannigan, J., Criss, A. K. Using imaging flow cytometry to quantify neutrophil phagocytosis. Methods in Molecular Biology. 2087, 127-140 (2020).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved