Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Eine Reihe von Screening-Techniken für einen schnellen Überblick über die Funktion der Neutrophilen
In diesem Artikel
Zusammenfassung
Dieses Protokoll umfasst eine Reihe von funktionellen Neutrophilen-Assays, die als Screening-Methode verwendet werden, um Funktionen aus verschiedenen Signalwegen abzudecken. Das Protokoll beinhaltet eine erste und einfache Bewertung der Zelllebensfähigkeit, Reinheit, Produktion reaktiver Sauerstoffspezies, Echtzeitmigration, Phagozytose und einen vorläufigen Vorschlag für neutrophile extrazelluläre Fallen.
Zusammenfassung
Neutrophile Granulozyten sind als eine der ersten Verteidigungslinien in der angeborenen Immunantwort bekannt und können viele bestimmte zelluläre Funktionen ausführen, wie z. B. Chemotaxis, Rückwanderung, Phagozytose, Degranulation von zytotoxischen Enzymen und Metaboliten und Freisetzung von DNA als neutrophile extrazelluläre Fallen (NETs). Neutrophile Granulozyten haben nicht nur selbst eine streng regulierte Signalübertragung, sondern sind auch an der Regulation anderer Komponenten des Immunsystems beteiligt. Da frische Neutrophile unheilbar differenziert, kurzlebig und sehr variabel zwischen den Individuen sind, ist es wichtig, das Beste aus den gesammelten Proben zu machen. Forscher müssen häufig Screening-Assays durchführen, um einen Überblick über die vielen Funktionen von Neutrophilen zu erhalten, die von bestimmten zu untersuchenden Bedingungen beeinflusst werden können. Um diesem Bedarf gerecht zu werden, wurde eine Reihe von Tests entwickelt, die einem einzigen Isolierungsprozess von Neutrophilen normaler Dichte folgen und ein Gleichgewicht zwischen Geschwindigkeit, Vollständigkeit, Kosten und Genauigkeit anstreben. Die Ergebnisse können als Begründung und Leitfaden für eingehende Folgestudien verwendet werden. Dieses Verfahren kann in einer durchschnittlichen Zeit von 4 Stunden durchgeführt werden und umfasst die Bewertung der Zelllebensfähigkeit, der Produktion reaktiver Sauerstoffspezies (ROS), der Echtzeitmigration und der Phagozytose von Hefe auf Glasobjektträgern, so dass genügend Zellen für detailliertere Ansätze wie Omics-Studien übrig bleiben. Darüber hinaus bietet das Verfahren eine Möglichkeit, nach einer schnellen panoptischen Färbung, die durch Lichtmikroskopie beobachtet wurde, auf einfache Weise eine vorläufige Vermutung von NETs zu beobachten, wobei es an spezifischen Markern mangelt, die jedoch ausreichen, um anzuzeigen, ob sich weitere Bemühungen auf diese Weise lohnen würden. Die Vielfalt der getesteten Funktionen kombiniert Gemeinsamkeiten zwischen den Tests und reduziert so den Zeit- und Kostenaufwand für die Analyse. Das Verfahren wurde NeutroFun Screen genannt, und obwohl es Einschränkungen hat, gleicht es die oben genannten Faktoren aus. Darüber hinaus ist das Ziel dieser Arbeit kein eindeutiges Testset, sondern vielmehr ein Leitfaden, der leicht an die Ressourcen und Anforderungen jedes Labors angepasst werden kann.
Einleitung
Neutrophile Granulozyten sind die am häufigsten vorkommenden Zellen des angeborenen Immunsystems im menschlichen Blut und es ist bekannt, dass sie eine wichtige Rolle bei Infektionen und Entzündungen spielen, da sie die ersten Helfer sind, die an der Stelle der Gewebeschädigung eintreffen1. In den letzten Jahren hat sich die Erkenntnis durchgesetzt, dass Neutrophile eine entscheidende Rolle bei einer Vielzahl von Krankheiten und bei der Unterstützung der Homöostase spielen2. Neutrophile Granulozyten haben nicht nur selbst eine streng regulierte Signalübertragung, sondern sind auch an der Regulation anderer Komponenten des Immunsystems beteiligt 3,4,5. Daher ist die Untersuchung von Neutrophilen und ihren vielen ungewöhnlichen zellulären Funktionen, wie Chemotaxis, Rückwanderung6, Phagozytose7, respiratorischer Ausbruch8 und die Freisetzung von neutrophilen extrazellulären Fallen (NETs)7, in zahlreichen Forschungskontexten unerlässlich, in denen es notwendig ist, die potenziellen funktionellen, morphologischen oder molekularen Veränderungen von Neutrophilen zu bewerten, die durch bestimmte zu analysierende Bedingungen ausgelöst werden.
Frisch isolierte Neutrophile sind terminal, kurzlebig, hochdynamisch und leicht zu aktivieren9. Eine effiziente Lagerungsmethode, die die Reaktionen der Neutrophilen nicht beeinflusst, wurde jedoch noch nicht erreicht, was es schwierig macht, mehrere Assays durchzuführen, die ununterbrochen sein müssen. Darüber hinaus sind zuvor beschriebene funktionelle Analysen10,11, die auf Assays basieren, die Zytometrie und/oder Fluoreszenzfärbung erfordern, möglicherweise keine praktikable Wahl, wenn eine breite und erste Bewertung der Neutrophilen erforderlich ist.
Um diese Probleme anzugehen, beschreibt dieses Protokoll eine Reihe von Tests, die nach einem einzigen Isolierungsprozess durchgeführt werden können, einschließlich der Bewertung der Zelllebensfähigkeit, der Produktion reaktiver Sauerstoffspezies (ROS), der Echtzeitmigration und der Phagozytose von Saccharomyces cerevisiae, deren Ergebnisse zur Begründung eingehender Folgestudien verwendet werden können. Dieses Verfahren mit dem Namen NeutroFun Screen wurde entwickelt, um die wichtigsten Effektoraktivitäten mit Ausnahme der Degranulation zu umfassen, und kann in einer durchschnittlichen Zeit von 4 Stunden abgeschlossen werden, einschließlich 1 Stunde Aktivierung. Darüber hinaus können die verbleibenden Zellen für detailliertere Ansätze wie Omics-Studien verwendet werden. Der Vorteil dieser Methode liegt in der Balance zwischen Geschwindigkeit, Komplexität, Kosten und Genauigkeit.
Darüber hinaus gibt es eine Möglichkeit, einen vorläufigen Vorschlag von NETs leicht zu beobachten, ohne spezifische Marker, aber genug, um anzuzeigen, ob sich weitere Bemühungen in dieser Richtung lohnen würden. Die Vielfalt der getesteten Funktionen zielt darauf ab, Gemeinsamkeiten zwischen den Tests zu kombinieren und so den Zeit- und Kostenaufwand für die Analyse zu reduzieren. Das Hauptziel dieser Methode ist es, eine ausgewogene, funktionelle Analyse in Bezug auf Geschwindigkeit, Vollständigkeit, Kosten und Genauigkeit zu liefern, die einen Überblick über die Reaktion der Neutrophilen ermöglicht, was sie zu einem nützlichen ersten Schritt bei der Untersuchung der Auswirkungen neuer Stimuli auf Neutrophile normaler Dichte macht.
Protokoll
Alle Experimente folgten strikt den ethischen Richtlinien, die vom institutionellen Prüfungsausschuss der Universität Brasilia festgelegt wurden (Prozess 13364819.0.0000.5558), und die Proben wurden durch Codes identifiziert, um die Anonymität der Spender zu gewährleisten. Die Zellen wurden von normalen, gesunden männlichen Spendern im Alter von 18 bis 35 Jahren gewonnen, die die Einverständniserklärung unterschrieben und die folgenden Zulassungskriterien erfüllten: Nichtraucher/Dampfer, keine chronischen Erkrankungen und keine entzündlichen Erkrankungen in der Vorgeschichte in den letzten 14 Tagen.
1. Blutabnahme
- Geben Sie aseptisch 0,3 ml 5.000 I.E./ml Heparin (siehe Materialtabelle) in eine sterile 20-ml-Spritze, um es zu heparinisieren.
- Legen Sie ein venöses Tourniquet etwa 4 Zoll über der Einstichstelle an und identifizieren Sie die mediane Kubital- oder Kopfvene für die Venenpunktion.
HINWEIS: Stellen Sie sicher, dass die Gesamtdauer des Tourniquets 1 Minute nicht überschreitet. - Reinigen Sie die Einstichstelle mit 70%igem Alkohol und führen Sie die Venenpunktion durch.
- Drehen Sie die Spritze nach der Blutentnahme drei- oder viermal vorsichtig um, um das Blut und das Heparin richtig zu mischen.
2. Isolierung von Neutrophilen
HINWEIS: Polymorphkernige Leukozyten (PMNs) werden durch Dichtegradientenzentrifugation isoliert, gefolgt von hypotoner Lyse der verbleibenden roten Blutkörperchen (RBC), wie zuvor beschrieben11 mit einigen Änderungen. Diese Methode ist für die Durchführung der Screening-Assays nicht zwingend erforderlich und kann ersetzt werden, solange die gewählte Methode zu einer Viabilität von >97 %, Priming oder Aktivierung von <3 % der PMNs führt und genügend Zellen für alle Assays, Replikate und Bedingungen liefert. Die Durchführung dieser Schritte unter aseptischen Bedingungen und die Verwendung endotoxinfreier Lösungen sind zwingend erforderlich, um eine Zellaktivierung zu vermeiden.
- 12-ml-Verdünnungen von 60%igen und 70%igen Trennmedien (im Handel erhältlich; siehe Materialtabelle) in konischen 50-ml-Röhrchen herstellen.
- Bereiten Sie den Gradienten von unten nach oben vor, indem Sie mit einer 5-ml-Pipette jeweils 4 ml der 60%igen Verdünnung über die 70%ige Verdünnung hinzufügen. Tun Sie dies vorsichtig, um eine Vermischung der Schnittstelle zu vermeiden.
- Schichten Sie vorsichtig 12 ml heparinisiertes Blut auf den Dichtegradienten. Bei 200 x g 15 min bei Raumtemperatur zentrifugieren.
HINWEIS: Von diesem Schritt an bis zur PMN-Aktivierung müssen alle verwendeten Reagenzien und Röhrchen in einem mit Eis gefüllten Kühler aufbewahrt werden. - Die Plasma-/mononukleäre Zellschicht wird verworfen und dann die Schicht über dem Erythrozytenpellet vorsichtig in zwei konische 15-ml-Röhrchen mit jeweils ca. 7,5 ml übertragen. Füllen Sie das Volumen des Röhrchens mit Hank's Balanced Salt Solution (HBSS; siehe Materialtabelle) auf.
- Bei 300 x g 5 min bei 19 °C zentrifugieren.
- Waschen Sie das Zellpellet mit HBSS.
- Verwerfen Sie den Überstand, indem Sie das Röhrchen gießen, und resuspendieren Sie das Pellet vorsichtig in 7 ml HBSS.
- Bei 300 x g für 5 min bei 19 °C zentrifugieren, um alle Trennmedien zu entfernen.
- Führen Sie eine hypotone Lyse der verbleibenden Erythrozyten durch.
- Entsorgen Sie den Überstand und mischen Sie die Pellets in einem einzigen Röhrchen.
- Resuspendieren Sie das RBC/PMN-Pellet in 3 ml sterilemH2Ound fügen Sie innerhalb von 25 s 3 ml HBSS (2x) hinzu, um die Osmolarität wiederherzustellen. Anschließend bei 300 x g für 5 min bei 19 °C zentrifugieren.
- Wiederholen Sie die Schritte 2.8.1 und 2.8.2 für ein weißes, erythrozytenfreies Pellet.
HINWEIS: Der Überstand muss so schnell wie möglich entfernt werden, um den Kontakt von Neutrophilen mit Erythrozytenabbauprodukten zu minimieren. Alternativ kann die zweite hypotone Lyse ersetzt werden, indem die verbleibende Erythrozytenschicht sanft resuspendiert und der gesamte Überstand entfernt wird, da die verbleibenden Erythrozyten über dem PMN-Pellet sedimentieren.
- Entsorgen Sie den Überstand, indem Sie das Röhrchen gießen, resuspendieren Sie die PMNs vorsichtig in den verbleibenden Puffer und geben Sie sie in ein eiskaltes Mikroröhrchen.
HINWEIS: Stellen Sie sicher, dass Sie das Volumen mit Anmerkungen versehen, während Sie die resuspendierten Zellen mit einer Mikropipette übertragen. - Übertragen Sie 3 x 1 μl der Zellsuspension auf einen sauberen Objektträger (drei Vertiefungen mit je 1 μl) und färben Sie sie mit einer schnellen Panoptik (siehe Materialtabelle) zur Beurteilung der Morphologie und Reinheit12.
- Um mit schneller Panoptik zu färben, tauchen Sie den Objektträger fünfmal in das panoptische Fixiermittel Nr. 1, sechsmal in Eosin Nr. 2 und zweimal in Hämatoxylin Nr. 3, wobei jedes Eintauchen 1 s dauert.
- Waschen Sie den Objektträger vorsichtig mit destilliertem Wasser.
- Abtropfen lassen und an der Luft trocknen lassen.
- Beobachten Sie unter dem Mikroskop und zählen Sie 300 zufällige Zellen in jeder Vertiefung, um die Neutrophilen von anderen Granulozyten zu unterscheiden.
- Man überträgt 1 μl der Zellsuspension auf 49 μl 0,2%igen Trypanblaufarbstoff13 und zählt die Zellen mit einer Neubauer-Kammer, wobei zwischen toten und lebensfähigen Zellen unterschieden wird.
- Stellen Sie die Zellkonzentration auf 6.667 Zellen/μl ein, indem Sie eine Lösung aus 50 % autologem Plasma und 50 % HBSS verwenden, die mit Kalzium und Magnesium ergänzt wird. Die 6.667 Zellen/μl Suspension wird gleichmäßig auf die Mikroröhrchen verteilt, die den zu testenden Bedingungen, einschließlich der Negativkontrolle, entsprechen.
HINWEIS: Jede Zellkonzentration, die den zirkulierenden Neutrophilen im Modellorganismus ähnlich ist, kann verwendet werden, aber es ist wichtig, in allen Experimenten die gleiche Zellkonzentration zu verwenden, um die Reproduzierbarkeit zu gewährleisten.
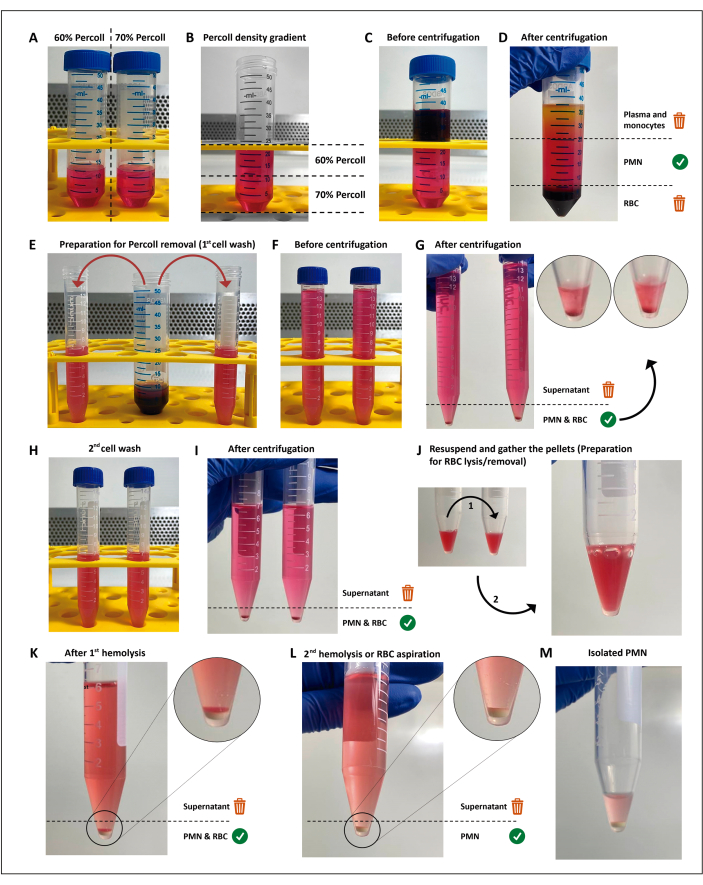
Abbildung 1: Das Protokoll zur Isolierung von Neutrophilen. Zwei Konzentrationen des Trennmediums (Percoll) (A) werden gestapelt (B), dann wird das Blut auf den Trenngradienten (C) geschichtet. Nach der Zentrifugation befindet sich das PMN in der zentralen Schicht (D), die in zwei 15-ml-Röhrchen (E) unterteilt ist. Die Zellsuspension wird zweimal in HBSS gewaschen und zentrifugiert (G-I), um das Medium zu entfernen, dann werden die Zellen resuspendiert und die verbleibenden Erythrozyten werden zwei Runden der hypotonen Lyse (J-M) unterzogen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
3. Vorbereitung auf die Neutrophilenaktivierung
- Bereiten Sie in 1,5-ml-Mikroröhrchen ein Aktivierungssystem für jede Bedingung vor, so dass die endgültige Zellkonzentration 6.600 Zellen/μl beträgt. Um beispielsweise die Wirkung von 100 nM fMLP (N-Formyl-Methionyl-Leucyl-Phenylalanin; siehe Materialtabelle) zu testen, fügen Sie 5 μl 10 μM fMLP zu 495 μl der 6.667 Zellen/μl-Suspension hinzu. Für die negative (unstimulierte) Kontrolle wird HBSS mit Ca2+ und Mg2+ zugegeben.
ANMERKUNG: Um diese Methodik zu demonstrieren, wurden die folgenden Endkonzentrationen der Stimuli verwendet: 100 nM fMLP, 16 μM Fallaxin, ein natürlich vorkommendes antimikrobielles Peptid14, und 100 nM PMA (Phorbol-12-myristat-13-acetat) (siehe Materialtabelle). - Bei 37 °C ohne Rotation inkubieren.
ANMERKUNG: Alle Aliquots für funktionelle Assays werden aus dieser Zellsuspension entnommen, die im Folgenden als Aktivierungssystem bezeichnet wird.
4. Nitrotetrazoliumblauchlorid (NBT)-Assay zur Bewertung der ROS-Produktion
- Herstellung der NBT-Arbeitslösung: Für jede Versuchsbedingung ist eine NBT-Arbeitslösung (siehe Materialtabelle) von 6 mM mit den folgenden Schritten herzustellen:
- 0,0005 g NBT in 10 μl Dimethylsulfoxid (DMSO) lösen und mindestens 15 Minuten lang vortexen.
- 90 μl HBSS Ca2+Mg2+ zugeben und bis zu 2 min vortexen.
HINWEIS: Alle Schritte, bei denen NBT zum Einsatz kommt, müssen im Dunkeln durchgeführt werden.
- Führen Sie einen NBT-Schiebertest durch.
- Nach 20 Minuten Zellaktivierung wird die Zellsuspension vorsichtig gemischt und vorsichtig 2 μl PMN auf einen sauberen Objektträger gegeben. 20 Minuten in einer befeuchteten Kammer bei 37 °C inkubieren.
HINWEIS: Verteilen Sie die Zellenaufhängung nicht zu stark auf dem Objektträger. Andernfalls kann es vor der Inkubation austrocknen. - Geben Sie 1 μl der NBT-Arbeitslösung über die Zellen und inkubieren Sie 20 Minuten lang lichtgeschützt weiter.
- Trocknen Sie den Objektträger mit heißer Luft und fixieren Sie ihn mit einem Tropfen Methanol in jeder Vertiefung für 1 min. Mit 0,03% Safranin (siehe Materialtabelle) 1 Min. beizen.
- Waschen Sie den Objektträger vorsichtig mit destilliertem Wasser.
- Lassen Sie den Objektträger an der Luft trocknen und beobachten Sie ihn unter dem Mikroskop.
- Zählen Sie 100 zufällige Zellen in jeder Vertiefung und differenzieren Sie Neutrophile mit und ohne Formazan-Ablagerungen.
- Nach 20 Minuten Zellaktivierung wird die Zellsuspension vorsichtig gemischt und vorsichtig 2 μl PMN auf einen sauberen Objektträger gegeben. 20 Minuten in einer befeuchteten Kammer bei 37 °C inkubieren.
- Führen Sie einen NBT-Spektrophotometrie-Assay durch.
- Nach 40 Minuten Zellaktivierung wird die Zellsuspension vorsichtig gemischt und 90 μl PMNs aus dem Aktivierungssystem in ein sauberes Mikroröhrchen überführt. Geben Sie dann vorsichtig 20 μl der 6 mM NBT-Lösung hinzu. 20 min im Dunkeln bei 37 °C inkubieren.
- 100 μl 10%iges Natriumdodecylsulfat (SDS; siehe Materialtabelle) zugeben und vortexen.
- Beschallung mit einem Tip-Sonicator mit einer Amplitude von 60 %, fünf Zyklen von je 15 s mit 15 s Intervallen. Bei 12.000 x g für 5 min zentrifugieren.
- 60 μl des Überstandes werden auf eine 96-Well-Platte mit klarem Boden überführt und die Absorption des Formazanprodukts bei 570 nm gemessen.
5. Phagozytose-Assay
- Bereiten Sie eine Suspension von 33.000 Hefen/μl für jede Bedingung vor, wie unten beschrieben:
- Etwa 0,75 mg Trockenhefe (Saccharomyces cerevisiae; siehe Materialtabelle) zu 200 μl HBSS Ca2+Mg2+ geben und in einem Thermomixer bei 100 °C mit 500 U/min für mindestens 15 min inkubieren.
- Die Mischung wird durch Vortexen homogenisiert und 5 μl Hefesuspension in 45 μl 0,2%igen Trypanblaufarbstoff überführt. Die Hefen mit einer Neubauer-Kammer abzählen.
- Stellen Sie die Konzentration der Ausgangssuspension auf 33.000 Hefezellen/μl unter Verwendung von HBSS Ca2+Mg2+ ein. Bewahren Sie die Suspension bis zur Verwendung auf Eis auf.
- Nach 20 Minuten Zellaktivierung wird die Zellsuspension vorsichtig gemischt und 5 μl des Aktivierungssystems in 5 μl der 33.000 Hefe/μl Saccharomyces cerevisiae-Suspension in einem neuen sterilen Mikroröhrchen überführt.
HINWEIS: Das Verhältnis von Neutrophilen zu Hefe beträgt 1:5 (PMN:Hefe). - Sofort werden 6 μl der PMN/Hefesuspension in drei Vertiefungen eines sauberen Objektträgers (je 2 μl) überführt und der Objektträger 40 Minuten lang in einer befeuchteten Kammer inkubiert.
HINWEIS: Verteilen Sie die Zellenaufhängung nicht zu stark auf dem Objektträger. Andernfalls kann es vor der Inkubation austrocknen. - Trocknen Sie den Objektträger unter heißer Luft und färben Sie ihn mit schneller Panoptik, wie in Schritt 2.9 oben beschrieben.
HINWEIS: Der dritte Schritt der schnellen panoptischen Färbung ist entscheidend für die mikroskopische Analyse des Objektträgers. Die Färbung des Objektträgers für ≥3 s in diesem Schritt kann ihn für die Analyse ungeeignet machen, da es schwierig sein wird, Hefe von neutrophilen Kernlappen zu unterscheiden. - Betrachten Sie die Objektträger unter dem Mikroskop, zählen Sie 100 zufällige Neutrophile jeder Vertiefung und unterscheiden Sie zwischen PMNs, die für Phagozytose positiv und negativ sind.
HINWEIS: Mindestens ein Hefepartikel innerhalb oder in direktem Kontakt mit der PMN-Zellmembran weist auf eine PMN hin, die für Phagozytose positiv ist. Wenn Sie sich für das Verhältnis von Hefe zu Neutrophilen interessieren, zählen Sie auch die Anzahl der verschlungenen Hefepartikel.
6. Echtzeit-PMN-Chemotaxis-Assay
HINWEIS: Der Migrationsassay wird ähnlich wie das zuvorbeschriebene Protokoll 15 durchgeführt, mit den folgenden Anpassungen:
- Bereiten Sie den chemotaktischen Gradienten vor, indem Sie 160 μl Chemolockstoff (z. B. fMLP, IL-8, C5 oder LTB4; siehe Materialtabelle) in die untere Kammer einer impedanzbasierten RTCA-Platte (Real Time Cell Analyzer) geben. Für Negativkontrollen und Blindproben 160 μl HBSS Ca2+Mg2+ zugeben.
- Befestigen Sie die obere Kammer und fügen Sie 25 μl HBSS Ca2+Mg2+ hinzu. Mindestens 1 Stunde bei Raumtemperatur inkubieren, um den chemotaktischen Gradienten zu bilden.
- Nach 60 Minuten Zellaktivierung wird die Zellsuspension vorsichtig gemischt und 60 μl Zellsuspension in die obere Kammer gegeben. 60 μl HBSS Ca2+Mg2+ zum Rohling geben.
- Platzieren Sie die RTCA-Platte und programmieren Sie die RTCA-Software so, dass der Zellindex (CI) 2 Stunden lang alle 60 s gemessen wird.
HINWEIS: Die RTCA-Platten können zur Wiederverwendung gewaschen werden, wie zuvor beschrieben16. Zusammenfassend lässt sich sagen, dass die RTCA-Kammern und Elektroden dreimal mit phosphathaltiger Kochsalzlösung (PBS) und dann zweimal mit Reinstwasser Typ I gewaschen werden. Die untere und obere Kammer werden 40 Minuten lang mit 0,25 % Trypsin und 0,53 mM Ethylendiamintetraessigsäure (EDTA) inkubiert. Dreimal mit Reinstwasser waschen.
7. NET-suggestiver Assay
- Nach 10 Minuten Zellaktivierung wird die Zellsuspension vorsichtig gemischt und 4 μl der PMNs von jedem zu bewertenden Aktivierungssystem übertragen, aufgeteilt in zwei Vertiefungen eines sauberen Objektträgers. In einer befeuchteten Kammer bei 37 °C für 30 min inkubieren.
- Geben Sie 1 μl DNAse I in eine der Vertiefungen und inkubieren Sie 20 Minuten lang bei 37 °C (in einer Feuchtkammer).
- Trocknen Sie den Objektträger und färben Sie ihn mit einer schnellen Panoptik, wie zuvor in Schritt 2.9 des Abschnitts "Neutrophile Isolierung" beschrieben.
- Werten Sie die Objektträger unter dem Mikroskop aus.
HINWEIS: Suchen Sie nach Hinweisen auf eine NET-Freigabe, die durch das Vorhandensein von netzartigen Strukturen gekennzeichnet ist. Bestätigen Sie nach der Identifizierung, ob die DNAse I-Behandlung in der Lage war, solche Strukturen zu entfernen. Dieser Assay deutet auf eine NET-Bildung hin, da zusätzliche Tests erforderlich sind, um ihr Vorhandensein zu bestätigen.
Ergebnisse
Die in dieser Studie verwendete dichtebasierte Isolationsmethode (Abbildung 1) erfüllte die Kriterien für die vorgeschlagenen Experimente. Zu den mit dieser Methode ermittelten neutrophilen Parametern gehörten die Lebensfähigkeit ≥98 %, die Reinheit ≥94 % und die Zellausbeute ≥1,5 x 107, wobei in den Screening-Tests keine Aktivierung nachweisbar war. Zwei relevante Schritte bei der Isolierung von PMNs sind die Antikoagulation und die Entfernung von Erythrozyten. Das Halt...
Diskussion
Neutrophile Granulozyten sind hochdynamische und reaktionsfähige Zellen, die kurzlebig sind und noch nicht kryokonserviert werden können19, was die Untersuchung ihrer Biologie zu einer Herausforderung macht. Daher ist es wichtig, sorgfältige Schritte zu befolgen, um lebensfähige, angereicherte und ruhende Neutrophile zu erhalten11,20. In dieser Studie wurde eine dichtebasierte Isolationstechnik verwendet, die den Schwerpunkt auf eine s...
Offenlegungen
Die Autoren erklären, dass kein Interessenkonflikt besteht.
Danksagungen
Die Autoren nennen die folgenden Förderorganisationen: FAPDF, CNPq, CAPES, UnB, FINEP und FINATEC.
Materialien
| Name | Company | Catalog Number | Comments |
| CIM-Plate 16 | Agilent | 5665825001 | |
| CLARIOstar Plate Reader | BMG LABTECH | US Patent Number 9,733,124 Product details: MARS Data Analysis Software | |
| Dimethyl sulfoxide | Dinâmica | 1582 | |
| DNAse I | Sigma - Aldrich | DN 25 | |
| Ethylenediaminetetraacetic acid disodium salt dihydrate | Sigma - Aldrich | E5134 | |
| Fast panoptic stain | Laborclin | 620529 | |
| Glass slide | Exacta | 7102 | |
| Hank’s Balanced Salt Solution with calcium, with magnesium, without phenol red. | Sigma - Aldrich | 55037C | |
| Hank’s Balanced Salt Solution without calcium chloride, magnesium sulfate and sodium bicarbonate. | Sigma - Aldrich | H4641 | |
| Heparin | Blau | 7896014655229 | |
| Laminar flow cabinet | Veco | VLFS-12 | |
| Microscope | Zeiss | 415501-0101-002 | Product details: Primostar 1 |
| Mixing Block | BIOER | MB-102 | |
| Neubauer improved bright-lined | New Optik | 1110000 | |
| N-formyl-methionyl-leucyl-phenylalanine | Sigma - Aldrich | F3506 | |
| Nitroblue tetrazolium | Neon | CAS 298-83-9 | |
| Percoll | Cytiva | 17089101 | separation media |
| Phorbol 12-myristate 13-acetate | Sigma - Aldrich | P8139 | |
| Phosphate buffered saline tablet | Sigma - Aldrich | P4417 | |
| ROTOFIX 32 A | Hettich | 1206 | |
| Saccharomyces cerevisiae | Fleischmann | ||
| Safranin | Sigma - Aldrich | 50240 | |
| Sodium dodecyl sulfate | Cytiva | 17-1313-01 | |
| Sonicator | Qsonica | Q125 | |
| Trypan blue solution | Vetec | C.I. 23850 | |
| Vortex Genie 2 | Scientific Industries, Inc. | 0K-0500-902 | |
| xCELLigence Real-Time Cell Analysis (RTCA) DP (dual purpose) | Agilent | 380601050 | Product details: RTCA system composed of detection hardware, cell plates and software |
Referenzen
- Nauseef, W. M., Borregaard, N. Neutrophils at work. Nature Immunology. 15 (7), 602-611 (2014).
- Groeneweg, L., Hidalgo, A. Emerging roles of infiltrating granulocytes and monocytes in homeostasis. Cellular and Molecular Life Sciences. 77 (19), 3823-3830 (2020).
- Rosales, C., Lowell, C. A., Schnoor, M., Uribe-Querol, E. Neutrophils: their role in innate and adaptive immunity 2017. Journal of Immunology Research. 2017, 9748345 (2017).
- Castro, M., et al. Proteome analysis of resting human neutrophils. Protein & Peptide Letters. 13 (5), 481-487 (2006).
- Li, Y., et al. The regulatory roles of neutrophils in adaptive immunity. Cell Communication and Signaling. 17, 147 (2019).
- de Oliveira, S., Rosowski, E. E., Huttenlocher, A. Neutrophil migration in infection and wound repair: going forward in reverse. Nature Reviews Immunology. 16 (6), 378-391 (2016).
- Burn, G. L., Foti, A., Marsman, G., Patel, D. F., Zychlinsky, A. The neutrophil. Immunity. 54 (7), 1377-1391 (2021).
- El-Benna, J., et al. Priming of the neutrophil respiratory burst: role in host defense and inflammation. Immunological Reviews. 273 (1), 180-193 (2016).
- Castro, M. S., Cilli, E. M., Fontes, W. Combinatorial synthesis and directed evolution applied to the production of alpha-helix forming antimicrobial peptides analogues. Current Protein & Peptide Science. 7 (6), 473-478 (2006).
- Mihaila, A. C., et al. Transcriptional profiling and functional analysis of N1/N2 neutrophils reveal an immunomodulatory effect of S100A9-blockade on the pro-inflammatory N1 subpopulation. Frontiers in Immunology. 12, 708770 (2021).
- Kuhns, D. B., Priel, D. A. L., Chu, J., Zarember, K. A. Isolation and functional analysis of human neutrophils. Current Protocols in Immunology. 111 (1), 7-23 (2015).
- Paulíková, E., Kociková, A., Sabol, M. Modification of a panoptic method of staining isolated cells. Bratislavske Lekarske Listy. 94 (12), 638-640 (1993).
- Strober, W. Trypan blue exclusion test of cell viability. Current Protocols in Immunology. 111 (1), 1-3 (2015).
- Libério, M. S., et al. Anti-proliferative and cytotoxic activity of pentadactylin isolated from Leptodactylus labyrinthicus on melanoma cells. Amino Acids. 40 (1), 51-59 (2011).
- Cano, P. M., Vargas, A., Lavoie, J. P. A real-time assay for neutrophil chemotaxis. BioTechniques. 60 (5), 245-251 (2016).
- Stefanowicz-Hajduk, J., Adamska, A., Bartoszewski, R., Ochocka, J. R. Reuse of E-plate cell sensor arrays in the xCELLigence Real-Time Cell Analyzer. BioTechniques. 61 (3), 117-122 (2016).
- Björkstén, B., Nyström, K., Lindqvist, B. The nitroblue tetrazolium (NBT) test in endemic benign (epidemic) nephropathy. Acta Medica Scandinavica. 199 (1-6), 147-150 (1976).
- Aquino, E., et al. Proteomic analysis of neutrophil priming by PAF. Protein & Peptide Letters. 23 (2), 142-151 (2016).
- Blanter, M., Gouwy, M., Struyf, S. Studying neutrophil function in vitro: cell models and environmental factors. Journal of Inflammation Research. 14, 141-162 (2021).
- Hsu, A. Y., Peng, Z., Luo, H., Loison, F. Isolation of human neutrophils from whole blood and buffy coats. Journal of Visualized Experiments. (175), e62837 (2021).
- Moghadam, Z. M., Henneke, P., Kolter, J. From flies to men: ROS and the NADPH oxidase in phagocytes. Frontiers in Cell and Developmental Biology. 9, 628991 (2021).
- Pattan, S. S., Bhat, K. G., Pattar, G. D., Kuntagi, M. Comparison of three different techniques for isolation of neutrophils from blood and their utility in performing nitroblue tetrazolium test. International Journal of Basic and Applied Physiology. 8 (1), 41 (2019).
- Gooty, J. R., Shashirekha, A., Guntakala, V. R., Palaparthi, R. Estimation of phagocytic activity of polymorphonuclear leukocytes in chronic and aggressive periodontitis patients with nitroblue tetrazolium test. Journal of Indian Society of Periodontology. 23 (4), 316 (2019).
- Langer, S., et al. Clinical and laboratory profiles of 17 cases of chronic granulomatous disease in north India. Indian Journal of Hematology and Blood Transfusion. 37 (1), 45-51 (2021).
- Oualha, R., et al. Infection of human neutrophils with Leishmania infantum or Leishmania major strains triggers activation and differential cytokines release. Frontiers in Cellular and Infection Microbiology. 9, 153 (2019).
- Zilinskas, J., Zekonis, J., Zekonis, G., Valantiejiene, A., Periokaite, R. The reduction of nitroblue tetrazolium by total blood in periodontitis patients and the aged. Stomatologijal. 9 (4), 105-108 (2007).
- Benov, L. Improved formazan dissolution for bacterial MTT assay. Microbiology Spectrum. 9 (3), e01637 (2021).
- Chen, Y., Junger, W. G. Measurement of oxidative burst in neutrophils. Methods in Molecular Biology. 844, 115-124 (2012).
- Richardson, M. P., Ayliffe, M. J., Helbert, M., Davies, E. G. A simple flow cytometry assay using dihydrorhodamine for the measurement of the neutrophil respiratory burst in whole blood: comparison with the quantitative nitrobluetetrazolium test. Journal of Immunological Methods. 219 (1-2), 187-193 (1998).
- Jancinová, V., et al. The combined luminol/isoluminol chemiluminescence method for differentiating between extracellular and intracellular oxidant production by neutrophils. Redox Report. 11 (3), 110-116 (2006).
- Nosál, R., et al. Pharmacological intervention with oxidative burst in human neutrophils. Interdisciplinary Toxicology. 10 (2), 56-60 (2017).
- Mol, S., et al. Efficient neutrophil activation requires two simultaneous activating stimuli. International Journal of Molecular Sciences. 22 (18), 10106 (2021).
- Schneider, L., et al. Flow cytometry evaluation of CD14/CD16 monocyte subpopulations in systemic sclerosis patients: a cross sectional controlled study. Advances in Rheumatology. 61 (1), 27 (2021).
- Akin, E., Pelen, N. N., Tiryaki, I. U., Yalcin, F. Parameter identification for gompertz and logistic dynamic equations. PLoS One. 15 (4), e0230582 (2020).
- Guy, J. B., et al. Evaluation of the cell invasion and migration process: A comparison of the video microscope-based scratch wound assay and the boyden chamber assay. Journal of Visualized Experiments. (129), e56337 (2017).
- Brinkmann, V., et al. Neutrophil extracellular traps kill bacteria. Science. 303 (5663), 1532-1535 (2004).
- de Bont, C. M., Koopman, W. J. H., Boelens, W. C., Pruijn, G. J. M. Stimulus-dependent chromatin dynamics, citrullination, calcium signalling and ROS production during NET formation. Biochimica et Biophysica Acta. Molecular Cell Research. 1865, 1621-1629 (2018).
- Masuda, S., et al. Measurement of NET formation in vitro and in vivo by flow cytometry. Cytometry Part A. 91 (8), 822-829 (2017).
- Zharkova, O., et al. A flow cytometry-based assay for high-throughput detection and quantification of neutrophil extracellular traps in mixed cell populations. Cytometry Part A. 95 (3), 268-278 (2019).
- Hosseinnejad, A., et al. DNase I functional microgels for neutrophil extracellular trap disruption. Biomaterials Science. 10 (1), 85-99 (2022).
- Chrysanthopoulou, A., et al. Neutrophil extracellular traps promote differentiation and function of fibroblasts. The Journal of Pathology. 233 (3), 294-307 (2014).
- Tong, M., Abrahams, V. M. Visualization and quantification of neutrophil extracellular traps. Methods in Molecular Biology. 2255, 87-95 (2021).
- Santana, C. J. C., et al. Biological properties of a novel multifunctional host defense peptide from the skin secretion of the chaco tree frog, boana raniceps. Biomolecules. 10 (5), 790 (2020).
- Murphy, M. P., et al. Guidelines for measuring reactive oxygen species and oxidative damage in cells and in vivo. Nature Metabolism. 4 (6), 651-662 (2022).
- Boero, E., et al. Use of flow cytometry to evaluate phagocytosis of staphylococcus aureus by human neutrophils. Frontiers in Immunology. 12, 635825 (2021).
- Karsten, C. B., et al. A versatile high-throughput assay to characterize antibody-mediated neutrophil phagocytosis. Journal of Immunological Methods. 471, 46-56 (2019).
- Smirnov, A., Solga, M. D., Lannigan, J., Criss, A. K. Using imaging flow cytometry to quantify neutrophil phagocytosis. Methods in Molecular Biology. 2087, 127-140 (2020).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten