Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Набор скрининговых методик для быстрого обзора функции нейтрофилов
В этой статье
Резюме
Этот протокол включает в себя набор функциональных анализов нейтрофилов, которые будут использоваться в качестве метода скрининга для охвата функций различных сигнальных путей. Протокол включает в себя первичную и простую оценку жизнеспособности, чистоты, продукции активных форм кислорода, миграцию в реальном времени, фагоцитоз и предварительное предложение внеклеточных ловушек нейтрофилов.
Аннотация
Нейтрофилы известны как одна из первых линий защиты в врожденном иммунном ответе и могут выполнять многие специфические клеточные функции, такие как хемотаксис, обратная миграция, фагоцитоз, дегрануляция цитотоксических ферментов и метаболитов и высвобождение ДНК в виде внеклеточных ловушек нейтрофилов (НВЛ). Нейтрофилы не только жестко регулируют сигнализацию, но и участвуют в регуляции других компонентов иммунной системы. Поскольку свежие нейтрофилы терминально дифференцированы, недолговечны и сильно изменчивы у разных людей, важно максимально использовать собранные образцы. Исследователям часто необходимо проводить скрининговые анализы, чтобы оценить обзор многих функций нейтрофилов, на которые могут влиять конкретные оцениваемые условия. Для удовлетворения этой потребности был разработан набор тестов, следующих за единым процессом выделения нейтрофилов нормальной плотности, в поисках баланса между скоростью, полнотой, стоимостью и точностью. Полученные результаты могут быть использованы для обоснования и руководства последующими углубленными исследованиями. Эта процедура может быть проведена в среднем за 4 часа и включает в себя оценку жизнеспособности клеток, продукцию активных форм кислорода (АФК), миграцию в реальном времени и фагоцитоз дрожжей на предметных стеклах, оставляя достаточное количество клеток для более детальных подходов, таких как омиксные исследования. Кроме того, процедура включает в себя способ легко наблюдать предварительное предположение НВЛ после быстрого паноптического окрашивания, наблюдаемого с помощью световой микроскопии, при отсутствии специфических маркеров, хотя и достаточных, чтобы указать, стоит ли прилагать дальнейшие усилия в этом направлении. Разнообразие тестируемых функций объединяет общие моменты между тестами, сокращая время и затраты на анализ. Процедура получила название NeutroFun Screen, и хотя у нее есть ограничения, она уравновешивает вышеупомянутые факторы. Кроме того, целью этой работы является не определенный набор тестов, а скорее руководство, которое может быть легко адаптировано к ресурсам и потребностям каждой лаборатории.
Введение
Нейтрофилы являются наиболее распространенными клетками врожденного иммунитета в крови человека и, как известно, играют важную роль в инфекции и воспалении, являясь первыми реагирующими наместо повреждения тканей. В последние годы растет признание решающей роли, которую нейтрофилы играют при различных заболеваниях и в поддержании гомеостаза2. Нейтрофилы не только обладают жестко регулируемой сигнализацией, но и участвуют в регуляции других компонентов иммунной системы 3,4,5. Таким образом, изучение нейтрофилов и их многочисленных необычных клеточных функций, таких как хемотаксис, обратная миграция6, фагоцитоз7, респираторный взрыв8 и высвобождение внеклеточных ловушек нейтрофилов (НВЛ)7, является обязательным в многочисленных исследовательских контекстах, где необходимо оценить потенциальные функциональные, морфологические или молекулярные изменения нейтрофилов, вызванные конкретными анализируемыми условиями.
Свежевыделенные нейтрофилы терминально дифференцированы, недолговечны, высокодинамичны и легко активируются9. Тем не менее, эффективный метод хранения, который не влияет на реакцию нейтрофилов, еще не достигнут, что затрудняет выполнение нескольких анализов, которые должны быть непрерывными. Кроме того, ранее описанные функциональные анализы10,11, основанные на анализах, требующих цитометрии и/или флуоресцентного окрашивания, могут быть нежизнеспособным выбором, когда необходима широкая и первоначальная оценка нейтрофила.
Для решения этих проблем в данном протоколе описан набор тестов, которые могут быть проведены после одного процесса выделения, включая оценку жизнеспособности клеток, продукцию активных форм кислорода (АФК), миграцию в реальном времени и фагоцитоз Saccharomyces cerevisiae, результаты которых могут быть использованы для обоснования углубленных последующих исследований. Эта процедура, получившая название NeutroFun Screen, была разработана для того, чтобы охватить основные эффекторные активности, за исключением дегрануляции, и может быть завершена в среднем за 4 часа, включая 1 час активации. Кроме того, оставшиеся клетки могут быть использованы для более детальных подходов, таких как омиксные исследования. Преимущество этого метода заключается в его балансе между скоростью, комплексностью, стоимостью и точностью.
Кроме того, существует способ легко наблюдать за предварительным предложением НЭО, без конкретных маркеров, но достаточных для того, чтобы указать, стоит ли предпринимать дальнейшие усилия в этом направлении. Разнообразие тестируемых функций направлено на то, чтобы объединить общие моменты между тестами, сокращая время и затраты на анализ. Основная цель этого метода состоит в том, чтобы обеспечить сбалансированный, функциональный анализ скорости, полноты, стоимости и точности, который позволяет получить обзор реакции нейтрофилов, что делает его полезным начальным шагом в исследовании влияния новых стимулов на нейтрофилы нормальной плотности.
протокол
Все эксперименты строго следовали этическим принципам, установленным институциональным наблюдательным советом Университета Бразилиа (процесс 13364819.0.0000.5558), а образцы были идентифицированы кодами для обеспечения анонимности доноров. Клетки были получены от нормальных здоровых доноров-мужчин в возрасте 18-35 лет, которые подписали информированное согласие и соответствовали следующим критериям приемлемости: некурящие/вейперы, отсутствие хронических заболеваний и отсутствие воспалительных состояний в анамнезе в течение последних 14 дней.
1. Забор крови
- Асептически помещают 0,3 мл гепарина 5 000 МЕ/мл (см. таблицу материалов) в стерильный шприц объемом 20 мл для его гепаринизации.
- Наложите венозный жгут примерно на 4 дюйма выше места прокола и определите срединную кубитальную или головную вену для венепункции.
ПРИМЕЧАНИЕ: Следите за тем, чтобы общее время наложения жгута не превышало 1 минуты. - Очистите место прокола 70% спиртом и выполните венепункцию.
- Осторожно переверните шприц три или четыре раза после сбора крови, чтобы правильно смешать кровь и гепарин.
2. Выделение нейтрофилов
ПРИМЕЧАНИЕ: Полиморфноядерные лейкоциты (ПМН) выделяют с помощью центрифугирования с градиентом плотности с последующим гипотоническим лизисом оставшихся эритроцитов (эритроцитов), как описано ранее11 с некоторыми изменениями. Этот метод не является обязательным для проведения скрининговых анализов и может быть заменен до тех пор, пока выбранный метод приводит к жизнеспособности >97%, праймингу или активации <3% PMN и дает достаточное количество клеток для всех анализов, репликаций и условий. Выполнение этих этапов в асептических условиях и использование растворов, не содержащих эндотоксинов, является обязательным, чтобы избежать активации клеток.
- Изготовьте 12 мл разбавлений 60% и 70% разделительной среды (коммерчески доступны; см. таблицу материалов) в конических пробирках по 50 мл.
- Подготовьте градиент снизу вверх, добавляя 4 мл за раз 60%-ного разведения над 70%-ным разведением, используя пипетку объемом 5 мл. Делайте это аккуратно, чтобы не допустить смешивания интерфейса.
- Аккуратно нанесите 12 мл гепаринизированной крови поверх градиента плотности. Центрифуга при 200 х г в течение 15 мин при комнатной температуре.
ПРИМЕЧАНИЕ: Начиная с этого этапа и до активации PMN, все используемые реагенты и пробирки должны храниться в охладителе, наполненном льдом. - Выбросьте слой плазмы/мононуклеарной клетки, затем аккуратно перенесите слой над гранулой эритроцита в две конические пробирки по 15 мл примерно по 7,5 мл в каждой. Восполните объем пробирки сбалансированным солевым раствором Хэнка (HBSS; см. Таблицу материалов).
- Центрифуга при 300 x g в течение 5 мин при 19 °C.
- Промойте гранулу ячейки HBSS.
- Выбросьте надосадочную жидкость, вылив пробирку и осторожно повторно суспендировав гранулу в 7 мл HBSS.
- Центрифуга при 300 x g в течение 5 минут при 19 °C, чтобы удалить всю разделительную среду.
- Проводят гипотонический лизис оставшихся эритроцитов.
- Выбросьте надосадочную жидкость и смешайте гранулы в одном тюбике.
- Ресуспендант гранулы RBC/PMN в 3 мл стерильногоH2Oи добавьте 3 мл HBSS (2x) в течение 25 с для восстановления осмолярности. Затем центрифугу при 300 x g в течение 5 мин при 19 °C.
- Повторите шаги 2.8.1 и 2.8.2 для белой гранулы без эритроцитов.
ПРИМЕЧАНИЕ: Надосадочную жидкость необходимо удалить как можно скорее, чтобы свести к минимуму контакт нейтрофилов с продуктами распада эритроцитов. В качестве альтернативы второй гипотонический лизис можно заменить, осторожно ресуспендировав остаточный слой эритроцитов и удалив всю надосадочную жидкость, так как оставшиеся эритроциты будут осаждаться над гранулой PMN.
- Выбросьте надосадочную жидкость, налив пробирку, осторожно ресуспендируйте PMN в оставшемся буфере и перенесите их в ледяную микропробирку.
ПРИМЕЧАНИЕ: Обязательно аннотируйте объем при переносе ресуспендированных клеток с помощью микропипетки. - Переносят 3 x 1 мкл клеточной суспензии на чистое предметное стекло (три лунки по 1 мкл каждая) и окрашивают быстрым паноптиком (см. таблицу материалов) для оценки морфологии и чистоты12.
- Для окрашивания быстрым паноптическим средством предметное стекло пять раз погружают в паноптический фиксатор No 1, шесть раз — в эозин No 2 и дважды — в гематоксилин No 3, при этом каждое погружение длится 1 с.
- Аккуратно промойте предметное стекло дистиллированной водой.
- Дайте стечь и высохнуть на воздухе.
- Наблюдают под микроскопом и подсчитывают 300 случайных клеток в каждой лунке, таким образом дифференцируя нейтрофилы от других гранулоцитов.
- Перенесите 1 мкл клеточной суспензии в 49 мкл 0,2% трипанового синего красителя13 и подсчитайте клетки с помощью камеры Нойбауэра, различая мертвые и жизнеспособные клетки.
- Доведите концентрацию клеток до 6 667 клеток/мкл, используя раствор из 50% аутологичной плазмы и 50% HBSS с добавлением кальция и магния. Распределите суспензию 6 667 клеток/мкл равномерно между микропробирками, соответствующими испытуемым условиям, включая отрицательный контроль.
Примечание: Можно использовать любую концентрацию клеток, аналогичную циркулирующим нейтрофилам в модельном организме, но важно использовать одну и ту же концентрацию клеток во всех экспериментах для воспроизводимости.
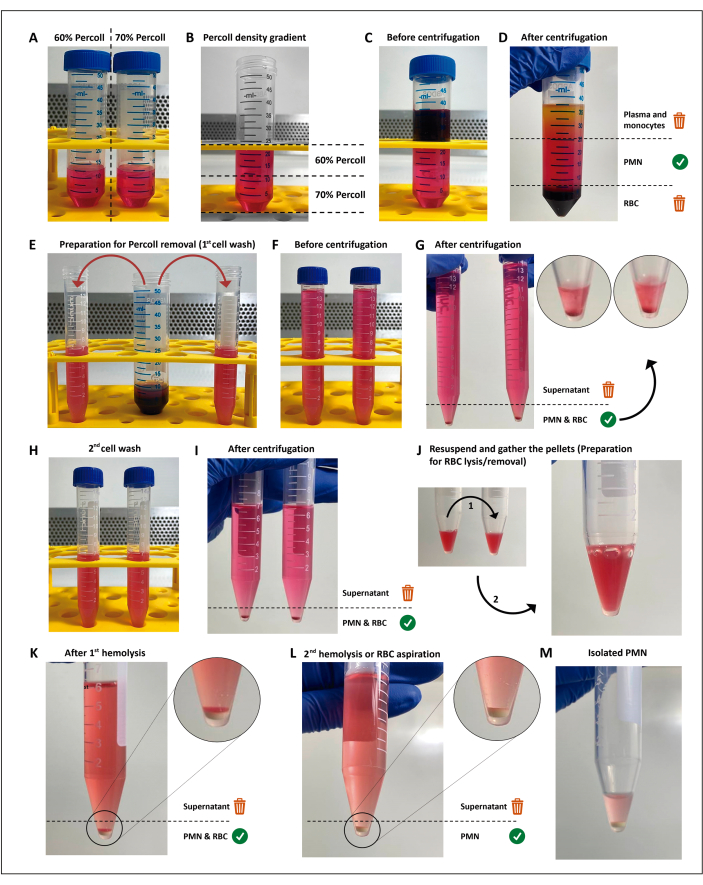
Рисунок 1: Протокол выделения нейтрофилов. Две концентрации разделительной среды (перколл) (А) укладываются друг на друга (В), затем кровь наслаивается поверх градиента разделения (С). После центрифугирования ПМН находится в центральном слое (D), который разделен на две пробирки по 15 мл (E). Клеточную суспензию дважды промывают в HBSS и центрифугируют (G-I) для удаления среды, затем клетки ресуспендируют, а остаточные эритроциты подвергают двум раундам гипотонического лизиса (J-M). Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
3. Подготовка к активации нейтрофилов
- В микропробирках объемом 1,5 мл подготовьте систему активации для каждого состояния, чтобы конечная концентрация клеток составляла 6 600 клеток/мкл. Например, для проверки эффектов 100 нМ fMLP (N-формил-метионил-лейцил-фенилаланин; см. таблицу материалов) добавьте 5 мкл 10 мкМ fMLP к 495 мкл суспензии 6667 клеток/мкл. Для отрицательного (нестимулированного) контроля добавляют HBSS, содержащий Ca2+ иMg2+.
ПРИМЕЧАНИЕ: Для демонстрации этой методологии были использованы следующие конечные концентрации стимулов: 100 нМ fMLP, 16 мкМ фаллаксина, природного антимикробного пептида14, и 100 нМ PMA (форбол-12-миристат-13-ацетат) (см. таблицу материалов). - Инкубировать при 37 °C без вращения.
ПРИМЕЧАНИЕ: Все аликвоты для функциональных анализов берутся из этой клеточной суспензии, далее именуемой системой активации.
4. Анализ на нитротетразолий синий хлорид (NBT) для оценки производства АФК
- Приготовление рабочего раствора НБТ: Для каждого экспериментального условия приготовьте рабочий раствор НБТ (см. Таблицу материалов) 6 мМ, выполнив следующие действия:
- Растворите 0,0005 г NBT в 10 мкл диметилсульфоксида (ДМСО) и взбуривайте не менее 15 мин.
- Добавьте 90 мкл HBSS Ca2+Mg2+ и встряхивайте до 2 мин.
ПРИМЕЧАНИЕ: Все шаги, связанные с NBT, должны выполняться в темноте.
- Выполните тест слайдов NBT.
- Через 20 минут после активации клетки осторожно перемешайте клеточную суспензию и осторожно перенесите 2 мкл PMN на чистое предметное стекло. Инкубируют 20 мин в увлажненной камере при температуре 37 °C.
ПРИМЕЧАНИЕ: Не растекайте клеточную суспензию слишком сильно по затвору; В противном случае она может высохнуть до инкубации. - Добавьте 1 мкл рабочего раствора NBT на клетки и продолжайте инкубировать в течение 20 мин в защищенном от света месте.
- Высушите горку горячим воздухом и зафиксируйте ее каплей метанола в каждой лунке на 1 мин. Окрашивают 0,03% сафранином (см. таблицу материалов) в течение 1 мин.
- Аккуратно промойте предметное стекло дистиллированной водой.
- Дайте предметному стеколу высохнуть на воздухе и понаблюдайте под микроскопом.
- Подсчитайте 100 случайных клеток в каждой лунке, дифференцируя нейтрофилы с формазановыми отложениями и без них.
- Через 20 минут после активации клетки осторожно перемешайте клеточную суспензию и осторожно перенесите 2 мкл PMN на чистое предметное стекло. Инкубируют 20 мин в увлажненной камере при температуре 37 °C.
- Выполните спектрофотометрический анализ NBT.
- Через 40 минут после активации клетки осторожно перемешайте клеточную суспензию и перенесите 90 мкл PMN из системы активации в чистую микропробирку. Затем осторожно добавьте 20 мкл 6 мМ раствора NBT. Инкубируют в темноте 20 мин при температуре 37 °C.
- Добавьте 100 мкл 10% додецилсульфата натрия (SDS; см. таблицу материалов) и встряхните.
- Ультразвуковая обработка с помощью наконечника-ультразвукатора с амплитудой 60%, пять циклов по 15 с каждый с интервалом 15 с. Центрифуга при 12 000 x g в течение 5 мин.
- Перенесите 60 мкл надосадочной жидкости на 96-луночную планшет с прозрачным дном и измерьте абсорбцию продукта формазана при 570 нм.
5. Анализ на фагоцитоз
- Приготовьте суспензию 33 000 дрожжей/мкл для каждого состояния, как описано ниже:
- Добавьте приблизительно 0,75 мг сухих дрожжей (Saccharomyces cerevisiae; см. таблицу материалов) к 200 мкл HBSS Ca2+ Mg2+ и инкубируйте в термомиксере при 100 °C при 500 об/мин не менее 15 мин.
- Гомогенизируют смесь путем вихря и переносят 5 мкл дрожжевой суспензии в 45 мкл 0,2% красителя трипанового синего. Подсчитайте количество дрожжей в камере Нойбауэра.
- Доведите концентрацию исходной суспензии до 33 000 дрожжевых клеток/мкл, используя HBSS Ca2+Mg2+. Держите суспензию на льду до использования.
- Через 20 минут после активации клетки осторожно перемешайте клеточную суспензию и перенесите 5 мкл системы активации в 5 мкл 33 000 дрожжей/мкл суспензии Saccharomyces cerevisiae в новой стерильной микропробирке.
ПРИМЕЧАНИЕ: Соотношение нейтрофилов и дрожжей составляет 1:5 (PMN:дрожжи). - Немедленно переносят 6 мкл суспензии ПМН/дрожжей в три лунки чистого предметного стекла (по 2 мкл каждая) и инкубируют предметное стекло в увлажненной камере в течение 40 мин.
ПРИМЕЧАНИЕ: Не растекайте клеточную суспензию слишком сильно по затвору; В противном случае она может засохнуть до инкубации. - Высушите предметное стекло под горячим воздухом и прокрасьте быстрым паноптиком, как описано в шаге 2.9 выше.
ПРИМЕЧАНИЕ: Третий этап быстрого паноптического окрашивания имеет решающее значение для микроскопического анализа предметного стекла. Окрашивание предметного стекла в течение ≥3 с на этом этапе может сделать его непригодным для анализа, так как будет трудно отличить дрожжи от ядерных лепестков нейтрофилов. - Наблюдайте за предметными стеклами под микроскопом, подсчитывая 100 случайных нейтрофилов каждой лунки и различая положительные и отрицательные ПМН на фагоцитоз.
ПРИМЕЧАНИЕ: По крайней мере, одна дрожжевая частица внутри или в прямом контакте с клеточной мембраной PMN указывает на PMN-положительный результат на фагоцитоз. Если вас интересует соотношение дрожжей и нейтрофилов, подсчитайте также количество поглощенных частиц дрожжей.
6. Анализ хемотаксиса PMN в режиме реального времени
ПРИМЕЧАНИЕ: Миграционный анализ выполняется аналогично протоколу, описанному в предыдущемпункте 15, со следующими изменениями:
- Подготовьте хемотаксический градиент, добавив 160 мкл хемоаттрактанта (например, fMLP, IL-8, C5 или LTB4; см. таблицу материалов) в нижнюю камеру планшета анализатора клеток в реальном времени (RTCA) на основе импеданса. Для отрицательного контроля и заготовок добавьте 160 мкл HBSS Ca2 + Mg2+.
- Присоедините верхнюю камеру и добавьте 25 мкл HBSS Ca2+Mg2+. Выдерживают при комнатной температуре не менее 1 ч до образования хемотаксического градиента.
- Через 60 минут после активации клеток осторожно перемешайте клеточную суспензию и поместите 60 мкл клеточной суспензии в верхнюю камеру. Добавьте в заготовку 60 мкл HBSS Ca2+Mg2+ .
- Поместите пластину RTCA и запрограммируйте программное обеспечение RTCA на измерение индекса клеток (CI) каждые 60 с в течение 2 часов.
ПРИМЕЧАНИЕ: Пластины RTCA можно мыть для повторного использования, как описано ранее16. Таким образом, промойте камеры и электроды RTCA фосфатно-солевым раствором (PBS) три раза, а затем дважды сверхчистой водой типа I. Инкубируют нижнюю и верхнюю камеру с 0,25% трипсином 0,53 мМ этилендиаминтетрауксусной кислоты (ЭДТА) в течение 40 мин. Умыться сверхчистой водой три раза.
7. НЭТ-суггестивный анализ
- Через 10 мин после активации клеток осторожно перемешайте клеточную суспензию и перенесите 4 мкл ПМН из каждой оцениваемой системы активации, разделенной на две лунки чистого предметного стекла. Инкубируют в увлажненной камере при температуре 37 °C в течение 30 мин.
- Добавьте 1 мкл ДНКазы I в одну из лунок и инкубируйте в течение 20 минут при 37 °C (во влажной камере).
- Высушите предметное стекло и окрасьте быстрым паноптическим средством, как описано ранее в шаге 2.9 раздела «Выделение нейтрофилов».
- Оцените предметные стекла под микроскопом.
ПРИМЕЧАНИЕ: Ищите любые признаки выпуска NET, характеризующиеся наличием веб-подобных структур. После идентификации подтвердите, что лечение ДНК-азой I способно удалять такие структуры. Этот анализ позволяет предположить образование НВЛ, так как для подтверждения их наличия требуются дополнительные тесты.
Результаты
Метод изоляции по плотности, использованный в данном исследовании (рис. 1), соответствовал критериям предложенных экспериментов. Параметры нейтрофилов, полученные с помощью этого метода, включали жизнеспособность ≥98%, чистоту ≥94%) и выход клеток ≥1,5 x 107, при этом а?...
Обсуждение
Нейтрофилы являются очень динамичными и чувствительными клетками, которые недолговечны и еще не могут быть криоконсервированы, что затрудняет изучение их биологии. Поэтому необходимо соблюдать осторожные шаги для получения жизнеспособных, обогащенных и покоящихся нейт?...
Раскрытие информации
Авторы заявляют об отсутствии конфликта интересов.
Благодарности
Авторы выражают признательность следующим финансирующим организациям: FAPDF, CNPq, CAPES, UnB, FINEP и FINATEC.
Материалы
| Name | Company | Catalog Number | Comments |
| CIM-Plate 16 | Agilent | 5665825001 | |
| CLARIOstar Plate Reader | BMG LABTECH | US Patent Number 9,733,124 Product details: MARS Data Analysis Software | |
| Dimethyl sulfoxide | Dinâmica | 1582 | |
| DNAse I | Sigma - Aldrich | DN 25 | |
| Ethylenediaminetetraacetic acid disodium salt dihydrate | Sigma - Aldrich | E5134 | |
| Fast panoptic stain | Laborclin | 620529 | |
| Glass slide | Exacta | 7102 | |
| Hank’s Balanced Salt Solution with calcium, with magnesium, without phenol red. | Sigma - Aldrich | 55037C | |
| Hank’s Balanced Salt Solution without calcium chloride, magnesium sulfate and sodium bicarbonate. | Sigma - Aldrich | H4641 | |
| Heparin | Blau | 7896014655229 | |
| Laminar flow cabinet | Veco | VLFS-12 | |
| Microscope | Zeiss | 415501-0101-002 | Product details: Primostar 1 |
| Mixing Block | BIOER | MB-102 | |
| Neubauer improved bright-lined | New Optik | 1110000 | |
| N-formyl-methionyl-leucyl-phenylalanine | Sigma - Aldrich | F3506 | |
| Nitroblue tetrazolium | Neon | CAS 298-83-9 | |
| Percoll | Cytiva | 17089101 | separation media |
| Phorbol 12-myristate 13-acetate | Sigma - Aldrich | P8139 | |
| Phosphate buffered saline tablet | Sigma - Aldrich | P4417 | |
| ROTOFIX 32 A | Hettich | 1206 | |
| Saccharomyces cerevisiae | Fleischmann | ||
| Safranin | Sigma - Aldrich | 50240 | |
| Sodium dodecyl sulfate | Cytiva | 17-1313-01 | |
| Sonicator | Qsonica | Q125 | |
| Trypan blue solution | Vetec | C.I. 23850 | |
| Vortex Genie 2 | Scientific Industries, Inc. | 0K-0500-902 | |
| xCELLigence Real-Time Cell Analysis (RTCA) DP (dual purpose) | Agilent | 380601050 | Product details: RTCA system composed of detection hardware, cell plates and software |
Ссылки
- Nauseef, W. M., Borregaard, N. Neutrophils at work. Nature Immunology. 15 (7), 602-611 (2014).
- Groeneweg, L., Hidalgo, A. Emerging roles of infiltrating granulocytes and monocytes in homeostasis. Cellular and Molecular Life Sciences. 77 (19), 3823-3830 (2020).
- Rosales, C., Lowell, C. A., Schnoor, M., Uribe-Querol, E. Neutrophils: their role in innate and adaptive immunity 2017. Journal of Immunology Research. 2017, 9748345 (2017).
- Castro, M., et al. Proteome analysis of resting human neutrophils. Protein & Peptide Letters. 13 (5), 481-487 (2006).
- Li, Y., et al. The regulatory roles of neutrophils in adaptive immunity. Cell Communication and Signaling. 17, 147 (2019).
- de Oliveira, S., Rosowski, E. E., Huttenlocher, A. Neutrophil migration in infection and wound repair: going forward in reverse. Nature Reviews Immunology. 16 (6), 378-391 (2016).
- Burn, G. L., Foti, A., Marsman, G., Patel, D. F., Zychlinsky, A. The neutrophil. Immunity. 54 (7), 1377-1391 (2021).
- El-Benna, J., et al. Priming of the neutrophil respiratory burst: role in host defense and inflammation. Immunological Reviews. 273 (1), 180-193 (2016).
- Castro, M. S., Cilli, E. M., Fontes, W. Combinatorial synthesis and directed evolution applied to the production of alpha-helix forming antimicrobial peptides analogues. Current Protein & Peptide Science. 7 (6), 473-478 (2006).
- Mihaila, A. C., et al. Transcriptional profiling and functional analysis of N1/N2 neutrophils reveal an immunomodulatory effect of S100A9-blockade on the pro-inflammatory N1 subpopulation. Frontiers in Immunology. 12, 708770 (2021).
- Kuhns, D. B., Priel, D. A. L., Chu, J., Zarember, K. A. Isolation and functional analysis of human neutrophils. Current Protocols in Immunology. 111 (1), 7-23 (2015).
- Paulíková, E., Kociková, A., Sabol, M. Modification of a panoptic method of staining isolated cells. Bratislavske Lekarske Listy. 94 (12), 638-640 (1993).
- Strober, W. Trypan blue exclusion test of cell viability. Current Protocols in Immunology. 111 (1), 1-3 (2015).
- Libério, M. S., et al. Anti-proliferative and cytotoxic activity of pentadactylin isolated from Leptodactylus labyrinthicus on melanoma cells. Amino Acids. 40 (1), 51-59 (2011).
- Cano, P. M., Vargas, A., Lavoie, J. P. A real-time assay for neutrophil chemotaxis. BioTechniques. 60 (5), 245-251 (2016).
- Stefanowicz-Hajduk, J., Adamska, A., Bartoszewski, R., Ochocka, J. R. Reuse of E-plate cell sensor arrays in the xCELLigence Real-Time Cell Analyzer. BioTechniques. 61 (3), 117-122 (2016).
- Björkstén, B., Nyström, K., Lindqvist, B. The nitroblue tetrazolium (NBT) test in endemic benign (epidemic) nephropathy. Acta Medica Scandinavica. 199 (1-6), 147-150 (1976).
- Aquino, E., et al. Proteomic analysis of neutrophil priming by PAF. Protein & Peptide Letters. 23 (2), 142-151 (2016).
- Blanter, M., Gouwy, M., Struyf, S. Studying neutrophil function in vitro: cell models and environmental factors. Journal of Inflammation Research. 14, 141-162 (2021).
- Hsu, A. Y., Peng, Z., Luo, H., Loison, F. Isolation of human neutrophils from whole blood and buffy coats. Journal of Visualized Experiments. (175), e62837 (2021).
- Moghadam, Z. M., Henneke, P., Kolter, J. From flies to men: ROS and the NADPH oxidase in phagocytes. Frontiers in Cell and Developmental Biology. 9, 628991 (2021).
- Pattan, S. S., Bhat, K. G., Pattar, G. D., Kuntagi, M. Comparison of three different techniques for isolation of neutrophils from blood and their utility in performing nitroblue tetrazolium test. International Journal of Basic and Applied Physiology. 8 (1), 41 (2019).
- Gooty, J. R., Shashirekha, A., Guntakala, V. R., Palaparthi, R. Estimation of phagocytic activity of polymorphonuclear leukocytes in chronic and aggressive periodontitis patients with nitroblue tetrazolium test. Journal of Indian Society of Periodontology. 23 (4), 316 (2019).
- Langer, S., et al. Clinical and laboratory profiles of 17 cases of chronic granulomatous disease in north India. Indian Journal of Hematology and Blood Transfusion. 37 (1), 45-51 (2021).
- Oualha, R., et al. Infection of human neutrophils with Leishmania infantum or Leishmania major strains triggers activation and differential cytokines release. Frontiers in Cellular and Infection Microbiology. 9, 153 (2019).
- Zilinskas, J., Zekonis, J., Zekonis, G., Valantiejiene, A., Periokaite, R. The reduction of nitroblue tetrazolium by total blood in periodontitis patients and the aged. Stomatologijal. 9 (4), 105-108 (2007).
- Benov, L. Improved formazan dissolution for bacterial MTT assay. Microbiology Spectrum. 9 (3), e01637 (2021).
- Chen, Y., Junger, W. G. Measurement of oxidative burst in neutrophils. Methods in Molecular Biology. 844, 115-124 (2012).
- Richardson, M. P., Ayliffe, M. J., Helbert, M., Davies, E. G. A simple flow cytometry assay using dihydrorhodamine for the measurement of the neutrophil respiratory burst in whole blood: comparison with the quantitative nitrobluetetrazolium test. Journal of Immunological Methods. 219 (1-2), 187-193 (1998).
- Jancinová, V., et al. The combined luminol/isoluminol chemiluminescence method for differentiating between extracellular and intracellular oxidant production by neutrophils. Redox Report. 11 (3), 110-116 (2006).
- Nosál, R., et al. Pharmacological intervention with oxidative burst in human neutrophils. Interdisciplinary Toxicology. 10 (2), 56-60 (2017).
- Mol, S., et al. Efficient neutrophil activation requires two simultaneous activating stimuli. International Journal of Molecular Sciences. 22 (18), 10106 (2021).
- Schneider, L., et al. Flow cytometry evaluation of CD14/CD16 monocyte subpopulations in systemic sclerosis patients: a cross sectional controlled study. Advances in Rheumatology. 61 (1), 27 (2021).
- Akin, E., Pelen, N. N., Tiryaki, I. U., Yalcin, F. Parameter identification for gompertz and logistic dynamic equations. PLoS One. 15 (4), e0230582 (2020).
- Guy, J. B., et al. Evaluation of the cell invasion and migration process: A comparison of the video microscope-based scratch wound assay and the boyden chamber assay. Journal of Visualized Experiments. (129), e56337 (2017).
- Brinkmann, V., et al. Neutrophil extracellular traps kill bacteria. Science. 303 (5663), 1532-1535 (2004).
- de Bont, C. M., Koopman, W. J. H., Boelens, W. C., Pruijn, G. J. M. Stimulus-dependent chromatin dynamics, citrullination, calcium signalling and ROS production during NET formation. Biochimica et Biophysica Acta. Molecular Cell Research. 1865, 1621-1629 (2018).
- Masuda, S., et al. Measurement of NET formation in vitro and in vivo by flow cytometry. Cytometry Part A. 91 (8), 822-829 (2017).
- Zharkova, O., et al. A flow cytometry-based assay for high-throughput detection and quantification of neutrophil extracellular traps in mixed cell populations. Cytometry Part A. 95 (3), 268-278 (2019).
- Hosseinnejad, A., et al. DNase I functional microgels for neutrophil extracellular trap disruption. Biomaterials Science. 10 (1), 85-99 (2022).
- Chrysanthopoulou, A., et al. Neutrophil extracellular traps promote differentiation and function of fibroblasts. The Journal of Pathology. 233 (3), 294-307 (2014).
- Tong, M., Abrahams, V. M. Visualization and quantification of neutrophil extracellular traps. Methods in Molecular Biology. 2255, 87-95 (2021).
- Santana, C. J. C., et al. Biological properties of a novel multifunctional host defense peptide from the skin secretion of the chaco tree frog, boana raniceps. Biomolecules. 10 (5), 790 (2020).
- Murphy, M. P., et al. Guidelines for measuring reactive oxygen species and oxidative damage in cells and in vivo. Nature Metabolism. 4 (6), 651-662 (2022).
- Boero, E., et al. Use of flow cytometry to evaluate phagocytosis of staphylococcus aureus by human neutrophils. Frontiers in Immunology. 12, 635825 (2021).
- Karsten, C. B., et al. A versatile high-throughput assay to characterize antibody-mediated neutrophil phagocytosis. Journal of Immunological Methods. 471, 46-56 (2019).
- Smirnov, A., Solga, M. D., Lannigan, J., Criss, A. K. Using imaging flow cytometry to quantify neutrophil phagocytosis. Methods in Molecular Biology. 2087, 127-140 (2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены